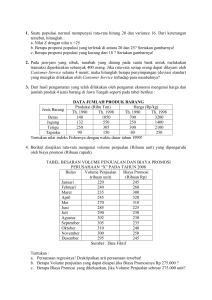
pembuatan tapioka asam dengan fermentasi spontan skripsi puja
advertisement

PEMBUATAN TAPIOKA ASAM DENGAN FERMENTASI SPONTAN SKRIPSI PUJA DWI SARI F34080005 FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR BOGOR 2012 PEMBUATAN TAPIOKA ASAM DENGAN FERMENTASI SPONTAN SKRIPSI Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN Pada Departemen Teknologi Industri Pertanian, Fakultas Teknologi Pertanian, Institut Pertanian Bogor. Oleh PUJA DWI SARI F34080005 FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR BOGOR 2012 Judul Skripsi : Pembuatan Tapioka Asam dengan Fermentasi Spontan Nama : PUJA DWI SARI NIM : F34080005 Menyetujui, Dosen Pembimbing , (Dr. Ir. Titi Candra Sunarti, M.Si) NIP. 19661219 199103 2 001 Mengetahui: Ketua Departemen, (Prof. Dr. Ir. Nastiti Siswi Indrasti) NIP. 19621009 198903 2001 Tanggal lulus : SOUR CASSAVA STARCH PRODUCTION BY SPONTANEOUS FERMENTATION Titi Candra Sunarti and Puja Dwi Sari Department of Agroindustrial Technology, Faculty of Agricultural Technology, Bogor Agricultural University, IPB Dramaga Campus, PO BOX 220, Bogor, West Java, Indonesia. Phone : 62 527 4826139, e-mail: [email protected] ABSTRACT Sour cassava starch is a modified starch produced by spontaneous fermentation of native cassava starch. The objectives of this research were to study the production process of sour cassava starch and investigate the effect of spontaneous fermentation to quality, physicochemical and functional properties of sour cassava starch. Sour cassava starch was prepared by spontaneous fermentation with variation of fermentation time (0, 10, 20, 30, 40 and 50 days). Analysis of variance (ANOVA) was employed for analyzed the result obtained from three replications. The result indicated that during spontaneous fermentation, sour cassava starch is dominated by lactic acid bacteria among other bacteria. High amount of organic acid made the environment become acid, and so pH value becomed low, and it effected to suppress the growth of pathogenic bacteria. Growth of the yeast also occurred during fermentation process after ten days. Sour cassava starch has an unique characteristic. It has better expanding capability when toasted (1.18-1.28 ml/g) compared to native cassava starch (1.15 ml/g). Structure of amorphous region in granules of cassava starch ruptured during fermentation so that the value of clarity (51.13-61.88%T), solubility at 70°C (33.88-50.56%) and swelling power at 70°C (0.85-1.71%) increase compared to native cassava starch (45.97%T); (21.18%); and (0.45%) recpectively. Keywords : sour cassava starch, spontaneous fermentation, physicochemical properties Puja Dwi Sari. F34080005. Pembuatan Tapioka Asam dengan Fermentasi Spontan. Dibawah bimbingan Titi Candra Sunarti. 2012 RINGKASAN Industri tapioka di Indonesia umumnya industri skala kecil dan menengah dengan proses pengolahannya masih dilakukan secara tradisional. Hal ini menyebabkan mutu tapioka yang dihasilkan tidak seragam, baik dari bentuk fisik maupun keamanan pangannya yang kurang terjamin. Sanitasi yang buruk dan peralatan yang masih sangat sederhana juga menyebabkan tingginya pencemaran tapioka oleh berbagai mikroorganisme selama pengolahan. Tapioka asam merupakan produk pati termodifikasi yang dihasilkan melalui fermentasi spontan dengan memanfaatkan bakteri asam laktat dan pengeringan dibawah sinar matahari. Di Indonesia kebutuhan tapioka asam khususnya industri kerupuk sangat besar, namun belum ada industri yang mengolahnya. Dengan pengembangan dan perbaikan proses produksi melalui fermentasi secara spontan dan teknologi yang sederhana sehingga dapat diaplikasikan dalam skala industri kecil atau rumah tangga, maka tapioka asam sangat prospektif untuk dikembangkan. Penelitian ini bertujuan untuk mengkaji proses produksi tapioka asam melalui fermentasi secara spontan dan mengkaji perbandingan karakteristik mutu tapioka asam dengan tapioka komersial (alami). Metode yang dilakukan yaitu proses fermentasi spontan pada pati basah tapioka selama 10 samapi 50 hari pada suhu kamar. Tapioka asam yang dihasilkan dianalisis karakteristik mutu, dan fisikokimianya. Analisis statistik yang digunakan adalah analysis of variance (ANOVA). ANOVA merupakan metode statistika untuk menguji signifikansi perbedaan dari dua atau lebih nilai rata-rata. Selama fermentasi spontan diketahui bahwa bakteri asam laktat mendominasi komunitas bakteri yang ada dan mencapai fase eksponensial pada lama fermentasi 20 hari. Nilai pH mengalami penurunan dari 4.75 hingga 3.36 yang diikuti oleh peningkatan total asam tertitrasi (2.23-7.36 ml NaOH/100 g bahan) pada tapioka asam yang dihasilkan. Pada kondisi tersebut ditemukan pertumbuhan kapang dan khamir mulai fermentasi 10 hari dan terus mengalami peningkatan sampai 50 hari fermentasi. Kandungan komponen proksimat pada tapioka asam yang dihasilkan tidak berubah, namun terjadi sedikit peningkatan pada kadar protein (0.44-0.49% bk) dibandingkan tapioka alami (0.19% bk). Tapioka asam memiliki karakteristik yang unik yaitu memiliki kapasitas pengembangan (expanding capability) (1.18-1.28 ml/g) yang lebih tinggi dari tapioka alami (1.15 ml/g). Selain itu, pada granula tapioka asam yang diamati terlihat bagian amorf pada struktur amilosa pati mengalami kerusakan sehingga menyebabkan nilai kejernihan pasta 1% (51.13-61.88%T), kelarutan (33.8850.56%) dan swelling power pada suhu 70°C (0.85-1.71%) meningkat dibandingkan tapioka alami (45.97%T), (21.18%), dan (0.45%). Pada sifat amilografi diperoleh bahwa suhu awal gelatinisasi tidak berubah (67.65°C) sedangkan breakdown viscosity lebih tinggi (4124-4617 cP) dibandingkan tapioka alami (4077cP). Namun, setback viscosity (449-576 cP) dan final viscosity (2221-2487 cP) pada tapioka asam lebih rendah dari tapioka alami (977 cP), dan (3178 cP). Viskositas maksimum pada tapioka asam hampir sama dengan tapioka alami (6035-6442 cP). PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI Saya menyatakan dengan sebenar-benarnya bahwa skripsi dengan judul Pembuatan Tapioka Asam dengan Fermentasi Spontan adalah karya asli saya sendiri, dengan arahan Dosen Pembimbing Akademik, kecuali yang dengan jelas ditujukan rujukannya. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini. Bogor, November 2012 Yang membuat pernyataan Puja Dwi Sari F34080005 © Hak Cipta Milik Institut Pertanian Bogor, tahun 2012 Hak cipta dilindungi Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencamtumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah dan pengutipan tersebut tidak merugikan kepentingan yang wajar di Insitut Pertanian Bogor. Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis dalam bentuk apapun tanpa izin Institut Pertanian Bogor. BIODATA PENULIS Puja Dwi Sari, lahir di Payakumbuh pada tanggal 25 Januari 1990. Penulis adalah anak kedua dari dua bersaudara dari pasangan Syahrial dan Elmisdar. Pada tahun 1996 penulis memulai pendidikan di SD Negeri 07 Balai Batimah Tiakar dan lulus tahun 2002. Pada tahun 2002 penulis melanjutkan pendidikan di SLTP Negeri 5 Payakumbuh dan lulus tahun 2005. Pada tahun 2005 penulis melanjutkan pendidikan di SMA Negeri 1 Payakumbuh dan lulus pada tahun 2008. Penulis melanjutkan pendidikan di Perguruan Tinggi Negeri, Institut Pertanian Bogor tahun 2008 melalui jalur USMI (Undangan Seleksi Masuk IPB) di Departemen Teknologi Industri Pertanian, Fakultas Teknologi Pertanian. Selama mengikuti perkuliahan di Institut Pertanian Bogor (IPB), penulis pernah menjadi asisten praktikum pada mata kuliah Pati, Gula dan Sukrokimia periode 2011/2012, dan Teknologi Minyak, Lemak dan Emulsi periode 2012/2013. Penulis juga aktif dalam Organisasi Mahasiswa Daerah Payakumbuh yang bernama IKMP sebagai sekretaris pada perode 2009/2010. Penulis juga berpartisipasi dalam kepanitian beberapa acara seperti Hagatri 2010 dan Atsiri 2010. Pada tahun 2011 penulis melakukan Praktek Lapang dengan judul Mempelajari Aspek Proses Produksi dan Pengawasan Mutu Resin Starch-Based Biodegradable Plastics di PT. Tirtamarta, Serang. Selanjutnya pada tahun 2012 penulis melaksanakan penelitian dengan judul Pembuatan Tapioka Asam dengan Fermentasi Spontan dibawah bimbingan Dr. Ir. Titi Candra Sunarti, M.Si. KATA PENGANTAR Puji dan syukur penulis panjatkan kehadirat Allah SWT atas rahmat, berkat, dan hidayah serta kemudahan sehingga penulis dapat menyelesaikan skripsi ini. Skripsi ini dibuat sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknologi Pertanian pada Departemen Teknologi Industri Pertanian, Fakultas Teknologi Pertanian. Selama proses penelitian sampai penulisan skripsi ini, penulis banyak mendapatkan bantuan baik moral maupun materil dari berbagai pihak. Pada kesempatan ini penulis ingin mengucapkan terima kasih kepada : 1. Dr. Titi Candra Sunarti, M.Si selaku dosen pembimbing akademik yang telah memberikan banyak arahan, bimbingan serta dukungan selama masa studi di TIN-IPB, pada saat penelitian serta dalam penyusunan skripsi ini. 2. Prof. Dr. Ing-. Ir. Suprihatin dan Dr. Ika Amalia K, S.TP. M.Si selaku dosen penguji yang telah memberikan masukan untuk penyempurnaan skripsi ini. 3. Keluarga besar, terutama kedua orang tua dan uda Dika yang telah memberikan dukungan dan doa serta keteladanan hidup bagi penulis. 4. Laboran TIN (Bu Ega, Bu Sri, Bu Rini, Bu Diyah, Pak Gunawan, Pak Diki, Pak Yogi, Pak Edi dan Pak Sugiardi) dan teknisi Techno-Park FATETA atas kesediaannya membantu penulis selama penelitian. 5. Terima kasih kepada Hari Putra yang telah memberikan bantuan, semangat dan dukungannya kepada penulis. 6. Teman sebimbingan (Siti Aminah Oktaviyani dan Dony Noor Romadona), perjuangan kita mulai dari praktik lapang sampai penelitian dan penulisan skripsi selama ini sungguh mengesankan. 7. Teman-teman TIN 45 yang tergabung dalam Himpunan Solidaritas Labroratorium (Citra, Lutfha, Fani, Ida, Anas, Niza, Dani, Abi) atas dukungan dan kebersamaannya selama penelitian. 8. Keluarga besar Villa Taman Sehat (Sovi, Putri, Desi, Yolan, Dita, Nisa), terima kasih atas kebersamaan dan keakraban kita selama ini. 9. Teman-teman TIN 45 terima kasih untuk tawa dan tangis bersamanya selama masa studi Sarjana di IPB serta semua pihak yang telah memberikan bantuan kepada penulis selama penelitian sampai penulisan skripsi ini yang tidak bisa disebutkan satu per satu. Penulis menyadari bahwa dalam penulisan skripsi ini masih jauh dari sempurna. Oleh karena itu penulis mengharapkan kritik dan saran yang dapat membangun dan bermanfaat demi perbaikan skripsi ini. Semoga skripsi ini memberikan manfaat bagi pembaca serta mampu memberikan kontribusi untuk perkembangan ilmu pengetahuan khususnya di bidang teknologi pertanian. Bogor, November 2012 Penulis i DAFTAR ISI Halaman KATA PENGANTAR i DAFTAR ISI ii DAFTAR GAMBAR iv DAFTAR TABEL v DAFTAR LAMPIRAN vi I. PENDAHULUAN 1 1.1. Latar Belakang 1 1.2. Tujuan 2 II. TINJAUAN PUSTAKA 3 2.1. Ubi Kayu 3 2.2. Pati 5 2.3. Tapioka 8 2.4. Modifikasi Tapioka dengan Fermentasi 10 III. METODOLOGI 13 3.1. Bahan dan Alat 13 3.2. Metode Penelitian 13 3.2.1. Proses Pembuatan Tapioka Asam 13 3.2.2. Karakterisasi Cairan Fermentasi 14 3.2.3. Karakterisasi Sifat Fisikokimia dan Mutu Tapioka Asam 14 3.2.4. Karakterisasi Sifat Fungsional Tapioka Asam 14 3.3. Analysis of Variance (ANOVA) IV. HASIL DAN PEMBAHASAN 16 18 4.1. Produksi Tapioka Asam 18 4.2. Karakteristik Cairan Fermentasi 20 4.2.1. pH 21 4.2.2. Total Asam 21 4.2.3. Bakteri Asam Laktat 21 4.2.4. Total Plate Count 22 4.2.5. Total Soluble Carbohydrate 22 4.3. Karakteristik Sifat Fisikokimia dan Fungsional Tapioka Asam 22 4.3.1. Bentuk Granula Pati 24 4.3.2. Komponen Kimia Tapioka Asam 27 4.3.2.1. Kadar Air 27 4.3.2.2. Kadar Abu 27 4.3.2.3. Kadar Protein 27 ii 4.3.2.4. Kadar Lemak 28 4.3.2.5. Kadar Serat Kasar 28 4.3.2.6. Karbohidrat by Difference 38 4.3.3. Komponen Mutu Tapioka Asam 29 4.3.3.1. pH 29 4.3.3.2. Total Asam 29 4.3.3.3. Bakteri Asam Laktat 30 4.3.3.4. Total Plate Count 31 4.3.3.5. Kapang dan Khamir 31 4.3.3.6. Escherichia coli 32 4.3.4. Sifat Fungsional Tapioka Asam 32 4.3.4.1. Kejernihan Pasta 1% 32 4.3.4.2. Kelarutan Pasta dan Swelling Power 70°C 33 4.3.4.3. Sifat Amilografi 34 4.3.4.4. Expanding Capability 38 V. PENUTUP 40 5.1. Kesimpulan 40 5.2. Saran 40 DAFTAR PUSTAKA 41 LAMPIRAN 44 iii DAFTAR GAMBAR Halaman Gambar 1. Bagian-bagian penyusun ubi kayu 3 Gambar 2. Struktur amilosa 5 Gambar 3. Struktur amilopektin 5 Gambar 4. Struktur amilopektin pada daerah kristalin dan amorf 6 Gambar 5. Model struktur granula pati 7 Gambar 6. Produksi asam laktat melalui fermentasi glukosa secara homofermentatif dan heterofermentatif 12 Gambar 7. Kondisi fermentasi secara spontan pada tapioka 14 Gambar 8. Bagan alir pembuatan tapioka asam 15 Gambar 9. Mekanisme modifikasi pati pada tapioka asam 20 Gambar 10. Bentuk granula tapioka asam dengan mikroskop cahaya perbesaran 100X 25 Gambar 11. Pengamatan mikroskopik granula pada tapioka asam dengan mikroskop cahaya terpolarisasi Gambar 12. Grafik jumlah mikroorganisme pada tapioka asam 26 31 Gambar 13. Pola Rapid Visco Amilograph pada tapioka asam 36 Gambar 14. Perubahan granula pati selama proses gelatinisasi dan retrogradasi 37 iv DAFTAR TABEL Halaman Tabel 1. Komposisi kimia ubi kayu per 100 g bahan 4 Tabel 2. Rasio amilosa-amilopektin pada umbi-umbian 6 Tabel 3. Komposisi kimia tapioka 8 Tabel 4. Syarat mutu tapioka menurut SNI 3451:2011 9 Tabel 5. Standar kehalusan tapioka 10 Tabel 6. Tabel ANOVA 16 Tabel 7. Hasil analisis cairan fermentasi 21 Tabel 8. Hasil analisis sifat fisikokimia dan fungsional tapioka asam 23 Tabel 9. Sifat amilografi dengan RVA (Rapid Visco Analyzer) 35 v DAFTAR LAMPIRAN Halaman Lampiran 1. Karakterisasi komposisi mutu cairan fermentasi dan tapioka asam 44 Lampiran 2. Karakterisasi sifat fisikokimia tapioka asam 45 Lampiran 3. Karakterisasi sifat fungsional tapioka asam 48 Lampiran 4. ANOVA karakteristik cairan fermentasi 50 Lampiran 5. ANOVA karakteristik kimia, mutu dan fungsional tapioka asam 54 Lampiran 6. Visualisasi tapioka asam yang dihasilkan 65 Lampiran 7. Expanding capability pada tapioka asam 66 vi I. PENDAHULUAN 1.1 Latar Belakang Ubi kayu merupakan salah satu komoditas pertanian jenis umbi-umbian yang banyak dimanfaatkan sebagai sumber pangan di Indonesia. Ubi kayu dapat diolah menjadi berbagai macam makanan tradisional yang dapat digunakan sebagai salah satu alternatif sumber karbohidrat selain padi. Komoditas ini sangat mudah dibudidayakan karena dapat tumbuh pada berbagai jenis tanah termasuk lahan kering dan kurang subur. Oleh karena itu penyebaran produksi ubi kayu meluas ke semua provinsi di Indonesia. Tapioka merupakan salah satu produk agroindustri yang memiliki banyak kegunaan antara lain sebagai bahan pembantu dalam berbagai industri. Tapioka juga merupakan salah satu komoditi yang potensial dan memiliki prospek pengembangan yang bagus. Namun proses pengolahan tapioka yang ada saat ini masih memiliki beberapa kelemahan. Industri tapioka di Indonesia umumnya industri skala kecil dan menengah dengan proses pengolahannya masih dilakukan secara tradisional. Hal ini menyebabkan mutu tapioka yang dihasilkan tidak seragam, baik dari bentuk fisik maupun keamanan pangannya yang kurang terjamin. Sanitasi yang buruk dan peralatan yang masih sangat sederhana juga menyebabkan tingginya pencemaran tapioka oleh berbagai mikroorganisme selama pengolahan. Tapioka asam merupakan salah satu produk pati termodifikasi yang dihasilkan melalui proses fermentasi tapioka alami yang diikuti dengan pengeringan pada sinar matahari. Tapioka asam memiliki sifat yang unik yaitu menghasilkan kapasitas pengembangan yang baik saat dipanggang. Tapioka asam sudah dikenal di Amerika Selatan yaitu di Colombia yang dikenal dengan almidon agrio dan di Brazil dengan polvilho azedo (Demiate et al., 2000). Pada kedua negara tersebut, tapioka asam digunakan untuk pembuatan roti keju dan bermacam biskuit tradisional lainnya. Di Indonesia tapioka asam digunakan di industri kerupuk tradisional dan biasanya disiapkan langsung oleh pabrik dengan cara merendam tapioka alami selama selang waktu tertentu. Selain itu, tapioka asam juga digunakan pada industri makanan lainnya seperti industri biskuit, industri roti, industri kue (cake) dan berbagai industri lainnya yang membutuhkan daya pengembangan tinggi. Oleh karena itu, kebutuhan masyarakat khususnya para pengusaha di Indonesia terhadap tapioka asam sangat besar, namun sampai saat ini belum ada industri yang mengolahnya. Kebanyakan industri pengguna menyiapkan sendiri kebutuhan tapioka asamnya. Fermentasi secara spontan dapat dilakukan untuk menghasilkan tapioka asam. Prinsip metode fermentasi tersebut yaitu memanfaatkan pertumbuhan mikroorganisme yang tumbuh secara alami selama proses fermentasi. Salah satu mikroorganisme yang menguntungkan dalam proses pengolahan tapioka ini adalah bakteri asam laktat. Selama proses fermentasi, bakteri asam laktat mendominasi komunitas bakteri yang ada dan dapat menghasilkan asam laktat yang merupakan produk utama fermentasi (Ampe et al., 2001). Selain itu, bakteri asam laktat juga dapat memproduksi protein yang disebut bakteriosin. Baik senyawa bakteriosin maupun asam laktat yang dihasilkan diharapkan mampu menghambat pertumbuhan bakteri patogen yang sering dijumpai pada tapioka alami. Dengan demikian, keamanan pangan akan lebih terjamin. Pengembangan dan perbaikan proses produksi yang sederhana melalui fermentasi secara spontan dan dapat diaplikasikan industri kecil dan rumah tangga, maka produk tapioka 1 asam sangat prospektif untuk dikembangkan dan diharapkan dapat meningkatkan minat petani untuk menanam ubi kayu sehingga akan meningkatkan pendapatan petani yang berdampak pada peningkatan kesejahteraan masyarakat. Tapioka asam yang dihasilkan diharapkan memiliki mutu dan sifat fungsional yang lebih baik dibandingkan dengan tapioka alami dari industri rakyat. 1.2 Tujuan Penelitian ini bertujuan untuk mengkaji proses produksi tapioka asam melalui fermentasi secara spontan (alami). Secara khusus penelitian ini mengkaji pengaruh proses fermentasi tapioka secara spontan terhadap karakteristik mutu, dan fisikokimia tapioka asam yang dihasilkannya. 2 II. TINJAUAN PUSTAKA 2.1 Ubi Kayu Tanaman ubi kayu atau ketela pohon di dalam dunia tumbuh-tumbuhan dinamakan Manihot utilissima Pohl atau M. esculenta Crantz. Tanaman ini termasuk famili Euphorbiaceae yang dapat tumbuh dengan baik pada ketinggian 10–700 m diatas permukaan laut dan pada daerah 25° lintang utara- 25° lintang selatan. Tanah yang sesuai adalah tanah yang berstruktur remah, gembur, tidak liat dan juga tidak poros serta mengandung unsur hara. Sementara itu pH yang dibutuhkan antara 4.5-8, dengan pH idealnya adalah 5.8. Suhu udara minimal bagi pertumbuhan tanaman ubi kayu adalah 10°C. Suhu dibawah 10°C akan menghambat pertumbuhan tanaman, seperti tanaman menjadi kerdil karena pertumbuhan bunga yang kurang sempurna. Curah hujan yang diperlukan antara 1.500-2500 mm/tahun dan kelembaban udara optimal untuk tanaman antara 60-65 % (Mastani, 2009). Ubi kayu berasal dari negara Amerika Latin atau tepatnya dari negara Brazil. Penyebarannya hampir ke seluruh dunia, antara lain Afrika, Madagaskar, India serta China. Ubi kayu atau ketela pohon diperkirakan masuk ke Indonesia pada tahun 1852. Pada tahun 1852 Kebun Raya Bogor menerima bibit ubi kayu dari Suriname yang pada tahun 1854 disebarkan ke seluruh karesidenan di Pulau Jawa dan kawasan lain di luar Pulau Jawa, sedangkan pengembangannya dimulai sekitar tahun 1914-1918. Pada tahun 1968 Indonesia menjadi negara penghasil ubi kayu nomor 5 di dunia (Rukmana, 1997). Umbi ubi kayu rata-rata bergaris tengah 2-3 cm dan panjang 50-80 cm, tergantung dari jenis ubi kayu yang ditanam. Daging umbinya berwarna putih atau kekuning-kuningan. Umbi ubi kayu tidak tahan simpan meskipun ditempatkan di lemari pendingin. Gejala kerusakan ditandai dengan keluarnya warna biru gelap akibat terbentuknya asam sianida yang bersifat racun bagi manusia (Anonim, 2012). Ubi kayu memiliki umbi yang berfungsi sebagai cadangan makanan. Umbinya berbentuk bulat memanjang, daging umbi mengandung pati dan tiap tanaman dapat menghasilkan 5-10 umbi (Rukmana, 1997). Bagian penyusun umbi ubi kayu diperlihatkan pada Gambar 1. Kulit luar Kulit dalam (cortex) Daging umbi Tali vaskular tengah Gambar 1. Bagian-bagian penyusun ubi kayu (CIAT, 2009) Pada Gambar 1 terlihat potongan melintang ubi kayu yang terdiri dari kulit luar (periderm), kulit dalam (cortex), daging umbi (flesh) dan tali vaskular tengah (central vascular strands). Kulit luar 3 terdiri dari beberapa lapisan sel mati yang membungkus umbi ubi kayu. Warnanya bervariasi, bentuk dan teksturnya kadang tebal dan kasar, kadang tipis dan halus. Kulit dalam terletak di bawah kulit luar, terdiri dari sklerenkima, parenkima kortikal, dan phloem. Warna kulit dalam bervariasi dari putih atau krem sampai merah muda. Daging buah terletak di tengah umbi dan sebagian besar terdiri dari sel-sel parenkima tempat penyimpanan yang berasal dari kambium. Daging umbi merupakan tempat penyimpanan utama tanaman ubi kayu dimana butir-butir pati disimpan. Warna daging umbi bervariasi dari putih sampai kuning. Benang vaskular tengah terdiri dari bundel xylem. Kadar serat dan kekuatan benang ini tergantung pada kondisi lingkungan dan umur tanaman. Umbi ubi kayu bervariasi bentuknya, tergantung kondisi tanah tempat tumbuhnya (Ekanayake et al., 1997). Daging umbi pada ubi kayu dapat berwarna putih atau kuning. Komposisi kimia ubi kayu dipengaruhi oleh faktor tanah, kondisi penanaman, kelembaban, suhu, varietas dan umur tanaman. Hal lain yang perlu dicatat adalah kandungan racun sianida di dalam ubi kayu. Racun tersebut ada didalam tanaman ubi kayu (akar, batang dan daun) dalam bentuk bebas maupun dalam bentuk terikat secara kimia yaitu sebagai senyawa kompleks linamarin glukosa. Adanya sianida mudah dikenali dengan munculnya rasa pahit. Tahap-tahap pengolahan sejak pengecilan ukuran hingga pengolahan lebih lanjut akan mengurangi kadar racun ini sampai tingkat yang tidak membahayakan (Wirakartakusumah, 1989). Tabel 1 berikut ini menyajikan komposisi kimia ubi kayu. Tabel 1. Komposisi kimia ubi kayu per 100 g bahan Jenis ubi kayu Komponen Putih Kuning Energi (kal) 146.00 157.00 Protein (g) 1.20 0.80 Lemak (g) 0.30 0.30 Karbohidrat (g) 34.70 37.90 Kalsium (g) 33.00 33.00 Fosfor (g) 40.00 40.00 Besi (g) 0.70 0.70 Vitamin A (SI) 0.00 385.00 Vitamin B (mg) 0.06 0.06 Vitamin C (mg) 30.00 30.00 Air (g) 62.50 60.00 Bagian yang dapat dimakan (g) 75.00 75.00 Sumber : Departemen Kesehatan RI (1990) Komposisi kimia ubi kayu biasanya bervariasi tergantung dari varietas disamping faktor luar seperti iklim, kesuburan tanah dan lain sebagainya. Komponen pati yang tinggi memungkinkan pati digunakan sebagai sumber karbohidrat. Kadar pati ubi kayu akan sangat dipengaruhi oleh waktu panen. Ubi kayu mengandung racun asam sianida (HCN) atau sianogenik glikosida. Berdasarkan kadar HCN-nya ubi kayu terbagi atas dua jenis yaitu ubi kayu manis dan tidak beracun dengan kadar HCN kurang dari 50 mg per kg ubi kayu segar. Kedua, jenis ubi kayu pahit, beracun dan kandungan HCN-nya lebih besar dari 50 mg per kg ubi kayu segar (Hamid, 2012). 4 2.2 Pati Pati merupakan salah satu jenis polisakarida terpenting dan tersebar luas di alam dan memiliki rumus molekul (C6H10O5)n. Pati disimpan sebagai cadangan makanan bagi tumbuhtumbuhan, antara lain di dalam biji buah (padi, jagung, gandum), di dalam umbi (ubi kayu, ubi jalar, talas), dan pada batang (aren dan sagu). Menurut Hart (1990), pati merupakan glukosa dengan ikatan α-glikosidik. Sifat pati tergantung panjang rantai karbonnya dan perbandingan antara molekul yang lurus dan bercabang rantai molekulnya. Pati tersusun paling sedikit oleh tiga komponen utama, yaitu amilosa, amilopektin, dan bahan antara seperti lipid dan protein. Umumnya pati mengandung 15-30% amilosa, 70-85% amilopektin dan 5-10% bahan antara. Pati terdiri dari dua fraksi yaitu amilosa dan amilopektin (Winarno, 2002). Struktur amilosa dan amilopektin dapat dilihat pada Gambar 2 dan 3. Gambar 2. Struktur amilosa Gambar 3. Struktur amilopektin Amilosa mempunyai struktur lurus yang didominasi dengan ikatan α-(1,4)-D-glukosa. Panjang polimer dipengaruhi oleh sumber pati dan akan mempengaruhi berat molekul amilosa. Pada umumnya amilosa dari umbi-umbian mempunyai berat molekul yang lebih besar dibandingkan dengan berat molekul amilosa serealia, dengan rantai polimer lebih panjang daripada rantai polimer amilosa serealia (Moorthy, 2004). Amilosa memiliki kemampuan membentuk kristal karena struktur rantai polimernya yang sederhana. Strukturnya yang sederhana ini dapat membentuk interaksi molekuler yang kuat. Interaksi ini terjadi pada gugus hidroksil molekul amilosa. Pembentukan ikatan hidrogen ini lebih mudah terjadi pada amilosa daripada amilopektin (Taggart, 2004). 5 Amilopektin mempunyai titik percabangan dengan ikatan α-(1,6)-D-glukosa disamping ikatan α-(1,4)-D-glukosa pada rantai lurusnya, dan memiliki bobot molekul yang besar. Amilopektin juga dapat membentuk kristal, tetapi tidak sereaktif amilosa. Hal ini terjadi karena adanya rantai percabangan yang menghalangi terbentuknya kristal (Taggart, 2004). Menurut Flach (1993) amilopektin mempunyai ukuran yang lebih besar daripada amilosa, tetapi mempunyai kekentalan yang lebih rendah. Pati alami biasanya mengandung amilopektin lebih banyak daripada amilosa. Butiran pati mengandung amilosa berkisar antara 15-30%, sedangkan amilopektin berkisar antara 70-85%. Perbandingan antara amilosa dan amilopektin akan berpengaruh terhadap sifat kelarutan dan derajat gelatinisasi pati. Tabel 2 menyajikan perbandingan jumlah amilosa dan amilopektin yang berbeda pada setiap jenis sumber pati. Tabel 2. Rasio amilosa-amilopektin pada umbi-umbian Sumber Pati Amilosa (%) Amilopektin (%) Ubi jalar 17.0 83.0 Ubi kayu 18.0 82.0 Talas 18.0 82.0 Kimpul 21.2 78.7 Ganyong 18.9 81.1 Suweg 18.3 81.7 Uwi 23.6 76.4 Gembili 24.3 75.7 Sumber : Sunarti (2005) Pati terdiri dari bagian yang bersifat kristalin dan bagian amorf, yang letaknya berselang seling membentuk cincin berlapis mengelilingi hilum. Bagian kristalin berisi ikatan pendek dari amilopektin yang berklaster-klaster. Bagian amorf berisi percabangan amilopektin dan amilosa (Liu, 2005). Model molekul amilopektin pada daerah kristalin dan amorf dapat dilihat pada Gambar 4. Gambar 4. Struktur amilopektin pada daerah kristalin (1) dan amorf (2) (Liu, 2005) 6 Pati terdiri dari butiran-butiran kecil yang disebut granula. Winarno (2002), menyatakan bahwa granula pati mempunyai sifat merefleksikan cahaya terpolarisasi, sehingga dibawah mikroskop terlihat kristal hitam putih. Sifat inilah yang disebut birefringent. Pada saat granula mulai pecah, sifat birefringent ini akan menghilang. Pada umumnya granula pati tidak terdapat dalam keadaan murni karena adanya zat antara misalnya protein dan lemak. Granula pati memiliki hilum sebagai inti. Hilum granula pati ada yang berada ditengah dan ada yang cenderung berada di tepi granula, tergantung asal pati tersebut. Liu (2005) menggambarkan model struktur pati seperti pada Gambar 5. Gambar 5. Model struktur granula pati (Liu, 2005) Granula pati mempunyai bentuk dan ukuran yang berbeda-beda tergantung dari sumbernya. Menurut Moorthy (2004), ukuran granula tapioka menunjukkan variasi yang besar yaitu sekitar 5-40 µm dengan bentuk bulat dan oval. Variasi tersebut dipengaruhi oleh varietas tanaman ubi kayu dan periode pertumbuhan pada musim yang berbeda. Menurut Satin (2007) bahwa sebaran dan ukuran 7 granula pati sangat menentukan karakterisasi fisik pati serta aplikasinya dalam produk pangan. Ukuran granula adalah salah satu faktor yang menentukan suhu gelatinisasi. Ukuran granula pati juga berpengaruh terhadap mutu pati yang dihasilkan dalam skala industri. Granula pati dapat menyerap air dan membengkak. Meyer (1982) menyatakan bahwa pengembangan granula pati dalam air dingin dapat mencapai 25-30% dari berat semula. Pada keadaan tersebut granula pati tidak larut dalam air dingin tapi berbentuk suspensi. Winarno (1991) menambahkan bahwa kemampuan pati menyerap air disebabkan oleh adanya gugus hidroksil pada molekul pati. Pemanasan suspensi pati dalam air mengakibatkan suspensi menjadi keruh dan bila gaya tarik-menarik antara molekul air lebih kuat daripada antar molekul pati, air akan terserap dan granula pati membengkak. Masuknya air ke dalam granula meningkatkan viskositas suspensi pati. Peningkatan volume granula pada selang suhu 55°C sampai 65°C masih memungkinkan granula pati kembali pada kondisi semula. Apabila terjadi pembengkakan yang luar biasa, dan granula pati tidak dapat kembali pada keadaan semula, maka perubahan ini disebut gelatinisasi. Suhu pada saat granula pati pecah disebut suhu gelatinisasi dan besarnya berbeda tergantung pada jenis pati dan konsentrasinya (Winarno, 1991). 2.3 Tapioka Tapioka merupakan pati yang diekstrak dari ubi kayu. Dalam memperoleh pati dari ubi kayu (tapioka) harus dipertimbangkan usia atau kematangan dari tanaman ubi kayu. Usia optimum yang telah ditemukan dari hasil percobaan terhadap salah satu varietas ubi kayu yang berasal dari jawa yaitu San Pedro Preto adalah sekitar 18-20 bulan (Grace, 1977). Ketika umbi ubi kayu dibiarkan di tanah, jumlah pati akan meningkat sampai pada titik tertentu, lalu umbi akan mejadi keras dan menyerupai kayu, sehingga umbi akan sulit untuk ditangani ataupun diolah. Pati tapioka memiliki bentuk granula oval, kerucut potong dengan ukuran diameter sebesar 20 µm (Beynum dan Roels, 1985). Komposisi kimia tepung tapioka dapat dilihat pada Tabel 3. Tabel 3. Komposisi kimia tapioka Komposisi Jumlah Serat (%) 0.5 Air (%) 15.0 Karbohidrat (%) 85.0 Protein (%) 0.5 – 0.7 Lemak (%) 0.2 Energi (kalori/100 g) 307.0 Sumber : Grace (1977) Sebagai bahan baku industri pangan, tapioka telah banyak digunakan untuk sumber karbohidrat (sumber kalori) maupun sebagai zat pengental (thickener) (Somaatmadja, 1984). Hal ini dikarenakan kandungan pati yang tinggi dan sifat patinya mudah membengkak dalam air panas dengan membentuk kekentalan yang dikehendaki. Dalam pembuatan tapioka berbagai faktor harus diperhatikan untuk memperoleh hasil yang bermutu tinggi. Mutu tapioka ditentukan oleh kadar air, serat dan kotoran, derajat putih dan kekentalan (Purwadaria, 1989). 8 Dalam Standar Nasional Indonesia (SNI), nilai pH tapioka tidak dipersyaratkan. Namun demikian, beberapa institusi mensyaratkan nilai pH untuk mengetahui mutu tepung tapioka berkaitan dengan proses pengolahan, misalnya pada proses pembentukan pasta. Pembentukan gel optimum terjadi pada pH 4-7 (Winarno, 2002). Bila pH terlalu tinggi, pembentukan pasta makin cepat tercapai tetapi akan cepat turun lagi. Sebaliknya, bila pH terlalu rendah, pembentukan pasta menjadi lambat dan viskositasnya akan turun bila proses pemanasan dilanjutkan. Disamping itu, nilai pH ini juga berpengaruh terhadap jumlah mikroorganisme yang terdapat dalam tapioka seperti bakteri asam laktat dan beberapa bakteri patogen. Mikroorganisme tersebut dapat mempengaruhi karakterisasi pati yang dihasilkan. The Tapioca Institute of America (TIA) menetapkan standar pH tepung tapioka sekitar 4.56.5 (Radley, 1976). Syarat mutu tepung tapioka sesuai SNI dapat dilihat pada Tabel 4. No Tabel 4. Syarat Mutu Tapioka menurut SNI 3451:2011 Kriteria uji Satuan Persyaratan 1 Keadaan 1.1 Bentuk - Serbuk halus 1.2 Bau - Normal 1.3 Warna - Putih, khas tapioka 2 Kadar air (b/b) % Maks. 14 3 Abu (b/b) % Maks. 0.5 4 Serat kasar (b/b) % Maks. 0.4 5 Kadar pati (b/b) % Min. 75 6 Derajat putih (MgO = 100) 7 Derajat asam 8 Cemaran logam 8.1 Min. 91 mL NaOH 1 N / 100 g Maks. 4 Kadmium (Cd) Mg/kg Maks 0.2 8.2 Timbal (Pb) Mg/kg Maks. 0.25 8.3 Timah (Sn) Mg/kg Maks. 40 8.4 Merkuri (Hg) Mg/kg Maks. 0.05 9 Cemaran arsen (As) Mg/kg Maks. 0.5 10 Cemaran mikroba 10.1 Angka lempeng total (35° C, Koloni/g Maks. 1x106 48 jam) 10.2 Escherichia coli APM/g Maks. 10 10.3 Bacillus cereus Koloni/g < 1x104 10.4 Kapang Koloni/g Maks. 1x104 Sumber : Badan Standardisasi Nasional (BSN) (2011) Kehalusan tepung juga penting untuk menentukan mutu tepung tapioka. Tepung tapioka yang baik adalah tepung yang tidak menggumpal dan memiliki kehalusan yang baik. Dalam SNI tidak dipersyaratkan mengenai kehalusan tepung tapioka. Salah satu institusi yang menyaratkan kehalusan sebagai syarat mutu tepung tapioka adalah The Tapioca Institute of America (TIA), yang membagi 9 tepung tapioka menjadi tiga kelas (grade) berdasarkan kehalusannya. Standar kehalusan tepung tapioka menurut TIA disajikan dalam Tabel 5. Tabel 5. Standar Kehalusan Tapioka Grade lolos ayak (%) Ukuran ayakan A 99 140 B 99 80 C 95 60 Sumber : Radley (1976) Tapioka dibuat dengan mengekstrak bagian umbi ubi kayu. Proses ekstraksi umbi kayu relatif mudah, karena kandungan protein dan lemaknya yang rendah. Jika proses pembuatannya dilakukan dengan baik, pati yang dihasilkan akan berwarna putih bersih (Moorthy, 2004). Berdasarkan derajat keputihan, maka semakin putih tapioka mutunya juga semakin baik. Pada pembuatan produk pangan juga demikian, tapioka yang lebih putih biasanya lebih diharapkan sebagai bahan baku. Untuk menghasilkan tapioka yang putih maka seringkali beberapa industri tapioka menambahkan bahan pemutih pada proses pembuatan tapioka seperti NaOCl atau metabisulfit. Dalam hal teknologi, ada perbedaan proses pembuatan tepung tapioka antara industri besar dan industri rumah tangga. Pada industri besar, proses pembuatan tepung tapioka biasanya dilakukan dengan menggunakan alat-alat atau mesin-mesin yang canggih, sedangkan pada industri rumah tangga pembuatan tepung tapioka biasanya dilakukan secara tradisional dengan menggunakan alat-alat yang sederhana sehingga kualitas pati rendah dengan kadar air tinggi, derajat asam yang tinggi dan kandungan serat serta kotoran yang juga tinggi. 2.4 Modifikasi Pati dengan Fermentasi Pati telah banyak digunakan pada pengolahan pangan, baik pada penggunaan di tingkat industri pangan maupun sklarumah tangga. Pati yang digunakan umumnya berupa pati tanpa perlakuan modifikasi (pati alami atau native starch). Walaupun pati alami cukup luas dalam penggunaannya, namun memiliki kekurangan yang sering menghambat aplikasinya dalam proses pengolahan pangan. kebanyakan pati alami menghasilkan suspensi pati dengan viskositas dan kemampuan membentuk gel yang tidak seragam (konsisten). Hal ini disebabkan profil gelatinisasi pati alami sangat dipengaruhi oleh iklim dan kondisi fisiologis tanaman sehingga jenis pati yang sama belum tentu memiliki sifat fungsional yang sama. Menurut Kusnandar (2010), diantara kekurangan yang utama adalah kebanyakan pati alami tidak tahan pada pemanasan suhu tinggi, kondisi dan proses mekanis. Kemudian pati alami memiliki kelarutan terbatas dalam air dan gel pati mudah mengalami sineresis (pemisahan air dari struktur gelnya) akibat retrogradasi pati. Oleh karena itu, pati alami sering dimodifikasi untuk menghasilkan pati yang sesuai dengan kondisi proses pengolahan. Pati termodifikasi adalah pati yang telah mengalami perlakuan fisik ataupun kimia yang bertujuan mengubah salah satu atau lebih sifat fisik atau kimia yang penting dari pati (Cui, 2006). Modifikasi pati dilakukan untuk mengatasi sifat-sifat dasar pati alami yang kurang menguntungkan tersebut sehingga dapat memperluas penggunaannya dalam proses pengolahan pangan serta menghasilkan karakteristik produk pangan yang diinginkan. Pati diberi perlakuan tertentu agar memiliki sifat yang lebih baik terutama sifat fisikokimia dan fungsionalnya. Beberapa sifat asal yang dapat diubah yaitu suhu gelatinisasi, karakteristik selama proses gelatinisasi, ketahanan 10 oleh pemanasan, pengasaman dan pengadukan, serta kecenderungan retrogradasi. Modifikasi dilakukan pada level molekuler dan level granular patinya. Teknik modififkasi pati yang banyak dilakukan diantaranya adalah modifikasi secara fisik (pregelatinisasi dan heat moisture treatment) dan modifikasi kimia (modifikasi ikatan silang, subsitusi, oksidasi dan hidrolisis asam). Modifikasi dapat juga dilakukan secara kombinasi, misalnya kombinasi modifikasi ikatan silang dan substitusi. Metode modifikasi lainnya yaitu dengan konversi atau hidrolisis pati menjadi karbohidrat rantai pendek, misalnya membentuk maltodekstrin (Kusnandar, 2010). Tapioka asam merupakan proses modifikasi pati dengan fermentasi yang memanfaatkan pertumbuhan bakteri asam laktat untuk menghasilkan asam organik terutama asam laktat. Proses fermentasi spontan dilakukan dengan cara merendam bahan dalam air pada selang waktu tertentu dengan memanfaatkan mikroorganisme dari lingkungan. Selama proses perendaman tersebut terjadi perubahan sifat yang disebabkan adanya aktivitas bakteri antara lain adalah bakteri asam laktat (Hounhouigan et al., 1993a, Johansson et al., 1995). Gibson dan Angus (2000) mengatakan bahwa bakteri asam laktat didefinisikan sebagai suatu kelompok bakteri Gram positif yang disatukan oleh berbagai morfologi. Bakteri asam laktat secara umum tidak berspora, berbentuk bulat atau batang yang memproduksi asam laktat sebagai produk akhir metabolik utama selama fermentasi karbohidrat. Bakteri asam laktat biasa digunakan di dalam industri makanan. Karthikeyan dan Santosh (2009) mengatakan bahwa bakteri asam laktat mampu menurunkan pH makanan, sehingga pada pH rendah pertumbuhan sebagian besar mikroorganisme yang terdapat di dalam makanan termasuk bakteri patogen dapat terhambat dan mampu memperpanjang umur simpan makanan. Bakteri asam laktat tidak hanya menurunkan pH media, tetapi juga menghasilkan antibiotik yang sering disebut sebagai bakteriosin, sehingga dapat menghambat pertumbuhan bakteri pembusuk (Fardiaz, 1988). Proses fermentasi tapioka menghasilkan beberapa perubahan sifat fisik dan fungsional produk yang dihasilkan. Buckle et al., (1980) menyatakan bahwa selama proses fermentasi tapioka terdapat peranan bakteri asam laktat yang menghasilkan asam laktat mencapai 66-82% dari total asam organik yang terdapat pada tapioka asam. Bakteri asam laktat merupakan sebutan umum untuk bakteri yang memfermentasikan gula seperti laktosa atau glukosa untuk menghasilkan sejumlah besar asam laktat. Tapioka asam menghasilkan produk panggang pada baking test dengan volume yang lebih maksimal dengan struktur yang lembut. Sifat amilograf menunjukkan bahwa viskositas pada tapioka asam lebih rendah dibandingkan dengan tapioka konvensional. Selama proses fermentasi tidak hanya terdapat modifikasi asam tetapi juga terdapat peranan enzim yang berasal dari mikroba yang tumbuh selama fermentasi. Dari produk panggang yang dihasilkan dari tapioka asam ditemukan adanya lubanglubang kecil yang menunjukkan bukti bahwa adanya peranan enzim yang terlibat (Buckle et al., 1980). Bakteri asam laktat terdiri dari dua kelompok yaitu bakteri asam laktat homofermentatif dan bakteri asam laktat heterofermentatif. Pada bakteri asam laktat homofermentatif, fermentasinya disebut fermentasi homolaktat karena satu-satunya produk fermentasi yang dihasilkan adalah asam laktat (Fardiaz, 1988). Bakteri asam laktat yang termasuk homofermentatif misalnya Streptococcus, Pediococcus dan beberapa spesies Lactobacillus. Kelompok bakteri asam laktat lainnya adalah bakteri asam laktat heterofermentatif, karena selain menghasilkan asam laktat juga memproduksi senyawasenyawa lainnya (Fardiaz, 1988). Bakteri asam laktat yang tergolong heterofermentatif misalnya Leuconostoc dan beberapa spesies Lactobacillus. Pada Leuconostoc pemecahan glukosa menjadi asam piruvat, asam asetat atau etanol dan karbondioksida. 11 Menurut Figueroa et al., (1995), fermentasi pada tapioka asam melibatkan dua kelompok bakteri yaitu bakteri asam laktat heterofermentatif yang didominasi oleh spesies Leuconostoc yang akan memulai pengasaman dan diikuti oleh bakteri asam laktat homofermentatif yang didominasi oleh Lactobacillus plantarum. Selain bakteri juga ditemukan khamir yang tumbuh pada proses fermentasi spontan tapioka (Lacerda et al., 2005). Proses pemecahan glukosa menjadi asam laktat oleh bakteri homofermentatif dan heterofermentatif dapat dilihat pada Gambar 6. Gambar 6. Produksi asam laktat melalui fermentasi glukosa secara homofermentatif (A) dan heterofermentatif (B) (Rahayu, 1992) 12 III. METODOLOGI 3.1 Bahan dan Alat 3.1.1 Bahan Bahan utama yang digunakan dalam penelitian ini adalah ubi kayu manis yang berumur 8 bulan yang diperoleh dari petani ubi kayu di Desa Nagrak, Kecamatan Sukaraja, Kabupaten Bogor dan air bersih sebagai bahan pembantu. Bahan lain untuk fermentasi adalah air yang memiliki standar air minum. Bahan yang digunakan untuk analisis adalah H2SO4 pekat, NaOH, alkohol, pelarut heksan, kertas saring, asam borat, indikator mengsel, indikator pp, glukosa murni, larutan phenol, NaCl, PCA (Plate Count Agar), EMB agar (Eosin Methylene Blue), NA (Nutrient Agar), MRS Broth (de ManRogosa-Sharpe), PDA (Potato Dextrosa Agar), Bakto Agar, spritus dan parafin. 3.1.2 Alat Peralatan yang digunakan untuk proses ekstraksi pati ubi kayu antara lain pisau, alat pengupas kulit ubi kayu, Starch Line Extraction-plant, wadah plastik dan kain penutup. Peralatan yang digunakan untuk pemanenan pati adalah tampah, blender, dan ayakan. Peralatan yang digunakan untuk analisis yaitu peralatan gelas, spektrofotometer, pH meter, mikroskop, cawan aluminium, cawan porselen, oven, desikator, tanur, labu kjeldahl, buret, alat destilasi, alat soxhlet, otoklaf, penangas air, RVA (Rapid Visco Analizer), dan inkubator. 3.2 Metode Penelitian 3.2.1 Proses Pembuatan Tapioka Asam Pembuatan tapioka asam menggunakan fermentasi spontan pada tapioka yang diekstrak dari umbi ubi kayu. Proses ekstraksi pati dilakukan di F-Technopark, IPB menggunakan alat starch line extraction-plant. Tahap awal pembuatan tapioka yaitu, pengupasan ubi kayu sebanyak 100 kg dengan alat pengupas kulit ubi kayu. Setelah dikupas kemudian dicuci bersih dengan air berulang kali sampai bersih. Proses selanjutnya yaitu pemarutan ubi kayu dengan mesin pemarut. Pada proses ini digunakan air untuk melancarkan proses pemarutan sehingga terbentuk bubur pati. Selanjutnya proses filtrasi bubur ubi kayu menggunakan alat vibrating screen. Proses filtrasi ini dilakukan sebanyak dua kali ulangan. Hasil filtrasi didekantasi selama 4-5 jam untuk mengendapkan patinya. Endapan pati yang dihasilkan, kemudian dicuci hingga bersih. Tahap selanjutnya yaitu proses persiapan fermentasi spontan. Proses pertama yaitu pemasukan sekitar 1000 g (volume ±1000 ml) pati basah ke dalam masing-masing wadah plastik yang telah disiapkan. Selanjutnya ditambahkan 500 ml air (standar air minum) sebagai cairan fermentasi. Wadah plastik ditutup dengan kain saring dan diikat yang bertujuan agar kotoran seperti debu tidak dapat masuk sehingga proses fermentasi tidak terkontaminasi. Selanjutnya, wadah disimpan pada suhu ruang dan difermentasi hingga 50 hari dengan pemanenan pati setiap 10 hari. Gambar 7 merupakan gambaran kondisi fermentasi yang dilakukan. 13 Gambar 7. Kondisi fermentasi secara spontan pada tapioka Tahap selanjutnya adalah proses pemanenan tapioka asam. Pertama, endapan pati dipisahkan dari cairan fermentasi dan dicuci untuk menghilangkan kotoran yang terdapat pada permukaan pati. Pati yang diperoleh kemudian dikeringkan dibawah sinar matahari selama lebih kurang 7 jam. Pati yang terbentuk dari hasil pengeringan yang tidak seragam dapat diblender dan diayak sehingga ukuran tapioka asam yang diperoleh lebih seragam. Proses pembuatan tapioka asam dapat dilihat pada Gambar 8. 3.2.2 Karakterisasi Cairan Fermentasi Cairan fermentasi merupakan hasil samping proses fermentasi spontan tapioka asam. Pengamatan karakterisasi cairan fermentasi meliputi analisis pH, total asam, analisis mikroba (TPC, BAL, E.coli, kapang dan khamir) dan TSC (Total Soluble Carbohydrate). Prosedur analisis disajikan pada Lampiran 1. 3.2.3 Karakterisasi Sifat Fisikokimia dan Mutu Tapioka asam Pengamatan karakterisasi sifat fisikokimia tapioka asam meliputi bentuk granula pati, karakterisasi kimia tapioka asam yang meliputi analisis proksimat (kadar air, kadar abu, kadar protein, kadar lemak, dan kadar serat kasar), dan kadar karbohidrat by difference. Karakterisasi mutu tapioka asam meliputi pH, total asam, dan analisis mikroba (TPC, BAL, E.coli, kapang dan khamir). Prosedur analisis komposisi mutu tapioka asam disajikan pada Lampiran 1, sedangkan prosedur analisis bentuk granula pati serta komposisi kimia tapioka asam disajikan pada Lampiran 2. 3.2.4 Karakterisasi Sifat Fungsional Tapioka Asam Pengamatan karakterisasi sifat fungsional tapioka asam meliputi kejernihan pasta, kelarutan dan swelling power pada suhu 70°C, expanding capability dengan memodifikasi metode Demiate et al (2000) dan sifat amilografi dengan Rapid Visco Analyzer (RVA). Prosedur analisis disajikan pada Lampiran 3. 14 Ubi kayu Pengupasan Air bersih Pencucian Air sisa pencucian Pemarutan Ekstraksi Ampas Pengendapan (4-5 jam) Pati basah Air (standar air minum) Fermentasi (0-50 hari) Pemisahan pati dengan cairan fermentasi Cairan Fermentasi Pengeringan dibawah sinar matahari (7-8 jam) Pengecilan Ukuran Tapioka asam Gambar 8. Bagan alir pembuatan tapioka asam 15 Analysis of Variance (ANOVA) 3.3 Desain percobaan pada penelitian ini adalah pengaruh lama fermentasi spontan terhadap karakteristik mutu cairan fermentasi dan karakteristik fisikokimia dan fungsional tapioka asam yang dihasilkan. Perlakuannya adalah variasi lama fermentasi yaitu 0, 10, 20, 30, 40, dan 50 hari dengan masing-masing tiga kali ulangan. ANOVA atau analisis ragam merupakan metode statistika untuk menguji signifikansi perbedaan dari dua atau lebih nilai rata-rata. Pada dasarnya metode ini merupakan proses aritmetika untuk membagi keragaman (jumlah kuadrat) total menjadi kompoen-kompenennya yang berhubungan dengan sumber keragaman yang diketahui. Bentuk hipotesis yang akan diuji ialah : H0 : µ1 = µ2 = … = µt (nilai rata-rata dari semua perlakuan adalah sama) H1 : minimal ada satu nilai rata-rata yang tidak sama dengan yang lainnya Hasil perhitungan pada ANOVA biasanya ditampilkan dalam bentuk tabel seperti yang terlihat dalam Tabel 6 berikut : Sumber Tabel 6. Tabel ANOVA Derajat bebas Jumlah kuadrat Kuadrat Tengah Keragaman (db) (JK) (KT) Perlakuan t-1 JKP KTP Galat (error) t(r-1) JKG KTG Total rt-1 JKT F hitung F Keterangan : t = jumlah perlakuan r = jumlah ulangan pada setiap perlakuan Nilai-nilai jumlah kuadrat, kuadrat tengah dan F hitung dicari dengan rumus-rumus sebagai berikut : ∑ ∑ Keterangan : Yij = data pada perlakuan ke-1 dan ulangan ke-j Yi = total data pada perlakuan ke-i Y.. = total data keseluruhan 16 Statistik uji yang digunakan adalah uji-F. F hitung merupakan nilai F yang diperoleh dari hasil perhitungan dan merupakan rasio dari dua nilai dugaan yang bebas dari ragam yang sama. Selanjutnya F hitung ini dibandingkan dengan F tabel, yakni nilai-nilai yang ada pada tabel distribusi F pada derajat bebas yangs esuai dan taraf nyata yang telah ditentukan. Jika F hitung>F tabel, maka keputusannya adalah tolak H0 dan terima H1, sedangkan jika F hitung ≤ F tabel maka keputusannya adalah terima H0. Apabila pengujian ANOVA menghasilkan penolakan terhadap H0 maka pengujian dapat dilanjutkan untuk mengetahui nilai rata-rata dari perlakuan mana saja yang berbeda signifikan. Uji lanjut yang digunakan adalah uji beda nyata terkecil (LSD). LSD merupakan kriteria uji untuk menentukan signifikan atau tidaknya selisih antara dua rata-rata perlakuan yang dibandingkan. Nilai LSD dicari dengan rumus : √ Keterangan : tα/2 = nilai distribusi t-student pada taraf nyata α dan derajat bebas galat Keputusan ujinya jika selisih antara dua rata-rata perlakuan yang dibandingkan lebih besar dari LSD maka dinyatakan berbeda signifikan pada tingkat kepercayaan (100 - α)%, sebaliknya jika lebih kecil dari LSD maka tidak berbeda signifikan. 17 IV. HASIL DAN PEMBAHASAN 4.1 Produksi Tapioka Asam Komponen utama karbohidrat dalam bahan pangan adalah pati. Ekstraksi basah dilakukan untuk memisahkan pati dari komponen bahan pangan lainnya, sehingga diperlukan air yang cukup banyak. Ekstraksi tersebut bertujuan untuk melepaskan granula pati sehingga diperoleh pati yang murni. Pengupasan kulit ubi kayu merupakan proses awal dalam pembuatan tapioka asam. Seperti dalam pembuatan tapioka, kulit ubi kayu umumnya dikupas dengan pisau sehingga memerlukan waktu yang relatif lama. Alternatif yang dapat dilakukan untuk mempercepat waktu pengupasan dengan menggunakan alat pengupas kulit ubi kayu, namun mutu kupasannya masih kurang bagus. Hal ini dikarenakan hanya kulit bagian terluar yang berwarna coklat saja yang terbuang dan sebagian kecil kulit bagian dalam yang berwarna putih. Hal ini menyebabkan kandungan asam sianida pada bubur ubi kayu yang diperoleh akan tinggi karena asam sianida banyak terkandung pada bagian kulit putih tersebut. Ubi kayu yang telah dikupas secepatnya dicuci dengan air mengalir atau di dalam bak. Tujuan pencucian ini untuk menghilangkan kotoran yang menempel selama pengupasan dan lendir pada permukaan sehingga dapat mengurangi kadar asam sianida. Pencucian dilakukan berulang kali untuk memastikan ubi kayu yang akan diproses selanjutnya sudah bersih. Ubi kayu yang sudah dibersihkan kemudian diparut dengan alat pemarut ubi kayu. Pada tahap ini ditambahkan air untuk memperlancar proses sehingga dihasilkan bubur ubi kayu. Pemarutan ini bertujuan untuk merusak jaringan dan sel-sel ubi kayu agar pati dapat terekstraksi. Tahap selanjutnya adalah pemerasan bubur ubi kayu dengan menggunakan vibrating screen. Prinsip kerja alat ini adalah menahan padatan yang terdapat pada bubur ubi kayu sehingga dihasilkan supernatan (cairan) yang mengandung pati. Pada alat tersebut terdapat dua saringan bertingkat dengan ukuran 200 mesh dan 100 mesh sehingga bisa dipastikan supernatan tidak mengandung ampas ubi kayu. Pemerasan bubur ubi kayu ini dilakukan sebanyak dua kali hingga cairan yang dihasilkan agak jernih. Hal ini berarti kandungan pati dalam ampas ubi kayu tinggal sedikit. Pengendapan supernatan yang diperoleh dilakukan dengan dekantasi selama 4-5 jam sehingga diperoleh endapan pati yang siap untuk difermentasi. Pengendapan cara ini memanfaatkan gaya grafitasi untuk menurunkan granulagranula pati dan memisahkannya dari cairan. Proses fermentasi spontan dilakukan dalam wadah-wadah plastik yang telah disiapkan. Endapan pati basah yang diperoleh dimasukkan kedalam wadah-wadah tersebut dengan volume yang sama. Kemudian ditambahkan air yang akan berfungsi sebagai cairan fermentasi. Pada fermentasi spontan tidak ditambahkan starter bakteri asam laktat (Cardena dan deBuckle, 1980). Hal ini dikarenakan fermentasi spontan merupakan teknik fermentasi yang memanfaatkan mikroba yang tumbuh secara alami selama fermentasi. Pada bagian atas wadah fermentasi ditutup dengan kain yang bertujuan untuk menghindari debu atau kotoran masuk. Kain yang digunakan harus tipis atau memiliki pori-pori yang cukup besar sehingga memungkinkan terjadinya pertukaran udara. Fermentasi spontan dilakukan selama 50 hari dengan pengamatan setiap 10 hari. Selain waktu, proses fermentasi juga dipengaruhi oleh berbagai faktor seperti suhu, pH, aktivitas air dan ketersediaan oksigen. Suhu adalah salah satu faktor lingkungan terpenting yang mempengaruhi pertumbuhan mikroorganisme. Suhu dapat mempengaruhi pertumbuhan dalam dua cara yang berlawanan. Pertama, apabila suhu naik, kecepatan metabolisme mikroorganisme akan naik dan pertumbuhan dipercepat dan 18 sebaliknya apabila suhu turun, kecepatan metabolismenya juga turun dan pertumbuhan diperlambat. Kedua, apabila suhu naik atau turun, tingkat pertumbuhan mungkin terhenti, komponen sel menjadi tidak aktif dan sel-sel dapat mati. Suhu yang digunakan pada fermentasi spontan ini adalah suhu ruang yang berkisar 25°C. Cardena dan de Buckle (1980) menyebutkan bahwa pada proses fermentasi spontan dilakukan pada kondisi suhu ruang dengan kisaran suhu 15-25° C. Setiap organisme juga mempunyai kisaran nilai pH dimana pertumbuhan masih memungkinkan dan masing-masing biasanya memiliki pH optimum. Kebanyakan mikroorganisme dapat tumbuh pada kisaran pH 6.0-8.0 dan nilai pH diluar kisaran 2.0 dan 10 biasanya bersifat merusak. Ketersediaan oksigen juga mempengaruhi mikroorganisme yang tumbuh selama fermentasi. Berdasarkan kebutuhan oksigen, mikroorganisme dikelompokkan menjadi mikroorganisme aerobik, anaerobik, anaerobik fakultatif dan mikroerofilik. Mikroorganisme aerobik membutuhkan ketersediaan oksigen, sedangkan anaerobik merupakan mikroorganisme yang tidak dapat tumbuh jika adanya oksigen. Mikroorganisme anaerobik fakultatif akan mempergunakan oksigen jika tersedia dan akan tetap hidup walaupun kondisi dalam anaerobik, sedangkan mikroerofilik yaitu mikroorganisme yang tumbuh pada kadar oksigen lebih rendah dari kadar oksigen di atmosfer. Mikroorganisme juga membutuhkan water activity yang berbeda. Bakteri membutuhkan aw yang tinggi berkisar 0.91, sedangkan khamir membutuhkan nilai aw yang rendah sekitar 0.87 (Buckle, 1985). Pati yang telah difermentasi kemudian dikeringkan dengan sinar matahari selama 7-9 jam bergantung cuaca. Pengeringan bertujuan untuk mengurangi kadar air yang terdapat dalam bahan. Pengeringan dengan sinar matahari berpengaruh terhadap baking expanding capability tapioka asam yang dihasilkan, khususnya pada panjang gelombang UV tertentu. Vatanasuchart et al., (2005) mengemukakan bahwa asam laktat dan energi UV dengan panjang gelombang 310-330 nm dapat menyebabkan terjadinya depolimerisasi parsial pada struktur amilosa tapioka asam sehingga baking expansion yang dihasilkan lebih tinggi dibandingkan menggunakan oven. Dengan demikian, ketika pasta pati dipanaskan maka molekul air lebih mudah terserap dan membentuk ikatan hidrogen sehingga akan mencapai viskositas yang lebih cepat. Tahapan terakhir adalah penghalusan tapioka asam kasar dengan blender sehingga diperoleh tapioka dengan ukuran pati yang dikehendaki. Bentuk tapioka asam yang dihasilkan secara visual dapat dilihat pada Lampiran 6. Secara visual tidak terlihat perbedaan pada tapioka asam yang dihasilkan berdasarkan umur fermentasinya. Akan tetapi, tekstur yang dimiliki oleh masing-masing tapioka tersebut berbeda. Umur fermentasi yang lebih panjang akan menghasilkan tapioka asam dengan tekstur lebih halus yang diringi dengan peningkatan jumlah bakteri asam laktat yang tumbuh. Hal ini menunjukkan bahwa granula-granula pati digunakan oleh bakteri asam laktat sebagai subsrat untuk metabolismenya sehingga dihasilkan asam laktat dan senyawa lainnya. Bakteri asam laktat juga memecah pati menjadi molekul yang sederhana seperti glukosa. Granula pati yang awalnya memiliki ukuran yang lebih besar, perlahan akan menjadi kecil dan memiliki bentuk yang tidak teratur dan seragam. Hal ini bergantung pada jumlah bakteri asam laktat yang tumbuh. Selain itu, flavour tapioka asam yang dihasilkan juga semakin baik seiring dengan makin lamanya fermentasi. Hal ini dikarenakan bakteri asam laktat menghasilkan komponen aroma non volatil. Menurut Onyango et al., (2004), bakteri asam laktat menghasilkan komponen utama berupa asam laktat yang merupakan komponen aroma non volatil utama disamping komponen flavor yang lain yaitu asam karboksilat, ester dan aldehida. Tapioka asam merupakan salah satu jenis pati termodifikasi. Proses modifikasi pada pati dapat memperbaiki cooking properties sehingga pada aplikasi pengolahannya akan semakin mudah. Proses modifikasi yang terjadi pada tapioka asam terjadi disebabkan oleh hidrolisis asam laktat yang dihasilkan dan thermal treatment dari pengeringan menggunakan sinar matahari yang memiliki panjang gelombang yang beragam. 19 Mekanisme modifikasi pati yang terjadi pada tapioka asam tidak lepas dari bagian yang membentuk pati tersebut yaitu amilosa dan amilopektin. Pada bagian tersebut terdapat bagian amorf dan kristalin yang berpengaruh terhadap sifat pati yang dihasilkan, khususnya sifat fungsional. Bagian amorf merupakan bagian yang dapat larut, sedangkan bagian kristalin tidak dapat larut. Pada tapioka asam bagian amorf akan mengalami kerusakan oleh asam laktat. Bagian amorf merupakan ikatan yang lemah dan umumnya terdapat pada titik percabangan struktur pati sehingga mudah terputus oleh asam. Pada saat bagian tersebut dirusak oleh asam maka percabangannya akan terputus dan akan terbentuk sebagian rantai yang lurus sesuai dengan jumlah kerusakan yang terjadi. Gambar 9 memperlihatkan mekanisme modifikasi pati pada bagian amorf tapioka asam. A A A A A A A A Model cluster amilopektin native starch A Model cluster amilopektin tapioka asam Ket : A = bagian amorf Gambar 9. Mekanisme modifikasi pati pada tapioka asam (model cluster amilopektin oleh Hizukuri, 1986) Pada produksi tapioka asam, jumlah kerusakan pada bagian amorf yang diinginkan hanya sebagian. Hal ini terkait dengan pengaruh bagian tersebut pada cooking properties pati yang dihasilkan. Jika seluruh bagian amorf terpotong-potong maka bagian yang tersisa pada pati yaitu bagian kristalin yang memiliki struktur yang kaku, sehingga cooking properties yang dihasilkan akan menurun. Pengaruh ini dapat dilihat pada sifat fungsional tapioka asam yang dihasilkan. 4.2 Karakteristik Cairan Fermentasi Proses fermentasi spontan menghasilkan produk samping berupa cairan fermentasi. Cairan fermentasi diperoleh saat pemisahan pati dengan cairannya. Cairan fermentasi sangat berpengaruh terhadap pertumbuhan mikroorganisme karena merupakan salah satu media untuk pertumbuhan mikroba. Pada awal proses fermentasi, tumbuh berbagai jenis mikroba pada permukaan cairan fermentasi dan membentuk sebuah lapisan yang berwarna gelap. Kemudian permukaan cairan fermentasi perlahan bersih dari mikroorganisme ketika fermentasi dilanjutkan hingga 50 hari. Analisis yang dilakukan pada cairan fermentasi meliputi nilai pH, total asam, jumlah bakteri asam laktat, TPC dan Total Soluble Carbohydrate. Hasil analisis cairan fermentasi dapat dilihat pada Tabel 7. 20 Parameter Tabel 7. Hasil analisis cairan fermentasi fermentasi hari ke - pH 10 4.18 20 b 3.75 30 b 3.39 40 a 3.65 50 b 3.63 b Total Asam (ml NaOH/100g bahan) 15.84 a 46.05 ab 55.15 ab 72.45 ab 103.25 b Bakteri Asam laktat (x 106 CFU/g) 0.72 a 59.60 abcd 19.56 abc 41.77 abcd 16.15 ab Total Plate Count (x 106 CFU/g) 0.03 a 16.24 abc 16.66 abc 28.54 abcd 10.66 ab 178.87 a 601.01 ab 1052.61 abc 1116.50 abc 1594.70 abc Total Soluble Carbohydrate (mg/L) 4.2.1. pH Dari hasil ANOVA dan uji lanjut LSD pada Lampiran 4 diperoleh bahwa terdapat satu perlakuan yang berbeda signifikan dengan perlakuan lain pada taraf 5% yaitu cairan fermentasi 30 hari, sedangkan cairan fermentasi 10 hari, 20 hari, 40 hari dan 50 hari tidak berbeda signifikan. Nilai pH cairan fermentasi 30 hari yaitu 3.39 dan merupakan nilai pH paling rendah, sedangkan pada perlakuan lain berkisar antara 3.63-4.18. Pada cairan fermentasi 30 hari lingkungan fermentasi paling asam dibandingkan dengan yang lain. Rendahnya nilai pH pada cairan fermentasi tersebut disebabkan adanya asam organik yang dihasilkan oleh mikroorganisme yang tumbuh selama proses fermentasi terutama bakteri asam laktat. Bakteri asam laktat menghasilkan asam laktat sehingga dapat menurunkan pH pada cairan fermentasi. 4.2.2. Total asam Dari hasil ANOVA dan uji lanjut LSD pada Lampiran 4 diperoleh bahwa nilai total asam berbeda signifikan pada cairan fermentasi 10 hari dan 50 hari, sedangkan pada cairan fermentasi 20 hari sampai 40 hari tidak berbeda signifikan pada taraf 5%. Kenaikan nilai total asam terjadi sampai dengan fermentasi 50 hari artinya jumlah asam yang dihasilkan oleh bakteri asam laktat semakin tinggi. Hal ini berhubungan dengan jumlah bakteri asam laktat yang tumbuh selama fermentasi. Selain dapat menurunkan pH, asam laktat yang dihasilkan oleh bakteri asam laktat juga dapat meningkatkan total asam pada cairan fermentasi. Bakteri asam laktat memanfaatkan kandungan pati sebagai substrat untuk diubah menjadi glukosa dan kemudian digunakan untuk menghasilkan asam laktat melalui proses glikolisis. 4.2.3. Bakteri Asam Laktat Dari analisis ANOVA dan uji lanjut LSD taraf 5% pada Lampiran 4 maka terdapat perlakuan yang berbeda signifikan berdasarkan jumlah bakteri asam laktat. Cairan fermentasi 10 hari dengan jumlah bakteri asam laktat paling rendah sebesar 0.72 x 106 CFU/g. Jumlah bakteri asam laktat mengalami peningkatan pada cairan fermentasi 20 hari menjadi 5.96 x 106 CFU/g dan nilai tersebut tidak berbeda signifikan dengan cairan fermentasi 40 hari (41.77 x 106 CFU/g). Pada cairan fermentasi 30 hari, jumlah bakteri asam laktat mengalami penurunan menjadi 19.56 x 106 CFU/g dan berbeda signifikan dengan cairan fermentasi 20 hari. Hal yang serupa juga terjadi pada cairan fermentasi 50 hari dengan bakteri asam laktat sebesar 16.15 x 106 CFU/g. Perubahan jumlah bakteri asam laktat disebabkan oleh berbagai faktor seperti suhu, ketersediaan oksigen dan subsrat yang sulit dikontrol selama proses fermentasi. 21 4.2.4. Total Plate Count (TPC) Dari hasil ANOVA dan uji lanjut LSD taraf 5% pada Lampiran 4 maka terdapat perlakuan yang berbeda signifikan berdasarkan TPC. TPC mengalami peningkatan yang signifikan sampai fermentasi 40 hari menjadi 28.54 x 106 CFU/g. Namun, pada fermentasi 50 hari mengalami penurunan yang signifikan menjadi 10.66 x 106 CFU/g. Penurunan TPC ini disebabkan kandungan total asam yang semakin tinggi pada cairan fermentasi sehingga pertumbuhan mikroorganisme yang tidak tahan terhadap asam akan terhambat. Penurunan TPC ini diduga menghasilkan biomassa berupa sel-sel mikroba yang telah mati sehingga meningkatkan amonia pada cairan fermentasi dan meningkatkan nilai pH yang terjadi mulai pada lama fermentasi 40 hari. Pertumbuhan bakteri asam laktat pada cairan fermentasi sudah mulai terlihat dominan dibandingkan TPC mulai fermentasi selama 10 hari. Walaupun pada fermentasi 30 hari jumlah bakteri asam laktat mengalami penurunan, namun jumlahnya tetap lebih dominan dari TPC. 4.2.5 Total Soluble Carbohydrate (TSC) Total Soluble Carbohydrate (TSC) menunjukkan karbohidrat yang terlarut pada cairan fermentasi. Metode yang dipakai untuk mengukur TSC adalah metode fenol-asam sulfat. Dari hasil ANOVA dan uji lanjut LSD pada Lampiran 4 diperoleh bahwa cairan fermentasi 10 hari dan 20 hari berbeda signifikan pada taraf 5% dengan perlakuan lain. Nilai TSC mengalami kenaikan hingga fermentasi 50 hari. Peningkatan yang terjadi pada cairan fermentasi 30 hari sampai 50 hari tidak berbeda signifikan. Peningkatan tersebut disebabkan oleh aktivitas bakteri asam laktat yang mengubah pati pada tapioka menjadi gula-gula sederhana yang larut dalam cairan. Tingginya jumlah bakteri asam laktat selama fermentasi mengakibatkan jumlah pati yang dipecah semakin banyak sehingga jumlah gula sederhana juga semakin meningkat. 4.3 Karakteristik Sifat Fisikokimia dan Fungsional Tapioka Asam Analisis yang dilakukan terhadap tapioka asam yaitu analisis terhadap sifat fisik, kimia, mutu dan fungsional. Sifat fisik merupakan kriteria yang penting pada pati yang meliputi bentuk dan sifat birefringence pada pati. Karakterisasi kimia tapioka asam meliputi analisis proksimat (kadar air, kadar abu, kadar protein, kadar serat kasar, kadar lemak, dan karbohidrat by difference). Karakterisasi mutu pati meliputi nilai pH, total asam, dan analisis mikroba (TPC, bakteri asam laktat, Eschericia coli, kapang dan khamir). Selain itu, juga perlu dilakukan karakterisasi fungsional tapioka asam yang dihasilkan meliputi kejernihan, kelarutan, swelling power, sifat amilografi dan expanding capability. Hasil analisis komponen kimia, mutu dan sifat fungsional tapioka asam dapat dilihat pada Tabel 8. Terlihat bahwa perbedaan umur fermentasi menghasilkan sifat fisikokima dan fungsional tapioka asam yang berbeda terutama dalam komponen mutunya. 22 Parameter Tabel 8. Hasil analisis sifat fisikokimia dan fungsional tapioka asam Fermentasi hari ke0 10 20 30 40 50 Komponen Kimia Air (%) 11.93 15.60 14.06 16.71 14.62 12.59 b a c b b 0.22 b Abu (% bk) 0.16 Protein (% bk) 0.19 a 0.20 b 0.49 c 0.44 c 0.45 c 0.49 c Lemak (% bk) 1.19 b 1.45 b 1.06 ab 1.07 b 1.05 a 1.07 b Serat Kasar (% bk) 0.11 a 0.12 b 0.11 b 0.11 b 0.11 b 0.11 b 86.43 b 82.49 b 83.43 b 81.47 a 83.52 b 85.51 b pH 4.75 b 4.18 b 3.78 b 3.83 b 3.36 a 3.64 b Total Asam (ml NaOH/100 g bahan) 2.23 a 4.75 b 6.13 b 6.22 b 7.30 c 7.36 c Bakteri Asam laktat (x 106 CFU/g) 0.01 a 0.12 ab 14.93 abcd 19.53 abcde 10.43 abcd 5.01 abc Total Plate Count (x 105 CFU/g) 0.17 a 3.96 ab 18.33 abcd 18.92 abcd 11.25 abc 9.33 abc Kapang dan Khamir (x 105 CFU/g) tt 0.01 ab 0.27 abc 2.49 abcd 2.58 abcd 2.65 abcd Eschericia coli (CFU/g) tt tt tt tt tt tt Kejernihan pasta (%T) 45.97 a 56.80 b 51.13 b 61.88 b 52.25 b 51.52 b Kelarutan (%) 21.18 a 33.88 b 50.56 b 35.78 b 35.63 b 34.92 b Swelling Power (%) 0.45 a 0.85 b 1.71 c 0.93 b 0.92 b 0.89 b Expanding Capability (SV, ml/g) 1.15 a 1.18 a 1.21 a 1.22 a 1.27 a 1.28 a Karbohidrat by different (% bk) 0.15 0.85 0.21 0.26 Komponen Mutu Sifat Fungsional *tt : tidak terdeteksi 23 23 4.3.1 Bentuk Granula Pati Tapioka memiliki bentuk asli berupa butiran atau granula yang berwarna putih, tidak berbau, tidak berasa, dan tidak berampas. Sifat fisik tapioka asam dapat dijelaskan melalui bentuk granula dan sifat birefringence. Sifat mikroskopis granula pati dapat digunakan untuk mengidentifikasi sumber patinya sebab pati yang terdapat dalam jaringan tanaman mempunyai bentuk dan ukuran yang khas dan beraneka ragam. Menurut Moorthy (2004), granula tapioka menunjukkan variasi yang besar yaitu sekitar 5-40 µm dengan bentuk bulat dan oval. Sriroth et al., (1999) menambahkan bahwa ukuran granula pati dari ubi kayu yaitu sekitar 8-22 µm, dengan rata-rata ukuran granula yaitu 15 µm (14 bulan masa panen) dan 12 µm (16 bulan masa panen). Perbedaan ukuran granula dapat dipengaruhi oleh kondisi dan waktu panen ubi kayu. Hasil pengamatan bentuk granula tapioka dapat dilihat pada Gambar 10. Pada Gambar 7 tersebut terlihat bahwa terdapat perbedaan bentuk granula pati sesuai dengan waktu fermentasinya. Secara umum, dapat terlihat bahwa semakin lama fermentasi kerusakan terhadap granula pati semakin meningkat. Ampe et al., (2001) melaporkan bahwa tapioka asam yang difermentasi selama 30 hari memperlihatkan kerusakan granula sebagai akibat terjadinya degradasi pada pati yang semakin meningkat. Bentuk granula tapioka alami (a) memperlihatkan bentuk sebagian besar granula masih utuh yaitu bulat dan oval. Kemudian tapioka asam yang telah difermentasi selama 10 hari (b) memberikan hasil yaitu terdapat granula yang sudah mulai mengalami kerusakan, walaupun masih banyak granula yang masih utuh. Kerusakan granula meningkat pada tapioka asam yang difermentasi selama 20 hari (c), terdapat banyak granula pati yang memiliki permukaan yang keropos pada bagian luar. Kerusakan granula terus meningkat pada tapioka asam yang difermentasi selama 30 hari (d) yang memperlihatkan banyaknya granula pati yang retak dan berlubang. Begitupun dengan tapioka asam yang difermentasi selama 40 hari (e), kerusakan ditandai dengan granula pati yang berlubang, keropos dan memiliki bentuk yang tidak beraturan. Pada tapioka asam dengan waktu fermentasi 50 hari (f) terdapat granula pati sudah sangat rusak dan berlubang sehingga kemungkinan lapisan yang menyusun granula tersebut banyak yang terkelupas tidak teratur. Kerusakan yang terjadi pada granula pati diduga disebabkan oleh aktivitas bakteri asam laktat yang memecah pati menjadi komponen yang sederhana. Jumlah bakteri asam laktat yang terus meningkat hingga mencapai fase eksponensial sejalan dengan kerusakan yang terdapat pada granula tapioka asam. 24 (a) Fermentasi 0 hari (b) Fermentasi 10 hari (c) Fermentasi 20 hari (d) Fermentasi 30 hari (e) Fermentasi 40 hari (f) Fermentasi 50 hari Gambar 10. Bentuk granula tapioka asam dengan mikroskop cahaya perbesaran 100X Granula pati pada tapioka asam menunjukkan sifat birefringence yaitu sifat granula pati yang dapat merefleksikan cahaya terpolarisasi, sehingga dibawah mikroskop polarisasi membentuk bidang warna kuning biru. Pada waktu granula rusak atau mulai pecah maka sifat birefringence akan semakin berkurang (Gambar 11). 25 (a) Fermentasi 0 hari (b) Fermentasi 10 hari (c) Fermentasi 20 hari (d) Fermentasi 30 hari (e) Fermentasi 40 hari (f) Fermentasi 50 hari Gambar 11. Pengamatan mikroskopik granula pada tapioka asam dengan mikroskop cahaya terpolarisasi (perbesaran 100X) Whistler dan Paschall (1984) di dalam Permatasari (2007), melaporkan bahwa warna birukuning pada permukaan granula pati disebabkan karena adanya perbedaan indeks refraksi dalam granula pati. Indeks refraksi dipengaruhi oleh struktur molekul amilosa di dalam pati. Bentuk heliks dari amilosa dapat menyerap sebagian cahaya yang melewati granula pati. Jika arah getar gelombang cahaya paralel terhadap sumbu heliks amilosa, maka terjadi penyerapan cahaya secara intensif. Jika arah getar gelombang cahaya tegak lurus terhadap sumbu heliks amilosa, maka terjadi sedikit atau tidak ada penyerapan cahaya. Jadi setelah dilakukan fermentasi secara spontan, ada bagian dari pati (amilopektin) yang bersifat amorf terpotong oleh asam. Hal ini yang menyebabkan sifat kristalinitas meningkat sedangkan fraksi amorf semakin berkurang sehingga sifat birefringence juga semakin berkurang. 26 4.3.2 Komponen Kimia Tapioka Asam 4.3.2.1 Kadar Air Jumlah kandungan air dalam suatu bahan sangat mempengaruhi daya simpan bahan tersebut terhadap serangan mikroba. Untuk memperpanjang umur simpan suatu bahan maka dilakukan penghilangan sebagian air dalam bahan tersebut sehingga mencapai kadar air tertentu. Pengeringan pada tapioka asam mempunyai tujuan untuk mengurangi kadar airnya sampai batas tertentu sehingga pertumbuhan mikroba dan aktivitas enzim penyebab kerusakan dapat dihambat. Berdasarkan Tabel 8 dapat dilihat bahwa kadar air tapioka asam yang diperoleh berkisar antara 11.93-16.71%. Perbedaan nilai kadar air pada tapioka asam ini dipengaruhi oleh proses pengolahan, khususnya pada saat pengeringan. Pengeringan yang dilakukan pada tapioka asam yaitu dengan penjemuran dibawah sinar matahari. Panas sinar matahari yang tidak stabil setiap waktu sehingga dihasilkan tapioka asam yang memiliki kadar air yang bervariasi. 4.3.2.2 Kadar Abu Kadar abu menunjukkan kandungan mineral dalam suatu bahan. Mineral merupakan zat anorganik dalam bahan yang tidak terbakar selama proses pembakaran. Bahan-bahan organik dalam proses pembakaran akan terbakar tetapi komponen anorganiknya tidak, karena itulah disebut sebagai kadar abu. Kadar abu sangat dipengaruhi oleh jenis bahan yang dianalisis dan cara pengabuannya. Kadar abu adalah komponen yang tidak mudah menguap, tetap tinggal dalam pembakaran dan pemijaran senyawa organik. Penentuan kadar abu total dapat digunakan untuk berbagai tujuan, antara lain untuk menentukan baik atau tidaknya suatu pengolahan, mengetahui jenis bahan yang digunakan, dan sebagai penentu parameter nilai gizi suatu bahan makanan. Komponen yang umum terdapat pada senyawa organik alami adalah kalium, natrium, kalsium, magnesium, mangan dan besi. Mineral yang banyak terkandung di dalam ubi kayu adalah kalsium dan phosfor. Dari hasil ANOVA dan uji lanjut LSD pada Lampiran 5 maka terdapat perlakuan yang berbeda signifikan yaitu pada kadar abu pada tapioka yang dihasilkan pada 10 hari dan 20 hari fermentasi. Tapioka asam yang dihasilkan dari fermentasi 20 hari memiliki kadar abu tertinggi sebesar 0.85 %, sedangkan pada perlakuan lain diperoleh kadar abu berkisar antara 0.15-0.26%. Nilai kadar abu tapioka asam yang diperoleh lebih rendah dari nilai kadar abu tapioka ditetapkan oleh SNI 3451:2011 yaitu maksimal 0.5 %. Kadar abu pada pati dipengaruhi oleh proses pengolahan yaitu pada tahap ektraksi. Ekstraksi yang dilakukan secara manual dengan menggunakan saringan bertingkat memberi kemungkinan mineral yang terkandung dalam umbi ubi kayu dapat ikut terbuang bersama ampas hasil ekstraksi sehingga kadar abu yang terukur menjadi lebih rendah. Sahlin (1999) menjelaskan bahwa kadar abu tidak dipengaruhi oleh fermentasi kecuali jika pada proses fermentasi tersebut ditambahkan beberapa garam atau terjadi leaching saat bagian yang cair dipisahkan dari makanan yang difermentasi. 4.3.2.3 Kadar Protein Protein merupakan komponen minor pada tapioka. Dari hasil ANOVA dan uji lanjut LSD pada Lampiran 5 maka diperoleh bahwa tapioka tanpa fermentasi (0 hari) atau yang selanjutnya disebut sebagai tapioka alami dan tapioka asam yang difermentasi 10 hari berbeda signifikan dengan perlakuan yang lain. Hal ini terlihat pada Tabel 8, diperoleh kadar protein tapioka alami dan tapioka asam yang difermentasi 10 hari berturut-turut adalah 0.19% dan 0.20%, sedangkan pada perlakuan yang lainnya diperoleh kadar protein tapioka asam berkisar antara 0.44-0.49%. Hasbullah (1985) menyebutkan bahwa kadar protein pada tapioka tanpa fermentasi adalah sebesar 0.8%. Rendahnya 27 nilai kadar protein pada tapioka yang difermentasi disebabkan karena adanya protein yang larut dalam air saat pencucian pati dan sebagian protein juga ikut terbuang bersama ampas sehingga kadar protein yang terukur menjadi rendah. 4.3.2.4 Kadar Lemak Dari hasil ANOVA dan uji lanjut LSD pada Lampiran 5 diperoleh terdapat dua perlakuan yang memiliki kadar lemak berbeda signifikan dengan perlakuan yang lainnya yaitu kadar lemak pada tapioka asam yang difermentasi 20 hari dan 40 hari. Berdasarkan Tabel 8 terlihat bahwa kadar lemak pada kedua perlakuan tersebut berturut-turut adalah 1.06% dan 1.05%, sedangkan pada perlakuan lain yaitu pada tapioka alami, tapioka asam yang difermentasi 10 hari, 30 hari dan 50 hari memiliki kadar lemak yang berkisar antara 1.07-1.45%. Menurut Hasbullah (1985), kadar lemak pada tapioka biasa yaitu 0.25%. Tingginya kadar lemak yang diperoleh pada tapioka asam dikarenakan tidak dilakukannya pemurnian pati dari lemak (defatting) sehingga masih banyak terdapat lemak di dalam pati. Lemak dalam pati tapioka tidak dapat dihilangkan secara seluruhnya. Hal ini mengacu pada Leach (1965) di dalam Goldswoth (1999) yang melaporkan bahwa proses pemurnian pada pembuatan tepung tapioka secara komersial tidak dapat dihilangkan secara keseluruhan substansi lemak maupun proteinnya. 4.3.4.5 Kadar Serat Kasar Serat merupakan bagian yang tidak terpisahkan pada struktur alami tanaman yang terdiri dari beberapa komponen seperti lignin, selulosa, hemiselulosa, substansi pektik, gum, waxes, dan oligosakarida yang tidak tercerna. Hemiselulosa dan substansi pektik yang mampu mengikat air dan mengembang disebut serat larut. Sebagian hemiselulosa, selulosa dan lignin, yang sedikit mengikat air disebut serat tidak larut atau serat kasar (Kalac dan Mika, 1997). Dari hasil ANOVA dan uji lanjut LSD pada Lampiran 5 maka kadar serat kasar pada tapioka alami berbeda signifikan dengan kadar serat pada tapioka asam. Hasil analisis yang menunjukkan bahwa kadar serat pada tapioka asam bernilai sama diduga bahwa sebagian besar serat yang terkandung merupakan serat kasar yang terdiri dari selulosa dengan sedikit lignin dan hemiselulosa. Fermentasi yang dilakukan sampai 50 hari tidak mempengaruhi kadar serat dalam tapioka asam. 4.3.4.6 Karbohidrat by difference Karbohidrat merupakan komponen tertinggi yang terdapat dalam tapioka. Ubi kayu yang merupakan bahan baku dalam pembuatan tapioka merupakan salah satu sumber karbohidrat terbesar selain padi dan jagung. Nilai karbohidrat pada tapioka asam yang diperoleh by difference yaitu 100% dikurangi dengan komponen kimia pada tapioka (kadar air, kadar abu, kadar protein, kadar serat kasar dan kadar lemak). Dari hasil ANOVA dan uji lanjut LSD pada Lampiran 5 diperoleh bahwa pada karbohidrat pada tapioka asam yang telah difermentasi selama 30 hari berbeda signifikan dengan perlakuan lain. Berdasarkan Tabel 8 nilai karbohidrat pada tapioka asam tersebut adalah 81.47%, sedangkan pada tapioka asam dengan perlakuan lain berkisar antara 82.49–86.43%. Rendahnya kandungan karbohidrat pada tapioka asam yang difermentasi selama 30 hari diduga berhubungan dengan jumlah mikroba yang tumbuh pada periode tersebut, yang mana pada fermentasi 30 hari mikroba yang dominan yaitu bakteri asam laktat yang mencapai pertumbuhan eksponensial. Bakteri asam laktat menggunakan pati sebagai substrat untuk diubah menjadi gula sederhana dan kemudian digunakan untuk menghasilkan asam laktat. Pati merupakan salah satu jenis karbohidrat yang tergolong jenis polisakarida. 28 4.3.3 Komponen Mutu Tapioka Asam 4.3.3.1 pH Nilai pH menunjukkan konsentrasi ion hidrogen dalam suatu bahan. Nilai pH di antara lingkungan 0 ke 7 menunjukkan asidik, nilai pH diantara lingkungan 7 ke 14 menunjukkan alkaline dan nilai pH 7 menandakan netral. Dari hasil ANOVA dan uji lanjut LSD pada Lampiran 5 diperoleh bahwa terdapat satu perlakuan yang berbeda signifikan yaitu tapioka asam dengan fermentasi selama 40 hari yang memiliki pH terendah sebesar 3.36. Pada periode tersebut lingkungan fermentasi lebih asam dari perlakuan yang lain. Nilai pH berhubungan dengan jumlah mikroorganisme yang tumbuh. Pada tapioka asam yang difermentasi selama 20 hari, jumlah bakteri asam laktat mencapai fase eksponensial, pada periode yang sama TPC juga mencapai fase eksponensial akan tetapi jumlahnya lebih rendah dari jumlah bakteri asam laktat. Kemudian TPC pada tapioka asam yang difermentasi 40 hari mengalami penurunan. Diduga pada selang periode fermentasi 30 hari sampai 40 hari, kondisi yang terbentuk sangat asam yang dipengaruhi oleh jumlah bakteri asam laktat yang sangat tinggi sehingga pH yang dihasilkan pada tapioka asam yang difermentasi 40 hari sangat rendah. Hal ini juga didukung oleh penurunan TPC yang dimulai pada periode tersebut. Suasana dengan tingkat keasaman yang tinggi membuat sebagian mikroorganisme yang tidak toleran terhadap asam tidak dapat bertahan sehingga mengalami kematian. 4.3.3.2 Total Asam Total asam menunjukkan kadar asam yang terkandung dalam suatu bahan. Prinsip menghitung total asam yang diperoleh dengan metode titrasi adalah banyaknya basa yang dibutuhkan untuk menetralkan kandungan asam pada sampel. Dari hasil ANOVA dan uji lanjut LSD pada Lampiran 5, terdapat perlakuan yang berbeda signifikan yaitu pada tapioka tanpa fermentasi dengan tapioka asam yang difermentasi 10 sampai 50 hari. Nilai total asam mengalami peningkatan hingga difermentasi selama 50 hari. Hal ini dikarenakan selama fermentasi spontan dihasilkan berbagai asam dari aktivitas mikroba yang tumbuh, salah satunya adalah bakteri asam laktat. Bakteri asam laktat dapat menciptakan kondisi lingkungan menjadi asam karena menghasilkan berbagai asam terutama asam laktat. Total asam dan nilai pH akan mempengaruhi mikroorganisme yang tumbuh selama proses fermentasi. Kemudian, total asam pada tapioka asam akan berpengaruh terhadap kerusakan yang terjadi pada bagian amorf pati, sehingga akan berpengaruh terhadap sifat fungsional tapioka asam yang dihasilkan. Total asam yang terus mengalami peningkatan maka akan semakin banyak bagian amorf yang terpotong-potong sehingga akan menghasilkan tapioka asam dengan bagian kristalin yang tinggi. Bagian kristalin yang sangat banyak pada struktur pati akan berpengaruh terhadap sifat fungsional yang dihasilkan seperti turunnya swelling power dan kelarutan pati. Bakteri asam laktat mengubah karbohidrat menjadi asam laktat dalam kondisi anaerob dan proses ini dapat dibagi menjadi tiga tahapan. Pada tahap awal, zat pati dari sumber karbohidrat akan dihidrolisa menjadi maltosa oleh α dan β amilase yang merupakan enzim ekstraseluler pada mikroorganisme, kemudian molekul maltosa ini akan dipecah menjadi glukosa oleh maltase dan pada tahap terakhir bakteri asam laktat akan mengubah glukosa menjadi asam laktat dan sejumlah kecil bahan lain seperti asam asetat, asam propionat dan etanol (Fardiaz, 1988). Proses perubahan glukosa menjadi asam laktat terlebih dahulu mengalami perubahan menjadi asam piruvat melalui jalur glikolisis dengan lintasan Embden-Meyerhof-Parnas (EMP). Proses glikolisis dimulai dengan molekul glukosa dan diakhiri dengan terbentuknya asam piruvat. Proses 29 glikolisis dapat terjadi secara aerob dan anaerob dan dibagi menjadi 4 tahapan. Pada masing-masing tahapan dihasilkan senyawa antara yang berbeda. Pada tahap pertama dimulai dengan penambahan satu gugus fosfat dari ATP ke glukosa sehingga terbentuk glukosa-6-fosfat dengan reaksi fosforilasi. Enzim heksokinase merupakan katalis dalam reaksi tersebut dibantu oleh ion Mg2+ sebagai kofaktor. Reaksi berikutnya ialah isomerasi, yaitu pengubahan glukosa-6-fosfat menjadi fruktosa-6-fosfat, dengan enzim fosfoglukoisomerase. Selanjutnya fruktosa-6-fosfat diubah menjadi fruktosa-1,6difosfat oleh enzim fosfofruktokinase dibantu oleh ion Mg2+ sebagai kofaktor. Dalam reaksi tersebut gugus fosfat dipindahkan dari ATP kepada fruktosa-6-fosfat. Tahap kedua dalam rangkaian reaksi glikolisis adalah penguraian molekul fruktosa-1,6difosfat membentuk dua molekul triosa fosfat, yaitu dihidroksi aseton fosfat dan D-gliseraldehida-3fosfat. Kemudian dilanjutkan dengan reaksi D-gliseraldehida-3-fosfat menjadi asam 1,3difosfogliserat. Pada tahap ketiga terjadi reaksi pengubahan asam 1,3-difosfogliserat menjadi asam 3fosfogliserat. Dalam reaksi ini dihasilkan molekul ATP. Fosfogliseril mutase bekerja sebagai katalis pada reaksi pengubahan asam 3-fosfogliserat menjadi asam 2-fosfogliserat. Enzim ini berfungsi memindahkan gugus fosfat dari suatu atom C kepada atom C lain dalam suatu molekul. Pada tahap keempat terjadi reaksi pembentukan asam fosfofenol piruvat dari asam-2-fosfogliserar dengan katalis enzim enolase dan ion Mg2+ sebagai kofaktor. Tahap akhir yaitu asam piruvat direduksi menggunakan enzim laktat dehidrogenase sehingga terbentuk asam laktat. 4.3.3.3 Bakteri Asam Laktat Bakteri asam laktat adalah kelompok bakteri Gram positif yang tidak membentuk spora dan memfermentasikan karbohidrat untuk menghasilkan asam laktat. Sebagian besar bakteri asam laktat dapat tumbuh sama baiknya di lingkungan yang memiliki dan tidak memiliki oksigen sehingga termasuk anaerob aerotoleran. Hampir semua bakteri asam laktat memperoleh energi dari metabolisme gula sehingga habitat pertumbuhannya hanya terbatas pada lingkungan yang kaya nutrisi, salah satunya adalah tapioka. Tapioka merupakan bahan yang kaya nutrisi untuk pertumbuhan mikroba. Dari hasil ANOVA dan uji lanjut LSD pada Lampiran 5 maka pertumbuhan bakteri asam laktat sangat bervariasi dan berbeda signifikan satu sama lain pada taraf nyata 5%. Jumlah bakteri asam laktat mengalami peningkatan sampai 30 hari fermentasi yaitu mencapai 19.53 x 105 CFU/g. Kemudian fermentasi lanjutan sampai 40 hari diperoleh jumlah bakteri asam laktat yang mengalami penurunan menjadi 10.43 x 105 CFU/g. Jumlah ini tidak berbeda nyata dengan jumlah bakteri asam laktat pada tapioka asam yang difermentasi 20 hari. Pada tapioka asam yang difermentasi 50 hari, jumlah bakteri asam laktat terus mengalami penurunan menjadi 5.01 x 105 CFU/g. Grafik jumlah bakteri asam laktat selama fermentasi dapat dilihat pada Gambar 12. Pada hakekatnya pertumbuhan mikroorganisme mengalami empat fase yaitu fase lag, fase eksponensial, fase stationer dan fase kematian. Keberadaan bakteri asam laktat sudah terdeteksi sebelum proses fermentasi. Pertumbuhan bakteri asam laktat selanjutnya mengalami fase eksponensial hingga 20 hari fermentasi dan fase stasioner terjadi pada rentang waktu 20 hari menuju 30 hari fermentasi. Kemudian fase kematian diduga dimulai pada 30 hari fermentasi hingga 50 hari. Jika dilihat dari fase pertumbuhan bakteri asam laktat tersebut maka umur fermentasi spontan yang paling baik untuk memproduksi tapioka asam yaitu 20 hari saat fase eksponensial tercapai. Lacerda et al., (2005) menyebutkan bahwa ditemukan empat spesies bakteri asam laktat yang berhasil diidentifikasi pada tapioka asam yang berasal dari dua industri di Brazil yaitu Lactobacillus brevis, Lactobacillus fermentum, Lactobacillus perolens dan Lactobacillus Plantarum. 30 Logaritmik jumlah mikroorganisme (CFU/g) 7 6 5 4 BAL 3 TPC 2 Kapang dan Khamir 1 0 0 10 20 30 40 50 60 Lama fermentasi (hari) Gambar 12. Grafik jumlah mikroorganisme pada tapioka asam 4.3.3.4 TPC (Total Plate Count) Total Plate Count (TPC) menunjukkan jumlah mikroba dalam suatu pangan. Dari hasil ANOVA dan uji lanjut LSD pada Lampiran 5 diperoleh perlakuan yang berbeda signifikan pada taraf nyata 5% berdasarkan TPC pada tapioka asam. Tapioka alami memiliki TPC sebesar 0.17 x 104 CFU/g. Kemudian setelah difermentasi terjadi peningkatan TPC pada tapioka asam 10 hari, 20 hari dan 30 hari dengan TPC berturut-turut 3.96 x 104 CFU/g, 18.33 x 104 CFU/g, dan 19.53 x 104 CFU/g. TPC pada tapioka asam yang difermentasi 20 hari dan 30 hari tidak berbeda signifikan. Akan tetapi, setelah difermentasi selama 40 hari sampai 50 hari terjadi penurunan TPC yang berturut-turut yaitu 11.25 x 104 CFU/g dan 9.33 x 104 CFU/g. Kedua nilai tersebut tidak berbeda signifikan pada taraf nyata 5%. Penurunan TPC yang terdapat pada tapioka asam dipengaruhi oleh jumlah bakteri asam laktat yang terus meningkat selama proses fermentasi. Dari grafik pada Gambar 12 terlihat bahwa setelah difermentasi 10 hari jumlah bakteri asam laktat lebih dominan dari TPC sampai fermentasi selama 50 hari. Bakteri asam laktat menghasilkan bakteriosin yang memiliki sifat bakteriostatik. Bakteriosin tersebut mampu menghambat pertumbuhan mikroorganisme yang dimulai setelah 10 hari fermentasi. Seperti yang dijelaskan oleh Buckle (1985) bahwa terdapat 2 sifat bahan-bahan kimia yang dihasilkan oleh mikroba yaitu sifat bakteriostatik dan bakterisidal. Bahan kimia yang bersifat bakteriostatik berfungsi untuk menghambat pertumbuhan bakteri, sedangkan bakterisidal adalah bahan kimia yang berfungsi untuk membunuh bakteri. Selain itu, bakteri asam laktat juga dapat menurunkan pH dan menciptakan suasana menjadi asam sehingga pertumbuhan mikroba-mikroba yang tidak dapat bertahan pada keadaan asam akan terhambat bahkan bisa mengalami kematian. 4.3.3.5 Kapang dan Khamir Selain bakteri asam laktat, juga ditemukan kapang dan khamir pada tapioka asam yang dihasilkan. Kapang dan khamir dapat tumbuh pada pH yang luas yaitu 2.0-8.5, akan tetapi biasanya pertumbuhannya akan baik jika pada kondisi asam dan kadar air rendah. Dari hasil ANOVA dan uji lanjut LSD pada Lampiran 5 diperoleh hasil bahwa terdapat perlakuan yang berbeda signifikan pada taraf nyata 5 % berdasarkan jumlah kapang dan khamir. Pada tapioka sebelum fermentasi tidak ditemukan adanya kapang dan khamir. Kemudian setelah 31 difermentasi selama 10 hari mulai ditemukan adanya kapang dan khamir sebesar 0.10 x 105 CFU/g. Setelah difermentasi 30 hari, jumlah kapang dan khamir meningkat signifikan menjadi 0.27 x 105 CFU/g. Pertumbuhan kapang dan khamir ini terus mengalami peningkatan hingga difermentasi selama 50 hari yaitu mencapai 2.65 x 105 CFU/g. Jumlah kapang dan khamir pada tapioka asam yang difermentasi 30 hari, 40 hari dan 50 hari tidak berbeda signifikan pada taraf nyata 5%. Peningkatan jumlah kapang dan khamir ini disebabkan semakin lama umur fermentasi maka lingkungan yang diciptakan semakin asam sehingga semakin baik untuk pertumbuhan kapang dan khamir. Lacerda et al., (2005) juga menyebutkan bahwa pada tapioka asam yang berasal dari dua industri di Brazil ditemukan dua spesies khamir yaitu Galactomyces geotrichum dan spesies dari Issatchenkia. 4.3.3.6 E.coli E. coli merupakan bakteri berbentuk batang pendek (kokobasil), Gram negatif, dan beberapa galur mempunyai kapsul. Terdapat galur E.coli yang bersifat patogen dan non patogen. E.coli non patogen banyak ditemukan di dalam usus besar manusia sebagai flora normal dan berperan dalam pencernaan pangan dengan menghasilkan vitamin K dari bahan yang belum dicerna dalam usus besar. E.coli yang bersifat patogen dapat menyebabkan kasus diare berat pada semua kelompok usia melalui endotoksin yang dihasilkannya. Selain itu, E.coli juga dapat menyebabkan infeksi saluran urin dan juga penyakit lain seperti pneumonia, meningitis dan traveler’s diarrhea. Meskipun infeksi E.coli dapat diobati dengan antibiotika, namun dapat menyebabkan penderita mengarah pada kematian karena toksin yang dihasilkan lebih banyak pada saat bakteri mati. Oleh sebab itu, keberadaan E.coli patogen dalam bahan pangan dapat menyebabkan keracunan bagi manusia sebagai konsumen. Berdasarkan hasil analisis E.coli pada tapioka asam yang dihasilkan tidak terdeteksi. Artinya tapioka asam yang diperoleh aman untuk diolah menjadi makanan untuk dikonsumsi. Selain itu, proses pengolahan, peralatan maupun air yang digunakan dalam pembuatan tapioka asam tergolong baik. Disamping itu, pertumbuhan E.coli juga dapat ditekan dengan adanya bakteri asam laktat dan bakteriosin yang dihasilkannya. Hal ini sesuai dengan penjelasan Karthikeyan dan Santosh (2009) yang mengatakan bahwa bakteri asam laktat mampu menurunkan pH makanan, sehingga pada pH rendah pertumbuhan sebagian besar mikroorganisme yang terdapat di dalam makanan termasuk bakteri patogen dapat terhambat. Bakteri asam laktat juga menghasilkan antibiotik yang sering disebut sebagai bakteriosin, sehingga dapat menghambat pertumbuhan bakteri pembusuk (Fardiaz, 1988). 4.3.4 Sifat Fungsional Tapioka Asam 4.3.4.1 Kejernihan pasta 1% Kejernihan pasta 1% terkait dengan sifat dispersi dan retrogradasi. Balagopalan et al. (1988) menyatakan bahwa pati alami yang memiliki swelling power tinggi dan kecenderungan retrogradasinya rendah memiliki kejernihan pasta 1% yang lebih tinggi. Metode yang digunakan untuk mengukur kejernihan pasta 1% pati ialah menggunakan transmisi cahaya dengan alat spektrofofometer. Transmisi cahaya dapat digunakan untuk mengukur secara langsung pengembangan granula pati. Pengamatan visual kejernihan pasta 1% bagaimanapun juga terkait dengan refleksi cahaya dari pasta yang mencerminkan perbedaan homogenitas diantara granula-granula pati yang berkaitan dengan keseragamannya dalam pelarutan (Balagopalan et al., 1988) Dari hasil ANOVA dan uji lanjut LSD pada Lampiran 5 diperoleh bahwa pada tapioka alami berbeda secara signifikan pada taraf nyata 5% dengan perlakuan yang lain dengan kejernihan 45.97%. 32 Kemudian tapioka asam yang dihasilkan dengan fermentasi selama 10 hari sampai 50 hari diperoleh nilai kejernihan yang tidak berbeda signifikan. Nilai kejernihan pasta 1% pada tapioka asam lebih tinggi dibandingkan dengan tapioka alami. Granula pati terdiri dari dua fraksi yaitu fraksi kristalin dan fraksi amorf. Fraksi kristalin sulit larut dalam air, sedangkan fraksi amorf mudah larut dalam air. Selama proses fermentasi, fraksi amorf pada granula tapioka asam terpotong sehingga semakin banyak bagian yang dapat larut dalam air. Dengan demikian, kejernihan pasta akan semakin tinggi. Balagopalan et al., (1988) menyatakan bahwa suspensi pati alami dalam air dapat berwarna buram (opaque), namun proses gelatinisasi pada granula pati dapat meningkatkan transparansi larutan tersebut. Semakin tinggi nilai persen transmitten, maka semakin transparan suspensi yang dihasilkan. Kejernihan pasta 1% sangat bergantung dari sifat dispersi dan sifat retrogradasi bahan. Tapioka asam yang memiliki kejernihan pasta 1% yang tinggi menghasilkan pasta pati yang lebih bening atau transparan, sehingga jika digunakan sebagai bahan baku akan menghasilkan produk dengan warna yang jernih atau transparan. 4.3.4.2 Kelarutan dan Swelling Power pada suhu 70°C Swelling power didefinisikan sebagai pertambahan volume dan berat maksimum yang dialami pati dalam air (Balagopalan et al.,1988). Swelling power dan kelarutan terjadi karena adanya ikatan non-kovalen antara molekul-molekul pati. Bila pati dimasukkan ke dalam air dingin, granula pati akan menyerap air dan membengkak. Namun demikian, jumlah air yang terserap dan pembengkakannya terbatas hanya mencapai 30% (Winarno, 2002). Ketika dipanaskan dalam air, granula pati mulai mengembang (swelling). Swelling terjadi pada daerah amorf granula pati. Ikatan hidrogen yang lemah antar molekul pati pada daerah amorf akan terputus saat pemanasan, sehingga terjadi hidrasi air oleh granula pati. Granula pati akan terus mengembang, sehingga viskositas meningkat hingga volume hidrasi maksimum yang dapat dicapai oleh granula pati (Swinkels, 1985). Faktor-faktor seperti rasio amilosa-amilopektin, distribusi berat molekul dan panjang rantai, serta derajat percabangan dan konformasinya menentukan swelling power dan kelarutan (Moorthy, 2004). Swelling merupakan sifat yang dipengaruhi oleh amilopektin (Li dan Yeh, 2001). Proporsi yang tinggi pada rantai cabang amilopektin memiliki kontribusi dalam peningkatan nilai swelling. Selain itu, terdapat korelasi yang negatif antara swelling power dengan kadar amilosa, swelling power menurun seiring dengan peningkatan kadar amilosa (Sasaki dan Matsuki, 1998 dalam Li dan Yeh, 2001). Amilosa dapat membentuk kompleks dengan lipida pada pati sehingga dapat menghambat swelling (Charles et al., 2005). Pengukuran swelling power dapat dilakukan dengan membuat suspensi pati dalam botol sentrifusa lalu dipanaskan selama 30 menit pada suhu yang telah ditentukan. Kemudian bagian yang cair (supernatan) dipisahkan dari endapan. Swelling power diukur sebagai berat pati yang mengembang (endapan) per berat pati kering. Tepung tapioka memiliki swelling power yang besar (Balagopalan et al., 1988). Ketika pati dipanaskan dalam air, sebagian molekul amilosa akan keluar dari granula pati dan larut dalam air. Persentase pati yang larut dalam air ini dapat diukur dengan mengeringkan supernatan yang dihasilkan saat pengukuran swelling power. Menurut Fleche (1985), ketika molekul pati sudah benar-benar terhidrasi, molekul-molekulnya mulai menyebar ke media yang ada di luarnya dan yang pertama keluar adalah molekul-molekul amilosa yang memiliki rantai pendek. Semakin tinggi suhu maka semakin banyak molekul pati yang akan keluar dari granula pati. Selama pemanasan akan terjadi pemecahan granula pati, sehingga pati dengan kadar amilosa lebih tinggi, granulanya akan lebih banyak mengeluarkan amilosa. 33 Dari hasil ANOVA dan uji lanjut LSD pada Lampiran 5 maka diperoleh bahwa kelarutan pada tapioka alami berbeda signifikan dengan perlakuan lain pada taraf nyata 5%. Nilai kelarutan pada perlakuan tersebut yaitu 21.18%. Pada tapioka asam yang dihasilkan dengan fermentasi 10 hari sampai 50 hari tidak berbeda signifikan pada taraf nyata 5%. Namun, kelarutan pada tapioka asam mengalami peningkatan dari tapioka alami. Tingginya nilai kelarutan menunjukkan semakin banyaknya pati yang terlarut dalam air. Selama proses fermentasi terjadi pengembangan granula sehingga ketika tapioka asam dipanaskan maka terjadi proses gelatinisasi yang semakin cepat yang menyebabkan banyak granula yang pecah. Pecahnya granula pati menyebabkan semakin banyaknya molekul pati yang keluar sehingga semakin banyak molekul pati yang larut dalam air dan menyebabkan kelarutan meningkat. Dari hasil ANOVA dan uji lanjut LSD pada Lampiran 5 diperoleh bahwa nilai swelling power tapioka alami dan tapioka asam yang dihasilkan pada fermentasi 20 hari berbeda signifikan pada taraf 5% dibandingkan dengan perlakuan lain. Tapioka alami memiliki swelling power yang paling rendah yaitu 0.45%. Swelling power pada tapioka asam juga mengalami peningkatan jika dibandingkan dengan tapioka alami. Nilai swelling power tertinggi juga terdapat pada tapioka asam yang telah difermentasi selama 20 hari sebesar 1,71% dan berbeda nyata dibandingkan dengan tapioka asam lainnya. Swelling power yang tinggi berarti semakin tinggi pula kemampuan pati mengembang dalam air. Pada proses fermentasi fraksi amorf yang terdapat pada amilopektin akan terpotong sehingga akan terjadi hidrasi air dengan mudah saat pemanasan. Hal ini menyebabkan granula pati akan semakin mudah mengembang sehingga nilai swelling power akan meningkat. Perubahan nilai swelling power bergantung dari banyaknya fraksi amorf yang terpotong selama fermentasi. Nilai swelling power perlu diketahui untuk memperkirakan ukuran dan volume wadah yang digunakan dalam proses produksi sehingga ketika tapioka asam mengalami swelling maka wadah tersebut masih bisa menampung tapioka tersebut. Pengembangan granula pati (swelling) yang tinggi pada pati sangat diinginkan pada produk pati termodifikasi karena dapat menurunkan nilai viskositas. Hal ini berkaitan dengan aplikasi pati dalam industri, khususnya industri makanan. Viskositas yang rendah akan menghasilkan produk dengan tekstur yang lebih baik seperti kekenyalannya meningkat dan permukaannya lebih lembut. Disamping itu, kelarutan yang tinggi, juga sangat penting untuk mencapai homogenitas pasta pati ketika diproses. Dilihat dari data yang diperoleh, kelarutan dan swelling power tertinggi pada tapioka asam dicapai pada fermentasi 20 hari. Nilai tersebut dipengaruhi oleh jumlah bagian amorf yang mengalami kerusakan oleh asam laktat. Pada umur fermentasi 20 hari diduga jumlah optimal bagian amorf yang terpotong-potong untuk menghasilkan nilai kelarutan dan swelling power yang tinggi. Umur fermentasi yang semakin lama akan menghasilkan tapioka asam yang didominasi oleh bagian kristalin yang sulit larut dan kaku karena semakin banyaknya jumlah amorf yang terpotong-potong. Tapioka asam hanya terdapat bagian kristalin saja akan menghasilkan granula yang sulit mengembang dan larut dalam air. 4.3.4.3 Sifat Amilografi Pola gelatinisasi tapioka asam dipelajari dengan mengukur sifat-sifat amilografi sampel dengan menggunakan alat Rapid Visco Analyzer (RVA). Pengamatan dilakukan terhadap suhu gelatinisasi, viskositas maksimum, viskositas minimum, suhu saat viskositas maksimum, stabilitas pasta (breakdown), viskositas balik (setback) dan stabilitas pendinginan. Suhu gelatinisasi merupakan batasan suhu yang mengakibatkan hampir seluruh pati mencapai pembengkakan maksimal dan pembengkakan tersebut bersifat irreversibel (tidak dapat kembali seperti semula). Mekanisme gelatinisasi dapat dibagi menjadi 3 tahap. Tahap awal, air secara 34 perlahan-lahan bolak balik berimbibisi ke dalam granula, selanjutnya tahap kedua yaitu pada suhu 60°C sampai 85°C granula akan mengembang dengan cepat dan polimer yang lebih pendek akan larut, sehingga pati kehilangan sifat birefringence-nya. Pada tahap ketiga, jika suhu tetap naik maka molekul-molekul pati akan berdifusi keluar granula (Fennema, 1996). Hasil pengukuran sifat amilografi tapioka asam disajikan pada Tabel 9, sedangkan pola amilografi tapioka asam dapat dilihat pada Gambar 13. Tabel 9. Sifat amilografi dengan RVA (Rapid Visco Analyzer) Fermentasi Pasting o Viskositas Breakdown Setback Final hari ke- temperature ( C) maksimum (cP) viscosity (cP) viscosity (cP) viscosity (cP) 0 67.65 6278 4077 977 3178 10 67.65 6442 4617 449 2274 20 67.65 6237 4476 533 2294 30 67.65 6035 4124 576 2487 40 67.65 6311 4590 500 2221 50 67.65 6094 4321 570 2343 Menurut Leach (1965) di dalam Goldsworth (1999), yang dimaksud dengan suhu awal gelatinisasi adalah suhu pada saat pertama kali viskositas mulai naik. Peningkatan viskositas ini disebabkan karena terjadinya pembengkakan granula pati yang irreversibel di dalam air, dimana energi kinetik molekul-molekul air lebih kuat daripada daya tarik menarik pati di dalam granula pati. Juliano dan Kongseree (1968), mengemukakan bahwa tidak ada hubungan nyata antara gelatinisasi dengan ukuran granula patinya. Tetapi suhu gelatinisasi mempunyai hubungan dengan kekompakan granula dan amilopektin berdasarkan derajat polimerisasinya. Gelatinisasi merupakan proses pembengkakan granula diikuti berubahnya struktur granula dan hilangnya sifat kristalin. Sebelum granula berubah, beberapa bahan (terutama amilosa) mulai terpisah dari granula. Perubahan morfologis granula pati selama pengembangan tergantung pada sifat alami pati itu sendiri. Setiap granula pati tidak selalu mengembang pada suhu yang sama, melainkan akan mengembang pada kisaran suhu yang biasanya sebesar 10°C. Selain karakteristik granula, terdapatnya komponen seperti protein, lemak dan gula pada pati juga mempengaruhi suhu awal gelatinisasi. Menurut Glicksman (1969) bahwa lemak mampu berperan sebagai pengkompleks amilosa dengan membentuk endapan yang tidak larut sehingga akan menghambat pengeluaran amilosa dari granula. Dengan demikian diperlukan energi yang besar untuk melepaskan amilosa sehingga suhu awal gelatinisasi menjadi lebih tinggi. Keberadaan gula pada pemanasan pati akan menghambat gelatinisasi karena terhambatnya pembengkakan granula pati oleh gula reduksi yang bersifat hidrofilik, sehingga semakin banyak jumlah pati dibanding gula akan semakin cepat terjadinya gelatinisasi yang akan menurunkan suhu awal gelatinisasi. Pada aplikasi pembuatan produk pangan, untuk menghindari suhu gelatinisasi yang terlalu tinggi karena adanya gula, maka penambahan gula dilakukan setelah terjadinya gelatinisasi. 35 Gambar 13. Pola Rapid Visco Amilograph pada tapioka asam 36 36 Selama penyimpanan, adonan menjadi keruh dan biasanya terbentuk endapan yang tidak larut. Hal ini disebabkan oleh rekristalinisasi molekul pati. pada awalnya amilosa membentuk rantai double helix yang diikuti pengumpulan helix-helix. Fenomena ini disebut retrogradasi. Retrogradasi adalah proses yang terjadi ketika molekul-molekul pati tergelatinisasi mulai bergabung kembali membentuk suatu struktur yang merupakan proses larutnya rantai linier polisakarida dan mengurangi kelarutan molekul. Fenomena retrogradasi merupakan hasil ikatan hidrogen antara molekul pati yang mempunyai gugus hidroksil dan sisi penerima hidrogen. Pada tahap awal, dua atau lebih rantai molekul pati membentuk ikatan sederhana yang dapat berkembang lebih luas pada suatu bagian secara teratur yang akhirnya membentuk daerah kristalin (Srichuwong, 2006). Srichuwong (2006) juga menggambarkan perubahan granula pati pada proses gelatinisasi dan retrogradasi seperti pada Gambar 14. Pati mengalami pengembangan dengan peningkatan suhu. mekanisme pengembangan tersebut disebabkan oleh melemahnya ikatan hidrogen yang menghubungkan molekul amilosa dan amilopektin sehingga mengganggu kekompakan granula pati. Saat pemanasan diteruskan, sebagian amilosa keluar. Setelah pengembangan maksimum dan pemanasan dilanjutkan, granula akan pecah. Pada saat pendinginan akan terjadi penggabungan kembali rantai linier pati. Gambar 14. Perubahan granula pati selama proses gelatinisasi dan retrogradasi (Srichuwong, 2006). Berdasarkan pola amilografi suhu awal gelatinisasi untuk tapioka asam dan tapioka alami yang dihasilkan sama yaitu 67.65°C. Hal ini berarti bahwa proses fermentasi spontan yang dilakukan untuk menghasilkan tapioka asam tidak berpengaruh terhadap suhu awal gelatinisasi pati yang dihasilkan dan didukung oleh hasil komponen kimia seperti lemak dan serat yang tidak berbeda signifikan dengan tapioka alami. Meskipun protein tapioka asam lebih tinggi dari tapioka alami serta meningkatnya gula yang diproduksi selama fermentasi oleh mikroorganisme yang tumbuh juga tidak mempengaruhi suhu awal gelatinisasi antara tapioka alami dan tapioka asam. Hal ini dikarenakan pada sebagian amorf tapioka asam telah terpotong-potong sehingga meningkatnya protein dan gula pada tapioka asam tidak dapat mempengaruhi suhu awal gelatinisasi. Suhu dimana viskositas maksimum tercapai disebut suhu akhir gelatinisasi. Pada suhu ini granula pati kehilangan sifat birefringence-nya dan granula sudah tidak mempunyai sifat kristal lagi (Leach et al., 1959). Viskositas maksimum merupakan titik puncak viskositas adonan pada proses pemanasan yang merupakan indikator kemudahan jika dimasak dan juga menunjukkan kekuatan adonan yang terbentuk dari gelatinisasi selama pengolahan dalam aplikasi makanan. Pola amilografi yang terbentuk pada masing-masing tapioka asam yang dihasilkan terlihat bahwa kurva saat tercapainya viskositas 37 maksimum hampir sama. Berdasarkan Tabel 9, viskositas maksimum pada tapioka asam hampir sama dengan tapioka alami yang berkisar antara 6035-6442 cP. Viskositas maksimum menggambarkan fragilitas dari granula pati yang mengembang, yaitu mulai saat pertama kali mengembang sampai granula tersebut pecah selama pengadukan terus menerus. Nilai viskositas maksimum perlu diketahui untuk penggunaan pati dalam reaktor di industri. Hal ini berkaitan dengan penggunaan daya atau energi yang digunakan untuk proses pengadukan pati tersebut didalam reaktor. Jika proses pemanasan dilanjutkan pada suhu yang lebih tinggi, granula pati akan pecah dan mengalami fragmentasi serta mengeluarkan molekul-molekul pati. Keadaan tersebut menyebabkan viskositas suspensi turun. Penurunan tersebut terlihat pada pola amilografi tapioka asam hingga mencapai viskositas minimum. Nilai penurunan viskositas yang terjadi dari viskositas yang terjadi dari viskositas maksimum menuju viskositas minimum disebut dengan breakdown viscosity. Dari hasil diperoleh, nilai breakdown viscosity tapioka asam (4124-4617 cP) lebih tinggi dari tapioka alami (4077 cP). Wurzburg (1968) melaporkan bahwa jika selama pemanasan terjadi pemecahan granula maka amilosa yang keluar semakin banyak sehingga kerenderungan untuk terjadinya retrogradasi meningkat. Kenaikan viskositas akan terjadi pada tahap pendinginan disebabkan oleh terjadinya retrogradasi yaitu bergabungnya rantai molekul amilosa yang berdekatan melalui ikatan hidrogen intermolekuler (Swinkels, 1985 di dalam Roels dan Beynum, 1985). Pada bagian akhir pola amilografi pada Gambar 12 memperlihatkan bentuk yang berbeda antara tapioka alami (0 hari fermentasi) dengan tapioka asam. Perbedaan tersebut akan menghasilkan nilai setback viscosity dan final viscosity yang berbeda pula. Nilai kenaikan viskositas ketika pati didinginkan disebut dengan setback viscosity, sedangkan final viscosity yaitu viskositas ketika pati mencapai suhu akhir. Nilai setback viscosity dan final viscosity tapioka asam lebih rendah dari tapioka alami. Nilai setback viscosity tapioka asam berkisar antara 449-576 cP, sedangkan pada tapioka alami memiliki nilai sebesar 977 cP. Kemudian final viscosity pada tapioka asam berkisar antara 2221-2487 cP, sedangkan pada tapioka alami sebesar 3178 cP. Proses fermentasi secara spontan diduga tidak mempengaruhi suhu awal fermentasi pada tapioka asam yang dihasilkan. Akan tetapi, proses fermentasi tersebut dapat meningkatkan breakdown viscosity dan menurunkan setback viscosity serta final viscosity pada tapioka asam yang dihasilkan. Pada aplikasi di industri, viskositas yang diharapkan adalah pada final viscosity. Nilai final viscosity yang lebih rendah pada tapioka asam akan memberikan tekstur yang lebih baik pada produk olahan yang dihasilkan. Misalnya, aplikasi tapioka asam yang umumnya pada industri makanan terutama produk bakery akan menghasilkan roti ataupun cookies yang memiliki tekstur lebih lembut sehingga dapat menjadi salah satu daya tarik konsumen. Karakterisasi sifat amilografi diperlukan untuk beberapa tujuan diantaranya adalah identifikasi perubahan respon amilografi akibat perbedaan variabel bahan atau proses, pendugaan sifat pati dan tepung selama pengolahan dan identifikasi data awal untuk keperluan set up peralatan pengolahan pati dan tepung. 4.3.4.4 Expanding Capability Expanding capability merupakan kemampuan pati dalam meningkatkan volume adonan. Expanding capability dihitung dengan baking test yang mana tapioka asam dibentuk menjadi adonan dan dipanggang dalam oven pada suhu pemanggangan roti yang berkisar antara 180°-200°C. Pertambahan volume setelah pemanggangan dinyatakan dalam spesifik volume (ml/g). Pada Lampiran 7 dapat dilihat perbedaaan expanding capability pada adonan tapioka asam setelah pemanggangan. Berdasarkan hasil diperoleh bahwa nilai expanding capability pada tapioka asam mengalami peningkatan selama proses fermentasi yaitu mulai dari 1.15 sampai 1.28 ml/g. Akan tetapi, dari hasil 38 ANOVA peningkatan tersebut tidak berbeda secara signifikan pada taraf nyata 5%. Hal ini disebabkan peningkatan yang terjadi sangat kecil. Peningkatan nilai expanding capability ini disebabkan karena adanya kandungan asam laktat yang terus meningkat pada tapioka asam yang dihasilkan selama proses fermentasi. Asam tersebut akan merusak bagian amilosa dan amilopektin pada tapioka asam terutama pada bagian amorf. Sifat amilosa pada tapioka asam sangat berpengaruh terhadap sifat baking. Amilosa cenderung membentuk ikatan hidrogen intramolekular sehingga memiliki kecendrungan yang tinggi untuk terkristalisasi (retrogradasi). Disamping itu juga memiliki kemampuan membentuk heliks dan kompleks. Sistem pengeringan yang dilakukan pada tapioka asam sangat mempengaruhi nilai expanding capability yang dihasilkan. Pengeringan yang dilakukan pada penelitian ini adalah dengan sinar matahari dan memberikan hasil expanding capability yang lebih tinggi dibandingkan tapioka alami. Vatanasuchart et al., (2005) melakukan riset mengenai pengaruh pengeringan terhadap baking expansion tapioka asam. perlakuan pengeringan yang dilakukan adalah menggunakan tiga UV dengan panjang gelombang 280-420 nm (UVBA), 310-330 nm (UVB), 254 nm (UVC) dan hasilnya dibandingkan dengan pengeringan menggunakan oven pada suhu 40°C dan tapioka alami. Hasil yang diperoleh adalah tapioka asam yang dikeringkan dengan UVB memberikan nilai baking expansion yang paling efektif yang mencapai 12.23 cm3/g dibandingkan dengan panjang gelombang UV yang lain maupun oven dan tapioka alami (Vatanasuchart et al., 2005). Penurunan molekul amilosa dan amilopektin pada tapioka asam diiradiasi oleh UVB sehingga menyebabkan depolimerisasi parsial pada fragment linier dan struktur amorf pada adonan selama dipanggang (Vatanasuchart et al., 2005). Kemudian Bertolini et al., (2001) juga menjelaskan bahwa expanding capability pada tapioka asam selama pemanggangan dikaitkan dengan peningkatan tekanan pada adonan karena hidrasi air pada granula pati dan nilai viskositas yang rendah karena terjadinya depolimerisasi pada pati. Pembengkakan granula pati menyebabkan ukuran matriks sel pati akan berkurang. Adonan yang dibentuk dari tapioka asam memiliki viskositas yang rendah sehingga akan mengembang lebih cepat. Ikatan hidrogen yang semakin lemah pada proses pemanggangan menyebabkan struktur amorf akan semakin banyak terputus dan terjadi hidrasi air yang tinggi pada granula pati. Pengembangan granula pati yang semakin tinggi menyebabkan expanding capability pada adonan akan semakin tinggi. Nilai expanding capability tapioka asam yang dihasilkan pada penelitian ini yang masih kecil dibandingkan dengan nilai dari pustaka yang ada diduga disebabkan oleh panjang gelombang yang tidak seragam yang terdapat pada sinar matahari (UV). Hal ini mempengaruhi depolimerisasi parsial yang terjadi pada struktur amilosa dan amilopektin pati saat dipanggang. Walaupun demikian, terjadinya peningkatan nilai expanding capability tapioka asam dibandingkan dengan tapioka alami memberikan keunggulan pada produk tersebut. Tapioka asam dapat disebut produk organik karena pada saat pengolahan untuk produk makanan terutama bakery, tidak perlu bahan tambahan pangan untuk menghasilkan produk dengan kapasitas pengembangan yang tinggi sehingga lebih sehat untuk dikonsumsi. Selain itu, keunggulan produk tapioka asam yang lainnya adalah dapat meningkatkan keamanan pangan dengan menurunnya jumlah bakteri patogen oleh meningkatnya jumlah bakteri asam laktat. 39 V. PENUTUP 5.1 Kesimpulan Fermentasi spontan pada tapioka dapat menekan pertumbuhan bakteri patogen yang terdapat pada tapioka asam yang dihasilkan. Bakteri asam laktat mendominasi pertumbuhan mikroorganisme selama fermentasi berlangsung dan dapat menurunkan nilai pH dan meningkatkan total asam pada tapioka asam. Suasana fermentasi yang semakin asam membuat pertumbuhan mikroba lainnya menjadi terhambat. Selain itu juga ditemukan adanya pertumbuhan kapang dan khamir yang mulai terlihat pada umur fermentasi 10 hari dan jumlahnya terus mengalami peningkatan seiring dengan semakin lamanya proses fermentasi dilakukan. Secara umum, fermentasi spontan yang dilakukan pada tapioka asam tidak merubah komponen kimia seperti kadar abu, kadar serat kasar, dan kadar lemak pada tapioka asam yang dihasilkan. Namun terjadi peningkatan pada kadar protein (0.44-0.49% bk) dibandingkan tapioka alami (0.19% bk). Selain itu, sifat fungsional tapioka asam yang dihasilkan juga berbeda dengan tapioka alami. Sifat fungsional seperti kejernihan pasta 1% (51.13-61.88%T), kelarutan (33.88-50.56%) dan swelling power pada suhu 70°C (0.85-1.71%) lebih tinggi dari tapioka alami (45.97%T), (21.18%), dan (0.45%). Kemudian, expanding capability pada tapioka asam (1.18-1.28 ml/g) juga lebih tinggi dibandingkan dengan tapioka alami (1.15 ml/g). Expanding capability pada tapioka asam mengalami peningkatan karena total asam yang semakin tinggi seiring semakin lamanya proses fermentasi sehingga tapioka asam memiliki kapasitas pengembangan yang baik saat dipanggang. Pada sifat amilografi diperoleh bahwa suhu awal gelatinisasi tidak berubah (67.65°C) sedangkan breakdown viscosity lebih tinggi (4124-4617 cP) dibandingkan tapioka alami (4077cP). Namun, setback viscosity (449-576 cP) dan final viscosity (2221-2487 cP) pada tapioka asam lebih rendah dari tapioka alami (977 cP), dan (3178 cP). Viskositas maksimum pada tapioka asam hampir sama dengan tapioka alami (6035-6442 cP). 5.2 Saran Penggunaan starter bakteri asam laktat untuk produksi tapioka asam diharapkan dapat menghasilkan mutu produk yang seragam dengan kondisi fermentasi yang dapat terkendali jika dibandingkan dengan fermentasi spontan. Selain itu juga diharapkan dapat menghasilkan tapioka asam dengan kandungan asam laktat yang lebih tinggi sehingga nilai expanding capability produk dapat lebih ditingkatkan. Disamping itu, penambahan starter bakteri asam laktat ini juga diharapkan dapat memperpendek waktu fermentasi sehingga tapioka asam yang dihasilkan dapat lebih cepat. 40 DAFTAR PUSTAKA Anonim. 2012. Singkong. http://id.wikipedia.org/wiki/Singkong [15 September 2012] AOAC. 1995. Official Methods of Analysis of The Association of Analytical Chemist. Washington, DC. Ampe F, Sircent A, Zakhia N. 2001. Dynamics of the microbial community responsible for traditional sour cassava starch fermentation studied by denaturing gradient gel electrophoresis and quantitative rRNA hydridization. Int J Food Microbiol 65: 45-54 [CIAT] International Center of Tropical Agriculture. 2009. Postharvest deterioration of the roots. http://www.ciat.cgiar.org. [27 Desember 2011] [BSN] Badan Standarisasi Nasional. Standar Nasional Indonesia 3451:2011 Tapioka. Jakarta: BSN. Balagopalan, Padmaja CG, Nanda SK, Moorthy SN. 1988. Cassava in Food, Feed, and Industry. Boca Raton Florida : CRC Pr. Ben Omar N, Ampe F, Raimbault M, Guyot JP, Tailliez P. 2000. Moleculer diversity of lactic acid bacteria from cassava sour starch (Colombia). Syst Appl Microb 23: 285-291. Bertolini AC, Mestres C, Lourdin D, Della VG, Colonna P. 2001. Relationship between thermomechanical properties and baking expansion of sour cassava starch (polvilho azedo). J Sci Food Agric 81: 429–435. Beynum GMAV, Roels JA. 1985. Carbohydrates: Starch Convertion Technology. New York : Marcel Dekker. Buckle KA, Edwards RA, Fleet GH, Wootton M. 1985. Ilmu Pangan. Terjemahan: Purnomo H dan Adiono. Jakarta : Universitas Indonesia. Cardenas OS, de Buckle TS. 1980. Sour cassava starch production : a preliminary study. J Food Sci 45: 1509-1512 Charles AL, Chang YH, Ko WC, Sriroth K, Huang TC. 2005. Influence of amylopectin structure and amylose content on gelling properties of five cultivars of cassava starches. J Agric Food Chem 53: 2717-2725. Demiate IM, Dupuy N, Huvene JP, Cereda MP, Wosiacki G. 2000. Relationship between baking behavior of modified cassava straches and starch chemical structure determinated by FTIR spectroscopy. Carbohyd Polym 42: 149-158. Departemen Kesehatan. 1990. Komposisi Zat Gizi Pangan Indonesia. Departeman Kesehatan RI: Direktorat Bina Gizi Masyarakat dan Pusat Penelitian dan Pengembangan Gizi. Ekanayake IJ, Osiru DSO, Porto MCM. 1997. Morphology http://www.iita.org/cms/details/trnmat/ir961.html. [16 September 2012] of cassava. Fardiaz S. 1988. Fisiologi Fermentasi. Bogor: Pusat Antar Universitas-Lembaga Sumberdaya Informasi, Institut Pertanian Bogor. Fennema OR. 1996. Food Chemistry. Third Edition. New York: Marcel Dekker. Figueroa C, Davila AM, Pourquie J. 1995. Lactic acid bacteria of the sour cassava starch fermentation. Lett Appl Microbiol 21: 126-130. 41 Flach M. 1993. Problems and prospects of sago palm development. Sago Palm 1: 8-17. Fleche G. 1985. Chemical modification and degradation of starch. In: Beynum GMAV, Roels JA (ed). Starch Conversion Technology. New York: Marcel Dekker. Gibson G, Angus F. 2000. Prebiotics and Probiotics. England: Leatherhead. Glicksman M. 1969. Gum Technology in Food Industry. London: Academic Pr. Grace MR. 1977. Cassava Processing. Roma: FAO. Hamid H. 2012. Pangan dan zat gizi. http://zaifbio.wordpress.com/ [16 September 2012] Hart H. 1990. Kimia organik. Suatu Kuliah Singkat. Terjemahan: Ahmadi S. Jakarta : Erlangga. Hizukuri S, Kaneko T, Takeda Y. 1983. Measurement of the chain length of amylopectin and its relevance to the origin or crystallin polymorphism of starch granules. Biochem et Biophys Acta 760: 188-191 Hounhouigan DJ, Nout MJR, Nago CM, Houben JH, Rombouts FM. 1993. Composition of microbial and physical attibutes of mawe, a fermented maize dough from benin. Int J Food Sci Technol 28: 513-517. Julliano BO, Kongseree. 1968. Physicochemical properties of rice grain and starch from line differing in amilosa content and gelatinization temperature. J Agric Food Chem 20: 714-717. Karthikeyan V, Santosh SW. 2009. Isolation and partial characterization of bacteriocin produced from Lactobacillus plantarum. J Microbiol 5: 233-239. Lacerda ICA, Miranda RL , Borelli BM, Nunes AC, Nardi RMD, Lachance MA, Rosa CA. 2005. Lactic acid bacteria and yeasts associated with spontaneous fermentations during the production of sour cassava starch in brazil. Int J Food Microbiol 105: 213-219. Leach HW, Mc Cowen LD, Schooh TJ. 1959. Structure of the starch granule, swelling and solubility patterns of various starch. J Cereal Chem 36: 534. Leach HW. 1965. Gelatinization of starch. In: Goldworth R (ed). Abundant of Plant Varieties. New York: World Wide. Li JY, Yeh AI. 2001. Relationship between thermal, rheological characteristics, and swelling power for various starches. J Food Eng 50: 141-148. Liu Q. 2005. Understanding starches and their role in foods. In: Cui SW (ed). Food Carbohydrates: Chemistry, Physical Properties and Applications. Francis: CRC Pr. Mastani. 2009. Budidaya singkong (Manihot esculenta). http://pertanian.blogdetik.com/ [16 September 2012] Meyer LG. 1982. Food Chemistry. Westport : AVI. Moorthy SN. 2004. Tropical sources of starch. In: Ann CE (ed). Starch in Food: Structure, Function, and Application. Florida: CRC Pr. Onyango C, Bley T, Raddatz H, Henle T. 2004. Flavour compounds in backslop fermented uji (an east african sour porridge). Eur Food Res Technol 218: 579-583. Purwadario HK. 1989. Teknologi Penanganan Pasca Panen Umbi Kayu. Deptan Bogor : FAO. 42 Radley JA. 1976. Starch Production Technology. London: Applied Science. Rahayu WP, Ma’oen S, Suliantari, Fardiaz S. 1992. Teknologi Fermentasi Produk Perikanan. Bogor: Pusat Antar Universitas Pangan dan Gizi, Institut Pertanian Bogor. Rukmana RH. 1997. Ubi Kayu, Budidaya, dan Pasca Panen. Jakarta: Kanisius. Sahlin P. 1999. Fermentation as a method of food processing production of organis acids , pHdevelopment and microbila growth in fermenting cereals. [tesis]. Lund: Lund Institute of Technology, Lund University. Sasaki T, Matsuki J. 1998. Effect of wheat starch structure on swelling power. In: Li JY, Yeh AI (ed). 2001. Relationship between thermal, rheological characteristics, and swelling power for various starches. J Food Eng 50: 141-148. Satin M. 2007. Functional Properties of Starches. Agroindustry and Post Harvest Management Service. Srichuwong S. 2006. Starches from different plant origins from structure to physicochemical properties [disertasi]. Japan: Mie University. Steinkraus KH. 2002. Fermentations in world food processing. Compre Rev Food Sci Food Safety 1: 23-32. Subagio A. 2006. Ubi kayu subsitusi berbagai tepung-tepungan. Food Rev 1(3): 18-21. Sunarti TC, Hayati A, Richana N. 2005. Production of maltodextrin from minor roots and tubers starches. Jakarta : 10th Asean Food Conference, 8 Agustus 2005. Swinkles JJM. 1985. Sources of starch, its chemistry and physics. In: Roels JA, Beynum GMAV (ed). Starch Conversion Technology. New York: Marcel Dekker. Taggart P. 2004. Starch as an ingredients : manufacture and applications. In: Ann CE (ed). Starch in Food : Structure, Function, and Application. Florida: CRC Pr. Vatanasuchart N, Naivikul O, Charoenrein S, Sriroth K. 2005. Moleculer properties of cassava starch modified with different UV irradiations to enhance baking expansion. Carbohyd Polym 61: 8087. Whistler RL, Paschall EF. 1984. Strach Chemistry and Technology. 2nded. USA: Academic Pr. Winarno FG. 1991. Kimia Pangan dan Gizi. Jakarta : PT Gramedia. Winarno FG. 2002. Kimia Pangan. Jakarta : PT Gramedia Pustaka Utama. Wirakartakusumah MA, Syarief R, Syah D. 1989. Pemanfaatan teknologi pangan dalam pengolahan singkong. Makalah pada Seminar Nasional Peningkatan Nilai Tambah Singkong, Univ. Padjadjaran, Bandung 10 Oktober 1989. Bul Pusbangtepa IPB 18: 27-42. Wurzburg OB. 1968. Starch in food industry. In: Furia TE (ed). Handbook of Food Additives. Ohio: The Chemical Rubber. 43 LAMPIRAN Lampiran 1. Karakterisasi Komposisi Mutu Cairan Fermentasi dan Tapioka Asam 1. pH (AOAC, 1995) Sampel sebanyak 2,5 g dilarutkan dalam 25 ml aquades. Pengukuran pH menggunakan alat pH meter yang sudah dikalibrasi. 2. Total Asam (AOAC, 1995) Sampel sebanyak 10 g ditera dengan aquades sampai 50 ml. larutan tersebut disaring menggunakan kertas saring hingga didapat 25 ml cairan jernih. Kemudian diberi indikator phenolptalein dan dititrasi dengan NaOH 0,1 N yang sudah distandarisasi. Keterangan : fp = faktor pengenceran N NaOH= Normalitas NaOH W = bobot sampel (g) 3. Analisa Mikroba (AOAC, 1995) Analisa mikroba diukur dengan menggunakan metode tuang. Sampel sebanyak 1 g ditimbang, kemudian dilakukan pengenceran pada tingkat yang dikehendaki. Contoh dipipet sebanyak 1 ml lalu disebar dalam cawan petri dan digoyang hingga rata. Setelah itu dimasukkan media sesuai analisa mikroba yang diinginkan. Untuk Total Plate Count menggunakan media PCA (Plate Count Agar), analisa E.coli menggunakan media EMB (Eosin Methylene Blue), analisa total mikroba menggunakan media NA (Nutrient Agar), analisa kapang dan khamir menggunakan PDA (Potato Dextrosa Agar), dan analisa BAL menggunakan MRS Agar (de Man-Rogosa-Sharpe). Selanjutnya diinkubasi selama 24-48 jam dalam inkubator pada suhu 37° C, kecuali untuk E.coli diinkubasi pada suhu 45°C, dan setelah masa inkubasi selesai dilakukan perhitungan jumlah koloni. Secara khusus koloni tipikal E. coli adalah koloni dengan warna hijau metalik. Jumlah mikroba dihitung berdasarkan Standard Plate Count (SPC) dan dinyatakan dalam CFU/g. 4. Total Soluble Carbohydrate (Metode Phenol-AsamSulfat) Sebanyak 1 ml larutan glukosa standar atau contoh dipipet, dan ditambahkan 0,5 ml larutan phenol. Kemudian ditambahkan 2,5 ml larutan H2SO4 pekat dengan posisi pipet tegak lurus dan dilepaskan dengan cepat. Pembacaan dengan spektrofotometer dilakukan dengan panjang gelombang 490 nm. Bila diperlukan, contoh diencerkan agar dapat terukur pada kisaran 0,2 – 0,8 %Abs (Absorbansi). Kurva standar dibuat dengan konsentrasi glukosa standar 10-60 ppm. 44 Lampiran 2. Karakterisasi Sifat Fisikokimia Tapioka Asam A. Bentuk Granula Pati (Metode Mikroskop Cahaya Terpolarisasi) Bentuk granula pati diamti menggunakan mikroskop cahaya dengan perbesaran 100 kali. Suspensi pati untuk pengamatan disiapkan dengan mencampur butir pati dengan air destilasi. Suspensi tersebut diteteskan di atas gelas obyek dan kemudian ditutup dengan gelas penutup. Obyek diuji dengan meneruskan cahaya melalui polarisator dan selama pengamatan, alat analisator diputar sehingga cahaya terpolarisasi sempurna. Selanjutnya hasil pengamatan disimpan dalam bentuk file JPEG. B. Karakterisasi Komposisi Kimia Tapioka Asam 1. Kadar air (SNI 3451:2011) Kadar air dihitung berdasarkan bobot yang hilang selama pemanasan dalam oven pada suhu (130 ± 3) °C. Prosedur kerjanya adalah sebagai berikut cawan dipanaskan dalam oven pada suhu (130 ± 3) °C selama kurang lebih satu jam dan dinginkan dalam desikator selama 20 menit sampai dengan 30 menit, kemudian timbang dengan neraca analitik. Sebanyak 2-5 g contoh dimasukkan ke dalam cawan dan timbang. Cawan yang berisi contoh tersebut dipanaskan di dalam oven setelah suhu oven (130 ± 3) °C selama satu jam. Pindahkan cawan ke dalam desikator dan dinginkan selama 20 menit sampai dengan 30 menit sehingga suhunya sama dengan suhu ruang, kemudian timbang. Hitung kadar air dalam contoh. Keterangan : A = wadah + contoh sebelum dikeringkan (g) B = wadah + contoh setelah dikeringkan (g) C = bobot contoh (g) 2. Kadar abu (SNI 3451:2011) Cawan dipanaskan dalam tanur pada suhu (550 ± 5) °C selama satu jam dan didinginkan dalam desikator sehingga suhunya sama dengan suhu ruang kemudian ditimbang dengan neraca analitik. Contoh sebanyak 3-5 g dimasukkan ke dalam cawan dan ditimbang. Cawan yang berisi contoh tersebut ditempatkan dalam tanur pada suhu (550 ± 5) °C sampai terbentuk abu berwarna putih dan diperoleh bobot tetap. Cawan dipindahkan ke dalam desikator sehingga suhunya sama dengan suhu ruang kemudian ditimbang dan dihitung kadar abu dalam contoh. Keterangan : A = cawan + contoh kering (g) B = cawan kosong (g) C = bobot contoh (g) 45 3. Kadar Protein (AOAC, 1995) Sebanyak 0,1 g contoh dimasukkan ke dalam labu kjeldahl lalu ditambahkan 2,5 ml H 2SO4 pekat, dan 1 g katalis. Larutan didestruksi hingga menghasilkan larutan jernih kemudian didinginkan. Larutan hasil destruksi dipindahkan ke alat destilasi dan ditambahkan 15 ml NaOH 50%. Labu erlenmeyer yang berisi 25 ml larutan asam borat 2 % dan 2-3 tetes indikator mengsel (campuran metil merah 0,02 % dalam alkohol dan metil biru 0,02 % dalam alkohol (2:1)) diletakkan dibawah kondensor. Ujung batang tabung kondensor harus terendam dalam larutan asam borat. Destilasi dilakukan sampai volume larutan dalam erlenmeyer mencapai 2 kali volume awal. Larutan yang berada dalam erlenmeyer dititrasi dengan H2SO4 0,02 N hingga diperoleh perubahan warna dari hijau menjadi ungu. Setelah itu dilakukan juga penetapan blanko. ( ) Keterangan : a = ml H2SO4 untuk titrasi blanko b = ml H2SO4 untuk titrasi contoh N = normalitas H2SO4 W = bobot contoh (mg) 4. Kadar Lemak (AOAC, 1995) Sebanyak 2 g contoh bebas air diekstraksi dengan pelarut organik heksan dalam alat soxlet selama 6 jam. Contoh hasil ekstraksi diuapkan dengan cara diangin-anginkan dan dikeringkan dalam oven bersuhu 105° C. Contoh didinginkan dalam desikator dan ditimbang hingga diperoleh bobot tetap. 5. Kadar Serat Kasar (SNI 3451:2011) Contoh sebanyak 2-4 g ditimbang dan dimasukkan ke dalam erlenmeyer 500 ml, ditambahkan 100 ml larutan H2SO4 0,325 N kemudian dihidrolisis dalam otoklaf selama 15 menit pada suhu 105° C. lalu ditambahkan 50 ml NaOH 1,25 N. Kemudian dihidrolisis kembali. Contoh disaring dengan kertas saring yang telah dikeringkan dan diketahui bobotnya. Kertas saring tersebut dicuci berturut-turut dengan air panas, 25 ml H2SO4 0,325 N lalu dengan air panas dan terakhir dengan alkohol 25 ml. Angkat kertas saring beserta isinya, dimasukkan ke oven dan dikeringkan pada suhu 105 °C, dinginkan dan timbang sampai bobot tetap. ( ) Keterangan : a = bobot residu serat dalam kertas saring (g) b = bobot kertas saring kering (g) c = bobot bahan (g) 46 6. Kadar Karbohidrat (by difference) Kadar karbohidrat dihitung dengan rumus sebagai berikut : ( Keterangan : A = kadar abu D = kadar air B = kadar protein E = kadar serat kasar C = kadar lemak ) 47 Lampiran 3. Karakterisasi Sifat Fungsional Tapioka Asam 1. Sifat Amilografi Pengukuran sifat-sifat amilografi dilakukan dengan menggunakan alat RVA (Rapid Visco Analyzer). Langkah pertama yaitu persiapan alat dengan cara menekan tombol ‘on’ pada bagian belakang alat dan menyalakan air pendingin. Selanjutnya buka software TCW3 (program RVA) dari komputer. Selanjutnya, paddle dipasang ke paddle coupling dan dipilih zero dari menu run pada toolbar. Proses tersebut ditunggu sampai nilai viskositas yang ditunjukkan stabil. Lalu, masukkan nilai kadar air sampel pada program dan klik run. Secara otomatis program akan melakukan perhitungan banyaknya akuades dan sampel yang akan dibutuhkan. Kemudian pada persiapan sampel, dimasukkan akuades dan sampel yang telah ditimbang kedalam canister. Lalu paddle dipasang paddle ke dalam canister dengan menggerakkan keatas dan kebawah untuk mendispersikan sampel. Selanjutnya, paddle coupling diputar dengan tangan sehingga bagian cekungannya menghadap ke depan. Lalu, bagian atas paddle didorong kedalam coupling dengan ibu jari, sementara jari lainnya dibelakang coupling. Kemudian tombol tower ditekan perlahan sampai terdengar vbunyi ‘klik’ dan lepaskan segera. Selanjutnya proses pengujian segera berjalan. Setelah proses pengujian selesai, pilih menu Analysis Result dari menu view untuk melihat hasil analisis. Kemudian, pilih report dan simpan grafik yang diperoleh dengan memilih menu save. Dari hasil analisis viskositas maksimum, breakdown viscosity, final viscosity, setback viscosity dan pasting temperature. 2. Swelling Power dan Kelarutan (Modifikasi metode Perez et al., 1999) Suspensi pati disiapkan yaitu 0,5 g sampel dicampur dengan 50 ml aquades dalam labu erlenmeyer 250 ml. Sampel ditempatkan pada penangas air pada suhu 95°C selama 2 jam dengan pengadukan secara kontinyu. Pada suspensi tersebut diambil 30 ml larutan yang jernih kemudian diletakkan pada cawan petri yang telah diketahui bobotnya. Cawan petri dikeringkan pada oven 100°C hingga bobotnya tetap, kemudian ditimbang dan dihitung kenaikan bobotnya. ( ) ( ) ( ) ( Keterangan : ) a = bobot cawan petri awal (g) b = bobot cawan petri akhir (g) c = bobot erlenmeyer awal (g) d = bobot erlenmeyer akhir (g) 3. Kejernihan Pasta 1 % (Modifikasi metode Perez et al., 1999) Pasta pati disiapkan dengan cara mensuspensikan 50 mg sampel dalam 5 ml air (gunakan tabung reaksi berulir). Selanjutnya suspensi dicelupkan pada air mendidih selama 30 menit. Tabung dikocok setiap 5 menit. Sampel didinginkan hingga suhu kamar. Nilai transmisi (% T) dibaca pada spektofotometer dengan panjang gelombang 650 nm. Aquades digunakan sebagai blanko. 48 4. Expanding Capability (Metode Demiate et al., 2000) Sebanyak 12 g pati ditimbang dan ditambahkan 10 ml air mendidih. Selanjutnya dicampur sehingga dihasilkan adonan yang homogen. Lalu, adonan tersebut dibentuk menjadi tiga bola kecil dan dipanggang dalam oven pada suhu 200°C selama 25 menit. Setelah dipanggang, tiga bola tersebut didinginkan pada suhu kamar dan ditimbang. Volume diukur dengan cara melapisi tiga bola tersebut dengan parafin dan dimasukkan kedalam sebuah tabung yang berisi air. Volume air yang tumpah dihitung sebagai volume bola (adonan) tersebut. Expanding capability dihitung dengan membagi volume terhadap berat dan dinyatakan sebagai volume spesifik (ml/g). 49 Lampiran 4. ANOVA Karakteristik Cairan Fermentasi 1. pH Anova dengan satu faktor Nilai statistik Lama fermentasi Total ulangan Total Rata-rata Varian 10 3 12.53 4.177 0.161 20 3 11.26 3.753 0.049 30 3 10.16 3.387 0.000 40 3 10.94 3.647 0.001 50 3 10.9 3.633 0.006 Jumlah kuadrat (JK) Derajat bebas Kuadrat tengah (KT) F hitung Nilai P F tabel Perlakuan 1.001 4.000 0.250 5.764 0.011 3.478 Galat (eror) 0.434 10.000 0.043 Total 1.435 14.000 Tabel ANOVA Sumber keragaman UJI LANJUT LSD (LEAST SIGNIFICANT DIFFERENCE) Nilai LSD = 0.032 Urutan rataan Perlakuan Rataan 30 50 40 20 10 3.387 3.633 3.647 3.753 4.177 0 tn a Notasi 30 3.387 a 50 3.633 0.247 0 tn 40 3.647 0.260 0 tn b 20 3.753 0.367 0 tn b 10 4.177 0.790 0 tn b b b 2. Total Asam Anova dengan satu faktor Nilai statistik Lama fermentasi Total ulangan Total Rata-rata Varian 10 3 47.520 15.840 3.098 20 3 138.160 46.053 45.173 30 3 165.440 55.147 12.649 40 3 217.360 72.453 4.905 50 3 309.760 103.253 519.106 50 Tabel ANOVA Sumber keragaman Jumlah kuadrat (JK) Derajat bebas Kuadrat tengah F hitung Nilai P F tabel Perlakuan 12550.75 4 3137.688 26.82105 2.51E-05 3.47805 Galat (eror) 1169.86 10 116.986 Total 13720.61 14 UJI LANJUT LSD (LEAST SIGNIFICANT DIFFERENCE) Nilai LSD = 86.882 Urutan perlakuan Perlakuan 10 20 30 40 50 15.840 46.053 55.147 72.453 103.253 Rataan Notasi 10 15.840 0 tn a a 20 46.053 30.213 0 tn 30 55.147 39.307 0 tn ab 40 72.453 56.613 0 tn ab 50 103.253 87.413 0 tn b b ab 3. Bakteri Asam Laktat Anova dengan satu faktor Nilai statistik Lama fermentasi Total ulangan Total Rata-rata Varian 10 3 2147500 715833 130664583333 20 3 178800000 59600000 319760625000000 30 3 58685000 19561667 68171414583333 40 3 125300000 41766667 485353958333333 50 3 48450000 16150000 66793125000000 Tabel ANOVA Sumber keragaman Jumlah kuadrat (JK) Derajat bebas Kuadrat tengah F hitung Nilai P F tabel Perlakuan 6.42949E+15 4 1.60737E+15 8.548 0.003 3.478 Galat (eror) 1.88042E+15 10 1.88042E+14 Total 8.3099E+15 14 51 UJI LANJUT LSD (LEAST SIGNIFICANT DIFFERENCE) Nilai LSD = 139652493770000 Urutan perlakuan Perlakuan 10 50 30 40 20 715833 16150000 19561667 41766667 59600000 Rataan 10 715833 0 tn a 50 16150000 15434167 0 tn 30 19561667 18845833 2695833 40 41766667 41050833 24900833 5339167 0 tn 20 59600000 58884167 42734167 23172500 0 tn Notasi a b ab 0 tn c abc d abcd abcd 4. TPC Anova dengan satu faktor Nilai statistik Lama fermentasi Total ulangan Total Rata-rata Varian 10 3 99075 33025 11480625 20 3 48725000 16241667 8.90646E+12 30 3 49972511 16657504 8.65467E+12 40 3 85625555 28541852 1.02356E+14 50 3 31975000 10658333 3.35508E+13 Jumlah kuadrat (JK) Derajat bebas Kuadrat tengah F hitung Nilai P F tabel Perlakuan 1.28666E+15 4 3.2166E+14 10.480 0.001 3.478 Galat (eror) 3.06937E+14 10 3.0694E+13 Total 1.5936E+15 14 Tabel ANOVA Sumber keragaman UJI LANJUT LSD (LEAST SIGNIFICANT DIFFERENCE) Nilai LSD = 22795170113716 Urutan perlakuan Perlakuan Rataan 10 33025 50 10 50 20 30 40 33025 10658333 16241667 16657504 28541852 0 tn a 10658333 10625308 0 tn 20 16241667 16208642 5550308 0 tn 30 16657504 16624479 5966145 0 tn 40 28541852 28508827 17850493 Notasi a b ab 1608827 c abc abc 0 tn d abcd 52 5. TSC (Total Soluble Carbohydrate) Anova dengan satu faktor Nilai statistik Lama fermentasi Total ulangan Total Rata-rata Varian 10 20 3 536.616 178.872 10332.704 3 1803.030 601.010 9352.920 30 3 3157.828 1052.609 346084.477 40 3 3349.495 1116.498 78956.569 50 3 4784.091 1594.697 70541.208 Jumlah kuadrat (JK) Derajat bebas Kuadrat tengah F hitung Nilai P F tabel 8.455 0.003 3.47805 Tabel ANOVA Sumber keragaman Perlakuan 3485411.412 4 871352.853 Galat (eror) 1030535.755 10 103053.576 Total 4515947.167 14 UJI LANJUT LSD (LEAST SIGNIFICANT DIFFERENCE) Nilai LSD = 76534.455 Urutan perlakuan Perlakuan 10 Rataan 178.872 10 20 30 40 50 178.872 601.010 1052.609 1116.498 1594.697 0 tn a Notasi a 20 601.010 422.138 0 tn b 30 1052.609 873.737 272.727 0 tn ab 40 1116.498 937.626 336.616 0 tn abc 50 1594.697 1415.825 814.815 0 tn abc c abc 53 Lampiran 5. ANOVA Karakteristik Kimia, Mutu dan Fungsional Tapioka Asam Karakteristik Kimia 1. Kadar Abu Anova dengan satu faktor Nilai statistik Lama fermentasi Total ulangan Total Rata-rata Varian 0 3 0.472 0.158 4.88E-05 10 3 0.449 0.150 0.000302 20 3 2.554 0.851 0.005976 30 3 0.626 0.209 0.001884 40 3 0.767 0.256 4.21E-05 50 3 0.664 0.221 4.53E-05 Jumlah kuadrat (JK) Derajat bebas Kuadrat tengah F hitung Nilai P F tabel Perlakuan 1.089 5 0.218 157.474 1.65E-10 3.106 Galat (eror) 0.017 12 0.001 Total 1.106 17 Tabel ANOVA Sumber keragaman Uji lanjut LSD Nilai LSD = 0.001 Urutan rataan Perlakuan Rataan 10 0 30 50 40 20 0.150 0.158 0.209 0.221 0.256 0.851 Notasi 10 0.150 0 tn a a 0 0.158 0.008 * 0 tn 30 0.209 0.059 * 0 tn b 50 0.221 0.071 * 0 tn b 40 0.256 0.106 * 0 tn b 20 0.851 0.702 * 0.544 * b 0.336 * b 0.114 * 0 tn c c 54 2. Kadar Protein Anova dengan satu faktor Nilai statistik Lama fermentasi Total ulangan Total Rata-rata Varian 0 3 0.574 0.191 0.000 10 3 0.587 0.196 0.000 20 3 1.475 0.492 0.013 30 3 1.310 0.437 0.002 40 3 1.347 0.449 0.001 50 3 1.476 0.492 0.009 Jumlah kuadrat (JK) Derajat bebas Kuadrat tengah F hitung Nilai P F tabel 14.659 0.000 3.106 Tabel ANOVA Sumber keragaman Perlakuan 0.307 5.000 0.061 Galat (eror) 0.050 12.000 0.004 Total 0.357 17.000 Uji lanjut LSD Nilai LSD : 0.003 Urutan rataan Perlakuan 0 10 30 40 20 50 0.192 0.196 0.437 0.449 0.492 0.492 Rataan 0 tn a Notasi 0 0.192 a 10 0.196 0.004* 0 tn b 30 0.437 0.245 * 0.049 * 0 tn 40 0.449 0.257 * 0.062 * 0 tn c 20 0.492 0.300 * 0.104 * 0 tn c 50 0.492 0.300 * 0.105 * 0 tn c b c c 3. Kadar Lemak Anova dengan satu faktor Nilai statistik Lama fermentasi Total ulangan Total Rata-rata Varian 0 3 3.563 1.188 0.071 10 3 4.341 1.447 0.063 20 3 3.171 1.057 0.000 30 3 3.207 1.069 0.001 40 3 3.145 1.048 0.000 50 3 3.200 1.067 0.002 55 Tabel ANOVA Sumber keragaman Jumlah kuadrat (JK) Derajat bebas Kuadrat tengah F hitung Nilai P F tabel Perlakuan 0.366 5.000 0.073 3.179 0.047 3.106 Galat (eror) 0.276 12.000 0.023 Total 0.642 17.000 Uji lanjut LSD Nilai LSD = 0.017 Urutan rataan Perlakuan Rataan 40 20 50 30 0 10 1.048 1.057 1.067 1.069 1.188 1.447 Notasi 40 1.048 0 tn a a 20 1.057 0.008 tn 0 tn 50 1.067 0.018 * 0 tn b 30 1.069 0.021 * 0 tn b 0 1.188 0.139 * 0 tn b 10 1.447 0.398 * 0 tn b b ab 4. Kadar Serat Kasar Anova dengan satu faktor Nilai statistik Lama fermentasi Total ulangan Total Rata-rata Varian 0 3 0.320 0.107 0.00002 10 3 0.368 0.123 0.00007 20 3 0.321 0.107 0.00000 30 3 0.334 0.111 0.00003 40 3 0.325 0.108 0.00001 50 3 0.333 0.111 0.00002 Jumlah kuadrat (JK) Derajat bebas Kuadrat tengah F hitung Nilai P F tabel 4.3269 0.0175 3.1059 Tabel ANOVA Sumber keragaman Perlakuan 0.0005 5.000 0.00011 Galat (eror) 0.0003 12.000 0.00003 Total 0.001 17.000 56 Uji lanjut LSD Nilai LSD = 0.000018 Urutan rataan Perlakuan 0 20 40 50 30 0.1067 0.1069 0.1084 0.1111 0.1112 Rataan Notasi 0 0.1067 0 tn a 20 0.1069 0.0002 * 0 tn a 40 0.1084 0.0017 * 0 tn b 50 0.1111 0.0044 * 0 tn b 30 0.1112 0.0046 * 0 tn b 10 0.1228 0.0161 * 0 tn b b b 5. Kadar Karbohidrat by differences Anova dengan satu faktor Nilai statistik Lama fermentasi Total ulangan 0 3 Total 259.283 10 3 247.469 82.490 0.245 20 3 250.298 83.433 0.158 30 3 244.403 81.468 3.937 40 3 250.569 83.523 0.045 50 3 256.541 85.514 0.001 Jumlah kuadrat (JK) 51.624 Derajat bebas 5.000 Kuadrat tengah 10.325 Galat (eror) 9.397 12.000 0.783 Total 61.021 17.000 Tabel ANOVA Sumber keragaman Perlakuan Rata-rata 86.428 Varian 0.314 F hitung Nilai P 13.184 0.000 F tabel 3.106 Uji lanjut LSD Nilai LSD = 0.569 Urutan rataan 30 81.468 10 82.490 20 83.433 40 83.523 50 85.514 0 86.428 Perlakuan Rataan Notasi 30 81.468 0 tn a 10 82.490 1.022 * 0 tn 20 83.433 1.965 * 0 tn b 40 83.523 2.055 * 0 tn b 50 85.514 4.046 * 0 tn b 0 86.428 4.960 * 0 tn b a b b 57 Karakteristik Mutu 1. pH Anova dengan satu faktor Nilai statistik Lama fermentasi Total ulangan Total Rata-rata Varian 0 3 14.240 4.747 0.003 10 3 12.550 4.183 0.004 20 3 11.345 3.782 0.099 30 3 11.485 3.828 0.027 40 3 10.080 3.360 0.031 50 3 10.930 3.643 0.044 Jumlah kuadrat (JK) 3.511 Derajat bebas 5.000 Kuadrat tengah 0.702 Galat (eror) 0.416 12.000 0.035 Total 3.927 17.000 Tabel ANOVA Sumber keragaman Perlakuan F hitung Nilai P F tabel 20.259 0.00002 3.106 Uji LSD Nilai LSD = 0.025 Urutan rataan Perlakuan Rataan 40 50 20 30 10 0 3.360 3.643 3.782 3.828 4.183 4.747 Notasi 40 3.360 0 tn a a 50 3.643 0.283 * 0 tn 20 3.782 0.422 * 0 tn b 30 3.828 0.468 * 0 tn b 10 4.183 0.823 * 0 tn b 0 4.747 1.387 * 0 tn b b b 2. Total Asam Anova dengan satu faktor Nilai statistik Lama fermentasi Total ulangan Total Rata-rata Varian 0 3 6.682 2.227 0.010 10 3 14.253 4.751 0.494 20 3 18.399 6.133 0.391 30 3 18.656 6.219 0.010 40 3 21.912 7.304 0.054 50 3 22.088 7.363 0.096 58 Tabel ANOVA Sumber keragaman Jumlah kuadrat (JK) 56.241 Derajat bebas 5.000 Kuadrat tengah 11.248 Galat (eror) 2.111 12.000 0.176 Total 58.352 17.000 Perlakuan F hitung Nilai P F tabel 63.941 0.000 3.106 Uji lanjut LSD Nilai LSD = 0.128 Urutan rataan 0 10 20 30 40 50 2.227 4.751 6.133 6.219 7.304 7.363 Perlakuan Rataan 0 2.227 10 4.751 2.524 0 tn 20 6.133 3.906 0 tn b 30 6.219 3.991 0 tn b 40 7.304 5.077 0.326 0 tn 50 7.363 5.135 0.384 0 tn 0 tn Notasi a a b b c c c 3. Bakteri Asam Laktat Anova dengan satu faktor Nilai statistik Lama fermentasi 0 Total ulangan 3 Total 3400 Rata-rata 1133 Varian 740833 10 3 34825 11608 1041458 20 3 4480000 1493333 37352083333 30 3 5860000 1953333 1838589583333 40 3 3127500 1042500 571443750000 50 3 1502500 500833 95652083333 Tabel ANOVA Sumber keragaman Perlakuan Jumlah kuadrat (JK) 9.6363E+12 Derajat bebas 5 Kuadrat tengah 1.9273E+12 Galat (eror) 5.0861E+12 12 4.2384E+11 Total 1.4722E+13 17 F hitung Nilai P 4.547 0.015 F tabel 3.106 59 Uji lanjut LSD Nilai LSD = 307849033117.419 Urutan rataan Perlakuan 0 10 50 40 20 30 1133 11608 500833 1042500 1493333 1953333 Rataan 0 1133 0 tn a 10 11608 10475 tn 0 tn b 50 500833 499700 tn 488092 tn 0 tn c 40 1042500 1041367 tn 1029758 tn 528925 tn 0 tn 20 1493333 1492200 tn 1480592 tn 979758 tn 0 tn 30 1953333 1952200 tn 1940592 tn 1439758 tn 397258 tn a ab abc d abcd abcd 0 tn e abcde 4. Total Plate Count Anova dengan satu faktor Nilai statistik Lama fermentasi Total ulangan Total Rata-rata Varian 0 3 5050 1683 1013333 10 3 118700 39567 57915208 20 3 550000 183333 7.28E+09 30 3 567500 189167 1.36E+10 40 3 337500 112500 3.73E+09 50 3 280000 93333 7.03E+09 Jumlah kuadrat (JK) 85050810694 Derajat bebas 5 Kuadrat tengah 1.701E+10 Galat (eror) 63455357083 12 5.288E+09 Total 1.48506E+11 17 Tabel ANOVA Sumber keragaman Perlakuan F hitung Nilai P F tabel 3.217 0.045 3.106 Uji lanjut LSD Nilai LSD = 3840811752.350 Urutan rataan Perlakuan 0 10 50 40 20 30 1683 39567 93333 112500 183333 189167 Rataan Notasi 0 1683 0 tn a 10 39567 37917 tn 0 tn b 50 93333 100017 tn 60450 tn 0 tn 40 112500 118350 tn 78783 tn 0 tn 20 183333 175017 tn 135450 tn 33783 tn 0 tn 30 189167 178350 tn 138783 tn 37117 tn 0 tn Notasi a ab c abc abc d abcd abcd 60 5. Kapang dan Khamir Anova dengan satu faktor Nilai statistik Lama fermentasi Total ulangan Total Rata-rata Varian 0 3 0 0 0 10 3 3525 1175 139375 20 3 80000 26667 564583333 30 3 747500 249167 1.308E+09 40 3 772500 257500 1425000000 50 3 795000 265000 918750000 Jumlah kuadrat (JK) 2.78377E+11 Derajat bebas 5 Kuadrat tengah 5.5675E+10 Galat (eror) 8433612083 12 702801007 Total 2.8681E+11 17 Tabel ANOVA Sumber keragaman Perlakuan F hitung Nilai P F tabel 79.219 9.12E-09 3.106 Uji Lanjut LSD Nilai LSD = 510467798.044 Urutan rataan Perlakuan Rataan 0 0 0 10 20 30 40 40 0 1175 26667 249166.7 257500 265000 0 tn a Notasi a 10 1175 1175 tn 0 tn b 20 26667 26667 tn 25492 tn 0 tn c ab 30 249167 249167 tn 247992 tn 221325 tn 0 tn 40 257500 257500 tn 256325 tn 229658 tn 0 tn abcd 50 265000 265000 tn 263825 tn 237158 tn 0 tn abcd abc d abcd Karakteristik Fungsional 1. Kejernihan Anova dengan satu faktor Nilai statistik Lama fermentasi Total ulangan Total Rata-rata Varian 0 3 137.900 45.967 8.223 10 3 170.400 56.800 3.723 20 3 153.400 51.133 0.341 30 3 185.650 61.883 11.851 40 3 156.750 52.250 9.167 50 3 154.550 51.517 1.491 61 Tabel ANOVA Sumber keragaman Jumlah kuadrat (JK) 446.005 Derajat bebas 5.000 Kuadrat tengah 89.201 Galat (eror) 69.592 12.000 5.799 Total 515.596 17.000 Perlakuan F hitung Nilai P F tabel 15.381 0.000 3.106 Uji Lanjut LSD Nilai LSD = 4.212 Urutan rataan Perlakuan 0 20 50 40 10 30 45.967 51.133 51.517 52.250 56.800 61.883 Rataan Notasi 0 45.967 0 tn a a 20 51.133 5.17 * 0 tn 50 51.517 5.55 * 0 tn b 40 52.250 6.28 * 0 tn b 10 56.800 10.83 * 0 tn b 30 61.883 15.92 * 0 tn b b b 2. Kelarutan Anova dengan satu faktor Nilai statistik Lama fermentasi Total ulangan Total Rata-rata Varian 0 3 63.550 21.183 1.815 10 3 101.650 33.883 0.069 20 3 151.668 50.556 4.211 30 3 107.355 35.785 0.379 40 3 106.885 35.628 1.012 50 3 104.766 34.922 0.207 Jumlah kuadrat (JK) 1303.553 Derajat bebas 5.000 Kuadrat tengah 260.711 15.386 12.000 1.282 1318.939 17.000 Tabel ANOVA Sumber keragaman Perlakuan Galat (eror) Total F hitung Nilai P F tabel 203.338 0.000 3.106 62 Uji Lanjut LSD Nilai LSD = 0.931 Urutan rataan Perlakuan 0 10 50 40 30 20 21.183 33.883 34.922 35.628 35.785 50.556 Rataan Notasi 0 21.183 0 tn a 10 33.883 12.699818 0 tn a 50 34.922 13.738567 0 tn b 40 35.628 14.445088 0 tn b 30 35.785 14.601446 0 tn b 20 50.556 29.372756 0 tn b b b 3. Swelling Power Anova dengan satu faktor Nilai statistik Lama fermentasi Total ulangan Total Rata-rata Varian 0 3 1.345 0.448 0.001 10 3 2.563 0.854 0.000 20 3 5.140 1.713 0.016 30 3 2.789 0.930 0.001 40 3 2.769 0.923 0.002 50 3 2.683 0.894 0.000 Jumlah kuadrat (JK) 2.542 Derajat bebas 5.000 Kuadrat tengah 0.508 Galat (eror) 0.041 12.000 0.003 Total 2.582 17.000 Tabel ANOVA Sumber keragaman Perlakuan F hitung Nilai P F tabel 150.162 0.000 3.106 Uji Lanjut LSD Nilai LSD = 0.002 Urutan rataan 0 10 50 40 30 20 0.448 0.854 0.894 0.923 0.930 1.713 Perlakuan Rataan 0 0.448 10 0.854 0.406 0 tn 50 0.894 0.446 0 tn b 40 0.923 0.475 0 tn b 30 0.930 0.481 0 tn b 20 1.713 1.265 0 tn Notasi a a b b 0.411 0 tn c c 63 4. Expanding Capability Anova dengan satu faktor Nilai statistik Lama fermentasi Total ulangan Total Rata-rata Varian 0 2 2.300 1.150 0.000 10 2 2.353 1.177 0.000 20 2 2.410 1.205 0.008 30 2 2.442 1.221 0.000 40 2 2.544 1.272 0.001 50 2 2.556 1.278 0.017 Jumlah kuadrat (JK) 0.026 Derajat bebas 5.000 Kuadrat tengah 0.005 Galat (eror) 0.026 6.000 0.004 Total 0.052 11.000 Tabel ANOVA Sumber keragaman Perlakuan F hitung Nilai P F tabel 1.219 0.402 4.387 Karena nilai F < F crit maka nilai expanding capability pada tapioka asam yang dihasilkan dari fermentasi 0 hari, 10 hari, 20 hari, 30 hari, 40 hari dan 50 hari tidak berbeda nyata pada taraf 5%. 64 Lampiran 6. Visualisasi Tapioka Asam yang dihasilkan 1. Tapioka alami (fermentasi 0 hari) 2. Tapioka asam dengan fermentasi 10 hari 3. Tapioka asam dengan fermentasi 20 hari 4. Tapioka asam dengan fermentasi 30 hari 5. Tapioka asam dengan fermentasi 40 hari 6. Tapioka asam dengan fermentasi 50 hari 65 Lampiran 7. Expanding Capability pada Tapioka Asam 1. Expanding capability tapioka alami 2. Expanding capability tapioka asam (10 hari) 3. Expanding capability tapioka asam (20 hari) 4. Expanding capability tapioka asam (30 hari) 5. Expanding capability tapioka asam (40 hari) 6. Expanding capability tapioka asam (50 hari) 66