Sifat Fisikokimia dan indeks glikemik berbagai
advertisement

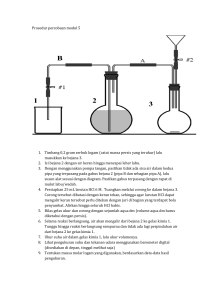
III. METODOLOGI PENELITIAN A. Bahan Bahan-bahan yang digunakan untuk analisis kimia antara lain heksana, air destilata, dietil eter, kertas saring, batu didih, KI, eter, metanol, etanol, alkohol, aseton, amilosa murni, petroleum eter, bufer fosfat, enzim pepsin, enzim pankreatin, termamyl, aluminium foil, celite kering, crucible kering porositas 2, K2SO4, HgO, Na2S2O3, H2SO4, H3BO3, HCl, pereaksi folin, Na2CO3, NaOH, larutan Luff-Schoorl, indikator PP, indikator pati, indikator metil merah-metilen blue, CH3COOH, buffer asetat, kertas saring dan glukosa murni. Bahan-bahan yang digunakan untuk analisis daya cerna pati antara lain pati murni, buffer Nafosfat, larutan enzim α-amilase, pereaksi dinitrosalisilat, air destilata, larutan maltose standar, dan glukosa murni. B. Alat Alat-alat yang digunakan untuk analisis fisik adalah Chromameter CR-300 (Minolta Camera, Co. Japan 82281029) dan Rheoner. Alat-alat yang digunakan untuk analisis kimia adalah pipet tetes, pipet volumetrik 10, 5, dan 2 ml, gelas piala ukuran 100 dan 400 ml, cawan alumunium, cawan porselen, labu lemak, labu Kjeldahl, cawan petri, gelas ukur 10, 100 dan 300 ml, erlenmeyer 100, 300 dan 1000 ml, neraca analitik, pendingin balik, tanur, oven pengering, alat destilasi, desikator, soxhlet, gegep, pinset, tabung reaksi, bunsen, hot plate, batang pengaduk, dan spektrofotometer. Alat-alat yang diginakan untuk uji indeks glikemik antara lain kertas uji indeks glikemik, jarum dan alat penguji kadar glukosa (Gluconometer). C. Metode Penelitian 1. Analisis Kimia a. Uji Kadar Air Metode Oven Udara (AOAC 1995) Kadar air sampel bahan pangan dapat ditentukan secara langsung dengan menggunakan metode oven pada suhu 105oC. sampel sejumlah 3–5 gram ditimbang dan kemudian dimasukkan ke dalam cawan yang telah dikeringkan sebelumnya dan diketahui bobotnya. Sampel dan cawan dikeringkan dalam oven bersuhu 105oC selama 6 jam. Cawan kemudian didinginkan dan 15 ditimbang, kemudian dikeringkan kembali sampai diperoleh bobot tetap. Kadar air sampel dapat dihitung dengan menggunakan rumus sebagai berikut: Kadar air (%bb) = ((a-(b-c))/a) x 100% Kadar air (%bk) = ((a-(b-c)/ (b-c)) x 100% Keterangan: a = berat sampel awal (g) b = berat sampel akhir dan cawan (g) c = berat cawan (g) b. Uji Kadar Abu (SNI 01-2891-1992) Kadar abu dalam bahan pangan dapat ditentukan dengan menimbang sisa mineral hasil pembakaran bahan organik pada suhu 550oC di dalam tanur. Sejumlah 3-5 gram sampel ditimbang dan dimasukkan ke dalam cawan porselen yang telah dikeringkan dan diketahui beratnya. Cawan dan sampel tersebut dibakar dengan pembakaran bunsen dalam ruang asap sampai sampel tidak berasap dan diabukan pada tanur pengabuan suhu 550oC sampai dihasilkan abu yang berwarna abu-abu terang dan bobotnya telah konstan. Selanjutnya kembali didinginkan di dalam desikator dan ditimbang segera setelah mencapai suhu ruang. Kadar abu dihitung menggunakan rumus: Kadar abu (%) = Bobot setelah pengabuan-Bobot cawan x 100 Bobot awal sampel c. Uji Kadar Protein dengan metoda Kjeldahl (AOAC 1995) Analisis kadar protein dibagi dalam 3 tahap : a) Digesti Sampel ditimbang sebanyak 0,1 g dalam labu digesti dan ditambahkan 5 ml H2SO4 pekat dan dimasukkan batu didih untuk mempercepat proses digesti. Sampel dipanaskan sampai sampel menjadi jernih kekuningan tanpa partikel di dalam sampel. Blanko dibuat pula tanpa sampel. 16 b) Destilasi Larutan asam borat ditambahkan ke dalam labu Erlenmeyer penerima destilat dan dipasang di rangkaian alat destilasi. Selang pengalir destilat harus tercelup dalam larutan asam borat. Sampel dimasukkan ke dalam alat destilasi dan didestilasi sampai jumlah destilat mencapai sekitar 20 ml. c) Titrasi Larutan HCl yang sudah distandardisasi dicari normalitasnya. Indikator metil merah-metilen biru ditambahkan ke dalam sampel. Sampel kemudian dititrasi menggunakan HCl sampai terjadi perubahan warna. Volume HCl yang terpakai dicatat dan dihitung menggunakan rumus: % N = Normalitas HCl x Volume HCl terpakai x 14,007g N x 100 Bobot sampel Mol % Protein = % N x 6,25 d. Uji Kadar Lemak dengan ekstraksi Soxhlet (AOAC 1995) Metode yang digunakan adalah metode Soxhlet. Prinsip analisis ini adalah melarutkan lemak dengan pelarut dietil eter. Lemak yang dihasilkan adalah lemak kasar. Sejumlah 2 gram sampel ditimbang dan dimasukan ke dalam selongsong kertas saring yang dialasi dengan kapas. Sumbat selongsong kertas yang berisi dengan kapas, lalu keringkan dalam oven pada suhu tidak lebih dari 800C selama 1 jam. Kertas saring yang telah kering dimasukkan dalam alat ekstraksi Soxhlet yang telah dihubungkan ke labu lemak bersama dengan dietil eter. Kemudian sampel direfluks selama 6 jam sampai pelarut yang turun kembali ke dalam labu lemak berwarna jernih. Pelarut dalam labu lemak didestilasi, labu yang berisi hasil ekstraksi dipanaskan dalam oven pada suhu 105oC sampai pelarut menguap semua. Setelah didinginkan dalam desikator, labu lemak tersebut ditimbang sampai memperoleh bobot yang konstan. Kadar lemak dihitung dengan rumus : 17 Kadar Lemak (%) = Bobot lemak (g) 100% Bobot sampel(g) e. Uji Kadar Karbohidrat (by difference) Analisis dilakukan dengan metode by difference yaitu dengan menghitung selisih yang dihasilkan setelah perhitungan kadar air, kadar abu, kadar lemak, dan kadar protein. Kadar Karbohidrat (%) = 100 - (Kadar air + Kadar Abu + Kadar Protein + Kadar Lemak ) f. Total Gula (Metode Luff Schoorl, SNI-01-2892-1992) Timbang bahan 2.5-25 gram sampel, dipindahkan dalam labu takar 100 ml dan tambahkan 20 ml akuades, bubur Al(OH)3 dan larutan Pb asetat. Penambahan bahan penjernih ini diberikan tetes demi tetes sampai penetesan reagensia tidak menimbulkan pengeruhan lagi, kemudian tambahkan aquades sampai tanda tera dan disaring. Filtrat ditampung dalam gelas piala. Tambahkan Na2CO3 anhidrat atau K/Na oksalat anhidrat atau Na fosfat secukupnya untuk menghilangkan kelebihan Pb. Diambil 50 ml filtrtat bebas Pb, masukkan ke dalam erlenmeyer, tambahkan 25 ml aquades dan 10 ml HCl 30%. Panaskan di atas penangas air pada suhu 67-70oC selama 10 menit lalu dinginkan secepatnya sampai suhu 20oC. Netralkan dengan NaOH 45%, kemudian diencerkan sampai volume tertentu sehingga 25 ml air mengandung 15-60 mg gula pereduksi. Sebanyak 25 ml larutan dimasukkan ke dalam erlenmeyer dan ditambahkan 25 ml larutan Luff Schrool. Blanko dibuat dari 25 ml larutan Luff Schrool ditambah 25 ml akuades. Kemudian erlenmeyer dihubungkan dengan pendingin balik lalu dididihkan (usahakan 2 menit sudah mendidih). Pendidihan pertahankan 10 menit lalu didinginkan dan tambahkan 15 ml KI 20% dan 25 ml H2SO4 26.5%. Yodium yang dibebaskan dititrasi dengan larutan Na thiosulfat 0.1 N menggunakan indikator pati 2-3 ml. Penetapan berat glukosa dilakukan 18 dengan membandingkan volume Na-thiosulfat yang diperlukan dengan tabel Luff Schrool. Total Gula (%) = bobot glukosa x FP x 100% bobot sampel g. Uji Kadar Pati (Direct Acid Hydrolisis Method; AOAC 1995) Sampel yang telah dihaluskan, ditimbang 2-5 g, dan ditambahkan 50 ml akuades serta diaduk selama 1 jam. Suspensi disaring dengan kertas saring dan dicuci dengan akuades sampai volume filtrat 250 ml. Filtrat ini mengandung karbohidrat yang larut dan dibuang. Untuk bahan yang mengandung lemak, pati yang terdapat sebagai residu pada kertas saring dicuci 5 kali dengan 10 ml eter. Eter dibiarkan menguap dari residu, kemudian dicuci lagi dengan 150 ml alkohol 10% untuk membebaskan karbohidrat yang terlarut. Residu dipindahkan secara kuantitatif dari kertas saring ke dalam erlenmeyer dengan pencucian 200 ml akuades dan ditambahkan 20 ml HCl 25%, lalu ditutup dengan pendingin balik dan dipanaskan di atas penangas air mendidih selama 2,5 jam. Setelah dingin, larutan dinetralkan dengan larutan NaOH 45% dan diencerkan sampai volume 500 ml, kemudian disaring. Penentuan kadar gula dinyatakan sebagai glukosa dari filtrat yang diperoleh. Berat glukosa yang dikalikan dengan faktor konversi 0,9 merupakan berat pati. h. Uji Kadar Amilosa (Muchtadi dan Sugiyono 1992) Pengukuran kadar amilosa didasarkan pada kurva standar. Mula-mula dilakukan pembuatan amilosa standar, yaitu dengan menimbang amilosa kentang sebagai amilosa murni sebanyak 40 mg, lalu dimasukkan ke dalam tabung reaksi dan ditambahkan 1 ml etanol 95% dan 9 ml NaOH 1 N. Campuran tersebut dipanaskan dalam air mendidih dipindahkan ke dalam labu takar 100 ml dan ditambahkan sampai tanda tera. Larutan campuran dipipet ke dalam labu takar masing-masing 1, 2, 3, 4 dan 5 ml. Ke dalam labu takar tersebut ditambahkan asam asetat 1 N berturut-turut sebanyak 0.2, 0.4, 0.6, 0.8 dan 1 ml serta masing-masing labu takar ditambah pula dengan 2 ml larutan 19 iod. Kemudian ditambahkan air sampai tanda tera. Setelah itu, larutan dikocok dan dibiarkan selama 20 menit. Absorbansinya diukur dengan spektrofotometer pada panjang gelombang 625 nm yaitu panjang gelombang yang memberikan absorbansi maksimum untuk warna biru. Kurva standar dibuat dengan cara memplot kadar amilosa (sumbu x) dengan absorbansinya (sumbu y). Kadar Amilosa = x 100% Keterangan: A : absorbansi sampel pada panjang gelombang 620 nm S : slope kemiringan pada kurva standar FP : faktor pengenceran W : berat sampel i. Komposisi Mineral (Miller 1998) Analisis komposisi mineral dilakukan dengan menggunakan alat Atomic Absorption Spectrophotometer. Persiapan sampel yang dilakukan adalah sebagai berikut. Mula-mula sampel sebanyak 1-2 g dimasukkan ke dalam cawan porselin ukuran 50 ml yang telah dikeringkan (600C, 15 menit) dan telah didinginkan. Selanjutnya sampel dibakar atau dioven 2500C sampai asapnya habis (2 jam) dan diletakkan dalam tanur pengabuan 5500C selama 6 jam. Apabila sampel tetap berwarna hitam ditambahkan 1 ml air destilata bebas ion dan 1 ml HNO3 pekat. Kemudian diuapkan sampai kering (1101500C), dan diabukan lagi 3500C selama 30 menit. Setelah semua sampel telah menjadi abu berwarna putih, ditambahkan 5 – 6 ml HCl 6 N dan dipanaskan di hot plate dengan suhu rendah sampai kering. Kemudian ditambahkan 15 ml HCl 3 N dan dipanaskan kembali sampai mulai mendidih, dan didinginkan. Larutan abu dituangkan ke dalam labu takar melalui kertas saring. Cawan dibilas dengan HCl 3 N 10 ml dan dipanaskan sampai mulai mendidih. Setelah didinginkan larutan dituang kembali melalui kertas saring ke dalam labu takar. Selanjutnya cawan dibilas dengan air destilata bebas ion minimal 3 kali, dan air bekas pembilasan juga dituang 20 melalui kertas saring ke dalam labu takar. Khusus untuk analisis Ca ditambahkan 5 ml Stronsium Klorida untuk tiap 100 ml larutan. Setelah itu labu takar ditepatkan sampai tanda tera dengan air destilata, dan sampel siap dianalisis dengan Atomic Absorption Spectrophotometer. Kadar mineral (mg/l) = Keterangan: FP W a= konsentrasi sampel dari kurva standar (mg/L) FP= faktor pengenceran W= berat sampel (g) j. Uji Kadar Serat Pangan Metode Enzimatis (AOAC 1995) Sampel kering diekstrak lemaknya dengan pelarut petroleum eter pada suhu kamar selama 15 menit. Sejumlah 1 gram sampel bebas lemak (w) dimasukkan ke dalam erlenmeyer, dan ditambahkan 25 ml 0.1 M buffer fosfat pH 6.0 dibuat suspensi. Selanjutnya, ditambahkan 0.1 ml termamyl, ditutup dengan alufo dan diinkubasi pada suhu 100oC selama 15 menit, diangkat dan didinginkan, dan ditambahkan 20 ml akuades dan pH diatur menjadi 1.5 dengan menambahkan HCl 4 M. Tambahkan 100 mg pepsin, ditutup dan diinkubasi pada suhu 40C dan diagitasi selama 60 menit. Tambahkan 20 ml akuades dan pH diatur menjadi 6.8 dan tuangkan 100 mg pankreatin, ditutup dan diinkubasi pada suhu 40C selama 60 menit sambil diagitasi, dan terakhir pH diatur dengan HCl menjadi 4.5. Selanjutnya, disaring dengan crucible kering porositas 2 yang telah ditimbang bobotnya yang mengandung celite kering (bobot diketahui), lalu dicuci dua kali dengan akuades. Residu (serat makanan tidak larut/IDF) Sampel dicuci dengan 2 x 10 ml etanol 95% dan 2 x 10 ml aseton, dan dikeringkan pada suhu 105C sampai berat tetap (sekitar 12 jam). Timbanglah sampel setelah didinginkan dalam desikator (D1). Selanjutnya, sampel diabukan dalam tanur 500C selama minimal 5 jam dan ditimbang setelah didinginkan dalam desikator (I1). 21 Filtrat (serat makanan larut /SDF) Volume filtrat diatur dengan akuades sampai dengan 100 ml, lalu ditambah dengan 400 ml etanol 95% hangat (60oC), diendapkan selama 1 jam. Filtrat disaring dengan crucible kering porositas 2 yang mengandung 0.5 g celite kering dan dicuci dengan 2 x 10 ml etanol 78%, 2 x 10 ml aseton, dan dikeringkan dengan oven pada suhu 105 C sampai berat konstan, didinginkan dalam desikator dan ditimbang (D2). Selanjutnya diabukan dalam tanur 500oC selama minimal 5 jam. Dinginkan dalam desikator dan ditimbang (I2). Serat makanan total TDF dan blanko Serat makanan total (TDF) ditentukan dengan menjumlahkan nilai SDF dan IDF. Nilai blanko untuk IDF dan SDF diperoleh dengan cara yang sama namun tanpa menggunakan sampel Nilai IDF (%) = ((D1-I1-B1)/w) x 100% Nilai SDF (%) = ((D2-I2-B2)/w) x 100% Serat Pangan = IDF + SDF Keterangan: 2. W : berat sampel (g) D : berat setelah analisis dan dikeringkan (g) I : berat setelah diabukan (g) B : berat blanko bebas serat (g) Analisis Daya Cerna Pati in vitro (Muchtadi 1989) Daya cerna pati sampel dihitung sebagai persentase terhadap pati murni (soluble starch). Suspensi sampel (1%) dipanaskan dalam penangas air selama 30 menit untuk mencapai suhu 90oC, dan didinginkan. Sebanyak 2 ml larutan sampel dalam tabung reaksi ditambah 3 ml air destilata dan 5 ml larutan buffer Na-fosfat 0,1 M dengan pH 7,0, selanjutnya diinkubasikan pada penangas air 37oC selama 15 menit. Larutan tersebut ditambahkan 5 ml larutan enzim α-amilase dan diinkubasikan pada penangas air 37oC selama 15 menit. Tabung reaksi lain ditempatkan 1 ml campuran reaksi, dan ditambahkan 2 ml pereaksi dinitrosalisilat 22 lalu dipanaskan dalam penangas air 100oC selama 10 menit. Setelah didinginkan, campuran reaksi diencerkan dengan menambahkan 10 ml air destilata. Warna oranye–merah yang terbentuk dari campuran reaksi diukur absorbansinya menggunakan spektrofotometer pada panjang gelombang 520 nm. Kadar maltosa dari campuran reaksi dihitung dengan menggunakan kurva standar maltosa murni yang diperoleh dengan cara mereaksikan larutan maltosa standar dengan pereaksi dinitrosalisilat menggunakan prosedur seperti di atas. Daya cerna sampel dihitung sebagai persentase terhadap pati murni: Daya cerna = 3. x 100% Uji Indeks Glikemik (Miller et. al. 1996; El 1999) Setiap porsi penyajian produk olahan snack yang akan ditentukan IG-nya mengandung 50 g karbohidrat. Produk tersebut diberikan kepada relawan yang telah menjalani puasa penuh (kecuali air) selama semalam (sekitar pukul 22.00 sampai pukul 08.00 keesokan harinya). Panelis yang digunakan terdiri atas dua kategori yaitu individu normal (non DM) sebanyak 10 orang, serta 10 individu penderita diabetes (DM). Sebelum konsumsi sampel, responden normal dan DM diambil contoh darahnya sebanyak 50 μL sampel darah dari ujung jari (finger-prick capillary blood samples method) dan diukur kadar glukosanya. Hasilnya dinyatakan sebagai kadar glukosa darah puasa (kadar glukosa menit ke-0). Setelah konsumsi produk sebanyak 50 μL sampel darah diambil kembali dari ujung jari setiap 30 menit untuk diukur kadar glukosanya (pengukuran kadar glukosa menit ke-30, 60, 90, dan 120). Sebagai standar, responden diberikan 50 gram glukosa murni. Kadar glukosa darah (pada waktu setiap pengambilan sampel) diplotkan pada dua sumbu, yaitu sumbu waktu (x) dan sumbu kadar glukosa darah (y). Indeks glikemik ditentukan dengan membandingkan luas daerah di bawah kurva antara pangan yang diukur IG-nya dengan pangan acuan (glukosa murni) dikalikan 100 (Miller et al. 2003). Indeks Glikemik = L L A A x 100 23 Beban glikemik Konsep beban glikemik diperkenalkan dengan perhitungan yang sederhana, yaitu mengalikan nilai IG suatu makanan dengan kandungan karbohidrat per sajian kemudian dibagi 100 (Leeds et al. 2003). Beban Glikemik = 4. IG K Analisis Fisik Analisis fisik merupakan analisis yang mendeskripsikan mengenai kondisi fisik dari produk yang diteliti. Analisis fisik dalam penelitian ini dilakukan secara obyektif dan subyektif. Analisis fisik yang dilakukan secara obyektif adalah uji warna (Chromameter) dan kekerasan (Rheoner). Analisis fisik secara subyektif dilakukan melalui uji evaluasi sensori. Berbagai analisis fisik yang dilakukan dalam penelitian ini antara lain: a. Analisis Warna (Metode Hunter) Pengukuran warna dilakukan dengan menggunakan alat Chromameter CR-300 (Minolta Camera, Co. Japan 82281029). Sebelum digunakan alat ini dikalibrasi dengan standar warna putih. Sampel diletakkan pada tempat yang tersedia, setelah menekan tombol start diperoleh nilai L, a dan b. ketiga parameter tersebut merupakan ciri notasi warna Hunter. Notasi L berkisar antara 0 (hitam) hingga 100 (putih). Notasi a menyatakan warna kromatik campuran merah-hijau dangan nilai +a (positif) dari 0 sampai +100 untuk warna merah dan nilai –a (negatif) dari 0 sampai -80 untuk warna hijau. Notasi b menyatakan warna kromatik campuran birukuning dengan nilai +b (positif) dari 0 sampai +70 untuk warna kuning dan nilai –b (negatif) dari 0 sampai –80 untuk warna biru. Selanjutnya dari nilai a dan b dapat dihitung 0Hue dengan rumus: 0 Hue = tan-1 24 Jika hasil yang diperoleh: 180 – 540 Maka produk berwarna red (R) 540 – 900 Maka produk berwarna yellow red (YR) 900 – 1260 Maka produk berwarna yellow (Y) 1260 – 1620 Maka produk berwarna yellow green (YG) 1620 – 1980 Maka produk berwarna green (G) 1980 – 2340 Maka produk berwarna blue green (BG) 2340 – 2700 Maka produk berwarna blue (B) 2700 – 3060 Maka produk berwarna blue purple (BP) 3060 – 3420 Maka produk berwarna purple (P) 3420 - 180 Maka produk berwarna red purple (RP) b. Analisis Tekstur, Rheoner Parameter tekstur yang diukur pada produk snack fruit soy bar adalah kekerasan. Kekerasan didefinisikan sebagai gaya maksimal yang dibutuhkan untuk memecahkan sampel. Pengukuran dilakukan pada snack dengan menggunakann Rheoner. Probe yang digunakan adalah silinder berujung runcing (d = 2mm). Kekerasan diperoleh dari nilai puncak tertinggi selama pengujian dikalikan skala pada kertas pengujian. c. Uji evaluasi sensori Uji evaluasi sensori yang diatur pada penelitian ini adalah uji rating hedonik dan uji ranking hedonik. Sampel yang diujikan secara subyektif melalui evaluasi sensori ini adalah fruit soy bar. Uji rating hedonik dievaluasi melalui penilaian karakteristik sensori yang meliputi aroma, warna, kekerasan, tekstur dan rasa. Skor penilaian berkisar antara 1 (sangat tidak suka) hingga 5 (sangat suka). Uji rating hedonik dilakukan dengan tanpa membandingkan karakteristik sensori antar produk. Uji lanjut rating hedonik adalah Duncan test melalui SPSS. Uji ranking hedonik dilakukan untuk mengetahui tingkat kesukaan konsumen dengan membandingkan keseluruhan karakteristik sensori antar 25 produk. Skor penilaian berkisar antara 1 (paling disukai) hingga 4 (paling tidak disukai). Uji lanjut ranking hedonik adalah Friedman test melalui SPSS. 26