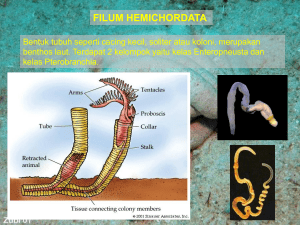
BAB I - Blogs Unpad
advertisement

BAB I MEDIA Media adalah suatu substrat yang digunakan untuk menumbuhkan dan mengembangbiakkan mikroorganisme. Syarat-syarat Media 1. Mengandung komposisi : • Air • Sumber energi metabolik (fermentasi, respirasi, fotosintesis) • Zat hara (sumber karbon, nitrogen, sulfur, fosfor, oksigen, hidrogen & trace elements) • Asam amino, vitamin, nukleosida 2. Memiliki pH, temperatur dan tekanan osmotik yang sesuai dengan kebutuhan mikroorganisme. 3. Steril, agar tidak ditumbuhi oleh mikroorganisme pencemar. Fungsi Komponen-komponen Media Mayoritas sel terdiri atas karbon, oksigen, hidrogen, nitrogen, fosfor. Senyawa diatas dibutuhkan dalam pembentukan membran sel, protein, asam nukleat dan struktur lain dari sel. Senyawa tersebut diatas dibutuhkan dalam jumlah banyak, meliputi 1% dari berat kering sel, disebut MAKRONUTRIEN. Senyawa lainnya yang dibutuhkan dalam jumlah yang lebih kecil antara lain kalsium, potassium, magnesium, sulfur, besi, mangan. Senyawa ini disebut MIKRONUTRIEN. Mikronutrien meliputi 0.1-1.0% dari berat kering sel. Walaupun dibutuhkan dalam jumlah yang sedikit, mikronutrien berperan penting dalam fungsi sel. HANDBOOK OF TA HAYATI 1 Trace elements dibutuhkan dalam jumlah yang sangat kecil yang sukar ditentukan. Jumlah yang dibutuhkan adalah <0.1%. Growth factors (faktor pertumbuhan) adalah molekul organik yang dibutuhkan dalam pertumbuhan dan tidak bisa disintesis oleh mikroorganisme itu sendiri, misalnya vitamin, asam amino dan nukleotida. Faktor pertumbuhan juga merupakan substansi kimia yang digunakan oleh mikroorganisme untuk proses biosintesis dan sebagai sumber energi.. Pengaruh pH, temperatur dan tekanan osmotik terhadap pertumbuhan mikroorganisme pH bila mikroorganisme tumbuh, pH media sering berubah-ubah Mikroorganisme yang melakukan fermentasi menghasilkan asam pH 3.5 Pada saat terjadi metabolisme protein dan asam amino melepaskan ion ammonium basa pH optimum 7, tetapi dapat hidup pada pH 5-8 Suhu optimum pertumbuhan 0-20oC PSIKROFIL Suhu optimum pertumbuhan 20-50oC MESOFIL Suhu optimum pertumbuhan 50-100oC THERMOFIL ISOTONIK konsentrasi cairan ekstrasel = konsentrasi cairan intrasel tidak terjadi perpindahan cairan dari dalam sel ke luar sel. HIPERTONIK konsentrasi cairan ekstrasel > konsentrasi cairan intrasel terjadi dehidrasi dan pengkerutan sel (PLASMOLISIS). HIPOTONIK konsentrasi cairan ekstrasel < konsentrasi cairan intrasel terjadi pembengkakan. Jenis media Berdasarkan konsistensi : • Media padat (agar/gelatin) • Dibuat dengan cara menambahkan agen pemadat, misalnya agar, gelatin atau silica gel ke dalam media cair. HANDBOOK OF TA HAYATI 2 • Agen pemadat yang baik adalah tidak diuraikan oleh mikroorganisme, tidak menghambat pertumbuhan mikroorganisme, tidak mencair pada suhu ruang. • Agar dan silica gel tidak mencair pada suhu ruang dan tidak diuraikan oleh mikroorganisme. Sebaliknya, gelatin, diuraikan oleh mikroorganisme dan mencair pada suhu ruang. • Contoh : agar nutrien, agar darah, Saboraud’s agar. • Media cair (broth) • Meliputi nutrient broth (kaldu nutrien), citrate broth, glucose broth, litmus milk dsb. • Media cair digunakan dalam propagasi banyak mikroorganisme, uji fermentasi dan uji lainnya. • Media semi-padat Berdasarkan kimiawi : • Media sintetik • Media non-sintetik (alami) Berdasarkan sifat : • Media Umum – Untuk pertumbuhan atau perkembangan satu atau lebih kelompok mikroorganisme. • Media Pengaya – Untuk memberikan kesempatan terhadap suatu jenis/kelompok mikroorganisme untuk tumbuh dan berkembang biak lebih cepat dari jenis/kelompok lain dalam satu media. • Media Penguji – Media yang digunakan untuk pengujian senyawa atau benda tertentu dengan bantuan mikroorganisme. • Media Perhitungan – Media yang digunakan untuk menghitung jumlah mikroorganisme pada suatu bahan HANDBOOK OF TA HAYATI 3 Media Selektif – Media yang hanya menumbuhkan mikroorganisme yang diinginkan saja yang dapat tumbuh karena tidak adanya nutrien penting bagi mikroorganisme yang tidak diinginkan untuk tumbuh dan kehadiran substansi inhibitor seperti NaCL, asam, kristal violet (toksik), antibiotika (misal : streptomisin) dsb. Media Diferensial – Media yang mengandung substansi yang dapat menyebabkan munculnya karakteristik dari masing-masing mikroorganisme yang ditumbuhkan. Contoh media selektif dan diferensial : Levine EMB agar untuk analisis koliform dalam air. Contoh Media HANDBOOK OF TA HAYATI 4 Pembuatan Media Bila tabung/cawan petri yang digunakan untuk pembuatan media sudah dalam keadaan bersih dan bebas kontaminasi, maka tidak perlu dilakukan pencucian. Pencucian dilakukan dengan menggunakan air hangat dan deterjen, bagian dalamnya disikat. Cuci sebanyak dua kali, pada pencucian kedua, gunakan aquadest untuk membersihkan sisa-sisa deterjen yang masih tertinggal. Tempatkan tabung/cawan petri tersebut pada keranjang/rak untuk pengeringan. Jangan dikeringkan dengan menggunakan handuk. Sterilisasi. Pembuatan Media Sintetik • Glukosa 0,2 g • Kalium fosfat 0,1 g • Ammonium klorida 0,05 g • Magnesium sulfat 0,02 g • Feri klorida 0,0005 g • Aquadest 100 ml Siapkan 100 ml kaldu glukosa garam mineral dengan kandungan seperti pada tabel Siapkan labu erlenmeyer 250 ml Masukkan aquadest sebanyak 75 ml HANDBOOK OF TA HAYATI 5 Tambahkan setiap bahan sesuai urutan pada tabel Kocok pada setiap penambahan bahan dan biarkan larut dulu sebelum penambahan bahan berikutnya Tambahkan sisa aquadest sebanyak 25 ml Masukkan 10 ml larutan ke dalam 10 buah tabung dengan menggunakan pipet 10 ml Tutup tabung dengan kapas yang dibalut oleh kain kasa Beri label dan sterilisasi Pembuatan Media Non-Sintetik KALDU NUTRIEN • Pepton 1,0 g • NaCl 1,6 g • Ekstrak daging 0,6 g • Aquadest 200 ml HANDBOOK OF TA HAYATI 6 • Siapkan 1 labu erlenmeyer 250 ml. • Masukkan 150 ml aquadest. • Tambahkan ketiga bahan berikutnya, campur dan kocok pada setiap penambahan bahan. • Tambahkan 50 ml sisa aquadest. • Panaskan larutan ini hingga semua bahan larut. • Ukur pH • Masukkan 10 ml larutan ke dalam 10 tube steril • Tutup tabung • Beri label • Tempatkan ke rak • Sterilkan Untuk membentuk media padat tambahkan 1.5 g agar pada sisa larutan • Panaskan larutan supaya agar larut • Kocok labu supaya agar tidak menempel pada dasar labu • Masukkan 10 ml larutan ke dalam tube steril HANDBOOK OF TA HAYATI 7 • Tutup tabung • Beri label • Tempatkan ke rak • Sterilisasi PERHATIKAN : • Pemanasan larutan dengan menggunakan api bunsen atau electric hot plate. • Tandai tinggi larutan awal sebelum dipanaskan untuk menghindari water loss. • Bila terjadi water loss tambahkan aquadest. • Suhu pemanasan tergantung komposisi medium, ada yang 600C. • Agar akan membeku pada suhu 40-420C. HANDBOOK OF TA HAYATI 8 BAB II STERILISASI Pengertian Suatu proses (dengan metode tertentu) yang memberikan hasil akhir suatu keadaan dimana tidak dapat ditunjukkan lagi adanya mikroorganisme hidup. Prinsip Dasar Sterilisasi • Adanya derajat kontaminasi yang serendah mungkin sebagai pra-kondisi. • Pemilihan metode sterilisasi yang paling tepat. • Ada tolak ukur yang tepat untuk mengukur efisiensi proses sterilisasi atau hasil akhir. • Ada sarana penunjang untuk menjaga mutu hasil akhir produk steril. Dekontaminasi • Jumlah kontaminan tinggi hasil akhir meragukan atau akan membutuhkan waktu proses lebih lama. • Proses dekontaminasi meliputi : - pembilasan - penyikatan - pencucian (dengan desinfektan), baik dengan manual/alat Pemilihan Metode Sterilisasi • Sifat bahan yang akan disterilkan. • Proses yang paling mudah, murah, namun cukup efektif. HANDBOOK OF TA HAYATI 9 Cara sterilisasi menurut FI Ed. IV 1. Sterilisasi Panas Basah (Uap) – Proses sterilisasi termal menggunakan uap jenuh di bawah tekanan berlangsung di suatu bejana yang disebut autoclave. – Metode yang paling sering digunakan. – Suhu 1210C selama 15-20’ tergantung bahan/prosedur sterilisasi. – Prinsip : Udara di dalam bejana diganti dengan uap jenuh. Fase Siklus Sterilisasi – Pemanasan/Vakum (Conditioning) – Fase Pemaparan Uap (Exposure) 132°C 2’ 121°C 12’ 116°C 30’ – Pembuangan Uap (Exhaust) – Fase Pengeringan (Drying) Metode ini paling banyak digunakan karena : • Hampir 80% alat dan bahan dapat disterilkan dengan metode ini, seperti karet. • Biaya operasional cukup rendah dibanding metode lain. • Temperatur merata pada setiap tempat selama proses. • Cepat dan hasil kering. HANDBOOK OF TA HAYATI 10 Bejana autoclave Prinsip kerja autoclave HANDBOOK OF TA HAYATI 11 2. Sterilisasi Panas Kering – Alat : Oven – Prinsip : • Udara dipanaskan dan disaring. • Didistribusikan secara merata ke seluruh bejana dengan cara sirkulasi atau radiasi. – Temperatur dan waktu yang digunakan : • 1500C 60-150’ • 1600C 45-120’ • 1700C 20-60’ • 1800C 20-30’ Kelebihan : – Hasil kering. – Dapat digunakan untuk semua bahan termostabil, seperti alat-alat gelas. – Mudah dilaksanakan. Kekurangan : – Waktu yang dihabiskan cukup lama. – Penetrasi panas terbatas pada lapisan tertentu. – Dibutuhkan tenaga listrik cukup besar. Oven HANDBOOK OF TA HAYATI 12 3. Sterilisasi Gas • Sebagai alternatif dari sterilisasi termal dilakukan bila bahan yang disterilkan tidak tahan terhadap suhu tinggi seperti pada proses sterilisasi uap atau panas kering. • Daya penetrasi dan absorpsi tinggi sehingga sterilisasi dapat dilakukan pada pembungkus akhir. • Sterilisasi dengan menggunakan gas kimia : Etilen oksida (EtO2) • Sifat : mudah meledak dan iritatif. • Dalam perdagangan dicampur dengan gas CO2 atau freon dalam kadar 1090%. • Mekanisme kerja : melalui alkilasi gugus biologis esensial dari mikroorganisme. • Meninggalkan residu toksik. • Mutagenik. • Afinitas tinggi sehingga perlu diangin-anginkan sebelum digunakan, tujuan untuk menghilangkan EtO2 yaitu selama 8-30 jam pada 450C atau 4-10 hari pada temperatur kamar. Formaldehida – Mekanisme kerja : • Melalui ikatan dengan gugus imino dan amino dari protein mikroorganisme. – Keunggulan dibanding etilen oksid : • Lebih murah • Kurang meninggalkan residu • Tidak mudah meledak • Kurang toksik HANDBOOK OF TA HAYATI 13 4. Sterilisasi dengan radiasi ion Digunakan sinar beta (sinar elektron) dari generator Van De Graaf. Atau sinar gamma. Sterilisasi dingin karena dilakukan pada temperatur kamar. Kemampuan daya tembus baik penyebaran energi homogen. 5. Sterilisasi dengan penyaringan/filtrasi Digunakan untuk mensterilkan udara atau bahan dalam bentuk cairan. Contohnya adalah filter udara seperti HEPA ( High Efficiency Particulated Air) untuk menghindari terjadinya kontaminasi atau infeksi silang. HEPA Filter 6. Sterilisasi dengan radiasi ultraviolet (UV) Efek maksimum : pada gel. radiasi 265 nm Aplikasi : • Untuk sterilisasi ruangan/udara. • Inaktivasi mikroorganisme pada permukaan bahan. • Produk yang tidak stabil, dan sulit disterilkan dengan cara konvensional. HANDBOOK OF TA HAYATI 14 INDIKATOR STERILISASI • Indikator Fisik/Mekanik • Indikator Kimia • Indikator Biologis INDIKATOR FISIK/MEKANIK • Bagian dari mesin sterilisasi. • Biasanya menunjukkan bahwa alat berfungsi baik. • Contoh : Pada alat high prevacum autoclave yang menunjukkan hub. T dan P konstan proses sterilisasi sempurna. INDIKATOR KIMIA • Yaitu indikator dari bahan kimia yang pada temperatur tertentu (± 121OC) akan berubah warna. • Contoh : autoclave tape, wipack med. HANDBOOK OF TA HAYATI 15 INDIKATOR BIOLOGIS Menggunakan bakteri thermophilus dan kertas pH/pH meter. Kontrol Kualitas Selain dengan penggunaan indikator, kontrol kualitas sterilisasi juga dapat dilakukan dengan kalibrasi alat secara periodik dan ditetapkan standar deviasinya. HANDBOOK OF TA HAYATI 16 BAB III INOKULASI MIKROORGANISME INOKULASI=KULTUR=BIAK=TUMBUH Inokulasi adalah penempatan sesuatu dengan tujuan penumbuhan atau reproduksi. Inokulasi mikroorganisme penempatan mikroorganisme dari suatu suspensi ke media steril agar dapat tumbuh dan berkembangbiak. Media steril yang dimaksud disini media padat dan cair dalam petri/tabung. Ketika kita akan mengamati dan mempelajari flora bakteri pada tubuh, tanah, air, makanan dan lingkungan sekitar kita lainnya, kita akan menemukan populasi mikroorganisme campuran. Mikroorganisme jarang ditemukan dalam satu spesies. Hal yang penting dilakukan agar dapat mempelajari karakteristik kultur, morfologi dan fisiologi satu spesies mikroorganisme adalah pemisahan mikroorganisme tersebut dari spesies lainnya. Dengan kata lain, kita harus membuat suatu biakan murni dari mikroorganisme tersebut. Pure culture = biakan murni. BIAKAN MURNI Bagaimana memperoleh suatu biakan murni teknik aseptik. Tidak tercemar dari luar biasanya dari udara. Media yang digunakan harus steril. Untuk memperoleh biakan murni dapat dilakukan pengenceran dengan menggunakan bahan cair atau bahan padat. HANDBOOK OF TA HAYATI 17 TEKNIK ASEPTIK Teknik aseptik mengacu pada praktek yang dilakukan oleh para ahli mikrobiologi untuk mematikan seluruh mikroorganisme yang dapat mencemari media, sel/jaringan hidup dan suatu proses pemindahan mikroorganisme pada biakan. Transfer atau pemindahan meliputi pemindahan suatu mikroorganisme dari koloninya pada media padat ke media cair atau inokulasi mikroorganisme pada suatu media padat maupun cair (Dibutuhkan saat memindahkan mikroorganisme dari suspensi mikroorganisme ke media steril). Suatu proses aseptik dikatakan sukses apabila tidak terdapat mikroorganisme pencemar yang dapat mencemari proses. HANDBOOK OF TA HAYATI 18 Prosedur Umum Desinfeksi area kerja. o Area kerja harus didesinfeksi terlebih dahulu untuk mengurangi kontaminan yang dapat mencemari proses aseptik. Ose dan jarum harus steril. o Cara sterilisasi adalah dengan cara fiksasi dengan panas/pemijaran menggunakan lampu bunsen. o Pemanasan dapat mematikan mikoorganisme pencemar. Pemijaran/pemanasan pada tabung. o Pada mulut tabung terkandung mikroorganisme yang dapat mencemari biakan. Oleh karena itu, lakukan pemijaran/pemanasan pada mulut tabung menggunakan lampu bunsen. Desinfeksi akhir. o Setelah melakukan suatu proses aseptik, lakukan desinfeksi akhir untuk mematikan mikroorganisme yang kemungkinan tertinggal. Teknik Biakan Murni Teknik Penggoresan Agar (Streak plate method) Teknik Agar Tuang (Pour plate method) Teknik Agar Sebar Teknik Tusukan gelatin Media Biakan Media biakan yang digunakan pada inokulasi : Media pembiakan dasar Media pembiakan penyubur Media pembiakan selektif HANDBOOK OF TA HAYATI 19 Media Pembiakan Dasar Adalah media pembiakan sederhana yang mengandung zat-zat yang umum diperlukan oleh sebagian besar mikroorganisme dan dipakai sebagai komponen dasar dalam pembuatan media pembiakan lainnya. Mengandung pepton dan ekstrak daging. Media Pembiakan Penyubur Komponen sama seperti pada media pembiakan dasar, ditambah darah, ekstrak hati, dsbnya. Zat tambahan untuk mempersubur pertumbuhan mikroorganisme tertentu, yang pada media pertumbuhan dasar tidak dapat tumbuh dengan baik. Media Pembiakan Selektif Menghambat pertumbuhan mikroorganisme lain yang tidak dicari. Berdasarkan konsistensi : Bentuk cair broth Bentuk padat (lempeng, miring, tegak) BIAKAN MURNI Dengan biakan murni nantinya akan diperoleh koloni terpisah yang mengandung satu macam mikroorganisme dalam satu petri. Hasil akhir koloni yang terpisah. Urutan : Suspensi mikroorganisme campuran biakan murni isolasi (satu macam mikroorganisme). Setelah mendapatkan biakan murni, lakukan proses identifikasi mikroorganisme. HANDBOOK OF TA HAYATI 20 STREAK PLATE METHOD Dikenal dengan teknik penggoresan agar. Metode ini hemat waktu dan ekonomis, hanya saja membutuhkan keterampilan menggores yang dapat diperoleh dengan pengalaman. Penggoresan yang baik nantinya akan dapat menghasilkan isolat yang baik. Untuk mendapatkan koloni terpisah pada saat penggoresan, perhatikan : o Dinginkan ose setelah dipijarkan. Gunakan ose yang telah dingin untuk menggores pada permukaan lempengan agar. Ose yang panas akan mematikan mikroorganisme sehingga tidak terjadi pertumbuhan pada bekas goresan. o Ose disentuhkan pada lempengan agar. Pada saat menggores, ose dibuat meluncur diatas permukaan lempengan agar. Agar jangan sampai terluka, karena agar yang luka mengganggu pertumbuhan mikroorganisme sehingga nantinya akan sulit memperoleh koloni terpisah. o Pijarkan ose setelah menggores satu daerah. Pemijaran ose mematikan mikroorganisme yang melekat pada mata ose dan mencegah pencemaran pada penggoresan daerah berikutnya. o Gunakan tutup cawan petri untuk melindungi permukaan agar dari pencemaran. o Balikkan lempengan agar untuk mencegah air kondensasi jatuh ke atas permukaan agar. o Apabila air kondensasi jatuh ke koloni, akan menghancurkan koloni dan seluruh teknik biakan yang telah dilakukan. HANDBOOK OF TA HAYATI 21 Beberapa teknik goresan : Goresan T : Lempengan dibagi menjadi 3 bagian dengan membentuk huruf T pada bagian luar dasar petri. Inokulasi daerah I sebanyak mungkin dengan gerakan sinambung. Panaskan ose dan biarkan dingin kembali. Gores ulang daerah I sebanyak 3-4 kali dan teruskan goresan di daerah II. Pijarkan ose dan biarkan dingin kembali. Ulangi prosedur 3-5 untuk menggores daerah III. Pijarkan ose. Goresan Kuadran : Sama dengan goresan T, hanya saja lempengan agar dibagi 4. Goresan Radian Goresan dimulai di bagian pinggir lempengan. Pijarkan ose dan dinginkan kembali. Putar lempengan agar 900 dan buat goresan terputus dimulai dari bagian pinggir lempengan. Putar lempengan agar 900 dan buat goresan terputus diatas goresan sebelumnya. Pijarkan ose. Goresan Sinambung Ambil satu mata ose suspensi dan gores secara sinambung pada setengah permukaan lempengan agar. Jangan pijarkan ose, putar lempengan 1800, gunakan sisi mata ose yang sama dan gores pada sisa permukaan lempengan agar. HANDBOOK OF TA HAYATI 22 Contoh hasil penggoresan POUR PLATE METHOD Dikenal dengan teknik agar tuang. Isolasi menggunakan media cair dengan cara pengenceran. Dasar melakukan pengenceran adalah penurunan jumlah mikroorganisme sehingga pada suatu saat hanya ditemukan satu sel dalam tabung. Pada metode ini, dilakukan pengenceran satu mata loop suspensi ke dalam tiga tabung, sehingga akan diperoleh lempengan dengan jumlah bakteri yang optimum untuk isolasi. Teknik ini lebih mudah karena tidak memerlukan keterampilan seperti pada teknik penggoresan. HANDBOOK OF TA HAYATI 23 TEKNIK AGAR SEBAR Langkah pertama sama dengan POUR PLATE METHOD. Kemudian media agar yang telah ditanami oleh mikroorganisme disebari oleh cairan dibantu dengan suatu alat penyebar yang telah disterilkan. Alat penyebar terbuat dari gelas. Cara : Pipet 0,1 ml cairan dari botol pengencer dan biarkan cairan mengalir ke atas permukaan agar. Cairan disebarkan dengan alat penyebar. Sterilisasi penyebar dilakukan dengan mencelupkan ke alkohol dipanaskan. Setelah itu penyebar didinginkan terlebih dahulu sebelum digunakan untuk menyebarkan cairan di permukaan agar. Penyebaran dilakukan dengan memutar petri. TEKNIK TUSUKAN Menggunakan jarum (needle), bukan ose. Jarum (needle) ditusukkan hingga ke dasar media. Sterilisasi jarum (needle) sama dengan ose. Media gelatin. HANDBOOK OF TA HAYATI 24 Cara Pemeriksaan Pertumbuhan Mikroorganisme Media Pembiakan Cair Media menjadi keruh merata (homogen) atau tampak granuler melekat pada dinding dan dasar tabung. Permukaan cairan berbentuk membran. Apakah pertumbuhan menghasilkan gas atau tidak. Apakah pertumbuhan menimbulkan bau yang khas. KOLONI Sifat Koloni Adalah sifat yang berhubungan dengan bentuk, susunan, permukaan, pengkilatan dsb. Dapat diamati tanpa mikroskop makroskopi. Media Pembiakan Padat Pada semua media pembiakan padat umumnya, baik yang berbentuk lempeng maupun miring perlu diperhatikan sifat-sifat koloni: Bentuk koloni koloni bulat, memanjang, tepi rata, tidak rata. Ukuran koloni menurut diameter rata-rata, ukuran koloni berbeda-beda pada berbagai jenis, selebar titik hingga menutupi permukaan media. Kenaikan permukaan koloni yang rata dengan permukaan media, ada koloni yang timbul diatas permukaan media. HANDBOOK OF TA HAYATI 25 Sifat-sifat Umum Koloni Halus kasarnya permukaan koloni yang permukaannya halus, ada juga yang kasar. Wajah permukaan koloni yang permukaannya mengkilap, ada yang kusam. Warna keputihan atau kekuning-kuningan, kemerah-merahan, coklat, jingga, biru, hijau, ungu. Kepekatan koloni lunak seperti lendir, lunak seperti mentega, ada juga yang keras dan kering. Bau koloni ada koloni yang berbau khas dan ada yang tidak berbau sama sekali. Gambar contoh koloni baik pada media cair (broth), agar, maupun gelatin HANDBOOK OF TA HAYATI 26 TEKNIK SUBKULTUR Langkah selanjutnya setelah mendapatkan biakan murni adalah memindahkan mikroorganisme dari cawan petri ke tabing berisi nutrient broth atau nutrient agar (subkultur). Hasil dari subkultur kemudian diinkubasi selama 24 jam. Pewarnaan mikroorganisme dilakukan untuk memeriksa apakah sudah terbentuk biakan yang benar-benar murni atau belum. Ketika memindahkan mikroorganisme dari suatu cawan petri yang mengandung media, sebaiknya menggunakan jarum yang ditusukkan. Jarum ditusukkan pada bagian tengah koloni untuk mendapatkan koloni yang benar-benar mengandung satu macam mikroorganisme saja. HANDBOOK OF TA HAYATI 27 BAB IV PEWARNAAN BAKTERI BAKTERI Hanya dapat dilihat dengan mikroskop mikroskopi. Satuan untuk ukuran bakteri mikron. Bakteri rata-rata berukuran lebar 0,5-1 mikron dan panjang hingga 10 mikron. 1 mikron = 10-3 mm. BENTUK BAKTERI Bulat/bola : Monococcus e.g. Neisseria gonorrhoeae (penyebab kencing nanah). Diplococcus e.g. Diplococcus pneumoniae (penyebab penyakit pneumonia). Sarkina. Streptococcus. Staphylococcus. Batang (Basil) Basil tunggal e.g. Salmonella typhi (penyebab penyakit tifus). Diplobasil Streptobasil e.g. Bacillus anthracis (penyebab penyakit antraks). HANDBOOK OF TA HAYATI 28 Melilit Spiral; sel tubuh umumnya kaku. e.g. Spirillum. Vibrio; seperti koma. e.g. Vibrio cholerae (penyebab penyakit kolera). Spirochaeta; dapat memanjang dan memendek karena sifatnya yang sangat lentur. PEWARNAAN BAKTERI Tubuh bakteri tidak mengadsorpsi dan membiaskan cahaya sehingga sukar diamati walau sudah menggunakan mikroskop. Untuk melihat bakteri dengan jelas tubuhnya diisi dengan zat warna PEWARNAAN BAKTERI. Zat warna mengadsorpsi dan membiaskan cahaya sehingga kontras tubuh bakteri dengan sekelilingnya ditingkatkan o Sudah dilakukan sejak pertengahan abad ke-19, oleh Louis Pasteur dan Robert Koch. o Ada 2 macam zat warna yang sering dipakai: Zat warna bersifat asam : komponen warnanya adalah anion (-). Zat warna bersifat alkali : komponen warnanya adalah kation (+). Muatan negatif banyak ditemukan pada dinding sel, membran sel, dan sitoplasma muatan positif pada zat warna alkali akan berikatan dengan muatan negatif dalam sel bakteri akan lebih jelas terlihat. Zat warna asam digunakan untuk mewarnai bagian sel yang bermuatan positif. Pewarnaan Positif : Yang diwarnai adalah bakteri. Bisa menggunakan zat warna asam dan alkali Pewarnaan Negatif Beberapa bakteri sukar diwarnai dengan zat warna alkali lakukan pewarnaan negatif. Latar belakang di sekeliling bakteri diwarnai untuk meningkatkan kontras dengan bakteri yang tidak berwarna. HANDBOOK OF TA HAYATI 29 Cara bakteri dicampur dengan nigrosin gesekkan di object glass zat warna akan mewarnai lingkungan sekitar bakteri, bukan bakteri dengan mikroskop, bakteri akan terlihat tidak berwarna dengan latar belakang hitam. Pada metode ini preparat tidak dipanaskan, tetapi dikeringkan di udara. Ciri pewarnaan negatif : Menggunakan zat warna asam (bermuatan negatif). Penggunaan zat warna asam menyebabkan zat warna tidak akan mewarnai permukaan sel yang mempunyai muatan negatif. Pewarnaan ini bukan merupakan pewarnaan sel bakteri karena sel bakteri tetap tidak berwarna setelah penambahan zat warna. Larutan zat warna yang digunakan larutan encer (<1%). Larutan encer yang dibiarkan berkontak agak lama dengan bakteri bekerja lebih baik dari larutan pekat dengan waktu yang singkat. Setelah dilakukan pewarnaan, dalam tubuh bakteri akan terjadi proses pertukaran ion-ion zat warna dengan ion-ion yang terdapat pada bagian tubuh/sel bakteri. MORDANT Zat yang dapat bergabung dengan komponen zat warna tertentu, sehingga terbentuk senyawa yang tidak dapat larut dan melekat pada tubuh bakteri. Contoh : ammonium oksalat, fenol, asam tanat, garam aluminium, besi, timah, seng, tembaga, krom dll. Cara penggunaan : o Sebelum penambahan zat warna o Dimasukkan ke dalam campuran zat warna o Diberikan antara pemakaian dua larutan zat warna CARA PEWARNAAN Pewarnaan Sederhana Mudah dan cepat Untuk membedakan bakteri dari benda-benda mati lain yang bukan bakteri dan untuk melihat bentuk, ukuran dan penataan bakteri. Zat warna hanya terdiri satu macam yang dilarutkan dalam suatu pelarut. HANDBOOK OF TA HAYATI 30 Misal : kristal violet, methylen blue, safranin (zat warna alkali), nigrosin, merah kongo (zat warna asam). Pewarnaan Khusus Untuk melihat salah satu struktur sel. Pewarnaan Kapsel Pewarnaan Spora Pewarnaan Flagela Pewarnaan Badan Inklusi Pewarnaan Diferensial Digunakan lebih dari satu zat warna. Adakalanya menggunakan pelarut yang sama (satu larutan mengandung dua atau lebih zat warna). Adakalanya menggunakan pelarut yang berbeda. Contoh : pewarnaan Gram, pewarnaan Tahan Asam (Ziehl-Neelsen). Sediaan (preparat) untuk proses pewarnaan Dibuat ulasan bakteri diatas object glass Jumlah bakteri dalam ulasan jangan terlalu padat dan jangan terlalu encer. Apabila terlalu padat, akan terlihat menumpuk di bawah mikroskop. Apabila terlalu cair, tidak akan terlihat dibawah mikroskop. Keringkan di udara sebentar. Fiksasi melewatkan preparat diatas api. Fiksasi berguna untuk melekatkan bakteri pada object glass dan mematikan bakteri. Proses pewarnaan. HANDBOOK OF TA HAYATI 31 PEWARNAAN KHUSUS Pewarnaan Kapsel Kapsel lapisan yang melekat di luar dinding sel yang terdiri dari polisakarida atau polipeptida. Fungsi kapsel melindungi bakteri terhadap sel fagosit. Bacillus anthracis, Streptococcus pneumoniae, S.mutans. Lapisan kapsel tebal, sukar diwarnai Jadi digunakan pewarnaan negatif. Pada pewarnaan negatif latar belakang diwarnai zat warna asam, sedangkan bakteri diwarnai dengan zat warna alkali. Kapsel tidak menyerap warna sehingga terlihat sebagai lapisan tembus-terang dengan latar belakang yang berwarna. Pewarnaan Spora Spora pada bakteri struktur tahan panas dan bahan kimia. Spora dibentuk oleh bakteri pada saat keadaan/ lingkungan tidak menguntungkan. Bacillus, Clostridium. Lapisan luar spora penahan yang baik terhadap bahan kimia, sehingga spora sukar diwarnai. Spora bakteri diwarnai dengan cara dipanaskan. Pemanasan menyebabkan lapisan luar spora mengembang, sehingga zat warna dapat masuk. Pewarnaan Flagela Flagela tipis dan panjang sukar dilihat di bawah mikroskop cahaya. Flagela pada bakteri sebagai alat gerak. Pewarnaan menggunakan mordant untuk membengkakkan flagela. Pewarnaan Badan Inklusi Beberapa bakteri mensintesis badan inklusi atau granula yang disimpan dalam sitoplasma. HANDBOOK OF TA HAYATI 32 Granula cadangan bahan makanan dan merupakan sumber karbon dan energi yang siap pakai. Dalam sel bakteri badan inklusi berupa granula metakromatik, asam poli-betahidroksibutirat, pati dan glikogen. PEWARNAAN DIFERENSIAL Pewarnaan Gram Dilakukan pertama kali oleh Christian Gram. Paling banyak digunakan di laboratorium. Untuk memisahkan bakteri menjadi kelompok Gram-positif dan Gram-negatif. Bakteri Gram-positif berwarna ungu disebabkan kompleks zat warna kristal violetiodium tetap bertahan walaupun sudah diberi larutan pemucat. Bakteri Gram-negatif berwarna merah karena kompleks tersebut larut sewaktu pemberian larutan pemucat dan menjadi warna merah. Memberikan hasil baik bila digunakan biakan segar berusia 24-48 jam. Biakan segar dinding sel belum mengalami kerusakan. Biakan tua dinding sel sudah mulai mengalami kerusakan zat warna dapat keluar saat diberikan larutan. Gram-positif Gram-negatif Kristal violet Ungu Ungu Larutan mordant Ungu Ungu Ungu Tidak (lugol) Larutan pemucat (aseton, alkohol) Safranin HANDBOOK OF TA HAYATI berwarna Ungu Merah 33 Perbedaan pada tahapan pewarnaan Gram disebabkan oleh : Perbedaan struktur dinding sel bakteri Gram-positif dan Gram-negatif Bakteri Gram-positif : dinding sel mengandung peptidoglikan. Bakteri Gram-negatif : dinding sel mengandung lipida. Pada bakteri Gram-negatif, lipida akan larut saat diberikan larutan pemucat (aseton, alkohol). Kompleks kristal violet-iodium yang terbentuk pada dinding sel juga ikut larut. Safranin. Pada bakteri Gram-negatif, penambahan safranin menyebabkan sel bakteri berwarna merah. Fungsi safranin sebagai pembeda (kontras) terhadap warna kristal violet-iodium. Larutan mordant meningkatkan afinitas pengikatan zat warna oleh bakteri sehingga pengikatan zat warna oleh bakteri menjadi lebih kuat. Setelah penambahan larutan mordant zat warna lebih sulit dilarutkan sehingga zat warna akan lebih jelas terlihat. Larutan mordant lugol. Tanpa penambahan larutan lugol zat warna kristal violet-iodium akan larut sewaktu penambahan larutan pemucat, sehingga bakteri Gram-positif tidak akan berwarna ungu. TABEL PEWARNAAN DIFERENSIAL (pewarnaan Gram) No Bakteri Gram-positif Bakteri Gram-negatif 1 Sensitif terhadap penisilin Sensitif terhadap streptomisin 2 Resisten terhadap alkali;tidak larut Sensitif terhadap alkali;larut oleh oleh 1% KOH 1% KOH Biasanya coccus atau basil Biasanya basil bukan pembentuk pembentuk spora spora Dapat bersifat tahan asam Biasanya tidak pernah tahan 3 4 asam HANDBOOK OF TA HAYATI 34 Pewarnaan Ziehl-Neelsen Untuk memisahkan bakteri menjadi kelompok tahan asam dan tidak tahan asam. TABEL PEWARNAAN DIFERENSIAL (pewarnaan Ziehl-Neelsen) Tahan Asam Tidak Tahan Asam Karbol fuksin Merah Merah Larutan pemucat Merah Tidak berwarna/pucat Merah Biru ( mengandung asam dan alkohol) Biru metilen Zat warna pertama karbol fuksin. Pada bakteri yang tidak tahan asam, setelah diberi larutan pemucat karbol fuksin akan melarut dengan cepat sel bakteri tidak berwarna. Setelah penambahan zat warna kedua (biru metilen) bakteri tidak tahan asam berwarna biru. Mycobacterium dan Nocardia bakteri tahan asam. Memiliki keistimewaan karena dinding sel mengandung lipida yang terlihat sebagai lapisan lilin. Kandungan lipida mencapai 60% dari berat dinding sel sukar diwarnai karena zat warna tidak bisa menembus lapisan lilin. Oleh karena itu, digunakan pemanasan sehingga zat warna dapat masuk ke dalam sel bakteri yang mengandung lipida. HANDBOOK OF TA HAYATI 35 BAB V UJI IDENTIFIKASI BAKTERI Media untuk uji identifikasi bakteri – Endo Agar – Brilliant Green Agar – Mac Conkey Agar – China-Blue Lactose Agar – Manitol Salt Agar – Agar Darah – Litmus Milk Media selektif : mengandung paling sedikit 1 bahan yg menghambat perkembangan bakteri yg tidak diinginkan dan membolehkan perkembangbiakkan bakteri tertentu yg ingin diisolasi. Contoh : antibiotika (streptomycin, penisilin), kristal violet dsb. Media diferensial : berbagai kelompok bakteri dapat tumbuh pada media ini. Kelompok bakteri dapat dibedakan berdasarkan perubahan pada media biakan atau penampilan koloninya. ENDO AGAR Mengandung : laktosa, Na-sulfit Sifat pertumbuhan koloni : Bakteri yang tidak memfermentasikan laktosa terlihat sebagai koloni yang tembus terang, tidak berwarna dan dikelilingi oleh media yang berwarna merah muda. Bakteri yang memfermentasikan laktosa terlihat sebagai koloni yang berwarna merah metalik dan dikelilingi oleh media yang berwarna kemerahan. HANDBOOK OF TA HAYATI 36 TABEL ENDO AGAR Koloni Bakteri Tidak berwarna, bening Laktose negatif (Salmonella, Shigella) Merah metalik Laktose positif (E.coli) Merah muda Enterobacter, Klebsiella, Citrobacter BRILLIANT GREEN AGAR Mengandung gula laktosa dan sukrosa. Zat warna brilliant green menghambat pertumbuhan E. coli, Proteus dan Pseudomonas. Media ini banyak digunakan untuk isolasi dan identifikasi Salmonella dari tinja dan bahan makanan. Indikator : merah fenol merah (basa) , kuning (asam). Sifat pertumbuhan koloni : Salmonella Koloni berwarna merah muda dikelilingi oleh media berwarna merah. Proteus Akan terlihat sebagai koloni merah tanpa penyebaran koloni. Pseudomonas Koloni kecil berwarna merah dengan permukaan yang menjorok ke dalam. Bakteri yang memfermentasikan laktosa atau sukrosa Pertumbuhan kelompok bakteri ini juga dihambat. Akan tampak sebagai koloni hijau-kuning dikelilingi oleh media yang berwarna hijau-kuning. HANDBOOK OF TA HAYATI 37 MAC CONKEY AGAR Mengandung laktosa, garam empedu. Media ini menghambat pertumbuhan bakteri Gram-positif. Koloni dari bakteri Gram-negatif yang memfermentasikan laktosa berwarna merah bata dan dapat dikelilingi oleh endapan garam empedu. Endapan garam empedu karena penguraian laktosa menjadi asam yang akan bereaksi dengan garam empedu. Bakteri yang tidak memfermentasikan laktosa biasanya bersifat patogen tidak memperlihatkan perubahan pada media. Warna koloni = warna media. TABEL MAC CONKEY AGAR Koloni Bakteri Serupa media Salmonella, Shigella Merah, dikelilingi oleh E. coli zona keruh Merah muda Enterobacter, Klebsiella Kecil dan tidak terang Enterococcus, tembus Staphylococcus CHINA-BLUE LACTOSE AGAR Untuk membedakan bakteri yang memfermentasikan dan tidak memfermentasikan laktosa. Tidak ada bahan yang menghambat pertumbuhan bakteri. Bakteri Gram-positif dan Gram-negatif dapat tumbuh pada media ini. Penguraian laktosa menjadi asam akan terlihat karena adanya indikator china blue sehingga warna akan menjadi biru tua. HANDBOOK OF TA HAYATI 38 TABEL CHINA-BLUE LACTOSE AGAR Koloni Bakteri Biru tua dikelilingi oleh zona biru E. coli Putih, kadang-kadang dikelilingi Laktose-negatif zona bening Biru hijau dan tidak terang tembus Staphylococcus Biru muda dan tidak terang tembus Enterococcus MANITOL SALT AGAR Mengandung NaCl 7.5%, manitol. Digunakan untuk membedakan Staphylococcus yang bersifat patogen dan yang tidak patogen. Indikator untuk melihat adanya pembentukan asam merah fenol. Zona warna merah disebabkan oleh manitol yang tidak terfermentasikan. Zona warna kuning disebabkan oleh fermentasi manitol disertai pembentukan asam. Misal : S. aureus membentuk zona kuning patogen. S. epidermidis membentuk zona merah tidak patogen. AGAR DARAH Untuk menumbuhkan bakteri yang sulit untuk dibiakkan dan untuk membedakan kelompok bakteri yang melisis atau tidak melisiskan butir darah merah. Mengandung 5% darah domba. Lisis butir darah merah terlihat sebagai wilayah jernih di sekitar koloni. Jenis-jenis hemolisis : o Beta-hemolisis : lisis sempurna, wilayah benar-benar jernih. o Alpha-hemolisis : proses lisis tidak sempurna, media berwarna kehijauan. HANDBOOK OF TA HAYATI 39 o Gamma-hemolisis : bakteri tidak mampu melisiskan butir darah merah dan tidak menyebabkan perubahan nyata pada media. o Proses hemolisis disebabkan oleh enzim yang dilepaskan bakteri. LITMUS MILK Mengandung skim milk dan indikator litmus. Reaksi yang terjadi : o Asam : Media berubah warna menjadi merah muda. o Basa : Media berubah warna menjadi biru atau ungu. o Reduksi : Media berubah warna menjadi putih. o Koagulasi : Media akan terlihat padat karena koagulasi protein pada keadaan asam. o Peptonisasi : Media berubah warna menjadi biru. o Pembentukan Gas : Terjadi penguraian laktosa menjadi asam dan gas. Contoh media uji identifikasi bakteri Isolasi dan identifikasi mikroorganisme penyebab penyakit ataupun keracunan harus dilaksanakan dengan cepat dan tepat sehingga pengobatan dapat diberikan sedini mungkin. Morfologi mikroorganisme seperti bentuk, ukuran dan penataan belum cukup untuk melakukan identifikasi suatu mikroorganisme. Oleh karena itu, diperlukan teknik lain dalam uji identifikasi mikroorganisme, misalnya sifat biakan HANDBOOK OF TA HAYATI 40 dan uji biokimia. Mikroorganisme yang akan diisolasi berasal dari biakan murni. Setelah biakan murni diperoleh, serangkaian uji dilakukan untuk memperoleh sifat biokimiawi mikroorganisme. Acuan yang digunakan dalam identifikasi bakteri pada saat ini adalah Bergey’s Manual of Systematic Bacteriology. Identifikasi Bergey’s mendasarkan pada morfologi, sifat faal dan sifat biokimiawi bakteri. Adapun tahapan dalam isolasi dan identifikasi bakteri dari suatu suspensi sebagai berikut : 1. Pembiakan ; untuk mengetahui sifat biakan. Suspensi bakteri digoreskan pada agar lempengan, agar miring atau media cair. Koloni yang terbentuk harus diperhatikan untuk mengetahui sifat pertumbuhan bakteri pada biakan. 2. Pewarnaan Pewarnaan Gram dibuat untuk mengetahui sifat Gram serta morfologi bakteri. Jika diperoleh suatu bakteri berbentuk batang Gram-positif, harus ditentukan ada dan tidak adanya endospora serta letaknya. Bakteri berbentuk batang Gram-negatif jarang menghasilkan spora. Jika bakteri yang ditemukan berbentuk batang, Gram-positif dan tidak membentuk spora, maka perlu dilakukan pewarnaan Ziehl-Neelsen. Apabila diperlukan, pewarnaan khusus dapat dilakukan. 3. Uji Biokimia Setelah diperoleh koloni yang terpisah pada biakan, dapat dilakukan uji biokimia. Uji biokimia memerlukan berbagai media, maka perlu dibuat biakan harian (working culture) dari koloni terpisah tersebut. HANDBOOK OF TA HAYATI 41 Penggunaan zat hara pada media (zat pati, lemak, protein, asam nukleat, asam amino, sakarida) tergantung aktivitas metabolisme bakteri. Hasil sampingan dari metabolisme tersebut dapat digunakan untuk identifikasi bakteri. 1. Uji Fermentasi Karbohidrat Hasil akhir fermentasi karbohidrat ditentukan oleh sifat bakteri, media biakan yang digunakan, serta faktor lingkungan antara lain suhu dan pH. Media fermentasi harus mengandung senyawa yang dapat dioksidasikan dan difermentasikan oleh bakteri. Pembentukan asam hasil fermentasi dapat diketahui dengan cara pemberian indikator ke dalam media. Media : Kaldu karbohidrat (glukosa, laktosa, manitol, maltosa dan sukrosa). Media digunakan untuk uji pembentukan asam dan gas hasil fermentasi. Pembentukan gas dapat ditentukan dengan menggunakan tabung Smith atau Durham. Tabung Smith digunakan bila jumlah dan macam gas yang dihasilkan harus ditentukan. Tabung Durham digunakan bila jumlah dan macam gas yang dihasilkan tidak perlu diketahui. Bila terbentuk gas, gas masuk ke dalam tabung Durham dan mendesak cairan dalam tabung ini; gas ini terlihat sebagai gelembung udara yang terperangkap dalam tabung Durham. Asam hasil fermentasi menyebabkan penurunan pH. Indikator yang digunakan : merah fenol dan bromcresol purple. Pembentukan asam ditandai oleh perubahan warna menjadi kuning. HANDBOOK OF TA HAYATI 42 2. Uji Metil Merah Uji metil merah sangat berguna dalam identifikasi kelompok bakteri yang menempati saluran pencernaan. Pada uji fermentasi menggunakan tabung Durham, hasil produksi fermentasi tidak diketahui. Uji metil merah digunakan untuk menentukan adanya fermentasi asam campuran dengan menggunakan media : MR-VP (Methyl Red-Voges Proskauer). Fermentasi asam campuran ditentukan dengan menumbuhkan bakteri dalam kaldu yang mengandung glukosa dan menambahkan indikator metil merah ke dalam kaldu setelah masa inkubasi. Indikator berwarna merah pada pH 4.4 dan berwarna kuning pada pH 6.2. Bila terjadi fermentasi asam campuran kaldu biakan akan tetap berwarna merah karena terjadi penurunan pH pada kaldu biakan. Bila tidak terjadi fermentasi asam campuran maka kaldu biakan akan menjadi berwarna kuning. 3. Uji Voges-Proskauer Uji ini digunakan untuk identifikasi bakteri yang memfermentasikan karbohidrat menjadi 2,3-butanadiol. Asetoin (asetilmetilkarbinol) adalah senyawa pendahulu dari 2,3butanadiol. HANDBOOK OF TA HAYATI 43 Penambahan KOH dan alphanaphtol dapat menentukan adanya asetoin. Pada penambahan KOH, adanya asetoin ditunjukkan oleh perubahan warna kaldu menjadi merah muda. Perubahan warna ini diperjelas dengan penambahan larutan alphanaphtol. Media yang digunakan : MR-VP. 4. Respirasi Karbohidrat Bakteri menggunakan glukosa sebagai sumber energi dengan mengoksidasikannya menjadi piruvat melalui glikolisis. Piruvat masuk ke dalam siklus Krebs. Dalam siklus Krebs, terjadi oksidasi menghasilkan proton dan elektron. Proton dan elektron masuk ke dalam sistem transport elektron untuk menghasilkan ATP. Proton dan elektron akan ditangkap oleh akseptor elektron, misalnya oksigen atau nitrat. Bila akseptor elektron terakhir berupa oksigen, prosesnya disebut respirasi aerobik. Bila akseptor elektron terakhir berupa nitrat atau molekul inorganik lainnya, prosesnya disebut respirasi anaerobik. a. Uji Oksidase o Uji ini berguna untuk menentukan adanya oksidase sitokrom yang ditemukan pada bakteri tertentu. o Uji ini berguna dalam identifikasi bakteri patogen seperti Neisseria gonorrhoea dan Pseudomonas aeruginosa. o Bila koloni bakteri yang bersifat oksidase-positif diberi reagen oksidase (dimetil-p-fenillendiamin oksalat), maka warna koloni berubah menjadi hitam. Perubahan warna ini disebabkan oleh oksidase sitokrom yang HANDBOOK OF TA HAYATI 44 mengoksidasi larutan reagen. Bila tidak terjadi proses oksidasi, misalnya terjadi reaksi reduksi, tidak akan terjadi perubahan warna pada koloni. b. Uji Katalase o Pada bakteri berbentuk coccus, uji katalase berguna untuk membedakan Staphylococcus dan Streptococcus. Kelompok Staphylococcus bersifat katalase-positif, sedangkan kelompok Streptococcus bersifat katalasenegatif. o Uji katalase menggunakan larutan H2O2. Pada bakteri bersifat katalasepositif terlihat pembentukan gelembung udara sekitar koloni. Reaksi : H 2O 2 H 2O 1 / 2O 2 Katalase Gelembung O2 o H2O2 bersifat toksik terhadap sel karena menginaktivasikan enzim dalam sel. o H2O2 terbentuk sewaktu metabolisme aerob, sehingga bakteri yang tumbuh pada lingkungan aerob harus menguraikan zat toksik tersebut. c. Uji Reduksi Nitrat o Nitrat digunakan oleh beberapa bakteri sebagai akseptor elektron terakhir. o Nitrat (NO3-) direduksi menjadi nitrit (NO2-) kemudian menjadi N2. o Kemampuan mereduksikan nitrat digunakan sebagai ciri dalam identifikasi bakteri. E. coli mereduksi nitrat menjadi nitrit, sedangkan P. aeruginosa mereduksi mereduksi nitrat hingga menjadi N2. HANDBOOK OF TA HAYATI 45 o Uji reduksi nitrat menggunakan kaldu nutrien yang mengandung KNO3 dan tabung Durham. Perhatikan apakah terbentuk gas pada tabung serta nitrit pada media biakan. o Gas yang terperangkap dalam tabung Durham merupakan campuran gas N2 dan CO2. o Gas N2 berasal dari penguraian sempurna nitrat, sedangkan CO2 berasal dari siklus Krebs. o Penambahan asam sulfamat dalam media biakan yang mengandung nitrit akan menyebabkan pembentukan gelembung gas (N2) sebagai hasil reduksi (NO2-) menjadi N2. 5. Uji Indol Gugus indol merupakan bagian dari asam amino triptofan. Dalam media biakan, indol menumpuk sebagai produk buangan, sedangkan bagian lain dari molekul triptofan digunakan untuk memenuhi kebutuhan zat hara bakteri. Penumpukan indol dalam media biakan dapat diketahui dengan penambahan reagens (Kovacs, Gore, Ehrlich dan Ehrlich-Bohme) yang mengandung para-dimetil-aminobenzaldehida. Reagens akan bereaksi dengan indol dan menghasilkan senyawa yang tidak larut dalam air dan berwarna merah pada permukaan media biakan. Media yang digunakan bersifat semipadat, oleh karena itu dapat digunakan juga untuk melihat pergerakan bakteri. Jika bakteri bergerak akan terlihat pertumbuhan di sekitar tusukan dan juga pada permukaan media. HANDBOOK OF TA HAYATI 46 6. Uji IMViC Uji untuk membedakan Enterobacter aerogenes dan E. coli. Uji IMViC terdiri dari Uji Indol-Metil Merah-Voges Proskauer-Citrat. TABEL UJI IMViC I M Vi C E. coli + + - - A. aerogenes - - + + 7. Uji Hidrogen Sulfida Asam amino sistein dan metionin dihasilkan saat protein dihidrolisis untuk memenuhi kebutuhan zat hara bakteri. Sistein dan metionin mengandung sulfur. Bakteri yang menghasilkan desulfurase sewaktu dibiakkan dalam media yang kaya dengan asam amino yang mengandung sulfur akan membentuk H2S. Fe++ dalam biakan bereaksi dengan H2S dan menghasilkan senyawa FeS yang berwarna hitam dan tidak larut dalam air. 8. Uji Dekarboksilase Lisin Dekarboksilasi merupakan proses penguraian gugus karboksil dari suatu molekul organik. Proses dekarboksilasi asam amino menghasilkan CO2. HANDBOOK OF TA HAYATI 47 Proses dekarboksilasi lisin dapat diketahui dengan menumbuhkan bakteri dalam biakan yang mengandung lisin, karbohidrat yang dapat difermentasikan (glukosa) dan indikator pH untuk melihat perubahan pH. Indikator yang digunakan adalah brom cresol purple (BCP). Asam yang dihasilkan dalam proses fermentasi glukosa akan menurunkan pH media biakan dan menyebabkan perubahan warna dari ungu menjadi kuning. Dalam suasana asam, proses dekarboksilasi lisin dapat berlangsung sehingga terjadi pembentukan amin yang menetralisasi suasana asam. Proses netralisasi asam ini terlihat sebagai perubahan warna dari kuning menjadi ungu seperti sebelumnya. Perubahan warna ungu ini menunjukkan bahwa lisin mengalami dekarboksilasi. Uji dekarboksilasi lisin merupakan salah satu uji yang digunakan dalam pencirian bakteri, terutama yang menempati saluran pencernaan. 9. Uji Deaminase Fenilalanin Deaminase mengkatalisasi pemindahan gugus amino (NH2) dari asam amino dan molekul lainnya yang mengandung –NH. Asam organik yang dihasilkan dapat digunakan bakteri untuk biosintesis. Proses deaminasi menetralisasi amin yang menghambat pertumbuhan. Uji deaminasi fenilalanin dapat digunakan dalam identifikasi bakteri saluran pencernaan. HANDBOOK OF TA HAYATI 48 Proses deaminasi fenilalanin menghasilkan asam fenilpiruvat. Reaksi asam fenilpiruvat dengan ferri klorida (FeCl3) menghasilkan senyawa berwarna hijau. Aktivitas enzim deaminase fenilalanin ditentukan dengan cara menumbuhkan bakteri dalam media biakan yang mengandung fenilalanin dan menambahkan beberapa tetes larutan FeCl3. Warna hijau setelah penambahan reagens menunjukkan bahwa fenilalanin telah dideaminasikan. 10. Uji Sitrat Uji sitrat digunakan untuk melihat kemampuan bakteri menggunakan sitrat sebagai satu-satunya sumber karbon dan energi. Digunakan media sitrat-Koser (cair) atau sitrat-Simmon (padat). Sitrat-Simmon mengandung Na sitrat (sumber karbon), NH4+ sebagai sumber N dan biru bromtimol sebagai indikator. Pada media sitrat-Koser, tidak terkandung indikator. Bila bakteri mampu menggunakan sitrat yang terkandung pada media sitratSimmon, maka asam akan dihilangkan dari media biakan, terjadi peningkatan pH dan mengubah warna media dari hijau menjadi biru. Pada media sitrat-Koser, kemampuan menggunakan sitrat ditunjukkan oleh kekeruhan yang menandakan adanya pertumbuhan. HANDBOOK OF TA HAYATI 49 BAB VI UJI MIKROORGANISME KUANTITATIF Uji Kuantitatif Bakteri Untuk menentukan jumlah bakteri dapat digunakan beberapa cara, antara lain : Jumlah bakteri secara keseluruhan (total cell count); dihitung semua bakteri baik yang hidup maupun yang mati. Jumlah bakteri yang hidup (viable count); dihitung bakteri yang hidup saja. A. Perhitungan Jumlah Bakteri secara Keseluruhan a. Menghitung langsung secara mikroskopik Digunakan object glass khusus (Petroff-Hauser) berbentuk persegi. Jumlah cairan yang terdapat antara object glass dan kaca penutup memiliki volume tertentu, sehingga satuan isi yang terdapat dalam persegi juga tertentu. Hanya cairan yang mengandung bakteri dalam jumlah tinggi yang dapat menggunakan cara ini. Perhitungan langsung dengan menggunakan mata atau alat bantu hitung. b. Menghitung dengan cara kekeruhan Cara ini menggunakan spektrofotometer atau nefelometer. Cahaya yang diabsorbsi ~ banyaknya sel bakteri. HANDBOOK OF TA HAYATI 50 B. Perhitungan Jumlah Bakteri Hidup 1. standard plate count/hitungan cawan/angka lempeng total. Setiap satu sel bakteri dalam suspensi diasumsikan akan tumbuh menjadi satu koloni setelah diinkubasikan dalam media dan lingkungan yang sesuai. Metode hitungan cawan merupakan cara yang paling sensitif untuk menghitung jumlah bakteri karena : 1. Hanya sel bakteri yang masih hidup yang dihitung. 2. Beberapa jenis bakteri dapat dihitung sekaligus. 3. Dapat digunakan untuk isolasi dan identifikasi bakteri karena koloni yang terbentuk mungkin berasal dari satu sel bakteri dengan penampakan pertumbuhan spesifik. Kelemahan metode hitungan cawan : 1. Hasil perhitungan tidak menunjukkan jumlah sel bakteri yang sebenarnya karena beberapa sel yang berdekatan mungkin membentuk satu koloni. 2. Media dan kondisi yang berbeda menghasilkan nilai yang berbeda. 3. Bakteri yang ditumbuhkan harus dapat tumbuh pada media padat dan membentuk koloni yang jelas. 4. Memerlukan persiapan dan waktu inkubasi beberapa hari sehingga pertumbuhan koloni dapat dihitung. HANDBOOK OF TA HAYATI 51 Metode hitungan cawan : Metode Tuang (Pour Plate) Cara : 1. Dari pengenceran yang dikehendaki, sebanyak 1 ml dipipet ke dalam cawan petri. 2. Kemudian ke dalam cawan petri tersebut, masukkan agar cair yang telah didinginkan hingga 500C ± 15 ml. 3. Cawan petri digerakkan dengan gerakan melingkar untuk menyebarkan sel-sel bakteri secara merata. 4. Setelah agar memadat, cawan petri tersebut diinkubasi dalam inkubator dengan posisi terbalik. 5. Koloni yang terbentuk dihitung. Metode Permukaan (Surface/Pour Plate) Cara : 1. Agar steril dituang ke dalam cawan petri steril, biarkan membeku. 2. Setelah membeku sempurna, kemudian sebanyak 0,1 ml sampel yang telah diencerkan dipipet pada permukaan agar tersebut, ratakan. 3. Inkubasi. 4. Hitung koloni yang terbentuk. HANDBOOK OF TA HAYATI 52 Cara menghitung koloni : Contoh. Penetapan jumlah bakteri dalam susu. Pengenceran awal 1:10 (=10-1) dibuat dengan cara mengencerkan 1 ml susu ke dalam 9 ml larutan pengencer, dilanjutkan dengan pengenceran yang lebih tinggi, misalnya hingga 10-5 atau 10-6, tergantung pada mutu susu. Semakin tinggi jumlah bakteri yang terdapat di dalam susu, semakin tinggi pengenceran yang harus dilakukan. Jika setelah inkubasi misal didapat 60 dan 64 koloni masing-masing pada cawan duplo yang mengandung pengenceran 10-4, maka jumlah koloni dapat dihitung sebagai berikut : Faktor pengenceran (fp) = Pengenceran x jumlah yang ditumbuhkan. = 10-4 x 1.0 = 10-4 Jumlah koloni = Jumlah koloni x 1/fp per cawan = (60+64)/2 x 1/10-4 = 6.2 x 105 HANDBOOK OF TA HAYATI 53 Gambar contoh pengenceran Standar perhitungan (Standard Plate Count) Cara menghitung koloni pada cawan adalah sebagai berikut : 1. Cawan yang dipilih dan dihitung adalah yang mengandung jumlah koloni antara 30 dan 300. Cawan dengan jumlah koloni yang tinggi (>300 koloni) sulit untuk dihitung sehingga kemungkinan kesalahan perhitungan sangat besar. Pengenceran membantu untuk memperoleh perhitungan yang tepat, tetapi pengenceran yang terlalu tinggi akan menghasilkan cawan dengan jumlah koloni yang rendah (<30 koloni). 2. Beberapa koloni yang bergabung menjadi satu merupakan suatu kumpulan koloni yang besar dimana jumlah koloninya diragukan, dapat dihitung sebagai satu koloni. 3. Suatu deretan (rantai) koloni yang terlihat sebagai suatu garis tebal dihitung sebagai satu koloni. HANDBOOK OF TA HAYATI 54 Data yang dilaporkan harus mengikuti peraturan sebagai berikut : 1. Hasil yang dilaporkan hanya terdiri dari dua angka, yaitu angka pertama di depan koma dan angka kedua di belakang koma. Jika angka yang ketiga sama dengan atau lebih besar dari 5, harus dibulatkan satu angka lebih tinggi pada angka yang kedua. Jumlah koloni per pengenceran Standard Plate 10-2 10-3 10-4 Ket Count 234 28 1 2.3 x 104 28 dan 1 <30 700 125 10 1.3 x 105 700>300;10<30 TBUD TBUD 197 2.0 x 106 TBUD >300 * TBUD = Terlalu banyak untuk dihitung 2. Jika semua pengenceran yang dibuat menghasilkan angka kurang dari 30 koloni pada cawan petri, hanya jumlah koloni pada pengenceran terendah yang dihitung. Hasilnya dilaporkan sebagai kurang dari 30 dikalikan dengan besarnya pengenceran, tetapi jumlah yang sebenarnya harus dicantumkan dalam tanda kurung. HANDBOOK OF TA HAYATI 55 Jumlah koloni per pengenceran Standard Ket Plate 10-2 10-3 1 16 10-4 Count <3.0 x 103 Hit. 0 (1.6 x 103) pengenceran pada 10-2 3. Jika semua pengenceran yang dibuat menghasilkan lebih dari 300 koloni pada cawan petri, hanya jumlah koloni pada pengenceran tertinggi yang dihitung, misal dengan cara menghitung jumlahnya pada ¼ bagian cawan petri, kemudian hasilnya dikalikan empat. Hasilnya dilaporkan sebagai lebih dari 300 dikalikan dengan besarnya pengenceran, tetapi jumlah yang sebenarnya harus dicantumkan dalam tanda kurung. Jumlah koloni per pengenceran Standard Ket Plate 10-2 TBUD 10-3 TBUD 10-4 355 Count > 3.0 x 106 Hit. (3.6 x 106) pengenceran pada 10-4 TBUD 325 20 > 3.0 x 105 Hit. (3.3 x 105) pengenceran pada 10-3 HANDBOOK OF TA HAYATI 56 4. Jika cawan dari dua tingkat pengenceran menghasilkan koloni dengan jumlah antara 30 dan 300, dan perbandingan antara hasil tertinggi dan terendah dari kedua pengenceran tersebut adalah lebih kecil atau sama dengan 2, tentukan rata-rata dari kedua nilai tersebut dengan memperhitungkan pengencerannya. Jika perbandingan antara hasil tertinggi dan terendah lebih besar dari 2, yang dilaporkan hanya hasil terkecil. Jumlah koloni per pengenceran Standard Plate 10-2 293 10-3 41 10-4 4 Ket Count 3.5 x 104 Hit. rata- ratanya karena 41000/29300 = 1.4 (<2) 140 32 2 1.4 x 104 Hit. pengenceran pada 10-2 karena 32000/14000 = 2.3 (>2) HANDBOOK OF TA HAYATI 57 5. Jika digunakan dua cawan petri (duplo) per pengenceran, data yang diambil harus dari kedua cawan tersebut, tidak boleh diambil salah satu, meskipun salah satu dari cawan duplo tersebut tidak memenuhi syarat diantara 30 dan 300. Jumlah koloni per pengenceran Standard Plate 10-2 10-3 10-4 175 16 1 208 17 0 Ket Count 1.9 x 104 Rata-rata dari pengenceran 10-2 138 42 2 162 43 4 1.5 x 104 Rata-rata dari pengenceran 10-2 karena perbandingan antara pengenceran 10-3 dan 10-2 adalah 2.8 (>2) 290 36 4 280 32 1 3.1 x 104 Rata-rata dari pengenceran 10-2 dan 10-3 HANDBOOK OF TA HAYATI 58 karena perbandingan antara kedua pengenceran adalah 1.2 (<2) 291 25 3 305 27 0 3.0 x 104 Rata-rata dari pengenceran 10-2 meskipun 305>300 (angka yang lain <30) Koliform adalah sekelompok bakteri yang digunakan sebagai indikator adanya polusi atau kotoran dan kondisi sanitasi yang tidak baik terhadap air, makanan, susu dan produk susu. Koliform dibedakan atas : 1) Koliform fekal, misalnya E.coli dan 2) Koliform non-fekal, misalnya Enterobacter aerogenes. Untuk mengetahui jumlah koliform, digunakan metode MPN dan metode membran filter. Kedua metode tersebut lebih sensitif dibandingkan metode hitungan cawan karena dapat mendeteksi dan menghitung koliform dalam jumlah kecil. HANDBOOK OF TA HAYATI 59 Uji kualitatif koliform terbagi atas uji penduga, uji penguat, uji lengkap. Uji penduga merupakan uji kuantitatif koliform menggunakan metode MPN. 2. Metode MPN (Most Probable Number) Dikenal dengan metode Jumlah Perkiraan Terdekat. Dalam metode MPN digunakan media cair di dalam tabung reaksi, dimana perhitungan dilakukan berdasarkan jumlah tabung yang positif, yaitu yang ditumbuhi oleh bakteri tertentu setelah inkubasi pada suhu dan waktu tertentu. Pengamatan tabung yang positif dilihat dari timbulnya kekeruhan, atau terbentuknya gas dalam tabung Durham untuk bakteri pembentuk gas. Pada umumnya untuk setiap pengenceran digunakan tiga atau lima seri tabung. Metode MPN biasanya dilakukan untuk menghitung jumlah bakteri dalam sampel yang berbentuk cair, meskipun dapat pula digunakan untuk sampel berbentuk padat dengan terlebih dahulu membuat suspensi 1 : 10 dari sampel tersebut. Pengenceran harus lebih tinggi dibandingkan metode hitungan cawan. Cara kerja : 1. Buat seri pengenceran (minimal 3). 2. Inokulasikan tiap pengenceran pada 3 atau 5 seri tabung media MPN, yaitu Lactosa Broth kemudian dilanjutkan dengan media Brilliant Green Lactose Bile Broth. 3. Inkubasi dan diamati hasilnya. 4. Uji positif jika keruh atau terbentuk gas. 5. Gas dapat terlihat dari adanya rongga kosong pada tabung Durham. HANDBOOK OF TA HAYATI 60 6. Sesuaikan dengan tabel MPN. 7. Hitung jumlah bakteri. Rumus : Jumlah bakteri = Indeks MPN x 1/Pengenceran tabung yang di tengah. o Kombinasi : 3-2-1 o Nilai MPN dari tabel MPN 3 seri : 1.50 o MPN Bakteri = Indeks MPN x 1/pengenceran tabung yang di tengah = 1.50 x 1/10-3 = 1.5 x 103 Uji Penduga 1. Buat seri media laktosa cair (Lactosa Broth) dengan suatu takaran air tertentu (10 ml, 1 ml, 0.1 ml). 2. Inkubasi 24 jam, 370C. 3. Amati terjadinya gas. Uji Penguat 1. Dari tabung yang memberi hasil positif timbul gas, ditanam ke dalam media agar Endo atau EMB (Eosin Metilen Blue) atau BGLBB (Brilliant Green Lactose Bile Broth). 2. Inkubasi pada suhu 370C selama 18-24 jam. 3. Amati terdapar E.coli bila : o Pada Endo Agar warna merah mengkilap logam o Pada EMB warna biru tua mengkilap logam o Pada BGLBB gas positif HANDBOOK OF TA HAYATI 61 Uji Lengkap 1. Dari koloni yang timbul (positif/meragukan) ditanam ke dalam media laktosa dan agar miring. 2. Inkubasi pada suhu 370C selama 24-48 jam. 3. Amati pada : o Laktosa timbul gas. o Koloni khas pada agar miring. o Pewarnaan Gram-negatif bentuk batang dan tidak berspora. 4. Untuk menentukan antara E.coli dengan golongan bentuk E.coli lainnya, maka dari pemeriksaan uji lengkap diteruskan uji IMViC. 3. Metode Membran Filter Sebanyak 25-100 ml sampel (misal air atau susu) disaring melalui membran filter steril dengan pori-pori 0.22 – 0.45 mikron dan diameter sekitar 5 cm. Membran filter diletakkan diatas agar cawan EMB atau Endo Agar dan diinkubasikan pada suhu 350C – 370C. Jumlah koliform dinyatakan dalam jumlah koliform per 100 ml sampel. Pada EMB : 1. Koloni koliform fekal diameter 0.5-1.5 mm dan berwarna gelap dengan sinar hijau metalik (keemasan). 2. Koloni koliform non-fekal diameter 1.0-3.0 mm berwarna merah muda dan bagian tengah berwarna gelap seperti mata ikan. HANDBOOK OF TA HAYATI 62 Pada Agar (mengandung laktosa) : 1. Koloni yang memfermentasikan laktosa (e.g. koliform) membentuk warna merah pada bagian atas koloni dan sekelilingnya. 2. Koloni bakteri yang tidak memfermentasikan laktosa (e.g. Salmonella dan Shigella) akan membentuk koloni yang tidak berwarna. Uji Angka Kapang 1. Media PDA steril yang telah dicairkan dan didinginkan pada temperatur 40ºC ditambahkan kloramfenikol sebesar 1ml/L, dan dituang ke dalam piring petri hingga membeku. 2. Sebanyak 1 ml suspensi hasil pengenceran sampel dituang pada permukaan media PDA yang telah beku dalam piring petri, yang mengandung kloramfenikol, dan diratakan dengan bantuan spreader glass. 3. Piring petri selanjutnya diinkubasi pada temperatur 20-25ºC selama 3-5 hari. Perhitungan jumlah koloni kapang/khamir yang tumbuh pada media dilakukan sesuai cara perhitungan angka lempeng total (ALT) pada bakteri. Syarat jumlah bakteri dalam suatu sediaan <106 CFU (Colony Forming Unit) per ml untuk bakteri. Syarat jumlah kapang/khamir dalam suatu sediaan <104 CFU/ml untuk kapang/khamir. HANDBOOK OF TA HAYATI 63 BAB VII DESINFEKTAN 1817, Joseph Lister menggunakan desinfektan yang mengandung fenol untuk mendesinfeksi peralatan bedahnya. Hingga sekarang, fenol digunakan sebagai larutan baku penentu kekuatan desinfektan. Desinfektan adalah zat yang digunakan untuk mencegah atau mengendalikan penularan dengan cara membasmi mikroorganisme patogen, apabila digunakan pada objek yang tidak hidup/benda mati, misalnya desinfeksi pada alat kesehatan, alat bedah dsb. Antiseptik adalah zat yang mampu membunuh/menghambat pertumbuhan mikroorganisme dan digunakan pada jaringan hidup, misalnya kulit, gigi, mata. Desinfektan yang ideal : 1. Cepat membasmi mikroorganisme yang patogen dan potensial termasuk spora. 2. Penetran yang baik ke dalam bahan organik, misal kapas, karet. 3. Dapat bercampur dengan bahan-bahan organik, misal sabun, deterjen. 4. Tidak menjadi inaktif oleh jaringan hidup. 5. Tidak bersifat korosif. HANDBOOK OF TA HAYATI 64 Pengendalian = mereduksi jumlah kegiatan suatu mikroorganisme. Tujuan pengendalian : 1. Mencegah transmisi penyakit dan infeksi. 2. Mencegah pencemaran/pertumbuhan mikroorganisme yang tidak diinginkan. 3. Mencegah peruraian/pembusukan bahan tertentu oleh mikroorganisme. Faktor-faktor yang mempengaruhi potensi desinfektan : 1. Konsentrasi 2. Waktu 3. pH 4. Suhu 5. Sifat mikroorganisme 6. Kehadiran bahan extraneus Berdasarkan mekanisme kerja, desinfektan terbagi atas : 1. Bahan yang merusak membran sel oSurface active bahan kationik, bahan anionik, bahan non-ionik. oSenyawa fenol fenol dan kresol. oAlkohol 2. Bahan yang mendenaturasi protein o Protein merupakan molekul organik yang sangat banyak terdapat di dalam sel. Tiap protein memiliki konformasi karakteristik yang diperlukan. Jika terdapat bahan yang dapat mengubah konformasi dari protein dengan denaturasi, maka akan terjadi pembukaan rantai polipeptida hingga rantai menjadi melipat atau memutar tidak beraturan. HANDBOOK OF TA HAYATI 65 o Contoh bahan kimia yang mendenaturasi protein : 1. Asam 2. Alkali 3. Alkohol 4. Aseton o Asam dan alkali Bahan asam dan alkali menunjukkan daya antibakterinya melalui ion H+ atau OH- bebas, yaitu melalui molekul yang tidak terdisosiasi. Asam kuat dan alkali kuat mempunyai kandungan desinfektan sebanding dengan disosiasinya dalam cairan. 3. Bahan yang memodifikasi kelompok fungsional dari protein dan asam nukleat. Bagian katalitik dari enzim menjadi kelompok fungsional khas yang akan mengikat substrat dan memulai proses katalisis. Inhibisi kegiatan enzim berhasil jika satu atau lebih dari kelompok fungsional diubah atau dirusak. Kelompok fungsional penting dari dinding sel, membran sel dan asam nukleat adalah peka terhadap inaktivasi. a. Logam berat : misal Hg fenil merkuri : untuk membunuh bakteri Grampositif dan Gram-negatif, kapang, khamir. Ag AgNO3 : untuk membunuh gonococcus. HANDBOOK OF TA HAYATI 66 b. Bahan pengoksidasi : Halogen; misal klorin (sebagai desinfektan air), iodin (sebagai desinfektan kulit). Hidrogen peroksida (H2O2); merupakan desinfektan yang banyak digunakan untuk desinfeksi yang tidak hidup, seperti peralatan bedah dan lensa kontak. c. Pewarna; beberapa jenis pewarna tidak hanya mewarnai bakteri, tetapi juga menghambat pertumbuhannya pada enceran sangat tinggi. Misal : Pewarna trifenilmetan (pewarna anilin), derivatnya : hijau berlian, hijau malakit, violet kristal. Ketiga derivatnya bersifat selektif terhadap Grampositif. Pewarna akridin (disebut juga flavin), misal : proflavina, akriflavina. Keduanya bersifat sebagai antiseptik luka. Berbeda dengan pewarna anilin, pewarna akridin tidak terpengaruh daya antimikrobanya dengan kehadiran serum atau nanah. d. Bahan pengalkil; inhibisi yang dihasilkan bahan pengalkil adalah irreversible sehingga terjadi modifikasi enzim dan inhibisi kegiatan enzim. Misal : 1. Aldehida ; Formaldehida; digunakan sebagai pengawet jaringan segar dan bangkai. Dalam konsentrasi tinggi merusak semua jenis mikroorganisme, termasuk HANDBOOK OF TA HAYATI 67 spora. Formaldehida dalam bentuk gas digunakan untuk mendesinfeksi ruangan, bahan tekstil dan instrumen. Glutaraldehida; memiliki kemampuan 10 x dari formaldehida. Digunakan sebagai bahan sterilisasi dingin untuk alat bedah. 2. Etilen oksida; merupakan bahan dalam bentuk gas, untuk sterilisasi materi yang rusak karena panas, misalnya peralatan elektronik, kedokteran, biologik dan obat. Selain bereaksi dengan protein juga bereaksi dengan ADN dan ARN. Untuk membandingkan kekuatan desinfektan dalam menghambat pertumbuhan bakteri dapat digunakan cakram kertas. Pada cakram kertas dibasahi dengan desinfektan, kemudian diletakkan pada lempengan agar yang telah diinokulasi. Lempengan agar kemudian dierami selama 48 jam. Jika desinfektan menghambat pertumbuhan bakteri, maka akan terlihat daerah jernih sekeliling cakram kertas. Luas daerah terang ini menjadi ukuran kekuatan daya kerja desinfektan. HANDBOOK OF TA HAYATI 68 BAB VIII ANTIBIOTIKA Antibiotika adalah : Senyawa kimia yang dihasilkan oleh mikroorganisme atau senyawa sejenis yang seluruhnya atau sebagian diproduksi secara sintesis kimia yang dalam konsentrasi rendah dapat menghambat pertumbuhan mikroorganisme lainnya. Persyaratan antibiotika : 1. Dapat merusak atau menghambat mikroorganisme patogen tanpa merusak tuan rumah. 2. Mikroorganisme yang peka terhadapnya tidak menjadi resisten. 3. Tidak menimbulkan alergi dan efek samping yang tidak diinginkan jika digunakan secara berkesinambungan dengan dosis tinggi. 4. Harus tetap aktif dalam plasma, cairan tubuh atau eksudat. 5. Larut dalam air dan stabil serta tingkat membunuh atau menghambat pertumbuhan mikroorganisme cepat tercapai dan dapat dipertahankan untuk waktu yang diperpanjang. Mekanisme kerja antibiotika : 1. Inhibitor dinding sel 2. Inhibitor membran sel 3. Inhibitor fungsi ADN 4. Inhibitor terhadap sintesis protein HANDBOOK OF TA HAYATI 69 I. Inhibitor Dinding Sel Dinding sel yang kaku melindungi membran sitoplasma terhadap pengaruh tekanan osmotik. Zat yang merusak dinding sel atau mencegah sintesis polimer dinding pada sel yang tumbuh akan mengembangkan sel yang peka terhadap osmosis dan akan mati. a. Antibiotika ß-laktam 1. Penicillin Dapat menimbulkan reaksi hipersensitif pada kelompok kecil manusia. Nukleus penicillin Asam-6-aminopenisilinat yang merupakan persyaratan struktur bagi aktivitas biologis. Efektif terhadap bakteri Gram-positif dan Gram-negatif. Kekurangan penicillin : 1. Dapat diinaktivasi oleh pH asam dari cairan lambung. 2. Dirusak oleh penisilinase, yaitu enzim bakteri yang memecah cincin ßlaktam. 3. Penicillin yang banyak digunakan adalah yang resisten terhadap penisilinase, antara lain metisilina, nafsilina, kloksasilina, dikloklasilina, oksasilina. 2. Sefalosporina Dihasilkan oleh jamur Cephalosporium acremonium. HANDBOOK OF TA HAYATI 70 Efektif terhadap Gram-positif dan Gram-negatif, mempunyai daya kerja hampir sama dengan penicillin semisintetik. b. Sikloserina Antibiotika spektrum luas hanya digunakan terhadap penyakit TBC. c. Fosfomisina Dihasilkan oleh Streptomyces fradiae, merupakan antibiotika spektrum luas sebagai inhibitor terhadap sintesis peptidoglikan dan kegiatan enzim. d. Vankomisin Antibiotika spektrum sempit, dihasilkan oleh Streptomyces orientalis. Efektif terhadap banyak spesies dan Gram-positif, bekerja dengan menghambat biosintesis peptidoglikan. II. Inhibitor Membran Sel Membran sel mempunyai peranan penting di dalam sel, yaitu merupakan pembatas osmotik terhadap difusi bebas antara lingkungan dalam dan luar. Membran sel berdaya terhadap konsentrasi metabolit dan nutrien di dalam sel dan merupakan bagian untuk pernapasan dan beberapa kegiatan biosintesis. Beberapa jenis antibiotika menunjukkan kemampuan menurunkan satu atau lebih dari fungsi membran di atas dan hal tersebut mengakibatkan keburukan bagi kehidupan sel. HANDBOOK OF TA HAYATI 71 a. Polimiksina 1. Terdiri atas polimiksina A,B,C,D dan E. 2. Polimiksina B yang banyak digunakan sebagai obat. 3. Antibiotika ini mengikat permukaan luar dari membran sel serta mengubah struktur dan kandungan osmosis dari sel. 4. Dihasilkan oleh Bacillus polymixa. 5. Efektif terhadap Gram-positif dan Gram-negatif. b. Antibiotika poliena Merupakan antibiotika antifungal, yaitu : 1. Nistatin; dihasilkan oleh Streptomyces noursei; tidak digunakan dalam bentuk injeksi karena toksik. Digunakan di kulit untuk menyembuhkan penyakit karena Candida. 2. Amfoterisina; umumnya digunakan amfoterisina-B yang dihasilkan oleh Streptomyces niveus, digunakan terhadap penyakit yang diakibatkan oleh fungi. III. Inhibitor Fungsi ADN Fungsi ADN yaitu duplikasi dan replikasi (sandi genetik). Beberapa jenis antibiotika secara khas dapat mengganggu struktur dan fungsi ADN, tetapi sedikit yang digunakan sebagai obat karena toksisitasnya. HANDBOOK OF TA HAYATI 72 Tiap bahan yang dapat mengganggu struktur dan fungsi ADN, maka mampu menimbulkan efek yang mendalam dalam semua fase pertumbuhan dan mikroorganisme yang bersangkutan. Novobiosina Efektif terhadap Gram-positif, dihasilkan oleh Streptomyces niveus, yang memiliki daya kerja menghambat replikasi DNA. IV. Inhibitor Terhadap Sintesis Protein Sintesis protein merupakan hasil akhir dari 2 proses, yaitu : 1. Transkripsi : sintesis RNA yang tergantung pada DNA. 2. Translasi : Sintesis protein yang tergantung pada RNA. Antibiotika yang menghambat salah satu dari proses di bawah ini, berarti menghambat sintesis protein. a. Inhibitor dari transkripsi 1. Aktinomisin; dihasilkan oleh Streptomyces, efektif menghambat sintesis ADN dan ARN, bersifat toksik. 2. Rifampin; merupakan derivat semisintetik dari Streptomyces mediterranei, yang paling berguna dari kelompok ini adalah rifampisin. Efektif terhadap Gram-positif dan Mycobacterium seperti penyebab penyakit TBC dan lepra. Rifampisin menghambat sintesis protein secara selektif menginaktivasi polimerase ADN. HANDBOOK OF TA HAYATI 73 b. Inhibitor dari translasi 1. Streptomisin Dihasilkan oleh Streptomyces griseus, efektif terhadap Gram-negatif dan M. tuberculosis. Streptomisin digunakan terhadap mikroorganisme yang tidak mempan terhadap penicillin. 2. Tetrasiklin Merupakan antibiotika spektrum luas, efektif terhadap Gram-positif dan Gramnegatif, mikoplasma, riketsia dan klamidia. Kelompok tetrasiklin : 1. Oksitetrasiklin 2. Khlortetrasiklin 3. Dimetilkhlortetrasiklin 4. Doksisiklin 5. Minosiklin Daya kerja tetrasiklin lebih luas dibandingkan penicillin, streptomisin dan kloramfenikol. Tetrasiklin menghambat hanya mikroorganisme yang berkembang biak secara cepat dan bersifat bakteriostatik. Penggunaan tetrasiklin terutama terhadap mikroorganisme yang resisten terhadap ampicillin dan sefalosporina. HANDBOOK OF TA HAYATI 74 3. Nitrofuran Misal : Nitrofurantoin, efektif terhadap infeksi saluran genitourinaria pada penderita yang tidak tahan terhadap sulfonamida. 4. Kloramfenikol Dihasilkan oleh Streptomyces venezuelae, bersifat bakteriostatik terhadap Gram-positif dan Gram-negatif, riketsia dan klamidia. Menghambat pertumbuhan bakteri dengan mengganggu sintesis protein. 5. Eritromisin Bersifat bakteriostatik dan dalam kadar tinggi sebagai bakterisida. Dihasilkan oleh Streptomyces erytherus. Efektif untuk infeksi pneumonia, atau diberikan pada penderita yang alergi terhadap penicillin dan yang menderita infeksi akibat streptococcus dan pneumococcus. 6. Linkomisin dan klindamisin Dihasilkan oleh Streptomyces linkolensis. Klindamisin adalah derivat khloro dari linkomisin yang dibuat secara semisintesis. Spektrum kerjanya sama dengan eritromisin walaupun secara kimia tidak ada hubungannya. Efektif terhadap streptococcus, pneumococcus dan staphylococcus. HANDBOOK OF TA HAYATI 75 7. Griseofulvin Dihasilkan oleh Penicillium griseofulvum, merupakan fungistatik dan mengganggu proses tubulin menjadi mikrotubula griseofulvin mengikat protein di dalam perakitan tubulina. Jadi proses sel yang terkandung pada fungsi mikrotubula seperti pergerakan kromosom selama mitosis akan terhambat oleh griseofulvin. HANDBOOK OF TA HAYATI 76 BAB IX UJI SENSITIVITAS 1. Desinfektan Daya kerja antimikroba (desinfektan) bahan kimia seringkali disetarakan dengan fenol. Kemampuan bahan kimia dibandingkan dengan fenol disebut koefisien fenol. Koefisien fenol adalah angka yang menunjukkan ratio/perbandingan dari pengenceran tertinggi desinfektan yang diuji dengan pengenceran tertinggi dari fenol yang dapat membunuh mikroorganisme penguji dalam 10 menit, tetapi tidak bisa membunuh dalam 5 menit. Bahan kimia yang memiliki koefisien fenol lebih dari 1, mempunyai daya kerja antimikroba yang lebih baik dibandingkan dengan fenol. Macam-macam desinfektan antara lain Lysol, Creolin, Denol, Dettol, SOS dll. Bila larutan desinfektan uji dengan pengenceran 1 : 250 dapat membunuh populasi S. aureus, sedangkan hasil yang sama ditunjukkan oleh fenol pada pengenceran 1 : 60, maka koefisien fenol sebagai desinfektan uji adalah 250/60 atau 4.2. Hasil ini menunjukkan bahwa desinfektan uji 4.2 kali lebih efektif dibandingkan fenol dalam membunuh S. aureus secara in vitro. HANDBOOK OF TA HAYATI 77 Rumus : Koefisien fenol (KF) = (a/b + c/d)/2 Ket : a Faktor pengenceran tertinggi larutan uji desinfektan masa kontak 5’. b Faktor pengenceran tertinggi larutan baku fenol masa kontak 5’. c Faktor pengenceran tertinggi larutan uji desinfektan masa kontak 10’. d Faktor pengenceran tertinggi larutan baku fenol masa kontak 10’. Contoh : Pengenceran Desinfektan Waktu 1/50 1/60 1/70 1/80 1/90 1/100 1/110 1/120 1/130 1/140 Fenol Lysol 5’ - - - - - - - -(b) + + 10’ - - - - - - - - -(d) + 5’ - - - - - - - - -(a) + 10’ - - - - - - - - - -(c) HANDBOOK OF TA HAYATI 78 Kf = (a/b + c/d)/2 = (130/120 + 140/130)/2 = 1.080 Ket : Kf > 1 : bahan antimikroba/desinfektan efektif Kf < 1 : bahan antimikroba/desinfektan kurang efektif Cara kerja : 1. Baku fenol 5% Buat pengenceran menggunakan aquadest steril (tiap tabung hanya diperlukan 5 ml fenol). Pengenceran dibuat dengan 2 bagian waktu, yaitu 5’ dan 10’ tiap bagian waktu terdiri dari 10 tabung pengenceran. 2. Inokulasi bakteri uji untuk fenol 5%. Masukkan 0.5 ml biakan bakteri pada masing-masing tabung pengenceran dimulai dari tabung pengenceran 5’. Ketika pertama kali memasukkan bakteri uji pada tabung pengenceran yang pertama, waktu dicatat sebagai 0 (nol) menit. Interval waktu antar tabung adalah 30 detik. Perlakuan sama terhadap pengenceran 10’. HANDBOOK OF TA HAYATI 79 3. Inokulasi pada media Nutrient Broth 5 menit setelah pengisian tabung untuk waktu 5 menit tersebut, tabung pertama dikocok, kemudian isinya diambil satu masa ose dan diinokulasikan ke dalam tabung pertama pada media Nutrient Broth. Dilanjutkan hingga tabung pengenceran terakhir untuk waktu 5’. Perlakuan sama terhadap 10 tabung pengenceran untuk waktu 10’. Inkubasi pada suhu 370C selama 24-48 jam. Amati pertumbuhan mikroorganisme. 2. Antibiotika Cara yang umum digunakan untuk mengetahui kekuatan antibiotika adalah uji kepekaan (sensitivitas) antibiotika terhadap mikroorganisme patogen penyebab penyakit. Adapun cara dibawah ini tidak terbatas pada antibiotika saja, tetapi juga agen antimikroba lainnya. A. Metode Minimum Inhibitory Concentration (MIC) Bahan antimikroba bersifat menghambat bila digunakan dalam konsentrasi kecil, dan mematikan mikroorganisme bila digunakan dalam konsentrasi tinggi. Oleh karena itu, perlu diketahui Minimum Inhibitory Concentration (MIC) dan Minimum Killing Concentration) bahan antimikroba tersebut terhadap mikroorganisme. Dalam uji ini diperlukan suspensi baku dari mikroorganisme patogen yang ditumbuhkan dalam kaldu. HANDBOOK OF TA HAYATI 80 Suspensi baku tersebut dimasukkan dalam kaldu yang berisi berbagai konsentrasi antibiotika. Konsentrasi terendah yang menghambat pertumbuhan mikroorganisme dalam kaldu dapat ditentukan dengan mengukur kekeruhan setelah diinkubasikan. Tabung kaldu yang berisi konsentrasi antibiotika yang mampu menghambat pertumbuhan mikroorganisme patogen terlihat bening, sedangkan tabung dengan konsentrasi antibiotika yang tidak menghambat pertumbuhan mikroorganisme patogen terlihat keruh. Uji juga dapat menggunakan media agar-agar (lempengan). Kekuatan antibiotika dapat ditentukan dengan melihat konsentrasi terendah antibiotika yang mampu mematikan atau menghambat pertumbuhan mikroorganisme patogen. MIC merupakan petunjuk konsentrasi antibiotika yang mampu menghambat mikroorganisme dan juga memberikan petunjuk mengenai dosis yang diperlukan dalam pengobatan penyakit. Dengan mengetahui MIC dan sifat cairan tubuh seperti darah dan urin, dapat ditentukan jenis antibiotik yang ampuh untuk pengobatan, besarnya dosis yang diperlukan. Umumnya, batas keamanan penggunaan antiibiotika untuk pengobatan penyakit adalah sepuluh kali dosis MIC. MIC dapat ditentukan dengan menggunakan cairan tubuh tanpa harus mengisolasi ataupun mengidentifkasi mikroorganisme penyebab penyakit. HANDBOOK OF TA HAYATI 81 Misal : darah atau cairan serebrospinal yang mengandung mikroorganisme infeksius ditambahkan pada berbagai konsentrasi antibiotika. Kekeruhan pada tabung setelah waktu inkubasi menunjukkan bahwa konsentrasi antibiotika dalam tabung tidak mampu menghambat pertumbuhan mikroorganisme. Sebaliknya, tidak adanya kekeruhan menunjukkan bahwa mikroorganisme peka terhadap konsentrasi antibiotika dalam tabung. B. Metode Antibiogram-Kirby-Bauer Uji ini diperkenalkan oleh William Kirby dan Alfred Bauer pada tahun 1966. Pada uji ini, lempengan agar ditaburi dengan mikroorganisme penguji. Cakram kertas (disc) yang berisi berbagai antibiotika diletakkan diatas lempengan agar tersebut. Penghambatan pertumbuhan mikroorganisme oleh antibiotika terlihat sebagai wilayah jernih sekitar pertumbuhan mikroorganisme (zona hambat). Luasnya wilayah jernih merupakan petunjuk kepekaan mikroorganisme terhadap antibiotika dan juga berkaitan dengan kecepatan berdifusi antibiotika dalam media. Faktor-faktor yang mempengaruhi ukuran diameter zona hambat : o Kekeruhan suspensi bakteri : Kurang keruh diameter zona hambatan lebih lebar. Lebih keruh diameter zona hambatan lebih sempit. o Kekeruhan suspensi bakteri harus distandardisasi terlebih dahulu. HANDBOOK OF TA HAYATI 82 o Standar kekeruhan dibuat dari 0.5 ml 1.75% Barium Chloride Dihydrat ditambah 1% asam sulfat. Waktu peresapan suspensi bakteri ke dalam lempengan agar. Setelah suspensi bakteri digoreskan pada agar dengan menggunakan lidi kapas steril, diamkan 5’-15’. Pendiaman tidak boleh melebihi batas waktu yang ditentukan karena dapat mempersempit diameter zona hambat, sensitif (S) dilaporkan resisten (R). Temperatur inkubasi o Inkubasi dilakukan pada 350C. o < 350C diameter zona hambatan lebih lebar sehingga R dilaporkan S terjadi pada lempengan yang ditumpuk-tumpuk lebih dari 2 lempengan pada saat inkubasi lempengan yang di tengah suhunya kurang dari 350C. o 350C ada bakteri yang kurang subur dalam pertumbuhannya, ada pula obat yang difusinya kurang baik. Waktu inkubasi 16-18 jam. Kurang dari 16 jam, pertumbuhan bakteri belum sempurna sehingga sukar dibaca atau diameter zona hambatan lebih lebar. Lebih dari 18 jam, pertumbuhan lebih sempurna sehingga diameter zona hambatan lebih sempit. HANDBOOK OF TA HAYATI 83 Tebal agar-agar Ketebalan agar-agar sekitar 4 mm. < 4 mm difusi obat lebih cepat. > 4 mm difusi obat lebih lambat. Jarak antar disc obat Jarak yang dianjurkan minimum 15 mm, untuk menghindari terjadinya zona hambatan yang tumpang tindih. Cawan petri dengan diameter 9-10 cm, maksimum dapat memuat 7 disc obat. Penempelan disc obat dapat menggunakan pinset. Potensi disc obat Tiap jenis disc obat memiliki diameter yang sama, tetapi potensinya berbeda. Komposisi media Berpengaruh terhadap pertumbuhan bakteri, difusi obat, aktivitas obat dsb. Gambar pengujian antibiotika HANDBOOK OF TA HAYATI 84 Pembacaan pengukuran diameter zona hambat Dengan menggunakan kertas berwarna gelap atau dengan latar belakang sedikit gelap, bisa dengan menggunakan jangka. Diameter zona hambat yang diukur adalah daerah jernih sekitar disc obat (tidak ada pertumbuhan bakteri), diukur dari ujung yang satu ke ujung yang lain melalui tengah-tengah disc obat. Hasil pengukuran diameter zona hambat dibandingkan dengan standar (resisten (R), sensitif (S) atau intermediate (I)). HANDBOOK OF TA HAYATI 85 HANDBOOK OF TA HAYATI 86 Kontrol Kualitas o Adalah usaha yang dilakukan untuk menetralisasi faktor-faktor yang berpengaruh terhadap diameter zona hambat. o Memeriksa mutu media dan disc obat dengan menggunakan bakteri standar: S. aureus ATCC 25923, E. coli ATCC 25922 dan P. aeruginosa ATCC 27853. HANDBOOK OF TA HAYATI 87 BAB X UJI PRODUK FARMASI 1. Uji Pirogen Pirogen adalah reaksi demam pada tingkat yang dapat diterima oleh pasien pada pemberian sediaan injeksi. Tujuan Uji Pirogen : Membatasi resiko reaksi demam. Pengujian meliputi : pengukuran kenaikan suhu kelinci setelah penyuntikan larutan uji secara intravena dan ditujukan untuk sediaan yang dapat ditoleransi dengan uji kelinci dengan dosis penyuntikan tidak lebih dari 10 ml per kg bobot badan dalam jangka waktu tidak lebih dari 10 menit. Alat dan Pengencer Alat : 1. Alat suntik 2. Jarum 3. Alat kaca bebas pirogen Pengencer : Sesuai monografi Misal : apabila digunakan injeksi Natrium Klorida sebagai pengencer, gunakan injeksi yang mengandung larutan Natrium Klorida P 0.9 %. HANDBOOK OF TA HAYATI 88 Rekaman suhu Termometer yang telah dikalibrasi untuk menjamin ketelitian skala ± 0.10C dan telah diuji bahwa pembacaan suhu maksimum tercapai ± 5 menit. Cara : Masukkan alat pengukur suhu ke dalam anus kelinci dengan kedalaman tidak kurang dari 7.5 cm. Hewan Uji 1. Kelinci dewasa yang sehat 2. Tempatkan satu ekor dalam satu kandang dengan suhu 20-230C dan bebas dari gangguan yang menimbulkan kegelisahan. 3. Untuk kelinci yang belum pernah digunakan untuk uji pirogen adaptasikan tidak lebih dari 7 hari dengan uji pendahuluan. 4. Kelinci tidak boleh digunakan untuk uji pirogen lebih dari sekali dalam waktu 48 jam atau sebelum 2 minggu setelah digunakan untuk uji pirogen bila menunjukkan kenaikan suhu maksimum 0.600C atau lebih, atau digunakan untuk sediaan yang mengandung pirogen. Prosedur : Pengujian dalam ruang terpisah dengan kondisi lingkungan yang sama dengan ruang pemeliharaan, bebas dari keributan yang menyebabkan kegelisahan. Kelinci tidak diberi makan selama waktu pengujian. Minum dibolehkan setiap saat, tetapi dibatasi pada saat pengujian. HANDBOOK OF TA HAYATI 89 Tidak lebih 30 menit sebelum penyuntikan larutan uji, tentukan suhu. Suhu awal setiap kelinci tidak boleh lebih dari 39.80C. Beda suhu setiap kelinci tidak boleh lebih dari 10. Kecuali dinyatakan lain, suntikan 10 ml/kg BB melalui vena tepi telinga 3 ekor kelinci dan penyuntikan dilakukan dalam waktu 10 menit. Semua larutan harus bebas dari kontaminasi, dengan cara menghangatkan pada suhu 370 ± 2 sebelum penyuntikan. Penafsiran Hasil : 1. Setiap penurunan suhu dianggap nol, sediaan memenuhi syarat apabila tak seekor kelinci pun menunjukkan kenaikan suhu 0.50 atau lebih. 2. Jika ada kelinci yang menunjukkan kenaikan 0.50 atau lebih lanjutkan pengujian menggunakan 5 ekor kelinci. Jika tidak lebih dari 3 ekor dari 8 kelinci masing-masing menunjukkan suhu 0.50 atau lebih dan jumlah kenaikan suhu maksimum 8 ekor kelinci tidak lebih dari 3.30, sediaan dinyatakan memenuhi syarat bebas pirogen. 2. Uji Sterilitas Media yang digunakan untuk uji sterilitas : Media tioglikolat cair Media tioglikolat alternatif Soybean-casein digest medium HANDBOOK OF TA HAYATI 90 Prosedur umum Prosedur pengujian terdiri atas : a. Inokulasi langsung ke dalam media uji CAIRAN 1. Pindahkan cairan dari wadah uji (ampul atau vial) menggunakan pipet atau jarum suntik steril. 2. Secara aseptik inokulasikan sejumlah tertentu bahan dari tiap wadah uji ke dalam tabung media. 3. Campur cairan dengan media. 4. Inkubasi selama 14 hari. 5. Amati pertumbuhan pada media secara visual sesering mungkin sekurangnya pada hari ke-3, ke-4 dan ke-5 atau ke-7 dan ke-8 pada hari terakhir masa uji. ZAT PADAT 1. Ambil sejumlah tertentu produk dalam bentuk padat kering (atau yang terlebih dahulu dibuat larutan atau suspensi dalam cairan pengencer steril) dengan tidak kurang dari 300 mg tiap wadah atau seluruh isi wadah jika tiap isi kurang dari 300 mg. 2. Inokulasikan ke dalam masing-masing tidak kurang dari 40 ml media tioglikolat cair dan soybean-casein digest medium. 3. Langkah selanjutnya sama seperti langkah pada CAIRAN. HANDBOOK OF TA HAYATI 91 KAPAS MURNI, PERBAN, PEMBALUT, BENANG BEDAH DAN BAHAN SEJENISNYA 1. Dari setiap kemasan kapas, perban gulung atau pembalut perban yang diuji ambil secara aseptik dua bagian atau lebih masing-masing 100-500 mg dari bagian paling dalam. Dari individu contoh bentuk kemasan tunggal seperti bantalan perban, ambil secara aseptik sejumlah 250-500 mg atau keseluruhan contoh bila ukurannya kecil, seperti pembalut serap berperekat 25 mm x 75 mm atau lebih kecil, atau benang bedah. 2. Langkah selanjutnya sama seperti langkah pada CAIRAN. ALAT KESEHATAN STERIL Untuk alat yang bentuk dan ukurannya memungkinkan dicelupkan keseluruhan ke dalam ± 1000 ml media, uji alat utuh menggunakan media yang sesuai, inkubasi. Langkah selanjutnya sama seperti langkah pada CAIRAN. Untuk alat yang mempunyai pipa/saluran berlubang seperti alat transfusi atau infus atau yang ukurannya menyebabkan pencelupan tidak dapat dilakukan dan hanya saluran cairannya yang harus steril, bilas lumen masing-masing dari 20 unit dengan sejumlah secukupnya media tioglikolat cair dan soybean-casein digest medium. Untuk alat yang bentuk dan ukurannya tidak dapat dicelup, maka uji bagian alat yang paling sulit disterilisasi, dan jika mungkin lepaskan dua atau lebih bagian yang penting dari alat. Secara aseptik pindahkan bagian tersebut ke dalam 1000 ml media. HANDBOOK OF TA HAYATI 92 ALAT SUNTIK KOSONG ATAU TERISI Untuk alat suntik terisi yang dilengkapi jarum steril, keluarkan isi produk melalui lumen. Pengujian sama seperti pada cairan dalam ampul atau vial. Untuk alat suntik kosong steril, masukkan media atau pengencer steril ke dalam alat suntik melalui jarum yang disertakan atau jika tidak disertakan melalui jarum steril yang dipasang untuk tujuan pengujian. Contoh : OBAT-OBATAN ANTIBIOTIKA/KIMIA Secara aseptik diambil setengah dari jumlah spesimen yang ada di dalam ampul, dilarutkan di dalam air garam, aquadest atau pelarut lain yang steril, sebanyak mungkin dengan tujuan meniadakan potensi obat tersebut. Kemudian lakukan penyaringan. VITAMIN, AQUADEST, AIR GARAM Diambil beberapa spesimen ampul, tutupnya atau bagian yang akan dibuka dibersihkan dengan kapas alkohol. Ampul dipatahkan ujungnya, sedangkan vial dibuka tutup aluminiumnya yang di tengah, isinya diambil dengan syringe steril disposable. KAIN KASA Bungkus kain kasa dibuka secara steril, kain kasa diambil diletakkan di dalam cawan petri steril, digunting-gunting dengan gunting steril menjadi bagian kecil-kecil. Media yang digunakan : BHI broth/Tryptose Soy Broth/Blood Broth untuk bakteri aerob. Cooked meat medium untuk bakteri aerob. HANDBOOK OF TA HAYATI 93 Media tioglikolat untuk bakteri aerob/anaerob. Potato dextroseagar untuk kapang dan khamir. b. Teknik penyaringan membran Membran yang sesuai umumnya memiliki porositas 0.45 m, dengan diameter lebih kurang 47 mm, dan kecepatan penyaringan air 55 ml hingga 75 ml per menit pada tekanan 70 cmHg. 3. Uji Koefisien Fenol Contoh hasil pengamatan baku fenol Lama kontak 5’ 10’ + + + 15’ - Contoh hasil pengamatan desinfektan Desinfektan X Lama kontak Pengenceran 5’ 10’ 1 : 100 1 : 150 1 : 200 1 : 250 + 1 : 300 + + 1 : 350 + + 1 : 400 + + 15’ + + Baku Pengenceran 1 : 80 1 : 90 1 : 100 Hitung koefisien fenol (KF). Tabel hasil uji baku fenol yang memenuhi syarat Lama kontak Pengenceran 5’ 10’ 1 : 80 +/1 : 90 +/+/1 : 100 + + 15’ +/- Bila dari dua pengenceran pertama dari baku fenol yang diuji tidak ada satupun tabung pengenceran yang memberikan hasil positif dalam masa kontak 5’ dan HANDBOOK OF TA HAYATI 94 memberikan hasil pertumbuhan negatif dalam masa kontak 10’, maka diperkirakan bahwa pengenceran yang diharapkan berada diantara pengenceran kedua (1 : 90) dan pengenceran ketiga (1 : 100). Lihat tabel di bawah. Contoh hasil perkiraan uji baku fenol Pengenceran 5’ + 1 : 80 1 : 90 1 : 100 Lama kontak 10’ + 15’ - Contoh hasil perkiraan uji desinfektan Pengenceran 1 : 300 1 : 350 1 : 400 5’ + Lama kontak 10’ + 15’ - Jadi angka perkiraan untuk baku fenol antara 90-100, untuk desinfektan antara 350400. Hitung koefisien fenol (KF). HANDBOOK OF TA HAYATI 95 BAB XI FUNGI Terbagi atas dua golongan yaitu kapang dan khamir. Kapang Membentuk filamen panjang yang disebut hifa dan merupakan ciri utama fungi. Kumpulan hifa disebut miselium. Hifa memiliki dua struktur yaitu bersepta dan tidak bersepta. Septa menyekat sel sehingga filamen yang panjang terlihat sebagai rangkaian sel. Hifa yang tidak bersepta disebut hifa konositik. Dinding sel fungi mengandung khitin yang merupakan komponen utama dinding sel. Hifa mengabsorbsi zat hara dari sekelilingnya dan memanjang dengan cara membelah diri. Hifa dapat membentuk struktur reproduksi yang disebut spora. Metode untuk melihat struktur fungi dengan jelas adalah dengan slide culture. Identifikasi kapang berdasarkan ciri morfologi hifa, warna (pigmen) hifa, jenis hifa (ada septa/tidak), ukuran, bentuk, warna serta penataan spora. HANDBOOK OF TA HAYATI 96 Kelompok kapang diklasifikasikan berdasarkan spora seksualnya; Klasifikasi Zygomycetes Ciri Hifa konositik. Spora seksual : zygospora. Spora aseksual : sporangiospora dalam sporangium. Contoh : Rhizopus dan Mucor. Ascomycetes Hifa bersepta. Spora seksual : askuspora dalam askus. Spora aksesual : konidium. Contoh : Neurospora, Saccharomyces. Deuteromycetes Bentuk seperti khamir. Hifa seperti Ascomycetes. Tidak mempunyai stadium seksual. Spora aseksual : konidium. Contoh : Penicillium, Aspergillus, Candida. HANDBOOK OF TA HAYATI 97 Slide Culture Cara : 1. Letakkan kertas saring pada dasar cawan petri. 2. Letakkan batang gelas steril berbentuk “U” diatas kertas saring. 3. Kertas saring dibasahi dengan air, sehingga suasana dalam cawan petri menjadi lembab. 4. Letakkan object glass diatas batang gelas berbentuk “U”. 5. Potong agar Saboraud berbentuk persegi dan letakkan diatas object glass. 6. Sisi dari agar ini diinokulasi dengan kapang. 7. Letakkan kaca penutup diatas potongan agar, kemudian tutup cawan petri. HANDBOOK OF TA HAYATI 98 8. Diamkan dalam suhu kamar selama 48 jam. Khamir (Ragi) Merupakan fungi yang tidak berfilamen dan bereproduksi melalui pertunasan atau pembelahan sel. Pertunasan dapat terjadi melalui satu ujung (pertunasan polar) atau melalui beberapa tunas di sekeliling sel (pertunasan multilateral). Jenis pertunasan, bentuk dan jumlah askuspora merupakan ciri yang banyak digunakan dalam identifikasi khamir. Khamir digunakan dalam pembuatan roti dan anggur, namun ada khamir yang bersifat patogen, contoh : Candida dan Cryptococcus. HANDBOOK OF TA HAYATI 99 Klasifikasi khamir sebagai berikut berdasarkan morfologinya : Genus Torulopsis, Ciri Cryptococcus, Hanya ada pertunasan Rhodotorula Candida Tunas dan pseudomiselium Trichosporon Tunas, pseudomiselium dan arthrospora Geotrichum Miselium dan arthrospora Saccharomyces Tunas dan askuspora Torulopsis Kecil, berbentuk oval, seringkali menyebabkan pencemaran dalam industri minuman. Cryptococcus Besar, berbentuk bulat, mempunyai kapsel dan sering ditemukan pada buah, C. neoformans bersifat patogen terhadap manusia. Rhodotorula Khamir berwarna merah atau merah muda. Bila biakan dibiarkan tumbuh pada lempengan agar maltosa terlihat pertumbuhan koloni bayangan pada bagian tutup cawan petri. HANDBOOK OF TA HAYATI 100 Candida Candida penting dalam bidang kesehatan, terutama C. albicans. Semua candida membentuk koloni kekuningan dan licin pada agar, terkecuali C. krusei yang berpenampilan seperti serpihan kaca. C. utilis sering digunakan pada industri makanan sehingga sering disebut khamir pangan. Trichosporon T. cutaneum sering ditemukan pada permukaan kulit. Bila ditumbuhkan pada agar maltosa akan terlihat sebagai koloni yang menyebar dan basah. Geotrichum Pencemar dalam industri makanan dan acar. Saccharomyces S. cereviseae digunakan dalam industri minuman dan roti. HANDBOOK OF TA HAYATI 101 Bahan yang diperlukan : Biakan khamir Media : agar V-8 Potongan wortel Cara mengerjakan : Buat preparat basah dari biakan khamir yang disediakan. Periksa preparat dengan menggunakan perbesaran 45x dan 100x. Amati morfologi khamir dan penampilan tunas. Cari sel yang memiliki askuspora. Amati bentuk dan hitung jumlah askuspora. HANDBOOK OF TA HAYATI 102 Bila askuspora tidak ditemukan, biakkan khamir pada agar V-8 atau sepotong wortel. Khamir seringkali membentuk askuspora pada media biakan yang kaya seperti agar V-8. Bandingkan dengan tabel di bawah ini. TABEL CIRI BIOKIMIA BEBERAPA KHAMIR HANDBOOK OF TA HAYATI 103 Daftar Pustaka Anonim, 1995, Farmakope Indonesia Ed. IV, Jakarta : DEPKES RI. Benson, Microbiological Applications, e-book. Fardiaz, S., 1993, Analisis Mikrobiologi Pangan, Jakarta : PT RajaGrafindo Persada. Irianto, K., 2006, Mikrobiologi Menguak Dunia Mikroorganisme, Bandung : CV Yrama Widya. Lay, B.W., 1994, Analisis Mikroba di Laboratorium, Jakarta : PT RajaGrafindo Persada. HANDBOOK OF TA HAYATI 104