1 BAB I PENDAHULUAN A. Latar Belakang Sistem imun
advertisement

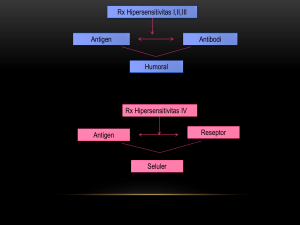
BAB I PENDAHULUAN A. Latar Belakang Sistem imun merupakan mekanisme pertahanan tubuh sebagai perlindungan dari bahaya berbagai bahan dalam lingkungan yang dianggap asing bagi tubuh seperti bakteri, virus, jamur, parasit dan protozoa (Abbas et al., 2015; Baratawidjaja & Rengganis, 2009; Benjamini et al., 2000). Ketika daya tahan tubuh lemah maka agen infektif akan dengan mudah menembus pertahanan tubuh dan menyebabkan penyakit. Oleh karena itu, upaya meningkatkan sistem imun menjadi penting untuk dilakukan, salah satunya adalah dengan menggunakan imunomodulator khususnya yang bersifat imunostimulan. Imunomodulator merupakan bahan atau agen yang dapat berinteraksi dengan sistem imun dan meyebabkan peningkatan atau penurunan aspek spesifik respon imun. Beberapa tanaman yang berpotensi sebagai imunomodulator antara lain meniran (Phyllanthus niruri L.), sirih merah (Piper crocatum Ruiz & Pav.) dan keladi tikus (Typhonium flagelliformae (Lodd.) Blume). Penelitian terdahulu menunjukkan bahwa penggunaan ekstrak tunggal herba meniran (Ash, 2012; Nworu et al., 2010; Lestarini, 2008; Eze et al., 2014), daun sirih merah (Hartini, 2014; Apriyanto, 2011) dan umbi keladi tikus (Handayani, 2012; Titania, 2012; Daulay, 2012; Sriyanti, 2012) telah terbukti mampu meningkatkan respon imun. Untuk meningkatkan efek terapetik dan meminimalisasi timbulnya efek samping 1 2 maka kombinasi obat atau herbal biasanya dilakukan dengan menggabungkan beberapa obat atau herbal dengan dosis yang lebih kecil daripada dosis optimumnya. Penelitian sebelumnya menggunakan kombinasi ekstrak etanolik herba meniran, daun sirih merah dan umbi keladi tikus oleh Vania (2014) dan Diarini (2014) dengan perbandingan 50mg EMN : 25mg ESM : 100mg EKT menunjukkan bahwa kombinasi ketiganya pada dosis 10mg/kgBB, 50mg/kgBB dan 100mg/kgBB tidak mempengaruhi aktivitas fagositosis makrofag dan proliferasi sel limfosit mencit. Pemberian fraksi n-heksana ekstrak etil asetat dan ekstrak metanol meniran pada dosis 100mg/kgBB mencit dapat meningkatkan repson imun nonspesifik (aktivitas fagositosis makrofag) dan respon imun spesifik (meningkatkan prolifersi limfosit dan titer antibodi primer dan sekunder) (Aldi et al., 2013; Eze et al., 2014). Ekstrak etanolik daun sirih merah pada dosis 100mg/kgBB dapat meningkatkan indeks fagsitosis tetapi tidak mempengaruhi kapasitas fagositosis dan tidak meningkatkan proliferasi limfosit tikus (Apriyanto, 2011) dan berdasarkan penelitian Nurrochmad et al. (2015) pemberian ekstrak etanolik umbi keladi tikus dosis 250mg/kgBB pada tikus yang diinduksi CPA dapat meningkatkan kemampuan fagositosis makrofag, sel T CD8+ dan mengurangi efek imunosupresi pada proliferasi limfosit. Berbeda dengan penelitian Vania (2014) dan Diarini (2014), dalam penelitian ini dosis kombinasi ekstrak yang digunakan adalah 25%, 50% dan 75% dari dosis optimum masing-masing ekstrak tunggal sehingga dosis kombinasinya 3 menjadi 12,5mg/kgBB EMN + 25mg/kgBB ESM + 62,5mg/kgBB EKT, 25mg/kgBB EMN + 50mg/kgBB ESM + 125mg/kgBB EKT dan 37,5mg/kgBB EMN + 75mg/kgBB ESM + 187,5mg/kgBB EKT. Pemilihan dosis optimum tersebut mengacu pada penelitian Aldi et al. (2013), Eze et al. (2014), Apriyanto (2011) dan Nurrochmad et al. (2015) setelah terlebih dahulu dilakukan konversi dosis ke tikus. B. Rumusan Masalah 1. Bagaimana pengaruh pemberian kombinasi ekstrak etanolik herba meniran (Phyllanthus niruri L.), daun sirih merah (Piper crocatum Ruiz & Pav.) dan umbi keladi tikus (Typhonium flagelliformae (Lodd.) Blume) terhadap aktivitas fagositosis makrofag sebagai parameter respon imun nonspesifik pada tikus galur Sprague Dawley yang diinduksi vaksin Hepatitis B? 2. Bagaimana pengaruh pemberian kombinasi ekstrak etanolik herba meniran (Phyllanthus niruri L.), daun sirih merah (Piper crocatum Ruiz & Pav.) dan umbi keladi tikus (Typhonium flagelliformae (Lodd.) Blume) terhadap proliferasi sel limfosit sebagai parameter repson imun spesifik pada tikus galur Sprague Dawley yang diinduksi vaksin Hepatitis B? 3. Bagaimana pengaruh pemberian kombinasi ekstrak etanolik herba meniran (Phyllanthus niruri L.), daun sirih merah (Piper crocatum Ruiz & Pav.) dan umbi keladi tikus (Typhonium flagelliformae (Lodd.) Blume) terhadap titer imunoglobulin G (IgG) sebagai parameter respon imun spesifik pada tikus galur Sprague Dawley yang diinduksi vaksin Hepatitis B? 4 C. Tujuan Penelitian 1. Mengetahui pengaruh kombinasi ekstrak etanolik herba meniran (Phyllanthus niruri L.), daun sirih merah (Piper crocatum Ruiz & Pav.) dan umbi keladi tikus (Typhonium flagelliformae (Lodd.) Blume) terhadap aktivitas fagositosis makrofag sebagai parameter respon imun nonspesifik pada tikus galur Sprague Dawley yang diinduksi vaksin Hepatitis B. 2. Mengetahui pengaruh kombinasi ekstrak etanolik herba meniran (Phyllanthus niruri L.), daun sirih merah (Piper crocatum Ruiz & Pav.) dan umbi keladi tikus (Typhonium flagelliformae (Lodd.) Blume) terhadap proliferasi sel limfosit sebagai parameter respon imun spesifik pada tikus galur Sprague Dawley yang diinduksi vaksin Hepatitis B. 3. Mengetahui pengaruh kombinasi ekstrak etanolik herba meniran (Phyllanthus niruri L.), daun sirih merah (Piper crocatum Ruiz & Pav.) dan umbi keladi tikus (Typhonium flagelliformae (Lodd.) Blume) terhadap titer imunoglobulin G (IgG) sebagai parameter respon imun spesifik pada tikus galur Sprague Dawley yang diinduksi vaksin Hepatitis B. D. Arti Penting Penelitian Penelitian ini dilakukan untuk menyelidiki potensi kombinasi ekstrak etanolik herba meniran (Phyllanthus niruri L.), daun sirih merah (Piper crocatum Ruiz & Pav.) dan umbi keladi tikus (Typhonium flagelliformae (Lodd.) Blume) sebagai agen imunomodulator dalam upaya pengatasan berbagai kondisi 5 kesehatan yang berkaitan dengan penekanan sistem imun. Hasil penelitian ini akan sangat bermanfaat untuk menambah data ilmiah mengenai potensi kombinasi ekstrak etanolik herba meniran, daun sirih merah dan umbi keladi tikus sebagai agen imunomodulator sehingga dapat menjadi sumber data yang bermanfaat bagi pengembangan penelitian selanjutnya. E. Tinjauan Pustaka 1. Sistem Imun Kata imun berasal dari bahasa Latin immunis yang berarti bebas dari beban (Benjamini et al., 2000). Dahulu imunitas diartikan sebagai daya tahan realtif hospes terhadap mikroba tertentu (Bellanti, 1985). Sistem imun adalah semua mekanisme yang digunakan tubuh untuk mempertahankan keutuhannya sebagai perlindungan terhadap bahaya yang ditimbulkan berbagai bahan dalam lingkungan hidup yang dianggap asing bagi tubuh (Baratawidjaja, 2000; Benjamini et al., 2000). Mekanisme tersebut melibatkan gabungan sel, molekul, dan jaringan yang berperan dalam resistensi terhadap infeksi yang disebabkan oleh berbagai unsur patogen yang terdapat di lingkungan sekitar kita seperti virus, bakteri, fungus, protozoa dan parasit (Kresno, 1996; Baratawidjaja & Rengganis, 2009). Sedangkan reaksi yang dikoordiansi oleh sel-sel, molekul-molekul dan bahan lainnya terhadap mikroba disebut dengan respon imun (Baratawidjaja & Rengganis, 2009). 6 Sistem imun memiliki tiga fungsi yaitu fungsi pertahanan (melawan patogen, fungsi homeostasis (mempertahankan keseimbangan kondisi tubuh dengan cara memusnahkan sel-sel yang sudah tidak berguna) dan pengawasan (surveillance). Pada fungsi pengawasan dini (surveillance) sistem imun akan mengenali sel-sel abnormal yang timbul di dalam tubuh dikarenakan virus maupun zat kimia. Sistem imun akan mengenali sel abnormal tersebut dan memusnahkannya. Fungsi fisiologis sistem imun yang terpenting adalah mencegah infeksi dan melakukan eradikasi terhadap infeksi yang sudah ada (Abbas et al., 2014). Respon imun ada dua yaitu imunitas alamiah atau nonspesifik/ natural/innate/native/nonadaptif dan imunitas dapatan atau spesifik/adaptif/ acquired. Gambar 1. Mekanisme imunitas bawaan dan imunitas adaptif (Abbas et al., 2014). Mekanisme imunitas bawaan merupakan pertahanan awal melawan infeksi. Sedangkan respon imun adaptif timbul setelahnya dan dimediasi oleh limfosit dan produknya. Antibodi mengeblok infeksi dan mengeliminasi mikroba, eradikasi mikroba ekstrasel dilakukan oleh sel T. Kinetika respon imun bawaan dan adaptif berbeda tergantung dari jenis infeksinya. 7 a. Respon imun nonspesifik Respon imun nonspesifik merupakan imunitas bawaan (innate imunity) dimana respon imun terhadap zat asing dapat terjadi walaupun tubuh sebelumnya tidak pernah terpapar oleh zat tersebut (Kresno, 1996). Imunitas nonspesifik berperan paling awal dalam pertahanan tubuh melawan mikroba patogen yaitu dengan menghalangi masuknya mikroba dan dengan segera mengeliminasi mikroba yang masuk ke jaringan tubuh (Abbas et al., 2014). Respon imun jenis ini akan selalu memberikan respon yang sama terhadap semua jenis agen infektif dan tidak memiliki kemampuan untuk mengenali agen infektif meskipun sudah pernah terpapar sebelumnya. Yang termasuk dalam respon imun nonspesifik adalah pertahanan fisik, biokimia, humoral dan seluler (Baratawidjaja & Rengganis, 2009). b. Respon imun spesifik Respon imun spesifik merupakan respon yang didapat dari stimulasi oleh agen infektif (antigen/imunogen) dan dapat meningkat pada paparan berikutnya. Target dari respon imun spesifik adalah antigen, yaitu suatu substansi yang asing (bagi hospes) yang dapat menginduksi respon imun spesifik (Benjamini et al., 2000). Antigen bereaksi dengan T-cell Receptor (TCR) dan antibodi. Antigen dapat berupa molekul yang berada di permukaan unsur patogen maupun toksin yang diproduksi oleh antigen yang bersangkutan. Ada tiga tipe sel yang terlibat dalam respon imun spesifik yaitu sel T, sel B dan APC (makrofag dan sel dendritik) (Benjamini et al., 2000). Respon imun 8 spesifik meliputi aktivasi dan maturasi sel T, sel mediator dan sel B untuk memproduksi antibodi yang cukup untuk melawan antigen (Kresno, 1996). Pada hakekatnya respon imun spesifik merupakan interaksi antara bebagai komponen dalam sistem imun secara bersama-sama. Respon imun spesifik terdiri dari respon imun seluler (cell-mediated immunity) dan respon imun humoral. Perbedaan kedua respon imun tersebut terletak pada molekul yang berperan dalam melawan agen infektif, namun tujuan utamanya sama yaitu untuk menghilangkan antigen (Benjamini et al., 2000). Respon imun seluler diperlukan untuk melawan mikroba yang berada di dalam sel (intraseluler) seperti virus dan bakteri. Respon ini dimediasi oleh limfosit T (sel T) dan berperan mendukung penghancuran mikroba yang berada di dalam fagosit dan membunuh sel yang terinfeksi. Beberapa sel T juga berkontribusi dalam eradikasi mikroba ekstraseluler dengan merekrut leukosit yang menghancurkan patogen dan membantu sel B membuat antibodi yang efektif (Abbas et al., 2015). Agen infektif yang berada di luar sel dapat dilawan dengan respon imun humoral. Respon ini dimediasi oleh serum antibodi, suatu protein yang disekresikan oleh sel B (Benjamini et al., 2000). Sel B berdiferensiasi menjadi satu klon sel plasma yang memproduksi dan melepaskan antibodi spesifik ke dalam darah serta membentuk klon sel B memori (Kresno,1996). Sel B menghasilkan antibodi yang spesifik untuk antigen tertentu. Antibodi ini berikatan dengan antigen membentuk suatu kompleks antigen-antibodi yang 9 dapat mengaktivasi komplemen dan mengakibatkan hancurnya antigen tersebut (Kresno, 1996). Respon imun humoral ada dalam darah dan cairan sekresi seperti mukosa, saliva, air mata dan ASI. Elemen lain yang berperan penting dalam respon imun humoral adalah sistem komplemen. Sistem komplemen diaktivasi oleh reaksi antara antigen dan antibodi. Ketika aktif sistem komplemen akan melisiskan sel target atau meningkatkan kemampuan fagositosis sel fagosit (Benjamini et al., 2000). Interaksi respon imun seluler dengan humoral disebut antibody dependent cell mediated cytotoxicity (ADCC) karena sitolisis baru terjadi bila dibantu antibodi. Dalam hal ini antibodi berfungsi melapisi antigen sasaran sehingga sel NK dapat melekat pada sel atau antigen sasaran dan menghancurkannya (Kresno,1996). 2. Imunomodulator Imunomodulator adalah berbagai macam bahan baik rekombinan, sintetik maupun alamiah yang merupakan obat-obatan yang digunakan dalam imunoterapi yang dapat mengembalikan dan memperbaiki sistem imun yang fungsinya terganggu atau untuk menekan yang fungsinya berlebihan (Baratawidjaja, 2000). Pengaruh senyawa tersebut terhadap respon imun dapat tergantung pada dosis, rute pemberian dan waktu pemberian. Imunoterapi merupakan suatu pendekatan pengobatan dengan cara merestorasi, meningkatkan atau mensupresi respon imun. 10 Ada dua cara mekanisme kerja dari obat imunomodulator yaitu up regulation (menguatkan sistem imun tubuh/imunostimulasi dan imunorestorasi) dan down regulation (menekan reaksi sistem imun yang berlebihan atau imunosupresi) (Baratawidjaja, 2000). Imunostimulasi adalah cara memperbaiki fungsi sistem imun menggunakan bahan yang merangsang sistem tersebut. Bahan yang dapat menginduksi atau meningkatkan sistem imun disebut dengan imunomostimulan, yang diperlukan pada pengobatan penyakit infeksi, imunodefisiensi dan keganasan (kanker). Imunorestorasi adalah suatu cara mengembalikan fungsi sistem imun yang terganggu dengan memberikan berbagai komponen sistem imun, seperti immunoglobulin dalam bentuk immune serum globulin (ISG), hyperimmune serum globulin (HSG), plasma, transplantasi sumsum tulang, jaringan hati, timus, plasmaferesis, dan leukoferesis (Baratawidjaja, 2000). Imunosupresi merupakan tindakan menekan respon imun. Senyawa yang dapat menekan respon imun disebut dengan imunosupresan. Penekanan sistem imun diperlukan pada beberapa kondisi misalnya transplantasi organ dan penyakit inflamasi yang menimbulkan kerusakan atau gejala sistemik seperti autoimun atau auto inflamasi (Baratawidjaja, 2000). 3. Makrofag Sel fagosit mononuklear adalah sel efektor yang berperan penting dalam imunitas nonspesifik maupun imunitas spesifik. Sel fagosit mononuklear yang paling dominan adalah makrofag. Makrofag berperan penting dalam pertahanan hospes karena memproduksi sitokin yang menginisiasi dan meregulasi inflamasi. 11 Makrofag akan memakan dan menghancurkan mikroba, serta membersihkan jaringan yang mati dan menginisiasi proses perbaikan jaringan (Abbas et al., 2014). Makrofag berperan dalam imunitas nonspesifik melalui aksi fagositosis mikroba dan produksi sitokin yang selanjutnya akan mengaktifkan mediatormediator inflamasi. Sedangkan dalam imunitas spesifik makrofag berperan sebagai efektor yang mengekspresikan protein mikroba yang telah difagosit kepada sel T. Selanjutnya sel T akan menstimulasi makrofag untuk menghancurkan mikroba tersebut. Pada permukaan makrofag terdapat reseptor untuk antibodi yang apabila diduduki oleh antibodi akan memicu fagositosis makrofag (Abbas et al., 2015). Sel ini berasal dari sel induk pluripoten yang mengalami diferensiasi menjadi sel pre-monosit yang meninggalkan sumsum tulang dan masuk ke dalam sirkuasi untuk selanjutnya berdiferensiasi menjadi monosit matang (Baratawidjaja & Rengganis, 2009). Monosit adalah fagosit yang didistribusikan secara luas di organ limfoid dan organ lainnya, berperan sebagai APC yang akan mengenal dan menyerang mikroba dan sel kanker, memproduksi sitokin, mengarahkan pertahanan sebagai respon terhadap infeksi, remodeling dan perbaikan jaringan (Baratawidjaja & Rengganis, 2009). Sel monosit yang matang akan bermigrasi ke berbagai jaringan untuk berdiferensiasi menjadi makrofag jaringan spesifik dengan berbagai fungsi. Makrofag yang hidup dalam jaringan sebagai makrofag residen (fixed macrophage) berbentuk khusus tergantung jaringan yang ditempati, misalnya di usus (makrofag intestinal), kulit (sel dendritik atau sel Langerhans), 12 paru (makrofag alveolar, sel Langerhans), hati (sel Kuppfer), otak (sel mikroglia), ginjal (sel mesangial), jaringan ikat (histosit), tulang (osteoklas) dan cairan peritoneum (makrofag peritoneal) (Baratawidjaja & Rengganis, 2009). Makrofag memiliki dua fungsi utama yaitu menelan dan menghancurkan agen infektif yang masuk ke dalam tubuh serta mengambil antigen dan memprosesnya untuk kemudian menyajikan antigen tersebut pada permukaannya kepada sel T. Fungsi makrofag yang kedua disebut dengan Antigen Presenting Cell (APC). Makrofag dan monosit dapat hidup lama, mempunyai beberapa granul dan melepas berbagai bahan di antaranya lisozim, komplemen, interferon dan sitokin yang semuanya berkontribusi dalam pertahanan nonspesifik maupun spesifik. Gambar 2. Tahapan fagositosis mikroba oleh sel fagosit (Abbas et al., 2014). Mikroba yang masuk ke dalam tubuh akan berikatan dengan reseptor sel fagosit kemudian membran sel fagosit akan mengelilingi mikroba yang terikat tadi dan pada akhirnya mikroba akan dicerna di dalam fagosom. Di dalam sel fagosit terjadi fusi antara fagosom dan lisosom membentuk fagolisosom. Sel fagosit menghasilkan ROS, NO dan enzim lisosomal dalam fagolisosom sehingga menyebabkan mikroba mati. 13 Makrofag yang teraktivasi adalah makrofag yang memiliki kemampuan membunuh mikroba yang lebih berkembang dibanding makrofag yang tidak aktif (Coligan et al., 2010). Makrofag diaktivasi oleh berbagai rangsangan misalnya LPS (Lipopolisakarida) yang dihasilkan bakteri, IFN-γ yang diproduksi oleh sel NK dan aktivasi TLR (Toll-like Receptor) oleh ligan PAMPs (Pathogen Associated Molecular Patterns) (Baratawidjaja & Rengganis, 2009; Coligan et al., 2010). Makrofag yang aktif dapat menangkap, memakan dan mencerna antigen eksogen, seluruh mikroba, partikel tidak larut dan bahan endogen seperti sel pejamu yang cedera atau mati karena makrofag akan menghasilkan NO, TNF dan IL-12 (Coligan et al., 2010). Penghancuran mikroorganisme atau antigen terjadi dalam beberapa tingkat yaitu kemotaksis, menangkap, memakan, fagositosis, memusnahkan dan mencerna (Baratawidjaja & Rengganis, 2009). Fagositosis merupakan proses ingesti partikel yang dilakukan oleh sel fagosit. MAF (Macrophage Activating Factor) adalah kemoatraktan untuk makrofag (Bellanti, 1985). Fagositosis yang efektif pada invasi dini antigen dapat mencegah terjadinya infeksi. Sel fagosit juga berinteraksi dengan komplemen dan sistem imun spesifik. Aktivitas fagositosis makrofag dapat ditentukan dengan menghitung indeks dan kapasitas fagositosisnya. 4. Limfosit Limfosit merupakan turunan dari sel darah putih (leukosit) yang berperan penting dalam sistem kekebalan tubuh dalam melawan berbagai penyakit infeksi. Limfosit berasal dari sel induk ploripoten yang berdiferensiasi melalui jalur 14 limfoid di dalam hati, sumsum tulang, dan timus sehingga menjadi beberapa kelas utama (Kresno, 1996). Limfosit terdiri atas sel T (TH, TC, TR), sel B dan sel NK (Baratawidjaja & Rengganis, 2009). Sel T berdiferensiasi di dalam timus, sedangkan sel B berdiferensiasi di dalam sumsum tulang belakang dan organ limfoid perifer. Pada burung sel B berdiferensiasi dalam bursa Fabricius (Baratawidjaja & Rengganis, 2009). Sel B mengalami maturasi menjadi sel plasma, atau sel B memori di bawah pengaruh makrofag. Sel T dibedakan menjadi sel TH (CD4+) yang dapat mengenali antigen, sel T supresor yang mengatur dan sel TC (CD8+) yang langsung memusnahkan zat asing. Beberapa sel CD4+ termasuk dalam subset sel T spesial karena berfungsi mencegah atau membatasi respon imun, yaitu limfosit T regulatori (TR) (Abbas et al., 2014). Sel NK termasuk dalam kelompok limfosit granuler besar yang memiliki banyak sitoplasma, granul plasma azurofilik, pseudopodia dan nukleus eksentris (Baratawidjaja & Rengganis, 2009). Limfosit mampu mengenali antigen secara spesifik karena mempunyai reseptor pada permukaannya yang mampu mengenal antigen tertentu. Reseptor tersebut pada sel T disebut dengan TCR dan surface immunoglobulin (sIg) pada sel B (Kresno, 1996). Limfosit B memiliki protein marker surface immunoglobulin M (sIgM), sedangkan marker protein pada limfosit T adalah limfosit TC berupa CD8+ dan limfosit TH berupa CD4+ (Shen & Louie, 2005). Sel T CD4+ memiliki peran yang sangat penting dalam imunitas spesifik yaitu membantu APC dan T CD8+ memulai respon imun spesifik. Secara umum, 15 limfosit yang teraktivasi akan segera membelah/berproliferasi dan mengekspresikan serta memproduksi sitokin yang dapat mengaktivasi proliferasi limfosit dalam organ limfoid (Baratawidjaja, 2000; Delves et al., 2011). Respon proliferasi limfosit terhadap antigen hanya terjadi jika pasien sudah diimunisasi dengan antigen, sudah sembuh dari infeksi mikroorganisme yang mengandung antigen, atau sudah divaksinasi. Selain aktivitas fagositosis makrofag, perubahan respon imun dapat diukur dari jumlah proliferasi limfosit. Uji proliferasi limfosit dapat dilakukan dengan mengukur kemampuan limfosit yang ditempatkan pada short-term tissue culture untuk membentuk suatu koloni proliferasi ketika distimulasi oleh molekul asing, antigen atau mitogen secara in vitro (Anonim, 2000). Salah satu metode yang dapat digunakan dalam uji proliferasi limfosit adalah MTT reduction. Penentuan sel dengan metode MTT biasanya digunakan untuk mengukur pertumbuhan sel sebagai respon terhadap adanya mitogen, stimulasi antigenik, growth factor dan reagen lain yang memicu pertumbuhan sel, untuk studi sitotoksisitas dan dalam derivasi kurva pertumbuhan sel (Anonim, 2007). Di dalam mitokondria sel hidup terdapat enzim mitokondria dehidrogenase yang dapat memotong cincin tetrazolium pada MTT (3-(4,5-dimethylthiazol-2-yl)2,5-diphenyltetra-zolium bromide) dan membentuk kristal ungu formazan. Absorbansi dari larutan berwarna ungu tersebut dapat dikuantifikasi dengan pengukuran panjang gelombang 500-600 nm. Peningkatan jumlah sel ditunjukkan 16 dengan peningkatan jumlah formazan MTT yang terbentuk dan peningkatan absorbansi. 5. Antibodi Antibodi atau yang disebut juga imunoglobulin merupakan molekul glikoprotein yang terdiri atas komponen polipeptida sebanyak 82-96% dan selebihnya karbohidrat (Kresno, 1996). Antibodi dibentuk oleh sel B sebagai respon atas adanya antigen yang bersifat imunologik masuk ke dalam tubuh dan berperan dalam respon imun humoral. Antibodi yang terbentuk bersifat spesifik terhadap antigen. Interaksi antara antigen dengan membran antibodi pada sel B naive, menyebabkan terjadinya respon imun humoral. Setelah disekresikan ke dalam sirkulasi darah dan cairan mukosal, antibodi akan menetralkan dan mengeliminasi mikroba dan toksin mikroba yang berada di luar sel inang (Abbas et al., 2014). Antibodi memiliki dua fungsi yaitu fungsi netralisasi (mengikat antigen) dan fungsi efektor yang diperantarai antibodi (Kresno, 1996). Fungsi efektor terdiri atas netralisasi mikroba atau produknya yang toksik, aktivasi sistem komplemen, opsonisasi antigen, lisis sel target dan hipersensitivitas tipe segera. Molekul antibodi dibentuk sel B dalam dua bentuk yaitu sebagai reseptor permukaan antigen dan sebagai antibodi yang disekresikan ke dalam cairan ekstraseluler. Pengikatan antigen harus disertai dengan fungsi efektor sekunder agar antigen terikat kuat dengan imunoglobulin. Fungsi efektor sekunder yaitu memacu aktivasi komplemen dan merangsang pelepasan hitamin oleh basofil atau 17 sel mast. Opsonisasi antigen oleh imunoglobulin memudahkan APC memproses dan menyajikan antigen kepada sel T. Gambar 3. Respon imun primer dan sekunder sel B (Abbas et al., 2014). Antigen X dan Y akan menginduksi produksi antibodi yang berbeda, yang merefleksikan spesifisitas antibodi tersebut. Respon sekunder terhadap antigen X lebih cepat dan besar dibandingkan dengan respon primer dan berbeda dengan respon primer terhadap antigen Y. Level produksi antibodi dinyatakan sebagai nilai arbitrari dan bervariasi tergantung tipe antigen yang memapar. Setelah imunisasi, repon imun primer akan muncul 1-3 minggu sedangkan respon imun sekunder muncul akan muncul 2-7 hari tetapi kecepatannya sangat dipengaruhi oleh antigen dan sifat imunisasi. Antibodi/imunoglobulin dapat ditemukan dalam berbagai cairan tubuh seperti darah, air mata, saliva dan ASI. Imunoglobulin memiliki 5 kelas utama yaitu IgG, IgA, IgM, IgD dan IgE. Klasifikasi ini dilakukan berdasarkan perbedaan struktur kimia yang mengakibatkan perbedaan sifat biologis maupun fisik. Imunoglobulin memiliki dua bentuk yaitu sIg dan Ig. Perbedaannya adalah pada domain terminal-C, di mana sIg memiliki bagian transmembran dan bagian intrasitoplasmik yang lebih pendek (Kresno, 1996). Kadar antibodi dalam darah dapat meningkat karena adanya respon primer dan respon sekunder terhadap antigen yang masuk ke dalam tubuh. Salah satu cara 18 yang digunakan untuk mendeteksi antibodi atau antigen dalam sampel ialah dengan Enzym Linked Immunosorbent Assay (ELISA). Metode ELISA dapat dikelompokkan menjadi ELISA langsung, ELISA tidak langsung, ELISA antibody-sandwich, ELISA double antobody-sandwich, ELISA direct cellular dan ELISA indirect cellular (Coligan et al., 2010). Prinsip dasar ELISA adalah bahwa suatu antibodi dapat mengenali satu epitop tertentu secara spesifik dan membentuk kompleks antigen-antibodi yang kemudian divisualisasikan dengan cara menambahkan antibodi kedua yang dikonjugasikan dengan enzim. Pemaparan substrat pada kompleks tadi akan menghasilkan warna yang dapat diukur intensitasnya. 6. Meniran Berikut ini adalah klasifikasi tumbuhan meniran (Anonim, 2012a). Divisi : Spermatophyta Subdivisi : Angiospermae Kelas : Dicotyledoneae Ordo : Euphorbiales Famili : Euphorbiaceae Genus : Phyllanthus Spesies : Phyllanthus niruri L. Phyllanthus niruri L. di daerah Jawa disebut dengan meniran dan di Sunda disebut dengan memeniran. Meniran merupakan tumbuhan terna semusim yang tumbuh liar, tingginya mencapai satu meter. Batangnya bulat, liat dan masif, tidak 19 berbulu, licin, berwarna hijau keunguan, serta bercabang dengan tangkai dan cabang-cabang berwarna hijau keunguan. Daunnya berwarna hijau dengan tipe majemuk berseling, memiliki anak daun sekitar 15-24 helai, berbentuk bulat telur, tepi rata, pangkal membulat, ujung tumpul dan di bawah ibu tulang daun sering terdapat butiran kecil-kecil, menggantung. Meniran memiliki bunga tunggal dengan daun kelopak berbentuk bintang, mahkota berwarna putih dan ukurannya kecil, serta buah dan biji (Sudarsono et al., 1996). Tumbuhan ini mampu tumbuh hingga 1000 meter di atas permukaan laut dengan curah hujan 2500-3000 mm/tahun. Selain di Indonesia meniran juga terdapat di India, Cina, Malaysia, Filipina, Australia, Amerika dan Afrika (Subarnas & Sidik, 1993 cit. Nugroho, 2003). Gambar 4. Meniran (Phyllanthus niruri L.) (Anonim, 2012a) Keseluruhan bagian dari meniran dapat dimanfaatkan sebagai obat. Masyarakat menggunakan meniran untuk mengobati penyakit kuning, infeksi saluran kencing, diuretik, diare, busung lapar, blennorrhagia, infeksi saluran pencernaan, penyakit karena gangguan fungsi hati, luka dan scabies, serta untuk meningkatkan nafsu makan dan antidemam (Sudarsono et al., 1996). Meniran 20 mengandung senyawa golongan flavonoid [quercetin; quercitrin; isoquercitrin; astragalin; rutin; kaempferol-4`-rhamnopyranosida; eriodictyol-7- rhamnopyranoside; fiestin-4`-O-glycoside; 5,6,7,4`-tetrehydroxy-8-(-3-methylbut2-enyl)-flavanone-5-O-rutinoside (nirurin)]; lignin; norsecurinine; securinine; allosecurinine; senyawa alkaloid (entnorsecurinine) dan trans-phytol (Sudarsono et al., 1996) serta polisakarida (arabinogalaktan) (Mellinger et al., 2005). Senyawa lignan yang ada dalam meniran antara lain mirphyllin (3,3`,5,9,9`pentamethoxy-4-hydroxy,4`,5`-methylendoxylignan), phyllnirurin methylendioxy-5`-methoxy-9`hydroxy-4`,7-epoxy-8,3`-neolignan, hypophyllanthin, nirtetralin, niranthin, phyllanthin, (3,4- isolintetralin, hinikinin, lintetralin, phyllantostatin A. Pada akar meniran terdapat 3,5,7-trihydroxyflavanol-4`-O-α-L(-) rhamnopyranoside, salah satu senyawa glikosida flavonoid dengan kaempferol sebagai aglikon dan rhamnosa sebagai bagian glikon. Senyawa yang berefek imunostimulan pada meniran berasal dari golongan flavonoid yaitu quercetin dan rutin karena dapat meningkatkan proliferasi sel limfosit (Liu et al., 2012). Arabinogalaktan memiliki efek imunostimulan dengan menstimulasi makrofag di dalam rongga peritoneum mencit untuk memproduksi anion superoksida (O2-) (Mellinger et al., 2005). Berdasarkan penelitian Lestarini (2008), mencit Balb/c yang dipejani Phyllanthus niruri L. dosis 125 µg, 250 µg dan 500 µg mengalami peningkatan jumlah limfosit teraktivasi dan kemampuan fagositosis makrofag. Ekstrak air meniran dapat meningkatkan ekspresi marker aktivasi (CD69), proliferasi limfosit 21 B dan T, produksi IFN-γ dan IL-4 (Nworu et al., 2010). Ash (2012) melaporkan adanya peningkatan aktivitas fagositosis makrofag dan produksi NO akibat pemberian ekstrak meniran hijau dan meniran merah pada mencit Balb/c yang diinfeksi S. thypi. 7. Sirih Merah Sirih merah merupakan tanaman yang tumbuh merambat dan tingginya bisa mencapai 10 m, tergantung pertumbuhan dan tempat merambatnya. Batang sirih berkayu lunak, beruas-ruas, beralur dan berwarna hijau keabu-abuan. Daun sirih merah berupa daun tunggal berbentuk seperti jantung hati, permukaan daun licin, bagian tepi rata dan pertulangannya menyirip. Bunga majemuk tersusun dalam bulir, merunduk dan panjangnya sekitar 5-15 cm (Backer & van Den Brink, 1963). Berikut ini adalah klasifikasi sirih merah (Anonim, 2012b). Divisi : Spermatophyta Subdivisi : Magnoliophyta Kelas : Magnoliopsida Ordo : Piperales Famili : Piperaceae Genus : Piper Spesies : Piper crocatum Ruiz & Pav. Sirih merah mengandung senyawa golongan flavonoid, alkaloid, tanin dan minyak atsiri (Safithri & Fahma, 2008). Piper sp. mengandung flavonoid, alkaloid, propenilfenol, lignan, neolignan, terpenoid, steroid, kawapyrone, 22 piperolide, chalchone, dihydrochalcone, flavon, flavanon dan komponen miselaneus (Parmar et al., 1997). Senyawa yang berperan sebagai imunostimulan pada sirih merah adalah golongan flavonoid dan neolignan. Flavonoid pada penggunaan dosis tertentu dapat berefek imunostimulan dan imunosupresan (Middleton et al., 2000). Senyawa neolignan memiliki efek imunomodulator yaitu antileishmaniasis, menekan produksi IL-6 dan IL-10 (Néris et al., 2013). Kustiawan (2012) telah berhasil mengisolasi dan mengidentifikasi kandungan senyawa aktif dari daun sirih merah yang termasuk golongan neolignan dan berefek pada aktivitas fagositosis makrofag secara in vitro, yaitu crocatidin (2allyl-4-(1’-(3”,4”,5”-trimethoxyphenyl) 3,5-dienone) trimethoxyphenyl) dan deasetyl propan-2’yl)-3,5-dimethoxycyclohexa- crocatidin (2-allyl-4-(1’acetyl-1’-(3”,4”,5”- propan-2’yl)-3,5-dimethoxycyclohexa-3,5-dienone). Hartini (2014) melaporkan bahwa dua senyawa neolignan (crocatidin dan deacetyl crcatidin) yang diisolasi dari ekstrak metanol daun sirih merah terbukti mampu meningkatkan aktivitas fagositosis makrofag dan produksi NO, tetapi tidak meningkatkan proliferasi limfosit. Gambar 5. Sirih merah (Piper crocatum Ruiz & Pav.) (Anonim, 2012b) 23 Secara empiris sirih merah dapat digunakan untuk menyembuhkan berbagai jenis penyakit diabetes mellitus, hepatitis, batu ginjal, keputihan, penyakit jantung, hipertensi, maag, radang liver, kelelahan, masuk angina, gonorrhoe (Sudewo, 2005 cit. Yuristiyani, 2012). Ekstrak etanolik daun sirih merah dapat meningkatkan indeks fagositosis makrofag namun tidak dapat meningkatkan proliferasi limfosit tikus secara signifikan (Apriyanto, 2011) dan tidak dapat mempengaruhi titer IgG tikus (Wiweko, 2010). Hartini (2014) melaporkan adanya peningkatan aktivitas fagositosis (dosis 5 dan 10 mg/kgBB) dan produksi IL-12 (dosis 2,5mg/kgBB, 5mg/kgBB dan 10mg/kgBB) pada mencit Balb/c yang dipejani senyawa neolignan hasil isolasi (1 dan 2) dari ekstrak metanol daun sirih merah. Namun pada pemberian dosis 2,5mg/kgBB, 5mg/kgBB dan 10mg/kgBB tidak berpengaruh terhadap proliferasi limfosit, titer IgG dan produksi IL-10. 8. Keladi Tikus Keladi tikus memiliki nama daerah yaitu bira kecil, daun panta susu, kalamayong, ileus, ki babi dan trenggiling mentik (Widyaningrum, 2011). Habitat keladi tikus yakni tempat yang lembab, basah dan teduh di daerah Asia Tenggara, Australia Utara dan India bagian Selatan (Lai et al., 2008). Keladi tikus memiliki daun tunggal yang muncul dari umbi, berbentuk bulat dengan ujung meruncing berbentuk jantung, warnanya hijau segar, tersusun di roset dan panjangnya 6-16 cm. Pangkal daunnya berbentuk jantung dengan tepi rata serta permukaan daun 24 mengkilap. Ciri khas dari tanaman ini adalah memiliki bunga unik yang bentuknya menyerupai keladi tikus (ekor tikus) (Widyaningrum, 2011). Bunganya muncul dari roset akar, bertangkai, panjangnya 4-8 cm dan berkelopak bunga bulat lonjong berwarna kekuning-kuningan. Bagian atas kelopak memanjang 5-21 cm dan ujungnya meruncing menyerupai ekor tikus. Umbi keladi tikus berbentuk bulat rata sebesar buah pala. Bagian dalam maupun luar umbi berwarna putih. Mahkota bunganya berbentuk panjang kecil berwarna putih mirip dengan ekor tikus, dari sinilah nama keladi tikus diberikan. Berikut ini klasifikasi keladi tikus (Widyaningrum, 2011). Divisi : Magnoliophyta Kelas : Liliopsida Ordo : Arales Famili : Araceae Genus : Typhonium Spesies : Typhonium flagelliforme Gambar 6. Keladi tikus (Thyphonium flagelliformae (Lodd.) Blume) (Anonim, 2014) 25 Keladi tikus mengandung alkaloid, flavonoid, terpenoid dan steroid (Mankaran et al., 2013). Komponen utama yang terdapat dalam keladi tikus adalah alkaloid dan flavonoid (Nobakht et al., 2010). Komponen lain yang ada dalam keladi tikus yaitu rantai asam lemak jenuh seperti metil ester dari asam linoleat, asam heksadekanoat, asam oktadekanoat, asam 9-oktadekanoat, dan asam 9,12-oktadekanoat (Choo et al., 2001). Di dalam umbi keladi tikus ditemukan adanya kandungan karbohidrat (Karuppiah, 2000). Aktivitas imunomodulator keladi tikus kemungkinan berasal dari karbohidrat. Karbohidrat dalam umbi keladi tikus diperkirakan berupa amilum yang merupakan suatu polisakarida. Polisakarida memiliki efek imunomodulator (Ramberg et al., 2010) dengan menstimulasi proliferasi limfosit, meningkatkan kemampuan membunuh sel NK, meningkatkan fagositosis makrofag dan produksi NO oleh makrofag, serta meningkatkan kadar TNF-α dalam serum (Ni et al., 2010; Zhang et al., 2012). Keladi tikus biasanya digunakan sebagai pengobatan alternatif pada terapi kanker karena memiliki aktivitas antikanker, sitotoksik dan antioksidan (Mankaran et al., 2013). Keladi tikus dapat mengatasi efek samping dari kemoterapi seperti rambut rontok, mual, perasaan tidak nyaman dan berkurangnya nafsu makan (Widyaningrum, 2011). Nurrochmad et al. (2015) melaporkan bahwa ekstrak etanolik keladi tikus memiliki efek imunomodulator pada tikus yang diinduksi cyclophosphamide (CPA) karena dapat mengurangi efek imunosupresan pada proliferasi limfosit, meningkatkan jumlah dan aktivitas 26 fagositosis makrofag, meningkatkan proliferasi sel T CD8+ dan mengurangi efek penekanan sitokin seperti TNF-α dan IL-1α. F. Landasan teori Kombinasi beberapa herbal dapat menyebabkan timbulnya efek yang rumit karena terjadi interaksi antara beberapa komponen (Che et al., 2013). Interaksi yang paling diinginkan adalah ketika menghasilkan peningkatan efek terapetik, tetapi adanya multikomponen dalam herbal menyebabkan interaksi menjadi tidak dapat diprediksi dan rumit. Berdasarkan teori dan praktik pengobatan herbal Cina, penggunaan beberapa bahan yang diformulasi didasarkan pada enam mode dasar interaksi herbal-herbal, yaitu penguatan (reinforcement), potensiasi (potentiation), pengendalian (restraint), detoksikasi (detoxification), menetralkan (counteraction), dan toksisitas (toxicity) (Che et al., 2013). Prinsip utamanya yakni untuk meningkatkan keamanan dan efektivitas penggunaan herbal. Suatu bahan aktif ketika dikombinasikan dengan bahan aktif lainnya dapat berefek sinergis (aditif dan potensiasi) ataupun antagonis. Meniran pada dosis 100 mg/kgBB mencit dapat meningkatkan aktivitas fagosistosis makrofag (Aldi et al., 2013), proliferasi limfosit (Aldi et al., 2013; Eze et al., 2014) dan titer antibodi primer dan sekunder (Eze et al., 2014). Daun sirih merah pada dosis 100 mg/kgBB dapat meningkatkan indeks fagositosis makrofag (Apriyanto, 2011), sedangkan umbi keladi tikus pada dosis 250 mg/kgBB dapat meningkatkan aktivitas fagositosis makrofag, meningkatkan jumlah sel T CD8+ dan mengurangi 27 efek imunosupresi pada proliferasi sel limfosit (Nurrochmad et al., 2015). Agar diperoleh efek sinergis maka dalam mengkombinasi beberapa obat/herbal biasanya dilakukan dengan menggabungkan beberapa obat/herbal yang dosisnya diturunkan dari dosis penggunaan masing-masing obat/herbal tersebut. G. Hipotesis Kombinasi ekstrak etanolik herba meniran, daun sirih merah dan umbi keladi tikus menggunakan dosis kombinasi 25%, 50% dan 75% dari dosis optimum masing-masing ekstrak tunggal mampu meningkatkan aktivitas fagositosis sel makrofag sebagai parameter respon imun nonspesifik serta proliferasi limfosit dan titer IgG sebagai parameter respon imun spesifik pada tikus yang diinduksi vaksin Hepatitis B.