Peranan Epitel Alveoli pada Edema Paru Non-kardiogenik
advertisement

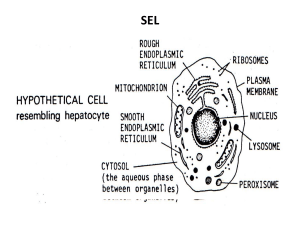
TINJAUAN PUSTAKA Peranan Epitel Alveoli pada Edema Paru Non-kardiogenik Jatu A, Lusiana SU Departemen Pulmonologi dan Kedokteran Respirasi Fakultas Kedokteran Universitas Sebelas Maret, Surakarta, Indonesia ABSTRAK Struktur alveoli terdiri dari 3 macam sel, yakni sel tipe 1, sel tipe 2, dan makrofag alveolar. Epitel alveoli berperan dalam resolusi edema paru non-kardiogenik antara lain pengeluaran cairan alveoli ke interstitial, repair epitel, serta normalisasi produksi surfaktan. Proses resolusi bertujuan menjaga kantung alveoli tetap kering, terjadi melalui proses transpor aktif ion dan cairan secara transeluler dan paraseluler. Transpor ion dan cairan dalam epitel alveoli terganggu pada edema paru non-kardiogenik pada apikal dan membran basalis alveoli. Edema paru didefinisikan sebagai akumulasi cairan abnormal di dalam kompartemen ekstravaskuler paru. Edema paru menyebabkan gagal napas dan berakibat fatal. Penanganan yang tepat dan cepat akan mencegah perburukan klinis. Kata kunci: Alveoli, edema paru non-kardiogenik, epitel, gagal napas ABSTRACT Alveoli structure consists of 3 types of cell namely type 1 cell, type 2 cell, and alveolar macrophages. The role of alveoli epithelial in resolution noncardiogenic pulmonary edema is reabsorption of liquid alveoli to interstitial, epithelium repair, and normalization surfactant production. The goal is to keep alveoli sacs stay dry that occur through ion and fluids active transport process in transcellular and paracellular pathways. There is impairment in ion and fluid transport in apical and membranous ganglia of epithelial alveoli in noncardiogenic pulmonary edema. Pulmonary edema is defined as an abnormal accumulation of fluid in the pulmonary extravascular compartments. Pulmonary edema causes respiratory failure and could be fatal. The appropriate and fast management would prevent clinical worsening. Jatu A, Lusiana SU. The Role of Epithelial Alveoli in Noncardiogenic Pulmonary Edema. Keywords: Alveoli, noncardiogenic pulmonary edema, epithelial, respiratory failure PENDAHULUAN Jumlah relatif cairan intravaskuler dan ekstravaskuler paru sebagian besar diatur oleh permeabilitas membran kapiler. Edema paru didefinisikan sebagai akumulasi cairan abnormal di dalam kompartemen ekstravaskuler paru. Edema paru dapat menyebabkan gagal napas dan berakibat fatal. Penanganan edema paru yang tepat dan cepat akan mencegah perburukan klinis.1,2 Edema paru secara garis besar terbagi menjadi dua tipe, yaitu edema paru kardiogenik (edema hidrostatik, hemodinamik) dan edema paru nonkardiogenik (edema paru peningkatan permeabilitas, acute lung injury/ALI, acute respiratory distress syndrome/ARDS). Gejala klinis keduanya hampir sama sehingga sulit dibedakan. Kemampuan untuk membedakan penyebab edema paru sangat penting, Alamat korespondensi karena mekanisme dan tata laksananya berbeda.3-5 ALVEOLI DAN STRUKTUR DI SEKITARNYA Perkembangan alveoli embrional dimulai pada usia kehamilan 30 - 32 minggu dan jumlahnya berkembang secara eksponensial hingga menjelang kelahiran. Luas alveoli saat lahir diperkirakan 3 - 4 m2 dengan morfologi masih sangat berbeda dibanding alveoli dewasa. Sruktur alveoli bayi akan terlihat sama dengan dewasa saat 2 bulan setelah lahir.6,7 Sel tipe 1 dan tipe 2 berkembang dari endoderm. Sel tipe 1 dan tipe 2 sudah dapat dibedakan pada usia kehamilan 30 - 32 minggu, karena pada sel tipe 2 ada lamella yang nampak setelah pengecatan histokimia dengan monoclonal antibody, surfactant-related protein specific antibodies, dan hybridization surfactant protein mRNA. Jumlah surfaktan cukup untuk memenuhi kebutuhan pernapasan pada usia kehamilan 30 - 32 minggu. Peran surfaktan dipengaruhi hormon terutama glukokortikosteroid.6,7 Sel Tipe 1 Sel epitel alveoli tipe 1 adalah sel skuamosa dengan diameter sekitar 50 - 100 μm dan volume sekitar 2000 - 3000 μm.3 Sel tipe 1 tersusun membentuk dinding alveoli. Jumlah sel tipe 1 sekitar 1/3 jumlah keseluruhan sel epitel alveoli, namun melapisi hampir 95% permukaan alveoli.8-11 Sel tipe 1 berisi beberapa vesikel berukuran kecil yang disebut caveola. Pengecatan histokimia memperlihatkan caveola berisi protein caveolin-1. Analisis biokimia email: [email protected] CDK-227/ vol. 42 no. 4, th. 2015 271 TINJAUAN PUSTAKA menunjukkan konsentrasi protein caveolin-1 dan mRNA yang tinggi di paru, yang diekspresikan oleh sel tipe 1 dan sel endotel vaskuler. Aquaporin, kanal natrium, dan kanal natrium kalium adenosine triphosphatase (NaKATP-ase) terdapat pada sel tipe 1.6,10,12 Sel tipe 1 berperan penting pada pertukaran gas secara pasif. Jarak antara permukaan apikal sel tipe 1 dengan permukaan endotel kapiler tipis, sehingga menyebabkan jarak yang dibutuhkan gas untuk berdifusi juga kecil. Sel tipe 1 berperan pada transpor cairan serta ion ke dalam dan keluar alveoli. Sel tipe 1 mengekspresikan kanal natrium dan NaKATP-ase.6,10,12 Sel tipe 1 berperan pada ekspresi transkripsi protein yang tidak bisa diekspresikan oleh sel tipe 2, misalnya aquaporin-5. Protein aquaporin-5 penting karena merupakan protein utama yang mampu mengekspresikan cairan melalui kanal cairan.10 Sel Tipe 2 Sel epitel alveoli tipe 2 (granular pneumocyte, giant corner cell, type 2 pneumocyte) adalah sel kuboid dengan diameter sekitar 10 μm dan volume sekitar 450 - 900 μm.3 Sel tipe 2 melapisi sekitar 5% permukaan alveoli, jumlahnya sekitar 15% dari sel distal paru dan bersifat lebih resisten terhadap cedera. Permukaan apikal ditutupi oleh mikrovili. Sitoplasma sel tipe 2 terisi beberapa organela yang tersusun sebagian oleh fosfolipid dan protein. Sitoplasma sel tipe 2 memiliki aktivitas metabolisme yang tinggi.6,8-10,13,14 Sel tipe 2 dapat berproliferasi menjadi sel tipe 1. Peristiwa ini terjadi pada kondisi patologis, misalnya saat terjadi kerusakan epitel. Peristiwa ini dipicu oleh trigger factor seperti fibroblast growth factor (FGF), hepatocyte growth factor (scatter factor), dan heparin binding epithelial growth factor (HBEGF). Hal ini dimaksudkan untuk menjaga kelangsungan fungsi epitel alveoli.8-10,13,15 Sel tipe 2 terutama berfungsi untuk sintesis dan produksi epitel alveoli. Sel tipe 2 berperan untuk repair karena kemampuannya berproliferasi, dan berperan pada kultur sel karena mempunyai protein spesifik yang mampu berdiferensiasi menjadi sel tipe 1 dan sel tipe 2. Protein tersebut diproduksi oleh sel tipe 2, baik secara in vivo maupun in vitro, yaitu laminin, fibronectin, entactin, tenascin, dan kolagen tipe IV.8,10,12,13,16 272 Sel tipe 2 berperan pada sintesis, sekresi, dan recycle surfaktan. Surfaktan adalah suatu protein yang berfungsi untuk melapisi permukaan alveoli, menjaga tegangan permukaan agar alveoli tidak kolaps, menjaga keseimbangan cairan di alveoli serta fungsi pertahanan tubuh. Surfaktan mampu memicu terjadinya opsonisasi patogen, sehingga memfasilitasi eliminasi oleh makrofag. Salah satu jenis surfaktan, yakni surfactant protein-A (SP-A), diketahui mempunyai peran penting untuk memperkuat sistem imun.6,13,14 Kanal ion yang berperan pada resorpsi ion dan aquaporins tempat transpor cairan transepitel terdapat pada sel tipe 2. Sel tipe 2 juga mengekspresikan beberapa aquaporin, yaitu kanal cairan yang mengatur pergerakan cairan transepitel.13 Makrofag Alveoli Makrofag alveoli (dust cell) adalah sel berukuran besar dan mampu bergerak aktif. Sel ini berasal dari monosit. Jumlah makrofag alveoli sedikit dalam jaringan ikat di dinding alveoli. Berdasarkan lokasinya, makrofag di paru terdiri dari 4 jenis: makrofag alveoli, makrofag interstitial, makrofag intravaskuler, dan sel dendritik. Makrofag alveoli menempati tempat spesifik di paru, yaitu pada lapisan surfaktan yang diproduksi oleh sel tipe 2.11,12,17 Makrofag alveoli adalah makrofag tubuh yang terpajan langsung oleh udara luar. Makrofag alveoli terletak di antara jaringan paru dan udara, sehingga merupakan pertahanan utama terhadap benda asing yang terhirup bersama udara pernapasan. Makrofag alveoli mempunyai aktivitas fagositosis dan mikrobisidal. Benda asing berupa partikel kecil yang berdiameter kurang dari 0,5 mikron dapat masuk ke alveoli. Dua pertiga partikel tersebut akan dikeluarkan bersama udara pernapasan, dan sisanya akan dikeluarkan oleh makrofag alveoli.11 Dua mekanisme yang berperan pada perekrutan makrofag alveoli adalah chemoattractive monosit ke dalam pembuluh darah paru dan replikasi monosit di paru. Makrofag berikatan dengan berbagai macam reseptor antara lain: imunoglobulin, protein, komplemen, lipoprotein, lektin dan marker permukaan, misalnya antibodi monoklonal.17-18 Masa hidup makrofag alveoli tergantung pada kondisi lingkungan, pada kondisi biasa waktu hidup makrofag alveoli adalah 4 - 8 hari dan pada kondisi steril bisa lebih panjang. Pada kondisi kultur di laboratorium bisa mencapai 100 hari. Sebagian besar makrofag alveoli dikeluarkan dari paru melalui bronkus oleh proses mucocilliary clearance dan sisanya dikeluarkan lewat drainage limfatik.17 Makrofag alveoli dapat memproduksi interleukin-1 (IL-1), IL-6, tumor necrosis factor (TNF), transforming growth factor-β (TGF-β), fibroblast growth factor (FGF), chemotactic factor, platelet derived growth factor (PDGF), dan colony stimulating factors (CSFs). Produksi sitokin tersebut tergantung pada stimulus yang diterima. Stimulus terberat yang biasa terjadi adalah lipopolisakarida dan virus. Makrofag alveoli bisa diperoleh melalui pemeriksaan bronchoalveolar lavage (BAL).19 Makrofag alveoli berperan penting pada pertahanan paru untuk menjaga paru tetap kering dan steril. Pada kondisi normal, makrofag berasal dari sumsum tulang. Makrofag alveoli akan menuju lokasi target untuk menangkap benda asing dan mengeluarkannya melalui mucosiliary clearance. Beberapa peran makrofag alveoli antara lain:17,19 1. Presentasi reseptor di membran sel 2. Metabolisme asam arakidonat 3. Produksi reactive oxygen species (ROS) 4. Aktivitas antimikroba (fungsi fagolisosom) 5. Produksi sitokin Rongga Interstitial Lapisan interstitial pada septum alveoli sangat tipis. Serat elastis dan matriks ekstraseluler yang diproduksi oleh fibroblast terdapat pada bagian tebal tempat barrier udara dan pembuluh darah. Membran basalis antara epitel alveoli dan endotel terpisah pada tempat tersebut.6 Peran Epitel Alveoli pada Edema Paru Kardiogenik Reabsorpsi cairan edema merupakan aspek penting resolusi. Epitel alveoli adalah kunci peristiwa ini. Sel epitel alveoli berperan aktif pada transpor ion dan zat terlarut, selain sebagai barrier untuk lewatnya cairan ke CDK-227/ vol. 42 no. 4, th. 2015 TINJAUAN PUSTAKA rongga udara, proses ini penting untuk resolusi edema paru. Terdapat hubungan antara transpor ion transepitelial dengan clearance edema paru non-kardiogenik, pasien dengan transpor ion transepitelial baik akan menunjukkan peningkatan resolusi edema paru non-kardiogenik dan memperbaiki outcome dibandingkan pasien dengan transpor ion transepitelial terganggu. Kondisi yang dapat menurunkan aktivitas transpor natrium tersebut antara lain: hipoksia, peningkatan sintesis nitric oxide (NO), endothelin-1(ET-1), IL-1β, TNF-α, dan serotonin. Endothelin-1 adalah suatu vasokonstriktor yang berperan dalam regulasi tekanan pembuluh darah pulmoner. Kadar endothelin-1 pada edema paru nonkardiogenik meningkat. Aktivitas transpor ion dapat meningkat pada pemberian agonis β-adrenergik, sehingga bermanfaat untuk meningkatkan clearance cairan alveoli dan mempercepat resolusi edema paru.8,20-22 Pergerakan cairan melalui epitel alveoli adalah proses interseluler yang menyertai perbedaan tekanan osmotik akibat transpor ion natrium melewati epitel alveoli. Pergerakan cairan tidak hanya paraseluler tetapi juga transeluler. Kanal khusus untuk tempat lewatnya cairan disebut aquaporin. Terdapat 4 macam aquaporin di paru. Aquaporin yang dominan pada sel tipe 1 adalah aquaporin-5 yang merupakan tempat utama clearance cairan edema paru. Cairan paling banyak melewati sel tipe 1 karena koefisien permeabilitas sel tipe 1 paling tinggi. Penutupan jalur aquaporin akan menghambat resolusi edema paru.20 Hipoksia dapat mengganggu transpor cairan dari rongga udara di distal paru. Hipoksia dapat terjadi pada kondisi di ketinggian atau pada kondisi patologik lainnya. Percobaan pada tikus yang dianestesi menunjukkan bahwa hipoksia dapat mengganggu clearance cairan oleh alveoli dengan cara menghambat jalur amiloride sensitive.12 Reabsorpsi cairan edema tergantung pada transpor aktif natrium dan klorida melewati barrier epitel alveoli. Tempat utama untuk reabsorpsi natrium dan klorida adalah kanal ion epitel yang terletak pada membran apikal sel epitel tipe 1 dan 2 serta jalan napas distal. Natrium secara aktif keluar ke ruang interstisial melewati NaKATP-ase yang terletak CDK-227/ vol. 42 no. 4, th. 2015 pada membran basolateral sel tipe 2. Air akan mengikuti secara pasif melewati aquaporin, yaitu kanal air yang terutama terdapat pada sel epitel tipe 1.23 Derajat cairan pada alveoli tergantung pada luasnya edema interstitial, kerusakan epitel alveoli, dan kemampuan epitel alveoli untuk mengurangi cairan edema pada alveoli. Kerusakan epitel alveoli mengakibatkan penurunan kemampuan untuk remove cairan pada alveoli, sehingga memperlambat resolusi edema paru.24 Pada edema paru dapat terjadi abnormalitas fungsi alveoli dengan atau tanpa abnormalitas struktur alveoli. Jenis cedera yang berbeda dapat juga terjadi pada waktu yang bersamaan. Fase akut edema paru ditandai dengan masuknya cairan yang banyak mengandung protein ke dalam rongga udara sebagai akibat dari peningkatan permeabilitas membran alveoli kapiler. Membran ini terdiri dari dua barrier, yakni endotel mikrovaskuler dan epitel alveoli. Edema paru lebih dipengaruhi oleh kerusakan endotel mikrovaskuler, akan tetapi epitel alveoli berperan penting pada resolusi dari edema paru. Derajat kerusakan epitel paru adalah faktor penentu yang penting pada resolusi edema paru.20-22 Secara fisiologis, epitel alveoli menunjukkan fungsi penting pada resolusi edema paru. Proses reabsorpsi cairan edema dan perbaikan epitel alveoli yang rusak akan diikuti oleh perbaikan klinis dari edema paru, proses ini bisa berlangsung cepat atau lambat tergantung kondisi epitel alveoli. Organisasi membran hialin terjadi apabila proses ini terganggu, sehingga menyebabkan terjadinya fibrosis.25 Repair edema paru melibatkan proliferasi dan diferensiasi sel epitel tipe 2. Resolusi cairan edema merupakan proses sekunder menyertai transpor ion natrium sel epitel alveoli. Protein terlarut dalam cairan edema akan dikeluarkan melalui proses difusi paraseluler dan endositosis, sedangkan makrofag akan menangkap protein yang tidak terlarut kemudian terjadi proses apotosis. Proliferasi bertahap dari fibroblas dan miofibroblas terjadi apabila sel epitel tidak dapat berproliferasi. Apoptosis sel tipe 2 bersifat menetap, sehingga terjadi fibrosis interstisial dan intraalveoli. Proses ini dimodulasi oleh sitokin dan growth factor yang dilepaskan oleh makrofag pada alveoli yang mengalami edema.20,26 Peran sel tipe 2 sebagai sel progenitor meningkat saat terjadi kerusakan struktural alveoli. Repair epitel membutuhkan koordinasi beberapa proses molekuler. Repair optimal terjadi pada membran basalis utuh, serta ketersediaan matriks fibrin untuk adhesi, perluasan, dan migrasi sel. Matriks tersebut antara lain: epithelial growth factor, transforming growth factor, hepatocyte growth factor, dan fibroblast growth factor.26 Proliferasi sel tipe 2 pada kondisi normal berlangsung sekitar 4% per hari dan meningkat pada kondisi edema paru. Kemampuan barrier epitel alveoli untuk resorpsi cairan edema dalam waktu 12 jam setelah onset cedera paru akut pada sepertiga kasus.26 Penelitian lain menunjukkan bahwa pengeluaran cairan merupakan proses aktif yang dipengaruhi oleh transpor aktif ion melalui kanal yang ada di apikal sel epitel alveoli, dibuktikan oleh pemberian amiloride (penghambat pompa natrium). Hasilnya adalah penurunan reabsorpsi cairan sebesar 40 - 70%. Pemberian ouabain in vitro menunjukkan hambatan pada kanal NaKATP-ase di basolateral membran sel epitel, sehingga terjadi penurunan reabsorpsi cairan edema sebanyak 90%. Pemberian ouabain harus hati-hati karena bersifat kardiotoksik.27 Sel yang terpapar dengan hipoksia selama 60 detik tidak akan menurunkan konsumsi oksigen, namun bila hipoksia berlanjut, konsumsi oksigen akan menurun. Hipoksia selama 5 menit akan menurunkan konsumsi oksigen sel epitel alveoli sebanyak 25%, sedangkan apabila hipoksia berlanjut selama 24 jam, konsumsi O2 akan turun sebanyak 35%. Hipoksia selama 5 menit bersifat reversible, namun setelahnya akan menjadi irreversible. Sel akan beradaptasi dengan jalan menurunkan aktivitas ATP-ase yang memerlukan oksigen. Aktivitas protein yang mengonsumsi oksigen turun sebesar 28% setelah hipoksia berlangsung selama 5 menit, dan 61% setelah hipoksia berlangsung selama 24 jam.27 Karakteristik utama ARDS adalah sekumpulan 273 TINJAUAN PUSTAKA Tabel. Biomarker serum pada pasien ARDS23 Surfactant-associated protein (SP-A, SP-B,SP-D) Protein khusus di epitel paru Mucin-associated antigen KL-6/MUC1 Sitokin Parameter serum lainnya IL-1, IL-2, IL-6, IL-8, IL-10, IL-15, TNF-á, Marker aktivasi endotel Adhesion molecules (E, L-selectin, ICAM-1, VCAM-1, VWF) Marker aktivasi neutrofil MMP-9, LTB-4, ferritin Keterangan: SP: surfactant protein; KL: Krebs von den lungen; MUC: mucin; IL: interleukin; TNF-α: tumor necrosis factor alpha; ICAM: intracellular adhesion molecule; VCAM: vascular cell adhesion molecule; VWF: von Willebrand factor: MMP: matrix metalloproteinase; LTB: leukotriene B. gejala yang ditandai oleh inflamasi difus dan peningkatan permeabilitas pada endotel vaskuler dan epitel alveoli. Berbagai macam mediator inflamasi ditemukan meningkat pada pasien ARDS meliputi protein, endotoksin, TNF-α, IL-1, IL-2, IL-6, IL-8, IL-15, chemokins, ferritin, marker aktivasi endotelium (molekul adhesi, von-willebrand factor, MMP serta leukotrien). Pemeriksaan biomarker tersebut penting pada pasien ARDS, karena dapat memperkirakan prognosis dan merencanakan penatalaksanaan yang tepat sehingga pasien tidak mengalami komplikasi yang lebih parah.23,29 RINGKASAN Struktur alveoli terdiri dari 3 macam sel, yakni sel tipe 1, sel tipe 2, dan makrofag alveolar. Epitel alveoli berperan dalam resolusi edema paru non-kardiogenik antara lain pengeluaran cairan alveoli ke interstitial, repair epitel, serta normalisasi produksi surfaktan. Proses resolusi bertujuan untuk menjaga kantung alveoli tetap kering, melalui proses transpor aktif ion dan cairan secara transeluler dan paraseluler. Edema paru didefinisikan sebagai akumulasi cairan abnormal di dalam kompartemen ekstravaskuler paru. Pada edema paru nonkardiogenik terjadi gangguan transpor ion dan cairan epitel pada apikal dan membran basalis alveoli. Edema paru dapat menyebabkan gagal napas dan berakibat fatal. Penanganan yang tepat dan cepat akan mencegah perburukan klinis. DAFTAR PUSTAKA 1. Gluecker T, Capasso P, Schnyder P, Gudinchet F, Schaller MD, Revelly JP, et al. Clinical and radiologic feature of pulmonary edema. Radiographics. 1999;19:1507-31. 2. Cotter G, Kaluski E, Moshkovitz Y, Milovanov O, Krakover R, Vered Z. Pulmonary edema: New insight on pathogenesis and treatment. Curr Opin Cardiol. 2001;16:159-63. 3. Ware LB, Matthay MA. Cinical practice acute pulmonary edema. N Engl J Med. 2005;353:2788-96. 4. Gonzales J, Verin A. Noncardiogenic pulmonary edema. Intech [Internet]. 2012 March 2 [cited 2013 August 23]. Available from: www.intechopen.com/books/lung-diseases-selected- 5. Perina DG. Noncardiogenic pulmonary edema. Emerg Med Clin N Am. 2003;21:385-93. 6. Crystal RG, Randell SH, Engelhardt JF, Voynov J, Sunday ME. Airway epithelial cells: Currents concepts and challenges. Proc Am Thorac Soc. 2008;5:772-7. state-of-the-art-reviews/non-cardiogenic-pulmonary-edema. 7. Hollenhorst MI, Richter K, Fronius M. Ion transport by pulmonary epithelia. J Biomed Biotechnol. 2011;174306. 8. Gropper MA, Wiener-Kronish JW. The epithelium in acute lung injury/acute respiratory distress syndrome. Curr Opin Crit Care. 2008;14:11-5. 9. Muluk A. Pertahanan saluran nafas. Maj Kedokt Nusantara. 2009;42:55-8. 10. Folkesson HG, Matthay MA. Alveoli and distal airway epithelial fluid transport. In: Mason RJ, Broadus VC, Martin TR, King TE, Schraufnagel DE, Murray JF et al, eds. Murray and Nadel’s Textbook of Respiratory Medicine. 5th ed. Philadelphia: Saunder Elsevier; 2010. p. 217-24. 11. Gereke M, Grobe L, Prettin S, Kasper M, Deppenmeier S, Gruber AD, et al. Phenotypic alterations in type II alveoli epithelial cells in CD4+ T cell mediated lung inflammation. Respir Res. 2007;8:47-60. 12. Li H. The alveolar epithelium and pulmonary fibrosis. J Epithel Biol Pharmacol. 2009;2:30-5. 13. Crandall ED, Matthay MA. Alveolar epithelial transport, basic science to clinical medicine. Am J Respir Crit Care Med. 2001;163:1021-9. 14. Fehrenbach H. Alveolar epithelial type II cell: Defender of the alveolus revisited. Respir Res. 2001;2:33-46. 15. Bowden DH. The alveolar macrophage. Environ Health Perspect. 1984;55:327-41. 16. Eisenhut M. Reduction of alveolar epithelial ion and fluid transport by inflammatory mediators. Am J Respir Cell Mol Biol. 2007;36:388-9. 17. Takahashi K. Development and differentiation of macrophages and related cells: Historical review and current concepts. J Clin Experimental Hematopathol. 2000;41(1):1-28. 18. Lohmann-Matthes ML, Steinmuller C, Franke-Ullmann G. Pulmonary macrophages. Eur Resp J. 1994;7:1678-89. 19. Matthay MA, Ware LB, Zimmerman GA. The acute respiratory distress syndrome. J Clin Invest. 2012;122:2731-40. 20. Hastings RH, Folkesson HG, Matthay MA. Mechanisms of alveolar protein clearance in the intact lung. Am J Physiol Lung Cell Mol Physiol. 2004;286:679-89. 21. Matthay MA, Robriquet L, Fang X. Alveolar epithelium: Role in fluid balance and acute lung injury. Proc Am Thorac Soc. 2005;2:206-13. 22. Jain M, Sznajder JI. Effects of hypoxia on the alveolar epithelium. Proc Am Thorac Soc. 2005;2:202-5. 23. Piantadosi CA, Schwartz DA. The acute respiratory distress syndrome. Ann Intern Med. 2004;141:460-70. 24. Piiper J. Pulmonary gas exchange. In: Greger R, Windhorst U, eds. Comprehensive human physiology. Berlin: Springer Verlag; 1996. p. 2037-49. 25. Berthiaume Y. Epithelial function in lung injury. In: Hamid Q, Shannon J, Martin J, eds. Physiologic Basics Respiratory Disease.1st ed. Ontario: BC Decker; 2005. p. 439-52. 26. Albertine KH. Anatomy of the lung. In: Mason RJ, Broadus VC, Martin TR, King TE, Schraufnagel DE, Murray JF, et al, eds. Murray and Nadel’s Textbook of Respiratory Medicine. 5th ed. Philadelphia: Saunder Elsevier; 2010. p. 1-20. 27. Tzouvelekis A, Pneumatikos I, Bouros D. Serum biomarkers in acute respiratory distress syndrome an ailing prognosticator. Respir Res. 2005;6:62. 28. Kuzovlev AN. Surfactant proteins A and D: New diagnostic and prognostic biomarkers of acute respiratory distress syndrome in septic patients. J Pulm Respir Med. 2013;3:1-2. 29. Fang X, Bai C, Wang X. Bioinformatics insights into acute lung injury/acute respiratory distress syndrome. Clin Transl Med. 2012;1(1):9. 274 CDK-227/ vol. 42 no. 4, th. 2015