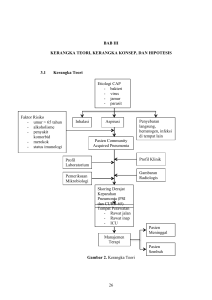
BAB II LANDASAN TEORI A. SISTEM PERTAHANAN PARU Udara
advertisement

5 BAB II LANDASAN TEORI A. SISTEM PERTAHANAN PARU Udara inspirasi selain sebagai sumber oksigen (O2) bagi tubuh juga memasukkan sejumlah partikel, gas beracun, dan mikroorganisme ke dalam saluran napas. Saluran napas atas dan bawah memproteksi paru melalui pertahanan anatomis. Hal ini berhubungan dengan reflek batuk dan penggunaan perangkat mukosilier beserta enzim dan imunoglobulin A (IgA) yang disekresikan.1 Sejumlah sel berfungsi memelihara sterilitas dan melindungi saluran napas, yaitu epitel saluran napas, epitel alveolar, makrofag, sel dendritik, dan sel polimorfonuklear (PMN). Sel-sel ini terutama dilengkapi dengan patternrecognition receptors (PRRs) dan secara anatomis dikondisikan untuk mengatasi mikroba yang masuk ke rongga udara.1 Lapisan basal mukosa respiratorik di hidung dan saluran napas konduksi mengandung sel dendritik yang tersusun rapat, akan mengenali dan menangkap setiap invasi mikroorganisme serta membawanya ke dalam drainaise limfatik untuk membangkitkan sistem imun adaptif. Partikel berukuran kurang dari 2 µm yang mencapai unit respiratorik di luar bronkiolus respiratorik akan ditangkap makrofag alveolar dalam mileu yang kaya elemen pertahanan seperti IgG, komplemen, surfaktan, dan fibronektin.1 1. Epitel saluran napas Epitel merupakan sawar mukosa dan berkontribusi terhadap bersihan mukosilier, membatasi permukaan lumen saluran napas yang saling berhubungan melalui tight junction, intermediate junction, gap junction, dan desmosom yang relatif impermeable.1 Sel epitel memproduksi sejumlah mediator seperti reactive oxygen radicals (ROR), sitokin, dan platelet-activating factor untuk merekrut sel inflamasi ke tempat inflamasi. Sitokin tersebut antara lain tumor necrosis factor (TNF)-α, interleukin (IL)-1β, dan granulocyte/macrophage colony-stimulating factor (GM-CSF).3 Sel epitel meningkatkan regulasi molekul adhesi sebagai 6 respons terhadap inflamasi, serta mengekspresikan major histocompatibility complex (MHC) kelas I dan II saat terpapar dengan sitokin. Sel epitel normal juga mensekresi peptida antimikroba seperti β-defensin, musin, lisozim, nitrit oksida, dan laktoferin yang berkontribusi langsung terhadap pertahanan nonspesifik.1,3 Patogen yang menginvasi akan dimusnahkan sel efektor teraktivasi sebagai pertahanan pertama.4 Epitel saluran napas terbagi menjadi sel epitel bronkial dan alveolar yang berfungsi sebagai sawar fisik dan aktivitas antimikroba. Sel epitel alveolar terdiri dari dua tipe sel berbeda, menghasilkan komponen antibakteri seperti surfaktan, menginisiasi dan mengakhiri inflamasi, serta mengatur pertukaran gas untuk menyediakan O2. Resident alveolar macropahages dan terkadang sel dendritik juga ditemukan pada epitel alveolar, merupakan mediator kunci sistem imun bawaan dan adaptif.4 Sel alveolar tipe I terutama berperan memfasilitasi pertukaran gas, terdiri dari sawar impermeable cukup luas sehingga dapat mengenali dan merespons produk mikroba. Sel epitel alveolar tipe II, disebut juga pneumosit tipe II, berperan sebagai pertahanan saluran napas melalui sekresi produk antimikroba, mengenali invasi patogen, memproduksi sitokin dan kemokin yang akan mengaktifkan dan menonaktifkan inflamasi. Sel tipe II ini dapat berdiferensiasi menjadi sel tipe I dan mensekresi enzim untuk memperbaiki kerusakan epitel.4 Kedua tipe sel epitel alveolar sangat penting dalam homeostasis alveoli, yaitu untuk pertukaran air dan elektrolit. Pneumosit merupakan sumber utama protein surfaktan A-D (SP A-D) berfungsi sebagai aglutinasi mikroba yang memfasilitasi pembersihannya.1,4 2. Sel dendritik Sel dendritik merupakan antigen-presenting cell (APC) yang menstimulasi proliferasi sel T naive, bersama makrofag menjadi mekanisme pertahanan pertama dalam mengenali berbagai macam patogen. Sel inflamasi ini berasal dari sumsum tulang, mencapai jaringan melalui sirkulasi darah, dan terdistribusi di seluruh saluran napas.3 Sel dendritik menjadi penghubung antara sistem imun bawaan dan 7 adaptif, terletak di atas dan bawah membran basalis dalam keadaan imatur dengan dendrit meluas di antara sel epitel. Sel dendritik pada paru manusia ditandai tingginya aktivitas endositik. Inflamasi paru dan kerusakan jaringan yang diinduksi invasi mikroba menyebabkan maturasi sel dendritik, segera setelah teraktivasi sel dendritik akan bermigrasi ke struktur limfoid pada limfonodi hilar.1,5 3. Sel makrofag alveolar Sel makrofag alveolar berada di saluran napas, alveoli, dan interstisial paru, atau bermigrasi ke dalam mikrovaskular paru. Sel ini berperan penting memodulasi respons inflamasi akut maupun kronik, meskipun dapat berproliferasi tetapi jumlahnya tidaklah cukup untuk melawan infeksi.3 Makrofag alveolar menjadi lini pertama pertahanan terhadap organisme atau partikel yang mencapai saluran napas bawah.1 Makrofag sebagai sumber utama sitokin, kemokin, dan mediator inflamasi lainnya memiliki fungsi utama memusnahkan mikroba atau partikel terinhalasi, membersihkan surfaktan paru, serta menekan berkembangnya inflamasi dan respons imun yang tidak sesuai.2,3 Kemampuan makrofag berinteraksi dengan patogen dimediasi reseptor permukaan yang mampu mengikat ligan spesifik, termasuk toksin, polisakarida, lipopolisakarida (LPS) , protein komplemen, dan imunoglobulin. Fungsi makrofag diperkuat sel dendritik, keduanya mampu memfagosit bakteri, partikulat, dan sel apoptotik.1 Patogen terinhalasi memicu sel epitel paru memproduksi kemokin dan sitokin yang akan menarik dan mengaktivasi neutrofil, monosit, dan sel dendritik. Patogen tersebut juga akan memicu respons makrofag alveolar untuk memfagositosis, sekaligus memicu respons imun bawaan. Proses inflamasi beserta sitokin dan sinyal endogen berbahaya akan mengaktivasi kerja sel dendritik seperti terlihat pada Gambar 1.6 8 Gambar 1. Proses inflamasi paru Dikutip dari (6) 4. Neutrofil Neutrofil atau limfosit PMN berperan penting dalam sistem imun bawaan yang menentukan ketahanan host melawan infeksi bakteri dan jamur.7 Neutrofil dihasilkan oleh sel progenitor sumsum tulang, beredar selama 6-8 jam dalam darah, dan bermigrasi ke jaringan inflamasi sebagai respons terhadap sinyal yang diproduksi mekanisme imun bawaan lokal.2 Peranan neutrofil dalam mekanisme pertahanan antibakteri di paru melibatkan berbagai langkah seperti aktivasi faktor transkripsi, produksi kemokin, peningkatan regulasi molekul adhesi, dan peningkatan interaksi antar sel.8 Neutrofil menyediakan pertahanan lini kedua, merupakan sel yang pertama direkrut ke tempat infeksi atau cedera, dan menyerang jamur, protozoa, bakteri, virus, serta sel tumor. Sel inflamasi ini bermigrasi keluar dari kapiler paru dan masuk ke dalam rongga udara selama terjadi infeksi paru. Neutrofil akan membunuh mikroba dengan reactive oxygen species (ROS), protein antimikroba, dan enzim degradatif (elastase) setelah fagositosis.3 Interaksi neutrofil dengan sel lain pada jaringan inflamasi dan limfonodi dapat dilihat pada Gambar 2. 9 5. 6. Gambar 2. Interaksi neutrofil dengan sel imun dan non imun pada jaringan inflamasi dan limfonodi. Keterangan: MSCs= mesenchymal stem cells, DCs= dendritic cells, NK= natural killer, CCR7= CC-chemokine receptor 7, TCR= T cell receptor, TLR= toll-like receptor Dikutip dari (9) Neutrofil dilengkapi dengan granula sitotoksik bervariasi berisi molekul antimikroba berbeda-beda (peptida kationik, protease, laktoferin, mieloperoksidase) untuk melawan mikroba patogen pada sistem imun bawaan. Berdasarkan ada tidaknya mieloperoksidase (MPO), granula tersebut dibedakan menjadi granula peroksidase positif (granula primer atau azurofilik) dan negatif (granula spesifik atau sekunder).7 Neutrofil juga membentuk neutrophil extracellular traps (NETs) untuk meregulasi beratnya infeksi dalam aktivitas fagositik bakteri patogen dan pelepasan molekul antimikroba. Neutrophil extracellular traps tersusun oleh material kromatin padat dan protease serin yang sama seperti protein sitoplasma, dapat terikat pada bakteri gram positif maupun negatif. Neutrophil extracellular traps mudah mendegradasi faktor virulensi bakteri dan membunuh bakteri ekstraselular karena kadar protease serin yang tinggi.7 10 5. Respons imun terhadap infeksi Patogen yang masuk host akan menginisiasi interaksi kompleks antara molekul patogen dengan sensor host, bertujuan menginduksi respons imun yang sesuai melalui kerja dinamis sel imun bawaan dan molekul mediatornya. Sistem imun pada mamalia diklasifikasikan menjadi sistem imun bawaan dan adaptif.10,11 a. Sistem imun bawaan Peranan utama sistem imun bawaan adalah mengenali dan mengeliminasi patogen, merupakan lini pertama pertahanan tubuh yang sangat efektif.10,12 Komponen efektor imun bawaan terdiri dari peptida antimikroba (α dan β defensin), mannosa binding protein, lisozim, laktoperoksidase, opsonisasi, aktivasi komplemen, interferon, dan fagosit. Komponen selularnya meliputi sel dendritik, makrofag, neutrofil, sel natural killer (NK), basofil, sel mast, dan eosinofil.13 Sistem imun bawaan mengenali patogen melalui reseptor bervariasi, dikenal sebagai PRRs yang diekspresikan makrofag, sel dendritik, sel mast, neutrofil, eosinofil, sel NK, sel epitel, dan fibroblas. Ligan yang dikenali PRRs disebut sebagai pathogen-associated molecular patterns (PAMPs) yang strukturnya bervariasi, hanya diproduksi mikroba, dan penting untuk patogenitas atau pertahanan mikroba.11 Toll-like receptors (TLRs) akan mengenali secara spesifik masingmasing PAMPs, terdapat minimal sepuluh tipe yang diketahui berperan dalam proses pengenalan mikroba di permukaan sel maupun endosom. Toll like receptor-4 mengenali endotoksin dan LPS bakteri gram negatif, sedangkan TLR-2 mengenali lipoprotein atau lipopeptida, lipoarabinomanan, lipoteichoic acid, peptidoglikan, dan zimosin. Proses pengenalan PAMPs memicu fagositosis sistem imun bawaan dan respons imun adaptif selular maupun humoral.12 b. Sistem imun adaptif Sistem imun adaptif terdiri dari dua sistem efektor mayor, yaitu imunitas yang diperantarai limfosit B (humoral) dan limfosit T (selular). Limfosit B mengenali antigen asli berupa karbohidrat, protein, dan kelompok kimia 11 sederhana.11,14 Reseptor limfosit T hanya mengenali peptida yang berasal dari antigen protein terikat pada permukaan sel MHC. Respons imun terhadap antigen spesifik membutuhkan waktu sekitar 7-10 hari untuk proliferasi dan diferensiasi limfosit B dan T. Terjadinya respons imun spesifik terhadap antigen infeksius dapat dibagi menjadi tiga fase yaitu fase aferen, pemrosesan atau kontrol sentral, dan eferen.11 Sel dendritik berperan sebagai penghubung antara respons imun bawaan dan adaptif, terdapat di jaringan perifer sebagai sel imatur.15 Sel ini mengenali patogen melalui TLRs, setelah teraktivasi akan berubah menjadi matur yang mengekspresikan major histocompatibility complex (MHC) I dan II. Sel dendritik bermigrasi ke limfonodi untuk mengaktifkan sel T naive yang spesifik terhadap antigen, selanjutnya mengalami proliferasi dan diferensiasi ke dalam tipe tertentu dari respons sel T seperti terlihat pada Gambar 2. 6,15,16 Sel T helper (Th)-1 memproduksi interferon (IFN)-γ dan terutama membantu sel monositik, termasuk makrofag dan sel dendritik, selanjutnya akan membunuh patogen intraselular serta memperkuat opsonisasi dengan bantuan sel B.6 Gambar 2. Regulasi aktivasi dan respons sel T helper Dikutip dari (17) 12 B. PNEUMONIA Perhimpunan Dokter Paru Indonesia (PDPI) mendefinisikan pneumonia sebagai inflamasi dan konsolidasi jaringan paru disebabkan mikroorganisme (bakteri, virus, jamur, dan parasit). Pneumonia yang disebabkan Mycobacterium tuberculosis tidak termasuk, sedangkan peradangan paru disebabkan nonmikroorganisme (bahan kimia, radiasi, aspirasi bahan toksik, dan obat-obatan) disebut pneumonitis.18 Pneumonia berdasarkan klinis dan epidemiologis dibagi menjadi empat kelompok yaitu:19 1. Pneumonia komunitas atau community-acquired pneumonia (CAP) yaitu pneumonia yang didapat dari masyarakat. 2. Pneumonia nosokomial atau hospital-acquired pneumonia (HAP) yaitu pneumonia yang terjadi setelah 48 jam perawatan di rumah sakit dan disingkirkan semua infeksi yang inkubasinya terjadi sebelum masuk rumah sakit. 3. Pneumonia aspirasi merupakan pneumonia akibat regurgitasi cairan saluran cerna ke paru, terjadi pada pasien penurunan kesadaran seperti penyalahgunaan obat, kejang, gangguan serebrovaskular, atau dalam pengaruh pembiusan. 4. Pneumonia pada penderita immunocompromised merupakan pneumonia yang terjadi pada seseorang dengan defek sistem imun humoral dan selular. Faktor risiko pneumonia komunitas meliputi penyakit paru obstruktif kronik (PPOK), insufisiensi ginjal, gagal jantung kongestif, penyakit arteri koroner, diabetes melitus, keganasan, kelainan neurologis kronik, dan kelainan hepar kronik. Faktor risiko lain yang signifikan adalah tinggal di tempat padat seperti penjara, penampungan tuna wisma, dan panti. Beberapa penelitian menunjukkan terdapat faktor risiko independen seperti alkoholisme, asma, imunosupresi, dan usia lanjut (≥71 tahun). Aspirasi merupakan faktor risiko mayor infeksi pneumokokus.20 1. Etiologi Pengetahuan terhadap patogen penyebab pneumonia komunitas dijadikan dasar pemilihan terapi antibiotik empirik yang berdampak penting terhadap 13 prognosis pasien.21 Sebagian besar kasus pneumonia komunitas disebabkan infeksi bakteri. Streptococcus pneumoniae, Haemophillus influenzae, dan Moraxella catarrhalis merupakan agen penyebab dari 50% kasus pneumonia komunitas dengan S. pneumoniae sebagai penyebab tersering di semua kelompok usia. Organisme gram negatif akhir-akhir ini makin terlihat sebagai etiologi mayor. Mycoplasma pneumoniae, Chlamidia pneumoniae, dan spesies Legionella merupakan organisme atipik penyebab pneumonia. Mycoplasma pneumoniae dan infeksi Legionella jarang didapatkan pada usia tua, berkebalikan dengan H. influenzae.22-24 Data dari beberapa rumah sakit di Indonesia tahun 2012 menunjukkan penyebab terbanyak pneumonia komunitas di ruang rawat inap dari bahan sputum adalah kuman gram negatif (Klebsiella pneumoniae, Acinetobacter baumanii, Pseudomonas aeruginosa), sedangkan gram positif (S. pneumoniae, Streptococcus viridans, Staphylococcus aureus) ditemukan dalam jumlah sedikit.18 2. Patogenesis Saluran napas bawah dirancang efektif untuk melindungi dari invasi patogen. Infeksi dapat terjadi apabila mekanisme proteksi terganggu atau tingginya jumlah patogen.20 Predisposisi pneumonia antara lain pada kondisi penurunan atau penekanan batuk, gangguan aktivitas mukosilier, penurunan aktivitas fagositik efektif dari makrofag alveolar dan neutrofil, serta gangguan produksi Ig.25 Risiko infeksi paru dipengaruhi kemampuan mikroorganisme untuk merusak permukaan epitel saluran napas. Mikroorganisme dapat mencapai permukaan saluran napas melalui empat cara yaitu inokulasi langsung, penyebaran melalui pembuluh darah, inhalasi bahan aerosol, dan kolonisasi di permukaan mukosa. Kolonisasi merupakan cara terbanyak, sebagai hasil abnormalitas pertahanan alamiah yang akan mempengaruhi keseimbangan antara replikasi bakteri serta pembersihannya.3 Pneumonia merupakan konsekuensi kolonisasi di paru, cedera epitel terinduksi patogen, aktivasi inflamasi, dan aktivasi berlebihan dari mekanisme perbaikan jaringan. Kebocoran vaskular dan 14 edema yang disebabkan respons host tersebut menyebabkan patogen mendapat akses masuk ke dalam darah, menyebar sistemik dan menyebabkan sepsis.4 Infeksi parenkim paru tidak hanya diikuti perubahan fungsi normalnya, tetapi juga memicu respons sistemik terhadap invasi mikroorganisme. Konsekuensi patofisiologis inflamasi dan infeksi berupa penurunan ventilasi pada area terkena. Alveoli yang terisi penuh eksudat inflamasi memungkinkan tidak terjadi ventilasi dan ketidaksesuaian ventilasi-perfusi yang ekstrim bermanifestasi sebagai hipoksemia.26 Infeksi bakterial akut terjadi apabila bakteri berjumlah sangat banyak menyerang pertahanan lokal, memicu inflamasi akut yang melibatkan imunitas bawaan dan adaptif.3 Respons inflamasi lokal dimulai saat invasi patogen mencapai parenkim paru. Sel inflamasi dan cairan akan masuk ke alveoli menghasilkan konsolidasi, diikuti keluarnya mediator inflamasi yang ikut sirkulasi darah. Hal inilah yang menyebabkan munculnya tanda dan gejala pneumonia. Keseimbangan antara respons inflamasi host dan pertumbuhan mikroba merupakan faktor kunci proses penyakit. Inflamasi seperti pedang bermata dua yang penting untuk resolusi infeksi tetapi juga bertanggungjawab pada kerusakan jaringan.20 Bakteri terinhalasi dalam jumlah signifikan menghadapi mekanisme pertahanan pertama host berupa pelepasan toksin silier, pneumolisin, endotoksin, dan protease IgA sehingga mengganggu bersihan mukosilier dan membuat bakteri melekat pada epitel. Sel dendritik, makrofag alveolar, dan sel epitel teraktivasi sebagai penanda patogen yang terindentifikasi melalui TLRs. Pengenalan patogen akan mengawali inflamasi, berkembang melalui empat fase yaitu inisiasi, amplifikasi, fagositosis, dan resolusi.3 a. Inisiasi Toll-like receptors merupakan PRRs yang terikat pada membran, mengenali pola molekular spesifik patogen yang dikenal sebagai PAMPs. Toll-like receptors setidaknya memiliki sepuluh tipe yang mengenali mikroba pada permukaan sel atau di dalam endosom, misalnya TLR-4 mengenali endotoksin dan lipopolysaccharide-binding proteins bakteri gram negatif, sedangkan TLR-2 15 mengenali bakteri gram positif dan peptidoglikan.3,27 Pattern-recognition receptors sitosolik terutama terdiri dari nucleotide oligomerization domain (NOD)-like receptors (NLRs) dan berfungsi sebagai regulator respons imun bawaan melawan patogen mikroba. Stimulasi NOD1 dan NOD2 akan mengaktifkan mitogen-activated protein kinase dan nuclear factor-kappa B (NFκB). Aktivasi NLRs seperti NLRP3 melalui PAMPs menyebabkan oligomerisasi dan merekrut protein adaptor sehingga akan terbentuk kompleks multiprotein disebut “inflammasome” yang berkontribusi terhadap produksi sitokin proinflamasi seperti IL-1β dan peptida antimikroba.3,27 Aktivasi inflammasome pada sel tertentu dapat memicu kematian sel host secara cepat (pyroptosis), sehingga memproteksi host melalui pencegahan replikasi bakteri.3 b. Amplifikasi Aktivasi sel setelah PAMPs dapat dikenali akan meningkatkan faktor transkripsi seperti NF-κB, produksi hormon pertumbuhan, kemokin, molekul adhesi, dan sitokin proinflamasi seperti IL-8 dan TNF-α. Jalur utama respons inflamasi dikendalikan faktor transkripsi selular NF-κB yang bermigrasi ke nukleus dan membentuk kompleks dengan DNA, menghasilkan ekspresi sitokin proinflamasi.3,27 Neutrofil bermigrasi cepat dari darah menuju tempat infeksi, dimediasi kemoatraktan seperti IL-8, granulocyte chemotactic protein-2 (GCP-2), leukotrien B4 (LTB4) yang disekresi monosit, makrofag, keratinosit, sel mast, endotel, dan sel imun host lainnya. Pengenalan dan fagositosis neutrofil terhadap mikroorganisme yang menginvasi dimediasi melalui PRRs dan difasilitasi antibodi Fc serta reseptor komplemen yang mengikat komplemen dan mikroba terselimuti antibodi.27 Interleukin-8 bertindak sebagai agen kemotaktik neutrofil, sedangkan TNF-α meningkatkan eskpresi molekul adhesi sel endotel kapiler paru untuk peningkatan adhesi neutrofil. Neutrofil teraktivasi akan melepaskan lebih banyak IL-8 sehingga pada akhirnya akan meningkatkan perekrutan neutrofil. Tumor necrosis factor-α diproduksi secara cepat oleh sel darah teraktivasi dan berperan 16 sebagai proinflamasi dan prokoagulan, diperkuat sitokin lain seperti IL-1, IL-2, IL-6, IL-8, dan IFN-γ.3,27 Saat neutrofil dan makrofag alveolar melawan patogen pada jalur nonspesifik, sel dendritik mempresentasikan limfosit T dengan antigen asing yang menyebabkan respons Th1 maupun Th2. Sel T teraktivasi dan sel B akan ikut mempertahankan tubuh terhadap serangan bakteri. Pelepasan hormon pertumbuhan dan sitokin dari sel T teraktivasi selanjutnya akan menstimulasi makrofag.3 c. Fagositosis Fagositosis merupakan proses dimana partikel dikenali, diikat pada permukaan sel, dan mengalami internalisasi ke dalam membran plasma vakuola intraselular atau fagosom. Sel fagosit mamalia antara lain leukosit PMN (dikenal sebagai neutrofil), sel dendritik, monosit, dan makrofag. Pada saat mikroorganisme memasuki bagian steril tubuh, sel fagosit akan menarik secara kemotaktik, mengikat mikroorganisme, mencerna, dan mematikannya.28 Mikroorganisme yang menginvasi dimatikan dan dibersihkan melalui dua mekanisme. Mekanisme pertama melibatkan makrofag alveolar dan kemampuannya membebaskan faktor kemotaktik di sekitar neutrofil dan mengawali respons imun. Mekanisme kedua terjadi saat bakteri memicu sel T, mengeluarkan sitokin yang menstimulasi kapasitas fagositik dan bakterisidal makrofag alveolar.3 Setelah fagositosis, mikroorganisme dalam fagosom akan dimusnahkan melalui nicotinamide adenine dinucleotide phosphate (NADPH) oxidase-dependent dan myeloperoxidase-dependent reactive oxygen species atau peptida antimikroba dari granula sitoplasma.27 Peran neutrophil extracellular traps (NETs) dalam memperkuat aktivitas fagositik dan memproduksi molekul antimikroba sering dibicarakan dan sampai saat ini masih dalam penelitian. Neutrophil extracellular traps terdiri dari histon, kromatin, granula azurofilik, dan protein sitosolik yang mengikat dan menghancurkan patogen.7,27 Neutrophil extracellular traps mampu mengikat gram negatif maupun positif, dapat dengan mudah menghancurkan faktor virulensi 17 bakteri dan membunuh bakteri secara ekstraselular karena tingginya kadar protease serin.7 Dua model NETs yang dikeluarkan di rongga ekstraselular melibatkan mekanisme kematian sel karena dikeluarkan dari neutrofil mati atau melibatkan ekstrusi material kromatin bersama dengan protease serin dari neutrofil intak. Mekanisme pertama terjadi dalam 2-3 jam setelah pajanan myristate phorbol (PMA), Staphylococcus aureus, atau Candida albicans sebagai stimulus. Mekanisme kedua melibatkan pengenalan LPS atau bakteri patogen oleh trombosit atau neutrofil, terjadi sangat cepat dalam beberapa menit setelah pajanan, dan terkait dengan obstruksi vaskular selama terjadinya sepsis.7 Perangkap yang terdapat dalam serat deoxyribonucleic acid (DNA) mencegah penyebaran mikroorganisme dan menyediakan faktor antimikroba berkadar tinggi pada tempat infeksi. Proses ini terjadi selama interaksi antara permukaan sel patogen dengan komponen NETs. Fungsi antimikroba ini diperoleh dari protein granula maupun sitoplasma, seperti NE, histon, MPO, katepsin G, proteinase 3 (PR3), laktoferin, kalprotektin dan peptida antimikroba.29 Aktivitas antimikroba NETs merupakan hasil perpaduan komponen-komponen tersebut. Histon merupakan komponen paling toksik, meskipun mekanisme toksisitasnya masih belum jelas diketahui.30 d. Resolusi Resolusi terjadi setelah keberhasilan respons host. Fagositosis bakteri komplit disertai penghancuran bakteri oleh ROS, protein penginduksi permeabilitas bakterisidal, laktoferin, elastase, serta NETs akan menurunkan pengaturan sistem pertahanan host. Perbaikan inflamasi paru tergantung pada apoptosis dan pengeluaran sel inflamasi akut oleh makrofag secara adekuat.3 Penelitian terbaru menunjukkan neutrofil mengatur fase resolusi melalui mekanisme berbeda meliputi penangkapan kemokin dan/ atau sitokin serta pembentukan mediator pro-resolving lipid (lipoksin, resolvin, dan protektin). Mediator ini menghentikan infiltrasi neutrofil dan meningkatkan uptake neutrofil apoptotik oleh makrofag. Apoptotik neutrofil juga mengamplifikasi ekspresi CC- 18 chemokine receptor 5 (CCR5) yang akhirnya akan menyebabkan sekuestrasi dan pembersihan CC-chemokine ligand 3 (CCL3) dan CCL5.29 3. Stres oksidatif Radikal bebas meliputi atom, molekul atau ion dengan elektron tidak berpasangan yang bereaksi aktif secara kimiawi dengan molekul lainnya. Radikal bebas seringkali berasal dari molekul O2, nitrogen, dan sulfur sebagai bagian dari kelompok molekul yang disebut ROS, reactive nitrogen species (RNS), dan reactive sulphur species (RSS). Sebagai contoh, ROS mencakup radikal bebas seperti anion superoksida (O2-.), radikal perhidroksil (HO2.), radikal hidroksil (.OH), nitrit oksida, dan spesies lain seperti hidrogen peroksida (H2O2), singlet oxygen (1O2), hypochlorous acid (HOCl), dan peroksinitrit (ONOO-).31 Jalur produksi ROS dapat dilihat pada Gambar 3 di bawah ini. Gambar 3. Jalur produksi ROS Dikutip dari (32) Reactive oxygen species diproduksi selama metabolisme selular dan aktivitas fungsional, pada kadar rendah berperan penting dalam cell signaling, apoptosis, ekspresi gen, dan pertahanan terhadap infeksi. Sejumlah molekul antara lain protein, lipid, RNA, dan DNA yang berukuran sangat kecil serta reaktif dapat terganggu oleh produksi ROS berlebihan.32 Keseimbangan antara produksi 19 ROS/RNS dengan pertahanan antioksidan menentukan status redoks intraselular yang berperan mengoptimalkan fungsi sel serta ekspresi gen.33 Reactive oxygen species memiliki fungsi mikrobisidal tetapi berefek negatif menyebabkan cedera jaringan host. Produksi radikal bebas melibatkan makrofag dan neutrofil untuk mengatasi invasi mikroorganisme, terlihat pada sel host selama aktivasi fagosit atau reaktivitas mikroorganisme beserta produknya terhadap reseptor spesifik. Lipopolisakarida berkontribusi penting terhadap peningkatan ROS, menginduksi acute lung injury (ALI), dan proliferasi abnormal fibroblast paru pada tahap awal penyakit yang berhubungan dengan aktivasi jalur PI3K-Akt.34 Stres oksidatif didefinisikan sebagai ketidakseimbangan antara terbentuknya ROS atau RNS dengan kapasitas organisme untuk menetralisir melalui sistem proteksi antioksidatif, ditandai penurunan kapasitas sistem endogen untuk melawan proses oksidatif mengganggu rasio secara biomolekular.35 GSH/GSSG Stres oksidatif dapat (glutathione/glutathione disulphide), menyebabkan aktivasi faktor transkripsi sensitif redoks seperti NF-κB dan HIF-1 yang mentransmisikan informasi ke sel. Reactive oxygen species mengaktivasi NF-κB melalui fosforilasi IκBs pada residu serin sehingga dapat masuk ke nukleus untuk mengaktifkan transkripsi gen. Sejumlah kinase diketahui dapat memfosforilasi IκBs sehingga menjadi target sinyal oksidatif untuk mengaktifkan NF-κB. Proses ini akan menghasilkan produksi sejumlah mediator inflamasi seperti IL-1β, IL-6, TNF-α, IL-8, dan molekul adhesi. Nuclear factor kappa B juga meregulasi angiogenesis, proliferasi, dan diferensiasi sel.36 Pneumonia merupakan infeksi paru yang biasanya disebabkan bakteri dan virus. Stres oksidatif merupakan bagian penting dari respons imun bawaan terhadap patogen yang akan meningkatkan produksi mediator inflamasi paru. Efek yang terjadi berupa peningkatan ekspresi intercellular adhesion molecule (ICAM)-1 dan IL-6 serta hipersekresi mukus. Penelitian Chen et al. menunjukkan pneumonia meningkatkan ROS jaringan paru, berkorelasi dengan derajat beratnya pneumonia. Peningkatan TNF-α dan IL-6 didapatkan bermakna pada pneumonia berat, sehingga didapatkan bukti bahwa stres oksidatif dan kerusakan DNA berperan penting pada patogenesis pneumonia berat.34 20 Antioksidan merupakan molekul yang dapat menetralisir radikal bebas dengan cara menerima atau mendonorkan elektron untuk mengeliminasi kondisi radikal tidak berpasangan. Molekul ini dapat bereaksi langsung dengan radikal reaktif dan menghancurkannya sehingga menjadi radikal bebas baru yang tidak terlalu aktif, mampu bertahan lama, dan kurang berbahaya.32 Hubungan antara antioksidan dan oksidan diperlihatkan pada Gambar 4. Gambar 4. Hubungan timbal balik antara oksidan dan antioksidan Keterangan: NOS= NO-synthase, ROS= reactive oxygen species, CAT= catalase, SOD= superoxide dismutase, GPx= glutathione peroxidase, GST= glutathione S-transferase, UA= uric acid, GSH= glutathione reduced. Dikutip dari (37) Antioksidan dapat bersifat endogen atau eksogen, disebut ideal apabila mudah diabsorpsi, mampu meredam radikal bebas, dan chelate redoks logam. Antioksidan pada manusia terdiri dari dua sistem sangat kompleks yaitu enzimatik dan nonenzimatik. Antioksidan enzimatik mayor yang sering ditemukan di paru adalah superoxide dismutase (SOD), katalase, glutathione peroxidases (GSHPxs), dan glutathione-S-transferase (GSTs).36 Pembentukan radikal bebas dihambat antioksidan melalui satu atau lebih mekanisme yaitu mengenali spesies yang menginisiasi peroksidasi, berikatan dengan ion logam sehingga tidak dapat 21 menstimulasi keluarnya reactive species atau dekomposisi lipid peroksidase, quenching . O2- mencegah pembentukan peroksidase, memecah rantai autooksidatif, dan/ atau mengurangi konsentrasi O2 terlokalisir.38 Peran penting stres oksidatif pada pneumonia komunitas diperlihatkan melalui penelitian Castillo et al. yang menyatakan skor FINE berkorelasi negatif dengan kadar ferric reducing ability of plasma (FRAP) dan positif dengan kadar malondialdehyde (MDA), sehingga disimpulkan pemberian antioksidan sebaiknya dipertimbangkan sebagai terapi tambahan pada penderita pneumonia komunitas yang dirawat.39 4. Diagnosis pneumonia komunitas Diagnosis pneumonia komunitas ditegakkan berdasarkan anamnesis, pemeriksaan fisik, pemeriksaan radiologis, dan laboratorium. a. Anamnesis dan pemeriksaan fisik Diagnosis pasti pneumonia komunitas menurut Perhimpunan Dokter Paru Indonesia (2014) ditegakkan apabila pada foto toraks didapatkan infiltrat atau air bronchogram ditambah beberapa gejala di bawah ini:18 - batuk - perubahan karakteristik sputum atau purulen - suhu tubuh ≥ 380 Celcius (aksila) atau riwayat demam - nyeri dada - sesak - pemeriksaan fisik dapat ditemukan tanda-tanda konsolidasi, suara napas bronkial, dan ronki - leukosit ≥10.000/uL atau <4500/uL Pneumonia komunitas secara klinis dibagi menjadi tipikal dan atipikal. Tipikal disebabkan bakteri seperti S. pneumoniae dan H. influenzae, ditandai demam, batuk produktif, nyeri pleuritik, dan sesak napas. Pemeriksaan fisik didapatkan takipnea, takikardi, dan konsolidasi paru berupa pekak pada perkusi, peningkatan fremitus, egofoni, suara napas bronkial, dan ronki. Pneumonia atipikal disebabkan C. pneumoniae, L. pneumophila, M. pneumoniae ditandai onset gradual dari batuk nonproduktif dan sesak napas. Manifestasi ekstraparu 22 (demam, myalgia, fatigue, dan nyeri telan) lebih dominan pada atipikal, meskipun demikian perbedaan gejala klinis tersebut tidak dapat digunakan untuk mengidentifikasi agen penyebab. Munculnya gejala klinis dapat dipengaruhi kondisi komorbid dan usia tua.20 b. Pemeriksaan radiologis Berdasarkan rekomendasi Infectious Diseases Society of America and American Thoracic Society (IDSA/ATS) diagnosis pneumonia harus memasukkan pemeriksaan foto toraks dimana didapatkan infiltrat, konsolidasi, dan terkadang kavitasi. Konsolidasi terlihat pada lebih dari 90% foto toraks penderita, dapat sulit dilihat pada lobus bawah kiri karena tertutup bayangan jantung. Pneumonia disebabkan M. pneumoniae dan C. pneumophila sering terlihat sebagai infeksi saluran napas kecil (bronkiolitis) daripada konsolidasi lobar, menyebabkan perubahan interstitial yang mudah terlewatkan pada foto toraks berkualitas buruk tetapi mudah teridentifikasi melalui computed tomography (CT) scan sebagai perubahan “tree-in-bud”.40 Opasitas pada foto toraks dianggap sebagai gold standard diagnosis pneumonia, meskipun hal tersebut dapat berkaitan dengan infeksi, infark, perdarahan, edema, keganasan, maupun inflamasi disebabkan berbagai proses seperti vaskulitis atau efek samping obat. Sejumlah penelitian menunjukkan penyebab bakterial dan nonbakterial tidak dapat dibedakan berdasarkan foto toraks.14 c. Pemeriksaan laboratorium Pemeriksaan laboratorium pada kasus pneumonia tidak berarti menunda pemberian antibiotik yang pemilihannya berdasarkan pengetahuan terhadap jenis patogen dan perkiraan beratnya infeksi.20 Pemeriksaan laboratorium darah didapatkan peningkatan lekosit lebih dari 10.000/ul atau kurang dari 4.500/ul, hitung jenis lekosit terdapat pergeseran ke kiri, dan peningkatan laju endap darah.41 Pemeriksaan mikrobiologi untuk menentukan penyebab pneumonia meliputi pemeriksaan mikroskopis dan kultur sputum, kultur darah, antigen terhadap S. 23 pneumoniae dan L. pneumophilia dalam urin, serta uji serologi dan molekular terhadap virus influenza, M. pneumoniae, Chlamydophila, dan C. burnetti.18 Oksigenasi dinilai dengan pulse oxymetri dan pemeriksaan analisis gas darah apabila saturasi di bawah 94% atau didapatkan pneumonia berat. Desaturasi harus segera dikoreksi karena dapat memperberat infeksi. Kebutuhan O2 inspirasi sebesar 35% atau lebih untuk mempertahankan saturasi O2 sekitar 90% menandakan pneumonia berat, demikian juga dengan PaO2 kurang dari 60 mmHg atau PaCO2 lebih dari 50 mmHg. Pemasangan ventilasi mekanik sebaiknya dilakukan pada kondisi ini.42 d. Penilaian tingkat keparahan Tingkat keparahan pneumonia menentukan tempat perawatan (rawat inap atau jalan), pemeriksaan mikrobiologi lebih lanjut, dan pemilihan antibiotik awal secara empirik.43 Keputusan merawat inap atau merawat jalan penderita merupakan bagian penting dalam penatalaksanaan pneumonia komunitas.20 Sistem penilaian keparahan pneumonia yang sering digunakan adalah pneumonia severity index (PSI) dan CURB (confusion, urea, respiratory rate, blood pressure and age)-65. Sejumlah sistem penilaian tambahan telah dikembangkan, termasuk penilaian terhadap penderita yang memerlukan perawatan di intensive care unit (ICU), seperti kriteria IDSA/ATS, SMART-COP, PIRO-CAP, dan SCAP.43,44 Pneumonia severity index dikembangkan Fine et al. pada tahun 1997 untuk mengidentifikasi penderita pneumonia komunitas berisiko kematian rendah dalam tiga puluh hari, telah divalidasi terhadap 40.000 penderita dalam penelitian Pneumonia Outcome Research Team (PORT).44 Parameter yang dinilai dan pengelompokkan penderita ke dalam kelas risiko dapat dilihat pada Tabel 1 dan 2. 24 Tabel 1. Sistem penilaian PSI Karakteristik Penderita Faktor demografi Umur: Laki-laki Perempuan Perawatan di rumah Skor Umur (tahun) Umur (tahun) dikurangi 10 Umur (tahun) ditambah 10 Penyakit penyerta Keganasan Penyakit hati Gagal jantung kongestif Penyakit serebrovaskular Penyakit ginjal 30 20 10 10 10 Temuan pemeriksaan fisik Perubahan status mental Frekuensi napas ≥30/menit Tekanan darah sistolik ≤90 mmHg Suhu tubuh <35oC atau ≥40oC Denyut nadi >125/menit 20 20 20 15 10 Temuan laboratorium dan radiologi pH darah arteri <7,35 Blood urea nitrogen >30 mg/dl Sodium <130 mmol/L Glukosa >250mg/dl Hematokrit <30% Tekanan parsial oksigen arteri ≤60 mmHg Efusi pleura 30 20 20 10 10 10 10 Dikutip dari (20) Tabel 2. Stratifikasi risiko kematian dan perawatan berdasarkan PSI Kelas risiko Jumlah poin I (Ringan) II (Ringan) III (Ringan) (usia < 50 tahun, tidak ada penyakit penyerta dan abnormalitas tanda vital) ≤ 70 71-90 IV (Sedang) V (Berat) 91-130 > 130 Mortalitas 30 hari (%) 0,1 0,6 2,8 8,2 29,2 Perawatan Rawat jalan Rawat jalan Rawat jalan/ inap Rawat inap Rawat inap Dikutip dari (45) Perhimpunan Dokter Paru Indonesia (2014) merekomendasikan apabila menggunakan PSI dalam menilai keparahan pneumonia, maka kriteria yang dipakai untuk indikasi rawat inap adalah:18 1. Skor PSI lebih dari 70 2. Skor PSI kurang dari 70 tetapi dijumpai salah satu dari kriteria sebagai berikut: 25 - Frekuensi napas >30 kali per menit - PaO2/FiO2 <250 mmHg - Foto toraks menunjukkan infiltrat multilobus - Tekanan sistolik <90 mmHg - Tekanan diastolik <60 mmHg 3. Pneumonia pada pengguna NAPZA (narkotika, psikotropika, dan zat adiktif lainnya). British Thoracic Society (BTS) mengembangkan CURB-65 pada tahun 2003 yang sekarang telah divalidasi pada 12.000 penderita dari berbagai negara. Tabel 3 menunjukkan penilaian dan pengelompokkan penderita ke dalam kelas risiko. Keuntungan CURB-65 lebih mudah digunakan tetapi dapat lalai menilai keparahan pneumonia pada penderita muda dengan komorbid.43,44 Tabel 3. Sistem penilaian CURB-65 (setiap kriteria memiliki 1 poin) Confusion Blood urea nitrogen > 20 mg/dL (7 mmol/L) Respiratory rate > 30x/menit Blood pressure (sistolik < 90 mmHg atau diastolik ≤ 60 mmHg) Usia ≥ 65 tahun Dikutip dari (19) 5. Penatalaksanaan pneumonia komunitas Penderita pneumonia komunitas diharuskan beristirahat dan menghindari asap rokok, menjaga kecukupan hidrasi dan nutrisi adekuat dengan suplementasi O2 untuk mempertahankan saturasi 94-98% pada mereka yang tidak berisiko mengalami gagal napas hiperkapnik. Mobilisasi dini dan profilaksis terhadap tromboemboli vena juga direkomendasikan.42 Antibiotik empirik berdasarkan prevalensi patogen dan profil resistensi antibiotik lokal sebaiknya diberikan dalam empat jam pertama, dilanjutkan 5-7 hari pada pneumonia komunitas ringan sampai sedang, dan 7-10 hari pada yang berat. Sulih terapi antibiotik dari intravena ke oral sebaiknya dilakukan apabila hemodinamik stabil, terjadi perbaikan klinis, dan fungsi pencernaan normal.18,42 Strategi de-eskalasi direkomendasikan untuk mencegah melonjaknya resistensi bakteri, didefinisikan sebagai pengubahan terapi antibiotik empirik 26 spektrum luas (terapi inisial efektif) menjadi lebih sempit setelah penilaian ulang dalam 72 jam inisiasi terapi bergantung pada perolehan data mikrobiologi. Antibiotik yang tepat memiliki spektrum lebih sempit, efikasi tinggi, toksisitas minimal, dan ekonomis.46 Rekomendasi pemilihan antibiotik untuk mikroorganisme spesifik dapat dilihat pada Tabel 4. Tabel 4. Antibiotik spesifik sesuai patogen respiratorik tertentu Tipe infeksi S. pneumoniae - Sensitif penisilin - Resisten penisilin Antibiotik pilihan pertama Penisilin G, klindamisin, telitromisin amoksisilin, doksisiklin, Mycoplasma Agen yang teridentifikasi melalui uji kepekaan in vitro, termasuk sefotaksim, seftriakson, vankomisin, dan fluorokuinolon Doksisiklin, makrolid Chlamydophila pneumoniae Doksisiklin, makrolid Legionella Neisseria meningitidis Azitromisin, fluorokuinolon (termasuk siprofloksasin), eritromisin (± rifampin) Sefalosporin generasi II atau III, klaritromisin, doksisiklin, βlaktam/penghambat βlaktamase, trimetoprim/sulfametoksazol, azitromisin, telitromisin Sefalosporin generasi II atau III,trimetoprim/sulfametoksazol, doksisiklin,βlaktam/penghambat β-laktamase Penisilin Neisseria meningitidis Penisilin Streptococci (selain S. pneumoniae) Penisilin, sefalosporin generasi I Anaerob Klindamisin, β-laktampenghambat β-laktamase, β- H. influenzae Moraxella catarrhalis Antibiotik alternatif Sefalosporin, makrolid (MIC< 2,0 g/ml), fluorokuinolon Telitromisin (MIC ≥ 2,0 g/ml) Fluorokuinolon, telitromisin Fluorokuinolon, telitromisin Doksisiklin rifampin Fluorokuinolon Fluorokuinolon Seftriakson, sefotaksim, sefuroksim, kloramfenikol, fluorokuinolon Seftriakson, sefotaksim, sefuroksim, kloramfenikol, fluorokuinolon Klindamisin (kepekaan obat sebaiknya terkonfirmasi), vankomisin Karbapenem ± 27 laktam ditambah metronidazol S. aureus -sensitif Metisilin Oksasilin, nafsilin, sefazolin; semuanya ± rifampin atau gentamisin Vankomisin ± rifampin atau gentamisin - resisten Metisilin Klebsiella pneumoniae Enterobacteriaceae lain Enterobacter spp.) dan (selain Sefalosporin generasi III atau sefepim (semuanya ± aminoglikosid) karbapenem Sefuroksim, sefotaksim, seftriakson, fluorokuinolon, klindamisin, vankomisin Linezolid, quinupristindalfopristin; trimetoprim/sulfam etoksazol, fluorokuinolon, dan tetrasiklin mungkin efektif (dibutuhkan uji in vitro) Aztreonam, βlaktam-penghambat β-laktamase, fluorokuinolon Dikutip dari (47) C. PROKALSITONIN Prokalsitonin menunjang diagnosis pneumonia komunitas, sekaligus sebagai prediktor komplikasi dan kematian. Evaluasi nilai prognostik PCT pada pneumonia komunitas memperlihatkan PCT >2 ng/ml berkaitan dengan peningkatan kejadian bakteremia, syok septik, gagal multiorgan, dan kematian.48 Penelitian metaanalisis yang membedakan infeksi bakterial dari inflamasi noninfeksi pada penderita rawat inap menyimpulkan bahwa PCT lebih sensitif (85% vs 78%) dan lebih spesifik (83% vs 60%) dibandingkan CRP. Prokalsitonin juga lebih sensitif dalam membedakan antara bakteri atau virus sebagai etiologi penyakit.49 Penggunaan antibiotik secara luas pada infeksi nonbakterial dapat menyebabkan terjadinya resistensi antibiotik, sehingga untuk mengurangi fenomena ini diperlukan pembatasan penggunaan antibiotik hanya pada infeksi bakterial. Peran PCT dalam menuntun penggunaan antibiotik secara lebih aman telah terbukti melalui sejumlah penelitian. Hasil penelitian menggunakan Kryptor assay salah satunya berupa keputusan tidak memberikan antibiotik pada penderita dengan kadar PCT rendah (<0,25 µg/liter) dan tanpa gejala klinis yang jelas. 28 Sebaliknya, kadar PCT ≥0,25 dan <0,5 ng/ml mengindikasikan kemungkinan infeksi bakteri dan disarankan untuk memulai pemberian antibiotik. Kadar PCT ≥ 0,5 ng/ml mendukung adanya infeksi bakteri yang sedang berlangsung sehingga sangat direkomendasikan pemberian antibiotik.50 1. Struktur dan biokimia Prokalsitonin merupakan prekursor hormon tiroid kalsitonin (CT) yang diproduksi sel C-tiroid dan berperan penting dalam homeostasis kalsium. Prokalsitonin tersusun oleh 116 asam amino dengan berat molekul 13 kDa, selanjutnya diproses menjadi peptida 57 asam amino pada terminal amino (aminoPCT/ aminopro-CT), immature CT yang terletak di tengah dan terdiri dari 32 asam amino, serta CT carboxyl-terminus peptide-I (CCP-1) terdiri dari 21 asam amino seperti terlihat pada Gambar 6. Seluruh PCT yang terbentuk di sel Ctiroid akan diubah menjadi CT sehingga kadarnya sangat rendah dalam serum individu sehat (<0,1 ng/ml). Prokalsitonin memiliki waktu paruh yang panjang sekitar 22-35 jam dalam serum, berkebalikan dengan waktu paruh CT yang pendek (4-5 menit).50,51 Eliminasi PCT belum jelas diketahui, seperti protein plasma lainnya PCT mungkin didegradasi melalui proteolisis. Ekskresi renal mungkin sedikit berperan dan tidak didapatkan akumulasi PCT pada penderita gagal ginjal berat.52 Pendapat lain mengemukakan bahwa enzim dalam plasma tidak dapat menghancurkan PCT yang masuk ke sirkulasi, sehingga apabila PCT lepas dari proteolisis intraselular dan disekresi ke sirkulasi maka didapatkan dalam bentuk yang tidak berubah.53 Gambar 6. Prokalsitonin dan peptida pecahannya Dikutip dari (51) 29 Gen yang mengkode PCT dikenal sebagai CALC-I, pada manusia terletak di lengan pendek kromosom 11. Pre-mRNA dari gen CALC-I berisi enam ekson, dimana mRNA CT mencakup ekson 1- 4 dan berakhir setelah sisi poliadenilasi pada ekson 4. Pre-mRNA ini juga memproduksi mRNA lain dengan melompati ekson 4, yaitu meliputi ekson 1-3, 5, dan 6, serta mengkode protein dikenal sebagai calsitonin gene-related peptide I (CGRP-I). Produk asli gen CALC-I adalah 141 rantai asam amino dari prePCT yang bertanggungjawab terhadap produksi PCT pada sel C tiroid terutama selama inflamasi.51 2. Regulasi Regulasi ekspresi PCT berbeda dengan CT. Peningkatan kadar kalsium pada sel C tiroid, sama halnya dengan stimulus lain seperti glukokortikoid, calcitonin gene related peptide (CGRP), glukagon, gastrin atau stimulasi β-adrenergik, akan memunculkan ekspresi gen CT. Somatostatin dan vitamin D justru akan menekan produksi CT. Gambar 7 menunjukkan skema ekspresi CALC-I pada sel non neuroendokrin dan sel C tiroid. Sesuai paradigma klasik neuroendokrin, ekpresi mRNA CT terbatas pada sel neuroendokrin terutama sel C tiroid. Mediator proinflamasi pada sepsis dan inflamasi memicu ekspresi mRNA CT pada sel non neuroendokrin, berkebalikan dengan sel C tiroid maka akan dilepaskan PCT yang tidak terproses.51 Gambar 7. Perbandingan ekspresi dan sekresi CALC-I pada sel adiposa dan sel C tiroid. Dikutip dari (51) 30 Peningkatan kadar PCT bersifat selektif pada proses inflamasi bakterial, berkebalikan dengan kadar sitokin yang tidak spesifik pada sebagian besar tipe inflamasi.51 Selama infeksi mikroba didapatkan peningkatan ekspresi gen CALC-I yang menyebabkan pelepasan PCT dari parenkim dan diferensiasi tipe sel di seluruh tubuh termasuk hepar dan sel mononuklear. Pelepasan PCT dalam fase inflamasi dapat diinduksi melalui dua jalur, yaitu melalui pelepasan toksin mikroba (endotoksin) dan melalui respons cell-mediated yang diperantarai sitokin proinflamasi (IL-1β, IL-6, dan TNF-α).50 Prokalsitonin juga meningkat pada berbagai kondisi noninfeksi seperti trauma, pembedahan, syok kardiogenik, luka bakar, heat stroke, dan acute respiratory distress syndrome (ARDS), nekrosis terinfeksi pasca pankreatitis akut, dan reaksi penolakan pasca transplantasi. Saat ini, PCT diketahui sebagai biomarker SMART untuk sepsis dan infeksi karena mampu memenuhi beberapa kriteria yang dibutuhkan seperti memiliki spesifisitas dan sensitivitas tinggi, mudah diukur, tersedia di banyak rumah sakit, responsif dan reproducible, serta memiliki waktu paruh sampai 24 jam.50 3. Prokalsitonin sebagai penunjang diagnostik dan prognostik Prokalsitonin diproduksi sebagai respons terhadap endotoksin atau mediator proinflamasi yang dilepaskan pada infeksi bakteri (IL-1β, TNF-α, dan IL-6) dan berkaitan erat dengan luas dan keparahan infeksi bakteri. Prokalsitonin lebih spesifik terhadap infeksi bakteri dan dapat membantu membedakannya dari virus. Kadar serum PCT terdeteksi dalam 3-4 jam setelah invasi, lebih awal dibandingkan peningkatan CRP atau laju endap darah (LED).54,55 Sejumlah penelitian observasional telah meneliti potensi diagnostik PCT dalam berbagai kondisi klinis, tipe, dan lokasi infeksi seperti terlihat pada Tabel 5. Profil kinetik PCT cukup baik sebagai penanda klinis, meningkat dalam 612 jam setelah stimulasi dan kadarnya dalam sirkulasi berkurang separuhnya saat infeksi sudah terkontrol oleh sistem imun host atau terapi antibiotik. Prokalsitonin memiliki implikasi prognostik dan mampu memprediksi outcome pada penderita pneumonia komunitas dan sepsis berat. Kadar PCT tidak dipengaruhi oleh 31 pemberian glukokortikoid atau golongan antiinflamasi nonsteroid (AINS), serta sedikit sekali meningkat atau tidak meningkat pada infeksi virus.54,55 Regulasi PCT dihambat oleh IFN-γ yang dilepaskan sebagai respons terhadap infeksi virus. In vitro, IL-1β menginduksi sekresi PCT pada kultur adiposit. Sekresi PCT hampir seluruhnya diblokade oleh IFN-γ yang ditambahkan ke media. Kadar IFN-γ meningkat sebagai respons terhadap infeksi virus saluran napas, sehingga disimpulkan bahwa tidak adanya peningkatan PCT pada penderita dengan infeksi virus saluran napas dapat disebabkan inhibisi sintesis PCT oleh IFN-γ.55 Analisis data post hoc dari 545 penderita menunjukkan bahwa peningkatan PCT secara bermakna berhubungan dengan peningkatan keparahan pneumonia komunitas berdasarkan penilaian PSI. Nilai prognostik PCT terlihat jelas pada pengukuran serial dimana kadar tinggi berhubungan dengan memburuknya outcome. Penurunan kadar PCT yang sering mengikuti kurva log-linear dengan waktu paruh 20-24 jam mendukung ke arah outcome lebih baik. Luyt et al. dari 49 dikutip membuktikan bahwa kinetik PCT juga berimplikasi prognostik pada penderita ventilator-associated pneumonia (VAP). Tabel 5. Potensi diagnostik PCT Tipe infeksi Infeksi abdomen Rancangan penelitian Observasional Cut-off PCT (µg/L) 0,25 Manfaat penggunaan PCT ? Artritis Observasional 0,1-0,25 + Infeksi bakteri Observasional 0,25 ++ Infeksi peredaran darah (primer) Bronkitis Observasional 0,1 ++ Randomisasi terkontrol 0,1-0,5 +++ PPOK eksaserbasi Randomisasi terkontrol 0,1-0,5 +++ Endokarditis Observasional 2,3 + Neutropenia Observasional 0,1-0,5 + Kesimpulan utama Membantu menyingkirkan iskemik dan nekrosis obstruksi usus Membedakan artritis noninfeksi (gout) dari infeksi Kadar rendah PCT menyingkirkan infeksi bakteri Membedakan infeksi dengan kontaminasi Mengurangi penggunaan antibiotik di IGD tanpa muncul efek yang tidak diinginkan Mengurangi penggunaan antibiotik di IGD dan RS tanpa muncul efek yang tidak diinginkan Prediktor independen endokarditis akut dengan akurasi diagnostik tinggi Membantu identifikasi penderita neutropenia dengan infeksi bakteri sistemik 32 Pneumonia Randomisasi terkontrol 0,1-0,5 +++ Demam pascaoperasi Observasional 0,25-0,5 + Infeksi pascaoperasi Randomisasi terkontrol 0,5-1,0 ++ Sepsis berat/syok Randomisasi terkontrol 0,25-0,5 +++ Infeksi saluran napas atas Randomisasi terkontrol 0,1-0,25 ++ Infeksi saluran kencing Ventilatorassociated pneumonia Observasional 0,25 + Randomisasi terkontrol 0,1-0,25 ++ Keterangan: Mengurangi penggunaan antibiotik di RS tanpa muncul efek yang tidak diinginkan Membedakan demam noninfeksi dari infeksi pascaoperasi Mengurangi penggunaan antibiotik di ICU Bedah tanpa muncul efek yang tidak diinginkan Mengurangi penggunaan antibiotik di ICU tanpa muncul efek yang tidak diinginkan Mengurangi penggunaan antibiotik di unit pelayanan kesehatan primer tanpa muncul efek yang tidak diinginkan Berkaitan dengan keparahan infeksi saluran kencing Mengurangi penggunaan antibiotik tanpa muncul efek yang tidak diinginkan PPOK= penyakit paru obstruksi kronik, IGD = instalasi gawat darurat, ICU= intensive care unit. Dikutip dari (54) Penelitian Schuetz et al. pada penderita pneumonia komunitas bertujuan memvalidasi penelitian sebelumnya (Procalcitonin-guided antibiotic therapy and hospitalisation in patients with lower respiratory tract infections /ProHOSP) serta mengevaluasi potensi prognostik dari kadar PCT awal dan serial dalam memprediksi kematian dan outcome lain yang tidak diharapkan. Penelitian tersebut membuktikan nilai prediktif PCT yang dikombinasikan dengan PSI atau CURB-65 dalam mengamati komplikasi serius pada penderita pneumonia komunitas, dan lebih baik dalam memprediksi kematian.54 4. Prokalsitonin sebagai penuntun terapi antibiotik Sejumlah penelitian telah mengevaluasi peran peningkatan kadar PCT serum dalam meningkatnya kemungkinan bakteri sebagai etiologi infeksi saluran napas penderita dewasa seperti terlihat pada Tabel 7. Angka keberhasilan terapi yang tinggi didapatkan sebagai konsekuensi mengikuti panduan PCT dalam pemberian antibiotik.55 Peran PCT tidak hanya mengurangi pemberian antibiotik yang sebenarnya tidak diperlukan, tetapi juga mempersingkat durasi terapi. Penelitian Christ-Crain 33 et al. dikutip dari 50 pada penderita pneumonia komunitas memperlihatkan penggunaan PCT sebagai penuntun terapi dapat mengurangi lama rawat dari 12 hari menjadi 5 hari, serta mempersingkat durasi pemberian antibiotik sampai 65% tanpa tergantung pada keparahan penyakitnya. Tabel 6. Penelitian randomisasi terkontrol yang menggunakan kadar PCT serum sebagai panduan pemberian antibiotik pada infeksi saluran napas. Jumlah penderita dievaluasi Sindroma klinis Tempat penelitian Grup kontrol Grup PCT Persentase penderita yang memulai terapi antibiotik Grup Grup kontr PCT ol 77,3 44,4 Pneumonia, PPOK eksaserbasi akut, bronkitis akut Unit gawat darurat (Basel, Swiss) 119 124 Pneumonia komunitas Unit gawat darurat (Basel, Swiss) 151 151 99 Rinosinusitis, tonsilitis, faringitis, otitis media akut, trakeobronkitis, PPOK eksaserbasi akut, pneumonia komunitas Praktek umum di beberapa unit rawat jalan (Swiss) 226 232 Pneumonia komunitas RS (Denmark) 107 Bronkitis akut, PPOK eksaserbasi akut, pneumonia komunitas Unit gawat darurat di 6 RS (Swiss) 699 Durasi terapi antibiotik (hari rata-rata) Grup kontrol Grup PCT 12,8 10,9 85 12 5 97 25 7,1 6,2 103 79 85 6,8 5,1 671 87,9 75,4 3,8 3,2 Dikutip dari (55) Drozdov et al. melakukan penelitian prospektif dan multisenter terhadap 1759 penderita pneumonia komunitas di Swiss, Prancis, dan Amerika Serikat antara September 2009-November 2010 tentang penggunaan algoritma PCT seperti terlihat pada Gambar 8. Hasil yang didapat menunjukkan perbedaan kultur 34 budaya dan geografis dalam peresepan antibiotik mempengaruhi kepatuhan terhadap panduan algoritma PCT. Antibiotic stewardship dengan PCT adalah memungkinkan, efektif, dan aman tanpa peningkatan risiko komplikasi.56 Gambar 8. Algoritma panduan pemberian antibiotik berdasarkan kadar PCT. Keterangan: ARDS= acute respiratory distress syndrome, BOOP= bronchiolitis obliterans with organizing pneumonia, CAP= community-acquired pneumonia, COPD GOLD= chronic obstructive pulmonary disease Global Initiative for Chronic Obstructive Lung Disease, HIV= human immunodeficiency virus, IMC= intermediate care unit, MOF= multiple organ failure, SCLC= small-cell lung cancer, SIRS= systemic inflammatory response syndrome, TB= tuberculosis. Dikutip dari (56) 5. Pengukuran kadar PCT Pemeriksaan PCT yang pertama kali dikomersialkan adalah pemeriksaan imunometrik (LUMItest®PCT, Brahms) yang mengukur kadar PCT maupun kombinasi CT dan CCP-I melalui luminometrik. Pemeriksaan ini berguna untuk mendeteksi peningkatan kadar PCT pada infeksi bakterial sistemik atau berat, misalnya pada sepsis. Kelemahannya adalah didapatkan insensitivitas relatif dengan batas deteksi akurat ~0,3-0,5 µg/l. LUMItest® tidak cukup sensitif mendeteksi peningkatan kadar PCT ringan sampai sedang, sehingga membatasi 35 peran diagnostiknya pada kondisi selain sepsis. Kadar PCT pada infeksi bakterial dapat meningkat sampai melebihi 0,25 ng/ml, sedangkan pada infeksi virus dapat meningkat tetapi tidak melebihi 0,1 ng/ml sehingga LUMItest® merupakan metode suboptimal dalam membedakan antara infeksi virus dengan bakteri.55,57 Food and drug administration (FDA) menyetujui pemeriksaan PCT generasi kedua berupa teknologi time-resolved amplified cryptate emission (TRACE) seperti Kryptor® PCT (Brahms, Hennigsdorf, Jerman) dengan 0,05 ng/ml sebagai batas nilai terendah yang terdeteksi. Pemeriksaan ini berdasarkan antibodi poliklonal antikalsitonin domba dan antibodi monoklonal antikatakalsin yang terikat pada kalsitonin dan sequence katakalsin dari molekul prekursor kalsitonin. Waktu pemeriksaan yang dibutuhkan adalah 19 menit dan hasilnya dapat diperoleh dalam satu jam menggunakan 20-50 µl plasma atau serum.57 D. VITAMIN C Vitamin C merupakan antioksidan mayor larut air yang bersifat tidak stabil, mudah teroksidasi asam, dapat dirusak O2 , alkali, dan temperatur tinggi. Vitamin ini tersedia dalam bentuk tereduksi (L-asam askorbat) dan teroksidasi (Lasam dehidroaskorbat), berperan meningkatkan produksi kolagen ekstraselular dan penting untuk fungsi sel imun.58 Pertama kali diisolasi pada tahun 1928 oleh ahli biokimia pemenang Nobel berkebangsaan Hongaria bernama Szent-GyorGyi. Asam askorbat sebagai bentuk tereduksi merupakan komponen esensial dalam diit, kadarnya yang tinggi dalam plasma dan jaringan dapat memproteksi terhadap kerusakan oksidatif dan inflamasi.59 1. Biosintesis dan defisiensi vitamin C Vitamin C merupakan gula kristalin berwarna putih yang secara alamiah didapatkan dalam bentuk kimia L-xylo-ascorbate dan D-xylo-ascorbate. L-xyloascorbate tidak memiliki aktivitas vitamin, akan dioksidasi secara reversibel menjadi L-asam dehidroaskorbat pada paparan dengan tembaga, panas, maupun kondisi alkali ringan. Baik L-asam askorbat maupun L-asam dehidroaskorbat 36 secara fisiologis merupakan bentuk aktif vitamin C. Proses oksidasi L-asam dehidroaskorbat menjadi 2,3-diketo-L-gulonic acid dan oksalat bersifat ireversibel.59 Biosintesis asam askorbat pada hewan mencakup jalur metabolisme asam glukoronat melibatkan metabolisme gula pada kondisi normal maupun sakit serta regulasinya pada fungsi fisiologis. Aktivitas sintesis enzim bervariasi antar spesies, sebagian besar hewan dapat mengkonversi D-glukosa menjadi L-asam askorbat. Manusia dan primata lainnya, guinea pig, kelelawar buah Indian, beberapa ikan dan burung, serta serangga tidak dapat memproduksi asam askorbat secara endogen karena kekurangan enzim L-gulonolakton oksidase yang mengkatalisis tahap akhir biosintesis vitamin C sehingga sangat diperlukan asupan dari luar.60,61 Tubuh membutuhkan vitamin C untuk fungsi fisiologis seperti membantu metabolisme tirosin, asam folat, dan triptofan. Vitamin C juga berperan dalam sintesis L-carnitine, metabolisme kolesterol, aktivitas sitokrom P-450, dan sintesis neurotransmitter. Defisiensi vitamin C dapat menyebabkan anemia, scurvy, infeksi, perdarahan gusi, degenerasi otot, buruknya penyembuhan luka, plak aterosklerotik, perdarahan kapiler, dan gangguan neurotik.58,59 2. Farmakokinetik vitamin C Farmakokinetik vitamin C meliputi absorpsi, distribusi, metabolisme, eliminasi, dan mekanisme transpor aktif maupun pasif.60 a. Absorpsi Vitamin C yang tercerna diabsorpsi pertama kali oleh epitel usus melalui transpor membran bagian apikal, baik sebagai askorbat dengan transpor aktif sodium-coupled melalui sodium-dependent vitamin C transporter (SVCT)1 maupun sebagai asam dehidroaskorbat dengan difusi terfasilitasi melalui glucose transporter (GLUT)2 atau GLUT3.60 Dehidroaskorbat segera setelah masuk ke dalam sel diubah menjadi askorbat atau diedarkan ke seluruh peredaran darah oleh GLUT1 dan GLUT2 pada membran basolateral sehingga akan memelihara kadar rendah intraselular dan 37 memfasilitasi uptake dehidroaskorbat lebih lanjut. Askorbat dihantarkan ke plasma melalui difusi, mungkin juga melalui difusi terfasilitasi melewati kanal anion sensitif terhadap volume. Sodium-dependent vitamin C transporter 2 berlokasi pada membran basolateral yang dapat melakukan re-uptake askorbat dari plasma ke epitel usus. Askorbat diekskresikan melalui filtrasi glomerular ke lumen tubulus renal. Reabsorpsi terutama dicapai SVCT1 pada membran apikal, walaupun difusi permukaan lumen dapat berkontribusi terhadap keseluruhan uptake.60 Hal ini seperti yang terlihat pada Gambar 9. Askorbat beredar dalam darah pada konsentrasi 30-60 µM, tetapi konsentrasinya pada sebagian besar sel lebih tinggi. Hal ini berhubungan dengan transpor aktif penghantar askorbat isoform lainnya, dikenal sebagai SVCT2 yang didapatkan pada sebagian besar jaringan tubuh termasuk otak, paru, hepar, jantung, dan otot skeletal. Konsentrasi plasma askorbat terbatas sampai 120 µM terkait saturasi absorpsi, uptake jaringan, dan kegagalan reabsorpsi komplit di ginjal. Bentuk teroksidasi (DHA) ditranspor ke dalam sel lebih cepat dibandingkan bentuk tereduksi oleh difusi terfasilitasi melalui beberapa isoform penghantar glukosa (GLUT), suatu proses yang dapat dihambat glukosa hanya pada beberapa tipe sel.61 b. Metabolisme Vitamin C dimetabolisme di hepar dan meluas ke ginjal pada beberapa rangkaian reaksi. Sekitar 80-90% vitamin C diserap pada saluran gastrointestinal dan tersirkulasi bebas dalam plasma, leukosit, dan eritrosit serta masuk ke seluruh jaringan dengan kadar maksimum 68-86 µmol/liter plasma tercapai melalui konsumsi oral sebesar 90-150 mg/hari. Tubuh akan menggunakannya dalam dua jam, dan akan dikeluarkan dari darah dalam 3-4 jam.59 Radikal bebas intermediate sebagai bentuk reversibel dehidroaskorbat akan memicu munculnya formasi ireversibel dari 2,3-diketogulonic acid yang fisiologis inaktif, selanjutnya terpecah menjadi asam oksalat dan asam treonat, atau mengalami dekarboksilasi menjadi CO2, xylosa, dan xylulosa, terpicu menjadi asam xylonat dan asam liksonat. Seluruh metabolit beserta vitamin C itu sendiri diekskresikan melalui urin.6 38 Gambar 9. Mekanisme transpor vitamin C melalui usus,darah, dan ginjal. Keterangan: ASC= askorbat, DHA= dehidroaskorbat Dikutip dari (60) c. Distribusi Vitamin C terdistribusi ke seluruh jaringan dengan kadar tertinggi di otak dan saraf dibandingkan organ lain seperti terlihat pada Gambar 10.60 Vitamin ini cenderung terakumulasi pada kelenjar adrenal, otak, beberapa tipe leukosit, sedangkan kadarnya di dalam plasma relatif rendah yaitu di bawah 100 µM pada dewasa sehat meskipun diberikan 2,5 gram sekali sehari per oral.58 Regulasi ketat homeostasis vitamin C terutama dikontrol oleh empat sistem regulasi yaitu uptake intestinal (bioavailabilitas), akumulasi jaringan dan distribusi, kecepatan utilisasi dan siklus berulang, serta eksresi ginjal dan reabsorpsi. Hal ini diperoleh melalui berbagai mekanisme termasuk difusi pasif, difusi terfasilitasi, transpor aktif, dan siklus berulang.60 3. Bioavailabilitas dan efek samping vitamin C Bioavailabilitas atau konsentrasi efektif vitamin C tergantung pada efektivitas absorpsi intestinal dan ekskresi ginjal. Penggunaan vitamin C akan makin cepat pada kondisi stres, konsumsi alkohol, dan merokok. Kadar vitamin C dalam darah perokok lebih rendah dibandingkan bukan perokok pada pemberian intake yang sama. Demam, infeksi virus, antibiotik, analgetik, produk petroleum 39 atau karbonmonoksida (CO), dan paparan terhadap logam berat mengurangi absorpsi dan meningkatkan penggunaan vitamin C.62 Gambar 10. Distribusi vitamin C di dalam tubuh Dikutip dari (63) Recommended dietary allowance (RDA) sebesar 60 mg/hari akhir-akhir ini dianggap terlalu rendah, sehingga sedang diusulkan asupan vitamin C sebesar 200 mg/hari untuk memenuhi kebutuhan orang sehat dan dewasa muda.60 Kebutuhan ini dihitung berdasarkan perkiraan absorpsinya, berkurangnya kadar vitamin karena penyiapan makanan, deplesi, pengubahan, dan katabolisme. Pauling menyarankan asupan harian vitamin C sebesar 250-4000 mg, sedangkan Hickey dan Roberts menyarankan dosis 2500 mg.77 Sejumlah penelitian menunjukkan pemberian vitamin C dosis minimal 1 gram/hari dapat memperbaiki sistem imun dan mencegah berbagai proses patologis, tetapi dibutuhkan dalam jumlah lebih besar pada penderita kanker dan penyakit jantung.61 Dosis tertinggi suplementasi vitamin C yang aman dikonsumsi menurut panduan Dietary Reference Intake adalah 2 gram, dengan dosis maksimal per oral sekitar 3-4 gram. 40 Pemberian oral terbatasi oleh diare osmotik dan saturasi absorpsi intestinal sehingga tidak dapat mencapai puncak konsentrasi plasma 1 mmol/liter.64 Penelitian bioavailabilitas vitamin C pada dosis 15-1250 mg memperlihatkan dosis farmakologis intravena dapat menghasilkan kadar plasma 70 kali lebih tinggi dibandingkan dosis oral maksimal yang dapat ditoleransi. Kadar dalam plasma sebesar 10 mmol/liter (10.000 µmol/liter) dapat diperoleh lebih dari tiga jam dengan rata-rata kecepatan infus 0,5-1 gram/menit, tergantung pada dosis, kecepatan dan frekuensi infus.64 4. Peran vitamin C pada pneumonia Vitamin C memperkuat dan memproteksi sistem imun melalui sejumlah mekanisme, terutama melalui kemampuannya mereduksi produksi radikal bebas sehingga mencegah kerusakan DNA sel imun. Vitamin ini dapat memperbaiki aktivitas sel NK, membunuh mikroba, proliferasi limfosit, dan kemotaksis.38,59 Metode yang umum digunakan untuk menilai status vitamin C adalah mengukur kadarnya dalam leukosit karena terkonsentrasi tinggi di dalamnya. Pentingnya peran vitamin C terhadap sistem imun umumnya terlihat pada kondisi defisiensi klinis, scurvy, infeksi, dan anergi yang mempengaruhi hampir seluruh komponen sistem imun.65 a. Antioksidan Sistem imun sensitif terhadap stres oksidatif. Beberapa mekanisme selular untuk menjelaskan peran vitamin C sebagai antioksidan telah diidentifikasi melalui suplementasi diet atau terapi in vitro sel imun.66 Vitamin C mendonorkan dua elektron dari ikatan ganda antara rantai karbon kedua dan keenam molekul 6karbon, disebut sebagai antioksidan karena mampu mencegah teroksidasinya komponen lain meskipun vitamin C ikut teroksidasi dalam proses tersebut. Asam askorbat, sebagai bentuk tereduksi vitamin C, memiliki empat kelompok –OH yang dapat mendonorkan hidrogen untuk sistem pengoksidasi. Kelompok –OH tersebut berdekatan dengan atom karbon sehingga mampu mengikat ion logam (Fe2+).38,65 41 Vitamin C merupakan agen pereduksi poten dan penangkap radikal bebas dalam sistem biologis, dengan bentuk monoanion (askorbat) sebagai unsur kimia predominan pada pH fisiologis.73 Prinsip jalur oksidasi dan pengubahan vitamin C melibatkan keberhasilan pemindahan dua elektron, menghasilkan radikal bebas askorbat terlebih dulu (ascorbate free radical/AFR) dan kemudian dehidroaskorbat. Dua molekul AFR dapat bereaksi bersama membentuk satu molekul askorbat dan satu molekul dehidroaskorbat. Ascorbate free radical dapat direduksi menjadi askorbat oleh mono-dehidro-L-askorbat oksidoreduktase, suatu enzim mikrosomal NADH-dependent.76 Reaksi redoks vitamin C terlihat pada Gambar 11. Gambar 11. Tiga macam status redoks vitamin C Keterangan: Askorbat= bentuk tereduksi total; SDA= semidehidroaskorbat (bentuk monooksidasi); DHA= dehidroaskorbat (bentuk teroksidasi total) Dikutip dari (67) Pemberian vitamin C pada kultur makrofag normal meningkatkan kadar cyclic GMP (cGMP) selular sama seperti halnya hexose monophosphate (HMP) shunt. Vitamin C dalam jumlah besar in vitro dapat menghambat aktivitas H2O2myeloperoxidase-halide, tetapi tidak dapat mengubah kapasitas bakterisidal sel.59 Gambar 12 memperlihatkan siklus vitamin C pada sistem imun, dimana vitamin ini akan menstimulasi diversi glukosa-6-P dari glikolisis ke dalam HMP shunt yang memiliki dua fungsi penting terhadap sistem imun. Pertama, konversi glukosa (6 karbon) menjadi gula 5 karbon, ribosa, dan deoksiribosa yang penting 42 untuk sintesis komponen genetik ribonucleic acid (RNA) dan DNA. Kedua, reduksi koenzim niasin NADP menjadi NADPH yang dibutuhkan dalam berbagai reaksi oksidasi.68 Gambar 12. Siklus vitamin C pada sistem imun Dikutip dari (68) 43 Gula 5-karbon dibutuhkan untuk menyokong peningkatan aktivitas mitotik memungkinkan sintesis DNA dan RNA untuk proliferasi sel fagositik. Fagosit menggunakan NADPH untuk memproduksi superoksida dan sejumlah highly ROS sehingga mampu membunuh patogen yang menginvasi. Akhirnya, phagocyte-derived highly reactive oxidant yang berlebihan jumlahnya akan bocor keluar dari sel masuk ke ruang ekstraselular. Oksidan tersebut toksik terhadap sel host dan harus dihancurkan sebelum merusaknya. Vitamin C berperan sebagai antioksidan yang akan menghancurkan toksin berlebih.68 b. Antiinflamasi Vitamin C memproteksi tubuh terhadap efek toksik ROS dengan cara menurunkan regulasi ekspresi gen proinflamasi IL yang terikat ROS melalui inhibisi faktor transkripsi NFκB. Faktor transkripsi ini meregulasi ekspresi sitokin proinflamasi seperti IL-1 dan TNFα. Sejumlah penelitian menunjukkan vitamin C juga memperkuat pertahanan antioksidan sel T dan meningkatkan respons terhadap antigen yang dianggap berperan penting dalam sistem imun.66 Penelitian Carcamo et al. menunjukkan vitamin C dapat menghambat aktivasi NFκB melalui dua jalur berbeda tetapi saling berhubungan, yaitu menekan aktivasi terinduksi ROS dan menghambat IKKα dan IKKβ. Asam dehidroaskorbat dapat berfungsi sebagai penghambat kinase dan secara langsung menghambat aktivitas IKKα, IKKβ, dan p38MAPK.69 Mekanisme vitamin C sebagai penghambat kinase dapat dilihat pada Gambar 13. 44 Gambar 13. Vitamin C sebagai penghambat kinase Keterangan: AA= ascorbic acid, DHA= dehydroascorbic acid, IKKβ= IκBα kinase B, TNF-α= tumor necrosis factor-α, ROS= reactive oxygen species Dikutip dari (69) Penelitian Bhoite et al. bertujuan menilai kadar vitamin C dan E pada anakanak dengan pneumonia berusia 5-15 tahun, melibatkan 40 penderita pneumonia dan 40 kontrol. Hasil penelitian menunjukkan terjadi penurunan kadar vitamin C dan E sangat signifikan pada kelompok pneumonia dibandingkan kontrol (p< 0,001) secara respektif.70 Khan et al. meneliti 222 penderita pneumonia anak berusia kurang dari lima tahun menyimpulkan bahwa kelompok yang diberikan vitamin C 200 mg/hari lebih cepat mengalami perbaikan saturasi oksigen dan laju pernapasan dibandingkan yang tidak mendapatkan vitamin C. Hal ini akan mengurangi durasi, morbiditas, dan mortalitas karena pneumonia.71 Fowler III et al. meneliti keamanan pemberian vitamin C infus intravena pada 24 penderita sepsis berat. Sebanyak masing-masing delapan penderita diberikan infus intravena vitamin C dosis rendah (50 mg/kgBB/24 jam) atau dosis tinggi (200 mg/kgBB/24 jam) atau plasebo (dektrosa 5% terlarut). Pemantauan yang dilakukan meliputi perburukan hipotensi arterial, takikardi, hipernatremia, mual muntah, skor sequential organ failure assessment (SOFA), kadar vitamin C plasma, C-reactive protein, PCT, dan trombomodulin. Peneliti menyimpulkan vitamin C infus intravena aman dan ditoleransi baik sehingga berdampak positif 45 pada perluasan kegagalan multiorgan, biomarker inflamasi, dan cedera endotel.72 Gambar 14 menjelaskan kerangka teori mengenai proses infeksi pada pneumonia. Gambar 14. Kerangka teori yang menjelaskan proses infeksi pada pneumonia. Keterangan gambar: IL= interleukin, NF-κB= nuclear factor kappa B, TNF-α= tumor necrosis factor-α, NK= natural killer, Th= T helper, CD= cluster of differentiation, ROS= reactive oxygen species, NET= neutrophil extracelular trap, ICAM= intracelular adhesion molecule, TLR= toll-like receptor = mengaktivasi/menstimulasi = menghambat = berkorelasi (?) 46 E. KERANGKA KONSEP PENELITIAN Pneumonia merupakan konsekuensi kolonisasi di paru, cedera epitel terinduksi patogen, aktivasi inflamasi, dan aktivasi berlebihan dari mekanisme perbaikan jaringan. Bakteri terinhalasi akan menghadapi mekanisme pertahanan pertama host berupa pelepasan toksin silier, pneumolisin, endotoksin, dan protease IgA sehingga membuat bakteri melekat pada epitel. Sel dendritik, makrofag alveolar, dan epitel teraktivasi sebagai penanda patogen yang teridentifikasi melalui TLRs, mengawali proses inflamasi yang melalui empat fase yaitu inisiasi, amplifikasi, fagositosis, dan resolusi. Aktivasi sel setelah PAMPs dapat dikenali TLRs akan meningkatkan faktor transkripsi seperti NF-κB dan sitokin proinflamasi (IL-6, IL-8, TNF-α, dan IL-1β). Interleukin-8 berperan sebagai agen kemotaktik neutrofil, dimana neutrofil teraktivasi akan melepaskan lebih banyak IL-8 sehingga akan makin meningkatkan perekrutan neutrofil. Tumor necrosis factor-α berperan meningkatkan ekspresi molekul adhesi sel endotel kapiler paru untuk peningkatan adhesi neutrofil, serta berperan sebagai proinflamasi dan prokoagulan yang akan diperkuat sitokin lain. Perpindahan neutrofil dari endotel kapiler paru ke rongga alveolar akan melepaskan protease, ROS, dan RNS yang berperan pada sel terinfeksi serta menginduksi kematian atau lisis antigen patogen dan jaringan. Patogen yang menginvasi akan dimatikan dan dibersihkan pada fase fagositosis oleh sel fagosit seperti leukosit PMN (neutrofil), sel dendritik, monosit, dan makrofag. Neutrophil extracellular traps merupakan perangkap khusus yang dikeluarkan granula neutrofil berperan meningkatkan aktivitas fagositik dan memproduksi molekul antimikroba. Fagositosis disertai penghancuran bakteri oleh ROS, protein penginduksi permeabilitas bakterisidal, laktoferin, elastase, serta NETs akan menurunkan pengaturan sistem pertahanan host sehingga terjadi resolusi. Prokalsitonin merupakan biomarker penunjang diagnosis pneumonia, sekaligus sebagai prediktor komplikasi dan kematian. Kadar PCT ≥ 0,5 ng/mL mendukung adanya infeksi bakteri yang sedang berlangsung sehingga sangat direkomendasikan pemberian antibiotik. Biomarker ini juga lebih sensitif dalam 47 membedakan antara bakteri atau virus sebagai etiologi penyakit. Selama infeksi mikroba didapatkan peningkatan ekspresi gen CALC-I yang menyebabkan pelepasan PCT dari parenkim dan diferensiasi tipe sel di seluruh tubuh termasuk hepar dan sel mononuklear. Vitamin C menstimulasi diversi glukosa-6-P dari glikolisis ke dalam HMP shunt yang penting terhadap sistem imun, serta mereduksi koenzim niasin NADP menjadi NADPH yang dibutuhkan dalam berbagai reaksi oksidasi. Fagosit menggunakan NADPH untuk memproduksi ROS sehingga mampu membunuh patogen yang menginvasi, tetapi ROS yang berlebihan jumlahnya dapat bocor keluar dari sel masuk ke ruang ekstraselular dan bersifat toksik. Vitamin C berperan sebagai antioksidan yang akan menekan produksi ROS berlebihan. Vitamin C mempunyai efek antiinflamasi dengan cara menurunkan regulasi ekspresi gen proinflamasi IL yang terikat ROS melalui inhibisi faktor transkripsi NFκB. Inhibisi ini melalui dua jalur berbeda, yaitu menekan aktivasi terinduksi ROS dan menghambat IKKα dan IKKβ. Asam dehidroaskorbat dapat berfungsi sebagai penghambat kinase dan secara langsung menghambat IKKα, IKKβ, dan p38MAPK. Penurunan aktivasi NFκB pada kondisi sepsis akan menghambat NETosis sehingga tidak terjadi apoptosis neutrofil berlebihan dan terjadi resolusi inflamasi aman dan efisien. Penambahan vitamin C pada terapi standar pneumonia diharapkan dapat menurunkan stres oksidatif dan respons inflamasi bakterial yang ditandai dengan penurunan kadar serum PCT sehingga menyebabkan perbaikan klinis lebih cepat dan lama rawat inap memendek. Kerangka konsep penelitian secara ringkas dapat dilihat pada Gambar 15. 48 Gambar 15. Kerangka konseptual yang menjelaskan pengaruh pemberian vitamin C terhadap kadar serum PCT dan lama rawat inap penderita pneumonia. Keterangan gambar: variabel penelitian= menghambat = berkorelasi = (?) , mengaktivasi/menstimulasi= , area penelitian: F. HIPOTESIS 1. Terdapat pengaruh pemberian vitamin C terhadap penurunan kadar serum PCT penderita pneumonia. 49 2. Terdapat pengaruh pemberian vitamin C terhadap penurunan lama rawat inap penderita pneumonia. 3. Terdapat korelasi antara penurunan kadar serum PCT dengan penurunan lama rawat inap penderita pneumonia setelah pemberian vitamin C.