Teori Atom dan Cahaya - Dosen Teknik Fisika ITB
advertisement

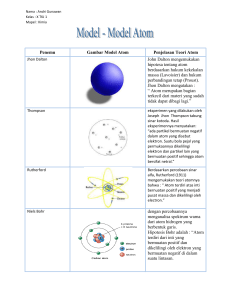
STRUKTUR ATOM Model atom Thomson Percobaan Geiger & Marsden Model atom Rutherford Spektral atom Model atom Bohr Eksitasi atom MODEL ATOM THOMSON - - - - - Materi bermuatan positip - - Elektron Unsur-unsur kimia terdiri dari atom-atom J.J. Thomson menemukan elektron Di dalam atom terdapat elektron Atom netral, di dalam atom harus ada yang bermuatan positip J.J. Thomson (1898) Atom terdiri dari materi bermuatan positip yang dikelilingi oleh elektron-elektron, seperti fruitcake. Kue onde-onde PERCOBAAN GEIGER & MARSDEN Cara langsung untuk mengetahui apa isi fruitcake, masukkan jari tangan ke dalamnya, sebagai probe Ernest Rutherford mengusulkan menggunakan partikel alpha sebagai probe Partikel alpha = inti Helium bermuatan + 2e Massa partikel alpha = 8000 massa elektron Hans Geiger dan Ernest Marsden (1911) menggunakan partikel alpha cepat (2x107 m/s) Hamburan partikel alpha akibat tumbukan dengan lapisan tipis emas diamati dan diukur PERCOBAAN GEIGER & MARSDEN Radioactive substance Zinc sulfide screen Microscope 99,86 % Thin gold foil Alpha particles Lead collimator MODEL ATOM RUTHERFORD - - + Neutron Elektron - Sebagian besar atom adalah ruang kosong Di dalam atom terdapat inti atom (neutron) yang bermuatan positip Hampir semua massa atom terkonsentrasi di dalam inti atom Elektron-elektron berada jauh dari inti atom Rutherford dianggap sebagai penemu neutron Elektron-elektron bergerak seperti planet-planet mengelilingi matahari Formula hamburan Rutherford N i ntZ 2e 4 N() (8o ) 2 r 2 (KE) 2 sin 4 ( / 2) N() = Jumlah total partikel alpha per satuan luas yang sampai di screen dengan sudut hamburan Ni = Jumlah total partikel alpha yang sampai di screen n = Jumlah atom persatuan volume di dalam foil t = Tebal foil Z = Nomor atom dari foil KE = Energi kinetik patikel alpha R = Jarak screen dari foil Ukuran inti atom 1 2Ze 2 KE PE 4o R 2Ze 2 R 4o KE r Inti atom KEalpha 7,7 MeV 1,2x1012 J 2(9x109 )(1,6x10 19 ) 2 Z R 1,2x10 12 R PE 3,8x10 16 Z m ZCu 79 R Cu 4x10 14 m 10 4 r KE Partikel alpha mv 2 Fc r Atom hidrogen Fc Fe v v r Fe Proton 1 e2 Fe 4o r 2 Elektron Fc e 4o mr Kecepatan elektron e2 PE 4o r 2 1 e KE mv 2 2 8o r Energi total atom hidrogen e2 E KE PE 8o r Contoh Soal 3.1 Dari percobaan-percobaan diperoleh bahwa diperlukan energi sebesar 13,6 eV untuk memisahkan atom hidrogen menjadi sebuah proton dan sebuah elektron. Ini berarti bahwa energi total atom hidrogen adalah E = - 13,6 eV. Tentukan kecepatan dan jari-jari orbit elektron dari atom hidrogen. Jawab : e2 r 8o E E 13,6eV 2,2x1018 J (1,6x1019 ) 2 11 r 5 , 3 x 10 m 12 18 8(8,85x10 )( 2,2x10 ) v e 4o mr 1,6x10 19 (9x109 )(9,1x10 31 )(5,3x1011 ) 2,2x106 m / s Kegagalan model atom klasik Mekanik : Hukum Newton Listrik : Hukum Coulomb Elektromagnetik : partikel bermuatan yang sedang bergerak akan meradiasikan energi dalam bentuk gelombang elektromagnetik Energi berkurang, sambil berputar elektron bergerak menuju proton Kenyataannya atom selalu stabil Fisika klasik gagal karena menggunakan pendekatan partikel murni dan gelombang murni SPEKTRAL ATOM Atom dalam fasa gas diberi arus listrik Setiap atom ternyata mengemisikan gelombang-gelombang dengan panjang gelombang tertentu (emission line spectra) SPEKTRAL ATOM Setiap atom juga menyerap gelombang-gelombang dengan panjang gelombang tertentu (absorption line spectra) Panjang gelombang yang diemisikan ternyata sama dengan panjang gelombang yang diserap Diperlukan model atom yang dapat menerangkan kestabilan atom dan adanya garis-garis spektrum Deret Spektral Hidrogen J.J. Balmer (1885) Spektrum cahaya tampak H = 656,3 nm H = 486,3 nm H = 364,6 nm Formula Balmer : 1 1 1 R 2 2 n 2 n 3, 4, 5, R = konstanta Rydberg = 0,01097 nm-1 Deret Lyman (ultravoilet) 1 1 1 R 2 2 n 1 n 2, 3, 4, Deret Paschen (inframerah) 1 1 1 R 2 2 n 3 n 4, 5, 6, Deret Brackett (inframerah) 1 1 1 R 2 2 n 4 n 5, 6, 7, Deret Pfund (inframerah) 1 1 1 R 2 2 n 5 n 6, 7, 8, MODEL ATOM BOHR Niels Bohr (1913) Konsep gelombang materi Menggunakan pendekatan yang lain, tetapi hasilnya sama dengan Broglie v e h h mv e 4o mr 4o r m r 5,3x1011 m 33x1011 m 33x1011 2(5,3x1011 ) 2 r Keliling orbit elektron yang mengelilingi inti atom hidrogen (proton) ternyata sama dengan panjang gelombangnya Terdapat analogi dengan vibrasi/gelombang pada tali/kawat Sebuah elektron hanya dapat mengelilingi inti atom bila lintasan orbitnya merupakan kelipatan bulat dari panjang gelombang Broglie-nya n 2rn nh e h e 4o rn m 4o rn 2rn m n 2 h 2o rn me 2 n=2 n=4 n 1, 2, 3, n = bilangan kuantum Jari-jari Bohr = ao = r1 = 5,292x10-11 m rn n 2 a o n=8 Tingkat Energi Atom Hidrogen e2 En 8o rn me 4 En 2 2 8 o h n 2 h 2o rn me 2 1 E1 2 2 n n n 1, 2, 3, E1 2,18x1018 J 13,6 eV E 2 , E3 , Excited states Ground state E 0 Elektron bebas E 5 0,87 x10 19 J 0,54 eV E 4 1,36x1019 J 0,85 eV E 3 2,42x10 19 J 1,51 eV E 2 5,43x1019 J 3,4 eV E1 21,79x1019 J 13,6 eV Contoh Soal 3.2 Sebuah elektron bertumbukan dengan sebuah atom hidrogen yang sedang berada pada tinggat dasar (ground state). Bila atom hidrogen ini sekarang berada pada tingkat terekstasi (n = 3), berapa energi yang telah diberikan oleh elektron kepada atom hidrogen dalam tumbukan tersebut ? Jawab : 1 E1 E1 1 E E f E i 2 2 E1 2 2 nf ni nf ni n i 1, n f 3, E1 13,6 eV 1 1 E (13,6 eV) 2 2 12,1 eV 1 3 Contoh Soal 3.3 Atom-atom hidrogen pada bilangan kuantum yang sangat tinggi dapat dibuat di laboratorium dan diamati di ruang angkasa. a). Tentukan bilangan kuantum dimana orbit Bohr = 0,01 mm b). Hitung energi atom hidrogen tersebut Jawab : 2 r a n n o a). n b). rn ao 1x105 435 11 5,29x10 E1 13,6 eV 5 En 2 7 , 19 x 10 eV 2 n (435) Garis-garis Spektrum Setelah mendapat energi, tingkat energi atom naik Bila tingkat energinya turun, maka tentunya atom akan mengeluarkan (mengemisikan) energi Energi yang diemisikan atom berupa foton Energi awal – Energi akhir = Energi foton 1 1 E i E f E1 2 2 hf nf ni c E1 1 1 f 2 2 h nf ni E1 1 1 f 2 2 h nf ni 1 E1 1 1 2 2 ch n f n i me 4 2 2 4 8 h E1 me o 7 1 1 , 097 x 10 m R 2 3 ch ch 8c o h Deret Lyman Deret Balmer Deret Paschen Deret Brackett Deret Pfund nf 1 1 1 1 R 2 2 n 1 n 2, 3, 4, nf 2 1 1 1 R 2 2 n 2 n 3, 4, 5, nf 3 1 1 1 R 2 2 n 3 n 4, 5, 6, nf 4 1 1 1 R 2 2 n 4 n 5, 6, 7, nf 5 1 1 1 R 2 2 n 5 n 6, 7, 8, Contoh Soal 3.4 Hitung panjang gelombang terbesar yang terdpat pada deret Balmer dari atom hidrogen (H). Jawab : Deret Balmer : nf 2 H n i 3 1 1 1 1 1 R 2 2 R 2 2 0,139R 3 2 nf ni 1 1 656 nm 7 0,139R 0,139(1,097 x10 ) E=0 n= n=6 n=5 n=4 n=3 n=2 Series limit n=1 Lyman series Balmer series Paschen series Brackett series EKSITASI ATOM Atom akan mampu meradiasikan energi bila berada dalam keadaan tereksitasi Mekanisme 1: Tumbukan dengan partikel lain Atom akan menyerap sebagian energi kinetik dari partikel yang menumbuknya Atom akan kembali kekeadaan semula dengan mengemisikan satu atau lebih foton dalam waktu singkat (10-8s) Mekanisme 2 : Interaksi dengan cahaya pada panjang gelombang tertentu Atom akan kembali kekeadaan semula sambil mengemisikan foton dengan panjang gelombang yang sama n=1 Tumbukan dengan partikel lain n=2 foton n=1 Interaksi dengan cahaya Spektrum absorbsi foton, + Spektrum emisi + foton,