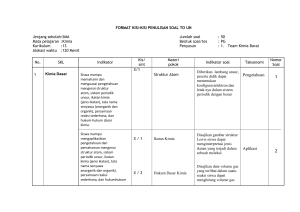
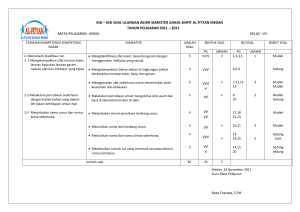
BAB GLOSARIUM
advertisement

KIMIA XI SMA GLOSARIUM A Adsorbsi : penyerapan pada permukaan Aerosol : sistem koloid yang medium pendispersinya gas (8, B) Asam Arrhenius : senyawa yang menghasilkan ion H+ bila dlarutkan dalam air (5, A) Asam Bronsted Lowry : donor proton (5, A) Asam diprotik : asam yang mempunyai 2 ion H+ (5, A) Asam konjungsi : asam yang terbentuk kerena penambahan H+ ke basa (5, A) Asam kuat : asam yang terionisasi sempurna menghasilkan ion H+ dalam air (5, C) Asam lemah : asam yang tidak terionisasi sempurna dalam air (5, C) Asam Lewis : akseptor pasangan elektron (5, A) Asam monoprotik : asam yang mempunyai 1 ion H+ (5, A) Asam tripotik : asam yang mempunyai 3 ion H+ (5, A) Asas le Chatelier : jika terhadap suatu sistem kesetimbangan dilakukan suatu aksi maka sistem kesetimbangan tersebut akan melakukan reaksi yang akan mengurangi aksi tersebut Aturan Aufbau : pengisian elektron berdasarkan tingkat energi. (1, D.1) Aturan Hund : pengisian orbital-orbital yang berenergi sama, elektron-elektron akan menempati orbital sendirisendiri dengan spin paralel baru berpasangan. (1, D.3) Autokatalis : katalis yang berasal dari hasil reaksinya sendiri (3, E) B Basa Arrhenius : senyawa yang menghasilkan dilarutkan dalam air (5, A) ion Basa Bronsted Lowry : akseptor proton (5, A) Basa dihidroksi : basa yang mempunyai 2 ion OH- (5, A) OH- bila 225 225 226 KIMIA XI SMA Basa konjungsi : basa yang terbentuk karena melepaskan H+ dari asam (5, A) Basa kuat : basa yang terionisasi sempurna menghasilkan ion OH- dalam air (5, C) Basa lemah : basa yang tidak terionisasi sempurna dalam air (5, A) Basa Lewis : donor pasangan elektron (5, A) Basa monohidroksi : basa yang mempunyai 1 ion H+ (5, A) Basa trihidroksi : basa yang mempunyai 3 ion OH- (5, A) Bilangan kuantum : bilangan yang menunjukkan/menjelaskan distribusi elektron dalam atom. (1. B) Blok d : unsur-unsur logam transisi, pengisian elektron terakhir di subkuit d. (1, F) Blok f : unsur-unsur lantanida dan aktinida, pengisian elektron terakhir di subkulit f. (1, F) Blok p : golongan IIIA - VIIIA, pengisian elektron terakhir pada subkulit p. (1, F) Blok s : golongan IA dan IIA, pengisian elektron terakhir di subkulit s. (1, F) Buffer asam : larutan yang berisi campuran antara asam lemah dengan basa konjugasinya (6, A) Buffer basa : larutan yang berisi campuran antara basa lemah dengan asam konjugasinya (6, A) Busa : sistem koloid yang fase terdispersinya gas dalam cair D Derajat dissosiasi (a) : perbandiangan jumlah mol zat yang terurai dengan jumlah mol zat mula-mula (4, C) Dialisis : pemurnian partikel koloid Dispersi : pembuatan koloid dari ukuran suspensi menjadi seukuran partikel koloid Dissosiasi : penguraian suatu senyawa menjadi zat lain yang lebih sederhana (4, C) KIMIA XI SMA Domain elektron bebas : domain yang mengandung pasangan elektron bebas. (1, E) Domain elektron ikatan : domain yang mengandung pasangan elektron ikatan. (1, G) E Efek Brown : gerak zig-zag partikel koloid Elektroforesis : peristiwa pergerakan partikel koloid ke salah satu elektroda Elektron valensi : elektron kulit terluar pada atom, yaitu elektron yang terlibat pada ikatan kimia. (1 F.4) Emulgator : zat yang dapat menstabilkan emulsi Emulsi : sistem koloid yang fase terdispersinya cair dalam cair Energi aktivasi : Energi minimum yang diperlukan untuk berlangsungnya suatu reaksi (3, D) Energi ikatan : energi yang diperlukan untuk memutuskan ikatan kimia satu mol senyawa yang berwujud gas menjadi atom-atom gas pada keadaan standar. (2, E) Energi kinetik : energi pada suatu kerja/bergerak. (2) Energi potensial : energi yang tersimpan dalam suatu materi. (2) Energi total : hasil penjumlahan antara energi kinetik dan energi potensial. (2) Energi : suatu kemampuan untuk melakukan kerja. (2, A) Entalpi (H) : total semua bentuk energi dalam suatu zat/ materi. (2, B) materi bila melakukan F G Fase terdispersi : zat yang dilarutkan (8, A) Gaya antarmolekul : gaya tarik-menarik di antar molekul-molekul. (1, I) Gaya dipol-dipol : gaya yang bekerja di antara sejumlah molekul polar. (1, I, 1) Gaya London : gaya tarik-menarik yang ditimbulkan oleh dipol sementara dalam molekul. (1, I.2) 227 228 KIMIA XI SMA Gaya Van der Waals: nama lain untuk gaya antarmolekul. (1, I) Gel : sistem koloid berupa jaringan setengah kaku H Hibridisasi : proses pembastaran orbital dalam suatu atom (biasanya atom pusat) menghasilkan satu set orbital baru yang energinya setingkat, sebelum membentuk ikatan kovalen. (1, G.b) Hidrolisis garam : peristiwa penguraian garam oleh air menjadi asam atau basa pembentukannya (6, B) Hidrolisis sebagian (parsial): hidrolisis yang menghasilkan asam atau basa pembentuk garam Hidrolisis total : hidrolisis yang menghasilkan asam dan sekaligus basa pembentuk garam (6, B) Hukum Hess : kalor yang dilepas atau diserap oleh suatu reaksi tidak tergantung pada jalannya reaksi tetapi tergantung dari kondisi awal zat-zat yang bereaksi dan kondisi akhir zat-zat hasil reaksi. (2, E) Hukum kesetimbangan : hasil kali konsentrasi zat-zat hasil reaksi dibagi dengan hasil kali konsentrasi zat-zat reaktan yang masing-masing dipangkatkan dengan koefisiennya akan menghasilkan suatu bilangan tetap (4, C) Hukum termodinamika I : sama dengan hukum kekekalan energi. (2,A) I Ikatan hidrogen : ikatan yang terbentuk antara atom H dari suatu molekul dengan pasangan elektron bebas yang dimiliki atom kecil yang sangat elektronegatif Ikatan kovalen polar : ikatan kovalen di mana salah satu atom lebih elektronegatif dari yang lain. (1, H) Indikator asam-basa : suatu zat yang berubah warna pada daerah pH tertentu (5, B) Inhibitor : zat yang memperlambat reaksi (3, E) KIMIA XI SMA K Ka : tetapan kesetimbangan asam dalam air (5, C) Kalorimeter : alat yang digunakan untuk mengukur jumlah kalor. (2, E) Kalorimetri : pengukuran jumlah kalor yang dilepaskan atau yang diterima pada suatu reaksi kimia. (2, E) Katalis heterogen : katalis yang wujudnya berbeda dengan wujud pereaksinya (3, E) Katalis homogen : katalis yang wujudnya sama dengan pereaksinya (3, E) Katalis : zat yang dapat mempercepat reaksi tetapi zat tersebut tidak mengalami perubahan kimia secara tetap/permanen (3, E) Kb : tetapan pengukuran basa dalam air (5, C) KC : tetapan kesetimbangan konsentrasi (4, C) Kelarutan (s) : jumlah maksimum zat yang dapat larut dalam sejumlah pelarut (7, A) Kesetimbangan dinamis : reaksi yang berlangsung terus-menerus dalam dua arah berlawanan dengan laju reaksi ke kiri sama dengan laju ke kanan (4, A) Kesetimbangan homogen : suatu kesetimbangan yang wujud zat-zatnya sama Kesetimbangan kimia : suatu keadaan di mana komponen-komponen dalam reaksi tetap (4, A) Ketimbangan heterogen : suatu kesetimbangan yang wujud zat-zatnya berbeda (4, A) Kh : tetapan hidrolisis Koagulasi : peristiwa penggumpalan atau pengendapan koloid Koloid liofil : koloid yang suka medium pendispersinya (8, C) Koloid liofob : koloid yang tidak suka medium pendispersinya Koloid pelindung : koloid yang melindungi koloid lain supaya tidak terjadi koagulasi Kompleks teraktivasi : keadaan transisi sebelum terjadinya reaksi (3, D) Kondensasi : pembuatan koloid dari ukuran larutan sejati menjadi seukuran partikel koloid Konfigurasi elektron : distribusi elektron dalam orbital atom. (1.D) Kp : tetapan kesetimbangan tekanan parsial (4, C) 229 230 KIMIA XI SMA Ksp : tetapan hasil kali konsentrasi ion-ion dari senyawa elektrolit yang sukar larut dalam larutan jenuhnya yang masing-masing dipangkatkan koefisiennya menurut persamaan reaksi ionisasinya (7, B) Kuantum : kuantitas terkecil dari energi yang dapat dipancarkan atau diserap dalam bentuk radiasi elektromagnetik. (1.B) Kulit valensi : kulit atom terluar yang ditempati elektron. (1, F.4) Kw : tetapan kesetimbanan air, (H+) (OH-) = 10-14 (5, C) L Laju reaksi : pengurangan konsentrasi pereaksi atau penambahan konsentrasi hasil reaksi per satuan waktu (3, B) Larangan Pauli : tidak mungkin dalam sebuah atom ada 2 elektron yang mempunyai keempat bilangan kuantum sama. (1, D.2) Larutan belum jenuh : larutan yang masih dapat melarutkan lagi zat terlarut (7, A) Larutan jenuh : larutan di mana zat terlarut sudah mencapai maksimum tetapi belum ada endapan (7, A) Larutan lewat jenuh : zat yang terlarut sudah mencapai maksimum dan sudah terdapat endapan (7, A) Larutan penyangga : larutan yang dapat mempertahankan pH-nya jika ditambah sedikit asam, basa, atau air (6, A) Larutan sejati : sistem dispersi yang berisi zat berukuran kurang dari 10 Å (8, A) Larutan standar : larutan yang telah ditetapkan konsentrasinya Lingkungan : segala sesuatu di luar sistem. (2, C) M Medium pendispersi : pelarut (8, A) Model atom mekanika kuantum: model atom di mana kedudukan elektron tidak dapat ditentukan dengan pasti, yang dapat ditentukan hanya kebolehjadian menemukan elektro sebagai fungsi jarak dari inti atom seperti halnya sifat gelombang. (1, A) KIMIA XI SMA Molaritas (M) : jumlah mol zat terlarut per liter larutan (3, A) Molekul nonpolar : molekul yang tidak memiliki momen dipol. (1, H) Molekul polar : molekul yang memiliki momen dipol. (1, H) Momen dipol : hasil kali muatan dan jarak antara muatan dalam suatu molekul. O Orbital hibrida sp : orbital hibrida yang terbentuk dari kombinasi 1 orbital s dan 1 orbital p. (1, G) Orbital hibrida sp2 : orbital hibrida yang terbentuk dari kombinasi 1 orbital s dan 2 orbital p. (1, G) Orbital hibrida sp3 : orbital hibrida yang terbentuk dari kombinasi 1 orbital s dan 3 orbital p. (1, G) Orbital hibrida sp3d : orbital hibrida yang terbentuk dari kombinasi 1s, 3p dan 1 orbital d. (1, G) Orbital hibrida sp3d2: orbital hibrida yang terbentuk dari kombinasi 1s, 3p dan 2 orbital p. (1, G) Orbital hibrida : orbital atom yang diperoleh bila dua buah orbital atau lebih tak setara dari atom yang sama bergabung sebelum membentuk ikatan kovalen. (1, G.b) Orbital : daerah kebolehjadian menemukan elektron (1, A) Orde reaksi : harga pangkat konsentrasi pada persamaan laju reaksi (3, C) P Pasangan asam basa konjungsi : pasangan rumus kimia yang berbeda hanya satu proton (H+) antara keduanya (5, A) Persamaan laju reaksi : persamaan yang menyatakan laju reaksi tergantung pada konsentrasi pereaksi (3, C) Perubahan energi pembentukan standar : perubahan kalor pada reaksi pembentukan satu mol yang senyawa dari unsurunsurnya diukur pada keadaan standar. (2, D) Perubahan energi penguraian standar : perubahan kalor pada reaksi penguraian satu mol senyawa menjadi unsur-unsurnya diukur pada keadaan standar. (2, D) 231 232 KIMIA XI SMA Perubahan entalpi pembakaran standar : kalor yang dilepaskan pada pembakaran sempurna 1 mol suatu zat (unsur atau senyawa) pada keadaan standar. (2, D) Perubahan entalpi standar (DHo): perubahan energi reaksi yang diukur pada suhu 298oK dan tekanan 1 atm. (2, D) pH : pangkat negatif dari konsentrasi H+ (5, C) pOH : pangkat negatif dari konsentrasi OH- (5, C) Proses Haber Bosch : proses industri pembuatan amoniak Proses kontak : proses komersial/industi pembuatan asam sulfat dari belerang Q R QC : hasil kali konsentrasi ion-ion dalam larutan (7, F) Reaksi eksoterm : reaksi yang disertai perpindahan kalor dari sistem ke lingkungan. (2, C) Reaksi endoterm : reaksi yang berlangsung bila ada perpindahan kalor dari lingkungan ke sistem. (2, C) Reaksi irreversible : reaksi yang berlangsung satu arah (4, A) Reaksi reversible : reaksi yang berlangsung dua arah (4,A) STU Sistem koloid : sistem yang terdiri atas fase terdispersi dan medium pendispersi (8, A) Sistem : segala sesuatu yang menjadi pusat perhatian. (2, C) Sol : sistem koloid yang fase terdispersinya padat dalam cair Subkulit : sekelompok orbital dengan tingkat energi sama. (1, B.2) Suspensi : sistem dispersi yang berisi zat berukuran lebih dari 103 Å (8, A) Termokimia : bagian dari ilmu kimia, mempelajari perubahan energi yang menyertai reaksi kimia. (2, A) Titrasi : cara kerja pengukuran konsentrasi larutan (5, D) Unsur transisi dalam : unsur-unsur yang terletak di bawah tabel periodik terdiri dari aktinida dan lantanida (1, G)