Massa inti atom
advertisement
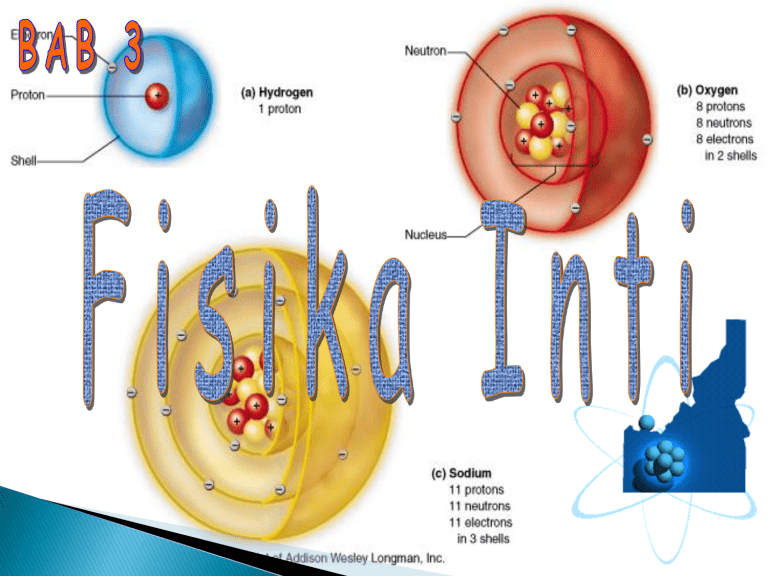
Menurut model atom Bohr, atom tersusun dari inti atom dan elektron yang mengelilingi inti atom pada kulit-kulit atom. Massa atom sebagian besar terkonsentrasi pada bagian Intinya yang tersusun atas proton dan neutron. Kedua partikel ini disebut nukleon dan nuklida penyusun inti. Suatu Nuklida dengan simbol kimia X Simbol inti : A Z Contoh : ket : Z = nomor atom = proton A = nomor massa = p + n. 35 17 Berarti : no atom 17, p= 17 dan n= 35-17 = 18 Inti atom: proton = 1.007276 sma 1 sma neutron = 1.008665 sma 1 sma Isotop : Nuklida yang jml protonnya sama tapi berbeda jml neutronnya Contoh : 12 6 13 6 C C 14 6 C Memiliki sifat kimiawi sama, fisika berbeda Isoton : Nuklida yang jml neutronnya sama tapi berbeda nomor massa Contoh : 13 6 C 14 7 N Memiliki sifat FISIKA sama KIMIA berbeda Isobar : Nuklida yang memiliki nomor massa sama tapi berbeda nomor atom Contoh : 14 6 C 14 7 N Memiliki sifat FISIKA dan KIMIA yang berbeda Massa Atom, Defek Massa, Energi Ikat Inti Massa Atom : bagaimana caranya para ilmuwan mengukur massa atom??? Spektrometer : ATOM ditempatkan pada suatu tempat pemanasan-- terbentuk ion- dilewatkan dengan kecepatan tertentu pada daerah medan magnet– ion mengalami gaya lorent – ion mnempuh suatu lintasan yang melingkar (terjadi gya sentripetal) berdasarkan prinsip gaya Lorentz” Massa atom sangatlah kecil, sehingga biasa dinyatakan dalam satuan massa atom (sma) Kg DEFEK MASSA : Inti atom tersusun dari proton adan neutron sehingga massa inti seharusnya sama dengan jumlah total massa nukleon-nukleonnya. minti = mproton + mneutron Namun, pada kenyataannya massa inti selalu lebih kecil dari pada total massa nukleon-nukleonnya. minti < mproton + mneutron Nah, Berarti ada massa yang hilang ????……. Massa yang hilang disebut dengan DEFEK MASSA ∆m = z.mp + (A – z).mn – minti mp = massa proton mn = massa neutron z = nomor atom A = nomor massa ENERGI IKAT: Menurut kesetaraan massa dan energi oleh Einstein: defek massa Ini berubah menjadi energiyang terdapat dalam inti atom. Energi Ini disebut energi ikat Massa inti atom selalu lebih kecil dari jumlah massa nukleon-nukleon pembentuknya. Akibatnya ada energi ikat inti. E mc2 2 E = ∆m c E = ∆m. 931 Mev CONTOH: Massa detron (1H2) = 2,014103 sma Massa detron lebih kecil dari massa proton dan netron yang menjadi komponen-komponen detron. Detron terdiri atas satu proton dan satu netron massa 1 proton = 1,007825 sma massa 1 netron = 1,008665 sma + jumlah = 2,016490 sma Perbedaan massa m = 0,002387 sma = 2,222 MeV Hal ini menunjukkan ketika proton bergabung dengan netron dibebaskanenergi sebesar 2,222 MeV p1 + n1 H2 + 2,222 MeV 1 0 1 1 1 1p + 0n 1H 2+ 2,222 MeV Untuk membelah detron kembali menjadi proton dan netron diperlukan energi 2,222 MeV, karenanya tenaga sebesar 2,222 MeV disebut tenaga ikat (energi binding) detron. Karena detron terdiri atas 2 nukleon, maka tenaga ikat tiap nukleon adalah 2,222/2=1,111 MeV. Tenaga ikat nukleon paling besar pada unsur yang nomor atomnya 50. Karena tenaga ikat tiap nukleon paling besar pada atom yang nomor atomnya 50, dapat ditarik kesimpulan : a. Ketika inti-inti ringan bergabung menjadi inti-inti yang lebih berat akan disertai dengan pembebasan energi. b. Bila inti-inti berat terbelah menjadi inti-inti yang sedang akan dibebaskan energi. Makin besar tenaga ikat ,makin besar pula energi yang diperlukan untuk memecah unsur inti,ini berarti makin stabil keadaan unsur itu. Radionuklida atau Radioisotop adalah isotop dari zat radioaktif. radionuklida mampu memancarkan radiasi. Radionuklida dapat terjadi secara alamiah atau sengaja dibuat oleh manusia dalam reaktor penelitian. Produksi radionuklida dengan proses aktivasi dilakukan dengan cara menembaki isotop stabil dengan neutron di dalam teras reaktor. Proses ini lazim disebut irradiasi neutron, sedangkan bahan yang disinari disebut target atau sasaran. Neutron yang ditembakkan akan masuk ke dalam inti atom target sehingga jumlah neutron dalam inti target tersebut bertambah. Peristiwa ini dapat mengakibatkan ketidakstabilan inti atom sehingga berubah sifat menjadi radioaktif. Banyak isotop buatan yang dapat dimanfaatkan antara lain Na-24, P-32, Cr-51, Tc-99, dan I-131 Penggunaan Kebocoran pipa Penyerapan pupuk P Pertanian Penelitian dasar Isotop Keterangan Isotop yg Alat pencacah Geiger pendek umurnya Isotop P - 14C Hasilnya disebut autoradiograf Menguji keefektifan pupuk & herbisida Membandingkan nilai nutrisi pakan Pemberantasan hama Mekanisme fotosintesis jalur metabolisme hewan & manusia 3.9 PENGOBATAN NUKLIR ISOTOP NAMA PENGUNAAN 51Cr Kromium-51 Penentuan volume sel darah & volume darah total 58Co Kobalt-58 Penentuan serapan vit. B12 60Co Kobalt-60 Perlakuan radiasi utk kanker 131I Iod-131 Deteksi ktdk beresan fs tiroid; pengukuran aktifitas hati & metabolisme lemak; perlakuan utk kanker tiroid 59Fe Besi-59 Pengukuran laju pembentukan & umur sel darah merah ISOTOP NAMA PENGUNAAN 32P Fosfor-32 Deteksi kanker kulit /kanker jaringan yg terbuka krn operasi 226Ra Radium-226 Terapi radiasi utk kanker 24Na Natrium-24 Deteksi konstriksi 7 obstruksi dlm sistem sirkuler 99Tcm Teknetium-99m Diagnosis beberapa penyakit 3H Tritium Penentuan total air tubuh Teknetium-99m* diperoleh dr peluruhan molibdenum 99 99 42 m 0 Mo 99 Tc 43 1 e *m = metastabil artinya isotop tsb akan melepas sjmlh energi utk menjadi isotop yg sama tp lbh stabil 99 42 Mo 99 43Tc Emisi Positron Tomografi Transaksial (PETT) Utk mengukur proses dinamis dlm tubuh, spt aliran darah atau laju metabolisme oksigen/glukosa C 115B 10 e 11 6 0 1 e 10 e 2 3.10 PENENTUAN UMUR DGN RADIOISOTOP Waktu paruh isotop tertentu dpt digunakan utk memperkirakan umur batuan & benda purbakala Uranium-238 (t1/2 = 4,5 x 109 thn) U 206Pb 238 Utk memperkirakan umur batuan batuan bumi 3-3,5 x 109 thn umur bumi 4,5-5,0 x 109 thn batuan bulan 4,5 x 109 thn karbon-14 (t1/2 = 5730 thn) Karbon-14 (t1/2 = 5730 thn) Utk menentukan umur benda purbakala & mendeteksi keaslian benda purbakala 14C terbtk di lap atmosfir atas 14 7 N 01n146 C 11H 14 14 C 6 (di atmosfir) 6 C(di makhlukhidup) jk makhluk hidup mati maka: 14 6 C(berkurang) 14 7N Tritium (t1/2 =5730 thn) Utk penentukan umur benda sampai 100 thn Isotop T1/2 (tahun) Selang umur yg diukur Penerapan 14C 5730 500-50000 thn Batubara, bhn organik 3H 12,3 1-100 thn Anggur tua 40K 1,3 x 109 10000 thn – contoh bumi tertua Batuan, kerak bumi 4 x 107 thn – contoh tertetua di dunia Meteorit 107- contoh tertua Batuan, kerak bumi 187Rh 109 4,3 x 238U 4,5 x 109 Contoh Sepotong kayu fosil mempunyai aktivitas karbon-14, 1/8 x aktivitas dlm kayu baru. Berapa umur fosil tsb? (t1/2 14C = 5730 thn) Jawab : 14C tlh melewati 3 waktu paruh yaitu (1/2)3= 1/8 jadi umur fosil = 3 x 5730 = 17190 thn 3.11 PEMBUATAN BOM fisi inti : inti dipecah dgn penembakan shg dihslkan fragmen inti yg lebih kecil, & dibebaskan energi yg sgt besar Enrico Fermi & Emilio Segre (1934) U n 238 92 1 0 239 92 U 0 U 239 Np 93 1 e 238 92 Otto Hahn & Fritz Strassman (1938) Atom uranium terpecah Ba, La, Ce Lise Meitner & Otto frisch Menghitung energi yg berkaitan dgn pembelahan uranium Pengayaan Uranium-235 235U di alam 0,7% utk bom atom dibutuhkan 90% campuran isotop U + gas F2 UF6 (volatil) 235UF lbh ringan & lbh cepat bergerak dibandingkan 238UF shg 6 6 dpt dipisahkan Glenn T. Seaborg Uranium-238 tdk akan pecah jk dibombardir oleh neutron U Np Pu (dpt dipecah, cocok utk pembuatan bom atom) U 01n 239 92 U 238 92 239 92 U 239 93 Np 01 n 239 93 0 Np 239 Pu 94 1 e sebelum suatu bhn yg dpt mptahankan reaksi berantai, maka diperlukan jml minimum ttt yg disebut massa kritis contoh : uranium-235 mempunyai massa kritis 4 kg penggabungan sjml inti < massa kritis akan memicu reaksi rantai pembuatan bom atom 235 92 239 94 U Hiroshima, 6 Agustus 1945 Pu Nagasaki, 9 Agustus 1945 3.12 KIMIAWI PERANG NUKLIR : DEBU RADIOAKTIF Ledakan bom menyebabkan kawah dgn lebar 300m & kedalaman 100m - Radius kerusakan total = 10 km - Radius kematian = 40 km - Perusakan oleh radioaktif tdk akan habis Reaksi fisi yg mungkin terjadi: 90 1 U 01n 38 Sr 143 Xe 3 54 0n 235 92 143 54 0 Xe143 Cs 55 1 e Komponen Debu Radioaktif: 90Sr, 143Xe,143Cs, 14C, 3H 90Sr • mirip dgn Ca • t1/2 = 28 thn • masuk ke tubuh melalui susu & sayuran serta terserap ke dlm tulang • merupakan sumber radiasi internal selam beberapa thn 131I • t1/2 = 8 hari • terbawa mealalui rantai pangan • dlm tubuh ada di kelenjar gondok • bermanfaat utk pelacakan diagnostik 143Cs mirip dgn K t1/2 = 30 thn diperoleh melalui sayuran, susu, & daging 3.13 EFEK RADIASI Radiasi : dpt menguntungkan & merugikan Partikel berenergi tinggi & sinar melepaskan e- dr atom ion Jk tjd dlm tubuh akan berbahaya, misalnya H2O H2O2 • Merusak sel darah putih • Mempengaruhi sumsum tulang anemia • Merangsang leukimia • Perubahan molekul DNA mutasi 3.15 REAKSI TERMONUKLIR Reaksi Termonuklir di matahari 4 1H 1 24 He 2 10 e Bom Hidrogen 2 1 H 13H 24 He 10 n 6 3 Li 01n 24 He 13H











