bentuk-bentuk molekul - Teknik Kimia UNDIP
advertisement

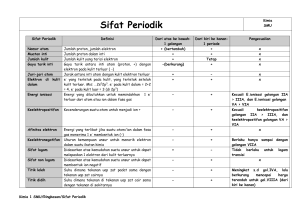
BENTUK-BENTUK MOLEKUL I. Penggambaran Molekul-Molekul dan Ion-Ion dengan Struktur Lewis A. Penggunaan Hukum Oktet untuk Menulis Struktur Lewis 1. Struktur Lewis dengan ikatan tunggal (langkah 1) Menempatkan atom pada posisi masing-masing, atom yang mempunyai nomor golongan lebih rendah berada ditengah, jika terdapat lebih dari satu atom yang bergolongan sama, maka atom yag mempunyai periode lebih tinggi yang berada di tengah, karena atom tersebut mempunyai elektronegatifitas lebih rendah. (langkah 2) Menentukan jumlah total elektron valensinya. (langkah 3) Membuat garis ikatan tunggal dari atom pusat ke seluruh atom sekelilingnya. (langkah 4) Mendistribusikan elektron yang tersisa sampai semua atom memiliki delapan elektron(oktet). 2. Struktur Lewis dengan ikatan rangkap Kadang, setelah melakukan langkah 1-4, ada elektron yang tidak pas untuk atom pusatnya sesuai hukum octet. Ini biasanya berlaku bahwa ada sebuah ikatan rangkap, langkah selanjutnya yang dibutuhkan adalah: (langkah 5) Mengubah pasangan elektron bebas pada atom sekitar menjadi satu ikatan lagi, jika atom pusat masih belum sesuai hukum oktet. B. Resonansi : Delokalisasi Elektron Ikatan Rangkap Pada struktur Lewis lain, bisa saja dalam 1 molekul ada 1 ikatan tunggal dan 1 ikatan rangkap. Seringkali satu ikatan rangkap bersebelahan dengan ikatan tunggal dan membentuk 2 struktur Lewis yang identik. Contohnya dalam senyawa O3. I II Struktur I dan II adalah sama, disebut dengan struktur resonansi. Sebenarnya kedua struktur ini tidak ada yang benar karena panjang ikatan dua ikatan O ternyata memiliki nilai diantara panjang O – O dan O=O. Struktur sebenarnya O3 lebih cocok disebut dengan resonansi hybrid, yaitu bentuk rata-rata keduanya. C. Muatan Formal : Memilih Struktur Resonansi yang Lebih Penting Resonansi dua senyawa identik terjadi ketika senyawa simetris dan tidak bisa dibedakan. Namun jika senyawa asimetris maka salah satu resonansi lebih disukai dengan melihat muatan formal masing-masing atom. Maka, Muatan formal = ∑ valensi – (∑ valensi sunyi + ½ ∑ berikatan) Tiga kriteria yang membantu kita memilih struktur resonansi yang lebih penting, yaitu: 1. Muatan formal yang lebih kecil (positif atau negatif) lebih disukai daripada yang besar. 2. Muatan sama yang berdampingan tidak disukai (gaya tolak). 3. Muatan formal dengan nilai lebih negatif harus diposisikan pada sebuah atom yang lebih elektronegatif. D. Struktur Lewis untuk Pengecualian Hukum Oktet 1. Molekul kekurangan elektron Molekul kekurangan electron salah satu contohnya adalah senyawa dengan atom pusat Be atau B yang cenderung memiliki elektron valensi kurang dari 8: BF3 dan BeCl2. Muatan formal menunjukkan struktur tanpa ikatan rangkap lebih disukai. BF3dapat memiliki 8 elektron valensi yang membentuk ikatan lebih lanjut dengan NH3 2. Molekul yang elektronnya ganjil Beberapa molekul mempunyai jumlah elektron ganjil sehingga tidak dan tidak berikatan,disebut radikal bebas, contoh pada NO2. Senyawa ini berikatan dengan sesamanya membentuk N2O4 dengan elektron valensi 8. 3. Valensi kulit yang diperluas Beberapa molekul atau ion memiliki lebih dari 8 elektron disekitarnya, molekul ini meningkatkan kapasitas kulit valensinya dengan memanfaatkan kulit d yang kosong untuk berikatan. Valensi kulit terekspansi hanya terjadi pada atom pusat non-logam dari perioda 3 keatas dengan kulit d yang bisa dipakai. Contoh senyawanya adalah SF6, PCl5 dan H2SO4. II. Teori Penolakan Pasangan Kulit Elektron Valensi dan BentukBentuk Molekul Untuk menyusun bentuk molekul struktur lewis digunakan teori Valence Shell Electron Pair Repulsion (VSEPR) yaitu prinsip dasar yang menyatakan bahwa setiap kelompok elektron valensi yang berada disekitar inti terletak sejauh mungkin dari kelompok elektron valensi yang lain dengan tujuan untuk meminimalisasi gaya tolakan yang akan akan menentukan geometri molekul. Kelompok elektron adalah sejumlah elektron yang berada disekitar inti atom dengan jenis yang bermacam-macam seperti pasangan elektron terikat tunggal, rangkap, maupun pasangan elektron bebas. A. Pengaturan Kelompok Elektron dan Bentuk-Bentuk Molekul Dalam sebuah molekul, kelompok elektron valensi akan berada di sebuah posisi dimana posisi terebut meminimalisasi gaya tolakan antarkelompok. Hal ini dilakukan dengan memperbesar jarak terhadap kelompok elektron valensi yang lain di sekitar inti atom. Penyusunan kelompok elektron valensi pada sebuah molekul ditentukan oleh jumlah kelompok elektron valensi yang menyusun, tetapi bentuk sebuah molekul ditentukan oleh jenis kelompok elektrovalensi itu sendiri yaitu pasangan elektron yang terikat dan bebas serta posisi relatif inti atom. Sudut ikatan yaitu sudut yang dibentuk oleh dua ikatan yang berdekatan dengan inti atom pusat sebagai titik acuannya. Sudut ikatan disebut ideal jika semua kelompok elektron valensi di sekitar inti adalah pasangan elektron terikat. Untuk mengklasifikasikan bentuk molekul, digunakan metode AXmEn.. ( A = atom pusat, X = pasangan elektron terikat tunggal atau rangkap di sekitar inti, E = pasangan elektron bebas sekitar inti, dan m & n = bilangan bulat.) B. Bentuk Molekul dengan Dua Kelompok Elektron Pada sebuah molekul yang mempunyai 2 kelompok elektron pada atom pusatnya akan memiliki bentuk linear dengan sudut 180o hal ini dikarenakan 2 kelompok elektron yang terpisah sejauh mungkin ini berada pada posisi yang berlawanan. Molekul ini memiliki formula bentuk molekul (AX2). Contoh : C. Bentuk Molekul dengan Tiga Kelompok Elektron Tiga kelompok elektron di sekitar atom pusat saling tolak ke sudut-sudut sebuah segitiga sama sisi, ini memberikan susunan planar trigonal. Pengaturan in imemiliki dua kemungkinan molekul bentuk, yang satu dengan tiga atom sekitarnya dan yang lain dengan dua atom dan satu pasangan bebas. Ini merupakan kesempatan untuk melihat efek ganda obligasi dan pasangan elektron bebas pada sudut-sudut ikatan. 1. Pengaruh ikatan – ikatan ganda Bentuk trigonal planar terbentuk karena dua jenis atom sekitarnya dan dua jenis kelompok elektron (ikatan tunggal dan ganda). Sudut ikatan yang sebenarnya menyimpang dari umumnya karena gaya tolakkan antara ikatan tunggal lebih besar daripada gaya tolakkan ikatan rangkap. 2. Pengaruh pasangan elektron bebas Bentuk molekul hanya didefinisikan oleh posisi inti. Sebuah pasangan bebas dapat memiliki efek besar pada sudut ikatan, karena salah satu pasangan hanya dipegang oleh satu inti. Gaya tolakkan pasangan elektron bebas lebih kuat daripada gaya tolakkan pasangan elektron yang berikatan. Gaya tolakkan yang lebih kuat ini akan menyebabkan sudut ikatan berkurang antara pasangan elektron yang berikatan. D. Bentuk Molekul dengan Empat Kelompok Elektron Struktur Lewis bukan berarti menggambarkan bentuk molekul. Sulit untuk menggambarkan bentuk molekul dengan 3 dimensi, karena pengaturan sudutnya harus betul, misalnya Metana, yang memiliki 4 pasangan elektron ikatan. Semua molekul atau ion dengan 4 pasangan elektron ikatan mengelilingi atom pusat seperti tetrahedron, contohnya Metana dengan simbol AX4. Apabila salah satu dari pasangan elektron ikatan menjadi pasangan elektron bebas, maka bentuknya akan berubah, otomatis sudutnya juga berbeda. Kalau ada 1 yang menjadi pasangan elektron bebas akan berubah menjadi Trigonal Piramida AX3E, otomatis sudutnya akan berbeda dari 109,5˚ menjadi 107,3˚, contoh NH3, terjadi karena tolakan yang sangat kuat tapi bisa kembali jika direaksikan kemnali dengan H+ dan sudutnya pun akan kembali. Jika terdapat 2 pasangan elektron bebas, maka akan menjadi bentuknya huruf V (AX2E2) sudutnya berubah menjadi 104,5˚, contohnya H2O. Tolak menolak antara 2 pasangan elektron bebas lebih besar. E. Bentuk Molekul dengan Lima Kelompok Elektron Semua molekul dengan 5 atau 6 grup elektron memiliki atom pusat dari periode 3 atau lebih, karena hanya atom tersebut yang memiliki orbital d untuk memperluas kulit valensi melebihi 8 elektron. Jika lima pasangan elektron mengelilingi atom pusat maka akan membentuk struktur ruang elektron bipiramidal trigonal. F. Bentuk Molekul dengan Enam Kelompok Elektron Oktahedral adalah 6 elektron yang mengelilingi atom pusat, ikatan sudutnya 0 90 , dituliskan dengan notasi AX6.Contohnya adalah SF6 dan IOF5. Piramidal persegi adalah 5 elektron yang mengelilingi atom pusat, serta memiliki 1 pasangan electron bebas, ikatan sudutnya <900, dituliskan dengan notasi AX5E, contohnya BrF5, TeF5-, dan XeOF4. Persegi planar mempunyai 4 elektron yang mengelilingi pusat, serta memiliki 2 pasang electron bebas, ikatan sudutya 900, dituliskan dengan notasi AX4E2. Contohnya XeF4 dan ICl4 -. G. Menggunakan Teori VSEPR untuk Menentukan Bentuk Molekul Ada langkah yang dapat dilakukan untuk menentukan bentuk molekul dengan metode VSEPR, yaitu: 1. Menuliskan struktur Lewis dari rumus molekulnya untuk menentukan penempatan atom dan jumlah kelompok elektron. 2. Menentukan penataan kelompok elektron dengan menghitung kelompok elektron yang ada di sekitar atom pusat, yang berikatan, maupun yang tidak berikatan. 3. Memperkirakan sudut ikatan yang ideal dari penataan kelompok elektron tersebut dan arah dari penyimpangan yang diakibatkan oleh elektron yang tidak berikatan maupun ikatan ganda. 4. Menggambarkan dan memberi nama bentuk molekul dengan menghitung kelompok yang berikatan dan yang tidakberikatan dengan terpisah. H. Bentuk Molekul dengan Lebih dari Satu Atom Pusat Banyak molekul sekarang ini, terutama molekul dalam sistem kehidupan yang mempunyai lebih dari satu atom pusat. Bentuk dari molekul ini adalah kombinasi dari setiap bentuk atom pusat dan ditemukan dari bentuk molekul disekitar atom pusat. Contohnya yaitu etana dan etanol. Intan Clarissa Sophiana 21030112110032 Kelas Selasa Pagi Teknik Kimia Universitas Diponegoro