Materi 1 Pengantar Ilmu Kimia
advertisement

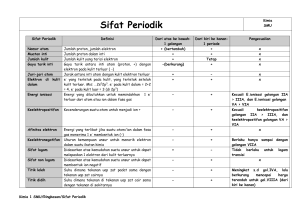
Kimia Dasar 1 Pendahuluan, Materi, Teori atom dan Struktur atom Oleh : Tim Dosen Kimia Dasar FTP 2012 ilmu kimia • Ilmu kimia adalah ilmu yang mempelajari mengenai komposisi, struktur, dan sifat zat atau materi dari skala atom hingga molekul serta perubahan atau transformasi serta interaksi mereka untuk membentuk materi. Kimia Analitik Kimia Fisik Kimia Kimia Organik Kimia Anorganik Biokimia Kimia Lingkungan Kimia Material Kimia Nuklir Kimia Pangan MATERI • Materi adalah sesuatu yang menempati ruang dan mempunyai massa. Materi dapat berupa benda padat, cair, maupun gas. Unsur • Unsur tidak dapat diuraikan menjadi zat-zat lain dengan reaksi kimia biasa. • Unsur terdiri dari logam dan non-logam. • Partikel terkecil dari unsur adalah atom. • Hal yang membedakan unsur satu dengan lainnya adalah "jumlah proton dan jumah elektron suatu unsur atau ikatan dalam inti atom tersebut”. Misalnya, seluruh atom karbon memiliki proton sebanyak 6 buah, sedangkan atom oksigen memiliki proton sebanyak 8 buah. Jumlah proton pada sebuah atom dikenal dengan istilah nomor atom (dilambangkan dengan Z). • Sifat unsur bergantung pada golongan unsur dalam sistim periodik unsur, termasuk logam dan non logam. Sistim Periodik Unsur Senyawa • Senyawa kimia adalah zat kimia yang terdiri dari dua atau beberapa unsur yang dapat dipecah-pecah lagi menjadi unsur-unsur pembentuknya dengan reaksi kimia. • Sifat senyawa berbeda dengan sifat unsur penyusunnya. Campuran • Campuran terbentuk dari dua atau lebih zat yang masih mempunyai sifat asalnya. • Ketika gula dicampurkan dengan air, akan terbentuk larutan gula (campuran gula dan air). Campuran ini masih mempunyai sifat gula (yaitu manis) dan sifat air. Tingkat kemanisan campuran gula dan air ini bermacam-macam tergantung dari jumlah gula yang ditambahkan ke dalam air. Senyawa mempunyai komposisi yang tetap, sedang campuran tidak memiliki komposisi yang tetap. • Campuran dapat berupa larutan, suspensi atau koloid. Larutan • Larutan adalah campuran homogen. • Ciri campuran homogen: - tidak ada bidang batas antar komponen penyusunnya - komposisi di seluruh bagian adalah sama • Komponen larutan terdiri dari pelarut dan zat terlarut. Komponen yang jumlahnya terbanyak dianggap sebagai pelarut. Tapi jika larutan adalah campuran dari zat padat dan cair, maka cairan dianggap sebagai pelarut. Suspensi • Suspensi adalah campuran kasar dan tampak heterogen. Batas antar komponen dapat dibedakan tanpa perlu menggunakan mikroskop. Suspensi tampak keruh dan zat yang tersuspensi lambat laun terpisah karena gravitasi. • Contoh: campuran kapur dan air Koloid • Koloid adalah campuran yang keadaannya terletak antara larutan dan suspensi. • Secara makroskopis koloid tampak homogen, tetapi jika diamati dengan mikroskop ultra akan tampak heterogen. • Contoh: santan, air susu, cat. Kadar zat dalam campuran • Komposisi campuran tidak tetap, oleh karena itu susunan zat dalam campuran dinyatakan dalam kadar zat yang membentuk campuran. Kadar biasanya dinyatakan dalam: Reaksi kimia • Reaksi kimia adalah suatu proses alam yang selalu menghasilkan perubahan senyawa kimia • Macam-macam reaksi kimia 1. menghasilkan gas: magnesium + lar HCl gas H2 2. menghasilkan endapan: lar Timbal(II) nitrat + lar kalium iodida endapan kuning 3. mengalami kenaikan suhu: lar NaOH + lar HCl kenaikan suhu (eksotermis) 4. mengalami perubahan warna: lar kalium kromat (kuning) + lar H2SO4 perubahan warna menjadi jingga Hukum kekekalan massa Hukum kekekalan Massa dikemukakan oleh Antoine Laurent Lavoisier (1743-1794) yang berbunyi: ”Dalam suatu reaksi, massa zat sebelum dan sesudah reaksi adalah sama”, dengan kata lain massa tidak dapat diciptakan dan tidak dapat dimusnahkan. Artinya selama reaksi terjadi tidak ada atom-atom pereaksi dan hasil reaksi yang hilang Hukum Kekekalan Massa C2H5OH + O2 → CO2 + H2O massa C2H5OH + massa O2 = massa CO2 + massa H2O CaCO3 massa CaCO3 → = CaO + CO2 massa CaO + massa CO2 Fe + 2 S → massa Fe + massa S = FeS2 massa FeS2 14 Hukum perbandingan tetap • Hukum perbandingan tetap ditemukan oleh Joseph Proust, seorang ahli kimia Perancis. Hukum perbandingan tetap menyatakan, seperti namanya, perbandingan massa unsurunsur dalam suatu senyawa adalah tertentu dan tetap. Jadi, senyawa apapun dimanapun pasti terdiri dari perbandingan massa yang pasti. Hukum Perbandingan Tetap (Joseph Proust) Dalam senyawa FeS massa Fe (g) massa S (g) 56 32 28 16 14 8 Massa Fe : massa S 7:4 7:4 7:4 massa Fe : massa S = selalu tetap 7:4 (1 x Ar Fe) + (1 x Ar S) = (1 x 56) : (1 x 32) =7:4 16 Hukum Perbandingan Tetap (Joseph Proust) Dalam senyawa FeS2 massa Fe (g) massa S (g) Massa Fe : massa S 56 64 7:8 28 32 7:8 14 16 7:8 massa Fe : massa S = selalu tetap 7:8 (1 x Ar Fe) + (2 x Ar S) = (1 x 56) : (2 x 32) =7:8 17 Hukum Perbandingan Berganda (Dalton) Bila dua unsur dapat membentuk lebih dari satu senyawa, dimana massa salah satu unsur tersebut tetap (sama), maka perbandingan massa unsur yang lain dalam senyawa-senyawa tersebut merupakan bilangan bulat dan sederhana Komposisi kimia ditunjukkan oleh rumus kimianya Dalam senyawa FeS dan FeS2 • massa S dalam FeS : massa S dalam FeS2 = 1 : 2 • massa Fe dalam FeS : massa Fe dalam FeS2 = 1 : 1 18 Definisi atom • Atom adalah suatu satuan dasar materi (partikel materi) atau bagian terkecil dr unsur, yang terdiri atas inti atom serta awan elektron bermuatan negatif yang mengelilinginya • Partikel penyusun atom: - proton - neutron - elektron Perkembangan teori atom Dalton Thompson Rutherford Bohr Model atom Dalton • Atom merupakan bagian terkecil dari unsur yang sudah tidak dapat dibagi lagi. • Atom digambarkan sebagai bola pejal yang sangat kecil, suatu unsur memiliki atom-atom yang identik dan berbeda untuk unsur yang berbeda. • Atom-atom bergabung membentuk senyawa dengan perbandingan bilangan bulat dan sederhana. Misalnya air terdiri atom-atom hidrogen dan atom-atom oksigen. • Reaksi kimia merupakan pemisahan atau penggabungan atau penyusunan kembali dari atom-atom, sehingga atom tidak dapat diciptakan atau dimusnahkan. • Kelemahan: tidak dapat menerangkan adanya proton, neutron dan elektron Model atom Thompson • Atom merupakan bola yang bermuatan positif dan elektron yang bermuatan negatif tersebar di permukaannya • Atom bersifat netral sehingga muatan (+) sama dengan muatan (–) • Kelemahan: tidak dapat menerangkan peredaran elektron di dalam atom Model atom Rutherford • Atom merupakan bola berongga yang terdiri atas inti atom yang bermuatan (+) dan merupakan pusat massa atom • Elektron yang bermuatan (-) beredar mengelilingi inti atom • Kelemahan: tidak dapat menerangkan mengapa elektron yang bermuatan (-) tidak dapat jatuh ke dalam inti atom yang bermuatan (+) Model atom N. Bohr • Teori Bohr menyebutkan elektron hanya dapat berpindah orbit/lintasan/kulit dengan melibatkan energi • Sehingga disempurnakan dalam teori atom mekanika kuantum terdapat daerah kebolehjadian lintasan elektron (kulit K,L,M…) di sekitar inti. • Kulit elektron ini masih memiliki subtingkat energi yang berbeda yang disebut sebagai orbital (s,p,d,f). • orbital menentukan konfigurasi elektron setiap atom dan menentukan elektron valensi tiap atom. Nomor atom, nomor massa A X Z A = massa atom / nomor massa = p+n Z = nomor atom (p=e) X = lambang unsur n = A-Z Isotop, isobar, isoton • Isotop adalah atom dengan nomor atom sama tetapi massanya berbeda contoh: 12 6C , 13 6C • Isobar adalah atom dengan nomor atom berbeda tetapi nomor massa sama contoh: 24 11Na, 24 12Mg • Isoton adalah atom dengan jumlah neutron sama contoh: 39 19K, 40 20Ca Konfigurasi elektron • Elektron valensi adalah elektron yang terdapat pada kulit terluar. Elektron valensi berperan pada pembentukan ikatan antar atom dalam membentuk senyawa. Sehingga sifat kimia unsur banyak ditentukan oleh elektron valensinya. • Unsur yang mempunyai elektron valensi sama, ternyata mempunyai sifat yang mirip. • Susunan elektron yang stabil mempunyai 8 elektron pada kulit terluar (konfigurasi oktet). (Kecuali Helium) • konfigurasi elektron suatu atom setiap orbital terisi elektron sesuai aturan aufbau sehingga orbital dengan tingkat energi yg rendah akan terisi elektron terlebih dahulu. • Aturan Hund tentang multiplisitas berlaku untuk orbital p,d dan f • Larangan Pauli menyatakan tidak ada 2 atau lebih elektron yang memiliki energi sama. Sehingga satu orbital hanya dapat ditempati oleh dua elektron dengan spin yang berlawanan CONTOH • 2 3p1 Al = (10Ne)3s 13 elektron valensi = 3 • 26Fe = 1s2 2s2 2p6 3s2 3p6 4s2 3d6 ev = 8 • 26Fe2+ = 1s2 2s2 2p6 3s2 3p6 4s2 3d6 ev = 6