disini - chemistryoke
advertisement

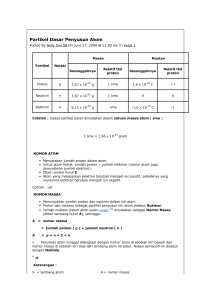
A. Perkembangan Teori atom JJ. Thomson Rutherford Rutherford - Neil Bohr Model Atom Mekanika Gelombang Thomson mengasumsikan bahwa atom dengan dimensi besar yaitu bola seragam bermuatan positif dan elektron-elektron kecil yang bermuatan negatif tersebar di bola tersebut. Dalam kaitan ini model Thomson sering disebut dengan “model bolu kismis”, kismisnya seolah elektron dan bolunya adalah atom. Rutherford merencanakan menentukan sudut partikel yang terhambur dengan menghitung jumlah sintilasi di layar ZnS (liht. Gambar ). Hasilnya sangat menarik. Sebagian besar partikel melalui lempeng tersebut. Beberapa partikel terpental balik. Untuk menjelaskan hal yang tak terduga ini, Rutherford mengusulkan adanya inti atom . Menurut ide Rutherford, muatan positif atom terpusat di bagian pusat (dengan jari-jari terhitung sekitar 10–12 cm) sementara muatan negatifnya terdispersi di seluruh ruang atom. Partikel kecil di pusat ini disebut dengan inti. Semua model atom sebelumnya sebagai ruang yang seragam dengan demikian ditolak.. Namun, model atom Rutherford yang terdiri atas inti kecil dengan elektron terdispersi di sekitarnya tidak dapat menjelaskan semua fenomena yang dikenal. Bila elektron tidak bergerak, elektron akan bersatu dengan inti karena tarikan elektrostatik (gaya Coulomb) TEORI BOHR (i) Elektron dalam atom diizinkan pada keadaan stasioner tertentu. Setiap keadaan stasioner berkaitan dengan energi tertentu. (ii) Tidak ada energi yang dipancarkan bila elektron berada dalam keadaan stasioner ini. Bila elektron berpindah dari keadaan stasioner berenergi tinggi ke keadaan stasioner berenergi lebih rendah, akan terjadi pemancaran energi. Jumlah energinya, h ν, sama dengan perbedaan energi antara kedua keadaan stasioner tersebut. (iii) Dalam keadaan stasioner manapun, elektron bergerak dalam orbit sirkular sekitar inti. (iv) Elektron diizinkan bergerak dengan suatu momentum sudut yang erupakan kelipatan bilangan bulat h/2π, yakni mvr = n(h/2π), n = 1, 2, 3,. Model Bohr. Elektron akan berotasi dalam orbit sirkular di sekililing inti. Nilai jari-jarinya dikontinyu dan dapat diprediksikan dari teori Bohr. Teori Bohr dengan sangat baik menggambarkan struktur atom hidrogen, dengan elektron berotasi mengelilingi inti dalam orbit melingkar. Kemudian menjadi jelas bahwa ada keterbatasan dalam teori ini. Seetelah berbagai penyempurnaan, teori Bohr mampu menerangkankan spektrum atom mirip hidrogen dengan satu . B. Struktur Atom 1. Inti atom. Menurut Rutherford dn Bohr: Atom terdiri dari Inti (muatan +) dan elektron ( muatan -) Elektron mengelilingi inti pad lintasan ( orbit) tertentu yg disebut kulit -------------- tingkat energi inti kulit 2. Lambang Atom/ unsur X = Lambang unsur Z = nomor Atom ( jumlah proton = jumlah elektron ) A = nomor massa ( proton + neutron ) A X Z Contoh : MASSA 23 Na 11 = 23 ( p + n =23) No. atom = 11 ( p=e= 11 ) sehingga n = 23 - 11 = 12 3. Susunan Elektron Banyaknya elektron yang berada pada setiap kulit / tingkat energi dengan rumus Pauli : 2n2 Kulit K --------------maksimum = 2 Kulit L -------------=8 kulit M ------------= 18 dst K L M N Distri busi elektron tiap kulit pada berbagai unsur : No atom 1 2 3 4 5 6 7 8 9 UNSUR H He Li Be B C N O F K L 1 2 2 2 2 2 2 2 2 1 2 3 4 5 6 7 M N 10 Ne 2 8 11 Na 2 8 1 12 Mg 2 8 2 13 L 2 8 3 14 Si 2 8 4 15 P 2 8 5 16 S 2 8 6 17 Cl 2 8 7 18 Ar 2 8 8 Isotop Unsur yg mempunyai nomor atom sama tetapi massa berbeda Contoh ; Hidrogen ( H-1; H-2 ; H-3 ) Karbon ( C- 12 ; C – 13 ) Oksigen ( O-16; O-17; O-18 ) Isobar Unsur yang mempunyai massa sma tetapi nomor atom berbeda. Contoh : N-14 dengn C-14 H -3 dengan He-3 Isoton Atom unsur-unsur yg memp. Jumlah netron yg sama: C-14 dan N-15 Iso elektron Atom/ ion yg mempunyai jumlah elektron yg sama Na + dan Ne ( 11Na + dan 10 Ne ) Sr ++ dan Kr (38 Sr++ dan 36 Kr Beberapa nama unsur dengan simbolnya Lithium Kalium Magnesium Calsium Ferrum Cuprum Zink Chlor Oxygen Carbon Phospor Litium Kalium Magnsium Kalsium Besi Tembaga Zeng Klor Oksigen Karbon fosfor Li K Mg Ca Fe Cu Zn Cl O C P Unsur pada tubuh manusia NO Unsur Lambang % massa No Unsur Lambang % massa 1 Oksigen O 65 7 Kalium K 0,35 2 Karbon C 18 8 Belerang S 0,25 3 Hidrogen H 10 9 Natrium Na 0,15 4 Nitrogen N 3 10 Klor Cl 0,15 5 Kalsium Ca 2 11 Magnesium Mg 0,05 6 fosfor P 1 12 besi Fe 0,004 KONFIGURASI ELEKTRON Elektron ada pad lintasan tertentu ( kulit elektron ), tiap kulit mempunyai sub kulit , dan sub kulit terdirir dr orbital. Konfigurasi elektron adalah susunan elektron dlm orbitalorbital.. Aturan penyusunan elektron: 1. Prinsip aufbau (meningkat ) Prinsip Eksklusi Pauli Aturan Hund Orbital penuh dan setengah penuh 2. 3. 4. . . Susunan dan hubungan bilangan kuantum utama, azimut dan bilangan kuantum magnetik . Sub tingkat Energi (Orbital) S p d f g Jumlah Elektron Maksimum . 2 6 10 14 18 Penggambaran orbital s dan orbital yang masingmasing memiliki satu pasang elektron. S2 px py pz Pengisian elektron diawali pada tingkat energi terendah yaitu orbital 1s, dilanjutkan pada orbital 2s, karena jumlah elektron yang tersisa 2 buah, maka elektron akan mengisi orbital 2px, dilanjutkan dengan orbital 2py, mengikuti aturan Hund. Untuk mempermudah membuat konfigurasi elektron dalam sebuah atom dapat dipergunakan bagan pengisian elektron sebagaimana ditampilkan pada Gambar Prinsip aufbau Elektron akan mengisi tingkat energi yg paling rendah menuju ke tingkat lbh tinggi n=1 n =2 n=3 n=4 n=5 n=6 n=7 1s 2s 3s 4s 2p 3p 4p 3d 5s 6s 5p 6p 4d 5d 4f 5f 6d 7s 7p Jadi urutan pengisian orbital adalah : 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p Mengapa pengisian 3d setelah 4s ?--- ternyata 4s mempunyai tingkat lebih rendah dari 3d ( 4s lbh dekat dg inti atom ) Contoh : 21 Sc artinya Sc nomor atom 21, jd jumlah elektron 21. pada tiap orbit diisikan elektron maksimum lbh dulu dan ditulis sbg pangkatnya. 21 Sc : 1S2 2S2 2p6 3s2 3p6 3d1 4s2 Kulit K L M N Jmlh elektron: 2 8 9 2 Dengan menghitung jumlah sub kulit maka dapt dihitung jumlah elektron maksimum pada tiap kulit : rumus jumlah orbital = n 2 jumlh elektron maks = 2 n 2 rumus ini hanya berlaku sampai kulit nomor 4 No Kulit n=1 N=2 N=3 N=4 N=5 N=6 N=7 Macam sub kulit S S,p S,p,d S,p,d,f S,p,d,f S,p,d S,p Jumlah orbital Elektron maksimum 1 4 9 16 16 9 4 2 8 18 32 32 18 8 Elektron valensi Merupakan jumlah elektron pada kulit terluar yang menunjukkan golongannya ( untuk golongan utama). Elektron valensi sangat menentukan sifat-sifat kimia suatu unsur. Contoh : 20Ca 20Ca : 1s2 2s2 2p6 3s2 3p6 4s2 atau [18Ar ] 4S2 Kulit terluar n = 4, pada orbital s ada 2 elektron, jadi lektron valensi Ca = 2 Berapa elektron valensi : a. 35Br b. 13Al c. 37Rb ISTIRAHAT DULU AH………. ..\kimia\buku KIMIA\kimia kesh 1.pdf 59