atom-dan-struktur-molekul-ppt
advertisement

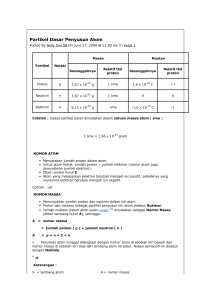
SEJARAH ATOM 460 BC Democritus mengemukakan bahwa Dia membagi-bagi material terus-menerus sampai material tersebut menjadi sangat kecil dan tidak dapat dibagi lagi dan dinamakan sebagai ATOMA SEJARAH ATOM 1808 John Dalton Semua materi terdiri dari bola-bola/bulatanbulatan kecil yang mampu memantul secara tidak tentu dengan sangat elastis yang dinamakan dengan ATOMS SEJARAH ATOM 1910 Ernest Rutherford Melihat percobaan Geiger and Marsden yang terkenal yaitu saat inti Helium ditembakkan pada sebuah plat emas yang hanya setenal beberapa atom. Diketahui bahwa walaupun sebagian besar inti mampu menembus, namun satu dari 10000 menabrak plat tersebut. SEJARAH ATOM Bukti baru Rutherford membuatnya mampu mengajukan model atom yang lebih lengkap dengan adanya sebuah inti nukleus. Dia mengemukakan bahwa muatan positif semuanya berada pada inti nukleus yang mengikat elektron pada tempatnya oleh adanya tarik-menarik elektris. SEJARAH ATOM 1913 Niels Bohr Belajar dibawah bimbingan Rutherford di Universitas Victoria Manchester. Bohr memperbaharui ide Rutherford dengan menambahkan bahwa elektron berada pada orbit-orbit. Seperti planet mengorbit matahari. Dengan setiap orbit hanya mampu menampung sejumlah elektron. Bohr’s Atom electrons in orbits nucleus ATOM Helium orbit proton + - N N + electron Atom ini terdiri dari apa saja ? - neutron PENDAHULUAN Definisi • Atom adalah partikel terkecil dari suatu elemen. • Setiap elemen memiliki struktur atom yang unik. • Menurut model atom Bohr, atom terdiri dari inti atom (nucleus) yang dikelilingi oleh elektron. • Nucleus terdiri dari proton (positif) dan neutron (netral). • Elektron yang mengelilingi inti atom bermuatan negatif. Nomor Atom • Semua elemen diurutkan dalam tabel periodik sesuai dengan nomor atomnya. Contoh : Hidrogen memiliki nomor atom 1 Helium memiliki nomor atom 2 PARTIKEL BERMUATAN • Muatan negatif elektron yaitu 1.6 x 10-19 Coulomb • Massa elektron yaitu 9.11 x 10-31 kg • Muatan ion positif : suatu kelipatan dari muatan elektron dengan tanda muatan yang berlawanan. • Massa suatu atom sama dengan berat atom dikalikan dengan 1.66 x 10-27 kg. • Jari – jari elektron kira-kira 10-15 m , jari – jari atom 10-10 m - +N N + - SIFAT DASAR ELEKTRON • Elektron bergerak mengelilingi inti atom. • Elektron bermuatan negatif. • Elektron bergerak dengan arah yang sama dan menghasilkan arus listrik. • Elektron direpresentasikan dengan e-. • Elektron yang letaknya jauh dari nucleus memiliki energi yang lebih besar dibandingkan elektron yang berada dekat dengan nucleus. - +N N + - Orbit • Lintasan yang mengelilingi inti atom dimana memiliki elektron dimana disebut juga level energi. Elektron Valensi • Elektron yang berada di lapisan paling luar dari inti atom. Ionisasi • Proses hilangnya elektron valensi. Elektron Bebas • Elektron yang keluar dari lintasan. Jumlah Elektron dalam Lintasan • Jumlah maksimum elektron yang mungkin dalam satu lintasan diberikan dengan rumus : Ne = 2n2 dimana n adalah jumlah lintasan. KONDUKTOR, ISOLATOR & SEMIKONDUKTOR • Konduktor merupakan penghantar listrik yang paling mudah. Contoh : Perak, tembaga, Emas, Alumunium. – Konduktor dicirikan dengan adanya satu elektron valensi bebas dimana elektron valensi ini dapat melepaskan diri dari atom dan menjadi atom bebas. – Banyaknya atom bebas dapat menyebabkan arus listrik. • Isolator bukan merupakan penghantar listrik yang baik – Elektron valensinya mengikat kuat pada atom dan memiliki sedikit elektron bebas serta dicirikan dengan memiliki 8 elektron valensi. Contoh : Intan • Semikonduktor merupakan penghantar listrik yang berada di antara konduktor dan isolator. – Jumlah elektron valensi pada semikonduktor biasanya terdiri dari 4 elektron valensi. Contoh : Silikon, Germanium, Karbon. ELEKTRON KONDUKSI DAN HOLE • Elektron konduksi dinamakan juga elektron bebas. • Ketika elektron berpindah ke pita konduksi, elektron tersebut meninggalkan hole pada pita valensi. • Setiap elektron yang pindah ke pita konduksi dan meninggalkan hole dinamakan pasangan elektron-hole. • Proses rekombinasi terjadi bila elektron pada pita konduksi kehilangan energinya dan jatuh kembali ke hole yang ada di pita valensi.