Stoikiometri - elista:.
advertisement

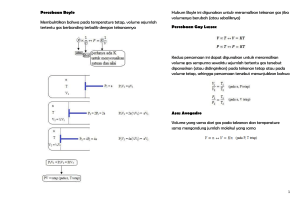
STOIKIOMETRI Kompetensi : Memiliki kemampuan untuk menginterpretasikan serta menerapkan dalam perhitungan kimia. Memiliki kemampuan untuk mengaplikasikan pengetahuan yang dimilikinya dan terbiasa menggunakan prinsip matematik dan sains untuk memecahkan persoalan industri. Memiliki kemampuan untuk bertanggung jawab, tepat waktu dan perbaikan berkesinambungan. Pengantar : Setiap reaksi kimia melibatkan atom dan molekul dalam jumlah yang besar. Misalnya akan membuat senyawa karbon dioksida, CO2. Dapat dilakukan dengan cara mereaksikan satu atom karbon dengan dua atom oksigen untuk mendapatkan satu molekul karbon dioksida. Berapapun jumlah zat yang akan direaksikan yang terpenting adalah perbandingan jumlah atom karbon dan oksigen haruslah 1 : 2. Jadi kita perlu memiliki metode perhitungan yang tepat agar jumlah yang kita timbang mengandung atom dalam jumlah yang sesuai dengan perbandingan di atas. Materi Pokok Bahasan : A. Konsep Mol B. Penentuan Rumus Kimia C. Koefisien Reaksi D. Hukum-hukum Gas A. Konsep Mol Pengertian konsep mol Hubungan mol dengan jumlah partikel Hubungan mol dengan massa (gram) Hubungan mol dengan volume gas Pengertian Konsep mol & Stoikiometri Konsep Mol Mol = satuan jumlah Contoh : Lusin untuk menyatakan sekumpulan zat yang jumlahnya 12 Bilangan Avogadro : 6,02 x 1023 Lambang : ( L ) Stoikiometri Perhitungan kimia yang berhubungan dengan jumlah partikel Hubungan mol dengan jumlah partikel Satu mol zat = banyaknya zat tersebut mengandung 6x1023 butir partikel Partikel : atom, molekul, ion Jumlah partikel = mol x L Contoh hubungan mol dengan partikel 1. Hitung jumlah atom dalam 5 mol besi (Fe) 2. Hitung jumlah mol dari 1,5 x 1024 molekul gula. Jawab : 1. Jumlah atom Fe = 5 x 6x1023 = 3 x 1024 atom 2. Mol gula = 1,5x1024 : 6x1023 = 2,5 mol Soal – soal : Hitunglah : 1) Jumlah molekul dalam 0,25 mol air (H2O) 2) Jumlah atom dalam 3 mol metana (CH4) 3) Jumlah mol dari 4,5 x 1023 atom Mg 4) Jumlah mol dari 6 x 1022 molekul CH4 Hubungan mol dg massa (gram) Massa molar adalah massa satu mol zat yang dinyatakan dalam gram. Rumus massa adl Gram = mol x Ar atau Mr Ar = Massa atom Mr = Massa molekul / Berat Molekul (BM) Massa atom (Ar) Fe = 56 Massa molar Fe = 56 gram (satu mol Fe mpy massa 56 gram) Massa molekul (Mr) H2O = 18 Massa molar air = 18 gram (satu mol H2O mpy massa 18 gram) Contoh hubungan mol dg massa Berapa gram massa 5 mol glukosa (Mr = 180)? Berapa Ar kalsium jika 0,2 mol kalsium mpy massa 8 gram? Hitung mol dari 16 gram belerang (Ar = 32)! Jawab : Gram = mol x Mr Massa glukosa = 5 mol x 180 = 900 gram Ar kalsium = gram : mol = 8 : 0,2 = 40 Mol belerang = 16 : 32 mol = 0,5 mol Soal – soal : Hitunglah jumlah atom dalam 0,28 gram besi (Ar Fe = 56, L = 6 x 1023) Berapa Mr amonia jika 5 mol amonia mpy massa 85 gram? 7,525 x 1022 unsur X ternyata mempunyai massa 5 gram. Hitunglah berat atom unsur X ? Hubungan mol dg volume gas Rumus : p. V = n. R. T p = tekanan gas (atm) V = volume gas (lt) n = jumlah mol gas R = tetapan 0,08205 T = suhu mutlak (oK) Keadaan standard (suhu 0oC, tekanan 1 atm) Liter = mol x 22,4 Mol = liter : 22,4 Contoh Hubungan mol dengan volume gas 1. Hitunglah volume dari 23 gram gas NO2 pada keadaan standard?(BM NO2 = 46) 2. Berapa massa dari 14 liter gas O2 pada 0oC, 1 atm ! 3. Berapa volume dari 9,03 x 1024 molekul gas pada keadaan standard ? Jawab : 1. 23 gram gas NO2 = 23 : 46 = 0,5 mol = 0,5 x 22,4 lt = 11,2 lt 2.14 lt gas 02 = 14 : 22,4 =0,625 mol =0,625 x 32 gram = 20 gram 3. 9,03 x 1024 molekul = 9,03 x 1024 : 6,02 x 1023 = 15 mol x 22,4 lt = 336 lt Soal - soal : Hitung jumlah molekul yang terkandung dalam 5,6 liter suatu gas, diukur pada keadaan standard? Mesin kendaraan yang tidak terkontrol dapat mengeluarkan 0,28 kg gas CO untuk tiap liter bensin yang dibakar (C = 12, O = 16). Hitunglah gas CO yang dihasilkan dari pembakaran 100 liter bensin, diukur pada tekanan 1 atm, suhu 0oC? B. Penentuan Rumus Kimia : Konsep mol digunakan untuk menentukan rumus kimia suatu senyawa, baik rumus empiris (perbandingan terkecil atom dalam senyawa) maupun rumus molekul (jumlah atom dalam senyawa) Rumus empiris dihitung gram atau persen masing-masing penyusun senyawa dan angka tersebut dibagi dengan Ar masing-masing diperoleh perbandingan mol terkecil dari unsur penyusun senyawa. Lanjutan penentuan rumus kimia : Rumus molekul dan rumus empiris suatu senyawa ada kalanya sama, tetapi kebanyakan tidak sama. Rumus molekul merupakan kelipatan dari rumus empiris. Jika senyawa mempunyai rumus empiris CH2O maka rumus molekul mungkin C2H4O2 dll. Menentukan rumus molekul senyawa ada dua hal yang harus terlebih dahulu diketahui yaitu rumus empiris senyawa dan Mr atau BM senyawa. CONTOH RUMUS EMPIRIS : 1. Suatu senyawa tersusun dari 84% karbon dan 16 % hidrogen (C = 12, H = 1). Tentukan rumus empiris senyawa tersebut? 2. Suatu gas mengandung 48 gram karbon, 12 gram hidrogen dan 32 gram oksigen (C = 12, H = 1, o = 16). Bagaimana rumus empiris gas tersebut? 3. Suatu senyawa mengandung 32,4% natrium, 22,6% belerang dan sisanya oksigen (Na = 23, S = 32, o = 16). Tentukan rumus empiris senyawa itu? Jawab : 1. C = 84% , H = 16% mol C : mol H = 84/12 : 16/1 = 7 : 16 Rumus empiris senyawa adalah : C7H16 2. C=48, H=12, O=32 mol C : mol H : mol O = 48/12 : 12/1 : 32/16 = 4 : 12 : 2 = 2 : 6 : 1 Rumus empiris gas adalah C2H6O 3. Na=32,4%, S=22,6%, O=100- (32,4+22,6) = 45% mol Na : mol S : mol O = 32,4/23 : 22,6/32 : 45/16 = 1,4 : 0,7 : 2,8 = 2 :1 :4 Rumus empiris senyawa adalah Na2SO4 Soal – soal : 1. 40 gram suatu oksida besi (senyawa besi dan oksigen) ternyata mengandung 28 gram besi (Fe = 56 dan O = 16). Tentukan rumus oksida besi tersebut? 2. Kristal CuSO4 mengadung 36% air (Cu = 64, S = 32, O = 16, H = 1) Tentukan rumus kristalnya? 3. Sebanyak 17 gram suatu oksida logam dengan rumus empiris M2O3 mengadung 8 gram oksigen. Jika Ar oksigen =16, berapa Ar logam tersebut? CONTOH RUMUS MOLEKUL : 1. Suatu gas dengan rumus empiris NO2 mempunyai BM = 92 (N = 14, O = 16). Tentukan rumus molekulnya? 2. Suatu senyawa organik dengan BM = 90 tersusun dari 40% karbon, 6,6% hidrogen dan sisanya oksigen (C=12, H=1, O=16). Tentukan rumus molekul senyawa tersebut? Jawab: 1. (NO2)n = 92 46 n = 92 n=2 Rumus molekul gas adalah N2O4 2. C = 40%, H = 6,6%, O = 53,4% Mol C : mol H : mol O = 40/12 : 6,6/1 : 53,4/16 = 3,3 : 6,6 : 3,3 = 1 : 2 : 1 Rumus empirisnya CH2O (CH2O) n = 90 30 n = 90 n = 3 Rumus molekulnya adalah C3H6O3 Soal - soal : Sebanyak 11 gram suatu senyawa organik dibakar sempurna, menghasilkan 22 gram CO2 dan 9 gram H2O. Jika Mr senyawa = 88 tentukan rumus molekulnya! 56 liter suatu gas pada suhu 0oC dan tekanan 1 atm memiliki massa 175 gram. Jika rumus empiris senyawa adalah CH2 bagaimana rumus molekulnya? C. KOEFISIEN REAKSI Koefisien reaksi : Perbandingan mol seluruh zat yang ada pada persamaan reaksi, baik reaksi ruas kiri maupun hasil di ruas kanan. Jika salah satu zat sudah diketahui molnya, mk zat lain pada persamaan reaksi dapat dicari dengan cara membandingkan koefisien. Mol A = koefisien A x mol B koefisien B Contoh soal : Diketahui reaksi : N2 + 3H2 2 NH3 jika H2 yang bereaksi adl 12 mol, berapa mol N2 yang bereaksi dan berapa mol NH3 yang terbentuk? Jwb : H2 = 12 mol N2 = 1/3 x 12 = 4 mol NH3 = 2/3 x 12 = 8 mol Berapa gram gas O2 yang diperlukan untuk membakar 260 gram asetilena, C2H2 secara sempurna ? Jwb : 2C2H2 + 5O2 4CO2 + 2H2O C2H2 = 260/26 mol = 10 mol O2 = 5/2 x 10 mol = 25 mol = 25 x 32 gram = 800 gram Soal – soal : Sebanyak 32 gram metana CH4 dibakar dengan 160 gram oksigen. Berapa gram CO2 yang dihasilkan? 6 gram etana C2H6 dibakar dengan oksigen sesuai dengan reaksi : 2C2H6 + 7 O2 4CO2 + 6H2O Hitunglah volume gas CO2 yang terbentuk, diukur pada keadaan standar! D. HUKUM-HUKUM GAS Yaitu: 1. Hukum Gay-Lussac volume). (hukum perbandingan 2. Hukum Avogadro (pada suhu dan tekanan yang sama, gas-gas yang bervolume sama akan memiliki mol yang sama). 3. Keadaan Standar (setiap 1 mol gas apa saja pada suhu 0oC dan tekanan 1 atm memiliki volume 22,4 liter (22,4 dm3). Soal-soal : Pada suhu dan tekanan tertentu, 1 lt gas X bermassa 2 gram dan 10 lt gas NO bermassa 7,5 gram. Hitunglah Ar unsur X ! 245 gram KClO3 dipanaskan sehingga terurai menjadi KCl dan gas O2 menurut reaksi : 2KClO3 2KCl + 3O2 Berapa lt gas O2 yang terbentuk diukur pada keadaan standar. Untuk memperoleh 5,6 lt gas hidrogen (0oC,1 atm) berapa gram logam titan (Ti = 48) yang harus direaksikan dengan larutan HCl menurut reaksi : Ti + 4HCl TiCl4 + 2H2 Kesimpulan : Perhitungan yang bersangkutan dengan partikel disebut stoikiometri atau pengukuran partikel. Partikel berupa atom, molekul, ion, elektron dll sedang pengukuran berat, volume, jumlah partikel dan besaran kwantitatif.