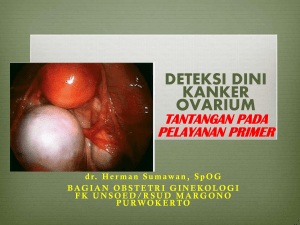
EKSPRESI PROTEIN 53 (p53) BERHUBUNGAN
advertisement

TESIS EKSPRESI PROTEIN 53 (p53) BERHUBUNGAN POSITIF DENGAN DERAJAT DIFERENSIASI SEL PADA KANKER OVARIUM EPITELIAL TJOK GEDE NGURAH CHANDRAGIRAM PROGRAM PASCASARJANA UNIVERSITAS UDAYANA DENPASAR 2014 i TESIS EKSPRESI PROTEIN 53 (p53) BERHUBUNGAN POSITIF DENGAN DERAJAT DIFERENSIASI SEL PADA KANKER OVARIUM EPITELIAL TJOK GEDE NGURAH CHANDRAGIRAM NIM 0914038206 PROGRAM MAGISTER PROGRAM STUDI ILMU BIOMEDIK (COMBINE-DEGREE) PROGRAM PASCASARJANA UNIVERSITAS UDAYANA DENPASAR 2014 xiv EKSPRESI PROTEIN 53 (p53) BERHUBUNGAN POSITIF DENGAN DERAJAT DIFERENSIASI SEL PADA KANKER OVARIUM EPITELIAL Tesis untuk Memperoleh Gelar Magister pada Program Magister, Program Studi Ilmu Biomedik Program Pasca Sarjana Universitas Udayana TJOK GEDE NGURAH CHANDRAGIRAM NIM 0914038206 PROGRAM MAGISTER PROGRAM STUDI ILMU BIOMEDIK (COMBINE-DEGREE) PROGRAM PASCASARJANA UNIVERSITAS UDAYANA DENPASAR 2014 xiv Lembar Pengesahan TESIS INI TELAH DISETUJUI TANGGAL 14 FEBRUARI 2014 Pembimbing I, Pembimbing II, Prof. Dr. dr. Ketut Suwiyoga, Sp.OG(K) NIP. 19530715 198003 1 009 dr. I Gede Mega Putra, Sp.OG(K) NIP. 19671214 199703 1 004 Mengetahui Ketua Program Studi Ilmu Biomedik Program Pascasarjana Universitas Udayana, Direktur Program Pascasarjana Universitas Udayana, Prof. Dr. dr. Wimpie I Pangkahila, SpAnd, FAACS NIP. 194612131971071001 Prof. Dr. dr. A.A. Raka Sudewi,Sp.S(K) NIP. 195902151985102001 xiv Tesis Ini Telah Diuji pada Tanggal 14 Februari 2014 Panitia Penguji Tesis Berdasarkan SK Rektor Universitas Udayana, No.:………………………. Ketua : Prof. Dr. dr. Ketut Suwiyoga, Sp.OG(K) Anggota : 1. dr. I Gede Mega Putra, Sp.OG(K) 2. Prof. Dr. dr. Nyoman Mangku Karmaya, M.Repro 3. Prof. Dr. dr. Wimpie I. Pangkahila, SpAnd, FAACS 4. Prof. Dr. dr. N. Tigeh Suryadhi, MPH. Ph.D xiv SURAT PERNYATAAN BEBAS PLAGIAT Nama : dr. Tjokorda Gede Ngurah Chandragiram NIM : 0914038206 Program Studi : Obstetri Ginekologi Judul Tesis : Ekspresi Protein 53 (p53) Berhubungan dengan Derajat Diferensiasi Sel pada Kanker Ovarium Epitelial Dengan ini menyatakan bahwa tesis ini bebas plagiat. Apabila di kemudian hari terbukti terdapat plagiat dalam karya ilmiah ini, maka saya bersedia menerima sanksi sesuai peraturan Mendiknas No. 17 tahun 2010 dan Peraturan perundang-undangan yang berlaku. Denpasar, 28 November 2013 Yang membuat pernyataan dr. Tjokorda Gede Ngurah Chandragiram xiv 1 UCAPAN TERIMA KASIH Pertama-tama perkenankanlah penulis memanjatkan puji syukur kehadapan Tuhan Yang Maha Esa, karena hanya oleh berkatNya tesis ini dapat diselesaikan. Pada kesempatan ini perkenankanlah penulis mengucapkan terima kasih yang sebesar-besarnya kepada Prof. Dr. dr. Ketut Suwiyoga, SpOG(K) selaku pembimbing I dan Kepala Bagian Obstetri dan Ginekologi FK UNUD/RSUP Sanglah Denpasar, dr. I Gede Mega Putra, Sp.OG(K) selaku pembimbing II, dan kepada Bapak Drs. Ketut Tunas, Msi selaku pembimbing statistik, serta dr Dewi, Sp.PA sebagai pembimbing dalam pemeriksaan, analisis imunohistokimia p53 yang telah memberikan dorongan, semangat, bimbingan dan saran selama penulis mengikuti Program Pendidikan Spesialis I (PPDS I) dan Program Magister Program Studi Ilmu Biomedik Kekhususan Kedokteran Klinik (Combined Degree), khususnya dalam penyelesaian tesis ini. Ucapan yang sama juga ditujukan kepada Rektor Universitas Udayana, Prof. Dr. dr. I Ketut Suastika, Sp.PD (KEMD), Direktur Program Pascasarjana yang dijabat oleh Prof. Dr. dr. A.A. Raka Sudewi, Sp.S(K), Dekan Fakultas Kedokteran Universitas Udayana, Prof. Dr. dr. Putu Astawa, Sp.OT.,M.Kes, serta Direktur Rumah Sakit Umum Pusat Sanglah, dr. I Wayan Sutarga, MPHM, atas kesempatan dan fasilitas yang diberikan untuk mengikuti dan menyelesaikan PPDS I dan Program Magister Program Studi Ilmu Biomedik Kekhususan Kedokteran Klinik (Combined Degree) di Universitas Udayana. Terima kasih penulis ucapkan juga kepada Kepala Program Studi Ilmu Kebidanan dan Penyakit Kandungan PPDS I FK UNUD/RSUP Sanglah, dr. A.A.N. Anantasika, Sp.OG(K) dan seluruh dosen/Staf Bagian Obstetri dan Ginekologi Fakultas Kedokteran Universitas Udayana/RSUP Sanglah atas segala bimbingan dan dorongan yang diberikan selama penulis mengikuti pendidikan spesialis. Ucapan terima kasih yang tulus dan penghargaan kepada seluruh guru yang telah mendidik dari sekolah dasar sampai perguruan tinggi. Pasien-pasien yang telah menjadi guru dan banyak memberikan pengetahuan dan pengalaman, rekan-rekan residen Obstetri dan Ginekologi, serta rekan-rekan paramedis RSUP Sanglah. Tidak lupa penulis haturkan ucapan terima kasih yang dalam kepada Ibu dan Ayah penulis yang telah mengasuh dan membesarkan penulis, memberikan dasardasar berpikir logik, selalu memberi dukungan baik secara moril maupun materiil dan keadaan suasana demokratis sehingga tercipta lahan yang baik untuk berkembangnya kreativitas. Semoga Tuhan Yang Maha Esa selalu memberkati semua pihak yang telah membantu pelaksanaan dan penyelesaian tesis ini, serta kepada penulis sekeluarga. Penulis 2 DAFTAR ISI Halaman SAMPUL DALAM .................................................................................................. i PRASYARAT GELAR MAGISTER ..................................................................... ii LEMBAR PERSETUJUAN................................................................................... iii PENETAPAN PANITIA PENGUJI ...................................................................... iv SURAT PERNYATAAN BEBAS PLAGIAT........................................................ v UCAPAN TERIMAKASIH ................................................................................... vi DAFTAR ISI ......................................................................................................... vii DAFTAR TABEL ................................................................................................... x DAFTAR GAMBAR ............................................................................................. xi DAFTAR SINGKATAN ...................................................................................... xii DAFTAR LAMPIRAN ........................................................................................ xiv ABSTRAK ............................................................................................................ xv ABSTRACT ........................................................................................................... xvi BAB I PENDAHULUAN ...................................................................................... 1 1.1 Latar Belakang .................................................................................................. 1 1.2 Rumusan Masalah ............................................................................................. 3 1.3 Tujuan Penelitian .............................................................................................. 3 1.4 Manfaat Penelitian ............................................................................................ 3 1.4.1 Manfaat bagi pengetahuan ............................................................................ 3 1.4.2 Manfaat bagi pelayanan ................................................................................ 4 BAB II TINJAUAN PUSTAKA........................................................................... 5 2.1 Kanker Ovarium ............................................................................................... 5 2.1.1 Epidemiologi kanker ovarium ....................................................................... 5 2.1.2 Faktor risiko kanker ovarium ........................................................................ 6 2.1.3 Karsinogesis kanker ovarium ........................................................................ 8 2.2 Protein p53 ..................................................................................................... 14 2.2.1 Struktur Protein p53 .................................................................................... 17 2.2.2 Peran protein p53 ........................................................................................ 20 3 2.2.3 Aktivasi gen p53 ......................................................................................... 26 2.3 Derajat Diferensiasi ......................................................................................... 31 BAB III KERANGKA BERPIKIR, KONSEP DAN HIPOTESIS PENELITIAN ....................................................................................................... 35 3.1 Kerangka Berpikir ........................................................................................... 35 3.2 Kerangka Konsep Penelitian ........................................................................... 37 3.3 Hipotesis Penelitian......................................................................................... 37 BAB IV METODE PENELITIAN ..................................................................... 38 4.1 Rancangan Penelitian ..................................................................................... 38 4.2 Tempat dan Waktu Penelitian ........................................................................ 38 4.3 Populasi Penelitian ......................................................................................... 39 4.4 Sampel Penelitian ........................................................................................... 39 4.4.1 Kriteria inklusi ............................................................................................ 39 4.4.2 Kriteria eksklusi .......................................................................................... 39 4.4.3 Perhitungan besar sampel ............................................................................ 40 4.4.4 Cara pengambilan sampel ........................................................................... 40 4.5 Variabel Penelitian ......................................................................................... 41 4.5.1 Identifikasi variabel ..................................................................................... 41 4.5.2 Definisi operasional variabel....................................................................... 41 4.6 Alur Penelitian ............................................................................................... 42 4.7. Instrumen Penelitian dan Metode Pemeriksaan ............................................. 44 4.7.1 Instrumen penelitian .................................................................................... 44 4.7.2 Metode pemeriksaan ................................................................................... 44 4.8 Pengumpulan dan Analisis Data .................................................................... 46 4.8.1 Pengumpulan data ....................................................................................... 46 4.8.2 Analisis data ................................................................................................ 46 BAB V HASIL PENELITIAN............................................................................ 48 5.1 Karakteristik Sampel Penelitian ..................................................................... 48 5.2 Hubungan antara Derajat Diferensiasi dengan Ekspresi p53 ......................... 49 BAB VI PEMBAHASAN ................................................................................... 50 6.1 Karakteristik Sampel Penelitian ..................................................................... 51 4 6.2 Ekspresi p53 ................................................................................................... 53 BAB VII SIMPULAN DAN SARAN ................................................................ 61 7.1 Simpulan ........................................................................................................ 61 7.2 Saran ............................................................................................................... 61 DAFTAR PUSTAKA ........................................................................................... 62 LAMPIRAN .......................................................................................................... 67 5 DAFTAR TABEL Halaman 2.1 Kelompok Gen dan Ekspresi Protein Abnormal pada Kanker Ovarium ...13 2.2 Mekanisme Interaksi Gen p53 ...................................................................17 2.3 Sistem Grading Shimizu-Silverberg Kanker Ovarium .............................32 4.1 Interpretasi Pulasan Imunohistokimia p53 ................................................ 46 5.1 Distribusi Umur, IMT, dan Paritas pada Kelompok Derajat Diferensiasi Kanker Ovarium……………………………..……………………………….48 4.2 Uji Korelasi Ekspresi p53 dengan Derajat Diferensiasi Sel pada Kanker Ovarium Epitelial ………………………………………………49 6 DAFTAR GAMBAR Halaman 2.1 Siklus Sel......................................................................................................9 2.2 Skema Dasar Sederhana Molekuler Kanker ..............................................11 2.3 Representasi Skematik Struktur p53 ..........................................................18 2.4 p53 pada Persimpangan Jalur Hubungan Kompleks Respon Sel terhadap Stress ...........................................................................................21 2.5 p53 serta Jalur yang Terlibat dalam Apoptosis ..........................................24 2.6 Jalur Aktivasi p53 ......................................................................................27 2.7 Sistem Grading Shimizu-Silverberg Kanker Ovarium ..............................32 2.8 Derajat Arsitektural: glanduler, papiler dan solid ......................................33 2.9 Derajat Atipia Inti: ringan, sedang , berat ..................................................33 3.1 Kerangka Konsep Penelitian ......................................................................37 4.1 Rancangan Penelitian .................................................................................38 4.2 Alur Penelitian ...........................................................................................43 7 DAFTAR SINGKATAN Apaf 1 ATM ATR Akt or RAC-PK APO2 AIF BRCA BRAF : Apoptotic protease-activating factor 1 : Ataxia Talangiectasia Mutated gene : Ataxia- Talangiectasia and Rad3 Related : Serine/threonine protein kinase, protein kinase B (PKB) Bp Bad Bax Bid Bcl-xl : Base pair : Bcl-2-associated death promoter : Bcl2 associated-X protein : BH3 interacting domain death agonist : B-cell lymphoma-extra large Bak Bcl-2 bFGF CTD : Bcl-2 homologous antagonist killer : B-cell CLL/Lymphoma-2 : Basic fibroblast growth factor or FGF-2 : C-terminal domain Chk : Cell cycle checkpoint CA-125 : Cancer antigen-125 CDKs : Cycline Dependent kinase specific Caspases : Cysteine aspartic acid proteases Cdk C-myc : Cyclin-dependent kinase : Cellular-myelocytomatosis gene cFLIP CDKN1A CDC COX-2 Cip1 DNA DR5/Killer DBD DISC DIABLO caspases or SMAC : caspase FLICE-like inhibitory protein : Cyclin-dependent kinase inhibitor 1A : Cell-division-cycle genes : Cyclooxygenase-2 : Cyclin-dependent kinase inhibitor 1A : Deoxyribonucleic Acid : The death-domain-containig receptor for TRAIL : DNA binding domain : Death-inducing signaling complex : Second mitochondria-derived activator of EGFR ETAR ET-1 : Epidermal growth factor receptors : Endothelin A receptor : Endothelin-1 FIGO FADD Fas/DR5 FASL GOG GF : International Federation of Gynecology and Obstetrics : Fas-associative death domain : Death receptor-5 : Fas ligand : Gynecologic Oncology Group : Growth factor : Accumulation of photosystem I protein 2 : Apoptosis-inducing factor : Breast cancer gene : Serine/threonine-protein kinase B-Raf 8 G1 G2 Gadd45 : Gap 1 : Gap 2 : Growth arrest and DNA-damage inducible gene #45 GTBP HR Her2/neu (Erb2) : G/T mismatch-binding protein or hMSH6 : Homologous recombination : Human Epidermal growth factor Receptor 2 HNPCC INK4 : Hereditary non-poliposis colorectal cancer : Inhibitory protein of cyclin-dependent kinase 4 IAPs K-ras kDa kb : Inhibitors of apoptotic protein : Kirsten-ras gene : Kilo Dalton : kilo base LOH : Loss of heterozygosity MDM2 : Murine Double Minute 2 MMR MSH-2 MLH-1 : Mismatch repair genes : mutS homolog-2 gene : MutL homolog-1 gene mRNA MAP4 MMP NTD NES NER NHEJ Omi : Messenger-RNA : Microtubule-associated protein 4 : Matrix Metalloproteinase : N-terminal domain : Nuclear export sequence : Nucleotide excision repair : Non-homologous end-joining : Mitochondrially-located serine protease or HtrA2 p53 : Protein 53 PTEN TEN PIK3CA : Phospatase and TENsin homolog on human chromosome p21waf1/Cip1 : Cyclin dependent kinase inhibitors-p21 PCNA Puma PTEN p53wt PERP : DNA polymerase processivity factor : p53-up-regulated modulator of apoptosis : Phospatase and tensin homolog : p53 wild type : p53 effector related to PMP-22 Rb : Retinoblastoma RD SV40 SUMO S TRAIL TAD TNFR1 TNFα : Regulatory domain : Simian virus 40 : Small ubiquitin related modifier : Sintesis : TNF-related apoptosis-inducing ligand : Transactivation domain : Tumor necrosis factor receptor-1 : Tumour necrosis factor α VEGF Waf1 : Vascular endothelial growth factor : Wild-type p53 activated fragment-1 : Phosphoinositide-3-kinase, catalytic, alpha polypeptide 9 10 DAFTAR LAMPIRAN Halaman 1 Keterangan Kelaikan Etik .................................................................... 67 2 Surat Ijin Penelitian .............................................................................. 68 3 Data Sampel Penelitian ....................................................................... 69 4 Pewarnaan HE (grade I, II dan III) dan Imunohistokimia (IHK) ......... 71 5 Analisis Statistik .................................................................................. 72 11 ABSTRAK EKSPRESI PROTEIN 53 (p53) BERHUBUNGAN POSITIF DENGAN DERAJAT DIFERENSIASI SEL PADA KANKER OVARIUM EPITELIAL Kanker ovarium merupakan penyebab kematian tersering diantara kanker ginekologi di negara-negara barat, dan merupakan kanker kedua terbanyak setelah kanker serviks. Angka morbiditas dan mortalitas kanker ovarium masih tinggi dalam 3 dekade terakhir, sementara etiologi dan patogenesis dari penyakit ini masih belum jelas. Salah satu alasannya adalah keterbatasan dari biologi molekular yang mendasarinya dan terbatasnya biomarker untuk deteksi dini. Salah satu gen yang diperkirakan mengambil peranan penting di dalam etiopatogenesis serta progresi kanker ovarium adalah p53, merupakan gen penekan tumor yang mengkode atau mengekspresikan protein p53. Protein p53 merupakan faktor transkripsi terhadap gen-gen yang terlibat dalam regulasi siklus sel, induksi apoptosis, repair DNA, stabilitas genom. Mutasi gen p53 merupakan abnormalitas molekuler tersering pada lebih dari 50% kasus keganasan. Hilangnya fungsi p53 akibat dari mutasi dapat menimbulkan transformasi keganasan, metastase tumor dan resistensi terhadap kemoterapi. Mutasi p53 dihubungkan dengan beberapa faktor prognostik pada tumor ovarium seperti tipe histologi, derajat diferensiasi dan stadium tumor. Tujuan dari penelitian ini adalah untuk mengetahui adanya hubungan positif antara ekspresi protein 53 (p53) dengan derajat diferensiasi sel pada kanker ovarium epitelial. Penelitian ini merupakan studi cross-sectional analitik untuk menilai korelasi antara p53 dengan derajat diferensiasi kanker ovarium di Bagian Obstetri dan Ginekologi RSUP Sanglah Denpasar dan Laboratorium Patologi Anatomi RSUP Sanglah pada bulan Maret 2011 sampai dengan Juli 2013. Sampel adalah 44 pasien dengan kanker ovarium derajat diferensiasi ringan, sedang dan buruk yang masih memiliki sisa jaringan berupa blok parafin di bagian Patologi Anatomi RSUP Sanglah. Semua blok parafin dilakukan pemeriksaan imunohistokimia untuk mengetahui ekspresi p53 masing-masing sampel. Dilakukan uji Levene T dan Spearman dengan SPSS 17 for windows® version. Didapatkan hasil yang berhubungan antara ekspresi p53 dengan derajat diferensi sel kanker ovarium dengan nilai p=0,038 (p<0,05); r = 0,313. Disimpulkan bahwa terdapat hubungan positif antara ekspresi p53 dengan derajat diferensiasi pada kanker ovarium epitelial. Kata kunci: p53, derajat diferensiasi sel kanker ovarium epitelial 12 ABSTRACT PROTEIN 53 (p53) EXPRESSION POSITIVE CORRELATED WITH EPITHELIAL OVARIAN CANCER CELL DIFFERENTIATION GRADE Ovarian cancer is the most cause of death among gynecological cancer in the western countries, and is the second most cancer prevalence after cervical cancer. The morbidity and mortality rates are still high in the last 3 decades, while the etiology and pathogenesis of this disease is still unclear. One of the reason is limitation of molecular biology underlying this disease and limitation of biomarker for detection. One of the most studied gene that play an important roles in development of ovarian cancer is the tumor suppressor gene p53. Protein p53 is a transcription factor for genes involved in cell cycle regulation, induction of apoptosis, DNA repair, genome stability. P53 gene mutations are the most common molecular abnormalities in over 50% of cases of malignancy. Loss of p53 function due to mutations can cause malignant transformation, tumor metastasis and tumor resistance to chemotherapy. P53 mutations are associated with several prognostic factors in ovarian tumors as histological type, differentiation grade and stage of the tumor. The aim of this study is to find positive correlation between p53 expression with epithelial ovarian cancer cell differentiation grade. This study was a cross-sectional analytic study in the Department Obstetrics and Gynecology of Sanglah Hospital and Anatomic Pathology Laboratory of Sanglah hospital from March 2011 to July 2013. Samples were 44 ovarian cancer patients with mild, moderate and poor differentiation grade who still had the rest of ovarian tissue in the form of parafin blocks at the Anatomical Pathology laboratory of Sanglah hospital. All paraffin blocks were stained by immunohistochemistry technique. T-Levene test and Spearman applied with SPSS version 17 for Windows®. In this study there was a correlation between p53 expression with epithelial ovarian cancer cell differentiation grade with a value of p = 0.038 (p<0,05); r = 0,313. The conclusion was that p53 expression positive corelated with epithelial ovarian cancer cell differentiation grade. Keywords: p53, epithelial ovarian cancer cell differentiation grade 13 BAB I PENDAHULUAN 1.1 Latar Belakang Kanker ovarium merupakan suatu keganasan ginekologik yang mematikan dan sampai saat ini belum ada suatu cara deteksi dini serta pendekatan terapi yang efektif. Fatalitas dan prevalensinya merupakan tantangan terberat yang dihadapi oleh para klinikus ginekologi. Fatalitas ini terkait dengan gejala klinis yang tidak spesifik, terbatasnya upaya deteksi dini dan senantiasa terjadi keterlambatan penegakan diagnosis, sehingga kanker ovarium sering disebut sebagai silent killer. Lebih dari 90% kanker ovarium adalah tipe epitelial, merupakan kelompok malignansi ginekologi yang paling letal sehingga sebagian besar studi di dunia dilakukan terhadap tipe tersebut. Hal ini juga mendukung hipotesis bahwa sebagian besar kanker ovarium berasal dari epitel permukaan ovarium (Karst & Drapkin, 2010; Kurman, 2010). Perjalanan alamiah, etiologi serta histogenesis kanker ovarium masih belum banyak diketahui. Etiologi perubahan seluler yang berperan dalam perkembangan tumor ovarium didasari oleh perubahan yang terjadi pada tingkat molekuler serta terjadinya defek yang spesifik, hal ini menandakan bahwa perbedaan gambaran dan pola histologis pada kanker ovarium berhubungan dengan terjadinya defek yang berbeda-beda pada gen-gen yang mendasari setiap tipe fenotip histologisnya. Pengetahuan tentang aspek biologi molekuler yang bertanggung jawab terhadap pertumbuhan dan perkembangan sel kanker ovarium sangat penting dalam hal menentukan biomarker untuk deteksi dini, indikator prognosis atau luaran klinis, bahkan terhadap perkembangan terapi yang memiliki target spesifik pada gen atau protein tertentu yang mendasari proses karsinogenesis (Wheeler, 2001). 14 Bermacam strategi telah dikembangkan beberapa tahun terakhir yang ditujukan pada abnormalitas molekular kanker ovarium di berbagai level sebagai targetnya. Berbagai penelitian terhadap peranan faktor genetik juga telah dikembangkan dalam rangka memahami etiopatogenesis kanker ovarium, baik melalui pemeriksaan secara langsung terhadap mutasi pada gen atau pun secara tidak langsung melalui abnormalitas ekspresi protein yang dihasilkan oleh gen termutasi (Legge, et al., 2005). Salah satu gen yang diperkirakan mengambil peranan penting di dalam etiopatogenesis serta progresi kanker ovarium adalah p53, merupakan tumor suppressor gene yang mengkode atau mengekspresikan protein p53. Protein p53 merupakan faktor transkripsi terhadap gen-gen yang terlibat dalam regulasi siklus sel, induksi apoptosis, DNA repair, stabilitas genom dan mutasi gen p53 merupakan abnormalitas molekuler tersering pada lebih dari 50% kasus keganasan terutama pada kanker ovarium, kanker kolorektal dan kanker paru (Reles, 2001). Restorasi fungsi p53 telah menjadi fokus utama dalam berbagai riset terhadap kemoterapi berbasis molekuler. Gen p53 juga berperan sebagai indikator prognostik, pertumbuhan malignansi dan berhubungan dengan respon atau resistensi kanker ovarium terhadap kemoterapi (Rauf & Masadah, 2009; Lane & Levine, 2010; Havrilesky, et al., 2010). Seperti halnya gen p53, derajat diferensiasi karsinoma ovarium sebagai salah satu karakteristik histopatologi juga memiliki nilai prognostik yang signifikan dan relevansi terapi (Sato, et al., 2003). Belum ada penelitian yang mencari hubungan langsung antara ekspresi p53 dengan derajat diferensiasi sel pada kanker ovarium di Indonesia, tetapi dari beberapa kepustakaan luar menyebutkan adanya hubungan signifikan antara ekspresi protein p53 dengan derajat diferensiasi sel kanker ovarium, yakni terdapat peningkatan ekspresi protein p53 pada sel dengan derajat diferensiasi buruk (Graeff, et al., 2006; Rauf & Masadah, 2009; Shi & Zhang, 2009). 15 Pada penelitian ini akan dilakukan penilaian hubungan antara ekspresi protein p53 dengan derajat diferensiasi sel pada kanker ovarium epitelial. 1.2 Rumusan Masalah Adapun rumusan masalah pada penelitian ini adalah sebagai berikut: Apakah ada hubungan positif antara ekspresi protein p53 dengan derajat diferensiasi sel pada kanker ovarium epitelial ? 1.3 Tujuan Penelitian Adapun tujuan yang ingin dicapai melalui penelitian ini adalah: Mengetahui adanya hubungan positif antara ekspresi protein p53 dengan derajat diferensiasi sel pada kanker ovarium epitelial. 1.4 Manfaat Penelitian 1.4.1 Manfaat bagi pengetahuan Untuk menambah pengetahuan mengenai hubungan ekspresi protein p53 dengan derajat diferensiasi sel kanker ovarium epithelial dan sebagai data dasar untuk penelitian lebih lanjut tentang karsinogenesis molekuler kanker ovarium. 1.4.2 Manfaat bagi pelayanan Memberikan informasi kepada klinisi mengenai protein p53 sebagai biomarker baru yang mungkin memiliki arti klinis untuk deteksi dini, menentukan prognosis dan respon 16 terapi pada kanker ovarium sehingga penanganan pasien menjadi lebih dini, lebih tepat dan efisien. 17 BAB II TINJAUAN PUSTAKA 2.1 Kanker Ovarium 2.1.1 Epidemiologi ovarium Kanker ovarium terjadi pada 204.000 orang wanita setiap tahunnya di seluruh dunia. Secara global, terjadi 125.000 kematian per tahunnya, menempatkannya pada peringkat ketujuh penyebab kematian utama akibat kanker pada wanita (Karst & Drapkin, 2010; Jemal, et al., 2010). Di Amerika Serikat, kanker ovarium merupakan 3% dari seluruh kanker pada wanita, akan tetapi kanker ovarium menjadi penyebab kematian utama pada keganasan ginekologik dan berada pada peringkat kelima penyebab utama kematian akibat kanker pada wanita. American Cancer Society memperkirakan terdapat 21.650 kasus baru kanker ovarium yang terdiagnosa dan 15.520 wanita meninggal dunia akibat penyakit ini pada tahun 2008 (Karst & Drapkin, 2010; WHO, 2008). World Health Organization (WHO) pada tahun 2002 melaporkan bahwa kanker ovarium di Indonesia menempati urutan ke empat terbanyak dengan angka insiden mencapai 15 kasus per 100.000 wanita setelah kanker payudara, korpus uteri, dan kolorektal (Fauzan, 2009). Sedangkan di Bali, pada tahun 2006 diperoleh angka kejadian kanker ovarium sebesar 5,96% dari seluruh kasus keganasan pada wanita (YKI, 2006). Kurang lebih 70% kasus kanker ovarium terdiagnosa pada saat penyakit sudah berkembang ke stadium III atau IV dan telah meIibatkan kavum peritonium atau organ lain. Gejala yang berhubungan dengan kanker ovarium mempunyai tipikal tidak spesifik, dan hubungannya sering tidak dapat dikenali hingga pada akhirnya didapati pada stadium lanjut. Faktor prognostik meliputi stadium dan grading histologik kanker saat diagnosa, 18 ada tidaknya residu setelah operasi pertama selesai, status fungsional, umur, dan pengobatan dengan kemoterapi. Saat kanker ovarium terbatas hanya pada ovarium (stadium I) dan kemudian mendapatkan terapi, 5-year survival rate kurang lebih 90%, berbeda jika terdiagnosa pada stadium II atau IV, kurang Iebih 33% (Pearson, 2009). Sebagian besar (80%-85%) tumor ovarium bersifat jinak dan dua pertiga dari tumor tersebut dijumpai pada wanita usia 20 hingga 45 tahun. Kemungkinan tumor ovarium primer bersifat ganas pada usia kurang dari 45 tahun adalah 1 dari 15 wanita (Rao, et al., 2004). Lifetime risk kanker ovarium invasif kurang Iebih 1,4% (1 dari 71), dan lifetime risk kematian akibat kanker ovarium invasif adalah 1 dari 95 (Karst & Drapkin, 2010; WHO, 2008). 2.1.2 Faktor risiko kanker ovarium Etiologi kanker ovarium belum diketahui dengan jelas, namun ditemukan beberapa faktor risiko yang dianggap dapat menjadi penyebab timbulnya kanker ovarium, antara lain adalah faktor genetik, umur, kehamilan dan paritas (Fauzan, 2009). 1. Faktor genetik a. Kurang Iebih 5-10% kanker ovarium bersifat herediter. Faktor risiko yang paling signifikan untuk kanker ovarium adalah mutasi yang diturunkan pada satu atau dua gen yang bernama breast cancer gene 1 dan 2 (BRCA-1 dan -2). Gen ini ditemukan hanya pada keluarga dengan riwayat kanker payudara, tetapi juga bertanggung jawab terhadap 5% sampai 10% kanker ovarium. Lifetime risk mutasi karier BRCA menderita kanker ovarium adalah 18% hingga 54% untuk BRCA-1 dan 2% hingga 19% untuk BRCA2 (Miettinen, S., 2009). 19 b. Keterkaitan genetik lainnya yang diketahui ialah melibatkan suatu sindroma inherediter yang dinamakan nonpolyposis colorectal cancer (HNPCC), juga dikenal dengan sindroma Lynch. Seseorang dalam keluarga dengan HNPCC berisiko menderita kanker kolorektal, begitu juga dengan kanker ekstra kolon lainnya termasuk kanker ovarium. Risiko HNPCC terkait dengan terjadinya kanker ovarium adalah sebanyak 12% (Miettinen, S., 2009). c. Berbagai kelainan pada gen dan ekspresi protein gen, yaitu: 1) Protoonkogen yang memicu pertumbuhan sel kanker 2) gen supresor tumor yang mengalami inaktivasi 3) gen pengatur apoptosis yang mengalami perubahan 4) DNA mismatch repair Gene (Kumar, et al., 2010). 2. Umur Kanker ovarium umumnya terjadi setelah menopause. Seperti halnya sebagian besar kanker, peluang seorang wanita menderita kanker ovarium meningkat seiring bertambahnya umur. Namun angka kejadian baru paling banyak ditemukan pada rentang umur 60 sampai 74 tahun dengan median umur saat terdiagnosis adalah 59 tahun. Risiko tumor ovarium untuk mengalami keganasan juga meningkat seiring dengan bertambahnya umur, dimana risiko keganasan didapatkan sebesar 13% pada wanita pre menopause dan 45% postmenopause. Sebanyak 80% dari kejadian kanker ovarium ditemukan pada umur wanita lebih dari 45 tahun, namun pada beberapa kasus kanker ovarium juga dapat ditemukan pada umur relatif muda yakni 20-30 tahun (Miettinen, S.; 2009. Fauzan, 2009). 20 3. Paritas Wanita yang sudah pernah hamil berisiko 50% lebih rendah untuk mengalami kanker ovarium daripada wanita yang belum pernah hamil atau nullipara. Bahkan, wanita yang telah hamil beberapa kali risiko terjadinya kanker ovarium menjadi semakin berkurang. Penelitian pada Cancer Research United of Kingdom tahun 2006 menyimpulkan bahwa semakin tinggi jumlah paritas maka semakin rendah kemungkinan risiko terjadinya kanker ovarium, bahkan wanita yang tidak memiliki anak atau nullipara memiliki risiko dua kali lipat lebih besar untuk terjadinya kanker ovarium daripada wanita dengan paritas tiga atau lebih (Granstrom, 2008). 2.1.3 Karsinogenesis molekuler kanker ovarium Siklus replikasi sel normal terdiri dari 4 fase yaitu gap (G1), sintesis (S), G2 dan mitosis (M). Replikasi DNA terjadi pada phase S dan pembelahan mitosis terjadi pada fase M. Fase S dan M merupakan fase yang paling sensitif terhadap berbagai macam faktor. Sehingga apabila sel terpapar oleh suatu faktor misalnya pajanan radiasi, sel biasanya melakukan arrest pada fase Gl atau G2. Pada Gl sel terus tumbuh dan melakukan metabolik normal, fase S merupakan fase dimana DNA sel akan bereplikasi, sedangkan pada fase G2 sel akan tumbuh dan melakukan persiapan untuk mitosis pada fase selanjutnya (Syaifudin, M., 2007; Kumar, et al., 2010). Gambar 2.1 Siklus Sel (Berek & Natarajan, 2007) 21 Karsinogenesis merupakan suatu proses berkesinambungan yang terjadi pada tahapan fenotip dan genetik. Kanker ganas memiliki beberapa macam fenotip seperti pertumbuhan yang berlebihan, invasi lokal dan kemampuan untuk bermetastasis hingga ke organ yang jauh. Semua karakteristik tersebut merupakan fenomena yang disebut progresifitas tumor. Gen yang terkait dengan kanker berperan pada tujuh perubahan dasar dari fisiologi sel yang secara bersama-sama menentukan fenotip keganasan. Tujuh perubahan dasar tersebut meliputi: 1. Persediaan sinyal pertumbuhan yang adekuat sehingga tumor memiliki kemampuan proliferasi tanpa rangsangan eksternal, umumnya akibat dari aktivasi onkogen. 2. Ketidakpekaan terhadap sinyal inhibisi pertumbuhan yang menyebabkan tumor mungkin tidak merespon molekul yang menghambat proliferasi sel normal seperti transforming growth factor (TGF-β) dan direct inhibitors of cyclin-dependent kinases (CDKIs). 3. Tidak terjadinya apoptosis sehingga tumor mungkin resisten terhadap program kematian sel, sebagai konsekuensi dari inaktivasi dari p53 atau aktivasi dari gen anti apoptosis. 4. Potensi replikasi yang tidak terbatas yang mengakibatkan tumor mempunyai kemampuan untuk berproliferasi dan menghindari proses penuaan selular. 5. Proses angiogenesis yang berkelanjutan, sel tumor, seperti halnya sel normal, tidak dapat tumbuh tanpa adanya pasokan pembuluh darah untuk membawa nutrisi dan oksigen serta membuang produk yang tidak 22 diperlukan. Oleh karena itu tumor harus menginduksi angiogenesis agar dapat memperoleh pasokan nutrisi dan oksigen. 6. Kemampuan untuk menginvasi dan metastasis. Tumor metastasis adalah penyebab sebagian besar kematian akibat kanker dan tergantung pada proses yang intrinsik dengan sel atau di inisiasi oleh sinyal dari jaringan. 7. Kerusakan pada fungsi DNA repair sehingga tumor mungkin gagal untuk memperbaiki kerusakan DNA yang disebabkan oleh karsinogen atau selama proliferasi seluler, hal ini menyebabkan ketidakstabilan genom dan terjadinya mutasi pada proto-onkogen dan gen penekan tumor (Kumar, et al., 2010). Gambar 2.2 Skema Dasar Sederhana Molekuler Kanker (Kumar, et al., 2010) 23 Siklus sel diatur oleh berbagai macam gen dan protein yang mana dalam keadaan normal saling berhubungan. Kelainan pada gen dan ekspresi protein gen tersebut dapat dibagi menjadi tiga, pertama adalah Proto-onkogen, gen yang termasuk dalam kelompok ini diantaranya adalah gen Her2-neu, RAS, MYC, dan CDK1. Proto-onkogen merupakan suatu gen yang berfungsi untuk meningkatkan proliferasi sel dalam keadaan normal, sehingga akan mengarah pada pertumbuhan sel yang tidak terkendali. Yang kedua adalah gen penekan tumor yang mengalami inaktivasi, gen-gen yang ternasuk dalam kelompok ini adalah BRCA1, BRCA2, dan p53 (Kumar, et al., 2010). Terjadinya inaktivasi pada BRCA1 dan BRCA2 menyebabkan gangguan repair kerusakan sel atau DNA. Sedangkan inaktivasi pada p53, misalnya pada sel yang mengalami mutasi atau kehilangan gen p53, maka ekspresi protein p53 tidak terjadi atau ekspresi protein p53 terjadi namun tidak dapat berfungsi sebagai pengaktivasi proses transkripsi pada beberapa gen target seperti gen inhibitor kinase dipendent-cydin CDKN1A (p21) dan GADD45. Protein p21 yang tidak teraktivasi menyebabkan siklus sel tidak dapat berhenti pada akhir fase Gl dan GADD45 yang tidak mengalami aktivasi, menyebabkan perbaikan DNA pun tidak dapat terjadi. Juga dengan terjadinya efek proapoptosis oleh p53 yang diperantarai melalui peningkatan sintesis BAX, sehingga pada sel yang mengalami mutasi atau kehilangan gen p53 tidak mengalami aktivasi pada gen apoptosis BAX, Terjadinya inaktivasi pada BAX menyebabkan sel tidak mengalami apoptosis. Yang terakhir adalah gen pengatur apoptosis yang mengalami perubahan, seperti pada gen BAX dan BCL2. Terjadinya inaktivasi pada BAX menyebabkan sel tidak mengalami apoptosis. Selain itu perubahan fungsi inhibisi apoptosis gen BCL2 justru akan menimbulkan terjadinya peningkatan ekspresi gen atau overekspresi gen tersebut, mengakibatkan sel semakin tidak mengalami apoptosis (Kumar et al., 2010). 24 Kelompok gen dan ekspresi protein abnormal pada kanker ovarium dapat dilihat pada tabel 2.1. Tabel 2.1 Kelompok Gen dan Ekspresi Protein Abnormal pada Kanker Ovarium Kelompok Onkogen Lokasi/Kategori Gen Keterangan TGF-a TGFA Overekspresi EGF receptor Her2-neu Overekspresi FMS- like lyrosine FLT3 Amplifikasi GTP-binding KRAS/HRAS Point mutation RAS signal BRAF Point mutation MYC Amplifikasi CDK1 Amplifikasi Kinase 3 transduction Transcriptional activator Cyclin dependent kinase Inaktivasi gen Inti sel P53 supresor tumor penghentian siklus sel dan induksi apoptosis (-) Inti sel BRCA1 perbaikan DNA (-) BRCA2 Perubahan Inti sel gen apoptosis Sumber : Kumar, et al., 2010 BCL2 inhibisi apoptosis meningkat 25 HER-2/neu ditemukan mengalami amplifikasi dan overekspresi pada 26% kanker ovarium. Diantara tumor supresor gen yang mengalami perubahan pada kanker ovarium sporadis, p53 memiiki peran yang paling penting, sementara BRCA1 dan BRCA2 jarang bermutasi. p53 dijumpai bermutasi pada kurang lebih 40%-80% dan mengalami overekspresi pada 32%-84% kanker ovarium tipe epitelial. Gen lain yang sering mengalami alterasi pada kanker ovarium adalah Mdm2, yang mengatur dengan ketat fungsi p53, dan p21 (cipl/waf1), dan mediasi p53 induced Gl cell cycle arrest (Reles, 2001). 2.2 Protein p53 Protein p53 pertama kali diidentifikasi pada tahun 1979 sebagai transformation- related protein dan protein yang terakumulasi pada inti sel kanker serta berikatan kuat dengan antigen T simian virus 40 (SV40). Akan tetapi, sepuluh tahun kemudian, para peneliti mendapatkan bahwa ternyata protein tersebut merupakan mutasi dari bentuk awal p53/wild-type p53 (wt p53) dan sifat onkogenik p53 sebenarnya merupakan hasil dari mutasi p53 (Bai & Zhu, 2006). Gen p53 merupakan tumor suppressor gene yang multifungsi dan sering mengalami alterasi pada kanker ovarium dan jenis kanker lainnya. Pada kondisi normal, p53 berinteraksi dengan berbagai jenis protein yang terlibat dalam regulasi transkripsional, repair DNA, siklus sel, apoptosis, dan degradasi protein yang dimediasi oleh proteosom (Havrilesky, et al., 2003). Produk protein dari gen ini. p53, merupakan salah satu molekul terpenting dalam dunia biologi. Berbagai peran dari p53 yang berhubungan dengan kanker terus berusaha diteliti, sejauh ini fungsi yang telah diketahui mencakup pengaturan siklus sel, penuaan sel, kematian sel atau apoptosis, perbaikan kerusakan DNA yang disebabkan oleh agen 26 genotoksik, angiogenesis dan regulasi stress oksidatif. Dengan relevansi fungsi yang sangat luas menempatkan p53 pada posisi pengendali yang bertanggung jawab terhadap berbagai proses terkait dengan kanker. Begitupula mengingat banyaknya mitra interaksi, tidaklah mengherankan jika penyimpangan pada p53 sangat sering ditemukan pada kanker (Foulkes, 2007). Dalam kondisi normal, jaringan p53 dalam kondisi tidak aktif, biasanya diaktifkan oleh semacam stress seluler yang dapat mengubah siklus pertumbuhan sel normal atau menginduksi mutasi genom yang kemudian mengarah pada tranformasi onkogenik. Protein p53 aktif dapat menghentikan siklus sel atau, pada banyak kasus. menghidupkan jalur apoptosis dan memaksa sel-sel rusak dan mengandung mutasi melakukan bunuh diri sehingga mencegah perbanyakan dan pertumbuhan selular yang abnormal. Oleh karena itu, protein p53, sebagai guardian of genom, adalah inhibitor penting dari perkembangan tumor sehingga menjelaskan mengapa gen ini menjadi paling sering bermutasi dalam penyakit kanker pada manusia (Bourdon, 2003). Tumor supresor gen p53 ditemukan bermutasi pada lebih dari 50% kanker pada manusia. Kapasitas dari p53 dalam beberapa fungsi biologis dapat dikaitkan dengan kemampuannya bertindak sebagai suatu faktor transkripsi untai-spesifik untuk mengatur ekspresi lebih dari 100 gen target yang berbeda, demikian juga untuk mengatur berbagai proses seluler termasuk apoptosis, penghentian siklus sel dan perbaikan DNA. Protein p53 dengan struktur C- dan N-terminal yang unik dimodulasi oleh beberapa proses biologis penting seperti fosforilasi, asetilasi, sumolasi dan ubiquitinasi, melalui proses tersebut secara efektif mampu mengatur pertumbuhan dan kematian sel (Anderson & Appela, 2002). 27 Pada penyakit kanker, mutasi p53 disebarluaskan melalui gen. Sebagian besar mutasi gen adalah missense mutations yang menimbulkan substitusi asam amino pada protein wild-type. Mutasi ini selalu berakibat pada terjadinya sintesis protein mutant yang dapat meningkatkan stabilitas seluler akan tetapi cacat secara fungsi. p53 mutant terakumulasi di dalam sel, mencapai level hingga 10 sampai 100 kali lipat lebih tinggi daripada protein wild type (Miettinen, 2009). Terdapat hubungan yang erat antara missense mutation dengan overekspresi protein p53. Nonsense mutation, insersi dan delesi pada p53 juga dijumpai (Havrilesky, et al., 2003). Pada beberapa studi, mutasi p53 berhubungan dengan prognosis yang buruk. Prevalensi mutasi p53 sangat tergantung pada subtipe histologik kanker ovarium. Mutasi p53 terjadi pada lebih dari dua pertiga kanker ovarium epitelial lanjut (Havrilesky et al., 2003). Mutasi dan overekspresi gen p53 lebih sering terjadi pada primary serous ovarian cancer yaitu berturut-turut pada 58% dan 59% kasus. Persentase mutasi gen p53 dilaporkan rendah pada tumor ovarium tipe endometrioid, musinus dan clear-cell, berturut-turut 28%, 16%, dan 10% tetapi sedikit lebih tinggi jika menggunakan tehnik imunohistokimia, yaitu 37% pada endometrioid dan 31% pada tipe tumor musinus (Schuijer & Berns, 2003). Insiden mutasi sangat tinggi khususnya pada highgrade serous carcinoma. Status ekspresi p53 telah digunakan untuk mengklasifikasi karsinoma ovarium serosa kedalam dua subtipe yang berbeda. Pasien dengan p53 aberrant, misalnya, ekspresi yang berlebihan atau status p53 yang benar-benar negatif, mempunyai 5-year overall survilance 26%, sedangkan pasien dengan p53 normal memiliki 5-year survilance 79%. Frekuensi overekspresi p53 lebih tinggi secara signifikan pada penyakit stadium lanjut yakni stadium III dan IV (40%-60%) dibandingkan pada stadium I (10%20%). Dengan kata lain, sangat mungkin jika p53 berhubungan erat dengan fenotipe yang 28 agresif dan juga berarti bahwa penyakit tersebut akan menyebar lebih cepat (Havrilesky, et al., 2003). Beberapa mekanisme inkativasi fungsi gen p53 pada berbagai keganasan dapat dilihat pada tabel 2.2. Tabel 2.2 Mekanisme Inaktivasi Gen p53 Mekanisme inaktivasi gen p53 Efek inaktivasi Mutasi perubahan asam amino Menghalangi p53 binding pada deret pada DNA binding domain DNA spesifik dan mengaktifkan gen didekatnya Delesi karboksil terminal domain Menghalangi pembentukan tetramer p53 Penggandaan gen MDM2 MDM2 ekstra menstimuli degradasi p53 Delesi gen p14ARF Kegagalan menghambat MDM2 dan menahan degradasi p53 tetap terkendali Mis-lokasi p53 pada sitoplasma, di Kegagalan fungsi p53, karena p53 luar inti berfungsi hanya dalam inti Sumber: Syaifudin, 2007 Alterasi pada p53 diketahui berhubungan dengan respon atau resistensi terhadap kemoterapi. Hal ini mengindikasikan bahwa hilangnya fungsi p53 dapat memberikan fenotipe kemoresisten karena p53 berperan dalam chemotherapy-induced apoptosis. Berdasarkan hasil studi in vitro, status p53 sangat penting khususnya dalam hal sensitifltas sel kanker ovarium terhadap kemoterapi cisplatin (Havrilesky, et al., 2003). 2.2.1 Struktur protein p53 Gen p53 terletak pada bagian lengan pendek dari kromosom 17 (17p13.1), merupakan suatu nuklear phospoprotein yang memiliki berat molekul sebesar 53 kilo Dalton (kDa). Gen p53 ini dikode oleh 20 kilobasa (kb) yang terdiri dari 11 ekson dan 10 29 intron (Maximov, 2008; Bai & Zhu, 2006). Gen p53 ini termasuk di dalam kelompok gen pelindung sel, yang memiliki dua anggota lainnya yaitu, p63 dan p73. Protein p53 wild type (wt p53), mengandung sebanyak 393 asam amino dan terdiri dari tiga domain fungsional. yaitu N-terminal activation domain, DNA binding domain dan C-terminal tetramerization domain (Gambar 2.3), Selain itu, terdapat sebuah daerah domain inti sentral atau central core, yaitu pada residu 102 sampai 292 dan daerah domain C-terminal, yaitu pada residu 324 sampai 393 (Bai & Zhu, 2006). Gambar 2.3 Representasi Skematik Struktur p53 (Bai & Zhu, 2006) 1. N-terminal domain (NTD) Sebagai faktor transkripsi, p53 memiliki domain transaktivasi bipartite (TAD; asam amino 1-42 dan 43-73) yang mana, bersama-sama dengan proline rich region (asam amino 61-94), membentuk N-terminal domain (NTD). Oleh karena kaya akan residu acidic seperti Asp dan Glu menjadikan domain ini suatu domain transaktivasi acidic (Chene, 2003). Domain ini tidak memiliki struktur tersier dan sebagian besar memerlukan elemen struktural sekunder yang merupakan ciri khas dari kebanyakan TAD acidic. Potongan kecil dari domain TAD p53 dapat membentuk sub-struktur lokal, seperti induced helices, dengan formasinya yang tergantung pada sifat partner 30 protein pengikatnya, misalnya Murine Double Minute 2 (Mdm2). Suatu nuclear export sequence (NES) terletak pada NTD (asam amino 11-27) dan berkolaborasi dengan C-terminal NES untuk melaksanakan ekspor nuklear p53. Inaktivasi sinyal ekspor oleh modifikasi post-translasional terhadap NTD terjadi saat aktivasi p53 (Jung, 2007). 2. DNA binding domain (DBD) Central sequence-specific DNA binding domain (DBD) dari p53, umumnya disebut sebagai core domain (asam amino 102-292), sangat penting dalam kapasitas faktor transkripsi p53 untuk mengikat DNA. p53 berikatan dengan fragmen DNA yang terdiri dari dua sekuens dekamer half-site recognition 5'-Pu-Pu-Pu-C-(A/T)-(T/A)-GPy-Py-Py-3'(Pu=A/G, Py = T/C) yang dipisahkan oleh region pembatas yang mencakup hingga 13 bp. Ikatan p53 dengan DNA terjadi melalui kerjasama dengan empat domain inti menempati satu elemen respon DNA. Berdasarkan database internasional, lebih dari 90% mutasi tumorigenik p53 terjadi pada domain inti (Chene, 2003). 3. C-terminal domain (CTD) C-terminal domain (CTD) dianggap memiliki peran regulasi. Residu pada domain Cterminal dasar mengalami modifikasi post translational termasuk fosforilasi dan asetilasi. Fungsional p53 terdapat dalam bentuk tetramer. Bagian C-terminal p53 terdiri dari dua domain, yaitu bagian yang mengandung domain oligomerisasi atau domain tetramerisasi (TD, residu 324 sampai 355) dan domain regulator (RD) pada terminal karboksil (residu 363 sampai 393) (Bai & Zhu, 2006). Suatu nuclear export sequence (NES, asam amino 350-351) terletak di dalam TD dan melakukan mediasi hubungan sitoplasma-inti. Saat domain ini terpapar pada permukaan protein dan 31 ketika p53 berada dalam bentuk monomernya, NES tertanam dibawah permukaan saat oligomerisasi p53 dan akan menimbulkan retensi nuklear. Negatif autoregulatory domain (RD) pada bagian C-terminal dari p53 dihubungkan dengan TD melalui regio penghubung utama, yang mengandung suatu bipartite nuclear localization signal (NLS) yang memediasi impor nuklear dari p53. RD berimplikasi pada auto-inhibisi terhadap p53 DNA-binding function (Jung, 2007). CTD juga berfungsi sebagai domain regulasi negatif yang memiliki fungsi menginduksi proses kematian sel atau apoptosis dan mengatur kemampuan DBD inti untuk mempertahankan DBD tetap dalam bentuk laten. Jika interaksi antara CTD dan DBD inti diputus atau dihilangkan oleh modifikasi post translasional, seperti proses fosforilasi dan asetilasi, sehingga akan dapat menginduksi terjadinya aktivitas traskripsi (Bai & Zhu, 2006). 2.2.2 Peran protein p53 Protein p53 memiliki aktivitas biokimia sebagai faktor transkripsi dan peran biologi sebagai tumor suppressor yang sangat kuat. Sebagai faktor transkripsi multitarget, p53 mengontrol berbagai jenis gen dengan fungsi yang berbeda-beda. Sebagai penekan tumor, p53 sangat penting untuk mencegah proliferasi sel yang menyimpang serta mempertahankan integritas genom akibat stress genotoksik (Foulkes, 2007). 32 Gambar 2.4 Protein p53 pada Persimpangan Jalur Hubungan Kompleks Respon Sel terhadap Stress (Bai & Zhu, 2006) Banyak pendekatan telah dilakukan untuk mengidentifikasi target kerja dari p53 melalui berbagai studi eksperimental. Hasilnya, ditemukan ratusan gen yang secara fisiologis responsif terhadap p53. Gen tersebut termasuk gen yang terlibat pada cell cycle arrest dan DNA repair, apoptosis dan gen yang berkaitan dengan penuaan sel, seperti p21Waf1/Cip1, Gadd45 dan gen dari keluarga Bcl-2. Selain menyebabkan aktivasi transkripsional secara langsung maupun tidak langsung, peningkatan kadar p53 juga menyebabkan represi terhadap berbagai ekspresi gen. Gen yang mungkin dapat ditekan dengan p53 termasuk Bcl-2, Bcl-X1, cyclin B1, MAP4 dan survivin, beberapa dari mereka adalah regulator negatif terhadap apoptosis (Gambar 2.4). Fungsi dari berbagai target gen p53 sangat beragam, sesuai dengan aktifitas p53 sebagai protein multifungsi (Bai & Zhu, 2006): 33 1. Cell cycle arrest Di antara berbagai respon seluler yang ditimbulkan oleh p53, yang utama adalah induksi terhadap cell cycle arrest, apoptosis dan DNA repair (Reles, 2001; Bai & Zhu, 2006). Tampak bahwa kemampuan p53 untuk menghambat pertumbuhan sel sangat penting mengingat fungsinya sebagai penekan tumor. Inhibisi terhadap siklus sel terjadi apabila timbul blokade di dalam siklus pembelahan sel. Induksi cell cycle arrest oleh p53 dapat memberikan tambahan waktu bagi sel untuk memperbaiki kerusakan genom sebelum memasuki tahapan penting sintesis DNA dan mitosis. Sel-sel yang sebelumnya tertahan akan dikembalikan ke kondisi proliferasinya melalui fungsi biokimia p53 yang memfasilitasi DNA repair termasuk diantaranya nucleotide excision repair dan base excision repair (Bai & Zhu, 2006). Penghambat Cdk, p21Waf1/Cip1, merupakan target hilir yang paling dikenal di antara berbagai produk gen target p53 yang telah dapat diidentifikasi. p21Waf1/Cip1 adalah mediator utama dari p53-dependent Gl cell cycle arrest yang menyertai terjadinya kerusakan DNA. Sebagai respon terhadap stress selular, p53 menstimulasi ekspresi mRNA p21Waf1/Cip1 endogen kemudian p21Waf1/Cip1 mengikat kompleks siklin-Cdk. Overekspresi p21Waf1/Cip1 menginduksi Gl arrest dengan menghalangi cyclin E/Cdk2-mediated phosphorylation dari protein Rb dan pelepasan E2F yang berfungsi untuk menginduksi ekspresi gen yang dibutuhkan untuk memasuki fase S. Jadi, saat p21Waf1/Cip1 menghambat Cdks akan menimbulkan hambatan pada fase transisi Gl-S maupun G2-mitosis (Whibly, 2009). Respon ini juga diatur oleh produk gen target p53 lainnya, seperti misalnya, peningkatan ekspresi Gadd45 dan 14-3-35 yang berpartisipasi dalam p53-driven G2 arrest. Gadd45 mengikat CDC2, mencegah pembentukan kompleks siklin B/CDC2 dan selanjutnya menghambat aktivitas kinase. Sebuah protein 14-3-3δ mengeluarkan siklin B/CDC2 dari nukleus sehingga 34 siklin B/CDC2 secara fisik terpisah dari protein target. Ekspresi dari 14-3-3δ menginduksi G2 arrest. G2 checkpoint merupakan barier terakhir sebelum mutasi terus berlanjut dan sangat penting untuk menjaga stabilitas genom (Reles, 2001). 2. p53-dependent apoptosis Sebagai cellular gatekeeper, salah satu peranan p53 adalah untuk memonitor stress selular dan menginduksi apoptosis apabila lesi DNA irreversible atau tidak dapat diperbaiki. Apoptosis merupakan proses bertingkat yang diregulasi dengan ketat, ditandai dengan penyusutan sel, kondensasi kromatin, serta fragmentasi sel dan inti (Bai & Zhu, 2006; Miettinen, 2009). Dalam perkembanganya apoptosis juga sering disebut dengan programmed cell death, yang berlangsung terus selama proses kehidupan dengan maksud untuk menjaga homeostasis jaringan, yaitu keseimbangan antara proliferasi dengan kematian sel. 35 Gambar 2.5 p53 serta Jalur yang Terlibat dalam Apoptosis (Maximov, 2008) Apoptosis merupakan barier utama onkogenesis dan tumor suppressor protein p53 merupakan kunci utama regulasi apoptosis dan karsinogenesis (Maximov, 2008). Apoptosis dimediasi oleh dua jalur apoptosis utama, yaitu jalur ekstrinsik dan intrinsik (Gambar 2.5). Apapun jalur aktivasi yang diinduksi, masing-masing jalur tersebut menimbulkan aktivasi protease selektif yang disebut sebagai kaspase. Kaspase dikenal sebagai eksekutor apoptosis, merupakan sistein protease selektif yang mengontrol semua tahap apoptosis. Kaspase terdapat di setiap sel sebagai prekursor tidak aktif yang disebut prokaspase. Jalur ekstrinsikdikenal sebagai death receptor pathway dan jalur intrinsik sebagai mitochondrial pathway. Baik jalur ekstrinsik dan intrinsik diaktifkan oleh tumor suppressor protein p53 (Miettinen, 2009). Pada jalur ekstrinsik terjadi aktivasi caspase 8 untuk menginduksi apoptosis, 36 sedangkan pada jalur intrinsik terdapat peran protein mitokondria dalam aktivasi kaspase 9 untuk menginduksi apoptosis. Selain itu, p53 dapat mengaktifkan Apaf-1 secara langsung untuk menginduksi apoptosis (Maximov, 2008). 3. DNA repair Tidak semua gen yang membatasi pertumbuhan tumor mengontrol hidup dan mati sel secara langsung. DNA repair genes yang terlibat dalam koreksi berbagai jenis kerusakan pada DNA tidak bekerja secara langsung saat mengalami aktivasi. Hal ini karena mutasi pada gen ini menyebabkan instabilitas genetik sehingga terjadi akumulasi kerusakan dari semua gen, termasuk gen yang mengatur pertubuhan sel. p53 berperan penting dalam memelihara stabilitas genetik. Mekanismenya masih belum jelas, tetapi p53 mungkin terlibat pada induksi gen yang meregulasi NER dari DNA, rekombinasi kromosomal dan segregasi kromosom (Vogelstein, 2000). Inaktivasi p53 dapat menimbulkan peningkatan frekuensi mutasi akibat dari tidak efisiennya NER. NER yang buruk menyebabkan instabilitas genom. Instabilitas ini dimanifestasikan dengan amplifikasi gen, aneuplodi, dan aberasi kromosom, berasosiasi dengan progresi malignansi (Reles, 2001). Induksi gen spesific ribonucleotide reductase oleh p53 setelah terjadinya kerusakan DNA merupakan bukti lain peran p53 dalam DNA repair (Vogelstein, 2000). Tumor suppressor gene p53 melakukan modulasi pada sebagian besar proses DNA repair melalui jalur transaktivasi dependen maupun independen. Sehingga, p53 berfungsi sebagai molecular node yang terletak pada persimpangan upstream signaling cascade dan downstream DNA-repair (Sengupta, 2005). Akumulasi protein p53 menghasilkan transient arrest pada siklus sel di Gl, sesaat sebelum replikasi DNA, atau di G2, sesaat sebelum mitosis. Berhentinya pembelahan sel ini memberikan kesempatan pada sel mengaktivasi sistem DNA repair enzimatis untuk memperbaiki lesi yang terjadi. Dengan 37 kata lain, pada sel yang mengekspresikan mutasi p53, pembelahan sel tidak berhenti walaupun telah terjadi kerusakan DNA (Soussi, 2004). 2.2.3 Aktivasi p53 Sebagai akibat dari berbagai stimulus intraseluler dan ekstraseluler, seperti kerusakan DNA (termasuk radiasi pengion, radiasi UV, pengunaan obat sitotoksik atau agen kemoterapi, dan infeksi virus), syok akibat pemanasan, hipoksia, dan ekspresi onkogen yang berlebihan, wt p53 diaktifkan sebagai protein regulator yang penting untuk memicu respon biologis yang beragam, baik di tingkat sel tunggal maupun pada tingkat organisme. Aktivasi p53 melibatkan perubahan kualitatif yang terjadi pada protein melalui modifikasi pasca translasional sehingga menghasilkan aktivasi gen target p53. Menanggapi berbagai jenis stress, p53 diakumulasikan di dalam inti dan berikatan pada tempat tertentu di daerah pengaturan dari gen responsif p53 dan kemudian mendorong dengan kuat transkripsi dari gen-gen tersebut (Bai & Zhu, 2006). 38 Gambar 2.6 Jalur aktivasi p53 (Chene, 2003) Protein p53 terletak di persimpangan jalur jaringan transmisi sinyal yang penting untuk regulasi pertumbuhan sel dan apoptosis yang diinduksi oleh stress genotoksik dan non-genotoksik. Dalam kondisi sel normal tanpa stress, level protein p53 ditekan melalui ikatan dengan protein regulator negatif Mdm2, sebagai E3 ubiquitin ligase, yang mempromosikan degradasi p53 melalui ubiquitinasi atau proteosom-mediated degradation (Gambar 2.6). Karena gen ini dipromosikan oleh p53, hal ini menyebabkan sebuah lengkung pengaturan umpan balik yang akan menjaga level p53 sangat rendah dalam sel normal (Vogelstein, et al., 2000; Levine, et al., 2006). Aktivasi p53 secara garis besar meliputi 2 langkah proses, pertama, level protein p53 meningkat melalui inhibisi terhadap interaksinya dengan Mdm2 dan regulator negatif lainnya. Kedua, suatu seri modulator (kinase, asetilase) akan mengaktifkan aktivitas 39 transkripsi p53. Sinyal stress ditransmisikan kepada protein p53 melalui modifikasi pasca-translasional (Vogelstein, et al. 2000; Harris & Levine, 2005). Downstream signaling meliputi berbagai jenis gen yang diaktivasi oleh bagian transaktivasi p53. Ini terjadi melalui ikatan spesifik DNA oleh protein p53 pada p53 response element (p53 RE) yang dijumpai pada promoter atau pada bagian intron dari gen target. Berkenaan dengan tipe stress yang terjadi, hasil akhir dari aktivasi p53 adalah penghentian siklus sel dan perbaikan DNA atau apoptosis, akan tetapi mekanisme yang menentukan berbagai pilihan terhadap nasib sel tersebut belum dapat diterangkan. Jalur aktivasi p53 dapat dibagi ke dalam lima bagian : 1. Stress signal yang memicu atau menyebabkan jaringan memasuki kondisi fungsional. 2. Upstream mediators yang mendeteksi dan menafsirkan sinyal yang memulai jalur fungsional dan me-relay sinyal input kepada protein p53 atau molekul yang dengan segera (dalam hitungan menit sampai satu jam) mengatur konsentrasi dan aktivitas dari protein p53. 3. The core regulation, termasuk protein p53 itu sendiri, yang mengatur aktivitas, stabilitas dan fungsi p53. 4. Downstream events yang terdiri dari satu set gen dan proteinnya yang diatur oleh protein p53, paling sering oleh aktivasi transkripsi tetapi dalam beberapa kasus oleh interaksi protein-protein. 5. Output seluler dari downstream events yang meliputi cell cycle arrest, senescence atau apoptosis dan sering menghasilkan komunikasi yang luas 40 dengan jalur transduksi sinyal lain dalam sel (Levine, et al., 2006; Harris & Levine, 2005; Chene, 2003). Pertama-tama, sebagai respons terhadap stress-activated signaling pathway (upstream events), p53 akan distabilkan dan terakumulasi di dalam inti. Level protein p53 meningkat secara proporsional dengan adanya kerusakan DNA ditandai dengan waktu paruh protein ini yang memanjang, selanjutnya DNA-binding activity p53 akan meningkat. Stabilisasi p53 dan peningkatan aktivitasnya diatur oleh beberapa mekanisme. Pada kondisi sel tanpa stress, protein p53 dipertahankan pada low steady-state level dan memiliki waktu paruh pendek karena mengalami ubiquitin-dependent degradation yang cepat melalui proteosome 26s. Ubiquitin adalah polipeptida dengan 76 asam amino yang ditransfer ke residu lisin pada protein oleh ubiquitin ligase (Anderson & Appela, 2002). Level protein p53 meningkat melalui inhibisi terhadap interaksinya dengan Mdm2 dan regulator negatif lainnya. Anti represi merupakan terbebasnya p53 dari pengaruh represi yang dimediasi oleh Mdm2. Tahap ini membutuhkan asetilasi dari p53 dan memfasilitasi aktivasi subset spesifik dari target gen p53, seperti p21Waf1/Cip1 dan Gadd45 untuk menginduksi cell cycle arrest dan DNA repair. Pada kondisi normal tanpa adanya stress pada sel, p53 mempunyai waktu paruh yang sangat pendek (20 menit) yang ditimbulkan oleh lengkung umpan balik negatif dimana ikatan dengan protein Mdm2 menjadikan p53 sebagai target destruksi. Mdm2 adalah regulator negatif utama p53 pada sel normal, p53 wild-type bertindak sebagai transcriptional activator dari gen penyandi Mdm2. Pada gilirannya, Mdm2 memiliki kemampuan berinteraksi secara fisik dengan p53 dan berperan sebagai ubiquitin E3 ligase yang memicu konjugasi ubiquitin dengan p53. Ubiquitin ini menandai target p53 untuk degradasi oleh proteosom. Selain ubiquitinasi dari p53, Mdm2 juga dapat mengkatalisis ubiquitinasi dirinya sendiri dalam suatu proses disebut sebagai autoubiquitinasi dan akibatnya, maka protein Mdm2 sendiri 41 juga memiliki waktu paruh yang sangat pendek. Mdm2 juga menghambat aktivitas transkripsional dari molekul p53. Dengan demikian, dalam kondisi sel normal tanpa stress protein p53 tetap dijaga pada level rendah, dalam status inaktif, oleh Mdm2 sehingga sel dapat berproliferasi (Kruse & Gu, 2009). Sebagai respon terhadap aktivasi p53 oleh berbagai jenis sinyal stress, maka secara spesifik p53 akan berikatan dengan sekuen DNA pada genom yang responsif terhadapnya. Sudah jelas diketahui bahwa sinyal stress yang berbeda sebagai suatu input akan menghasilkan transkripsi terhadap gen yang berbeda di bawah kontrol dari p53. Selain itu, sinyal stress yang diterima oleh sel atau jaringan yang berbeda juga menghasilkan program transkripsi yang berbeda melalui kontrol protein p53. Protein p53 berperan sebagai faktor transkripsi dari gen-gen yang diregulasi oleh p53. Hal ini berujung pada tiga downstream events yang utama; cell cycle arrest, senescence atau apoptosis. Gen-gen lainnya yang diregulasi oleh p53 melakukan komunikasi dengan selsel yang berdekatan, memperbaiki kerusakan DNA atau menyusun lengkung umpan balik positif dan negatif yang dapat meriingkatkan serta memperkuat fungsi protein p53 dan mengintegrasikan respon terhadap stress tersebut dengan jalur transduksi sinyal lainnya (Levine, et al., 2006; Harris & Levine, 2005). 2.3 Derajat diferensiasi Derajat diferensiasi merupakan hasil penilaian mikroskopis sel kanker yang berfungsi untuk menentukan fitur morfologis, keagresifan atau sifat biologis dari sel kankernya (Huston, 2006). Grading histologi dari karsinoma ovarium memiliki relevansi prognostik dan terapiutik (Silverberg, 2000). Selama ini telah diterapkan berbagai sistem grading untuk menilai derajat diferensiasi kanker ovarium akan tetapi tidak ada keseragaman dalam hal sistem yang digunakan untuk menilai derajat diferensiasi 42 karsinoma ovarium. Berbagai sistem grading yang berbeda telah digunakan dengan hasil yang bervariasi pula, termasuk sistem International Federation of Gynecology and Obstetric (FIGO) berdasarkan persentase arsitektur padat, sistem World Health Organization (WHO) berdasarkan kesan arsitektur dan fitur sitologi, sistem Gynecologic Oncology Group (GOG) berdasarkan tipe histologi, sistem yang berdasarkan kombinasi dari indeks mitosis dan persentase volume epitelial, sistem yang berdasarkan adanya/jumlah inti hiperkromatik raksasa dan arsitektur padat atau kribiformis, serta suatu indeks grading yang berdasarkan rata-rata dari skor individual untuk pola arsitektural, pleomorfisme inti, nukleoli, rasio inti-sitoplasma, indeks mitosis, pola invasi, penetrasi kapsul dan invasi vaskuler. Hingga akhirnya suatu sistem baru diajukan oleh Shimizu dan Silverberg (1998) yang merupakan sistem grading yang universal serta dapat diterapkan pada semua subtipe histologi dari karsinoma ovarium (Vang et al., 2009). Pada sistem ini nilai ditetapkan dari masing-masing 3 parameter berikut: pola arsitektur (glandular, papiler, atau solid), derajat atipia inti dan indeks mitosis (Tabel 2.3). Nilai dari masing-masing parameter tersebut kemudian dijumlahkan, menghasilkan skor total yang menentukan grading, hampir sama dengan sistem grading Nottingham yang digunakan pada kanker payudara (Tavasolli, et al., 2003; Vang, et al., 2009). Sistem grading universal ini membagi derajat diferensiasi karsinoma ovarium menjadi tiga kelompok, skor 3-5: Grade 1 (derajat diferensiasi baik); skor 6-7: Grade 2 (derajat diferensiasi sedang); skor 8-9: Grade 3 (derajat diferensiasi buruk) (Gambar 2.7). 43 Tabel 2.3 Sistem Grading Shimizu-Silverberg Kanker Ovarium Skor Pola arsitektur dominan Atipia sitologi Mitosis per 10 HPF 1 Glandular Ringan 0-9 2 Papiler Sedang 10-24 3 Solid Berat >25 Sumber: Malpica, 2004 Gambar 2.7 Sistem Grading Shimizu-Silverberg: Grade 1, 2 dan 3 (Kommoss, et al., 2009) Pola arsitektur ditentukan berdasarkan proporsi dominan glandular, papiler, dan bentuk solid (Gambar 2.8). Atipia sitologi dievaluasi pada area tumor yang paling atipik. Atipia ringan jika sel dengan inti vesikuler relatif uniform, tanpa adanya penggumpalan kromatin atau anak inti yang prominen. Atipia sedang jika variasi bentuk dan ukuran inti sedang, anak inti dapat diamati tetapi kecil, kromatin inti menggumpal, dan tidak ada sel bizarre. Atipia berat jika bentuk dan ukuran inti sangat bervariasi, kromatin inti sangat menggumpal, membrane inti tebal, anak inti prorninen eosinofilik, dan dapat dijumpai adanya sel bizarre (Gambar 2.9) 44 Gambar 2.8 Derajat arsitekural: glanduler, papiler dan solid (Kommoss, et al., 2009) Gambar 2.9 Derajat atipia inti: ringan, sedang dan berat (Kommoss, et al., 2009) Jumlah mitosis pada dasarnya merupakan variabel histologi yang independen tetapi pada umumnya juga akan meningkat sejalan dengan bertambahnya derajat atipia inti, sebagai suatu mitotic figures (MF) yang abnormal. Jumlah mitosis di hitung pada area yang paling aktif. Aktifitas mitosis paling baik dinilai pada bagian perifer tumor karena pertumbuhannya cenderung lebih aktif, akan tetapi pada banyak kasus bagian perifer tidak teridentifikasi. Penghitungan hanya untuk 45 inti sel dengan fitur morfologi yang terbatas pada metafase, anafase, atau telofase. Inti sel hiperkromatik dan mengalami apoptosis dieksklusi. Dinilai sedikitnya 30 lapangan pandang dan dihitung jumlah terbanyak dari mitotic figures (MF) per 10-high power microscopic fields (MF/10 HPF) menggunakan 10x wide field eyepiece 40x objective dengan diameter lapangan pandang dan luas berturut-turut 0,663 mm dan 0,345 mm2. Sistem grading Shimizu-Silverberg berkorelasi kuat dengan prognosis dari semua tipe histologi karsinoma ovarium dan lebih superior dibandingkan dengan sistem FIGO dalam hal prediksi malignansi seperti potensi metastase dan invasi pada kelenjar limfe (Ishioka et al., 2003). Sistem ini sangat sederhana, dapat dipakai berulang kali, menyediakan informasi prognostik yang sangat berguna. Menggunakan sistem ini diperoleh 5-year surveilance rate grade I (91%), grade II (64%), grade III (38%) (Sato, 2003). Tipe histologi terbanyak pada populasi penelitian adalah tipe serus (40,6%) dengan prevalensi karsinoma ovarium tipe serus derajat diferensiasi baik, sedang dan buruk di populasi berturut-turut adalah 13,8 %, 42,4% dan 43,8% (Sriwidnyani, 2008). BAB III KERANGKA BERPIKIR, KONSEP DAN HIPOTESIS PENELITIAN 3.1 Kerangka Berpikir Secara umum kerusakan genetik merupakan mekanisme dasar dari proses karsinogenesis dan merupakan sebuah proses bertahap pada tingkat genetik serta fenotip sebagai hasil dari akumulasi mutasi yang terjadi berulangkali. Target utama kerusakan genetik ini adalah empat kelompok gen utama, yaitu 1) protoonkogen yang meningkatkan proliferasi dan diferensiasi sel, 2) mutasi pada tumor suppressor gen yang berfungsi menghambat pertumbuhan, 3 ) gen pengatur apoptosis, 4) gen yang terlibat dalam DNA repair. Beberapa abnormalitas gen serta ekspresi proteinnya telah diketahui terlibat dalam karsinogenesis kanker ovarium. Pertama adalah onkogen, lebih dari 60 onkogen telah diidentifikasi dan beberapa termasuk gen Her2/neu, RAS, MYC, dan ERB2, CDK1 telah diteliti pada kanker ovarium. Onkogen merupakan suatu kelainan gen yang terjadi melalui beberapa mekanisme seperti point mutation, amplifikasi, overekspresi dan translokasi yang mengakibatkan terjadinya peningkatan aktivasi pertumbuhan dan atau pembelahan seluler, sehingga akan mengarah pada pertumbuhan sel yang tidak terkendali. Berikutnya adalah inaktifasi tumor suppressor gen. Gen-gen yang termasuk dalam kelompok ini adalah BRCA1, BRCA2, dan p53. Adanya inaktivasi pada BRCA1 dan BRCA2 mengakibatkan terjadinya gangguan DNA repair. Sedangkan inaktivasi pada p53, misalnya pada sel yang mengalami mutasi atau kehilangan gen p53, maka ekspresi protein p53 tidak terjadi atau ekspresi protein p53 terjadi namun tidak dapat bekerja sebagai pengaktivasi proses transkripsi pada beberapa gen target seperti inhibitor kinase 47 dipendent-cyclin CDKN1A gene (p21) dan GADD45. Akibat tidak teraktifasinya protein p21, maka siklus sel tidak dapat berhenti pada akhir fase Gl dan tidak teraktivasinya GADD45, maka perbaikan DNA pun tidak dapat terjadi. Ditambah lagi, adanya efek proapoptosis yang diperankan oleh p53 diperantarai melalui peningkatan sintesis BAX, sehingga pada sel yang mengalami mutasi atau kehilangan gen p53, tidak adanya aktivasi pada gen apoptosis BAX yang mengakibatkan sel tidak mengalami apoptosis. Adanya onkogen dan inaktivasi gen supresor tumor selanjutnya akan mengakibatkan proliferasi sel menjadi tidak terkontol. Ke tiga, perubahan pada gen pengatur apoptosis, terutama diperankan oleh BAX dan BCL2. Perubahan fungsi inhibisi apoptosis gen BCL2, justru akan meningkatkan ekspresi gen atau overekspresi gen tersebut, mengakibatkan sel semakin tidak mengalami apoptosis. Pada akhirnya, proliferasi sel yang tidak terkendali dan tidak terjadinya apoptosis berdampak pada terfiksasinya mutasi pada sel yang membelah, khususnya DNA sehingga sel akan masuk menuju proses menuju transformasi ganas yaitu kanker ovarium. Derajat diferensiasi merupakan hasil penilaian mikroskopis untuk menentukan keagresifan atau sifat biologis dari sel kanker, sejalan dengan peran mutasi gen p53 dalam proses malignansi kanker ovarium, mempercepat pertumbuhan tumor, dan selanjutnya akan mempengaruhi derajat diferensiasi sel kanker tersebut. 48 3.2 Konsep Penelitian Secara skematis konsep penelitian diperlihatkan pada gambar 3.1 p53 Derajat Diferensiasi Derajat Diferensiasi Derajat Diferensiasi Baik Sedang Buruk Gambar 3.1 Konsep Penelitian 3.3 Hipotesis Penelitian Adapun hipotesis pada penelitian ini adalah sebagai berikut: Ada hubungan positif antara ekspresi protein p53 dengan derajat diferensiasi sel pada kanker ovarium epitelial. 49 BAB IV METODE PENELITIAN 4.1 Rancangan Penelitian Adapun rancangan pada penelitian ini adalah observasional analitik (crosssectional). Secara sistematik rancangan penelitian dapat digambarkan sebagai berikut: Kanker ovarium epitelial Derajat diferensiasi baik Derajat diferensiasi sedang Derajat diferensiasi buruk Ekspresi p53 (+)/(-) Ekspresi p53 (+)/(-) Ekspresi p53 (+)/(-) Gambar 4.1 Rancangan Penelitian 4.2. Tempat Dan Waktu Penelitian Penelitian ini dilaksanakan di Bagian Kebidanan dan Penyakit Kandungan, Bagian Patologi Anatomi dan Rekam Medis Rumah Sakit Umum Pusat (RSUP) Sanglah, Denpasar. Waktu penelitian dilaksanakan mulai Maret 2011 sampai Juli 2013. 50 4.3 Populasi Penelitian Adapun populasi target penelitian adalah semua pasien dengan kanker ovarium. Populasi terjangkau penelitian adalah semua pasien kanker ovarium yang telah menjalani laparotomi di RSUP Sanglah dari tahun 2011 sampai 2013, dimana jaringan tumornya telah dibuat blok parafin di Bagian Patologi Anatomi RSUP Sanglah. 4.4 Sampel Penelitian Sampel penelitian ini adalah semua pasien kanker ovarium epitelial yang telah menjalani laparotomi di RSUP Sanglah dari tahun 2011 sampai 2013, dimana jaringan tumornya telah dibuat blok parafin di Bagian Patologi Anatomi RSUP Sanglah serta memenuhi kriteria inklusi dan eksklusi. 4.4.1 Kriteria inklusi Adapun kriteria inklusi penelitian adalah sebagai berikut. a. Pasien yang terdiagnosis kanker ovarium epitelial dengan kualitas blok parafin baik (tidak rusak) dan dapat dilakukan pemeriksaan imunohistokimia p53. b. Data rekam medis terdapat hasil pemeriksaan histopatologi derajat diferensiasi sel kanker ovarium. 4.4.2 Kriteria eksklusi Adapun kriteria eksklusi penelitian adalah sebagai berikut. a. Pasien pernah menjalani kemoterapi atau radiasi sebelum pembedahan (neoadjuvan). b. Kasus dengan diagnosis histopatologik yang belum pasti (masih ada diagnosis banding). 51 4.4.3 Perhitungan besar sampel Besar sampel pada penelitian ini dihitung dengan menggunakan rumus sebagai berikut (Araoye, 2003): ……....................................................................................(1) N= Keterangan: N = besar sampel Zα = 1,96 (α = 0,05) P = 13,8% (prevalensi derajat diferensiasi sedang di populasi kanker ovarium) Q = 86,2% (1-p) D = 10% (penyimpangan absolut penelitian) Berdasarkan hasil perhitungan dengan menggunakan rumus di atas, diperoleh besar sampel penelitian adalah 43,8. Sehingga dalam penelitian ini diambil sampel penelitian sebanyak 44. 4.4.4 Cara pengambilan sampel Blok parafin dari semua pasien kanker ovarium epitelial yang telah menjalani laparotomi di RSUP Sanglah dari tahun 2011 sampai 2013 serta telah memenuhi kriteria 52 inklusi dan eksklusi, kemudian dipilih dengan cara random sampling sebanyak 44 sampel. 4.5 Variabel Penelitian 4.5.1 Identifikasi variabel Identifikasi variabel adalah sebagai berikut: 1. Variabel bebas : ekspresi p53 2. Variabel tergantung : derajat diferensiasi sel kanker ovarium 4.5.2 Definisi operasional variabel Adapun definisi operasional variable penelitian adalah sebagai berikut: 1. Ekspresi p53 adalah perhitungan semi-kuantitatif dari protein p53 yang diperiksa dengan teknik imunohistokimia metode peroksidase antiperoksidase memakai antibodi primer p53 dalam suatu lapangan pandang mikroskopis. Penilaian ekspresi p53 dibuat berdasarkan analisis persentase sel tumor yang positif dan intensitas pewarnaan. Ekspresi p53 diberi skor 0,+l, +2, +3 (Tabel 4.1). Skor 0 dan +1 dikatagorikan sebagai ekpresi p53 negatif, skor +2 dan +3 disebut positif (Yamashita, 2004). 2. Derajat diferensiasi sel kanker ovarium adalah tingkat diferensiasi sel tumor yang dinilai menurut Shimizu-Silverberg grading system. Sistem ini membagi derajat diferensiasi tumor menjadi tiga berdasarkan pola arsitektur yang dominan, derajat atipia inti, dan indeks mitosis (Tabel 2.3) (Malpica, 2004). Skor total: 3-5 = derajat diferensiasi baik; 6-7 = derajat diferensiasi sedang; 8-9 = derajat diferensiasi buruk. Atipia sitologi 53 dievaluasi pada area tumor yang paling atipik. Atipia ringan jika sel dengan inti vesikuler relative uniform, tanpa adanya penggumpalan kromatin atau anak inti yang prominen. Atipia sedang jika variasi bentuk dan ukuran inti sedang, anak inti dapat diamati tetapi kecil, kromatin inti menggumpal, dan tidak ada sel bizarre. Atipia berat jika bentuk dan ukuran inti sangat bervariasi, kromatin inti sangat menggumpal, membrane inti tebal, anak inti prominen eosinofilik, dan dapat dijumpai adanya sel bizarre. Jumlah mitosis dihitung pada area yang paling aktif. 4.6 Alur Penelitian Blok parafin yang telah diperiksa secara histopatologis di Bagian Patologi Anatomi dan terdiagnosis pasti kanker ovarium tipe epitelial serta memenuhi kriteria inklusi dan eksklusi penelitian dikumpulkan. Pada kriteria inklusi, blok parafin telah diperiksa secara histopatologis, sehingga telah terdiagnosis pasti kanker ovarium di Bagian Patologi Anatomi RSUP Sanglah. Selanjutnya blok parafin tersebut didata kelengkapan rekam medisnya di Bagian Rekam Medis RSUP Sanglah. Kelengkapan yang dicari adalah hasil pemeriksaan histopatologi yaitu derajat diferensiasi sel kanker ovarium. Sedangkan pada kriteria eksklusi, antara lain: pasien pernah menjalani kemoterapi atau radiasi sebelum pembedahan (neoadjuvan), blok parafin rusak sehingga tidak dapat digunakan atau dianalisis dan data rekam medis pasien kanker ovarium tidak ditemukan atau tidak lengkap. Blok parafin dari semua pasien kanker ovarium yang telah menjalani laparotomi di RSUP Sanglah dari tahun 2011 sampai 2013 dan telah memenuhi kriteria inklusi dan eksklusi, kemudian dipilih dengan cara random sampling sebanyak 44 sampel. Sampel blok parafin ini dikelompokkan berdasarkan atas derajat diferensiasi kanker ovarium yang diperoleh dari data rekam medis, yaitu: derajat diferensiasi baik, sedang dan buruk. 54 Kemudian masing-masing kelompok derajat diferensiasi dilakukan pemeriksaan ekspresi p53 dengan teknik imunohistokimia peroksidase anti-peroksidase memakai antibodi primer p53. Akhirnya, dilakukan analisis terhadap hasil pemeriksaan ekspresi p53 pada masing-masing kelompok derajat diferensiasi sel kanker ovarium. Secara sistematis alur penelitian ditunjukkan pada gambar 4.2. Blok parafin pasien kanker ovarium epitelial Kriteria inklusi Kriteria eksklusi Sampel penelitian Random sampling Pemeriksaan Derajat diferensiasi sel kanker ovarium Analisis Gambar 4.2 Alur Penelitian Ekspresi p53 55 4.7 Instrumen Penelitian dan Metode Pemeriksaan 4.7.1 Instrumen penelitian Instrumen untuk penelitian yaitu meja tulis, formulir penelitian, komputer, kertas serta perlengkapan lainnya. 4.7.2 Metode pemeriksaan Teknik pemeriksaan yang digunakan pada penelitian ini adalah dengan menggunakan pemeriksaan imunohistokimia (IHC). Langkah-langkah pemeriksaan Imunohistokimia p53 (CCRC, 2009): a. Potong jaringan 4 mikrometer, kemudian ditempelkan pada gelas objek yang sebelumnya telah dilapisi poly-L-lysine. b. Inkubasi dalam oven dengan suhu 37°C selama satu malam. c. Lakukan deparafinisasi dengan xylene sebanyak tiga kali, masing-masing tiga menit. d. Rehidrasi preparat dengan menggunakan etanol 100%, etanol 95% dan etanol 70%, masing-masing selama dua menit, dua menit, satu menit dan terakhir dengan air selama satu menit. e. Rendam dalam peroxidase blocking solution pada suhu kamar selama sepuluh menit. f. Inkubasi preparat dalam prediluted blocking serum 25°C selama sepuluh menit. g. Rendam preparat di dalam antibodi monoclonal anti-p53 25°C selama sepuluh menit. 56 h. Cuci preparat dengan Phospate Buffer Saline (PBS) selama lima menit. i. Inkubasi preparat dengan antibodi sekunder (conjugated to horse radisperoxidase) 25°C selama sepuluh menit, j. Cuci preparat dengan PBS selama lima menit, k. Inkubasi preparat dengan peroksidase 25°C selama sepuluh menit. l. Cuci preparat dengan PBS selama lima menit. m. Inkubasi preparat dengan kromogen Diaminobenzinidine (DAB) 25°C selama sepuluh menit. n. Inkubasi preparat dengan Hematoxylin Eosin selama tiga menit, o. Cuci preparat dengan air mengalir. p. Bersihkan preparat dan tetesi dengan mounting media. q. Tutup preparat dengan coverslip. Kemudian setelah dilakukan pengecatan imunohistokimia p53 atau dipulas dengan antibodi monoklonal p53, selanjutnya sediaan dilakukan interpretasi sebagai berikut: a. Interpretasi p53 dilakukan tanpa mengetahui data klinis dan patologik dari setiap kasus. b. Perhitungan ekspresi p53 dilakukan secara semikuantitatif. Pertama, dilakukan penghitungan presentase sel ganas yang tercatat positif diantara 200 sel ganas, menggunakan mikroskop cahaya binokuler merk Olympus dengan pembesaran 400 kali. c. Pewarnaan yang dinyatakan positif hanya membran sel yang berwarna coklat. Intensitas pewarnaan dievaluasi secara objektif yaitu lemah, sedang, dan kuat. 57 d. Skor diperoleh berdasarkan kombinasi antara persentase sel yang terpulas dan intensitas pewarnaannya, dengan rentang skor 0, 1+, 2+, 3+ (Tabel 4.1). Tabel 4.1 Interpretasi Pulasan Imunohistokimia p53 Pola Pulasan Skor Tidak ada sel terpulas atau terpulas kurang 10% 0 Terpulas lebih dari 10% sel, intensitas pulasan lemah, membran sel 1+ terpulas hanya sebagian. Terpulas lebih dari 10% sel, intensitas pulasan lemah sampai sedang, 2+ membran sel terpulas komplit. Terpulas lebih dari 10% sel, intensitas kuat dan komplit 3+ Sumber: Rosai, 2004 4.8 Pengumpulan dan Analisis Data 4.8.1 Pengumpulan data Data yang diperoleh dari Bagian Obstetri dan Ginekologi, Bagian Patologi Anatomi, dan Rekam Medis RSUP Sanglah dikumpulkan dan dimasukkan ke dalam formulir penelitian (terlampir). 4.8.2 Analisis data Data pada formulir penelitian kanker ovarium diolah dengan menggunakan SPSS 17.0 for windows. Kemudian dilakukan beberapa tes atau uji, antara lain adalah sebagai berikut: 1. Karakteristik sampel disajikan secara deskriptif dengan menggunakan tabel. 58 2. Uji One sample KS untuk mengetahui normalitas data, Levene’s test untuk mengetahui homogenitas data dan uji One Way Anova untuk membandingkan nilai rerata masing-masing variabel digunakan. 3. Uji Korelasi dengan menggunakan Uji Spearman digunakan untuk mencari koefisien korelasi antar variabel penelitian. 59 BAB V HASIL PENELITIAN Selama periode penelitian, sebanyak 44 blok parafin dijadikan sampel penelitian yang dilaksanakan di Bagian Obstetri dan Ginekologi, Patologi Anatomi dan Rekam Medis RSUP Sanglah. 5.1 Karakteristik Sampel Penelitian Pada penilitan ini dilakukan uji normalitas data dengan uji Kolmogorov-Smirnov dan uji homogenitas data dengan Levene’s test terhadap variabel umur, Indek Massa Tubuh (IMT), dan paritas. Hasil analisis menunjukkan bahwa data pada variabel umur, IMT dan paritas berdistribusi normal (p>0,05) dan homogen (p>0,05), sedangkan untuk membandingkan nilai rerata masing-masing variabel digunakan uji One Way Anova. Tabel 5.1 Distribusi Umur, IMT, dan Paritas pada Kelompok Derajat Diferensiasi Sel Kanker Ovarium Epitelial Derajat Diferensiasi Sel Kanker Ovarium Epitelial Variabel Umur (tahun) IMT (kg/m2) Paritas Baik (n=13) rerata±2SD Sedang (n=14) rerata±2SD Buruk (n=17) rerata±2SD p 50,00±9,89 41,29±13,14 47,76± 8,14 0,087 23,36±5,60 22,65±4,95 20,68±2,35 0,227 1,92±1,11 1,79 ±0,97 1,88±1,26 0,949 60 Tabel 5.1 menunjukkan bahwa antar kelompok derajat diferensiasi sel kanker ovarium epitelial tidak memiliki perbedaaan pada variabel umur, IMT dan paritas, dengan nilai p>0,05. 5.2 Hubungan antara Ekspresi p53 dengan Derajat Diferensiasi Sel pada Kanker Ovarium Epitelial Penilaian terhadap hubungan antara ekspresi p53 dengan derajat diferensiasi sel pada kanker ovarium epitelial dengan melakukan analisis menggunakan uji korelasi Spearman. Hasil analisis tersebut disajikan pada Tabel 5.2. Tabel 5.2 Uji Korelasi Ekspresi p53 dengan Derajat Diferensiasi Sel pada Kanker Ovarium Epitelial Derajat diferensiasi Variabel (+) Buruk (n=17) Sedang (n=14) Baik (n=13) 6 1 1 Ekspresi p53 (-) 11 13 r p 0,313 0,038 12 Tabel 5.2 menunjukkan adanya hubungan yang bermakna antara ekspresi p53 dengan derajat diferensiasi sel pada kanker ovarium epitelial (p<0,05). 61 BAB VI PEMBAHASAN Penyebab dari kanker ovarium sampai saat ini masih menjadi bahan perdebatan namun terdapat beberapa faktor risiko yang telah banyak diteliti dan diduga menjadi pemicu terjadinya kanker ovarium ini diantaranya adalah faktor genetik, umur, paritas, ras, dan riwayat keluarga dengan kanker payudara dan kanker kolorektal, riwayat pemakaian terapi atau kontrasepsi hormonal, dan obesitas (Granstrom, 2008; Miettinen, 2009; Fauzan, 2009). Berbagai penelitian terhadap peran genetik telah dikembangkan dalam rangka memahami etiologi dan patofisiologi kanker ovarium, baik melalui pemeriksaan secara langsung terhadap mutasi pada gen atau pun tidak langsung melalui abnormalitas ekspresi protein yang dihasilkan oleh gen termutasi. Salah satu gen yang diperkirakan mengambil peranan penting dalam etiopatogenesis terjadinya kanker ovarium adalah p53, gen yang mengkode atau mengekspresikan protein 53 (p53). Untuk mengetahui hubungan ekspresi p53 dengan derajat diferensiasi sel pada kanker ovarium epitelial, maka dilakukan penelitian dengan rancangan cross-sectional, yang dilaksanakan di Bagian Kebidanan dan Penyakit Kandungan, Patologi Anatomi dan Rekam Medis Rumah Sakit Umum Pusat (RSUP) Sanglah Denpasar dari Maret 2011 sampai Juli 2013, dengan jumlah sampel yang digunakan dalam penelitian ini adalah 44 buah blok parafin. 62 6.1 Karakteristik Sampel Penelitian Pada penelitian ini, rentang usia penderita karsinoma ovarium antara 30 sampai 67 tahun, dengan rerata umur 46,4 tahun dan kasus terbanyak pada dekade ke-4 (38,6%). Rerata umur pada kelompok kanker ovarium derajat diferensiasi baik adalah 40,86 ± 5,24 tahun, derajat diferensiasi sedang adalah 43,56 ± 12,70 tahun dan derajat diferensiasi buruk adalah 45,57 ± 9,77 tahun. Insiden kanker ovarium meningkat seiring dengan bertambahnya usia, dari 15,7 kasus per 100.000 wanita pada umur 40, hingga 54 kasus per 100.000 wanita pada umur 79 tahun. Secara keseluruhan diperkirakan 1 dari 70 wanita akan terkena kanker ovarium sepanjang masa hidupnya. Puncak insiden kanker ovarium epithelial invasif adalah pada umur 56 sampai 60 tahun. Ekspresi p53 sebagian besar ditemukan pada dekade ke-6 kehidupan (30,9%), hal ini mungkin berhubungan dengan akumulasi dari mutasi somatik. Seperti yang diketahui, hilangnya heterozigositas pada kromosom 17 bertambah seiring bertambahnya usia (Abdul, et al., 2012). Rauf mendapatkan sebagian besar penderita kanker ovarium berumur diatas 55 tahun (82,9%) (Rauf & Masadah, 2009). Ekspresi p53 tidak memiliki hubungan yang signifikan dengan umur pasien (Abdul, et al., 2012; Rauf & Masadah, 2009). Hal tersebut sesuai dengan salah satu teori terjadinya kanker ovarium yaitu teori incessant ovulation, dimana setiap ovulasi yang terjadi menimbulkan trauma minor berulang pada epitel permukaan ovarium, mengakibatkan epitel ovarium mudah terpajan atau terpapar oleh berbagai faktor risiko sehingga dapat mengakibatkan terjadinya kelainan atau abnormalitas genetik. Adanya ovulasi dan semakin bertambahnya umur seorang wanita dapat menyebabkan terperangkapnya fragmen epitel permukaan ovarium pada cleft atau invaginasi pada permukaan dan badan inklusi pada kortek ovarium. 63 Beberapa penelitian telah membuktikan bahwa terdapat hubungan antara frekuensi metaplasia dan neoplasma pada daerah-daerah ovarium yang mengalami invaginasi dan terbentuknya badan inklusi (Kurman, 2008). Pada penelitian ini diperoleh rerata Indek Massa Tubuh (IMT) dalam rentang normal. Rerata IMT pada masing-masing kelompok kanker ovarium derajat diferensiasi baik adalah 23,36±5,60 kg/m2, derajat diferensiasi sedang adalah 22,65±4,95 kg/m2, derajat diferensiasi buruk adalah 20,68±2,35 kg/m2. Beberapa penelitian membuktikan bahwa peningkatan IMT dapat meningkatkan risiko terjadinya kanker ovarium. Obesitas berhubungan dengan peningkatan risiko kanker ovarium melalui mekanisme hormonal, dibandingkan dengan wanita dengan berat badan yang normal (IMT 18,5-24,9 kg/m2), risiko relatif kanker ovarium pada wanita obese (IMT ≥30 kg/m2) adalah 1,26 (Leitzmann, 2008). Penelitian yang dilakukan oleh European Prospective Investigation into Cancer and Nutrition tahun 2006 memperoleh hasil bahwa pada wanita dengan IMT di atas 30 atau obesitas memiliki risiko relatif sebesar 1,59 untuk terjadinya kanker ovarium dibandingan dengan wanita dengan IMT normal (Lahmann, 2009). Penelitian yang berbeda memperoleh hasil bahwa peningkatan IMT pada wanita premenopause meningkatkan risiko terjadinya kanker ovarium dengan risiko relatif sebesar 1,72 (Schouten, 2008). Pada penelitian ini diperoleh rerata paritas adalah dua. Rerata paritas pada kelompok kanker ovarium derajat diferensiasi baik adalah 1,92±1,11, derajat diferensiasi sedang adalah 1,79 ±0,97, derajat diferensiasi buruk adalah 1,88±1,26. Nuliparitas berhubungan dengan periode yang lama dari ovulasi yang repetitif, dan wanita yang tidak memiliki anak mengalami risiko dua kali lipat menderita kanker ovarium. Kanker ovarium telah dihubungkan dengan paritas yang rendah dan infertilitas. Oleh karena paritas berhubungan terbalik dengan risiko menderita kanker ovarium, memiliki sedikitnya satu 64 orang anak akan memberikan efek proteksi, dengan penurunan risiko sebanyak 0,3 hingga 0,4. Pada wanita yang tidak memiliki anak atau nullipara memiliki risiko dua kali lipat lebih besar untuk terjadinya kanker ovarium daripada wanita dengan paritas tiga atau lebih. Paritas dalam hubugannya dengan kanker ovarium telah membawa pada suatu hipotesis bahwa supresi ovulasi mungkin sebagai suatu faktor yang penting (Granstrom, 2008). 6.2 Ekspresi p53 P53 memiliki peran yang krusial dalam mengontrol siklus sel, apoptosis dan memelihara stabilitas genom. Hilangnya fungsi p53 akibat dari mutasi dapat menimbulkan transformasi keganasan, penyebaran tumor dan resistensi tumor terhadap terapi yang menginduksi kerukasan DNA. Mutasi dari p53 akan menghasilkan protein yang abnormal dengan waktu paruh yang sangat memanjang, menyebabkan akumulasi dari produk ini, yang ekspresinya dapat terdeteksi secara imunohistokimia (Choudhury, et al., 2012). Pada penelitian ini telah dilakukan pemeriksaan imunohistokimia terhadap 44 sampel blok parafin kanker ovarium. Sebanyak 8 dari 44 (18,18%) sampel blok parafin didapatkan ekspresi p53 yang positif, di mana masing-masing 6 sampel dengan derajat diferensiasi buruk, 1 sampel dengan derajat diferensiasi sedang, dan 1 sampel dengan derajat diferensiasi baik. Studi lain yang serupa menunjukkan angka ekspresi p53 yang bervariasi (25,6-61%). Alasan terjadinya variasi ini belum diketahui, namun kemungkinan variasi tersebut terjadi karena perbedaan antibodi yang digunakan, metode skoring imunoreaktivitas p53 yang digunakan, enzyme dan penanganan jaringan selama proses pengecatan, prosedur fiksasi jaringan (Abdul, et al., 2012). Standarisasi terhadap 65 metode yang digunakan untuk penyimpanan jaringan tumor (blok parafin) dan prosedur analisis imunohistokimia juga merupakan faktor yang berpengaruh (Graef, et al., 2006). Adapun perbedaan ekspresi p53 pada penelitian ini dengan beberapa penelitian yang lain dapat disebabkan oleh karena adanya ketidakseragaman pada fase preanalitik, analitik, dan post analitik. Perbedaan pada fase preanalitik diantaranya adalah perbedaan jaringan yang dipergunakan, dalam hal ini jaringan beku atau jaringan yang telah dilakukan blok parafin, fiksasi jaringan yang dipergunakan, dan antibodi primer yang dipergunakan. Perbedaan kriteria interpretasi yang dipergunakan pun juga mempengaruhi hasil penelitian. Sehingga diperlukan suatu protokol atau panduan standar untuk melakukan pengecatan imunohistokimia p53 mulai dari jaringan tersebut dikeluarkan dari tubuh penderita sampai menjadi suatu sediaan yang siap untuk dilakukan interpretasi serta diperlukan juga adanya keseragaman teknik interpretasi terhadap pasien kanker pengecatan imunohistokimia p53 tersebut. Penelitian yang dilakukan 41 ovarium untuk mengidentifikasi nilai prognostik ekspresi p53 terhadap kanker ovarium, didapatkan 58,5% sampel mengalami ekspresi p53 positif dimana hasil positif terbanyak ditemukan pada kanker ovarium derajat diferensiasi buruk, kemudian diikuti dengan derajat diferensiasi sedang, dan baik (Rauf & Masadah, 2009). Penelitian lain menunjukkan ekspresi p53 yang bervariasi, antara lain sebesar 44% (Havrilesky, et al., 2003), 52,1% (Graef, et al., 2006), 28,3% (Shao, et al., 2007), 48,1% (Abdul, et al., 2010). Ekspresi p53 sebagian besar terjadi pada karsinoma ovarium, studi lainnya juga mendapatkan tumor epitelial, terutama serus kistadenokarsinoma ovarium menunjukkan ekspresi p53 yang tinggi dibandingkan tumor jinak dan borderline. Di sisi lain, ekspresi p53 pada tumor yang berasal dari germ cells atau sexcord-stromal cells tampak sangat 66 rendah. Mutasi p53 terjadi secara spontan akibat cedera berulang pada permukaan ovarium yang disebabkan oleh ovulasi. Repair yang berulang ini membutuhkan laju yang tinggi dari sintesis DNA dengan meningkatnya kecenderungan mutasi terutama pada epitel permukaan ovarium yang mana karsinoma ovarium epitelial berasal (Abdul, et al., 2012). Ekspresi p53 tidak berhubungan signifikan dengan tipe histologi tumor ovarium. Namun review beberapa studi menunjukkan hasil yang saling bertentangan, ada yang tidak menunjukkan hubungan yang signifikan namun lainnya mendapatkan adanya hubungan yang signifikan (Abdul, et al., 2012). Ekpresi p53 yang meningkat berhubungan dengan tumor tipe serus dibandingkan tipe non serus (p=0,040)(Graef, et al., 2006). Karsinoma tipe serus dan clear cell lebih sering ditemukan dengan derajat diferensiasi yang buruk dan pada stadium lanjut, sedangkan pada tipe musinus dan endometrioid lebih sering ditemukan dengan derajat diferensiasi baik dan pada stadium awal (Tavasolli, 2003). Karsinoma ovarium tipe serus dan clear cell lebih banyak menunjukkan derajat diferensiasi tumor yang jelek (53,8% dan 50%) sedangkan sebaliknya pada tipe musinus dan endometrioid lebih banyak menunjukkan diferensiasi tumor yang baik (57,1% dan 50%) (Sri Widnyani, 2008). Overekspresi p53 sebagian besar berhubungan dengan missense mutations dari gen p53. Pewarnaan positif tanpa adanya mutasi p53 bisa terjadi jika adanya aktivasi wildtype p53 oleh respon stress onkogenik atau interaksi dengan onkoprotein virus. Pewarnaan false negative dapat terjadi pada keadaan delesi homozygous gen p53 atau null mutations. Sepanjang perjalanan sel kanker, p53 dapat mengalami perubahan oleh mutasi, loss, atau silencing gen p53 oleh mekanisme transkripsional atau posttranskripsional. Sejauh ini, missense mutation p53 sangat sering terjadi pada sel kanker. Nonsense mutations, insertions, dan deletions pada p53 juga ditemukan. Suatu 67 missense mutation menyebabkan perubahan pada satu asam amino dan tipe point mutation ini pada DNA-binding domain dari p53 (exons 5 hingga 8) dapat mengkode protein yang transcriptionaly inactive atau menunjukkan aktivitas transkripsional yang menyimpang dibandingkan dengan p53 normal atau wild-type. Walaupun sel-sel normal juga umumnya memiliki level protein 53 yang rendah sebagai hasil dari waktu paruh yang pendek dari protein wild-type, missense mutation dari p53 sering mengkode produk protein yang resisten terhadap degradasi, dan hasilnya, protein p53 mutan terakumulasi di dalam nukleus. Bentuk truncated dari p53 dihasilkan dari insersi, nonsensense mutation yang menghasilkan stop kodon, atau suatu delesi gen p53, dan truncated mutation ini mengkode protein dengan aktivitas fungsional yang sangat berbeda atau tanpa aktivitas jika dibandingkan dengan wild-type p53. Tidak seperti missense mutation pada p53, truncated mutation umumnya tidak meningkatkan stabilitas protein p53. Protein p53 mutan yang mengalami kelainan pada beberapa atau semua fungsi p53 dapat terikat dengan wild-type p53 inaktif yang terdapat dalam sel. Aktivitas negatif yang dominan ini dapat merubah peringai dan kelangsungan hidup sel tumor dan diduga dapat menimbulkan progresi dari berbagai tipe kanker. Havrilesky dalam studinya mendapatkan 74% pasien dengan mutasi tunggal, 3% dengan dua mutasi dan 23% mutasi pada exon 2 hingga 11 dari p53. Walaupun sebagian besar mutasi terjadi antara exon 5 sampai 8, mutasi diluar bagian ini terjadi pada 11% pasien. Overekpresi p53 didapatkan pada 100% pasien dengan missense mutation saja, 32% dengan truncation mutation, dan 40% mutasi pada exon 2 sampai 11 (Havrilesky, 2003, Rauf & Masadah, 2009). Telah dipahami bahwa hubungan antara genotipe, fenotipe, dan manifestasi klinis sangat kompleks. Ekspresi gen mengalami banyak tahapan mulai dari DNA hingga menjadi protein. Beberapa peneliti menemukan sel neoplastik yang mengalami mutasi p53 missense, dapat diamati dengan tehnik imunohistokimia oleh karena mutasi ini 68 menghasilkan protein p53 yang stabil dan waktu paruh yang lebih lama. Mereka juga menemukan mutasi p53 frame-shift atau nonsense (chain termination/protein truncated) menghasilkan protein p53 yang tidak stabil dan mudah terdegradasi, dan tidak dapat terdeteksi dengan imunohistokimia. Hal ini mungkin menjadi alasan mengapa beberapa sampel dari penelitian ini tidak menunjukkan ekspresi p53. Hasil ini membutuhkan studi lebih lanjut untuk mengidentifikasi tipe mutasi p53 pada sampel penelitian ini (Rauf & Masadah, 2009). Mutasi p53 dihubungkan dengan beberapa faktor prognosis pada tumor ovarium seperti tipe histologi, grade dan stadium tumor. Banyak penelitian yang menilai korelasi antara ekspresi p53 dengan berbagai faktor prognostik menunjukkan hasil yang tidak konsisten, termasuk korelasi dengan derajat diferensiasi tumor. Pada penelitian ini didapatkan kanker dengan derajat diferensiasi baik sebanyak 13 (29,6%), derajat diferensiasi sedang sebanyak 14 sampel (31,8%), derajat diferensiasi buruk sebanyak 17 (38,6%). Studi lain mendapatkan sebagian besar kanker memiliki derajat diferensiasi baik (68,3%), dan 31,7% dengan derajat diferensiasi buruk (Rauf & Masadah, 2009). Ekspresi p53 pada penelitian ini sebagian besar ditemukan pada kanker dengan derajat diferensiasi buruk (35,3%), 7,1% pada kanker dengan derajat diferensiasi sedang dan 7,6% pada kanker dengan derajat diferensiasi baik. Setelah dilakukan analisis statistik diperoleh adanya hubungan antara ekspresi p53 dengan derajat diferensiasi kanker ovarium dengan nilai p=0,038 (p<0,05). Ekspresi p53 tampak pada sebagian besar dengan tumor dengan diferensiasi buruk (47,6%) (Abdul, et al, 2012). Studi lainnya memperoleh 60% dari tumor dengan diferensiasi buruk menunjukkan ekspresi p53 yang positif, lebih tinggi dibandingkan dengan pada tumor dengan diferensiasi baik (28%), namun perbedaan tersebut tidak signifikan secara statistik yang mungkin disebabkan oleh jumlah sampel yang kecil pada 69 studi ini (Choudhury, et al., 2012). Sebagian besar tumor dengan derajat diferensiasi buruk (92,3%) menunjukkan overekspresi p53, sedangkan sampel tanpa ekspresi p53 sebagian besar dengan derajat diferensiasi baik (57,1%). Terdapat hubungan yang signifikan antara overekspresi p53 dan diferensiasi sel kanker ovarium (p=0,008) (Rauf & Masadah, 2009). Ekspresi p53 meningkat seiring dengan meningkatnya derajat diferensiasi tumor ovarium, ekspresinya yang kuat tampak pada grade 3. Tampaknya, kanker dengan mutasi p53 menampilkan kecenderungan perangai tumor yang lebih agresif seperti metastase jauh dan diferensiasi sel yang buruk (Abdul, et al., 2012). Terdapat hubungan yang signifikan antara ekspresi p53 dengan derajat diferensiasi pada sebagian besar studi lainnya, dimana dilaporkan adanya korelasi yang signifikan seiring derajat diferensiasi yang semakin buruk (Min, et al., 2007; Kupryjanczyk, et al., 2008; Choudhury, et al., 2012). Adanya hubungan yang bermakna pada penelitian ini mendukung dasar teori yang menyatakan bahwa gen p53 berperan penting pada pathogenesis dan progresi dari kanker ovarium. Derajat diferensiasi atau grading pada kanker ovarium dipercaya memiliki nilai prognostik yang signifikan yang pada awalnya hanya ditunjukkan oleh stadium kanker ovarium. Namun, secara umum grading masih kurang reprodusibel dengan nilai statistik kappa antara 0,27 sampai 0,64 (tergantung pada sistem grading yang digunakan). Dengan marker diagnosis yang reprodusibel, harapan di masa mendatang adalah dapat mengidentifikasi fitur-fitur histopatologikal lain atau biomarker yang reprodusibel serta dapat digunakan untuk menentukan prognosis dan prediksi terhadap respon terapiutik (Clarke, 2011). Hasil dari studi ini mungkin dapat diaplikasikan terhadap berbagai situasi klinis pada pasien kanker ovarium. Jika ekspresi protein p53 tinggi pada jaringan pasien kanker ovarium, maka kita dapat memprediksi prognosis yang buruk karena pasien kemungkinan 70 besar resisten terhadap kemoterapi terkait dengan penurunan kemampuan apoptosis. Menentukan prognosis dari pasien kanker ovarium sangat penting untuk meningkatkan kualitas hidup dan memperpanjang usia pasien. Selain itu, model dari penelitian ini juga dapat mengungkap pengetahuan mengenai multistep model pada karsinogenesis dan mungkin dapat berguna dalam epidemiologi molekuler, sehingga diperoleh pemahaman yang lebih baik terhadap faktor-faktor dan mekanisme yang menentukan agresifitas dari kanker ovarium epitelial yang penting untuk mengembangkan cara pengobatan yang baru. 71 BAB VII SIMPULAN DAN SARAN 7.1 Simpulan Adapun simpulan pada penelitian ini adalah ekspresi p53 berhubungan positif dengan derajat diferensiasi sel pada kanker ovarium epitelial. 7.2 Saran Berdasarkan simpulan di atas, terdapat beberapa rekomendasi yang diajukan oleh penulis, antara lain adalah sebagai berikut: 1. Penelitian lebih lanjut terhadap mutasi gen p53 sangat diperlukan, sehingga ekspresi gen 53 dapat diaplikasikan secara klinis sebagai suatu biomarker baru untuk deteksi dini, faktor prognostik, dan untuk menilai efektifitas kemoterapi pada kasus kanker ovarium. 2. Dibuat suatu protokol atau panduan standar untuk pemeriksaan imunohistokimia p53 mulai dari jaringan tersebut dikeluarkan dari tubuh penderita sampai menjadi sediaan yang siap diinterpretasi serta diperlukan juga adanya keseragaman teknik interpretasi derajat diferensiasi tumor dan imunohistokimia p53. 72 6.3 Kelemahan Penelitian Studi ini juga masih memiliki keterbatasan dalam konteks penjelasan dari patogenesis dan prognosis kanker ovarium oleh karena hanya menganalisa satu ekspresi gen yang berperanan dalam karsinogenesis (p53) dan tidak mengidentifikasi tipe mutasi p53. Namun, hasil penelitian ini dapat digunakan sebagai data dasar untuk studi kanker ovarium lebih lanjut. 73 DAFTAR PUSTAKA Abdul, E., Shuaib H. 2012. P53 expression in ovarian tumors: (an immunohistochemical study). Ann.Coll.Med. Mosul; 38 (2):73-79. Anderson, C.W., Appela, W. 2002. Signaling to the p53 Tumor Suppressor through Pathways Activated by Genotoxix and Non-genotoxic Stress. In: Bradshaw, Dennis, E. editors. Handbook of Cell Signaling. New York: Academic Press:126-129. Andrilli, G. Christine Kumar, Giovanni Sambia, Antonio Giordano. 2004. Cell Cycle Genes in Ovarian Cancer: Steps Toward Earlier Diagnosis and Novel Therapies. Clinical Cancer Research, 10:8132-8141. Araoye, M.O. 2003. Sample Size in: Research Methodology with Statistics for Health and Social Sciences, florin. Nathadex Publishers.p.115-112. Bai, L. & Zhu, G. 2006. p53: Structure, Function and Therapeutic Applications, [cited 2010 august.11] available from : URL : http://mupnet.com/20141153.pdf Berek, J.S., Natarajan, S. 2007. Ovarian and Fallopian Tube Cancer, in: Berek & Novak’s Gynecology, 14th. Ed. California: Lippincott William & Wilkins. p.1457-1531. Bourdon, J.C., Laurenzi, V.D., Melino, G., Lane, D. 2003. p53: 25 years of Reaserch and More Question to Answer in : Cell Death and Differentiation, 10th ed. p. 397-399. Cancer Chemoprevennon Research Center (CCRC) : Fakultas Farmasi Universitas Gajah Mada (UGM). 2009. Prosedur Tetap Pengecatan Imunohistokimia p53. [Cited 2010 Okt. 1] Available from: http://ccrc farmasi npm ac id wp-content/uploads/sop-ihc-o53-laras.pdf. Chene P. 2003.Inhibiting the p53-Mdm2 Interaction: An Important Target for Cancer Therapy. In : Nature Reviews Cancer,3rd ed.p.102-109. Choi, J.H., Wong, A.S.T., Huang, H.F., Leung, P.C. 2007. Gonadotropins and Ovarian Cancer. In : Endocrine Reviews, 4th ed.p. 440-461. Choudhury Monisha, Seema Goyal, Mukta Pujani, Meenu Pujani. 2012. A Cytohistological study of p53 overexpression in ovarian neoplasm. South Asian Jounal of Cancer. Vo.1:59-65. 74 Clarke Blaise A., Blke Gilks, MD. 2011. Ovarian Carcinoma: Recent Development in Classification of Tumour Histological Subtype. Canadian Journal of Pathology:33-34. Fauzan, R. 2009. “Gambaran faktor penggunaan kontrasepsi terhadap angka kejadian kanker ovarium di RSUPN Dr. Cipto Mangunkusumo Jakarta berdasarkan pemeriksaan histopatologik tahun 2003-2007” (tesis). Jakarta: Universitas Indonesia. Foulkes, W.D. 2007.p53 Master and Commander. N Engl J Med, 357(25):25392541. Graeff, P.D., Hall. J., Paul, J., Brown, R., Hollema, H. 2006. Factors Influencing p53 Expression in Ovarian Cancaer as a Biomarker of Clinical Outcome in Multicentre Studies. British Journal of Cancer, 95:627-633. Granstrom, C 2008. Population Attributable Fractions for Ovarian Cancer in Swedish Women by Morphological. [cited 2010 oct.10] htto://www.jacfaitilmnih.pov/pmc/articles/PMC23/. Havrilesky, 2003. Significance of p53 Mutation and p53 Overexpression in Advanced Epithelial Ovarian Cancer-A Oncology Group Study. Journal of Clinical Oncology, 21 (20):3814-3825. Huston L.M. 2006. Cell Differentiation and Natural Compounds That Induced Differentiation Induce-Differentiation [cited 2010 Nov.24]. Available from : http://www.physiolcell.org/sch/art/17/. Ishioka, S., Sagae, S., Terasawa, K., Sugimura, M., Nishioka, Y., Tsukada, K., Kudo, R. 2003. Comparison of the Usefulness Between a New Universal Grading System for Epithelial Ovarian Cancer and the FIGO Grading System. Gynecologic Oncology, 89(3).p.447-452. Jemal, A., Rebecca, S., Jiaquan, Elizabeth, W. 2010. Cancer Statistics. CA Cancer J Clin, 60:277-300. Jung, P. 2007. “Analysis of p53 and c-MYC, Two Key Transcription Factors Involved in Tumorigenesis” (dissertaton).Munchen: der LudwigMaximilians University. Karst, A.M, Drapkin, R. 2010. Ovarian cancer Pathogenesis: A Model in Evolution. Journal of Oncology, Vol 2010:1-13. 75 Kumar, V., Robbins, Leonard, S. 2010. Neoplasia in: Robbins &Cotran Pathologic Basis of Disease, 8th ed. Philadelphia: Saunders Elsevier.p. 269342. Kurman, R.J., Shih, I.E. 2010. The Origin and Pathogenesis of Epithelial Ovarian Cancer: A Proposed Unifying Theory. Am J SurgPathol, 198(4):351-356. Kurman, R.J., Shih, I.E. 2008. Pathogenesis of Ovarian Cancer.Lesson from Morphology and Molecular Biology and their Clinical Implications.Int J GynecolPathol, 27(2):151-160. Kommoss, S., Schmidt, D., Hedderich, J., Harter, P., Pfisterer, J., du Bois, A. 2009. Histological Grading in a Large Series of Advanced Stage Ovarian Carcinomas by Three Widely Used Grading Systems Consistent Lack of Prognostic Significance.Virchows Arch, 454:249-256. Kupryjanczyk J, Kraszewska E, Seta Z. 2008. TP53 status and taxane-platinumbased therapy in ovarian cancer patients: a non randomized retrospective study. BMC Cancer.8(27):1471-240. Kruse, JP, Gu, W. 2009. Modes of p53 Regulation. Cell. 137;7.p.609-622. Lahmann, P.H. 2009. Anthropometric Measures and Epithelial Ovarian Cancer Risk in The European Prospective Investigation into Cancer and Nutrition. [cited 2010 Sep. 18]. Available from: URL:http://www.ncbi.nlm.nih. gov/pubmed/19821492. Lane, D., Levine, A. 2010. P53 Research: The Past Thirty Years and the Next Thirty Years., [cited 2010 Nov.5]. Available from: URL: http./cshperspectives.org/cgi/lO.l101/a00Q893. Legge, F., Fenandina, G., Salutari, V., Scambia, G. 2005. Biological Characterization of Ovarian Cancer: Prognostic and Therapeutic Implications. Annals of Oncology;16 (Suppl.4): 95- 101. Levine, AJ., Hu, W., Feng, Z. 2006. The p53 Pathway: What Question Remain to be Explored?.Cell Death and Differentiation. 13: 1027-1036. 76 Leitzmann MF., Corinna K, Kim ND. 2009. Body Mass Index and Risk of Ovarian Cancer, American Cancer Society.; 33-38 Liu, Y., Ganesan, T. 2002. Tumour Suppressor Genes in Sporadic Epithelial Ovarian Cancer. Reproduction, 123: 341-353. Malpica, A., Deavers, M.T., Lu, K., Bodurka, D.C., Atkinson, E.N., Gerherson, D.M., Silva E.G. 2004.Grading Ovarian Serous Carcinoma Using a Two-Tier System. Am J SurgPathol, 28:496- 504. Maximov, G.K., 2008. The Role of p53 Tumor-Supressor Protein in Apoptosis and Carcinogenesis.Biotechnol Review, 22:664-668. Miettinen, S. 2009. “Targetting the Growth of Ovarian Cancer Cell” (dissertation) Finland: University of Tampere. Min KW, Park MH. 2007. The expression of c-erbB-2, EGFR, p53 and Ki-67 in ovarian borderline tumors and carcinomas of the ovary. Korean J Pathol; 41: 296-306 Pearson D.L.C. 2009. Screening for Ovarian Cancer. N Engl J Med, 361:170-177. Rao, G.G., Skinner, E., Gehrig, P., Duska, L., Coleman, R., Schorge, J. 2004. Surgical Staging of Ovarian Low Malignant Potential Tumors. J ObstetGynecol, 104:261-266. Rauf, S., Masadah, H. 2009. The Prognostic Value of the p53 Gene Expression and Mutation in Ovarian Cancer. Med J Indonesia, 18:81-90. Reles, A. 2001. “Molecular Genetic Alterations In Ovarian Cancer The Role of the p53 Tumor Supressor Gene and the mdm2 Oncogen” (dissertation). Berlin: Humboldt University. Rosai J. 2004. Breast. In: Rosai and Ackerman’s Surgical Pathology. 9ed. Edinbrg: Mosby. p. 1763-1876. Sato, Y., Shimamoto, Tomihiro M.D., Amada, Satoshi M.D., Asada, Yujiro M.D., Hayashi, Tohru M.D. 2003. Prognostic value of histologic grading of ovarian carcinomas.Int J GynecolPathol, 22(1): 52-6. Shi, H.R., Zhang, R.T. 2009.Expression and Significance of P53, P21WAF1 and CDK1 Proteins in Epithelial Ovarian Cancer. Ai Zheng, 28(8): 882-885. Schouten, L.J. 2008. Height, Body Mass index, and Ovarian Cancer: a Pooled Analysis of 12 Cohort Studies. (serial online). [cited 2012 July. 11]. Available from: URL: http://info.cancerresearchuk.org/cancerstats/types /ovary/riskfactors/. 77 Schuijer, M., Bems, E. 2003.TP53 and Ovarian Cancer, p53 Review Article. Hum Mutat, 21: 285-291. Sengupta, S., Harris, C. 2005. P53: Traffic Cop at the Crossroads of DNA Repair and Recombination. Moleculer Cell Biology. 6:44-55. Shao HL, Shen DH, Xue WC. 2007. Clinicopathologic analysis and expression of cyclin D1 and p53 of ovarian borderline tumors and carcinomas. Zhonghua Fu Chan Ke Za Zhi; 42(4): 227-232. Silverberg, S.G. 2000. Histopathologic Grading of Ovarian Carcinoma: a Review and Proposal. Int J GynecolPathol, 19(1): 7-15. Soussi T, 2004. Analysis of p53 Gene Alterations in Cancer: a Critical Review. In: Hainaut, P., Wiman, K.G. editors. 25 Years ofp53 Research. Netherlands: Springer, p. 259-288. Sriwidyani, N.P. 2008. “Korelasi Ekspresi HER-2/neudengan Tipe Histologik dan Derajat Diferensiasi Karsinoma Ovarium” (tesis). Denpasar. Universitas Udayana. Syaifudin, M. 2007. Gen Penekan Tumor p53, Kanker danRadiasi Pengion. 1 (3), 119- 128. [cited 2010 August. 20]. Available from:URL:http://www.batan. go.id/ptkmr/Biomedika/MS BalaraVol 83 Apr 07. Pdf. Tavasolli, F.A. &Devilee, P. 2003. Tumours of the Ovary and Peritoeum. Lyon: IARC Press, p. 113-202. Vang, R., Shih, I., Kurman, R.J. 2009.Ovarian Low-grade and High-grade Serous Carcinoma; Pathogenesis, Clinicopathologic and Molecular Biologic Features, and Diagnostic Problems.AdvAnatPathol. 16: 267-282. Vogelstein, B., Lane, D., Levine, A.J. 2000. Surfing the p53 Network. Nature, 408: 307-310. Wheeler, J.E. 2001. Histopathology of Ovarian Cancer in: Rubin, S.C., Sutton, G.P., editors. Ovarian Cancer, 2nd.Ed. Lippincott Williams&Wilkins.p. 201218. Whibly, C., Pharoah, P., Hollstein, M. 2009. P53 polymorphisms: cancer implication. Nature Reviews Cancer, 9: 95-107 78 World Health Organization (WHO), 2008.World Cancer Report.Boyle, P. & Levin, B., editors.International Agency for Research on Cancer (IARC). p. 424-427. Yayasan Kanker Indonesia (YKI), 2006. Kanker di Indonesia Tahun 2006; Data Histopatologik. Jakarta: Badan Registrasi Kanker. Yamashita. 2004. P53 and BCL-2 Scoring.Breast Cancer Res.6: 24-30. 79 Lampiran 3 3.1 Data Sampel Penelitian Derajat No CM Umu r IMT Paritas Ekspresi Histopatologi kanker p53 ovarium epitelial diferensiasi sel 1 01.44.62.10 50 18.9 2 buruk + endometrioid adeno ca 2 01.44.94.40 34 18.3 2 sedang - musinus cyst adeno ca 3 01.45.18.86 48 21.2 0 buruk - clear cell adeno ca 4 01.45.44.57 59 22.0 3 buruk + endometrioid ca 5 00.44.13.72 49 21.6 3 buruk + endometrioid adeno ca 6 01.46.84.91 30 26.8 1 sedang - serous cyst adeno ca 7 01.46.67.88 40 29.6 0 baik - musinus tumor 8 01.44.95.40 64 17.3 3 baik + serous adeno ca 9 01.46.61.79 44 20.0 2 sedang - cyst adenoca musinus 10 01.47.05.36 60 22.8 3 baik - serus adeno ca 11 01.38.48.90 48 19.4 2 baik - clear cell adeno ca 12 01.47.90.00 45 19.1 2 sedang - serus adeno ca 13 01.47.69.39 28 28.3 2 sedang - adeno ca musinosum 14 01.47.21.38 44 21.2 0 baik - serus adeno ca 15 01.23.13.40 43 23.8 2 sedang - serus adeno ca 16 01.48.31.89 36 19.4 2 buruk - serous adeno ca 17 01.49.25.03 50 22.5 2 buruk + clear cell adeno ca 80 18 01.49.63.90 47 32.3 0 sedang - serus adeno ca 19 01.46.20.82 37 38.2 3 baik - clear cell adeno ca 20 01.52.30.28 61 26.8 2 baik - adeno ca musinosum 21 01.52.52.09 36 18.9 2 sedang - clear cell adeno ca 22 01.48.35.96 48 23.5 2 baik - clear cell adeno ca 23 01.50.80.92 39 20.5 1 sedang - serous cyst adeno ca 24 01.53.48.73 52 24.6 4 sedang + serous cyst adeno ca 25 01.53.50.97 55 22.0 0 baik - clear cell adeno ca 26 01.53.39.11 39 18.2 0 buruk + clear cell adeno ca 27 01.53.95.99 67 28.4 0 sedang - endometrioid adeno ca 28 01.54.14.54 35 23.3 2 buruk - musinus cyst adeno ca 29 01.54.80.49 56 15.2 3 sedang - serus adeno ca 30 01.55.67.92 44 23.3 2 sedang - serus adeno carcinoma 31 01.55.81.11 58 24.5 1 buruk + endometrioid adeno ca 32 01.18.69.85 39 15.5 2 buruk - musinus adeno ca 33 01.55.43.48 48 23.8 0 buruk - serus adeno ca 34 01.55.04.87 63 17.7 4 baik - musinus adeno ca 35 01.14.23.14 35 23.4 0 baik - clear cell adeno ca 36 01.55.66.84 66 17.8 4 buruk - clear cell ca CM Umu r Paritas Derajat diferensiasi No IMT Ekspresi p53 sel 37 01.52.30.28 46 20.0 0 buruk - Histopatologi kanker ovarium epitelial musinus adeno ca 81 38 01.60.66.47 46 22.2 2 buruk - serus adeno ca 39 01.60.65.71 45 19.8 2 baik - musinus cyst adeno ca 40 01.61.98.89 51 20.4 4 buruk - serus adeno ca 41 01.61.89.00 50 22.0 4 baik - clear cell adeno ca 42 01.55.59.01 44 21.2 3 buruk - serus adeno ca 43 01.23.24.65 13 17.6 0 sedang - clear cell adeno ca 44 01.22.78.66 48 19,2 2 buruk - musinus adeno ca 82 Lampiran 4 4.1 Hasil Pewarnaan HE (grade I, II dan III) 4.2 Hasil Pewarnaan Imunohistokimia (IHK) Positif & Negatif 22/PP/2013; IHK P53 Negatif 83 Lampiran 5 5.1 Uji One-Sample Kolmogorov-Smirnov untuk Mengetahui Normalitas Sampel Paritas N IMT 44 44 44 1.86 46.36 22.102 1.112 10.835 4.4290 Absolute .201 .096 .146 Positive .201 .096 .146 Negative -.185 -.095 -.094 1.335 .636 .970 .057 .814 .304 Normal Parametersa,,b Mean Std. Deviation Most Extreme Differences Umur Kolmogorov-Smirnov Z Asymp. Sig. (2-tailed) a. Test distribution is Normal. b. Calculated from data. 5.2 Uji Levene untuk Mengetahui Homogenitas Sampel Levene Statistic df1 df2 Sig. Paritas .576 2 41 .567 Umur 1.396 2 41 .259 IMT 3.168 2 41 .053 84 5.3 Uji One Way Anova untuk Membandingkan Rerata Karakteristik Sampel Sum of Squares Paritas Umur IMT Between Groups df Mean Square .137 2 Within Groups 53.045 41 Total 53.182 43 566.266 2 Within Groups 4481.916 41 Total 5048.182 43 58.806 2 Within Groups 784.683 41 Total 843.490 43 Between Groups Between Groups F .068 .053 Sig. .949 1.294 283.133 2.59 0 .087 109.315 29.403 1.53 6 19.139 .227 85 5.4 Uji Spearman’s untuk Mengetahui Korelasi antara p53 dengan Derajat Diferensiasi Gradin g P53 Spearman's rho P53 Correlation Coefficient 1.000 .313* . .038 44 44 .313* 1.000 .038 . 44 44 Sig. (2-tailed) N Grading Correlation Coefficient Sig. (2-tailed) N *. Correlation is significant at the 0.05 level (2-tailed).