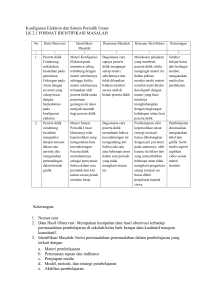
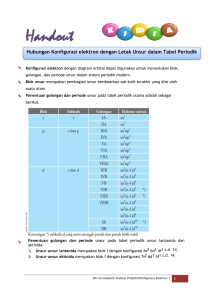
RENCANA PELAKSANAAN PEMBELAJARAN (RPP) KD 3.4 Menganalisis kemiripan sifat unsur dalam golongan dan keperiodikannya DI SUSUN OLEH : 1. 2. KHATMIZARULLAH SRI NURSAKINAH (E1M016034) (E1M016067) PROGRAM STUDI PENDIDIKAN KIMIA FAKULTAS KEGURUAN DAN ILMU PENDIDIKAN UNIVERSITAS MATARAM 2019 RENCANA PELAKSANAAN PEMBELAJARAN A. Identitas Sekolah 1. Sekolah : SMA Negeri 1 Mataram 2. Mata Pelajaran : Kimia 3. Kelas/Semester : X / Ganjil 4. Materi Pokok : Sistem Sist em Periodik Unsur 5. Alokasi Waktu : 2 pertemuan (6 X 45 menit) B. Kompetensi Inti (KI) (KI) KI 1 dan KI 2 Kompetensi sikap spritual dan kompetensi sikap sosial dicapai melalui pembelajaran tidak langsung (indirect teaching) pada pembelajaran kompetensi pengetahuan dan kompetensi keterampilan melalui keteladanan, pembiasaan dan budaya sekolah dengan memperhatikan karakteristik pembelajaran serta kebutuhan dan kondisi fisik peserta didik. KI 3 KI 4 Memahami, menerapkan, menganalisis Mengolah, menalar, dan menyaji dalam pengetahuan faktual, konseptual, ranah konkrit konkrit dan ranah abstrak terkait prosedural berdasarkan rasa ingin ingin tahunya Dengan pengembangan dari yang tentang ilmu pengetahuan, teknologi, dipelajarinya di sekolah secara mandiri, seni, budaya, dan humaniora dengan dan mampu menggunakan metode sesuai wawasan kemanusiaan, kenegaraan, dan kebangsaan, kaidah keilmuan peradaban terkait penyebab fenomena dan kejadian, serta menerap-kan pengetahuan prosedural pada bidang kajian yang spesifik sesuai dengan bakat dan minatnya untuk memecahkan masalah C. Kompetensi Dasar (KD) No Kompetensi Dasar (KD) No Kompetensi Dasar (KD) 3.4 Menganalisis unsur kemiripan dalam golongan sifat 4.4 Menalar kemiripan dan kepriodikan dan sifat unsur berdasarkan data sifat- keperiodikannya No sifat periodik unsur Indikator Pencapaian No Indikator Pencapaian Kompetensi (IPK) Kompetensi (IPK) Pertemuan 1 3.4.1 Menjelaskan perkembangan 4.4.1 Mempresentasikan perkembangan sistem periodik unsur 3.4.2 sistem periodik unsur Menunjukkan elektron valensi 4.4.2 Menunjukkan elektron valensi dari dari masing-masing unsur 3.4.3 masing-masing unsur Membedakan antar golongan dan 4.4.3 Membedakan antar golongan dan periode dalam tabel periodik periode dalam tabel periodik unsur unsur Pertemuan 2 3.4.4 Menjelaskan sifat fisik dan kimia 4.4.4 Mengemukakan sifat fisik dan kima unsur 3.4.5 unsur Menganalisis keteraturan sifat 4.4.5 Menyajikan hasil analisis kepriodikan unsur-unsur keteraturan sifat kepridikan unsur- beradasarkan letaknya dalam unsur berdasarkan letaknya dalm tabel periodik unsur tabel periodik D. Tujuan Pembelajaran Pembelajaran Melalui model pembelajaran discovery terbimbing dengan menggali infomasi dari berbagai sumber belajar, penyelidikan sederhana dan mengolah informasi, diharapkan peserta didik dapat Menganalisis kemiripan sifat unsur dalam golongan dan keperiodikannya, terlibat aktif selama proses belajar mengajar berlangsung, memiliki sikap rasa ingin tahu, kerja sama, bertanggung jawab dan kreatif. E. Materi Pembelajaran 1. Faktual: Tabel periodik unsur Nomor atom dan nomor nomor massa 2. Konseptual: Perkembangan tabel periodik unsur: 1) Triad Dobereiner 2) Hukum oktaf Newlands 3) Sistem periodik Mendeleev 4) Sistem periodik Modern Moseley 3. Prosedural: Penulisan konfigurasi elektron` F. Pendekatan/Model/Metode Pembelajaran 1. Pendekatan Pembelajaran : Saintifik 2. Model Pembelajaran : Kooperatif Tipe Two Stay Two Stray (TSTS) (Pertemuan ke-1) 3. Metode Pembelajaran Discovery Terbimbing (Pertemuan 2 ke-2) : Diskusi, penugasan, dan tanya jawab G. Media/Alat dan Bahan Pembelajaran 1. Media : Lembar kerja siswa, lembar penilaian, dan Power point 2. Alat Pembelajaran : Spidol, papan tulis, LCD, penghapus, dan laptop 3. Bahan Pembelajaran :- H. Sumber Belajar 1. Buku teks kimia : Sudarmo, H. (2013). Kimia 3 Untuk SMA/MA Kelas XII. Jakarta: Erlangga. Purba, Michael. (2006). Kimia Untuk SMA. Jakarta: Erlangga. 2. Internet http://www.studiobelajar.com/sistem-periodik-unsur/.html http://id.m.wikibooks.org/wiki/Subjek:kimia/sifat-periodik-unsur.html 3. Lembar kerja peserta didik (LKPD) I. Langkah-langkah Pembelajaran Pertemuan Pertama (3 JP) No Tahap Kegiatan Karakter Waktu 1 Pendahuluan Guru melakukan salam pembuka Religiostitas, dan doa bersama untuk memulai Disiplin pembelajaran Guru mengabsensi peserta didik Apersepsi. Misalnya: “Guru mengecek materi prasyarat yang harus dimiliki siswa untuk lanjut ke materi sistem periodik unsur” “Tuliskan konfigurasi 20Ca!” Motivasi. Misalnya: “Setelah mempelajari materi ini, kalian akan dapat menjelaskan tentang Tabel Periodik Unsur dan Elektron Valensi serta golongan dan periode unsur dalam tabel periodik unsur” Menjelaskan tujuan pembelajaran atau kompetensi dasar yang akan dicapai Menyampaikan cakupan materi dan penjelasan pembelajaran yang kegiatan akan dilakukan. Misalnya: “hari ini kita akan belajar mengenaitabel periodik unsur jadi saya harap kalian memerhatikan dengan baik” Guru menjelaskan model dan sintak digunakan 2 Inti Mengamati pembelajaran yang 10 menit (Stimulation) Guru membimbing siswa untuk Kemandirian, 5 mengamati tabel periodik unsur integritas menit Guru memberikan masalah yang Rasa ingin 5 berkaitan dengan tabel periodik tahu, displin Guru mengarahkan siswa untuk membaca buku tentang perkembangan sistem periodik unsur Menanya (Problem Statement) menit unsur seperti: “Bagaimana perkembangan awal tabel periodik sebelum sampai ke tabel yang sekarang ini?” “Tabel periodik menurut siapakah yang gunakan kita sampai saat ini?” Mencoba (Data Collecting) Guru membagi siswa menjadi 8 Kemandirian, kelompok yang masing-masing kerja sama, kelompok terdiri dari 4-5 orang integritas Masing-masing kelompok diberikan materi perkembangan tabel periodik yang berbeda-beda (Kelompok 1 dan 2: doboreiner) (Kelompok 3 dan 4: newlands) (kelompok 5 dan 6: mendeleev) (Kelompok 7 dan 8: moseley) Guru mengarahkan masing- masing kelompok untuk mencari 20 menit 2. Energi Ionisasi (EI) Perhatikan reaksi berikut ini! Li(g) + Ei → Li+ + e- Ei = Energi Ionisasi Maka kecenderungan Energi Ionisasi dalam : a. Satu golongan dari atas ke bawah energi ionisasi semakin ……..……... sebab jari-jari atom semakin …………. Sehingga gaya tarik inti terhadap elektron semakin ……..….. Oleh karena itu elektron l ebih mudah untuk dilepas. b. Satu periode dari kiri ke kanan energi ionisasi semakin ……………. sebab jarijari atom semakin ……….….. sehingga gaya tarik inti terhadap elektron semakin …………….. Oleh karena itu elektron lebih sukar untuk dilepaskan. 3. Afinitas Elektron (AE) Bila afinitas elektron merupakan kebalikan dari energi ionisasi, maka afinitas elektron adalah …. Tabel Afinitas Elektron Beberapa Unsur (dalam satuan kJ/mol) Li Be B C N O F -60 +240 -23 -124 0 -141 -322 Na Mg Al Si P S Cl -53 +23 -44 -120 -74 -201 -347 K Ca Ga Ge As Se Br -77 -195 -324 Dari tabel di atas, dapat disimpulkan bahwa : -49 +150 -40 -116 Dalam satu golongan, dari atas kebawah, afinias elektron semakin ………………., sedangkan satu periode semakin ………… Rb Sr dalam In Sn dari kiri Sbke kanan Teafinitas elektron I -46 +160 -40 -121 -101 -190 -295 Catatan : Dalam satu periode, harga afinitas elektron cenderung semakin negatif. Hal ini menyebabkan suatu unsur semakin mudah menerima elektron. Sebaliknya, dalam satu golongan harga afinitas elektron semakin positif sehingga semakin sulit menerima elektron. Jika penyerapan elektron disertai dengan pelepasan energi maka afinitas elektronnya bertanda (-) Jika penyerapan elekron disertai dengan penyerapan energi maka afinitas elektronnya bertanda (+) Semakin negatif (-) nilai afinitas elektron, maka semakin besar kecenderungan untuk menarik elektron membentuk ion negatif. Unsur dengan afinitas elektron bertanda negatif (-) artinya ion yang dibentuk lebih stabil daripada atom netralnya. Unsur dengan afinitas elektron bertanda positif (+) artinya ion yang dibentuknya kurang stabil daripada atom netralnya. 4. Keelektronegatifan Cermati tabel berikut! H 2,20 Li 0,98 Be 1,57 B 2,04 C 2,55 N3,04 O 3,44 F 3,98 Na 0,93 Mg 1,31 Al 1,61 Si 1,90 P 2,19 S 2,58 Cl 3,16 K 0,82 Ca 1,00 Sc 1,36 Ti 1,54 … Cu 1,90 Zn 1,65 Ga 1,81 Ge 2,01 As 2,18 Se 2,55 Br 2,96 Rb 0,82 Sr 0,95 Y 1,22 Zr 1,33 … Ag 1,93 Cd 1,69 In 1,78 Sn 1,96 Sb 2,05 Te 2,1 I 2,66 Cs 0,79 Ba 0,89 Keelektronegatifan adalah kecenderungan suatu unsur untuk menarik elektron dalam molekul senyawa sehingga bermuatan negatif. Dari tabel elektronegatifitas beberapa unsur di atas, simpulkanlah sifat keelektronegatifan unsur dalam tabel periodik unsur. Dalam satu golongan : Dalam satu periode : 5. Buatlah diagram panah yang menggambarkan sifat-sifat periodik di atas! a. Jari-jari atom 3. INSTRUMEN PENILAIAN a. Tes Sikap. Mata Pelajaran c. Afinitas elektron b. Energi ionisasi : Kimia d. Keelektronegatifan Nilai Jumlah skor yang diperoleh Skor Total x 100 LEMBAR PENILAIAN SIKAP X IPA No Nama Siswa Skor Sikap Pro-Aktif Responsif Bijaksana 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 N b. Instrumen Penilaian Pengetahuan Total Skor Nilai Akhir Pertemuan 1 dan 2 IPK 3.4.1 Menjelaskan perkembangan sistem periodik unsur 3.4.2 Menunjukkan Materi Pembelajaran Tabel periodik dan sifat keperiodikan unsur Indikator soal elektron valensi dari masingmasing unsur 3.4.3 Membedakan antar golongan dan periode dalam tabel periodik unsur Menjelaskan perkembangan sistem periodik unsur Teknik Bentuk penilaian instrumen Tes Essay tertulis Nomor soal 1 Diberikan suatu unsur, siswa diharapkan dapat menentukan elektron valensi unsur tersebut dengan menggunakan konfigurasi elektron 2 Menjelaskan perbedaan golongan dan periode dalam tabel periodik unsur 3 3.4.4 Menjelaskan sifat fisik dan kimia unsur 3.4.5 Menganalisis keteraturan sifat kepriodikan unsur-unsur beradasarkan letaknya dalam tabel Menjelaskan sifat fisika dan kimia unsur dalam SPU 4 Diberikan sifat fisika dan kimia suatu unsur, siswa menganalisis keteraturan sifatsifat tersebut berdasarkan golongan dan periodenya 5 periodik unsur K artu Soal Indikator Soal Menjelaskan perkembangan sistem periodik unsur HOTS/LOTS LOTS Rumusan Soal Jelaskan secara singkat perkembangan sistem periodik unsur menurut Mendeley dan Mosley! Kunci Jawaban Skor 1. Mendeley Pada tahun 1869 Mendeleyef dan Lothar Meyer secara terpisah menyusun berdasarkan kenaikan massa atom dan kemiripan sifatnya. Dari data tersebut Mendeleyef mengemukakan : “Sifat unsur-unsur adalah merupakan fungsi periodik dari massa atomnya”. Salah satu kehebatan sistem penyusunan ini adalah dari keperiodikan ini Mendeleyef telah dapat meramalkan sifat unsurunsur yang pada saat itu belum diketahui orang. 2. Mosley Pada tahun 1913 Hendry G.J. Moseley melihat hubungan antara nomor 20 Dalam satu golongan, makin kebawah jumlah kulitnya makin banyak. Meskipun dalam hal ini jumlah muatan inti makin banyak, tetapi pengaruh bertambahnya jumlah kulit lebih besar daripada pengaruh muatan inti. Akibatnya jarak elektron kulit terluar terhadap inti makin jauh. Dalam satu periode dari kiri ke kanan muatan inti makin bertambah sedangkan jumlah kulit elektronnya tetap. Akibatnya, gaya tarik inti terhadap elektron terluar makin kuat sehingga menyebabkan jarak elektron kulit terluar dengan inti makin dekat. 2. Energi Ionisasi (EI) Energi ionisasi adalah energi minimum yang diperlukan atom netral dalam wujud gas untuk melepas suatu elektron paling luar (yang terikat paling lemah) membentuk ion positif. Pelepasan elektron kedua (dari ion positif satu) disebut energi ionisasi kedua, pelepasan elektron ketiga disebut energi ionisasi ketiga, dan seterusnya. Harga energi ionisasi dipengaruhi oleh jari-jari atom dan jumlah elektron valensi atau muatan inti. Semakin kecil jari-jari atom, harga ionisasi akan semakin besar. Semakin besar muatan inti, energi ionisasi cenderung akan semakin besar. Hubungan energi ionisasi dengan nomor atom a. Dalam satu golongan dari atas kebawah energi ionisasi semakin kecil. Karena dalam satu golongan dari atas ke bawah jari-jari atom bertambah, jari-jari atom bertambah karena jumlah kulit bertambah. Akibatnya makin kecil daya tarik inti terhadap elektron terluar, sehingga semakin mudah atom unsur itu melepaskan elektron dan makin kecil energi ionisasinya. b. Dalam satu periode dari kiri ke kanan energi ionisasi semakin besar karena dalam satu periode dari kiri ke kanan jari-jari atom makin kecil. Dengan demikian, semakin kuat daya tarik inti terhadap elektron terluar dan makin sukar elektron tersebut dilepas, sehingga energi ionisasinya bertambah. 3. Afinitas Elektron Afinitas elektron adalah energi yang dibebaskan oleh suatu atom dalam wujud gas ketika menerima sebuah elektron. Harga afinitas elektron sukar ditentuka secara langsung. Dalam satu periode dari kiri ke kanan afinitas elektron cenderung semakin besar. Dalam satu golongan dari atas kebawah afinitas elektron cenderung semakin kecil. 4. Keelektronegatifan Keelektronegatifan adalah besaran kecenderungan suatu atom untuk menarik elektron. Harga keelektronegatifan bersifat relatif (berupa harga perbandingan suatu atom terhadap atom yang lain). Salah satu definisi keelektronegatifan adalah definisi Pauling yang menghasilkan data skala kuantitatif, yakni : Dalam satu golongan, harga keelektronegatifan dari atas kebawah semakin kecil. Dalam satu periode, dari kiri ke kanan harga keelektronegatifan semakin besar.