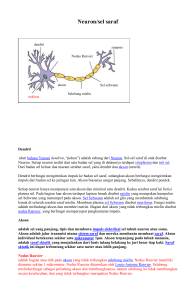
kultur in vitro sel-sel otak besar (cerebrum) anak tikus
advertisement

KULTUR IN VITRO SEL-SEL OTAK BESAR (CEREBRUM) ANAK TIKUS VIVIT RIYACUMALA FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR BOGOR 2010 PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI Saya menyatakan bahwa skripsi dengan judul Kultur In Vitro Sel-sel Otak Anak (Cerebrum) Tikus adalah karya saya sendiri dengan arahan pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir skripsi. Bogor, Agustus 2010 Vivit Riyacumala NIM B04060805 ABSTRAK VIVIT RIYACUMALA. Kultur In Vitro Sel-sel Otak Besar (Cerebrum) Anak Tikus. Dibimbing oleh ITA DJUWITA. Telah dilakukan penelitian kultur in vitro sel-sel otak besar anak tikus (Sprague Dawley) umur tiga hari dalam Dulbecco’s Modified Eagle Medium (DMEM) yang mengandung Fetal Bovine Serum (FBS) 10%, dan gentamisin 50 µg/ml dengan dan tanpa penambahan insulin 5 µg/ml, transferin 10 µg/ml, selenium 5 µg/ml (ITS). Kultur dilakukan dalam inkubator CO2 5% dan suhu 37oC selama 11 hari. Identifikasi dilakukan terhadap jenis sel yang tumbuh berdasarkan pengamatan morfologi, kemampuan pertumbuhan sel (tingkat proliferasi dan population doubling time (PDT) serta panjang akson dendrit) berdasarkan penghitungan sel menggunakan hemositometer dan mikrometer, serta kandungan protein yang dihasilkan berdasarkan identifikasi menggunakan metode Sodium dodecyl sulfate – polyacrilamide gel electrophoresis (SDS-PAGE). Data kuantitatif dianalisis menggunakan uji statistik T-test dalam program Minitab, sedangkan data kualitatif dianalisis secara deskriptif. Hasil penelitian menunjukkan bahwa berdasarkan pengamatan morfologi terdapat dua jenis sel yaitu sel saraf yang meliputi sel saraf bipolar dan multipolar serta sel glia yang meliputi astrosit fibrous, astrosit protoplasmik, oligodendrosit, dan mikroglia. Penambahan ITS ke dalam medium kultur mampu meningkatkan tingkat proliferasi (P<0,05) dengan PDT yang lebih rendah, meningkatkan pertumbuhan panjang akson dan dendrit, serta secara kualitatif produksi protein (berukuran antara 21,5–36,5 kDa) yang lebih tinggi yang diindikasikan dari intensitas pita protein. Kata kunci: kultur sel, sel saraf, ITS, SDS-PAGE ABSTRACT VIVIT RIYACUMALA. In Vitro Culture of Newborn Rat Cerebrum Cells. Under direction of ITA DJUWITA. Research has been conducted on in vitro culture of three days old rat cerebrum cells in Dulbecco’s Modified Eagle Medium (DMEM) containing 10% Fetal Bovine Serum (FBS) and 50 µg/ml gentamycin, and supplemented with and without 5 µg/ml insulin, 10 µg/ml transferin, 5 µg/ml selenium (ITS). Culture was done in 5% CO2 incubator at 37oC for 11 days. Identification was done on types of cell based on morphological observation, growth capacity (cell proliferation, population doubling time/ PDT and length of axon and dendrit) based on calculation of the number of cells using hemocytometer and micrometer, and the protein produced by the cerebrum cells in the culture medium using sodium dodecyl sulfate–polyacrilamide gel electrophoresis (SDS-PAGE) method. Quantitative data were analyzed using statistical T-test on Minitab program. The results showed that based on the morphological observations, there are two types of cells including nerve cells of bipolar and multipolar neurons and glial cells including the fibrous astrocyte, protoplasmic astrocyte, oligodendrocyte, and microglia. Supplementation of ITS into the culture medium could increase the cells proliferation rate (P<0.05) with lower PDT, axon and dendrit lenght growth and quantitatively the 21.5–36.5 kDa protein production as indicated by the intensity of the protein band. Keywords: cell culture, nerve cell, ITS, SDS-PAGE ©Hak Cipta milik IPB, tahun 2010 Hak Cipta dilindungi Undang-Undang Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah, dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB. Dilarang mengumumkan dan memperbanyak sebagian sebagiaan atau seluruh karya tulis dalam bentuk apapun tanpa izin IPB. KULTUR IN VITRO SEL-SEL OTAK BESAR (CEREBRUM) ANAK TIKUS VIVIT RIYACUMALA Skripsi sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada Fakultas Kedokteran Hewan Institut Pertanian Bogor FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR BOGOR 2010 Judul Skripsi Nama NIM : Kultur In Vitro Sel-sel Otak Besar (Cerebrum) Anak Tikus : Vivit Riyacumala : B04060805 Disetujui: Pembimbing Dr. Drh. Hj. Ita Djuwita, M.Phil 19590403 198601 2 002 Diketahui a.n. Dekan Wakil Dekan Dr. Nastiti Kusumorini 19621205 198703 2 001 Tanggal Lulus: PRAKATA Syukur ke hadirat Allah SWT atas rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan skripsi ini dengan judul “Kultur In Vitro Sel-sel Otak Besar (Cerebrum) Anak Tikus”. Skripsi ini disusun berdasarkan hasil penelitian yang dilaksanakan pada bulan Februari-Juli 2010 dan merupakan salah satu syarat untuk memperoleh gelar sarjana kedokteran hewan pada Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Pada kesempatan ini penulis mengucapkan terima kasih yang sebesarbesarnya kepada: 1. Dr. Drh. Hj. Ita Djuwita, M.Phil selaku dosen pembimbing akademik sekaligus pembimbing skripsi yang telah memberikan banyak ilmu, bimbingan, dukungan, perhatian, dan pelajaran hidup selama menyelesaikan studi di S1. 2. Mas Wahyu, Bu Ekayanti, dan para staf laboratorium Anatomi, Histologi, dan Embriologi yang telah banyak membantu selama penelitian. 3. Dr. Nurhidayat, Dr. Joko Pamungkas, dan Dr. Iis Arifiantini selaku dosen penguji dalam seminar dan ujian akhir sarjana. 4. Harlystiarini, atas doa, dukungan, dan bantuan serta suka cita selama menjalani penelitian bersama. 5. Keluarga tercinta, Ayah dan Ibu serta Mas David, atas doa, dukungan, dan kasih sayangnya. 6. Teman-teman terbaik Sisca, Nirna, Nobo, Reni, Winda, Sekar, Bundo, Dina, Binol, Edo, Laras, Rista, Ninis, Nia, Dana, Yevi, atas semua bantuan dan dukungannya. 7. Keluarga besar wisma PNS, Haya, Bintang, Sofura, Nia, Sabti, Chika, Melly, Idja, Asti, Iwi, Nita, Lia, Mbak Vika, Mbak Vivi, Mbak Kiki atas semua keceriaan, kebersamaan, dan dukungannya. 8. Rekan-rekan penelitian di Laboratorium Embriologi Kak Yeni, Kak Devi, Rani, Riska, Adhil, Vin, Irma, Disa, Yayan, Ani, Nita, atas kebersamaan dan dukungan yang diberikan. 9. Rekan-rekan Aesculapius 43 atas dukungan, bantuan, serta kekompakan selama menempuh pendidikan S1 dan untuk semua pihak yang turut membantu kelancaran penelitian ini yang tidak bisa disebutkan satupersatu. Penulis menyadari penelitian ini masih jauh dari sempurna dikarenakan keterbatasan pengetahuan penulis. Namun demikian, penulis berharap agar hasil penelitian ini dapat bermanfaat untuk berbagai pihak. Bogor, Agustus 2010 Penulis RIWAYAT HIDUP Penulis dilahirkan di Kediri, pada tanggal 07 Juni 1988 dari pasangan Bapak Drs. Mujiono dan Ibu Anik Mutafarida. Penulis telah menempuh pendidikan formal di Madrasah Ibtidaiyah-YPSM Tawangrejo-Kediri (2000), SLTPN 1 Pagu-Kediri (2003), dan SMAN 2 Pare-Kediri (2006). Pada tahun 2006, penulis melanjutkan pendidikan sarjana di Institut Pertanian Bogor melalui jalur USMI dan diterima di Fakultas Kedokteran Hewan setelah setahun di IPB. Selama menjalani pendidikan sarjana, penulis berkesempatan menjadi anggota dan pengurus Himpunan Minat dan Profesi Satwaliar divisi pendidikan (2007-2008) dan divisi infokom (2008-2009) serta aktif dalam berbagai kegiatan kepanitiaan. Untuk menyelesaikan pendidikan S1 di Fakultas Kedokteran Hewan IPB, penulis melaksanakan penelitian yang berjudul “Kultur In Vitro Sel-sel Otak Besar (Cerebrum) Anak Tikus”. DAFTAR ISI DAFTAR TABEL Halaman ....................................................................................... i DAFTAR GAMBAR ................................................................................... ii DAFTAR LAMPIRAN .............................................................................. iii DAFTAR SINGKATAN ............................................................................ iv PENDAHULUAN ...................................................................................... Latar Belakang .................................................................................... Tujuan ............................................................................................... Manfaat .............................................................................................. 1 1 2 2 TINJAUAN PUSTAKA ............................................................................. Sel Saraf Otak .................................................................................... Morfologi dan Fungsi Berbagai Jenis Sel Otak .................................... Kultur Sel Saraf .................................................................................. Sistem Kultur ...................................................................................... Pemanfaatan Kultur Sel Saraf ............................................................. Protein yang Dihasilkan Sel Saraf ...................................................... Metode Analisis Protein Sel Saraf ....................................................... 3 3 3 5 6 8 9 9 METODE PENELITIAN ........................................................................... Waktu dan Tempat .............................................................................. Alat dan Bahan .................................................................................... Prosedur Kerja ....................................................................................... Isolasi Sel Saraf Otak Besar ........................................................ Kultur Sel Saraf Otak ................................................................. Pembuatan dan Koleksi Conditioned Medium ............................ Evaluasi Hasil Kultur Sel Otak .................................................... Tipe-tipe sel .................................................................... Tingkat Proliferasi dan Population Doubling Time ......... Pertumbuhan Panjang Akson dan Dendrit ........................ Identifikasi Protein Menggunakan SDS-PAGE ............... Rancangan Percobaan .......................................................................... 12 12 12 12 12 13 13 13 13 14 14 14 14 HASIL DAN PEMBAHASAN ................................................................... Tipe-tipe Sel yang Tumbuh dan Berkembang dalam Kultur ..... Pertumbuhan Sel Saraf ............................................................. Tingkat Proliferasi dan Population Doubling Time ....... Panjang Akson dan Dendrit .......................................... Komposisi Sel Saraf dan Glia ....................................... Analisis Protein pada Kultur Sel Saraf Otak dengan Menggunakan SDS-PAGE .............................................................................. 16 16 19 19 20 21 22 SIMPULAN DAN SARAN ....................................................................... 24 Simpulan ............................................................................................ 24 Saran ................................................................................................. 24 DAFTAR PUSTAKA LAMPIRAN ................................................................................ 25 .............................................................................................. 29 i DAFTAR TABEL Halaman 1 Tingkat proliferasi sel yang tumbuh dalam medium mDMEM dan mDMEM+ITS ......................................................................................... 20 2 Panjang akson dan dendrit pada medium mDMEM dan mDMEM+ITS .. 21 3 Persentase sel saraf dan sel glia yang berkembang dalam kultur 22 .......... ii DAFTAR GAMBAR Halaman 1 Morfologi neuron di dalam kultur .............................................................. 4 2 Berbagai tipe neuron dan sel glia 5 3 Morfologi sel-sel saraf dalam kultur in vitro 4 Morfologi sel glia yang berkembang dalam kultur sel otak 5 Morfologi neuroblast dengan pengamatan secara natif ............................. 18 6 Morfologi sel saraf dengan pengamatan secara natif ................................. 19 7 Sel saraf bipolar dengan akson bermyelin .................................................. 19 8 Hasil SDS elektroforesis CM kultur sel saraf yang diwarnai dengan silver nitrat ......................................................................................................... 23 .............................................................. ........................................... 16 ..................... 17 iii DAFTAR LAMPIRAN Halaman 1 Pembuatan medium kultur mDMEM ........................................................ 30 2 Pembuatan mPBS ...................................................................................... 30 3 Pembuatan separating dan stacking gel elektroforesis ............................... 30 4 Pembuatan buffer SDS ........................................................................... 31 5 Pewarnaan silver nitrat ............................................................................ 31 6 Prosedur tripsinasi....................................................................................... 32 iv DAFTAR SINGKATAN CM : conditioned medium DMEM : Dulbecco’s Modified Eagle Medium FBS : fetal bovine serum FGF : fibroblast growth factor HE : hematoksilin eosin IEF : isoelectric focusing ITS : insulin transferrin selenium suplement MBP : myelin basic protein mDMEM : Dulbecco’s Modified Eagle Medium yang telah dimodifikasi mPBS : phosphate buffered saline yang telah dimodifikasi MS : mass spectrometry NBCS : newborn calf serum NGF : nerve growth factor PBS : phosphate buffered saline PLP : proteolipid protein SDS : sodium dodecyl sulphate SDS-PAGE : sodium dodecyl sulfate – polyacrilamide gel electrophoresis PENDAHULUAN Latar Belakang Otak besar (cerebrum) merupakan bagian otak yang paling besar, tersusun atas jaringan saraf yang terdiri atas sel saraf (neuron) dan sel glia yang masingmasing berfungsi untuk menyampaikan sinyal dari satu sel ke sel lainnya dan melindungi, mendukung, merawat, serta mempertahankan homeostasis cairan di sekeliling neuron (Kuntarti 2007). Beberapa peneliti melaporkan bahwa sel saraf individu dewasa secara in vivo diketahui tidak memiliki kemampuan membelah (Cormack 2001; Junqueira & Carneiro 2005) meskipun telah ditemukan bahwa pada burung dewasa sel saraf masih dapat membelah (Junqueira & Carneiro 2005). Kerusakan pada sistem saraf pusat akan bersifat permanen karena ketidakmampuan sel saraf untuk melakukan regenerasi (Yiu & He 2006; Jusuf & Antarianto 2009). Kerusakan sel saraf dapat menyebabkan munculnya penyakit yang disebut dementia yang meliputi penyakit Alzheimer dan Parkinson (Halim et al. 2010). Menurut Gage dan Verma (2003) serta Halim et al. (2010) stem cell memiliki potensi besar sebagai alternatif terapi penyakit degenerasi saraf. Stem cell tersebut dapat diarahkan untuk berdiferensiasi membentuk sel saraf dan progenitor sel saraf. Pengarahan stem cell menjadi sel saraf dibutuhkan induktor seperti nerve growth factor (Zhang et al. 2006), fibroblast growth factor, atau suatu bahan kimia seperti retinoic acid dan sebagainya. Sel-sel otak besar dapat digunakan sebagai sumber untuk kultur sel saraf. Kultur sel saraf memiliki banyak manfaat terutama untuk menyelidiki karakteristik fisiologi dan metabolisme sel saraf serta pengujian terhadap efek zat tertentu (Butler 2004). Kultur in vitro sel saraf juga dapat digunakan untuk memproduksi berbagai growth factor ke dalam medium yang dapat digunakan untuk menginduksi perkembangan stem cell. Medium kultur yang telah mengandung sekreta sel-sel yang dikultur ini dikenal dengan conditioned medium (CM). Conditioned medium dari kultur primer sel saraf mengandung faktor pertumbuhan seperti nerve growth factor (NGF), glial derived neurotrophic factor (GDNF), nestin, dan glial fibrillary acidic protein (GFAP). Dibandingkan dengan tipe sel lain seperti sel fibroblas dan epitel, kultur primer sel saraf otak lebih susah ditumbuhkan. Sel saraf berkembang dari progenitor saraf dan tidak mampu membelah ketika sudah mature, berbeda dengan sel fibroblas dan epitel yang kemampuan pertumbuhannya masih bagus meskipun sudah mature. Selain itu sel harus beradaptasi dengan lingkungan (Mather dan Roberts 1998) dan berinteraksi dengan populasi sel yang tidak homogen pada awal kultur primer. Oleh karena itu dibutuhkan medium yang mampu mempertahankan daya hidup pada kultur primer sel saraf otak. Insulin transferrin selenium (ITS) diketahui mampu meningkatkan daya hidup dan proliferasi sel (Freshney 1994). Kebanyakan medium kultur tidak mengandung ITS sehingga ingin diketahui pertumbuhan sel saraf dalam medium yang mengandung ITS. Penambahan ITS diharapkan dapat meningkatkan proliferasi sel. Tujuan Penelitian ini bertujuan mengetahui kemampuan pertumbuhan secara in vitro sel-sel saraf yang diisolasi dari otak besar anak tikus umur tiga hari dan secara khusus untuk mengidentifikasi tipe-tipe sel yang tumbuh, tingkat proliferasi, population doubling time (PDT) dan panjang akson dan dendrit serta gambaran kualitatif protein yang disekresikan. Manfaat Manfaat yang diperoleh dari penelitian ini adalah mendapatkan informasi tentang kemampuan pertumbuhan secara in vitro dan tingkat proliferasi sel saraf otak besar anak tikus dalam medium dengan dan tanpa penambahan ITS. Selain itu juga dapat dimanfaatkan untuk menghasilkan conditioned medium dan galur sel. TINJAUAN PUSTAKA Sel Saraf Otak Otak merupakan bagian dari sistem saraf yang termasuk dalam susunan saraf pusat. Otak terdiri atas sel-sel saraf yang jumlahnya diperkirakan mencapai 100 milyar sel (Freudenrich 2001; Kuntarti 2007). Otak berfungsi dalam mengkoordinasi, mengontrol, dan mengatur seluruh aktivitas tubuh (Freudenrich 2001). Bagian-bagian otak vertebrata secara umum antara lain cerebrum, diensefalon, cerebellum, midbrain, pons, dan medulla oblongata (Kuntarti 2007). Bagian-bagian otak pada tikus dapat dibagi menjadi beberapa bagian utama yaitu otak depan (forebrain), batang otak (brain stem), otak tengah (midbrain), cerebellum, dan medulla oblongata. Otak depan terdiri atas korteks serebri, hippocampus, dan bulbus olfactorius. Batang otak meliputi ganglia basalis, septum, epithalamus, thalamus, dan hypothalamus. Sedangkan otak tengah meliputi tectum, tegmentum, dan pedunculi cerebri (Hedrich & Bullock 2004). Secara umum sistem saraf disusun oleh jaringan saraf yang terdiri atas selsel saraf atau neuron dan sel pendukung atau sel glia (Beresford 2001; Junqueira & Carneiro 2005). Neuron memiliki bagian-bagian yang sama seperti sel yang lain akan tetapi memiliki kemampuan yang istimewa yaitu kemampuan mentransmisikan sinyal dan menyampaikan pesan menuju sel target (Freudenrich 2001) sehingga dapat menjalankan fungsi sistem saraf seperti mengingat, berfikir, dan mengontrol semua aktivitas tubuh. Secara khusus neuron juga berfungsi dalam merangsang aktivitas sel tertentu dan melepaskan neurotransmitter dan molekul lain (Junqueira & Carneiro 2005). Sel glia atau neuroglia berfungsi untuk melindungi, mendukung, merawat, dan mempertahankan homeostasis cairan di sekeliling neuron (Kuntarti 2007). Morfologi dan Fungsi Berbagai Jenis Sel Otak Neuron terdiri dari tiga bagian utama yaitu dendrit, badan sel, dan akson (Gambar 1). Dendrit merupakan penjuluran-penjuluran kecil yang memanjang berfungsi dalam menerima stimulus dari lingkungan, sel sensoris atau sel saraf lainnya (Junqueira & Carneiro 2005). Badan sel berukuran besar mengandung bagian-bagian utama sel seperti nukleus, reticulum endoplasma, ribosom, dan mitokondria. Kerusakan pada badan sel menyebabkan kematian pada sel saraf (Freudenrich 2001). Badan sel berfungsi menerima stimulus dari dendrit untuk diteruskan menuju akson. Akson berupa penjuluran tunggal yang keluar dari badan sel. Fungsi akson yaitu menghubungkan stimulus menuju sel lainnya seperti sel saraf, otot, dan kelenjar. Bagian distal akson biasanya bercabang dan berhubungan dengan sel lain baik sel saraf maupun sel lainnya membentuk struktur yang disebut sinaps (Junqueira & Carneiro 2005). Gambar 1 Morfologi neuron di dalam kultur, N: nukleus, P: perikaryon, D: dendrit, A: akson, H: axon hillock, tanda panah: sel glia (Kerr 2000). Neuron memiliki bentuk yang bervariasi. Berdasarkan bentuknya neuron dapat dikelompokkan menjadi neuron multipolar, bipolar, dan unipolar atau pseudounipolar (Gambar 2) yang didasarkan atas jumlah penjuluran akson dan dendrit (Junqueira & Carneiro 2005). Neuron multipolar memiliki satu penjuluran akson dengan banyak penjuluran dendrit. Neuron bipolar memiliki masing-masing satu penjuluran dendrit dan akson sedangkan neuron unipolar hanya memiliki satu penjuluran yang dekat dengan badan sel dan membagi menjadi dua cabang. Kebanyakan neuron dalam tubuh berbentuk multipolar (Cormack 2001; Junqueira & Carneiro 2005). Neuron bipolar dapat ditemukan pada ganglion cochlearis dan ganglion vestibularis serta pada retina dan mukosa olfaktorius. Neuron unipolar banyak ditemukan pada ganglion kranialis dan juga dapat ditemukan pada ganglion spinalis (Junqueira & Carneiro 2005). Sel glia terdiri dari astrosit, oligodendrosit, sel Schwann, sel-sel ependymal, dan mikroglia (Gambar 2). Sel glia lebih banyak jumlahnya dibandingkan dengan neuron. Sel glia terletak di sekitar sel saraf mengelilingi badan sel, dendrit, dan akson. Astrosit, oligodendrosit, sel-sel ependymal, dan mikroglia dapat ditemukan pada sistem saraf pusat sedangkan sel Schwann ditemukan pada saraf perifer (Junqueira & Carneiro 2005). Masing-masing sel glia memiliki fungsi yang spesifik. Astrosit berfungsi dalam mengontrol sinyal antarneuron, mengatur ion dan metabolisme sel saraf, serta sebagai blood brain barrier (Cormack 2001). Oligodendrosit dan sel Schwann memiliki fungsi yang sama yaitu bertanggung jawab dalam sintesis selubung myelin, sedangkan mikroglia berfungsi sebagai makrofag. Sel-sel ependymal merupakan komponen sel glia yang menyusun plexus choroideus. Sel-sel ependymal berfungsi dalam sekresi dan pergerakan cairan serebrospinal (Junqueira & Carneiro 2005). Gambar 2 Berbagai tipe neuron dan sel glia (Cormack 2001). Kultur Sel Saraf Kultur sel adalah kultur sel-sel yang berasal dari organ atau jaringan yang telah diuraikan secara mekanis dan atau secara enzimatis menjadi suspensi sel. Suspensi sel tersebut kemudian dibiakkan menjadi satu lapisan jaringan (monolayer) di atas permukaan yang keras seperti botol, tabung, dan cawan atau menjadi suspensi sel dalam media penumbuh (Malole 1990). Kultur primer berarti menumbuhkan sel dari jaringan hewan secara langsung dalam medium penumbuh (Butler 2004). Kebanyakan kultur primer sel saraf didapatkan dari jaringan saraf tikus pada masa embrionik atau neonatal (Banker & Goslin 1998; Butler 2004). Sel-sel pada masa embrionik tersebut lebih mudah didispersi dan memiliki potensi pertumbuhan yang lebih unggul (Butler 2004). Di antara mamalia, tikus dan mencit merupakan spesies yang umum digunakan sebagai sumber jaringan pada kultur saraf (Banker & Goslin 1998; Fedoroff & Richardson 2001). Penggunaan tikus dan mencit dapat memberikan keuntungan terutama pada konsistensi genetik dan biaya yang tidak terlalu mahal (Banker & Goslin 1998). Sel saraf dapat juga ditumbuhkan dari neural cell line (Murayama et al. 2001). Beberapa neural cell line telah dikembangkan seperti neuronal cell line, glial cell line, embryonal carcinoma cell line, dan melanoma cell line. Keuntungan menggunakan cell line antaralain memiliki kemampuan hidup lebih lama, pertumbuhannya tidak terbatas, dan terdiri dari satu jenis sel tunggal. Selain itu penggunaan cell line sebagai sumber kultur dapat mengurangi penggunaan hewan coba (Murayama et al. 2001). Ketersediaan sel tunggal dalam jumlah cukup besar dalam kultur dapat memberikan keuntungan untuk purifikasi bahan alami maupun rekombinan. Misalnya untuk produksi neuroendokrin yang jumlahnya dalam tubuh sangat sedikit. Meskipun demikian kultur sel saraf dari sumber cell line memiliki kekurangan terutama karena ketiadaan beberapa jenis sel yang berkembang dalam sistem saraf secara in vivo (Murayama et al. 2001). Sistem Kultur Kultur sel membutuhkan medium dan lingkungan yang sesuai dengan kondisi in vivo. Kondisi ini diciptakan dengan pengaturan temperatur, pH, oksigen, CO2, tekanan osmosis, permukaan untuk melekat sel, nutrien dan vitamin, proteksi terhadap zat toksik, hormon, dan faktor pertumbuhan yang mengatur pertumbuhan dan diferensiasi sel (Malole 1990). Temperatur yang ideal untuk pertumbuhan sel adalah pada 37°C (Pollard & Walker 1990) dengan pH optimal 7,4 (Malole 1990). Selama kultur diusahakan pH tidak lebih rendah dari 7,0 karena pH yang rendah akan memperlambat pertumbuhan sel. Kestabilan pH dapat dijaga dengan sistem buffer karbondioksida-karbonat sama seperti dalam darah (Malole 1990). Sistem tersebut terdiri dari penambahan NaHCO 3 dalam medium dan udara yang mengandung karbondioksida 5%. (Malole 1990). Permukaan untuk melekat sel harus memiliki daya adhesif. Beberapa bahan tertentu dapat digunakan sebagai substrat untuk melekatkan sel seperti fibronectin, gelatin, dan kolagen (Butler 2004). Sel di dalam tubuh organisme menerima nutrisi dari sirkulasi darah. Medium untuk kultur sel in vitro harus mampu menyuplai nutrisi yang sama seperti keadaan nutrisi pada darah (Radledge & Kristiansen 2001). Awalnya untuk menumbuhkan sel mamalia in vitro melibatkan medium yang berasal dari bahan alami seperti embrio ayam, serum, dan cairan limfe. Tetapi sejak tahun 1950 ditemukan medium kultur yang mengandung berbagai komponen penting dan sudah banyak perkembangan. Medium dasar untuk kultur sel adalah larutan garam seimbang. Larutan ini berfungsi untuk menciptakan pH dan osmolaritas fisiologis yang dibutuhkan untuk mempertahankan viabilitas sel in vitro. Untuk menciptakan kondisi yang mampu merangsang proliferasi sel, dalam medium perlu ditambahkan glukosa, asam amino, vitamin, dan beberapa garam tertentu yang dibutuhkan sesuai jenis sel yang dikultur (Radledge & Kristiansen 2001). Medium pertumbuhan yang sering dipakai untuk kultur sel mamalia adalah Dulbecco’s Modified Eagle Medium (DMEM). Medium tersebut merupakan modifikasi dari Basal Medium Eagle (BME) yang mengandung konsentrasi asam amino dan vitamin empat kali lipat lebih banyak. Asam amino dan vitamin yang ditambahkan dalam media berfungsi sebagai suplemen tambahan. Awalnya DME mengandung 1000 mg/L glukosa dan dilaporkan pertama kali digunakan untuk kultur embrio tikus. Selain asam amino dan vitamin, medium ini juga mengandung asam folat, nikotinamid, riboflavin, vitamin B-12, dan garam mineral seperti kalsium korida, potasium klorida, magnesium sulfat, sodium klorida, dan monosodium fosfat. Natrium bikarbonat digunakan sebagai sumber karbonat yang dapat mempertahankan pH dan osmolaritas (Mather dan Barnes 1998). Medium DMEM sangat cocok digunakan dalam berbagai kultur sel termasuk sel-sel yang berasal dari manusia, monyet, hamster, tikus, mencit, ayam, dan ikan (Pombinho et al. 2004). Medium kultur dapat juga ditambahkan komponen lain seperti ITS. Suplemen ITS mengandung tiga komponen faktor pertumbuhan yang penting untuk beberapa tipe sel tertentu. Insulin penting dalam pertumbuhan dan kelangsungan hidup sel sedangkan transferrin merupakan protein pengangkut zat besi (iron-transport protein) yang fungsinya sama seperti insulin (Banker & Goslin 1998). Selenium berfungsi sebagai kofaktor sintesis glutathione, yaitu membantu memecah peroksida dan superoksida. Dilaporkan juga bahwa selenium mampu melindungi kerusakan yang distimulasi oleh cahaya (Banker & Goslin 1998). Selain itu selenium juga dapat mengoptimalkan pertumbuhan sel. Kebanyakan medium basal untuk kultur sel tidak mengandung ITS. Penambahan ITS diketahui mampu mengurangi penggunaan serum dalam medium. Banyak cell line seperti BHK, HeLa, Vero, MDCK, dan CHO dapat tumbuh dengan penambahan ITS meskipun serum yang digunakan 1-2% (Anonimus 2005). Sel tidak dapat hidup hanya dengan medium basal saja (Banker & Goslin 1998). Kebutuhan akan nutrisi dan faktor pertumbuhan untuk pemeliharaan sel dapat disediakan dalam medium dengan penambahan serum. Serum yang digunakan dapat diperoleh dari berbagai hewan seperti sapi (Fetal Calf Serum (FCS), Newborn Calf Serum (NBCS)), kuda, dan manusia (Mather & Barnes 1998). Jumlah serum yang ditambahkan biasanya 5-20% (Shuler & Kargi 1992; Banker & Goslin 1998). Menurut Banker dan Goslin (1998) FCS mengandung faktor mitogenik yang tinggi sehingga sering digunakan untuk keperluan kultur cell line atau kultur primer sel glia. Serum terbukti dapat mendukung pertumbuhan sel melalui penyediaan faktor hormonal, pertumbuhan, perlekatan, dan penyebaran sel (Mather & Roberts 1998) serta menyediakan transport protein pembawa hormon, mineral, dan lipid (Shuler & Kargi 1992). Penggunaan antibiotik dalam medium juga diperlukan untuk mencegah kontaminasi (Jakoby & Pastan 1979). Antibiotik yang sering digunakan dalam medium adalah gentamisin (Mather & Roberts 1998). Pemanfaatan Kultur Sel Saraf Kultur sel memiliki banyak manfaat terutama untuk menyelidiki karakteristik fisiologi dan metabolisme sel. Kultur sel juga bermanfaat dalam pengujian efek zat tertentu terhadap suatu sel. Zat toksik dan bahan-bahan mutagenik dapat dievaluasi di dalam kultur (Butler 2004). Selain itu kultur sel dapat digunakan untuk memproduksi bahan-bahan untuk mendiferensiasikan stem cell menjadi sel spesifik. Secara khusus, kultur sel saraf memiliki potensi untuk dimanfaatkan dalam terapi penyakit degenerasi saraf seperti Alzheimer dan penyakit Parkinson. Hal ini karena sel saraf sendiri memiliki stem cell yang disebut sebagai neural stem cell (Halim et al. 2010). Stem cell pada jaringan saraf dimanfaatkan untuk regenerasi sel-sel saraf yang rusak. Saat ini penelitian baik riset maupun klinis telah banyak dilakukan untuk mengarahkan diferensiasi neural stem cell menjadi sel saraf (Halim et al. 2010) Protein yang Dihasilkan oleh Sel Saraf Otak menghasilkan bermacam-macam protein yang disekresikan oleh sel saraf maupun sel glia. Menurut Quarles et al. (2006) protein menyusun bagian otak tikus sebanyak 56,9%. Salah satu protein yang dihasilkan oleh sel saraf adalah protein tau. Protein ini dihasilkan dari bagian akson yang berfungsi dalam menstabilkan dan meningkatkan pembentukan mikrotubuli neuron serta meningkatkan viabilitas neuron (Hansson 2008). Bagian lain sel saraf seperti selubung myelin juga menghasilkan protein yaitu myelin basic protein (MBP) dan proteolipid protein (PLP). Kedua protein ini dapat larut dalam SDS elektroforesis dan dapat dipisahkan berdasarkan berat molekulnya (Quarles et al. 2006). Selain protein, sel saraf juga mensekresikan beberapa growth factor seperti nerve growth factor (NGF), glial derived neurotrophic factor (GDNF), nestin, dan glial fibrillary acidic protein (GFAP). Astrosit diketahui mampu mensekresikan fibroblast growth factor-1 (FGF-1) berdasarkan penelitian Ito et al. (2005). Metode Analisis Protein Sel Saraf Identifikasi protein dapat dilakukan dengan berbagai macam metode diantaranya liquid phase isoelectric focusing (IEF), imunopresipitasi, mass spectrometry (MS), dan gel elektroforesis (Hansson 2008). Protein merupakan molekul yang bersifat amfoter yang mengandung grup asam dan basa pada sekuen asam amino sehingga muatan protein akan bervariasi berdasarkan pH. Sifat demikian dimanfaatkan untuk memisahkan protein berdasarkan titik isoelektrik (pI) masing-masing protein dengan IEF. Titik isoelektrik akan berhenti pada pH spesifik ketika muatan protein sama dengan nol (Hansson 2008). Pemisahan protein dapat juga dengan metode imunopresipitasi apabila sampel biologis mengandung beberapa macam protein. Metode MS digunakan untuk menganalisis massa protein berdasarkan rasio massa per muatan. Selain itu MS juga memberikan informasi tentang sekuen dan perubahan asam amino (Hansson 2008). Penelitian ini menggunakan gel elektroforesis untuk menganalisa protein. Elektroforesis mampu memisahkan protein dengan baik berdasarkan titik isoelektrik dan berat molekul. Biasanya metode yang digunakan adalah SDSPAGE (Sodium dodecyl sulfate – polyacrilamide gel electrophoresis ) (Hansson 2008). Menurut Roe (2001) dan Ahmed (2005) SDS-PAGE merupakan metode yang cukup cepat dalam identifikasi protein dan sering digunakan untuk memperkirakan berat molekul serta menentukan komposisi subunit dari suatu protein murni (Deutscher 1992). Penggunaan lain SDS-PAGE adalah untuk monitoring purifikasi protein, verifikasi konsentrasi protein, deteksi proteolisis, deteksi modifikasi protein, dan deteksi imunopresipitasi protein (Ahmed 2005). Mekanisme kerja SDS-PAGE sama seperti elektroforesis pada umumnya akan tetapi ditambahkan dengan sodium dodecyl sulphate (SDS) sebelum dilakukan elektroforesis. Adanya SDS yang merupakan bahan detergen anionik ini akan mendenaturasi protein lalu melekat kuat pada molekul yang diuraikan tersebut. Satu molekul SDS diperkirakan mengikat dua asam amino. Molekul SDS ini lalu menutupi permukaan protein dan membentuk jejaring muatan negatif yang dihasilkan dari grup sulfat pada molekul SDS. Semua protein akan bermuatan negatif dengan berat jenis yang sama sehingga protein tersebut hanya dapat dipisahkan berdasarkan ukurannya (Hames 1998). Protein dengan berat molekul rendah akan bergerak lebih cepat di dalam gel dibandingkan dengan protein dengan berat molekul besar. Berdasarkan prinsip tersebut berat molekul suatu protein dapat diperkirakan dengan memasukkan marker protein standar yang sudah diketahui berat molekulnya dalam gel yang sama (Ahmed 2005). Elektroforesis dapat dilakukan dalam dua sistem bufer yaitu sistem langsung dan tidak langsung. Sistem langsung (continuous system) hanya menggunakan satu separating gel serta buffer yang sama baik pada gel maupun bak elektroforesis sedangkan pada sistem tidak langsung (discontinuous system) terdiri dari dua macam gel yaitu separating gel dan stacking gel. Kedua gel ini memiliki daya rembes, daya ion, dan pH yang berbeda. Kelebihan penggunaan sistem ini adalah didapatkan hasil yang lebih baik dibandingkan dengan tanpa stacking gel dalam volume sampel yang sama (Ahmed 2005). Deteksi protein dalam gel dilakukan dengan berbagai macam pewarnaan seperti coomassie blue, silver nitrat, dan amido black (Ahmed 2005). Coomassie blue merupakan pewarnaan yang cepat dan sering digunakan untuk visualisasi protein pada gel poliakrilamid (Ahmed 2005; Bonner 2007). Protein dapat terdeteksi oleh coomassie blue apabila konsentrasi sampel protein yang diloading dalam gel sebelum tahapan rehidrasi sebanyak 500 µg sampai dengan 1 mg (Blot 2003). Dibandingkan dengan coomassie blue, pewarnaan silver nitrat jauh lebih sensitif (Janson & Ryden 1998; Blot 2003) bahkan pada konsentrasi nanogram, akan tetapi membutuhkan waktu lebih lama (Ahmed 2005). METODE PENELITIAN Waktu dan Tempat Penelitian ini dilaksanakan pada bulan Februari-Juli 2010 di Laboratorium Embriologi dan Laboratorium Layanan Pendidikan Terpadu, Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Alat dan Bahan Alat yang digunakan dalam penelitian ini antara lain peralatan bedah steril, pinset, mikropipet, tip, timbangan digital, biosafety cabinet, mikroskop, cawan petri steril, object glass, cover glass, gelas piala, gelas ukur, tabung konikal, tabung eppendorf, mikrofilter, spuit, hemositometer, dan mesin elektroforesis. Bahan–bahan yang digunakan antara lain otak tikus (Rattus norvegicus) umur 3 hari (newborn), medium kultur mDMEM (Dulbecco’s Modified Eagle Medium) yang dimodifikasi dengan penambahan asam amino non esensial (AANE) 10%, fetal bovine serum (FBS) 10%, sodium bikarbonat 3 mM, 2mercaptoetanol 0,1 mM dan gentamisin 50 µg/ml, phosphate buffered saline yang dimodifikasi dengan penambahan FBS 0,1% dan gentamisin 50 µg/ml (mPBS), insulin transferrin selenium (ITS), pewarna hematoksilin eosin, dan pewarna silver nitrat. Metode Isolasi Sel Saraf Otak Besar Tikus strain SD (Sprague Dawley) umur 3 hari dimatikan terlebih dahulu dengan menggunakan eter kemudian daerah kepala didesinfeksi dengan alkohol 70%. Otak bagian cerebrum diisolasi dan dicuci dengan larutan PBS. Suspensi otak dibuat dengan cara menyedot dan mengeluarkan kembali secara berulang menggunakan spuit 1 cc yang mengandung larutan mPBS. Suspensi dimasukkan ke dalam tabung dan dilakukan sentrifugasi dengan kecepatan 210 g selama 10 menit. Pencucian dilakukan dengan mPBS sebanyak 4 kali ulangan dan medium mDMEM sebanyak 1 kali ulangan. Terakhir pelet diresuspensi dalam larutan mDMEM sebanyak 1 ml. Kultur Sel Saraf Otak Suspensi otak dengan konsentrasi 104 sel/ml dikultur dalam 3 cawan petri yang telah dilapisi dengan gelatin 0,1% dan berisi 2 ml mDMEM dengan dan tanpa ITS. Kultur sel otak dilakukan dengan teknik aseptis di dalam clean bench untuk mencegah kontaminasi. Kultur diinkubasi dalam inkubator CO 2 5% pada suhu 37°C. Penggantian medium dilakukan setiap 2 hari untuk menyediakan kembali nutrisi yang berkurang dan membuang sisa metabolisme sel. Kultur dilakukan selama 11 hari atau sampai mencapai konfluen 90%. Pembuatan dan Koleksi Conditioned Medium Kultur yang telah konfluen dilakukan koleksi medium. Medium kultur primer dibuang dan dicuci dengan PBS tanpa FBS. Selanjutnya diganti dengan mDMEM tanpa FBS pada masing-masing petri sebanyak 2 ml. Setelah 2 hari medium dikoleksi dan disimpan dalam tabung eppendorf 1,5 ml pada refrigerator. Evaluasi Hasil Kultur Sel Otak Tipe-tipe Sel Identifikasi tipe-tipe sel yang tumbuh dilakukan berdasarkan morfologi sel baik secara natif maupun dengan pewarnaan Hematoksilin Eosin (HE). Kultur sel yang ditumbuhkan di atas cover glass dicuci menggunakan PBS kemudian difiksasi dalam larutan buffer paraformaldehid 4% selama 24 jam. Setelah 24 jam dilakukan penyimpanan dalam alkohol 50% selama 2 jam kemudian dalam alkohol 70% sampai dengan dilakukan pewarnaan HE. Kultur yang disimpan dalam alkohol 70% sebelum diwarnai dilakukan stopping point dalam alkohol 50% selama 3 menit. Selanjutnya direndam dalam aquades selama 5 menit, hematoksilin 4 menit, dan dibilas dengan aquades. Selanjutnya dilakukan perendaman dalam eosin selama 2 menit dan dibilas dengan aquades. Pewarnaan dilanjutkan dengan dehidrasi bertingkat dalam alkohol 70%, 80%, 90%, 96%, absolut 3 kali ulangan, masing-masing 10 menit dan dilanjutkan dalam xilol dua kali ulangan kemudian dimounting pada object glass menggunakan entelan. Evaluasi dilakukan dengan mengamati morfologi sel dengan mikroskop cahaya pada perbesaran 40x10. Tingkat Proliferasi dan Population Doubling Time Tingkat poliferasi ditentukan berdasarkan penghitungan jumlah sel sebelum dan setelah kultur mencapai konfluen 90%. Peningkatan (proliferasi) sel diketahui dari total sel yang tumbuh menggunakan kamar hitung hemositometer Improved Neubauer dengan perhitungan sebagai berikut: Total sel (sel /ml) = jumlah sel pada 5 kotak x faktor pengenceran x 104 Sedangkan Population Doubling Time (PDT) dihitung menggunakan rumus: PDT (hari) = 1 ( log jumlah sel akhir- log jumlah sel awal) x 3,32 waktu Pertumbuhan Panjang Akson dan Dendrit Pertumbuhan panjang akson dan dendrit diamati dengan mikroskop pada perbesaran 40x10 dan diukur menggunakan mikrometer. Satu skala mikrometer pada perbesaran 40x10 setara dengan 2,5 µm. Jumlah sel yang diukur sebanyak 50 sel untuk masing-masing ulangan. Identifikasi Protein Menggunakan Sodium Dodecyl Sulfate – Polyacrilamide Gel Electrophoresis (SDS-PAGE) Elektroforesis diawali dengan pembuatan gel poliakrilamid yang terdiri atas dua bagian yaitu separating gel 12% dan stacking gel 4%. Selanjutnya chamber alat elektroforesis diisi dengan running buffer 1x sampai bagian bawah gel terendam. Sampel dari CM kultur sel saraf sebanyak 15 µl dicampurkan dengan loading buffer (1:2) dan dimasukkan ke dalam sumur gel. Larutan baku protein dimasukkan juga ke dalam gel sebagai marker. Elektroforesis dijalankan pada tegangan 120 V dan arus listrik sebesar 25 A selama 3 jam. Setelah proses running selesai, gel dilepaskan secara hati-hati dari lempeng kaca dan selanjutnya dilakukan visualisasi protein dengan pewarnaan silver nitrat. Rancangan Percobaan Kultur sel-sel saraf dibagi menjadi dua kelompok perlakuan berdasarkan kondisi medium yang digunakan yaitu (1) mDMEM dan (2) mDMEM yang ditambah dengan ITS (insulin 5 µg/ml, transferin 10 µg/ml, selenium 5 µg/ml) masing-masing sebanyak tiga kali ulangan. Parameter yang diamati adalah tipe sel yang tumbuh berdasarkan morfologi, panjang akson dan dendrit, komposisi sel saraf dan sel glia, tingkat proliferasi sel dan population doubling time, serta kandungan protein yang disekresikan. Data tipe-tipe sel berdasarkan morfologi sel serta gambaran protein diuraikan secara deskriptif sedangkan data kuantitantif yaitu tingkat proliferasi, PDT dan panjang akson-dendrit dianalisis menggunakan metoda statistik T-test dengan tingkat kepercayaan 95%. HASIL DAN PEMBAHASAN Tipe-tipe Sel yang Tumbuh dan Berkembang dalam Kultur Berdasarkan morfologi, sel-sel yang tumbuh dan berkembang dalam kultur primer terdiri dari dua tipe sel yaitu sel saraf dan sel-sel glia. Tipe sel saraf yang teramati dalam kultur adalah sel saraf bipolar dan sel saraf multipolar (Gambar 3). d a A a s d s B Gambar 3 Morfologi sel-sel saraf dalam kultur in vitro, a: akson, d: dendrit, s: badan sel. (A) Sel saraf multipolar. (B) Sel saraf bipolar. Pewarnaan HE. Bar: 10µm. Sel saraf umumnya memiliki morfologi badan sel yang besar dengan penjuluran akson dan dendrit. Morfologi sel saraf mudah diidentifikasi karena dicirikan oleh banyaknya penjuluran panjang yang khas (Junqueira & Carneiro 2005). Sel saraf bipolar memiliki inti sel bulat dengan satu penjuluran akson dan satu penjuluran dendrit. Sel saraf multipolar memiliki morfologi inti sel besar dengan beberapa penjuluran dendrit dan satu penjuluran akson. Penyusun utama jaringan saraf adalah sel saraf dan sel glia (Beresford 2001) dan sel saraf multipolar dan sel saraf bipolar merupakan jenis sel saraf yang sering ditemukan dalam susunan saraf pusat (Junqueira & Carneiro 2005; Cormack 2001). Tidak ditemukannya sel saraf unipolar dalam kultur karena biasanya sel ini berbentuk menyerupai sel saraf bipolar. Ditegaskan pula oleh Beitz dan Fletcher (2006) bahwa sel saraf unipolar berasal dari sel saraf bipolar dan setelah dewasa (mature) akan berkembang menjadi sel saraf bipolar. Sel-sel glia diidentifikasi dengan melihat morfologi, memiliki inti sel yang lebih gelap, dan ukuran yang relatif lebih kecil dari sel saraf. Sel glia yang teramati dalam kultur antara lain astrosit, oligodendrosit, dan mikroglia (Gambar 4). Sel glia terlihat lebih gelap dengan pewarnaan HE akan. Hal ini dikarenakan pada inti sel mengandung banyak kromatin (Beitz & Fletcher 2006). Astrosit memiliki morfologi yang khas dengan penjuluran sitoplasma seperti bintang. Astrosit protoplasmik memiliki inti yang bulat berbeda dengan astrosit fibrous yang memiliki inti sedikit lebar dan memanjang. Oligodendrosit dapat diidentifikasi dari morfologinya yang menyerupai astrosit dengan jumlah penjuluran lebih sedikit dan kecil. Mikroglia memiliki inti sel kecil dan bulat dikelilingi dengan banyak penjuluran berukuran kecil. A B C D Gambar 4 Morfologi sel glia. (A) Astrosit protoplasmik. (B) Astrosit fibrous. (C) Oligodendrosit. (D) Mikroglia. Pewarnaan HE. Bar: 10µm. Beberapa sel glia seperti sel Schwann dan sel ependymal tidak ditemukan dalam pengamatan. Tidak ditemukannya pertumbuhan sel Schwann dalam kultur karena sel tipe ini ditemukan di susunan saraf perifer (Junqueira & Carneiro 2005). Sel-sel ependymal memiliki morfologi yang cukup berbeda dibandingkan sel glia lainnya akan tetapi sel ini juga tidak ditemukan di dalam kultur. Sel ini berbentuk seperti epitel kubus dan kadang memiliki silia (Junqueira & Carneiro 2005). Identifikasi dan karakterisasi sel ini berdasarkan penelitian Gabrion et al. (1998) dilakukan menggunakan transmission electron microscopy (TEM) dan teknik pewarnaan imunositokimia. Sel-sel glia yang ditemukan dalam kultur memiliki fungsi masing-masing yang spesifik. Astrosit berfungsi dalam memberi nutrisi sel saraf, mengontrol sinyal antarneuron, mengatur ion dan metabolisme sel saraf, serta sebagai blood brain barrier (Cormack 2001). Oligodendrosit berfungsi dalam sintesis selubung myelin sedangkan mikroglia berfungsi sebagai makrofag dalam jaringan saraf (Junqueira & Carneiro 2005). Sel saraf berkembang dari progenitor saraf yang belum berdiferensiasi (Svendsen et al. 2001). Progenitor saraf atau neuroblast yang ditemukan dalam kultur memiliki morfologi bulat, bulat dengan disertai penjuluran pendek (bipolar neuroblast), serta berbentuk spindel yang memanjang (Gambar 5). Menurut Tzeng (2002) umumnya neuroblast di dalam kultur berbentuk bulat. Neuroblast akan berkembang menjadi sel saraf dan penjuluran neuroblast pada akhirnya akan membentuk akson dan dendrit (Kalverbour et al. 1999). Gambar 5 Morfologi neuroblast (tanda panah) dengan pengamatan secara natif. Bar: 10 µm. Sel saraf selain dikelilingi oleh berbagai sel glia juga dikelilingi oleh protein transmitter. Protein ini memiliki morfologi bulat, memiliki ukuran kecil, dan menempel pada sel saraf dengan jumlah cukup banyak (Gambar 6). Sel ini dibedakan dengan sel glia dengan melihat morfologi dan cara menempel pada sel saraf. Sel glia menempel pada sel saraf melalui penjuluran-penjulurannya sedangkan protein transmitter tidak memiliki penjuluran. a s n d Gambar 6 Morfologi sel saraf dengan pengamatan secara natif, a: akson, d: dendrit, s: soma, n: inti sel, tanda panah: protein transmitter. Bar: 10 µm. Beberapa sel saraf ditemukan memiliki myelin. Myelin tampak seperti badan sel saraf namun berukuran kecil dan hanya terdapat pada akson (Gambar 7). Antar myelin dipisahkan oleh nodus Ranvier yang merupakan bagian akson yang tidak bermyelin (Agamanolis 2010). Myelin berfungsi untuk melindungi akson dan meningkatkan kecepatan impuls. Pada saraf perifer myelin dibentuk oleh sel Scwann sedangkan pada saraf pusat dibentuk oleh oligodendrosit (Agamanolis 2010). Gambar 7 Sel saraf bipolar dengan akson bermyelin (tanda panah hitam) yang dipisahkan oleh nodus Ranvier (tanda panah merah). Bar: 10 µm. Pertumbuhan Sel Saraf Tingkat Proliferasi dan Population Doubling Time. Jumlah sel yang tumbuh dalam medium mDMEM dengan penambahan ITS secara nyata lebih banyak dibandingkan dengan medium mDMEM (P<0,05). Demikian pula dengan PDT yang dihasilkan pada medium mDMEM+ITS lebih cepat dibandingkan tanpa penambahan ITS (Tabel 1). Tabel 1 Tingkat proliferasi sel yang tumbuh dalam medium mDMEM dan mDMEM+ITS mDMEM Jumlah awal 9,0x104 mDMEM+ITS Jumlah akhir PDT 6,2x105a ±104083 3,9 ± 0,3 Jumlah akhir 8,6x105b ± 28868 PDT 3,2 ± 0,2 Huruf superscript yang berbeda pada baris yang sama menunjukkan adanya perbedaan yang nyata (P<0,05). Menurut Freshney (1994) insulin dalam suplemen ITS memiliki fungsi untuk meningkatkan penyerapan glukosa dan asam amino ke dalam sel. Efek mitogenik yang dihasilkan insulin dikarenakan pada sel terdapat reseptor terhadap insulin yaitu insulin-like growth factor receptor (reseptor IGF-1). Adanya transferin dan selenium juga membantu pertumbuhan sel menjadi lebih baik. Transferin diketahui sebagai protein pengangkut zat besi ke dalam sel. Protein ini juga dapat mengoptimalkan pertumbuhan sel melalui proses detoksifikasi terhadap peroksidase dan radikal bebas dalam medium (Freshney 1994). Selenium dalam medium digunakan sebagai antioksidan. Selenium dapat mengoptimalkan pertumbuhan sel melalui aktivasi glutathione peroxidase yang berfungsi dalam detoksifikasi dari radikal bebas. Suplemen ITS selain berfungsi dalam pertumbuhan sel juga dipakai untuk mengurangi penggunaan serum dalam medium (Freshney 1994). Population Doubling Time (PDT) adalah waktu yang diperlukan oleh populasi sel untuk menjadikan jumlahnya dua kali dari jumlah semula. Sel saraf yang dikultur dalam medium dengan dan tanpa ITS menunjukkan kisaran PDT yang normal. Menurut Martin (1994) sel saraf memiliki PDT sekitar 3-4 hari. Proliferasi sel yang cepat ditunjukkan dengan PDT yang rendah. Kultur sel saraf dalam medium dengan ITS menunjukkan nilai PDT yang rendah. Hal ini menunjukkan bahwa penambahan ITS ke dalam medium mampu meningkatkan proliferasi sel. Panjang Akson dan Dendrit. Panjang akson dalam medium mDMEM berkisar dari 58-469 µm dengan rata-rata 167,7 µm dan panjang dendrit 20,3-432 µm dengan rata-rata 102,5 µm. Panjang akson dalam medium mDMEM+ITS berkisar dari 52,2-478,5µm dengan rata-rata 211,3 µm dan panjang dendrit 20,3252,3 µm dengan rata-rata 115 µm. Panjang akson dan dendrit dalam medium mDMEM dan mDMEM+ITS tidak menunjukkan perbedaan yang nyata. Namun demikian secara rataan didapatkan angka lebih besar pada medium mDMEM+ITS (Tabel 2). Tabel 2 Rataan panjang akson dan dendrit pada medium mDMEM dan mDMEM+ITS Parameter akson dendrit Ukuran panjang (µm ) dalam medium mDMEM 167,7 ± 9,6 102,5 ± 6,6 mDMEM+ITS 211,3 ± 36,4 115,0 ± 26,9 Akson dan dendrit dijadikan salah satu parameter ukuran pertumbuhan sel karena sel saraf yang mature dilihat dari ukuran akson dan dendrit yang dimilikinya. Isnaeni (2006) memaparkan bahwa penjuluran dendrit dan akson sangat bervariasi dalam ukuran dan bentuk. Hasil pengukuran menunjukkan panjang akson dan dendrit yang dihasilkan dari kultur sel saraf memiliki ukuran bervariasi yaitu berkisar antara 20-400 µm. Menurut Korogod dan Dumont (2009) ukuran dendrit yang paling pendek pada tikus adalah 20,803 µm dan dapat mencapai panjang 250-300 µm. Akson umumnya memiliki ukuran lebih panjang daripada dendrit meskipun beberapa neuron ditemukan memiliki ukuran akson yang pendek (Junqueira & Carneiro 2005). Sama seperti dendrit, ukuran akson yang dihasilkan dalam kultur juga bervariasi. Akson tikus berukuran kurang dari 1 mm dan dapat mencapai panjang 1 cm (Barres 1997). Ukuran akson yang dihasilkan dalam kultur relatif lebih pendek. Butler (2004) menyatakan bahwa pertumbuhan akson dan dendrit dapat menjadi lebih baik dengan penambahan NGF ke dalam kultur. Neuron cukup dapat teramati dengan pewarnaan HE namun penjuluran neuron tidak terwarnai jelas dengan HE (Agamanolis 2010). Akson dan dendrit dapat ditunjukkan dengan lebih jelas dengan pewarnaan silver (Agamanolis 2010). Umumnya pewarnaan silver yang digunakan untuk mewarnai akson dan dendrit adalah Bielschowsky stain (Agamanolis 2010). Komposisi Sel Saraf dan Glia. Hasil kultur in vitro menunjukkan bahwa komposisi rata-rata antara sel saraf dan glia tidak berbeda nyata yaitu masingmasing 47,8% dan 52,2%. (Tabel 3). Hasil pengamatan dengan menggunakan mikroskop menunjukkan jumlah sel saraf dan sel glia lebih banyak pada medium mDMEM+ITS dibandingkan dengan dalam medium DMEM namun persentase sel-sel tersebut dalam kedua medium tidak berbeda nyata. Hal ini menunjukkan bahwa sel yang dihasilkan memiliki komposisi yang sama tetapi berbeda tingkat kepadatannya. Tingkat kepadatan lebih tinggi dihasilkan pada medium mDMEM+ITS. Tabel 3 Persentase sel saraf dan sel glia yang berkembang di dalam kultur (%) Medium Jenis sel Sel saraf Sel glia Rata-rata mDMEM mDMEM+ITS 48,5 ± 10,3 51,5 ± 10,3 47,16 ± 1,06 52,84 ± 1,06 47,8 52,2 Sel glia memiliki persentase lebih banyak daripada sel saraf. Menurut Junqueira & Carneiro (2005) jumlah sel glia 10 kali lebih banyak dibandingkan dengan sel saraf dan mengisi jaringan saraf sebesar 90% (Beitz dan Fletcher 2006). Sel glia memiliki jumlah lebih banyak karena digunakan untuk membantu pertumbuhan sel saraf melalui absorbsi nutrisi secara optimal. Berdasarkan hasil pengamatan diperoleh jumlah sel glia sedikit lebih banyak daripada sel saraf yaitu 52,2%. Komposisi sel saraf dan sel glia memiliki persentase yang sama pada otak manusia. Pewarnaan HE kurang mampu menggambarkan sel glia secara jelas terutama untuk sel yang berukuran sangat kecil. Penggunaan imunositokimia dalam pewarnaan sel dapat membantu identifikasi sel glia secara jelas (Beitz & Fletcher 2006). Analisis Protein pada Kultur Sel Saraf Otak dengan Menggunakan SDSPAGE Hasil elektroforesis menunjukkan bahwa CM yang dikoleksi dari kultur sel saraf baik dari medium mDMEM maupun mDMEM+ITS menghasilkan tiga pita dengan perkiraan berat molekul (BM) +66, +55 dan +30 kDa yang menunjukkan intensitas pita tebal (Gambar 8). Sampel CM medium dengan penambahan ITS menunjukkan intensitas warna yang lebih gelap pada gel elektroforesis yang mengindikasikan konsentrasi protein yang lebih tinggi. Hal ini selaras dengan hasil pada Tabel 1 yang menunjukkan bahwa jumlah sel yang tumbuh dalam mDMEM+ITS lebih tinggi dibandingkan dengan dalam mDMEM. Jumlah sel yang tinggi akan menghasilkan konsentrasi protein yang tinggi pula. 1 2 3 66,3 kDa 55,4 kDa 36,5 kDa 21,5 kDa 3,5 kDa Gambar 8 Hasil SDS elektroforesis CM kultur sel saraf yang diwarnai dengan silver nitrat. (1) Unstained marker. (2) Sampel mDMEM. (3) Sampel mDMEM+ITS. Sel saraf menghasilkan berbagai macam protein diantaranya protein tau, protein MBP (myelin basic protein), dan protein PLP (proteolipid protein). Protein tau memiliki berat molekul cukup besar yaitu 48-65 kDa (Holzer 2002). Protein yang dihasilkan myelin memiliki berat molekul lebih ringan, misalnya protein MBP yang memiliki berat molekul 21,5 kDa dan protein PLP dengan berat molekul 30 kDa (Quarles et al. 2006). Growth factor yang dihasilkan oleh sel saraf antara lain nerve growth factor (NGF), glial derived neurotrophic factor (GDNF), nestin, dan glial fibrillary acidic protein (GFAP) dengan berat molekul masing-masing 30 kDa (Bocchini dan Angeletti 1969), 39 kDa (Lin 1996), 240 kDa, dan 52 kDa (Jung et al. 2007). Berdasarkan berat molekul tersebut diperkirakan protein yang dihasilkan adalah NGF dan protein PLP, namun perlu dilakukan analisis lebih lanjut untuk mengetahui secara pasti protein yang dihasilkan tersebut. Salah satu teknik identifikasi yang dapat dilakukan adalah western immunoblotting. Selanjutnya, untuk memisahkan protein dapat digunakan metode isoelectric focusing gel electrophoresis. SIMPULAN DAN SARAN Simpulan Kultur sel saraf otak besar menghasilkan sel-sel saraf bipolar dan multipolar serta sel-sel glia berupa astrosit, oligodendrosit, dan mikroglia. Penambahan ITS ke dalam medium mampu meningkatkan proliferasi sel-sel yang berkembang dalam kultur dan menghasilkan protein dengan konsentrasi lebih banyak. Saran Kultur sel saraf menghasilkan protein yang diduga mengandung growth factor tertentu. Oleh karena itu diperlukan identifikasi, purifikasi, dan penghitungan konsentrasi protein tersebut. Peneguhan terhadap identifikasi sel-sel yang berkembang dalam kultur sel saraf dapat dilakukan dengan pewarnaan yang lebih spesifik yaitu imunositokimia. Peneguhan terhadap sekreta protein yang dihasilkan dapat menggunakan metode western immunoblotting. DAFTAR PUSTAKA Agamanolis DP. 2010. Applied Neurocytology and Basic Reactions. http://neuropathology.neoucom.edu/chapter1/chapter1cOligodendroglia.ht ml. [09 Agustus 2010]. Ahmed H. 2005. Principles and Reactions of Proteins Extraction, Purification, and Characterization. USA: CRC Press LLC. Anonimus. 2005. Insulin–Transferrine-Sodium Selenite Suplement. http://www.roche-applied-science.com/support. [13 Mei 2010]. Banker G, Goslin K. 1998. Culturing Nerve Cells. USA: Massachusetts Institute of Technology. Barres BA. 1997. Neuron-glial Interactions. Di dalam Cowan WM, Jessel TM, Zipursky SL, editor. Mollecular and Cellular Approaches to Neural Development. USA: Oxford University Press. Beitz AJ, Fletcher TF. 2006. Nervous Tissue. Di dalam Eurell JA, Frappier BL, editor. Dellmann’s Textbook of Veterinary Histology. USA: Willey Blackwell. Beresford WA. 2001. Nervous Elements. http://wberesford.hsc. wvu. edu/ histol. htm#NERVOUS%20ELEMENTS. [18 Juli 2010]. Blot M. 2003. Prokayotic Genomics. Germany: Birkhauser Verlag. Bocchini V, Angeletti PU. 1969. The nerve growth factor purification as a 30.000-molecular-weight protein. Proceeding of the National Academy of Sciences of the United States of America 64: (787-794). Bonner PLR. 2007. Protein Purification. New York: Tailor and Francis Group. Brancoft JD, Gamble M. 2008. Theory and Practice of Histological Techniques. Philladelphia: Elsevier Limited. Butler M. 2004. Animal Cell Culture & Technology. Cornwall UK: Bios Scientific Publishers. Chevallet M, Luche S, Rabilloud T. 2006. Silver staining of proteins in polyacrylamide gels. Nature Protocols 1: (1852-1858). Cormack DH. 2001. Essential Histology. USA: Lippincott William&Wilkins. Deutscher MP. 1992. Guide to Protein Purification. USA: Academic Press. Fedoroff S, Richardson A. 2001. Protocols for Neural Cell Cultures. USA: Humana Press Inc. Freshney RI. 1994. Culture of Animal Cells: A Manual of Basic Technique. New York: Wiley-Liss. Freudenrich CC. 2001. How Your Brain Works. http:// pustaka. ictsleman. net/ how/b/brain/brain.htm. [18 Juli 2010]. Gabrion JB, Herbuté S, Bouillé C, Maurel D, Kuchler BS, Laabich A, Delaunoy JP. 1998. Ependymal and choroidal cells in culture: characterization and functional differentiation. Microscopy Research and Technique 41(2): 124-57. Gage FH, Verma IM. 2003. Regenerative Medicine. USA: National Academy of Science. Halim D, Murti H, Sandra F, Boediono A, Djuewantono T, Setiawan B. 2010. Stem Cell – Dasar Teori & Aplikasi. Jakarta: Penerbit Erlangga. Hames BD. 1998. Gel Electrophoresis of Proteins. New York: Oxford University Press Inc. Hansson S. 2008. Proteomic Strategies for Analysis of Cerebrospinal Fluid in Neurodegenerative Disorders. Sweden: Institute of Neuroscience and Phisiology University of Gothenburg. Hedrich HJ, Bullock GR. 2004. The Laboratory Mouse. USA: Elsevier Academic Press. Holzer JM. 2002. Alterations in Content and Phosphorylation State of Cytoskeletal Proteins in the Sciatic Nerve During Ageing and Alzheimer's Disease. http://www.innovitaresearch.org/news/02111801.html. [08 Agustus 2010]. Isnaeni W. 2006. Fisiologi Hewan. Yogyakarta: Kanisius. Ito J, Nagayasu Y, Lu R, Hayashi AKM, Yokoyama S. 2005. Astrocytes produce and secrete fibroblast growth factor-1 that promotes production of apoE-high density lipoprotein in a manner autocrine action. Journal of Lipid Research 46: (679-686). Jakoby WB, Pastan IH. 1979. Cell Culture. USA: Academic Press Inc. Janson JC, Ryden L. 1998. Protein Purification Principles, High Resolution Methods, and Applications. USA: John Wiley & Sons, Inc. Jung CS, Foerch C, Schanzer A, Heck A, Plate KH, Seifert V, Steinmetz H, Raabe A, Sitzer M. 2007. Serum GFAP is a diagnostic marker for glioblastoma multiform. Brain 130: (3336-3341). Junqueira LC, Carneiro J. 2005. Basic Histology 11th Edition. USA: The McGraw-Hill Companies Inc. Jusuf AA, Antarianto RD. 2009. Aspek Histologi dalam Neurosains. Jakarta: Departemen Histologi Fakultas Kedokteran Universitas Indonesia. Kalverbour AF, Genta ML, Hopkins JB. 1999. Current Issues in Developmental Psychology. Neteherlands: Kluwer Academic Publishers. Kerr JB. 2000. Atlas of Functional Histology. London: Harcourt Publishers Limited. Korogod S, Dumont ST. 2009. Electrical Dinamics of the Dendritic Space. United Kingdom: Cambridge University Press. Kuehnel W. 2003. Color Atlas of Citology, Histology, and Microscopic Anatomy. Germany: Georg Thieme Verlag. Kuntarti. 2007. Anatomi Sistem Saraf. http:// staff.ui.ac.id/ internal/ 1308050290/ material/anatomisaraf.pdf. [18 Juli 2010]. Lin LFH. 1996. Glial Cell Line-Derived Neurotropic Factor (GDNF): A Comprehensive Review. http:// www. promega.com/ nnotes/ nn203/ 203_03. pdf. [31 Agustus 2010]. Malole MBM. 1990. Kultur Sel dan Jaringan Hewan. Bogor: Departemen Pendidikan dan Kebudayaan, Direktorat Jenderal Pendidikan Tinggi Pusat Antaruniversitas Bioteknologi, Institut Pertanian Bogor. Martin BM. 1994. Tissue Culture Technique. USA: Birkhauser Boston. Mather JP, Barnes D. 1998. Animal Cell Culture Methods. USA: Academic Press. Mather JP, Roberts PE. 1998. Introduction to Cell and Tissue Culture Theory and Technique. New York: Plenum Press. Murayama K, Singh NN, Helmrich A, Barnes DW. 2001. Neural Cell Lines. Di dalam Fedoroff S, Richardson A, editor. Protocols for Neural Cell Cultures. Totowa: Humana Press Inc. Pollard JW, Walker JM. 1990. Animal Cell Culture. USA: The Humana Press Inc. Pombinho AR, Laizé V, Molha DM, Marques SM, Cancela ML. 2004. Development of two bone-derived cell lines from the marine teleost Sparus aurata evidence for extracellular matrix mineralization and celltype-specific expression of matrix Gla protein and osteocalcin. Cell Tissue Research 315(3): (393-406). Quarles RH, Macklin WB, Morell P. 2006. Myelin Formation, Structure, and Biochemistry. Di dalam Siegel G, Albers RW, Brady S, Price D, editor. Basic Neurochemistry: Molecular, Cellular, and Medical Aspects. Canada: Elsevier Academic Press. Radledge C, Kristiansen B. 2001. Basic Biotechnology. United Kingdom: Cambridge University Press. Roe S. 2007. Protein Purification Techniques: A Practical Approach. Great Britain: The Bath Press. Shuler ML, Kargi F. 1992. Bioprocess Engineering. USA: Prentice Hall Inc. Svendsen CN, Bhattacharyya A, Tai YT. 2001. Neurons from stem cells: preventing an identity crisis. Nature Reviews Neuroscience 2: (831-834). Tzeng SF. 2002. Neural progenitor isolated from newborn rat spinal cord differentiate into neurons and astroglia. Journal of Biomedical Science 9: (10-16). Yiu G, He Z. 2006. Glial inhibition of CNS axon regeneration. Nature Reviews Neuroscience 7: (617-627). Zhang JQ, Yu XB, Ma BF, Yu WH, Zhang AX, Huang G, Mao FF, Zhang XM, Whang ZC, Li SN, Lahn BT, Yiang AP. 2006. Neural differentiation of embryonic stem cells induced by conditioned medium from neural stem cell. Neuroreport 17: (981-986). LAMPIRAN Lampiran 1 Pembuatan medium kultur mDMEM Medium kultur mDMEM merupakan medium Dulbecco’s Modified Eagle Medium (DMEM; Sigma) yang telah dimodifikasi dengan penambahan asam amino non-esensial (AANE; Sigma) 1%, fetal bovine serum (FBS; Gibco) 10%, NaHCO3 44mM, gentamisin 50 µg/mL, dan 2-mercaptoetanol 0,1 mM. Pembuatan 100 mL mDMEM diperlukan 1 gram serbuk DMEM, 0,37 gram serbuk NaHCO3, 100 µL larutan asam amino non-esensial (AANE; Sigma), 125 µL gentamisin 50 µg/mL, 700 µL 2-mercaptoetanol 0,1 mM, dan ddH 2O sampai volume akhir 100 mL. Penambahan 10 mL FBS dilakukan pada saat medium akan digunakan untuk kultur. Medium yang telah ditambah FCS selanjutnya disterilisasi menggunakan mikrofilter 0,22 µm. Penambahan FCS dan sterilisasi medium dilakukan di dalam clean bench. Medium yang sudah steril diinkubasi dalam inkubator 37°C 5% CO2 selama 15 menit sebelum digunakan sebagai medium kultur. Lampiran 2 Pembuatan mPBS Larutan mPBS merupakan larutan phosphate buffered saline (PBS; Gibco) yang diberi tambahan fetal bovine serum (FBS; Gibco) 1% dan gentamisin 50 µg/mL. Pembuatan 100 mL PBS diperlukan 0,96 gram serbuk PBS yang dilarutkan dalam 95 mL ddH2O kemudian ditambah 125 µL gentamisin 50 µg/mL. Selanjutnya larutan tersebut ditambah FCS sebanyak 5 mL dan disterilisasi menggunakan mikrofilter 0,22 µm. Penambahan FCS dan sterilisasi mPBS dilakukan di dalam clean bench. Sebelum digunakan, mPBS diinkubasi dalam inkubator selama 15 menit. Lampiran 3 Pembuatan separating dan stacking gel elektroforesis Separating gel dibuat dengan memasukkan berturut-turut yaitu larutan akrilamid 12% sebanyak 12 mL, aquades 10,05 mL, tris HCl 1,5M (pH 8,8) 7,5 mL, SDS 10% sebanyak 3 mL, TEMED 15 µL dan ammonium persulfat 10% sebanyak 150 µL. Semua bahan tersebut dihomogenkan dalam Erlenmeyer. Stacking gel dibuat dengan mencampurkan berturut-turut larutan akrilamid 12% sebanyak 0,65 mL, aquades 3,05 mL, tris HCl 0,5M (pH 6,8) 1,25 mL, SDS 10% 50 µL, TEMED 5 µL, dan ammonium persulfat 10% 125 µL. Semua bahan tersebut dihomogenkan dalam Erlenmeyer. Lampiran 4 Pembuatan buffer SDS Larutan buffer yang digunakan dalam proses elektroforesis adalah tris HCl 1,5 M pH 8,6, tris HCl 0,5 M pH 6,8, dan running buffer. Tris HCl 1,5 M pH 8,6 dibuat dengan cara melarutkan tris base 54,45 g dalam 150 mL aquades. Setelah larutan homogen, pH larutan diatur hingga mencapai 8,6 dengan penambahan larutan NaOH atau HCl. Selanjutnya, larutan ditambah aquades hingga volumenya mencapai 300 mL. Tris HCl 0,5 M pH 6,8 dibuat dengan cara melarutkan 6 g tris base di dalam 60 mL aquades. Larutan kemudian dihomogenkandan pH larutan diatur hingga mencapai 6,8 dengan penambahan NaOH atau HCl. Selanjutnya larutan ditambah aquades hingga volumenya mencapai 100 mL. Running buffer dibuat dengan mengencerkan stock buffer. Stock buffer dibuat dengan mencampurkan tris base 1,5 g, glycine 7,2 g, dan SDS 0,5 g. Pembuatan running buffer 1x yang siap pakai dilakukan dengan mengencerkan 100 mL stock buffer dalam 400 mL aquades. Kemudian pH larutan diatur dengan dengan menambah NaOH atau HCl sampai mencapai 8,3. Lampiran 5 Pewarnaan silver nitrat Pewarnaan silver nitrat terdiri dari empat tahapan yaitu fiksasi protein, sensitisasi, pewarnaan (impregnation), dan pembentukan warna (developing) (Chevallet et al 2006). Setelah dilakukan elektroforesis, gel dikeluarkan dan dimasukkan dalam larutan fiksasi yang terdiri dari etanol 100 mL, asam asetat glasial 25 mL, dan aquades 125 mL. Proses fiksasi dilakukan selama 30 menit. Selanjutnya proses sensitisasi dalam larutan etanol, glutaraldehid 25% w/v, sodium tiosulfat 5% w/v, sodium asetat, dan aquades. Sensitisasi dilakukan selama 30 menit. Kemudian dilakukan pencucian dengan aquades 3x5 menit. Proses pewarnaan dilakukan dalam larutan silver nitrat 2,5% w/v, formaldehid 37% w/v, dan aquades selama 20 menit. Tahapan terakhir adalah pembentukan warna (developing). Gel dimasukkan dalam larutan yang terdiri dari sodium karbonat, formaldehid, dan aquades selama 2-5 menit sampai terbentuk warna yang cukup jelas. Setelah itu dilakukan stopping menggunakan larutan EDTA dan dicuci dalam aquades selama 3x15 menit. Lampiran 6 Prosedur tripsinasi Sel yang telah konfluen 90% dibuang mediumnya lalu dicuci dengan PBS kemudian dimasukkan tripsin 0,1% sebanyak 1 ml ke dalam petri. Selanjutnya sel diinkubasi selama 5-10 menit sampai sel terlihat soliter dengan pengamatan di bawah mikroskop. Pemipetan berulang dapat dilakukan untuk mempermudah disosiasi sel. Sel yang telah hemositometer Improved Neubauer. terdisosiasi selanjutnya dihitung dengan