Kimia Koordinasi
advertisement

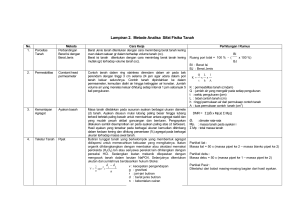
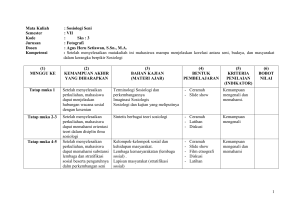
KIMIA KOORDINASI Jurusan Kimia FMIPA UNNES 2012 Ella Kusumastuti DESKRIPSI MATA KULIAH Mata kuliah lanjutan dari Kimia Anorganik I dan Kimia Anorganik II Membahas (1). sejarah perkembangan teori–teori kimia koordinasi klasik (Teori Koordinasi Bloomstrad-Jorgensen dan Teori Rantai Werner), (2). sejarah perkembangan teori–teori kimia koordinasi modern (Teori Ikatan valensi, Teori Medan Kristal, Teori Orbital Molekul), (3).Stereokimia Senyawa Koordinasi, (4).Stabilitas Ion Kompleks, (5).Kinetika dan Mekanisme Reaksi Senyawa Kompleks, (6).Pembuatan dan Reaksi Senyawa Kompleks , MANFAAT Dalam kehidupan sehari-hari manusia tidak pernah lepas dari senyawa koordinasi atau senyawa kompleks Memahami dan menjelaskan gejala/ fenomena senyawa kompleks dalam kehidupan sehari-hari MATERI : 1. Arti Penting Kimia Koordinasi, 2. Konsep Dasar Kimia Koordinasi, 3. Teori Kimia Koordinasi Klasik (Teori Koordinasi Bloomstrad-Jorgensen dan Teori Rantai Werner) 4. Teori Ikatan valensi, 5. Teori Medan Kristal, 6. Teori Orbital Molekul, 7. Stereokimia Senyawa Koordinasi, 8. Stabilitas Ion Kompleks, 9. Kinetika dan Mekanisme Reaksi Senyawa Kompleks, 10. Pembuatan dan Reaksi Senyawa Kompleks. RENCANA PERKULIAHAN 1. Pertemuan 1 : Kontrak Perkuliahan, Arti Penting Kimia Koordinasi 2. Pertemuan 2 : Konsep Dasar Kimia Koordinasi 3. Pertemuan 3 : Teori Kimia Koordinasi Klasik (Teori Bloomstrad-Jorgensen dan Teori Rantai Werner) 4. Pertemuan 4 : Teori Ikatan Valensi, 5. Pertemuan 5 dan 6 : Teori Medan Kristal, 6. Pertemuan 7 : Teori Orbital Molekul, 7. Pertemuan 8 : Mid Semester 8. Pertemuan 9 : Stereokimia Senyawa Koordinasi, 9. Pertemuan 10 dan 11 : Stabilitas Ion Kompleks, 10. Pertemuan 12 dan 13 : Kinetika dan Mekanisme Reaksi Senyawa Kompleks, 11. Pertemuan 14 dan 15 : Pembuatan dan Reaksi Senyawa Kompleks, 12. Pertemuan 16 : UAS STRATEGI PERKULIAHAN Ceramah Diskusi Penelusuran literatur Latihan soal PENILAIAN Tugas : Terstruktur (individu, diskusi kelompok) Mid semester Ujian akhir semester Kriteria penilaian 2 tugas 2 mid 3 ujian Nilai Total 7 REFERENSI Sukardjo, 1992, Kimia Koordinasi, PT Rineka Cipta, Jakarta. Nuryono, 1999, Kimia Koordinasi, Jur. Kimia FMIPA UGM Effendy, 2007, Kimia Koordinasi, jilid 1, Bayumedia Publising, Malang Jawa Timur. Basolo, Fred ; Ronald Johson, 1964, Coordination Chemistry, W.A. Benyamin, Inc, New york, Amsterdam. Banerjea, D, 1993, Coordination Chemistry, Tata McGraw-Hill Publishing Company Limited, New Delhi. KESEPAKATAN Masuk kelas paling lambat : 07.10 Kehadiran minimal 75% Mid dan UAS : Tidak ada remidi, tidak ikut mid dan ujian tanpa ijin akan diskwalifikasi (nilai = 0) Pelaporan dan pelengkapan nilai K selambat – lambatnya 7 hari setelah yudisium. CONTACT PERSON Bu Ella : 085730327960 Komting Rombel 1 : Halimi 085642165045 Wakil Komting Rombel 1 : Ferdila 085641388568 Komting Rombel 2 : Lintang 087731484465 Wakil Komting Rombel 2 : Fera 085641474770 Komting Rombel 1 (Pend. Kimia) : Wakil Komting Rombel 1 (Pend. Kimia) : APA ITU KIMIA KOORDINASI?? Ilmu yang membahas tentang senyawa koordinasi Apakah yang disebut senyawa koordinasi? Dan apa bedanya dengan senyawa kompleks? Dapatkah anda memberi contoh senyawa kompleks? ARTI PENTING SENYAWA KOMPLEKS Senyawa Bioanorganik Metalurgi Elektroplating Analisis Kuantitatif dan Kualitatif Katalisator Kesehatan Industri Pengolahan Air 1. SENYAWA BIOANORGANIK HEMOGLOBIN KLOROFIL COENZYM B12 2. METALURGI Ekstraksi Logam dari bijihnya : Emas Au(s) + 8CN-(aq) + O2(g) + H2O(l) 4[Au(CN)2]-(aq) + 4OH-(aq) 4[Au(CN)2]-(aq) + Zn(s) 2Au(s) + [Zn(CN)4]-(aq) o Nikel Ni (s) + 4 CO(g) [Ni(CO)4](g) Ni(CO)4](g) Ni (s) + 4CO(g) 3. ELEKTROPLATING Senyawa lompleks digunakan untuk pelapisan logam. Beberapa logam, misalnya, tembaga, perak dan emas, umumnya disepuhkan dari larutan ion kompleks siano. Pada reaksi elektrolisis, obyek yang disepuh dibuat sebagai katode dan batang tembaga sebagai anode. Anode : Cu + 4CN- → [Cu(CN)4]3- + e Katode: [Cu(CN)4]3- + e- → Cu + 4 CN 4. PENGOLAHAN AIR Penghilangan kesadahan dengan EDTA 4M+ + H4EDTA ↔ M4-EDTA + 4H+ Afinitas logam M dengan EDTA : Na+ < Ba2+ < Mg2+ < Ca2+ < Fe2+ < Cu2+ < Fe3+ 5. KATALISATOR Besi(III)-trifluoroasetat merupakan katalis yang baik digunakan pada reaksi diasetilasi aldehid dan tioasetilasi senyawa karbonil [Fe(EDTA)]- sebagai katalis dalam sintesis Vitamin E. 6. KESEHATAN Terapi khelasi adalah metode pengobatan dengan menggunakan bahan utama EDTA (Ethylene Diamine Tetracetik Acid ) dan nutrien lain yang dilarutkan dalam 500 ml larutan infus steril, kemudian dimasukan ke dalam tubuh langsung melalui pembuluh darah vena. EDTA mengikat logam-logam berat yang banyak masuk kedalam tubuh manusia karena berbagai polusi seperti timah hitam, aluminium, merkuri, dan kadmium. Kompleks kalsium disodium EDTA (CaNa2EDTA) sebagai pengikat logam timbal (Pb) dalam tubuh manusia TUGAS INDIVIDU Membuat makalah : Topik : Arti Penting Kimia Koordinasi dalam Kehidupan Sehari-hari. Topik dapat mengambil dari slide ini ataupun yang lain. Ambil judul (spesifik) selain yang sudah dibahas. Panjang makalah minimal 8 halaman isi. Ketentuan : Kertas A4, huruf Arial 11, spasi 1,5, batas-batas 3 cm atas bawah kanan kiri Struktur : Pandahuluan (latar belakang, tujuan, manfaat), Isi, Penutup (Kesimpulan & Saran), Daftar Pustaka Lengkapi isi dengan gambar struktur senyawa kompleks yang dibahas, sebutkan pula yang mana ligan dan ion pusatnya. Antara satu mahasiswa dengan yang lain tidak boleh sama (dikoordinir Komting dan Wakil Komting) Dikumpulkan melalui email (dalam bentuk pdf atau Word) ke [email protected] dan print outnya paling lambat tanggal 4 Oktober 2012. Makalah akan dibahas sebelum Mid Semester.