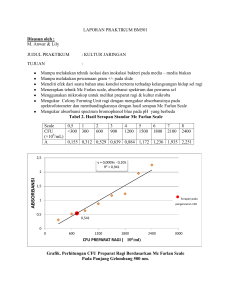
HALAMAN PENGESAHAN Laporan lengkap praktikum Biokimia dengan judul “Fermentasi”, yang telah disusun oleh: Nama : Yunanda Fitri Ramadhani NIM : 1313142011 Kelas : Kimia B Kelompok : VI (enam) telah diperiksa oleh asisten dan koordinator asisten dan dinyatakan diterima. Makassar, Koordinator Asisten Andi Candra Januari 2015 Asisten Dipo Ade Putra Iskandar Mengetahui, Dosen Penanggung Jawab Prof. Dr. Sudding, M.Si . NIP. 19571220 198602 2 001 I. JUDUL PERCOBAAN Fermentasi II. TUJUAN PERCOBAAN Untuk mempelajari kemampuan memfermentasi amilum, glukosa, fruktosa, galaktosa, oleh beberapa jenis inokulum murni ragi roti (Saccharomyces sereviceae), ragi tape, dan inokulum murni Rhizopus oligosporus. III. TINJAUAN PUSTAKA Fermentasi meruPakan proses perubahna kimia yang disebabkan oleh aktivitas mikroorganisme untuk memperoleh energy dengan memecah substrat untuk pertumbuhan dan metabolism dari mikoorganisme tersebut. Proses fermentasi untuk menghasilkan energy berupa ATP berlangsung secara anaerob atau tanpa bantuan oksigen. Dimana ATP yang dihasilkan hanya dengan fosforilasi tingkat subsrat sepanjang terdapat pasokan NAD+ yang cukup untuk menerima electron saat oksidasi. Fermentasi terbagi atas fermentasi alcohol dan fermentasi asam laktat. Dimana fermentasi alcohol berlangsung oleh mikoorganisme melalui pelepasan CO2 dan pembentukan etanol. fermentasi asam laktat oleh fungi dan bakteri tanpa melepas CO2, umumnya digunakan pada pembuatan keju dan yogurt (Campbel, 2002: 174). Fermentasi menggunakan mikroorganisme, dimna mikroorganisme dapat memecah pati menjadi senyawa yang lebih sederhana. Pati merupakan polisakarida yang tersususn atas 20% amilosa dan juga kandungan 80% amilopektin. Dimana amilosa dapat larut sedangkan amilopektin tidak dapat larut bila ditiraturasi secara parsial, dan membentuk D-glukosa apabila dihidrolisis sempurnanya, namun hidrolisis parsialnya menghasilkan maltos dan isomaltosa (Fessenden, 1982: 354). Glukosa dapat diperoleh dengan menghidrolisis amilum dengan asam amino. Namun, apabila dihidrolisis dengan amilase akan membentuk maltose. Hasil hidrolisis amilum dipengaruhi oleh reaktannya. Pada hidrolisis amilum dengan enzim ataupun dengan mikoorganisme. Seperti halnya hidrolisis amilum dengan bakteri tertentu akan menghasilkan sakarida yang lebih sederhana (Sumardjo, 2009: 228). Hasil hidrolisis pati menjadi senyawa yang lebih sederhana oleh adanya mikroorganisme dapat diidentifikasi dengan penetesan iodium. Apabila pati telah mengalami hidrolisis maka akan Nampak zona jernih di atas pemrukaan media. Pemilihan kapang dan khamir dapat mempengaruhi proses fermentasi. Misalnya pada penggunaan kapang mampu menghidrolisis pati walaupun terdapat perbedaan kesempurnaan pada hasil hidrolisisnya. Sehingga kapang dan khamir yang sesuai dapat mempengaruhi proses hidrolisis pati serta fermentasinya. Dimana, kapang dapat mengkonversi pati menjadi glukosa, khamir dapat mengkonversi glukosa menjadi etanol dan karbon dioksida pada proses fermentasi (Meliawati, 2006: 102). Proses fermentasi pada 24 jam pertama merupakan konsumsi gula yang tinggi untuk pertumbuhan Rhizopus oryzae. Glukosa menjadi sumber pembentuk energi dan pembentuk CO2. Dalam pembentuk energi glukosa difermentasi oleh Rhizopus oryzae menjadi asam laktat, etanol dan asam organic lainnya serta energy. Dan pada pembentukan CO2, glukosa diubah menjadi biomassa (Pramudyanti, 2004: 22). Faktor – faktor yang mempengaruhi lama fermentasi yaitu: substrat, suhu, pH, oksigen, dan pH yang digunakan. Dimana substrat yaitu bahan baku fermentasi sebagai penghasil energy bagi mikroba. Misalnya karbohidrat yang dikonversi oleh Saccharomyces cereviceae menjadi etanol oleh enzi, invertase dan zimase. Jika substratnya adalah disakarida, maka enzim invertase akan mengkonversinya menjadi monosakarida dan enzim zimase akan mengubah monosakarisa menjadi etanol. Suhu optimum pembentukan fermentasi yaitu pada 30°C - 35°C puncak produksi. Jika suhu rterlalu rendah, proses akan lambat, dan jika terlalu tinggi maka khamir akan mati / rusak. Dan produksi maksimal etanol dapat dicapai pada pH 4,5. Serta mikroba pemilihannya yang tepat mempengaruhi proses fermentasi pada konversi adanya gula menjadi alcohol (Azizah, 2012: 74-75). Pengaruh pH pada proses fermentasi mempengaruhi prose fermentasi. Bertambahnya waktu fermentasi akan menurunkan kadar glukosa sehingga aktivitas ragi menurun sesuai dengan berkurangnya substrat dan nutrient yang tersedia. Hal ini juga berpengaruh pada jumlah asam organic yang terbentuk sebagai residu dalam pembuatan bioetanol seiring dengan penurunan aktivitas ragi. Reaksi pembentukan etanol dari glukosa berlangsun sesuai persamaan reaksi: C6H12O6 → 2C2H5OH + 2CO2 (glukosa) (etanol) (karbon dioksida) Pemanfaatan fermentasi mikoroganisme secara konvensional sering dijumpai pada pembuatan makanan dan minuman tradisional ytang memberikan aroma dan cita rasa yang khas. Misalnya pada pembuatan beraneka macam tempe (tempe kedelai, tempe bunguk, tempe ampas kacang tanah, atau tempe bungkil dengan menggunakan Rhizopus oligosporus, Rhizopus arhizus), pada fermentasi oncom dengan menggunakan Neurospora intermedia, fermentasi tauco dengan Rhizopus oryzae, pembuatan kecap dengan Aspergilus oryzae, dan lain-lain (Gandjar, 2006: 126). Proses fermentasi menggunakan amilum dengan adanya ragi dapat diidentifikasi apakah khamir dan kapang dapat menghidrolisis amilum menjadi senyawa yang lebih sederhana dengan beberapa pengujian. Yaitu uji benedict, uji fehling, dan uji tollens. Ketiga pereaksi ini akan menghasilkan uji positif pada gula pereduksi, dimana fehling juga demikian, dan uji tollens akan menghasilkan cermin perak (Sumardjo, 2009: 237). IV. ALAT DAN BAHAN A. Alat 1. Autoclaft 1 buah 2. Batang pengaduk 1 buah 3. Botol semprot 1 buah 4. Gelas kimia 25 ml 3 buah 5. Gelas ukur 10 ml 1 buah 6. Gelas ukur 25 ml 2 buah 7. Lap kasar dan halus 1 buah 8. Pipet tetes 1 buah 9. Plat tetes 1 buah 10. Rak tabung reaksi 1 buah 11. Spatula 1 buah 12. Tabung reaksi 15 buah B. Bahan 1. Amilum 1 % (C6H10O5)n 2. Aquades (H2O) 3. Fruktosa (C6H12O6) 4. Galaktosa (C6H12O6) 5. Glukosa (C6H12O6) 6. Iod 0,1% (I2) 7. Pereaksi benedict (Cu2+) 8. Pereaksi tollens (Ag(NH2)2OH) 9. Kapas penutup 10. Ragi roti 11. Ragi tape 12. Ragi tempe V. PROSEDUR KERJA A. Tes hidrolisis pati 1. Suspensi ragi roti, ragi tape, dan ragi tempe dilarutkan ke dalam 25 ml aquades 2. Sebanyak 1 ml larutan amilum dimasukkan ke 10 lubang plat tetes dan diberi penomoran 1-10 3. Pada plat tetes nomor 2,3,4 ditambahkan masing-masing 1 ml suspense ragi roti, ragi tape, dan ragi tempe, lubang 5,6,7 ditambahkan 1 ml suspensi ragi tape dan lubang 8,9,10 ditambahkan 1 ml suspense ragi tempe. Dan nomor 1 ditambahkan air sebagai kontrol 4. Setelah 5 menit, masing-masing lubang 2,5,8 ditambahkan iod 0,1%, setelah 10 menit pada 3,6,9, dan setelah 15 menit pada 4,7,10 5. Masing-masing perubahan dicatat dan disimpulkan berdasarkan data B. Fermentasi alcohol 1. Sebanyak 15 buah tabung reaksi disipakan di atas rak tabung 2. Larutan pati 1% dimasukkan pada tabung reaksi 1,2,3 ditutup dengan kapas 3. Hal yang sama dilakukan pada tabung reaksi lain dengan masin-masing larutan glukosa, fruktosa, dan galaktosa Ke-12 tabung reaksi disterilisasi pada suhu 110°C selama ± 10 menit 4. VI. HASIL PENGAMATAN A. Tes hidrolisis pati No. 1. Aktivitas Lubang 1 4 tetes amilum + 4 tetes H2O (tak berwarna) 2. Lubang 2,3,4 (tak berwarna) Larutan keruh (tes hidrolisis) Lubang 5,6,7 4 tetes amilum + 4 tetes suspensi ragi tape (tak berwarna) 4. Larutan tak berwarna (tes hidrolisis) 4 tetes amilum + 4 tetes suspensi ragi roti 3. Pengamatan Larutan keruh (tes hidrolisis) Lubang 8,9,10 4 tetes amilum + 4 tetes suspensi ragi Larutan keruh tempe (tak berwarna) 5. Setelah 5 menit, pada lubang 2,5,8 Larutan biru muda (lubang 2), Campuran + 1 tetes iod 0,1 % berwarna biru (lubang 5 dan 8) (keruh) 6. (tes hidrolisis) (kuning) Setelah 10 menit, pada lubang 3,6,9 Larutan berwarna biru Campuran + 1 tetes iod 0,1 % (lubang 3,6,9) (keruh) (kuning) 7. Setelah 15 menit, pada lubang 4,7,10 Campuran + 1 tetes iod 0,1 % (keruh) 8. (kuning) Larutan berwarna biru tua (lubang 4,7,10) Pada tabung1, sebagai kontrol Air + 1 tetes iod 0,1 % Larutan berwarna biru (tak berwarna) (kuning) B. Fermentasi alcohol No. 1. Aktivitas Masukkan larutan pati 1% pada tabung 1,2,3 Pengamat Larutan tak berwarna (tutup dengan kapas), dan disterilisasi 2. Masukkan larutan glukosa pada tabung 4,5,6 Larutan tak berwarna (tutup dengan kapas), dan disterilisasi 3. Masukkan larutan fruktosa pada tabung 7,8,9 Larutan tak berwarna (tutup dengan kapas), dan disterilisasi 4. Masukkan larutan galaktosa pada tabung Larutan tak berwarna 10,11,12 (tutup dengan kapas), dan disterilisasi 5. Tambahkan ragi roti pada tabung reaksi 1,4,7,10 Larutan keruh dan diinkubasi 6. Tambahkan ragi roti pada tabung reaksi 2,5,8,11 Larutan keruh dan diinkubasi 7. Tambahkan ragi roti pada tabung reaksi 3,6,9,12 Larutan keruh dan diinkubasi 8. 9. Memeriksa adanya gas CO2 dengan Tabung 1 terdapat CO2, menggoyang-goyangkan setiap percobaan tabung 2-12 tidak ada CO2 Memeriksa adanya bau alkohol dengan mencium Tabung 1-6 dan 8-12 tidak bau pada mulut tabung terdapat bau alcohol, Tabung 7 ada bau alcohol 10. Tabung 1-3 dilakukan uji benedict dan uji tollens Uji benedict Tabung 1 dan 3 : Tabung 2 : endapan merah Uji tollens Tabung 1- 3 : tidak ada cermin perak VII. PEMBAHASAN Percobaan ini bertujuan untuk mempelajari kemampuan memfermentasi amilum, glukosa, fruktosa, dan galaktosa oleh beberapa jenis inokulum murni ragi roti (Saccharomyces cereviceae), ragi tape, dan inokulum murni Rhizopus oligosporus. Dimana percobaan ini dilakukan melalui dua tahapan percobaan, yaitu: A. Tes hidrolisis pati Percobaan ini dilakukan untuk menguji amilum atau pati yang dihidrolisis menjadi glukosa dengan penambahan mikroba yaitu ragi roti, rage tape, dan ragi tempe dalam suspensinya. Mikroba pada beberapa jenis jenis ragi ini disuspensikan dengan air agar mudah direaksikan pada fasa cair. Percobaan ini menggunakan plat tetes sebagai media yang telah diisi amilum 1% pada nomor plat tetes 1-10. Lubang plat tetes nomor 2,3,4 diisi dengan suspensi ragi roti, lubang plat tetes nomor 5,6,7 diisi dengan suspensi ragi tape, dan lubang plat tetes nomor 8,9,10 diisi dengan suspensi ragi tempe, serta lubang plat tetes nomor 1 diisi dengan aquades sebagai kontrol. Penambahan suspensi ragi berfungsi untuk membandingkan ragi mana yang dapat menghidrolisis pati menjadi monomer-monomernya, yaitu monosakarida / oligosakarida. Pada lubang yang diisi suspensi ragi roti menghasilkan larutan keruh. Hal ini sesuai denga teori, dimana ragi roti mengandung kapang dan khamir, dimana kapang dapat menghidrolisis pati (Katrika, 2014: 6). Pada lubang yang diisi suspensi ragi tempe juga menghasilkan larutan keruh, dikarenakan amilum telah terhidrolisis menjadi amilopektin. Hal ini sesuai dengan teori dimana ragi tempe terdiri atas kapang (Rhizopus oligosporus) dapat mengkonversi pati menjadi glukosa (Tim Dosen Biokimia, 2014: 1). Menurut reaksi: HOCH2 O HOCH2 HOCH2 OH O OH HOCH2 OH O O H2O OH H2O OH O O OH OH HOCH2 HOCH2 OH OH glukosa OH O OH (pati) OH O O O OH amilopektin Lubang yang diisi suspensi ragi tape menghasilkan larutan keruh. Hal ini sesuai dengan teori, dimana ragi tape terdapat mikroba Rhizopus aspergillus yang dapat menghidrolisis amilum menjadi glukosa (Bsuka, 2014: 1). Interval waktu tertentu, setiap plat ditambah dengan larutan iod 0,1 N yang berfungsi untuk mengetahui pembentukan kompleks dengan perubahan warna menjadi biru tua dan saat pati terhidrolisis maka warna biru akan semakin memudar atau hilang seiring lamanya proses hidrolisis (Fessenden, 1982: 354). Setiap plat tetes yang tambahkan dengan iod berubah menjadi warna biru dengan intensitas warna yang berbeda. Plat nomor 2 menghasilkan warna bitu muda, plat nomor 1,3,5,6,8,9 berwarna biru, dan plat nomor 4,7,10 berwarna biru tua yang diperoleh tidak sesuai dengan teori, dimana semakin lama waktu yang digunakan maka amilum semakin terhidrolisis dan intensitas warna biru akan semakin memudar (Fessenden, 1982: 354). Adapun reaksi antara sakarida dan larutan iod, yaitu: (C6H10O5)n + H2O + I2 (sakarida) (C6H10O5)nI + H2 (kompleks iodin amilum) B. Fermentasi alkohol Percobaan ini bertujuan untuk mempelajari kemampuan memfermentasi amilum, glukosa, fruktosa, dan galaktosa oleh bebrapa jenis mikroba yaitu ragi roti, ragi tape, tagi tempe yang ditandai dengan terbentuknya alkohol dan karbon dioksida. Percobaan ini dilakukan dengan mengisis 3 tabung reaksi dengan amilum, glukopsa, fruktosa, dan galaktosa. Setiap tabung ditutup dengan kapas dan disterilisasi pada suhu 110ºC. atbung reaksi ditutup dengan kapas berfungsi agar tidak ada oksigen yang masuk karena fermentasi yang dilakukan adalah reaksi anaerob yang tidak memerlukan adanya oksigen. Tabung disterilisasi untuk mematikan mikoorganisme yang dapat mengganggu proses fermentasi. Dan pada tabung yang berisis amilum ditambahkan suspense ragi roti, ragi tape, dan ragi tempe. Dan dilakukan hal yang sama pada tabung yang berisis glukosa, fruktosa dan galaktosa. Tabung reaksi ini diinkubasi dalam autoclaft agar reaksi dapat berlangsung maksimal. Setelah diuji dengan menggoyangkan tabung, dideteksi adanya bau alcohol pada tabung reaksi 7 yang berisi fruktosa dan ragi roti, serta adanya CO2 hanya pada tabung reaksi 1 yang berisi amilum menjadi glukosa, lalu menjadi alcohol dan CO2 oleh adanya mikroba Saccharomyces cereviceae. Seharusnya terjadi uji positif di tabung yang ditambahkan amilum, glukosa, fruktosa, galaktosa dengan ragi roti dan ragi tape (Tim Dosen Biokimia, 2014: 1). Reaksi fermentasi yaitu: C6H12O6 → 2C2H5OH + 2CO2 + 2 ATP (glukosa) (etanol)(karbon dioksida) Pengujian tabung yang berisi amilum dan ketiga jenis ragi, menghasilkan endapan merah pada tabung 2 yang berisi amilum dan ragi tape ketika ditambahkan pereaksi benedict. Hal ini sesuai denga teori, namun ragi roti dan ragi tempe juga dapat mengkonversi amilum menjadi glukosa, dan kemudian dapat mereduksi pereaksi benedict akibat ion Cu2+ yang tereduksi menjadi Cu2O yang berupa endapan merah bata oleh glukosa tersebut (Sumardjo, 1990: 237). Reaksinya yaitu: HOCH3 HO COOH O + OH glukosa OH 2Cu2+ O + H2O OH O + C H HO OH Cu2O endapan merah bata + 2 H+ Pengujian dengan pereaksi tollens tidak ada yang membentuk cermin perak. Hal ini tidak sesuai dengan teori, dimana amilum dapat mengkonversi menjadi glukosa oleh ragi roti, ragi tape, ragi tempe yang kemudian dapat mereduksi tollens dengan terbentuknya cermin perak (Ag), yang melekat pada dinding tabung (Sumardjo, 2009: 238). Reaksinya yaitu: HOCH3 HO COONH2 O + OH O Ag(NH2)2OH OH glukosa OH O + C H HO Ag + H 2O cermin perak OH Penyimpangan yang terjadi pada percobaan disebabkan bahan yang digunakan telah terkontaminasi dengan zat lain atau mikroba lain sehingga rekasi tidak berlangsung sebagaimana mestinya. VIII. PENUTUP A. Kesimpulan Berdasarkan percobaan yang telah dilakukan dapat disimpulkan bahwa ragi roti, ragi tape, dan ragi tempe dapat mengkonversi amilum menjadi gula sederhana oleh adanya kapang (Rhizopus atau Asspergillus). Dan hanya ragi roti dan ragi tape yang dapat mengkonversi gula menjadi alcohol dan karbon dioksida oleh adanya khamis yang sama pada kedua ragi yaitu Saccharomyces cereviceae. B. Saran Diharapkan agar memperhatikan kebersihakn alat yang digunakan serta bahanbahan untuk percobaan masih murni (tidak terkontaminasi) oleh zat lain karena proses fermentasi dapat terganggu oleh mikroba dan dapat merusak proses percobaan. DAFTAR PUSTAKA Azizah, dkk. 2012. Pengaruh Lama Fermentasi Terhadap Kadar Alkohol, pH, dan Produksi Gas pada Proses Fermentasi Bioetanol dari Whey dengan Substitusi Kulit Nanas. Jurnal Aplikasi Teknologi Panas, Vol. 12, No. 2. Fessenden, dkk. 2012. Kimia Organik. Jakarta: Erlangga. Gandjar, Indrawati, dkk. 2006. Mikologi Dasar dan Terapan. Jakarta: Yayasan Obor Indonesia. Melliawati, Ruth, dkk. 2006. Seleksi Mikroorganisme Potensial untuk Fermentasi Pati Sagu. Jurnal Biodiversitas, Vol. 7, No. 2. Pramudyanti, Idayu R, dkk. 2004. Pengaruh Pengaturan pH dengan CaCO3 terhadap Produksi Asam Laktat dari Glukosa oleh Rhizopus Oryzae. Jurnal Bioteknologi, Vol.1, No. 1. Reece, Campbell, dkk. 2013. Kinetika Reaksi Fermentasi Glukosa Hasil Hidrolisis Pati Biji Durian Menjadi Etanol. Kimia Stundent Journal, Vol.2, No. 1. Sumardjo, Damin, 2009. Pengantar Kimia. Jakarta: Penerbit Buku Kedokteran EGC.