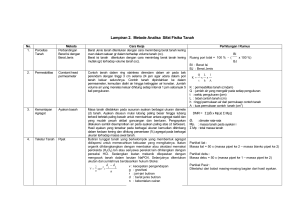
PRAKTIKUM KIMIA ANALITIK LAPORAN HASIL PERCOBAAN XII TITRASI PEMBENTUKAN KOMPLEKS OLEH: PUTU CIPTAYANI PARTAMA PUTRI 1613031001 MELISA CHRISTIN DIANA DARA 1613031008 ZEFFANYA DANIELLA 1613031021 I GUSTI AYU AGUNG NGURAH DIANA WATI 1613031038 KELAS: VIA UNIVERSITAS PENDIDIKAN GANESHA SINGARAJA 2019 PERCOBAAN XII TITRASI PEMBENTUKAN KOMPLEKS I. Tujuan a. Menentukan derajat kesadahan air dengan titrasi pembentukan kompleks. II. Dasar Teori Titrasi pembentukan kompleks biasa disebut kompleksometri. Kompleksometri adalah jenis titrasi dimana titran dan titrat saling membentuk kompleks. Senyawa kompleks terbentuk dari suatu reaksi ion logam, yaitu kation dengan suatu anion atau molekul netral. Ion logam didalam kompleks disebut atom pusat dan kelompok yang terikat pada atom pusat disebut ligan. Jumlah ikatan terbentuk oleh atom logam pusat disebut bilangan koordinasi dari logam. Reaksi membentuk kompleks dapat dianggap sebagai reaksi asam-basa menurut Lewis dengan ligan bekerja sebagai basa dengan memberikan sepasang elektron, kepada kation yang merupakan suatu asam. Sejumlah senyawa organik dapat membentuk senyawa kompleks dengan ion logam, terutama senyawa organik yang mengandung nitrogen. Senyawa pembentuk kompleks ini disebut sebagai komplekson. Dalam analisis titrimetri dipilih komplekson yang dapat membentuk kompleks secara kuantitatif. Umumnya, dalam penentuan ion-ion logam secara kompleksometri digunakan EDTA (ethylene diamine tetraacetate acid atau asam etilena diamina tetraasetat) sebagai zat pembentuk kompleks khelat atau komplekson. Senyawa EDTA umumnya digunakan sebagai komplekson dalam analisis kompleksometri karena beberapa alasan berikut ini. 1. Senyawa EDTA selalu membentuk kompleks ketika direaksikan dengan ion logam 2. Kestabilannya dalam membentuk kelat sangat konstan sehingga reaksi berjalan sempurna, kecuali dengan logam alkali 3. Senyawa EDTA dapat bereaksi cepat dengan banyak jenis ion logam 4. Senyawa EDTA telah dikembangkan indikatornya secara khusus untuk komplekson EDTA yaitu Erio T 5. Senyawa EDTA mudah diperoleh bahan baku primernya 6. Senyawa EDTA dapat digunakan baik sebagai bahan yang dianalisis maupun sebagai bahan untuk standarisasi Senyawa EDTA ini bersifat sebagai asam dikarboksilat dengan dua gugus yang bersifat asam kuat dan dua proton amonium yang masing-masing terionisasi pada pH 6,3 dan 11,5. Rumus molekul dari EDTA adalah H4C10H12O8N2 atau sering disingkat H4Y. HO O C CH2 CH2 N CH2 CH2 OC HO CH2 OH CO N CH2 C O OH Gambar 1. Struktur molekul EDTA Dalam analisis volumetri yang sering digunakan adalah garam dinatrium dari asam tersebut yakni Na2H2C10H12O8N2 atau sering disingkat Na2H2Y. Di dalam air, garam ini terionisasi membentuk ion bivalen H2Y2-. Na2H2Y(aq) 2Na+(aq) + H2Y2-(aq) Senyawa EDTA akan bereaksi dengan ion logam yang polivalen seperti Al3+, Bi3+, Ca2+, Cu2+ membentuk senyawa atau kompleks khelat yang stabil dan larut dalam air. Kompleks logam EDTA adalah kompleks 1 : 1, artinya 1 mol ion logam selalu mengikat 1 mol EDTA dengan melepaskan 2 mol ion H+ sesuai persamaan reaksi berikut. Mn+(aq) + H2Y2-(aq) MY(n-4)(aq) + 2H+(aq) Misalkan ion logamnya adalah Zn2+, maka reaksi EDTA dengan Zn2+ adalah sebagai berikut. Zn2+(aq) + H2Y2-(aq) ZnY2-(aq) + 2H+(aq) Dari reaksi tersebut dapat dinyatakan bahwa penambahan EDTA menyebabkan pH makin kecil dan konsentrasi ion logam makin kecil (pM atau power of metal atau derajat logam semakin besar). Seperti pada titrasi umumnya, titrasi kompleksometri dapat ditentukan dengan adanya penambahan indikator yang berguna sebagai tanda tercapai titik akhir titrasi. Sebagian besar titrasi kompleksometri menggunakan indikator yang juga bertindak sebagai pengompleks dan tentu saja kompleks logamnya mempunyai warna yang berbeda dengan pengompleksnya sendiri. Indikator demikian disebut indikator metalokromat. Beberapa contoh indikator metalokromat antara lain Eriochrome black T, pyrocatechol violet, xylenol orange, kalmagit, 1-(2-piridil-azonaftol), PAN, zincon, asam salisilat, metafalein, dan calcein blue (Khopkar, 2002). Dalam titrasi dengan menggunakan EDTA, indikator yang paling umum digunakan dalam titrasi kompleksometri adalah Eriochrome black T atau Erio T dengan rumus kimia NaH2In. Indikator Erio T memenuhi setidaknya tiga syarat suatu indikator ion logam dapat digunakan pada pendeteksian visual dari titik-titik akhir titrasi, yaitu sebagai berikut. 1. Reaksi warna harus sedemikian sehingga sebelum titik akhir, bila hampir semua ion logam telah berkompleks dengan EDTA, larutan akan berwarna kuat. Selain itu, reaksi warna itu haruslah spesifik (khusus), atau sedikitnya selektif. Senyawa Erio T jika terdapat di dalam air, maka senyawa ini akan terionisasi memberikan ion berwarna yang berbedabeda dan spesifik sesuai persamaan reaksi berikut. Na+(aq) + H2In-(aq) NaH2In(aq) pH H2In-(aq) HIn2-(aq) + H+(aq) 5,3 – 7,3 Merah Biru pH HIn2-(aq) In3-(aq) + H+(aq) 10,5 – 12,5 Biru Jingga kekuningan 2. Senyawa kompleks antara logam dan Erio T (kompleks logam – indikator) itu harus memiliki kestabilan yang cukup. Jika senyawa kompleks logam – indikator tidak stabil, maka tidak akan diperoleh perubahan warna yang tajam karena senyawa kompleks tersebut akan terdisosiasi dengan sendirinya. Seperti pada persamaan reaksi sebelumnya pada poin 1, pada pH 7 – 11 warna indikator Erio T adalah biru, tetapi dengan adanya ion logam seperti Mg2+, Ca2+ atau Zn2+, warnanya berubah menjadi merah anggur dari kompleks antara logam dan Erio T (kompleks logam – indikator). Stabilitas kompleks logam – indikator ini harus lebih rendah dari kompleks logam – EDTA, sehingga memungkinkan terjadinya reaksi substitusi seperti berikut. Mg2+(aq) + HIn2-(aq) MgIn-(aq) + H+(aq) Biru Merah anggur MgIn-(aq) + H2Y2-(aq) MgY2-(aq) + HIn2-(aq) + H+(aq) Merah anggur Biru Apabila ke dalam larutan yang mengandung ion Mg2+ dan Ca2+ ditambahkan beberapa tetes indikator Erio T, maka mula-mula akan terbentuk kompleks MgIn- yang berwarna merah anggur, bukan terbentuk kompleks CaIn-. Hal ini disebabkan karena kompleks MgIn- memiliki kestabilan yang lebih tinggi daripada kompleks CaIn-. Kemudian, apabila kompleks ini dititrasi dengan EDTA, maka mula-mula EDTA akan bereaksi dengan Ca2+, kemudian Mg2+ dan terakhir baru dengan kompleks MgIn-, sehingga terjadi perubahan warna dari warna merah anggur menjadi warna biru. 3. Kontras warna antara indikator bebas dan kompleks-indikator logam harus sedemikian sehingga mudah diamati. Indikator harus sangat peka terhadap ion logam (yaitu, terhadap pM) sehingga perubahan warna terjadi sedikit mungkin dengan titik ekuivalen (Roth, 1998). Titrasi kompleksometri pada percobaan ini digunakan untuk menentukan derajat kesadahan air. Air sadah adalah air yang banyak mengandung garam-garam Ca dan Mg yang terlarut di dalamnya. Kesadahan air dapat ditentukan dengan cara menentukan kesadahan sementara terlebih dahulu dan kemudian menentukan kesadahan tetapnya. Kesadahan sementara disebabkan oleh garam-garam bikarbonat yang pada pemanasan akan memberikan endapan karbonat normal, sementara kesadahan tetap biasanya disebabkan oleh garam-garam CaCl2, CaSO4, MgCl2, dan MgSO4. Tingkat kesadahan air sering dinyatakan dengan derajat kesadahan Prancis. Derajat kesadahan Prancis menyatakan banyaknya garam yang ekivalen dengan jumlah CaCO3 dalam 100 liter air. (Selamat, dkk., 2004) III. Alat dan Bahan Tabel 1. Rincian Alat yang Digunakan No. Nama Alat Ukuran Jumlah 1. Buret - 1 buah 2. Statif - 1 buah 3. Klem - 1 buah 4. Labu ukur 250 mL 1 buah 5. Pipet volumetrik 5 mL 1 buah 6. Pipet tetes - 3 buah 7. Gelas kimia 100 mL 5 buah 8. Gelas kimia 250 mL 1 buah 9. Labu Erlenmeyer 50 mL 2 buah 10. Labu Erlenmeyer 100 mL 1 buah 11. Corong kaca - 1 buah Tabel 2. Rincian Bahan yang Digunakan No. Nama Bahan 1. Air keran 2. Larutan ZnSO4 3. Larutan buffer salmiak (pH = 10) 4. Larutan indikator Erio T 5. Larutan EDTA 6. Akuades Konsentrasi Jumlah - 265 mL 0,01 M 15 mL - 20 mL - 5 mL 0,01 M 80 mL - 50 mL IV. Prosedur Kerja dan Hasil Pengamatan Tabel 3. Prosedur Kerja dan Hasil Pengamatan No. Prosedur Kerja Hasil Pengamatan A. Penghilangan Kesadahan Sementara Air 1. Sebanyak 250 mL air sadah (air - Air sadah: cairan tidak berwarna keran) dan tidak berbau. dididihkan selama 30 menit, didinginkan lalu air sadah - Ketika tersebut dididihkan, disaring. Filtrat ini air sadah yang sudah didinginkan, lalu dimasukkan ke dalam labu ukur disaring tersebut dicampur dengan 250 mL dan ditambahkan dengan akuades, maka akan air sadah tidak akuades sampai tanda batas. berubah warna sehingga air tersebut tetap tidak berwarna. Gambar 2. Air sadah yang sudah dididihkan, didinginkan, dan dicampur dengan akuades B. Standarisasi Larutan EDTA 1. Sebanyak 5 mL larutan standar - Larutan ZnSO4 dimasukkan ke dalam labu berwarna dan tidak berbau Erlenmeyer. Larutan buffer salmiak: larutan Larutan tersebut - ZnSO4: larutan tidak ditambahkan 2 mL larutan buffer tidak berwarna dan tidak berbau salmiak dan 3 tetes indikator Erio - Larutan indikator Erio T: larutan T. berwarna hitam kebiruan dan tidak berbau - Larutan standar ZnSO4 + larutan buffer salmiak + indikator Erio T: campuran berubah warna dari tidak berwarna menjadi warna merah muda - Labu Erlenmeyer yang digunakan sebanyak 3 labu yang berukuran 25 mL (Labu I), 50 mL (Labu II), dan 50 mL (Labu III) Gambar 3. Larutan ZnSO4 Gambar 4. Larutan buffer salmiak Gambar 5 dan 6. Larutan indikator Erio T Gambar 7. Campuran antara larutan ZnSO4, larutan buffer salmiak, dan indikator Erio T 2. Larutan tersebut dititrasi dengan - Larutan larutan EDTA sampai terjadi berwarna dan tidak berbau perubahan Warna larutan sebelum dititrasi: warna dari merah - EDTA: larutan anggur menjadi biru. Volume warna merah muda titran yang digunakan dicatat. - Warna larutan setelah Titrasi ini diulangi untuk dua kali warna biru pengulangan. tidak dititrasi: Titrasi dilakukan hingga warna larutan berubah warna dari merah anggur menjadi biru. Volume EDTA yang diperlukan pada setiap kali titrasi adalah sebagai berikut. Nomor Volume Volume Labu ZnSO4 EDTA Labu 1 5 mL 21,62 mL Labu 2 5 mL 21,95 mL Labu 3 5 mL 22,10 mL Tabel 4. Hasil titrasi campuran larutan ZnSO4, larutan buffer salmiak, dan indikator Erio T dengan larutan EDTA Gambar 8 dan 9. Larutan EDTA Gambar 10. Hasil titrasi campuran larutan ZnSO4, larutan buffer salmiak, dan indikator Erio T dengan larutan EDTA C. Penentuan Kesadahan Total Air 1. Sebanyak 5 mL sampel air sadah - Sampel air keran: air yang tidak (air keran) dimasukkan ke dalam berwarna dan tidak berbau labu Larutan buffer salmiak: larutan Erlenmeyer. Sampel air - tersebut ditambahkan 2 mL buffer tidak berwarna dan tidak berbau salmiak dan 4 tetes indikator Erio - Larutan indikator Erio T: larutan T. berwarna hitam kebiruan dan tidak berbau - Sampel air keran + larutan buffer salmiak + indikator Erio T: larutan berubah warna dari tidak berwarna menjadi warna merah muda - Labu Erlenmeyer yang digunakan sebanyak 3 labu yang berukuran 25 mL (Labu I), 50 mL (Labu II), dan 50 mL (Labu III) 2. Larutan tersebut dititrasi dengan - Larutan EDTA: larutan larutan EDTA sampai terjadi berwarna dan tidak berbau tidak perubahan warna dari merah - Warna larutan sebelum dititrasi: anggur menjadi biru. Volume warna merah muda titran yang digunakan dicatat. - Warna larutan setelah Titrasi ini diulangi untuk dua kali warna biru pengulangan. digunakan Titrasi untuk dititrasi: ini Titrasi dilakukan hingga warna larutan penentuan berubah warna dari merah anggur kesadahan total air dalam derajat menjadi biru. Volume EDTA yang kesadahan Prancis. diperlukan pada setiap kali titrasi adalah sebagai berikut. Nomor Volume Volume Labu Air Sadah EDTA Labu 1 5 mL 2,95 mL Labu 2 5 mL 2,00 mL Labu 3 5 mL 2,19 mL Tabel 5. Hasil titrasi campuran air sadah, larutan buffer salmiak, dan indikator Erio T dengan larutan EDTA Gambar 11. Hasil titrasi campuran air sadah, larutan buffer salmiak, dan indikator Erio T dengan larutan EDTA D. Penentuan Kesadahan Tetap dari Air 1. Sebanyak 5 mL sampel air dari - Sampel air dari hasil prosedur hasil nomor A: air yang tidak berwarna prosedur dimasukkan Erlenmeyer. ke nomor dalam Sampel A labu itu - dan tidak berbau Larutan buffer salmiak: larutan ditambahkan 2 mL larutan buffer tidak berwarna dan tidak berbau salmiak dan 4 tetes indikator Erio - Larutan indikator Erio T: larutan T. berwarna hitam kebiruan dan tidak berbau - Sampel air nomor A + larutan buffer salmiak + indikator Erio T: larutan berubah warna dari tidak berwarna menjadi warna merah muda - Labu Erlenmeyer yang digunakan sebanyak 3 labu yang berukuran 25 mL (Labu I), 50 mL (Labu II), dan 50 mL (Labu III) Gambar 12. Campuran antara sampel air nomor A, larutan buffer salmiak, dan indikator Erio T 2. Larutan tersebut dititrasi dengan - Larutan larutan EDTA sampai terjadi berwarna dan tidak berbau perubahan Warna larutan sebelum dititrasi: warna dari merah - EDTA: larutan anggur menjadi biru. Volume warna merah muda titran yang digunakan dicatat. - Warna larutan setelah Titrasi ini diulangi untuk dua kali warna biru pengulangan. digunakan Titrasi untuk tidak dititrasi: ini Titrasi dilakukan hingga warna larutan penentuan berubah warna dari merah anggur kesadahan tetap air dalam derajat menjadi biru. Volume EDTA yang kesadahan Prancis. diperlukan pada setiap kali titrasi adalah sebagai berikut. Nomor Volume Volume Labu Sampel EDTA Air Labu 1 5 mL 1,75 mL Labu 2 5 mL 1,82 mL Labu 3 5 mL 1,95 mL Tabel 6. Hasil titrasi campuran sampel air nomor A, larutan buffer salmiak, dan indikator Erio T dengan larutan EDTA Gambar 13. Hasil titrasi campuran sampel air nomor A, larutan buffer salmiak, dan indikator Erio T dengan larutan EDTA V. Pembahasan Pada praktikum kali ini dilakukan penentuan kesadahan air secara kompleksometri. Titrasi kompleksometri dilakukan untuk senyawa-senyawa logam. Kompleks dibentuk melalui reaksi ion logam, sebuah kation, dengan sebuah anion atau molekul netral yang larut namun sedikit terdisosiasi. Pada percobaan ini ion Ca2+ yang terdapat dalam air sadah berperan sebagai ion logam dalam kompleks dengan larutan indikator Erio T. Larutan baku yang digunakan adalah EDTA yang akan dibakukan terlebih dahulu dengan ZnSO4. Berikut ini adalah tahap-tahap yang dilakukan dalam percobaan ini. a) Pembuatan larutan indikator Erio T Larutan indikator Erio T (Eriochrome black T) (C20H12N3O7SNa atau NaH2In) adalah larutan Erio T dalam campuran antara trietanolamina dan etanol absolut atau larutan Erio T dalam etanol. Larutan ini berwarna hitam kebiruan dan tidak berbau. Percobaan kali ini menggunakan larutan indikator Erio T yang dibuat dengan melarutkan 0,2 gram padatan Erio T dalam 100 mL etanol sesuai perhitungan berikut ini. 𝑚𝑎𝑠𝑠𝑎 𝑝𝑎𝑑𝑎𝑡𝑎𝑛 𝑁𝑎𝐻2 𝐼𝑛 = 0,2 𝑔𝑟𝑎𝑚 𝑔𝑟𝑎𝑚 𝑚𝑎𝑠𝑠𝑎 𝑚𝑜𝑙𝑎𝑟 𝑁𝑎𝐻2 𝐼𝑛 = 461,381 ⁄𝑚𝑜𝑙 𝑣𝑜𝑙𝑢𝑚𝑒 𝑙𝑎𝑟𝑢𝑡𝑎𝑛 𝑁𝑎𝐻2 𝐼𝑛 = 100 𝑚𝐿 [𝑁𝑎𝐻2 𝐼𝑛] = 𝑚𝑎𝑠𝑠𝑎 𝑝𝑎𝑑𝑎𝑡𝑎𝑛 𝑁𝑎𝐻2 𝐼𝑛 1000 × 𝑚𝑎𝑠𝑠𝑎 𝑚𝑜𝑙𝑎𝑟 𝑁𝑎𝐻2 𝐼𝑛 𝑣𝑜𝑙𝑢𝑚𝑒 𝑁𝑎𝐻2 𝐼𝑛 (𝑚𝐿) [𝑁𝑎𝐻2 𝐼𝑛] = 0,2 𝑔𝑟𝑎𝑚 1000 × 𝑔𝑟𝑎𝑚 461,381 ⁄𝑚𝑜𝑙 100 𝑚𝐿 [𝑁𝑎𝐻2 𝐼𝑛] = 4,335 × 10−3 𝑀 Jadi, konsentrasi larutan Erio T yang digunakan pada percobaan kali ini adalah 4,335 × 10−3 𝑀. Pada percobaan ini, larutan Erio T sudah dibuat oleh laboran sehingga penulis tidak membuat larutan Erio T. b) Pembuatan larutan buffer salmiak Larutan buffer salmiak merupakan larutan buffer yang terbentuk dari campuran larutan NH3 (basa lemah) dengan NH4Cl (garam dari NH3). Larutan ini merupakan larutan yang tidak berwarna dan tidak berbau. Pada percobaan ini, larutan buffer salmiak dibuat dengan 𝑝𝐻 = 10 , dengan cara melarutkan 17,5 gram NH4Cl dalam 142 mL NH3 pekat dengan berat jenisnya 0,88 − 0,90 𝑘𝑔⁄ 𝑚3 dan diencerkan dengan akuades sampai volumenya 250 mL. Terbentuk larutan buffer pada sistem ini disebabkan karena persamaan reaksi berikut. NH3(aq) + H2O(l) NH4Cl(aq) NH4+(aq) + OH-(aq) NH4+(aq) + Cl-(aq) Larutan buffer salmiak digunakan dalam titrasi kompleksometri untuk menciptakan suasana basa, karena pH = 10. Adanya larutan EDTA yang distandarisasi terlebih dahulu dengan ZnSO4 perlu untuk dilakukan. Ion Zn2+ dalam ZnSO4 berfungsi untuk menghindari pengendapan yang terjadi akibat buffer salmiak. Pada percobaan ini, larutan buffer salmiak ini sudah dibuat oleh laboran sehingga penulis tidak membuat larutan buffer salmiak. c) Pembuatan larutan EDTA 0,01 M Senyawa EDTA atau asam etilena diamina tetraasetat merupakan senyawa dengan rumus kimia H4C10H12O8N2 atau biasa disingkat H4Y. Senyawa ini pada umumnya ada pada fasa larutannya dalam bentuk garam Na-nya, sehingga rumus kimianya menjadi Na2H2C10H12O8N2 atau Na2H2Y. Pada percobaan kali ini, penulis menggunakan larutan EDTA dalam akuades. Larutan ini merupakan larutan yang tidak berwarna dan tidak berbau. Larutan ini dibuat dengan cara mengoven serbuk atau kristal Na2H2Y pada suhu 80oC dan selanjutnya didinginkan dalam desikator sehingga terbentuk garam dihidrat dengan massa molarnya 372,25 gram/mol. Kemudian, sebanyak 3,7225 gram garam ini ditimbang dan dilarutkan dalam 1 liter akuades. Hal ini sesuai dengan perhitungan berikut ini. 𝑚𝑎𝑠𝑠𝑎 𝑝𝑎𝑑𝑎𝑡𝑎𝑛 𝑁𝑎𝐻2 𝑌 = 3,7225 𝑔𝑟𝑎𝑚 𝑔𝑟𝑎𝑚 𝑚𝑎𝑠𝑠𝑎 𝑚𝑜𝑙𝑎𝑟 𝑁𝑎𝐻2 𝑌 = 372,25 ⁄𝑚𝑜𝑙 𝑣𝑜𝑙𝑢𝑚𝑒 𝑙𝑎𝑟𝑢𝑡𝑎𝑛 𝑁𝑎𝐻2 𝑌 = 1 𝐿 [𝑁𝑎𝐻2 𝑌] = 𝑚𝑎𝑠𝑠𝑎 𝑝𝑎𝑑𝑎𝑡𝑎𝑛 𝑁𝑎𝐻2 𝑌 1 × 𝑚𝑎𝑠𝑠𝑎 𝑚𝑜𝑙𝑎𝑟 𝑁𝑎𝐻2 𝑌 𝑣𝑜𝑙𝑢𝑚𝑒 𝑁𝑎𝐻2 𝑌 (𝐿) [𝑁𝑎𝐻2 𝑌] = 3,7225 𝑔𝑟𝑎𝑚 1 × 𝑔𝑟𝑎𝑚 372,25 ⁄𝑚𝑜𝑙 1 𝐿 [𝑁𝑎𝐻2 𝑌] = 0,01 𝑀 Jadi, larutan Na2H2Y yang digunakan dengan konsentrasi 0,01 𝑀. Pada percobaan ini, larutan Na2H2Y ini sudah dibuat oleh laboran sehingga penulis tidak membuat larutan Na2H2Y. d) Pembuatan larutan standar ZnSO4 0,01 M Larutan ZnSO4 merupakan larutan standar primer pada percobaan ini. Larutan ZnSO4 akan digunakan untuk menstandarisasi larutan EDTA, dimana EDTA berperan sebagai larutan standar sekunder pada percobaan ini. Larutan ZnSO4 yang dibuat sebanyak 1 L dengan konsentrasi 0,01 M, namun dalam bentuk hidratnya yaitu ZnSO4‧7H2O, sesuai dengan perhitungan berikut ini. 𝑣𝑜𝑙𝑢𝑚𝑒 𝑍𝑛𝑆𝑂4 ∙ 7𝐻2 𝑂 = 1 𝐿 [𝑍𝑛𝑆𝑂4 ∙ 7𝐻2 𝑂] = 0,01 𝑀 𝑔𝑟𝑎𝑚 ⁄𝑚𝑜𝑙 𝑚𝑎𝑠𝑠𝑎 𝑍𝑛𝑆𝑂4 ∙ 7𝐻2 𝑂 1 [𝑍𝑛𝑆𝑂4 ∙ 7𝐻2 𝑂] = × 𝑚𝑎𝑠𝑠𝑎 𝑚𝑜𝑙𝑎𝑟 𝑍𝑛𝑆𝑂4 ∙ 7𝐻2 𝑂 𝑣𝑜𝑙𝑢𝑚𝑒 𝑙𝑎𝑟𝑢𝑡𝑎𝑛 (𝐿) 𝑚𝑎𝑠𝑠𝑎 𝑚𝑜𝑙𝑎𝑟 𝑍𝑛𝑆𝑂4 ∙ 7𝐻2 𝑂 = 287,56 0,01 𝑀 = 𝑚𝑎𝑠𝑠𝑎 𝑍𝑛𝑆𝑂4 ∙ 7𝐻2 𝑂 1 × 𝑔𝑟𝑎𝑚 1𝐿 287,56 ⁄𝑚𝑜𝑙 𝑚𝑎𝑠𝑠𝑎 𝑍𝑛𝑆𝑂4 ∙ 7𝐻2 𝑂 = 0,01 𝑀 × 287,56 𝑔𝑟𝑎𝑚 ∙ 𝐿⁄ 𝑚𝑜𝑙 𝑚𝑎𝑠𝑠𝑎 𝑍𝑛𝑆𝑂4 ∙ 7𝐻2 𝑂 = 2,8756 𝑔𝑟𝑎𝑚 Jadi, massa ZnSO4‧7H2O yang ditimbang adalah 2,8756 𝑔𝑟𝑎𝑚. Setelah ditimbang, kristal tersebut dilarutkan dalam 1 liter akuades dan membentuk larutan ZnSO4‧7H2O 0,01 M. Pada percobaan ini, larutan ZnSO4‧7H2O ini sudah dibuat oleh laboran sehingga penulis tidak membuat larutan ZnSO4‧7H2O. e) Penghilangan kesadahan sementara air Titrasi kompleksometri pada percobaan ini digunakan untuk menentukan derajat kesadahan air. Kesadahan air merupakan ukuran kandungan garam-garam mineral yang terdapat dalam air sadah. Air sadah adalah air yang banyak mengandung garam-garam Ca dan Mg yang terlarut di dalamnya. Kesadahan air dapat ditentukan dengan cara menentukan kesadahan sementara terlebih dahulu dan kemudian menentukan kesadahan tetapnya. Kesadahan sementara disebabkan oleh garam-garam bikarbonat yang pada pemanasan akan memberikan endapan karbonat normal, sementara kesadahan tetap biasanya disebabkan oleh garamgaram CaCl2, CaSO4, MgCl2, dan MgSO4. Kesadahan air dapat dihilangkan secara sementara dengan mendidihkan air sadah, lalu disaring dan dicampurkan dengan akuades. Hal ini dapat mengurangi kesadahan air secara sementara karena air sadah bercampur dengan akuades yang tidak atau sangat sedikit mengandung garam mineral, sehingga kadar garam mineral dalam air sadah berkurang. Air sadah yang diambil merupakan air keran di Laboratorium Kimia Analitik, Jurusan Kimia, Fakultas Matematika Pendidikan Ganesha. dan Ilmu Pengetahuan Alam, Universitas f) Standarisasi larutan EDTA Proses standarisasi larutan EDTA dilakukan dengan cara melakukan titrasi dimana EDTA sebagai titran dan larutan Zn2+ yang sudah ditambahkan buffer salmiak dan indikator Erio T sebagai titratnya. Hasil titrasi standarisasi larutan EDTA disajikan dalam tabel berikut ini. Nomor Labu Volume ZnSO4 Volume EDTA Labu 1 5 mL 21,62 mL Labu 2 5 mL 21,95 mL Labu 3 5 mL 22,10 mL Tabel 7. Hasil titrasi campuran larutan ZnSO4, larutan buffer salmiak, dan indikator Erio T dengan larutan EDTA Reaksi yang terjadi pada proses titrasi ini adalah sebagai berikut. Na2H2Y(aq) 2Na+(aq) + H2Y2-(aq) Ca2+(aq) + H2Y2-(aq) ZnY2-(aq) + 2H+(aq) 1. Perhitungan konsentrasi larutan EDTA yang sudah distandarisasi pada labu I [𝑍𝑛𝑆𝑂4 ] = 𝑀 𝑍𝑛𝑆𝑂4 = 0,01 𝑀 𝑣𝑜𝑙𝑢𝑚𝑒 𝑍𝑛𝑆𝑂4 = 5 𝑚𝐿 𝑣𝑜𝑙𝑢𝑚𝑒 𝐸𝐷𝑇𝐴 𝑦𝑎𝑛𝑔 𝑑𝑖𝑔𝑢𝑛𝑎𝑘𝑎𝑛 = 21,62 𝑚𝐿 𝑀1 𝑉1 = 𝑀2 𝑉2 𝑀𝑍𝑛𝑆𝑂4 𝑉𝑍𝑛𝑆𝑂4 = 𝑀𝐸𝐷𝑇𝐴 𝑉𝐸𝐷𝑇𝐴 𝑀𝐸𝐷𝑇𝐴 = 𝑀𝑍𝑛𝑆𝑂4 𝑉𝑍𝑛𝑆𝑂4 𝑉𝐸𝐷𝑇𝐴 𝑀𝐸𝐷𝑇𝐴 = 0,01 𝑀 × 5 𝑚𝐿 21,62 𝑚𝐿 𝑀𝐸𝐷𝑇𝐴 = 0,00231 𝑀 2. Perhitungan konsentrasi larutan EDTA yang sudah distandarisasi pada labu II [𝑍𝑛𝑆𝑂4 ] = 𝑀 𝑍𝑛𝑆𝑂4 = 0,01 𝑀 𝑣𝑜𝑙𝑢𝑚𝑒 𝑍𝑛𝑆𝑂4 = 5 𝑚𝐿 𝑣𝑜𝑙𝑢𝑚𝑒 𝐸𝐷𝑇𝐴 𝑦𝑎𝑛𝑔 𝑑𝑖𝑔𝑢𝑛𝑎𝑘𝑎𝑛 = 21,95 𝑚𝐿 𝑀1 𝑉1 = 𝑀2 𝑉2 𝑀𝑍𝑛𝑆𝑂4 𝑉𝑍𝑛𝑆𝑂4 = 𝑀𝐸𝐷𝑇𝐴 𝑉𝐸𝐷𝑇𝐴 𝑀𝐸𝐷𝑇𝐴 = 𝑀𝑍𝑛𝑆𝑂4 𝑉𝑍𝑛𝑆𝑂4 𝑉𝐸𝐷𝑇𝐴 𝑀𝐸𝐷𝑇𝐴 = 0,01 𝑀 × 5 𝑚𝐿 21,95 𝑚𝐿 𝑀𝐸𝐷𝑇𝐴 = 0,00228 𝑀 3. Perhitungan konsentrasi larutan EDTA yang sudah distandarisasi pada labu III [𝑍𝑛𝑆𝑂4 ] = 𝑀 𝑍𝑛𝑆𝑂4 = 0,01 𝑀 𝑣𝑜𝑙𝑢𝑚𝑒 𝑍𝑛𝑆𝑂4 = 5 𝑚𝐿 𝑣𝑜𝑙𝑢𝑚𝑒 𝐸𝐷𝑇𝐴 𝑦𝑎𝑛𝑔 𝑑𝑖𝑔𝑢𝑛𝑎𝑘𝑎𝑛 = 22,10 𝑚𝐿 𝑀1 𝑉1 = 𝑀2 𝑉2 𝑀𝑍𝑛𝑆𝑂4 𝑉𝑍𝑛𝑆𝑂4 = 𝑀𝐸𝐷𝑇𝐴 𝑉𝐸𝐷𝑇𝐴 𝑀𝐸𝐷𝑇𝐴 = 𝑀𝑍𝑛𝑆𝑂4 𝑉𝑍𝑛𝑆𝑂4 𝑉𝐸𝐷𝑇𝐴 𝑀𝐸𝐷𝑇𝐴 = 0,01 𝑀 × 5 𝑚𝐿 22,10 𝑚𝐿 𝑀𝐸𝐷𝑇𝐴 = 0,00226 𝑀 Dari perhitungan konsentrasi larutan EDTA yang sudah distandarisasi per labu, maka konsentrasi rata-rata larutan EDTA yang sudah distandarisasi adalah sebagai berikut. 𝑀𝐸𝐷𝑇𝐴 𝑙𝑎𝑏𝑢 𝐼 + 𝑀𝐸𝐷𝑇𝐴 𝑙𝑎𝑏𝑢 𝐼𝐼 + 𝑀𝐸𝐷𝑇𝐴 𝑙𝑎𝑏𝑢 𝐼𝐼𝐼 3 0,00231 𝑀 + 0,00228 𝑀 + 0,00226 𝑀 = 3 𝑀𝐸𝐷𝑇𝐴 = 𝑀𝐸𝐷𝑇𝐴 𝑀𝐸𝐷𝑇𝐴 = 0,00228 𝑀 = 2,28 × 10−3 𝑀 Jadi, konsentrasi larutan EDTA yang sudah distandarisasi adalah 0,00228 𝑀. g) Menentuan kesadahan total air Tingkat kesadahan total air sering dinyatakan dengan derajat kesadahan Prancis. Derajat kesadahan Prancis menyatakan banyaknya garam yang ekivalen dengan jumlah CaCO3 dalam 100 liter air. Air sadah pada umumnya mengandung ion Ca2+, sehingga pada percobaan ini Ca2+ akan bereaksi dengan EDTA. Pada titik ekuivalen, jumlah mol ion Ca2+ akan sama dengan jumlah mol EDTA, sesuai persamaan reaksi berikut ini. Na2H2Y(aq) 2Na+(aq) + H2Y2-(aq) Ca2+(aq) + H2Y2-(aq) CaY2-(aq) + 2H+(aq) Nomor Labu Volume Air Sadah Volume EDTA Labu 1 5 mL 2,95 mL Labu 2 5 mL 2,00 mL Labu 3 5 mL 2,19 mL Tabel 8. Hasil titrasi campuran air sadah, larutan buffer salmiak, dan indikator Erio T dengan larutan EDTA 1. Perhitungan konsentrasi larutan Ca2+ pada labu I [𝐸𝐷𝑇𝐴] = 0,00228 𝑀 𝑣𝑜𝑙𝑢𝑚𝑒 𝐶𝑎2+ = 5 𝑚𝐿 𝑣𝑜𝑙𝑢𝑚𝑒 𝐸𝐷𝑇𝐴 𝑦𝑎𝑛𝑔 𝑑𝑖𝑔𝑢𝑛𝑎𝑘𝑎𝑛 = 2,95 𝑚𝐿 𝑀1 𝑉1 = 𝑀2 𝑉2 𝑀𝐶𝑎2+ 𝑉𝐶𝑎2+ = 𝑀𝐸𝐷𝑇𝐴 𝑉𝐸𝐷𝑇𝐴 𝑀𝐶𝑎2+ = 𝑀𝐸𝐷𝑇𝐴 𝑉𝐸𝐷𝑇𝐴 𝑉𝐶𝑎2+ 𝑀𝐶𝑎2+ = 0,00228 𝑀 × 2,95 𝑚𝐿 5 𝑚𝐿 𝑀𝐶𝑎2+ = 0,0013452 𝑀 2. Perhitungan konsentrasi larutan Ca2+ pada labu II [𝐸𝐷𝑇𝐴] = 0,00228 𝑀 𝑣𝑜𝑙𝑢𝑚𝑒 𝐶𝑎2+ = 5 𝑚𝐿 𝑣𝑜𝑙𝑢𝑚𝑒 𝐸𝐷𝑇𝐴 𝑦𝑎𝑛𝑔 𝑑𝑖𝑔𝑢𝑛𝑎𝑘𝑎𝑛 = 2,00 𝑚𝐿 𝑀1 𝑉1 = 𝑀2 𝑉2 𝑀𝐶𝑎2+ 𝑉𝐶𝑎2+ = 𝑀𝐸𝐷𝑇𝐴 𝑉𝐸𝐷𝑇𝐴 𝑀𝐶𝑎2+ = 𝑀𝐸𝐷𝑇𝐴 𝑉𝐸𝐷𝑇𝐴 𝑉𝐶𝑎2+ 𝑀𝐶𝑎2+ = 0,00228 𝑀 × 2,00 𝑚𝐿 5 𝑚𝐿 𝑀𝐶𝑎2+ = 0,000912 𝑀 3. Perhitungan konsentrasi larutan Ca2+ pada labu III [𝐸𝐷𝑇𝐴] = 0,00228 𝑀 𝑣𝑜𝑙𝑢𝑚𝑒 𝐶𝑎2+ = 5 𝑚𝐿 𝑣𝑜𝑙𝑢𝑚𝑒 𝐸𝐷𝑇𝐴 𝑦𝑎𝑛𝑔 𝑑𝑖𝑔𝑢𝑛𝑎𝑘𝑎𝑛 = 2,19 𝑚𝐿 𝑀1 𝑉1 = 𝑀2 𝑉2 𝑀𝐶𝑎2+ 𝑉𝐶𝑎2+ = 𝑀𝐸𝐷𝑇𝐴 𝑉𝐸𝐷𝑇𝐴 𝑀𝐶𝑎2+ = 𝑀𝐸𝐷𝑇𝐴 𝑉𝐸𝐷𝑇𝐴 𝑉𝐶𝑎2+ 𝑀𝐶𝑎2+ = 0,00228 𝑀 × 2,19 𝑚𝐿 5 𝑚𝐿 𝑀𝐶𝑎2+ = 0,00099864 𝑀 Dari perhitungan konsentrasi Ca2+ per labu, maka konsentrasi rata-rata ion Ca2+ adalah sebagai berikut. 𝑀𝐶𝑎2+ 𝑙𝑎𝑏𝑢 𝐼 + 𝑀𝐶𝑎2+ 𝑙𝑎𝑏𝑢 𝐼𝐼 + 𝑀𝐶𝑎2+ 𝑙𝑎𝑏𝑢 𝐼𝐼𝐼 3 0,0013452 𝑀 + 0,000912 𝑀 + 0,00099864 𝑀 = 3 𝑀𝐶𝑎2+ = 𝑀𝐶𝑎2+ 𝑀𝐶𝑎2+ = 0,00108528 𝑀 = 1,085 × 10−3 𝑀 𝑔𝑟𝑎𝑚 𝑚𝑎𝑠𝑠𝑎 𝑚𝑜𝑙𝑎𝑟 𝐶𝑎2+ = 40,078 ⁄𝑚𝑜𝑙 𝑚𝑎𝑠𝑠𝑎 𝐶𝑎2+ = 𝑀𝐶𝑎2+ × 𝑚𝑎𝑠𝑠𝑎 𝑚𝑜𝑙𝑎𝑟 𝐶𝑎2+ × 𝑉 𝐶𝑎2+ 𝑔𝑟𝑎𝑚 𝑚𝑎𝑠𝑠𝑎 𝐶𝑎2+ = 0,00108528 𝑀 × 40,078 ⁄𝑚𝑜𝑙 × 5 𝑚𝐿 𝑔𝑟𝑎𝑚 𝑚𝑎𝑠𝑠𝑎 𝐶𝑎2+ = 0,00108528 𝑚𝑜𝑙⁄𝐿 × 40,078 ⁄𝑚𝑜𝑙 × 0,005 𝐿 𝑚𝑎𝑠𝑠𝑎 𝐶𝑎2+ = 0,0002175 𝑔𝑟𝑎𝑚 = 2,175 × 10−4 𝑔𝑟𝑎𝑚 Massa 𝐶𝑎2+ yang diperoleh adalah 2,175 × 10−4 𝑔𝑟𝑎𝑚. Massa 𝐶𝑎2+ ini merupakan massa 𝐶𝑎2+ dalam 5 mL atau 5 gram air sadah, sehingga kadar 𝐶𝑎2+ dalam air sadah dapat ditentukan sebagai berikut. % 𝐶𝑎2+ = % 𝐶𝑎 2+ 𝑚𝑎𝑠𝑠𝑎 𝐶𝑎2+ × 100 𝑚𝑎𝑠𝑠𝑎 𝑎𝑖𝑟 𝑠𝑎𝑑𝑎ℎ 2,175 × 10−4 𝑔𝑟𝑎𝑚 = × 100 5 𝑔𝑟𝑎𝑚 % 𝐶𝑎2+ = 0,00435% Kandungan 𝐶𝑎2+ dalam air sadah dapat juga dinyatakan dalam bentuk ppm, sehingga diperoleh: 𝑘𝑎𝑑𝑎𝑟 𝐶𝑎 2+ 2,175 × 10−4 𝑔𝑟𝑎𝑚 = 5 𝑔𝑟𝑎𝑚 𝑘𝑎𝑑𝑎𝑟 𝐶𝑎2+ = 0,0000435 𝑔𝑟𝑎𝑚 𝐶𝑎2+ ⁄ 𝑔𝑟𝑎𝑚 𝑎𝑖𝑟 𝑠𝑎𝑑𝑎ℎ 𝑘𝑎𝑑𝑎𝑟 𝐶𝑎2+ = 4,35 × 10−5 𝑔𝑟𝑎𝑚 𝐶𝑎2+ ⁄ 𝑔𝑟𝑎𝑚 𝑎𝑖𝑟 𝑠𝑎𝑑𝑎ℎ 𝑘𝑎𝑑𝑎𝑟 𝐶𝑎2+ (𝑝𝑝𝑚) = 4,35 × 10−5 × 106 𝑘𝑎𝑑𝑎𝑟 𝐶𝑎2+ = 43,5 𝑝𝑝𝑚 h) Penentuan kesadahan tetap dari air Tingkat kesadahan tetap air juga sering dinyatakan dengan derajat kesadahan Prancis. Derajat kesadahan Prancis menyatakan banyaknya garam yang ekivalen dengan jumlah CaCO3 dalam 100 liter air. Air sadah pada umumnya mengandung ion Ca2+, sehingga pada percobaan ini Ca2+ akan bereaksi dengan EDTA. Pada titik ekuivalen, jumlah mol ion Ca2+ akan sama dengan jumlah mol EDTA, sesuai persamaan reaksi berikut ini. Na2H2Y(aq) 2Na+(aq) + H2Y2-(aq) Ca2+(aq) + H2Y2-(aq) CaY2-(aq) + 2H+(aq) Nomor Labu Volume Sampel Air Volume EDTA Labu 1 5 mL 1,75 mL Labu 2 5 mL 1,82 mL Labu 3 5 mL 1,95 mL Tabel 9. Hasil titrasi campuran sampel air yang sudah dicampur akuades, larutan buffer salmiak, dan indikator Erio T dengan larutan EDTA 1. Perhitungan konsentrasi larutan Ca2+ pada labu I [𝐸𝐷𝑇𝐴] = 0,00228 𝑀 𝑣𝑜𝑙𝑢𝑚𝑒 𝐶𝑎2+ = 5 𝑚𝐿 𝑣𝑜𝑙𝑢𝑚𝑒 𝐸𝐷𝑇𝐴 𝑦𝑎𝑛𝑔 𝑑𝑖𝑔𝑢𝑛𝑎𝑘𝑎𝑛 = 1,75 𝑚𝐿 𝑀1 𝑉1 = 𝑀2 𝑉2 𝑀𝐶𝑎2+ 𝑉𝐶𝑎2+ = 𝑀𝐸𝐷𝑇𝐴 𝑉𝐸𝐷𝑇𝐴 𝑀𝐶𝑎2+ = 𝑀𝐸𝐷𝑇𝐴 𝑉𝐸𝐷𝑇𝐴 𝑉𝐶𝑎2+ 𝑀𝐶𝑎2+ = 0,00228 𝑀 × 1,75 𝑚𝐿 5 𝑚𝐿 𝑀𝐶𝑎2+ = 0,000798 𝑀 2. Perhitungan konsentrasi larutan Ca2+ pada labu II [𝐸𝐷𝑇𝐴] = 0,00228 𝑀 𝑣𝑜𝑙𝑢𝑚𝑒 𝐶𝑎2+ = 5 𝑚𝐿 𝑣𝑜𝑙𝑢𝑚𝑒 𝐸𝐷𝑇𝐴 𝑦𝑎𝑛𝑔 𝑑𝑖𝑔𝑢𝑛𝑎𝑘𝑎𝑛 = 1,82 𝑚𝐿 𝑀1 𝑉1 = 𝑀2 𝑉2 𝑀𝐶𝑎2+ 𝑉𝐶𝑎2+ = 𝑀𝐸𝐷𝑇𝐴 𝑉𝐸𝐷𝑇𝐴 𝑀𝐶𝑎2+ = 𝑀𝐸𝐷𝑇𝐴 𝑉𝐸𝐷𝑇𝐴 𝑉𝐶𝑎2+ 𝑀𝐶𝑎2+ = 0,00228 𝑀 × 1,82 𝑚𝐿 5 𝑚𝐿 𝑀𝐶𝑎2+ = 0,00082992 𝑀 3. Perhitungan konsentrasi larutan Ca2+ pada labu III [𝐸𝐷𝑇𝐴] = 0,00228 𝑀 𝑣𝑜𝑙𝑢𝑚𝑒 𝐶𝑎2+ = 5 𝑚𝐿 𝑣𝑜𝑙𝑢𝑚𝑒 𝐸𝐷𝑇𝐴 𝑦𝑎𝑛𝑔 𝑑𝑖𝑔𝑢𝑛𝑎𝑘𝑎𝑛 = 1,95 𝑚𝐿 𝑀1 𝑉1 = 𝑀2 𝑉2 𝑀𝐶𝑎2+ 𝑉𝐶𝑎2+ = 𝑀𝐸𝐷𝑇𝐴 𝑉𝐸𝐷𝑇𝐴 𝑀𝐶𝑎2+ = 𝑀𝐸𝐷𝑇𝐴 𝑉𝐸𝐷𝑇𝐴 𝑉𝐶𝑎2+ 𝑀𝐶𝑎2+ = 0,00228 𝑀 × 1,95 𝑚𝐿 5 𝑚𝐿 𝑀𝐶𝑎2+ = 0,0008892 𝑀 Dari perhitungan konsentrasi Ca2+ per labu, maka konsentrasi rata-rata ion Ca2+ adalah sebagai berikut. 𝑀𝐶𝑎2+ 𝑙𝑎𝑏𝑢 𝐼 + 𝑀𝐶𝑎2+ 𝑙𝑎𝑏𝑢 𝐼𝐼 + 𝑀𝐶𝑎2+ 𝑙𝑎𝑏𝑢 𝐼𝐼𝐼 3 0,000798 𝑀 + 0,00082992 𝑀 + 0,0008892 𝑀 = 3 𝑀𝐶𝑎2+ = 𝑀𝐶𝑎2+ 𝑀𝐶𝑎2+ = 0,00083904 𝑀 = 8,390 × 10−4 𝑀 𝑚𝑎𝑠𝑠𝑎 𝑚𝑜𝑙𝑎𝑟 𝐶𝑎2+ = 40,078 𝑔𝑟𝑎𝑚 ⁄𝑚𝑜𝑙 𝑚𝑎𝑠𝑠𝑎 𝐶𝑎2+ = 𝑀𝐶𝑎2+ × 𝑚𝑎𝑠𝑠𝑎 𝑚𝑜𝑙𝑎𝑟 𝐶𝑎2+ × 𝑉 𝐶𝑎2+ 𝑔𝑟𝑎𝑚 𝑚𝑎𝑠𝑠𝑎 𝐶𝑎2+ = 0,00083904 𝑀 × 40,078 ⁄𝑚𝑜𝑙 × 5 𝑚𝐿 𝑔𝑟𝑎𝑚 𝑚𝑎𝑠𝑠𝑎 𝐶𝑎2+ = 0,00083904 𝑚𝑜𝑙⁄𝐿 × 40,078 ⁄𝑚𝑜𝑙 × 0,005 𝐿 𝑚𝑎𝑠𝑠𝑎 𝐶𝑎2+ = 0,0001681 𝑔𝑟𝑎𝑚 = 1,681 × 10−4 𝑔𝑟𝑎𝑚 Massa 𝐶𝑎2+ yang diperoleh adalah 1,681 × 10−4 𝑔𝑟𝑎𝑚. Massa 𝐶𝑎2+ ini merupakan massa 𝐶𝑎2+ dalam 5 mL atau 5 gram air sadah, sehingga kadar 𝐶𝑎2+ dalam air sadah dapat ditentukan sebagai berikut. % 𝐶𝑎2+ = 𝑚𝑎𝑠𝑠𝑎 𝐶𝑎2+ × 100 𝑚𝑎𝑠𝑠𝑎 𝑎𝑖𝑟 𝑠𝑎𝑑𝑎ℎ % 𝐶𝑎2+ = 1,681 × 10−4 𝑔𝑟𝑎𝑚 × 100 5 𝑔𝑟𝑎𝑚 % 𝐶𝑎2+ = 0,003362% Kandungan 𝐶𝑎2+ dalam air sadah dapat juga dinyatakan dalam bentuk ppm, sehingga diperoleh: 𝑘𝑎𝑑𝑎𝑟 𝐶𝑎 2+ 1,681 × 10−4 𝑔𝑟𝑎𝑚 = 5 𝑔𝑟𝑎𝑚 𝑘𝑎𝑑𝑎𝑟 𝐶𝑎2+ = 0,00003362 𝑔𝑟𝑎𝑚 𝐶𝑎2+ ⁄ 𝑔𝑟𝑎𝑚 𝑎𝑖𝑟 𝑠𝑎𝑑𝑎ℎ 𝑘𝑎𝑑𝑎𝑟 𝐶𝑎2+ = 3,362 × 10−5 𝑔𝑟𝑎𝑚 𝐶𝑎2+ ⁄ 𝑔𝑟𝑎𝑚 𝑎𝑖𝑟 𝑠𝑎𝑑𝑎ℎ 𝑘𝑎𝑑𝑎𝑟 𝐶𝑎2+ (𝑝𝑝𝑚) = 3,362 × 10−5 × 106 𝑘𝑎𝑑𝑎𝑟 𝐶𝑎2+ = 33,62 𝑝𝑝𝑚 VI. Simpulan Simpulan yang dapat diperoleh dari percobaan ini adalah derajat kesadahan air di Laboratorium Kimia Analitik, Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Pendidikan Ganesha yaitu 43,5 𝑝𝑝𝑚 derajat kesadahan total airnya, dan 33,62 𝑝𝑝𝑚 derajat kesadahan tetap airnya. VII. Jawaban Pertanyaan 1. Apa fungsi penambahan larutan buffer salmiak pada prosedur di atas? Larutan buffer salmiak digunakan dalam titrasi kompleksometri untuk menciptakan suasana basa, karena pH = 10. Adanya larutan EDTA yang distandarisasi terlebih dahulu dengan ZnSO4 perlu untuk dilakukan. Ion Zn2+ dalam ZnSO4 berfungsi untuk menghindari pengendapan yang terjadi akibat buffer salmiak. 2. Apa yang terjadi apabila air sadah digunakan dalam memasak? Apabila air sadah digunakan dalam memasak, maka akan terjadi beberapa hal berikut ini. - Menyebabkan lapisan kerak pada alat dapur yang terbuat dari logam - Mengakibatkan terbentuknya kerak pada dinding pipa yang menyebabkan pipa semakin kecil dan debit air semakin kecil - Dapat menyebabkan terjadinya ledakan pada boiler - Sayur-sayuran ketika dicuci dengan air sadah akan menjadi keras dan sulit untuk dikunyah - Jika diminum atau dikonsumsi, dalam jangka panjang dapat menyebabkan osteoporosis pada tubuh manusia - Menyebabkan pemborosan sabun di rumah tangga, karena sabun menjadi tidak berbusa ketika menggunakan air sadah - Menimbulkan kerak pada ketel yang dapat menyumbat katup ketel karena terbentuknya endapan Ca pada dinding dan katup ketel, sehingga bahan bakar akan menjadi sangat boros 3. Berikan alternatif untuk menghilangkan kesadahan air! Proses penghilangan kesadahan air yang sering dilakukan pada industriindustri adalah melalui penyaringan dengan menggunakan zat-zat sebagai berikut. - Resin pengikat kation dan anion Resin adalah zat polimer alami ataupun sintetik yang salah satu fungsinya adalah dapat mengikat kation dan anion tertentu. Secara teknis, air sadah dilewatkan melalui suatu wadahyang berisi resin pengikat kation dan anion, sehingga diharapkan kation Ca2+ dan Mg2+ dapat diikat resin. Dengan demikian, air tersebut akan terbebas dari kesadahan. - Zeolit Zeolit memiliki rumus kimia Na2Al2Si3O10.2H2O atau K2Al2Si3O10.2H2O. Zeolit mempunyai struktur tiga dimensi yang memiliki pori-pori yang dapat dilewati air. Ion Ca2+ dan Mg2+akan ditukar dengan ion Na+ dan K+ dari zeolit, sehingga air tersebut terbebas dari kesadahan. VIII. Daftar Pustaka Anonim, 1979, Farmakope Indonesia Edisi IV, Departemen Kesehatan Republik Indonesia, Jakarta. Anonim, 1979, Farmakope Indonesia Edisi III , Departemen Kesehatan Republik Indonesia, Jakarta. Khopkar, S.M. 1990. Konsep Dasar Kimia Analitik. UI Press: Jakarta. Roth, Herman J. 1988. Analisis Farmasi. UI Press: Yogyakarta. Sastrawidana, I D. K., I N. Selamat, dan I G. L. Wiratma. 2001. Buku Penuntun Belajar Kimia Analitik Kualitatif. Singaraja: IKIP Negeri Singaraja Selamat, I N. dan I G. L. Wiratma. 2004. Penuntun Praktikum Kimia Analitik. Singaraja: IKIP Negeri Singaraja. Svehla, G. 1990. Bagian II Vogel Buku Teks Analisis Anorganik Kualitatif Makro dan Semimikro. Jakarta: PT. Kalman Media Pusaka.