Uploaded by
Rizkiana Nurazizah
Laporan Praktikum Spektroskopi Serapan Atom

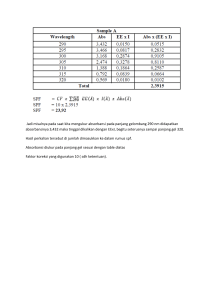
A. JUDUL : SPEKTROSKOPI SERAPAN ATOM B. : TUJUAN 1. Menentukan konsentrasi dari suatu sampel larutan 2. Menentukan konsentrasi dari sampel organic 3. Menetntukan trace konsentrasi sampel C. DASAR TEORI : Spektroskopi serapan atom adalah metode analitik kimia intrumen berdasarkan pengukuran besaran fisis yang timbul atau berubah akibat interaksi materi dan energi (panas, elektromagnetik, kimia). Analisis secara Spektroskopi Serapan Atom merupakan analisis instrumen yang berdasarkan adanya interaksi berupa absorpsi radiasi elektromagnetik dari sumber radiasi oleh atom yang dianalisis dalam suatu sampel. Sumber radiasi berasal dari lampu katode katode berongga (Hollow Katode Lamp/ HCL) berfungsi untuk menghasilkan radiasi elektromagnetik yang sesuai dengan atom unsur yang akan dianalisis. Metode ini sangat tepat untuk analisi zat pada konsentrasi endah. Teknik ini mempunyai beberapa kelebihan dibandingkan dengan metode spektroskopi emisi konvensional. Lampu Katode Berongga (Hollow Cathode Lamp) Bentuk lampu katode dapat dilihat pada gambar 17.4.Ciri utama lampu ini adalah mempunyai katode silindris berongga yang dibuat dari logam tertentu. Katode and anode tungsten diletakkan dalam pelindung gelas tertutup yang mengandung gas inert (Ne atau Ar) dengan tekanan 1-5 torr. Lampu ini mempunyai potensial 500 V, sedangkan arus berkisar antara 2 – 20 mA. Gambar17.4. Lampu katode berongga Adapungas pengisi terionisasi pada anode, dan ion-ion yang hasilkan dipercepat menuju katode dimana bombardemen ion-ion ini menyebabkan atom-atom logam menjadi terlepas ke permukaan dan terbentuk awan/populasi atom. Proses ini disebut dengan percikan atom (sputtering). Lebih jauh lagi, tumbukan ini menyebabkan beberapa atom tereksitasi dan kemudian kembali pada keadaan dasar dengan memancarkan spektrum atom yang spesifik. Spektrum gas pengisi (dan komponen lain yang terdapat dalam katode) juga dipancarkan. Jendela atau tempat dimana radiasi keluar dari lampu biasanya dibuat dari silika sehingga dapat menggunakan panjang gelombang di bawah 350 nm. Dalam proses atomisasi, larutan sampel akan disebarkan (nebulized) seperti penyemprotan dan kemudian dicampurkan dengan bahan bakar dan oksidan dan membawanya ke pembakar. Larutan akan menguap ke dalam ruang (base region) yang mana terletak diatas pembakar. Dan hasilnya, partikel-partikel padat yang dibawa ke ruang tengan pembakar (inner cone). Ini merupakan daerah terpanas pada pembakar dimana gas atomatom dan ion-ion dasar terbentuk menjadi partikel-partikel padat sehingga terjadi eksitasi atomic. Akhirnya atom-ato dan ion-ion dibawa ke outer cone, M +X - M +X - MX MX larutan kabut padat gas Pancaran hv M+ M+X gas gas Pancaran kembali hv M+ gas Dalam metode kurva kalibrasi ini, dibuat seri larutan standard dengan berbagai konsentrasi dan absorbansi dari larutan tersebut diukur dengan SSA. Selanjutnya membuat grafik antara konsentrasi (C) dengan Absorbansi (A) yang akan merupakan garis lurus melewati titik nol dengan slope = ε. B atau slope = a.b, konsentrasi larutan sampel diukur dan diintropolasi ke dalam kurva kalibrasi atau di masukkan ke dalam persamaan regresi. Perhitungan kuantitatif berasaskan pada hukum Lambert-Beer : A = a b C atau A = ε b C Komponen SSA terdiri dari HCL, chooper, pembakar & nebulizer, monochromator, detector, piranti pembaca. Kegunaan dari masing-masin komponen tersebut yaitu : a. HCL Kegunaannya untuk menghasilkan radiasi elektromagnetik sesuai dengan atom yang akan menyerap atau dianalisis. b. Chooper Kegunaannya untuk pemecah atom sehingga atom-atom akan berukuran lebih kecil dari semula. c. Pembakar & Nebulizer Kegunaannya untuk tempat terjadinya proses atomisasi dan tempat untuk mengubah sampel menjadi aerosol. d. Monochromator Kegunaannya untuk mengisolasi resonansi dari sekian radiasi gelombang elektromagnetik. e. Detector Menghasilkan signal atau meneruskan garis resonansi dari monochromator dan juga untuk mendeteksi sinar dari monochromator. f. Piranti pembaca Mengubah signal listrik pada detector menjadi suatu nilai. Destruksi Basah Untuk menentukan kandungan mineral bahan makanan. Bahan dihancurkan/ didestruksi dulu. Cara biasa dilakukan yaitu pengeringan (dryashing) dan pengabuan basah (wet digestion). Pemilihan tersebut tergantung pada sifat zat organic dalam bahan, sifat zat antara yang ada dalam bahan, mineral yang aka digunakan sertasensitivitas yang digunakan. Destruksi basah terutama digunakan untuk penentuan logam trace dan logam- logam beracun. Pada dasarnya destruksi basah ini merupakan perbaikan dari cara kering yang biasanya memerlukan waktu yang lama dan dapat dipakai untuk menentukan unsur-unsur dengan konsentrasi yang rendah. Agar unsur-unsur tersebut tidak saling mengganggu dalam analisis, maka salah satu unsur harus di hilangkan, dengan adanya proses destruksi tersebut diharapkan yang tertinggal hanya logam-logamnya saja. Dalam analisis kegunaan HNO3 pekat berfungsi sebagai destruktor. Larutan ini dipakai untuk bahan-bahan organik yang sulit dihancurkanselain itu, Asam nitrat juga digunakan untuk agar tidak kehilangan logam-Iogam yang akan dianalisa akibat penguapan sedangkan asam perklorat digunakan untuk menambah daya oksidasi pada dekomposisi cuplikan. Dilakukan pemanasan untuk menyempurnakan destruksi. Pemilihan asam pengoksidasi harus diperhatikan untuk mempermudah dan mempercepat proses oksidasi dan mencegah hilangnya unsur-unsur analit yang akan diukur. Asam nitrat sebagai pengoksidasi dikombinasikan dengan pengoksidasi yang lain seperti asam sulfat, asam perklorat, dan hidrogen peroksida adalah cara yang lazim dipakai. D. ALAT DAN BAHAN Alat: - Pipet tetes - Gelas ukur - Pipet volume - Gelas kimia - Labu ukur - Corong kaca - SSA PERKIN ELMER SERI AA100 Bahan: - Larutan baku Cu(II) 1000 ppm (sebelumnya diencerkan lebih dulu) - Larutan standart Cu(II) 2; 4; 6; 8; dan 10 ppm - Asam Nitrat - aquades E. ALUR KERJA 1. Penentuan konsentrasi Cu pada sampel a. Pembuatan larutan standar Cu(II) Larutan Baku 1000 ppm + 2 ml As. Nitrat 5N - Diencerkan sampai tanda batas Larutan Baku Cu(II) STD Cu(II) 1ppm STD Cu(II) 2ppm STD Cu(II) 4ppm STD Cu(II) 6ppm STD Cu(II) 8ppm STD Cu(II) 10ppm + 1 ml As. Nitrat 5N - Diencerkan sampai tanda batas Lart. STD Cu(II) b. Kurva kalibrasi STD Cu(II) 1ppm STD Cu(II) 2ppm STD Cu(II) 4ppm STD Cu(II) 6ppm HASIL c. Penentuan konsentrasi sampel Sampel STD Cu(II) 8ppm Diukur pada panjang gelombang 217 dan 324.7 nm Diukur mulai konsentrasi rendah STD Cu(II) 10ppm - Diukur pada panjang gelombang 217 dan 324.7 nm Absorbansi - Dihitung konsentrasi sampel Cu(II) 2. Penentuan kadar Pb pada sampel organik (destruksi basah) Larutan Baku Pb STD Pb 5ppm STD Pb 15ppm STD Pb 10ppm STD Pb 20ppm Sampel Daun Sono - Dicuci Dioven agar airnya hilang Ditumbuk hingga halus + HNO3 pekat 100mL sampel + indicator MJ + 5mL atau lebih HNO3 Diuapkan sampai volume 10-20mL + lagi 10 mL HNO3 pekat dan 10 mL HClO4 Diuapkan sampai ada bau uap HClO4 dan larutan jernih +HNO3 (jika perlu) Didinginkan dan diencerkan sampai 50mL, dan didihkan sampai gas klor dan oksida-oksida nitrogen hilang HASIL 3. Penentuan kadar Fe pada air sumur dengan metode adisi standar STD Pb 25ppm Larutan Baku Fe 50ppm STD Fe 1ppm STD Fe 4ppm STD Fe 2ppm STD Fe 6ppm STD Fe 8ppm Air Sumur Blanko - Disaring jika keruh + HNO3 1% Di baca absorbansi blanko, standar, dan sampel dengan AAS pada panjang gelombang 248,3 nm Dibuat kurva standar Fe Dihitung konsentrasi sampel Hasil Cara Kerja II Larutan Baku Fe 50ppm STD Fe 1ppm 5 mL Sampel 5 mL Sampel STD Fe 2ppm 5 mL Sampel STD Fe 4ppm 5 mL Sampel STD Fe 6ppm 5 mL Sampel STD Fe 8ppm 5 mL Sampel - - + 0.5 mL larutan standart 1ppm - + 1 mL larutan standart 2ppm + 1.5 mL larutan standart 4ppm - - + 2 mL larutan standart 6ppm - Di baca absorbansi blanko, standar, dan sampel dengan AAS pada panjang gelombang 248,3 nm Dihitung konsentrasi sampel - Hasil F. Hasil pengamatan 1. Penentuan Konsentrasi Cu pada sampel Y = 0.028 x + 0.001 Konsentrasi Absorbansi (ppm) Absorbansi sampel = 0.173 2 0.061 0.173 = 0.028 x +0.001 4 0.112 0.028x = 0.173 – 0.001 6 0.173 0.028x = 0.172 8 0.236 X = 6.14236 ppm 10 0.287 2. Penentuan Kadar Pb pda sampel organic Y = 0.007 x - 0.003 Absorbansi sampel = -0.001 -0.001= 0.007 x - 0.003 - 0.007 x = - 0.003 + 0.001 - 0.007 x = - 0.002 X = 3.5 ppm Concentration Absorbance + 2.5 mL larutan standart 8ppm (ppm) 5 0.034 10 0.071 20 0.128 40 0.247 60 0.36 3. Penentuan Kadar Fe pada Air Sumur dengan Metode Adisi Standar Konsentrasi (ppm) Absorbansi 2 0.061 4 0.112 6 0.173 8 0.236 10 0.287 Y = 0.020 x + 0.033 Absorbansi sampel = -0.004 -0.004 = 0.020 x +0.033 -0.020x = 0.173 + 0.004 X = - 1.85 ppm G. ANALISIS DAN PEMBAHASAN 1. Percobaan I : Penentuan Konsontrasi Cu pada sampel Pada percobaan ini yang bertujuan untuk menentukan konsentrasi dari suatu samapel larutan dengan menggunakan spektrometri serapan atom engan menggunakan prinsip hollow chatode lamp di dalamnya. Dalam percobaan kali ini Hollow catode yang digunakan adalah Hollow katoda FeCrCu. Prinsip penembakan sinar oleh hollow katoda adalah dalam katoda akan dipilih energi yang cocok untuk menembakkan suatu atom menjadi suatu atom yang tereksitasi. Sinar yang keluar dalam katoda dipilih hanya sinar dari eksitasi Cu, yaitu dengan cara memprogram panjang gelombangnya yang sesuai dengan panjang gelombang Cu. Pengukuran kadar Cu dengan menggunakan spektro serapan atom pada kondisi atom gas, sehingga larutan Cu yang encer mengalami pembakaran pada ruang pengkabutan oleh O2 dan asetilena. Hasil dari atomisasi tersebut yang akan di tembak oleh sinar dari Hallow katode, atom logam yang di tembak tersebut mengalami eksitasi menuju tingkat energy yang lebih tinggi karena mendapatkan tambahan energy dari tembakan HCL tersebut. Setelah itu atom logam tersebut kembali ke adaah dasar dengan melepaskan energy yang diamati berupa warna nyala, dalam hal ini warna nyala atom Cu berarna biru tua. Sedangkan atom yang tidak diserap oleh HCL di teruskan kedetector untuk dibaca dalam bentuk angka absorbansi. a. Pembuatan kurva kalibrasi Kurva kalibrasi berdasarkan standart larutan Cu, dengan konsentrasi 2 ppm, 4ppm, 6ppm, 8 ppm, dan 10ppm. Dari data tersebut dengan menggunakan spektrometri serapan atom diproleh absorbansi sebagai berikut : Konsentrasi (ppm) 2 4 6 8 10 Absorbansi 0.061 0.112 0.173 0.236 0.287 Dari data absorbansi berdasarkan alat instrument spectrometri serapan atom diatas didapat di buat grafik sebagai berikut : Kurva Standart Cu 0,35 y = 0,0288x + 0,001 R² = 0,9985 Absorbansi 0,3 0,25 0,2 Ряд1 0,15 0,1 Линейная (Ряд1) 0,05 0 0 2 4 6 8 10 12 Konsentrasi (ppm) Larutan standar ini dibuat dengan menambahkan HNO3 pekat, penambahan HNO3 pekat ini bertujuan untuk memberikan suasana asam dalam larutan. Suasana asam ini dimaksudkan untuk menjaga kejernihan larutan dari endapan logam, karena sifat dari logam Cu ketika bereaksi dengan suatu basa akan menghasilkan endapan. Hal ini dilakukan dimaksudkan agar endapan yang dihasilkan akan tidak akan menyumbat pipa kapiler dalam alat. Dari grafik tersebut, diperoleh persamaan garis lurus y= 0.028x +0.001dengan regresi = 0.998, ini menunjukkan bahwa pada kurva tersebut terbentuk garis linier yang lurus dengan sumbu x (konsentrasi) dan sumbu y (absorbansi). Dari persamaan grafik tersebut dapat dilalakukan perhitungan konsentrasi larutan suatu sampel Cu. Dari perhitungan di peroleh konseentrasi Cu dalam sampel 6.14286 mg/L sedangkan pada pembacaan spektrometri serapan atom diperoleh konsentrasi Cu dalam sampel 6.004 mg/ L. Sehingga didapatkan keefektivan alat sebesar 97.71%. Dari harga krrfaktivan alat tersebut tampak bahwa alat yang digunakan membutuhkan kalibrasi. 2. Penentuan kadar Pb pada sampel organic dengan metode destruksi basah Sampel organik yang digunakan pada praktikum yang bertujuan menentukkan konsentrasi dari sampel organic ini adalah daun tanaman sonokembang yang ditanam di sepanjang pinggiran jalan raya, sehingga dimungkinan mengandung logam berat Pb yang tinggi. Analisis kandungan Pb dalam daun tanaman sonokembang dilakukan dengan metode dekstruksi basah. Destruksi dilakukan dengan menyuci sampel daun dari tanaman sonokembang yang diambl di tepi jalan raya dengan air dari kotorannya, setelah itu daun sono tersebut dioven selama 10 menit untuk menghilangkan kandungan airnya. Daun sono yang sudah kering tersebut selanjutnya di tumbuk hingga halus, dan dilakukan penambahan HNO3 pekat yang bertujuan untuk memberikan suasana asam dalam larutan. Penambahan indikator metil jingga digunakan untuk mengetahui pH larutan dalam suasana asam (3,14,4). Selanjutnya ditambah HNO3 pekat lagi dan HClO4 hal ini ditujukan supaya mengurangi pengendapan logam dalam larutan. Kemudian larutan dimasukkan kedalam labu dekstruksi dan diuapkan sampai muncul bau uap HClO4, mendidih dan larutan menjad jernih. Setelah didinginkan larutan hasil dekstruksi basah di ukur absorbansinya dengan AAS. Dalam analisis dengan cara destruksi basah, bahan organik diuraikan dalam larutan oleh asam pengoksidasi pekat dan panas yaitu H2SO4, HNO3, dan HClO4 sedangkan residu anorganiknya tertinggal dalam larutan sampel dilarutkan dengan larutan asam. Keuntungan pengabuan basah adalah suhu yang digunakan tidak dapat melebihi titik didih larutan dan pada umumnya karbon lebih cepat hancur. Dengan prinsip yang sama dengan percobaan Cu di atas dalam pembacaan absorbansi larutan atandart Pb didapatkan data sebagai berikut : Konsentrasi (ppm) Absorbansi 5 0.034 10 0.071 20 0.128 40 0.247 60 0.36 Dari data larutan standartersebut dapat di buat kurva refresi linier sebagai berikut : 0,4 y = 0,0059x + 0,0091 R² = 0,9994 0,35 0,3 0,25 Ряд1 0,2 Линейная (Ряд1) 0,15 0,1 0,05 0 0 20 40 60 80 Data hasil percobaan yang diperoleh, pada larutan standarnya nilai absorbansi semakin besar dengan meningkatnya konsentrasi. Hal ini berarti dalam AAS, semakin besar konsentrasi suatu zat/senyawa maka semakin besar serapan absorbansi radiasi oleh atom bebasnya. Hasil percobaan ini selaras dengan hukum Lambert-Beer yaitu A= ε.b.c. Ditunjang dengan grafik dari larutan standart Pb terbukti bahwa benar-benar sebanding dengan hokum Lambert-Beer. Dalam praktikum kami didapatkan hasil (-) dari sampel Pb, karena dalam proses destruksi basah, suhu yang digunakan terlalu tinggi, sehingga larutan yang dalam pemurnian tersebut hangus. Hal inilah salah satu factor yang menyebabkan mengapa hasil absorbansi dari daun sono yang mengandung Pb bernilai (-), karena dimungkinkan logam Pb dalam larutan tersebut ditutupi oleh karbon dari pemanasan pada suhu 70o yang terlalu lama. Maka dapat diambil kesimpulan bahwa Hasil (-) pada absorbansi dikarenakan kurang murninya larutan ( masih banyak pengotor). Dari grafik tersebut dapat dihitung konsentrasi Pb dalam larutan sampel sebesar 3.5 ppm sedangkan hasil dari pembacaan dengan menggunakan AAS diperoleh konsentrasi Pb dalam larutan sampel -1.733 ppm. 3. Penentuan Kadar Fe pada Air Sumur Pada percobaan ini yang bertujuan untuk menentukan konsentrasi Fe dari suatu sampel air sumur dengan menggunakan spektrometri serapan atom engan menggunakan prinsip hollow chatode lamp di dalamnya. Dalam percobaan kali ini Hollow catode yang digunakan adalah Hollow katoda FeCrCu. Prinsip penembakan sinar oleh hollow katoda adalah dalam katoda akan dipilih energi yang cocok untuk menembakkan suatu atom menjadi suatu atom yang tereksitasi. Sinar yang keluar dalam katoda dipilih hanya sinar dari eksitasi Fe, yaitu dengan cara memprogram panjang gelombangnya yang sesuai dengan panjang gelombang Fe. Pengukuran kadar Fe dengan menggunakan spektro serapan atom pada kondisi atom gas, sehingga larutan Fe yang encer mengalami pembakaran pada ruang pengkabutan oleh O2 dan asetilena. Hasil dari atomisasi tersebut yang akan di tembak oleh sinar dari Hallow katode, atom logam yang di tembak tersebut mengalami eksitasi menuju tingkat energy yang lebih tinggi karena mendapatkan tambahan energy dari tembakan HCL tersebut. Setelah itu atom logam tersebut kembali ke adaah dasar dengan melepaskan energy yang diamati berupa warna nyala, dalam hal ini warna nyala atom Fe berarna biru tua. Sedangkan atom yang tidak diserap oleh HCL di teruskan kedetector untuk dibaca dalam bentuk angka absorbansi. a. Pembuatan kurva kalibrasi Pembuatan kurva kalibrasi dengan menggunakan larutan standart Fe dengan masing-masing konstrasi Fe dalam larutan yaitu, 1 ppm, 2 ppm, 4 ppm, 6 ppm, dan 8 ppm. Tujuannya adalah untuk membuat kurva kalibrasi yang nantinya akan digunakan untuk menghitung kadar besi dalam sampel air. Dari larutan standart tersebut diukur absorbansinya dan diperoleh data sebagai berikut : Konsentrasi (ppm) Absorbansi 2 0.054 6 0.172 10 0.265 14 0.31 18 0.396 Dari data absorbansi tersebut didapatkan kurva kalibrasi sebagai berikut : 0,45 y = 0,0206x + 0,0339 R² = 0,9781 0,4 0,35 0,3 0,25 Ряд1 0,2 Линейная (Ряд1) 0,15 0,1 0,05 0 0 5 10 15 20 Larutan standar ini dibuat dengan menambahkan HNO3 pekat, penambahan HNO3 pekat ini bertujuan untuk memberikan suasana asam dalam larutan. Suasana asam ini dimaksudkan untuk menjaga kejernihan larutan dari endapan logam, karena sifat dari logam Fe ketika bereaksi dengan suatu basa akan menghasilkan endapan. Hal ini dilakukan dimaksudkan agar endapan yang dihasilkan akan tidak akan menyumbat pipa kapiler dalam alat. Dari grafik tersebut diperoleh nilai persamaan garis y = 0.020x + 0.033. Persamaan garis tersebut digunakan untuk menghitung kadar besi dalam sample air sumur. Secara analisis kualitatif dan data yang diperoleh, data absorbansi sample air sample dibanding dengan larutan deret standar. Melalui perhitungan, diperoleh hasil bahwa konsentrasi besi dalam sample air sumur yang dianalisis adalah -1.85 ppm. Nilai tersebut terpaut cukup jauh dari konsentrasi pembacaan pada alat yaitu 1.031ppm. Didapatkan absorbani (-), karena terlalu cepat dalam pemindahan injector dari sampel 1 ke sampel lain terlalu cepat sehingga dimungkinkan sampel yang kami analisis terkontaminasi dengan sampel yang sebelumnya, hal tersebut menyebabkan proses atomisasi dan penyerapan Fe pada sampel kami kurang sempurna. I. Diskusi Dalam praktikum yang dilakukan banyak yang tidak sesuai dengan procedure pada buku praktikum yang telah diterima, seperti pada percobaan ke tiga dimana penentuan kaadar Fe dalam air sumur dengan menggunakan metode adisi, namun yang telah dilakukan adalah dengan menggunakan perhitungan %efektivitas saja. Dari konsentrasi yang berbeda antara konsentrasi sampel hasil perhitungan dan konsentrasi sampel hasil pembacaan alat pada percobaan diatas. Hal ini disebabkan oleh interferensi kimia dari penyimpangan hukum Lambert-Beer. Untuk mengatasinya dapat dilakukan perubahan terhadap kondisi operasional, seperti menggunakan suhu nyala yg lebih tinggi atau menggunakan releasing agent. J. Kesimpulan 1. Konsentrasi Cu dalam sampel sebesar 6.004 mg/ L dan efektifitas alat diperoleh sebesar 97.71%. 2. Konsentrasi Pb dalam sampel sebesar -1.733 ppm. 3. Konsentrasi besi dalam sample air sumur yang dianalisis adalah -1.031ppm 4. Perbedaan antara konsentrasi sampel hasil perhitungan dengan konsentrasi sampel hasil pembacaan alat dapat disebabkan oleh interferensi kimia. DAFTAR PUSTAKA Day, R. A Jr. dan A. L. Underwood. 2002. Analisis Kualitatif edisi keenam. Jakarta : Penerbit Erlangga Mulya, Muhammad, dkk. 1995. Analisis Instrumental. Surabaya : Airlangga University Press Rusmini, dkk. 2008. Panduan Praktikum Dasar-dasar Kimia AnalitikiIII Spektroskopi dan Kromatografi.Surabaya: UNESA-press. Suyanta dan Regina T. P. 2000. Kimia Analisis Instrumen. Yogyakarta : Laboratorium Kimia Analitik FMIPA UNY Wiryawan ,Adam pada 25-02-2011. http://www.chem-istry.org/materi_kimia/instrumen_analisis/spektrofotometri-serapan-atom/spektrometerserapan-atom/11.09 8 Oktober 2011 sabtu LAPORAN PRAKTIKUM KIMIA ANALITIK III SPEKTROSKOPI SERAPAN ATOM (SSA) OLEH : LOITA DATU NINDITA 093234018 KIMIA A 2009 JURUSAN KIMIA FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS NEGERI SURABAYA 2011