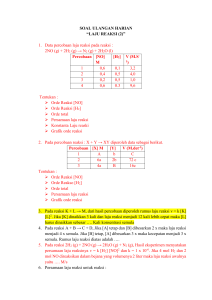
Latihan Soal Titrasi Asam Basa Pilihlah satu jawaban yang paling tepat ! 1. Larutan HCl 0,1 M sebanyak 25 mL dititrasi dengan larutan NH4OH. Perubahan warna indikator terjadi pada saat penambahan 25 mL NH4OH. Berapakah molaritas NH4OH yang digunakan ? A. 0,50 M. B. 0,25 M. C. 0,12 M D. 0,10 M E. 0,08 M 2. Larutan H2CO3 0,1 M 20 mL dititrasi dengan larutan NaOH 0,1 M. Berapakah volume NaOH yang dibutuhkan untuk mencapai titik ekuivalen ? A. 10 mL. B. 20 mL. C. 25 mL. D. 30 mL. E. 40 mL. 3. Larutan HCl 0,1 M sebanyak 25 mL dititrasi dengan larutan NaOH 0,1 M. Setelah penambahan 20 mL larutan NaOH, pH larutan dinyatakan dengan persamaan …..(gunakan Tabel 5.6 sebagai panduan) A. pH = - log [H+] B. pOH = - log [OH-] C. [H+] = Ka. mol asam/mol garam. D. [OH-] = Kb. mol basa/ mol garam. E. [H+] = √ Kw/Ka . [ion positif] 4. Larutan HCl 0,1 M sebanyak 25 mL dititrasi dengan larutan NaOH 0,1 M. Setelah penambahan 25 mL larutan NaOH, pH larutan sebesar…………..(gunakan Tabel 5.6 sebagai panduan) A. 4 B. 5 C. 6 D. 7 E. 11 5. Larutan HCl 0,1 M sebanyak 25 mL dititrasi dengan larutan NaOH 0,1 M. Setelah penambahan 30 mL larutan NaOH, pH larutan dinyatakan dengan persamaan …..(gunakan Tabel 5.6 sebagai panduan) A. pH = - log [H+] B. pOH = - log [OH-] C. [H+] = Ka. mol asam/mol garam. D. [OH-] = Kb. mol basa/ mol garam. E. [H+] = √ Kw/Ka . [ion positif] 6. Larutan HCl 0,1 M sebanyak 25 mL dititrasi dengan larutan NH4OH 0,1 M (Kb = 1x10-5). Setelah penambahan 20 mL larutan NH4OH, pH larutan dinyatakan dengan persamaan …..(gunakan Tabel 5.6 sebagai panduan). A. pH = - log [H+] B. pOH = - log [OH-] C. [H+] = Ka. mol asam/mol garam. D. [OH-] = Kb. mol basa/ mol garam. E. [H+] = √ Kw/Ka . [ion positif] 7. Larutan HCl 0,1 M sebanyak 25 mL dititrasi dengan larutan NH4OH 0,1 M (Kb = 1x10-5). Setelah penambahan 25 mL larutan NH4OH, pH larutan dinyatakan dengan persamaan …..(gunakan Tabel 5.6 sebagai panduan). A. pH = - log [H+] B. pOH = - log [OH-] C. [H+] = Ka. mol asam/mol garam. D. [OH-] = Kb. mol basa/ mol garam. E. [H+] = √ Kw/Kb . [ion positif] 8. Larutan HCl 0,1 M sebanyak 25 mL dititrasi dengan larutan NH4OH 0,1 M (Kb = 1x10-5). Setelah penambahan 35 mL larutan NH4OH, pH larutan dinyatakan dengan persamaan …..(gunakan Tabel 5.6 sebagai panduan). A. pH = - log [H+] B. pOH = - log [OH-] C. [H+] = Ka. mol asam/mol garam. D. [OH-] = Kb. mol basa/ mol garam. E. [H+] = √ Kw/Kb . [ion positif] 9. Larutan CH3COOH 0,1 M (Ka = 1x10-5)sebanyak 25 mL dititrasi dengan larutan NaOH OH 0,1 M . Setelah penambahan 20 mL larutan NH4OH, pH larutan dinyatakan dengan persamaan …..(gunakan Tabel 5.6 sebagai panduan). A. pH = - log [H+] B. pOH = - log [OH-] C. [H+] = Ka. mol asam/mol garam. D. [OH-] = Kb. mol basa/ mol garam. E. [H+] = √ Kw/Kb . [ion positif] 10. Larutan CH3COOH 0,1 M (Ka = 1x10-5) sebanyak 25 mL dititrasi dengan larutan NaOH 0,1 M. Setelah penambahan 25 mL larutan NaOH, pH larutan dinyatakan dengan persamaan …..(gunakan Tabel 5.6 sebagai panduan) A. pH = - log [H+] B. pOH = - log [OH-] C. [H+] = Ka. mol asam/mol garam. D. [OH-] = √ Kw/Ka . [ion negatif] E. [H+] = √ Kw/Kb . [ion positif]