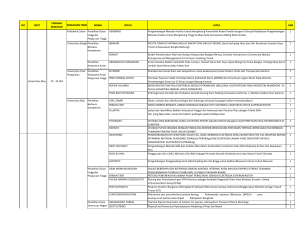
1. Menyimpulkan faktor faktor yang mempengaruhi hantaran jenis larutan dari data analisis ( DHL ) A. Beda tegangan antara kedua elektroda B. Konsentrasi larutan C. Sifat ion seperti besarnya muatan, derajat disosiasi, besarnya ion, kompleksasi dengan molekul lain dan sebagainya D. Suhu lautan E. Luas permukaan masing masing elektroda F. Jarak antara katoda dan anoda 2. Menentukan hambatan jenis dari suatu larutan R=l/A 3. Menyimpulkan reaksi yang terjadi yang di anoda dan katoda sel galvani / sel volta Katoda (+) = tempat terjadinya reduksi Anoda (-) = tempat terjadinya oksidasi 4. Membedakan sel elektrolisis dan galvani Sel elektrolisis Sel galvani Reaksi redoks hanya terjadi ketika Reaksi redoks berlangsung spontan dialiri listrik ( tidak spontan ) Merubah energi listrik menjadi kimia Merubah energi kimia menjadi listrik Anoda +, katoda - Anoda -, katoda + Bergantung pada sumber arus listrik Tidak bergantung oada arus listrik agar bisa terjadi reaksi kimia 5. Menentukan unsur yang mengalami oksidasi dan reduksi dalam sel volta berdasarkan nilai E sel nya Cont ; logam Fe mempunyai E sel = +0,67 v dan logan Zn mempunyai E sel = +0,76 Semakin tinggi ( + ) nilai E sel suatu logam maka akan mengalami reduksi dan semakin rendah ( - ) nilai E sel maka akan mengalami oksidasi. Jadi logam Fe akan mengalami oksidasi dan Zn akan mengalami reduksi 6. Menuliskan notasi sel 1) 2Al(s) + 3Sn2+(aq) ---> 2Al3+(aq)n+ 3Sn(s) Notasi sel : Al(s) l Al3+(aq) ll Sn2+(aq) l Sn(s) 2) Zn(s) + Cl2(g) ---> Zn2+(aq) + 2Cl-(aq) (katoda menggunakan elektroda inert Pt) Notasi sel : Zn(s) l Zn2+(aq) ll Cl2(g) l Cl-(aq) l Pt(s) 7. Mendeteksi reaksi yang terjadi di katoda dan anoda ( elektolisis ) antara Ni/Cu Katoda ( reduksi ) Cu2+(aq)+ 2e ---> Cu(s) Anoda ( oksidasi ) x 2 2H2O ---> O2(g) + 4H+(aq) + 4e x 1 2Cu2+(aq) + 2H2O(l) ---> 2Cu(s) + O2(g) 4H+(aq) Katoda ( reduksi ) Ni2+(aq) + 2e ---> Ni(s) Anoda ( oksidasi ) x 2 4OH-(aq)---> 2H2O(l) + O2(g) + 4e x 1 2Ni2+(aq) + 4OH-(aq) ---> 2Ni(s) + 2H2O(l) + O2(g) 8. Membedakan prinsip dasar potensiometri dan konduktometri, prinsip elektrogravimetri Potensiometri ; didasarkan pada pengukuran beda potensial yang terjadi pada dua elektroda dalam larutan Konduktometri; didasarkan pada perubahan daya hantar listrik yang terjadi pada proses analisis Elektrogravimetri; sama kaya gravimetri tapi nu dilihatna endapan yang menempel pada katoda 9. Menyimpulkan jenis elektroda yang dipergunakan dalam titrasi potensiometri Elektroda pembanding dan elektroda indikator Pembanding; Elektroda hidrogen, elektroda kalomel. Elektroda perak/perak klorida Indikator ; Elektroda logam, elektroda membran Elektroda logam jnis pertama; eletroda Cu, jenis kedua; eletroda perak, jenis ketiga; elektroda Hg, jenis keempat; elektroda Pt, Au. Elektroda membran; membran kristal ( elektroda LiF untuk F- ) nonkristlin membran ( elektroda gelas kombinasi untuk H+/Na+ ) pendeteksi gas ( membran hidrofob untuk CO2 ) elektroda bersubstrat enzim ( membran urease untuk urea ) - sifat sifatnya Pembanding; harga potensial sel diketahui dan konstan, inert Indikator; potensial bergantung pada konsentrasi zat yang diselidiki - kekurangan kelebihan - dipakai dimana 10. Memahami titik akhir dalam titrasi potensiometri dan konduktometri ( grafik ) 11. Elektroda perawatan jangka panjang dan jangka pendek Jangka pendek; sehabis dipakai elektroda dibilas dengan air dan direndam dalam air Jangka panjang; elektroda harus dikeringkan dan disimpan kering, lalu sesekali elektroda perlu dilapis ulang denga Pt ( platinizing ) sesuai prosedur 12. Menentukan data analisis dan data penunjang dalam analisis 13. Mengoreksi data analisis 14. Menetapkan hukum faraday dalam perhitungan hasil elektrogravimetri Hukum faraday 1; w = Q, Q = i x t, w = i x t Hukum faraday 2; w = ME ( massa ekivalen ), ME = Ar/biloks atau muatan ion 15. Menjelaskan fungsi pereaksi dalam analisis elektrogravimetri HNO3 bebas nitrit; HNO3; H2SO4; NH4OH; 16. Menentukan kadar suatu zat ( dari potensio, kondukto elektrogravimetri ) Elektrogravimetri; berat endapan = ( B.Katoda+endapan ) - ( katoda ) % kadar = B.Endapan/B.Sampel x faktor pengenceran x 100% Potensiometri&konduktometri = mek = V.Peniter x [larutan] Berat = mek x Be x faktor pengenceran Kadar = Berat/berat sampel x 100% 17. Menentukan angka penting dalam analisis Angka penting adalah bilangan/angka selain nol - angka nol disebelah kanan angka bukan nol merupakan angka penting - angka nol diapit oleh angka selain nol merupakan angka penting 1) 0,001660 = 4 angka penting 2) 365.000 = 6 angka penting 3) 2020 = 4 angka penting