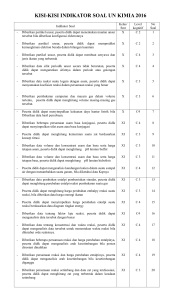
Kesetimbangan Kimia dan Faktor – faktor yang Mempengaruhinya KELOMPOK 1 Kesetimbangan Kimia dan Faktor – faktor yang Mempengaruhinya 1 2 Keadaan Setimbang dan Tetapan Kesetimbangan Faktor – faktor yang mempengaruhi Kesetimbangan 1 Keadaan Setimbang dan Tetapan Kesetimbangan Ada 2 macam reaksi kimia : 1. Reaksi irreversible : reaksi kimia yang berjalan satu arah 2. Reaksi reversible : reaksi kimia yang berjalan dua arah a. Keadaan setimbang dinamis Kesetimbangan kimia bersifat dinamis, yaitu secara makroskopis pada keadaan setimbang tidak terjadi perubahan konsentrasi atau warna, namun secara mikroskopis reaksi bolak – balik selalu terjadi perubahan terus menerus. Tetapi keadaan demikian hanya dapat terjadi pada reaksi dalam sistem tertutup. Contoh : Pemanasan air dalam wadah tertutupm dengan reaksi sbb : a. Reaksi penguapan H2O(l) H2O(g) b. Reaksi pengembunan H2O(g) H2O(l) Berdasarkan wujud zat dalam keadaan setimbang, kesetimbangan kimia dapat dibedakan sebagai berikut : a. Kesetimbangan Homogen Pada reaksi ini seluruh spesies yang terlibat dalam reaksi memiliki fasa yang sama Contoh : 2SO3(g) 2SO2(g) + O2(g) b. Kesetimbangan Heterogen Pada reaksi ini spesies reaktan dan produknya berada dalam fasa yang berbeda Contoh : CaCO3(s) CaO(s) + CO2(g) b. Tetapan kesetimbangan Hukum kesetimbangan menurut “Guldberg dan Waage” : “ Dalam keadaan setimbang pada suhu tertentu, hasil kali konsentrasi hasil reaksi dibagi hasil kali konsentrasi pereaksi yang ada dalam sistem kesetimbangan yang masing – masing dipangkatkan dengan koefisiennya mempunyai harga tetap”. Hasil bagi tersebut dinamakan tetapan kesetimbangan ( Kc ) a. Reaksi Homogen Harga Kc pada reaksi aA + bB cC + dD, dapat dirumuskan dengan ketentuan sebagai berikut : 1. Pada kesetimbangan, laju reaksi v1 = v2 2. Pada keadaan setimbang, reaksi dianggap stabil. V1 = k1 [A]a [B]b v2 = k2 [C]c [D]d 3. Harga Kc c d C D Kc Aa Bb b. Reaksi Heterogen Untuk reaksi heterogen “tetapan kesetimbangannya ditentukan hanya berdasarkan konsentrasi zat yang berfasa gas saja, karena zat dalam fasa padat dan cair konsentrasinya dianggap tetap Contoh : pP(g) + qQ(s) rR(l) + sS(g) r s R S K' p q P Q Oleh karena [Q] dan [R] dianggap tetap, sehingga : s S K p P Soal 1. Tuliskan ungkapan tetapan kesetimbangan untuk reaksi berikut : a. 2NO2(g) N2O4(g) b. CaCO3(s) CaO(s) + CO2(s) c. Pb(NO3)2(aq) + 2KI(aq) PbI2(s) + 2KNO3(aq) d. Ag+(aq) + Fe2+(aq) Ag(s) + Fe3+(aq) 2. Dalam bejana 1.000 mL terbentuk kesetimbangan 2SO2(g) + O2(g) 2SO3(g) H = +189 kJ/mol Jika mula – mula ada 0,5 mol gas SO2 dan 0,3 mol gas O2 dan dalam keadaan setimbang tinggal 0,1 mol gas SO2. Berapakah harga tetapan kesetimbangannya ? 3. Jika 1 mol AB dalam 1 liter air terurai sebanyak 40%, menurut reaksi AB A + B Berapakah harga tetapan kesetimbangan reaksi tersebut ? 2 Faktor – faktor yang mempengaruhi Kesetimbangan Pada tahun 1884, Henri Louis Le Chatelier dikenal dengan “azas Le Chatelier” menyatakan : Apabila dalam suatu sistem kesetimbangan yang sedang berlangsung dilakukan aksi maka timbul reaksi dari sistem sehingga pengaruh aksi tersebut dapat diperkecil. Faktor – faktor yang mempengaruhi pergeseran kesetimbangan reaksi antara lain : 1. Perubahan konsentrasi Jika kedalam sistem kesetimbangan konsentrasi pereaksi ditambah atau diperbesar maka kesetimbngan akan bergeser ke kanan atau kearah produk, sehinggan konsentrasi produk bertambah dan sebaliknya jika konsentrasi pereaksi dikurangi atau diperkecil maka maka kesetimbangan bergeser ke kiri Contoh : A(g) + B(g) C(g) + D(g) 2. Perubahan suhu Pada reaksi kesetimbangan, apabila kalor sistem reaksi diturunkan dengan cara menurunkan suhu sistem tersebut maka sistem akan melakukan reaksi dengan cara menggeser kesetimbangan ke arah yang melepaskan kalor (eksoterm). Sebaliknya, jika kalor sistem dinaikkan, sistem akan menggeser kesetimbangan ke arah yang memerlukan kalor Contoh : A(g) + B(g) C(g) + D(g) H = -x kJ Reaksi 1 ( eksoterm ), yaitu zat A dan B membebaskan kalor utk membentuk zat C dan D. Reaksi 2 ( endoterm ), yaitu menyerap kalor untuk membentuk zat A dan B Kesimpulan : a. Jika temperatur naik, maka reaksi akan bergeser ke pereaksi b. Jika temperatur diturunkan, reaksi akan bergeser ke arah hasil reaksi 3. Perubahan Tekanan dan Volume Faktor tekanan dan volume merupakan faktor yang bersifat kebalikan satu sama lain, artinya bila tekanan gas diperbesar, berarti volume gas diperkecil, dan bila tekanan gas diperkecil, berarti volume gas diperbesar. Hukum Boyle “Pada suhu tetap, hasil kali tekanan (P) dan Volume (V) selalu konstan ( PV = C ) Menurut “asas Le Chatelier” , jika dalam sistem kesetimbangan volume ruang diperbesar atau tekanan diperkecil maka kesetimbangan akan bergeser ke pihak raksi yang jumlah koefsiennya lebih besar dan sebaliknya. Contoh : 2A(g) + B(g) 3C(g) + D(g) Kesimpulan a. Jika tekanan diperbesar ( volume diperkecil ) maka kesetimbangan akan bergeser ke arah jumlah mol yang lebih kecil b. Jika tekanan diperkecil ( volume diperbesar ) maka kesetimbangan akan bergeser ke arah jumlah mol yang lebih besar Soal 1. Diketahui reaksi kesetimbangan sebagai berikut : BiClO3(aq) + H2O (l) BiOCl(s) + 2HCl(aq) Kemana arah kesetimbangan bergeser jika pada suhu tetap. a. Jumlah reaktan ditambah b. Jumlah BiOCl dikurangi c. Jumlah HCl ditambah 2. Pada kesetimbangan : H2(g) + Br2(g) 2HBr(g) H = -26 kkal Kemanakah arah pergeseran reaksinya jika suhu diturunkan ? Jelaskan.