KISI UAS XII KIMIA 2015
advertisement

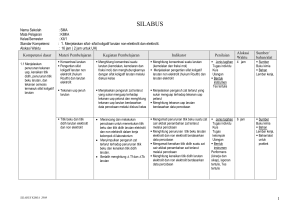
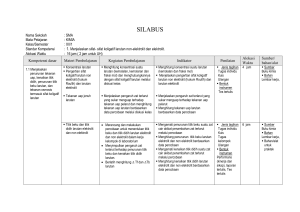
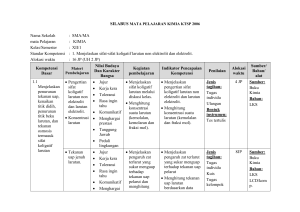
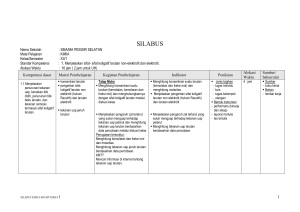
KISI – KISI SOAL ULANGAN AKHIR SEMESTER GASAL MADRASAH ALIYAH TAHUN PELAJARAN 2015/2016 MATA PELAJARAN KELAS No 1 1 Stansar Kompetensi 2 1.Menjelaskan sifat- sifat koligatif larutan nonelektrolit dan elektrolit. : KIMIA : XII IPA Kompetensi Dasar 3 1.1.Menjelaskan penurunan tekanan uap, kenaikan titik didih, penurunan titik beku larutan, dan tekanan osmosis termasuk sifat koligatif larutan. Kimia – XII IPA – UAS – 2015/2016 Materi Pokok 4 Konsentras i larutan Inikator Silabus 5 Menghitung konsentrasi suatu larutan (kemolalan dan fraksi mol) Jumlah Soal 6 7 Menghitung molalitas larutan jika di ketahui 1 massa zat terlarut dan volume pelarut Indikator Soal Bentuk soal 8 PG No Soal 9 1 Bobot Soal 10 C1 Tekanan uap jenuh larutan Menjelaskan pengaruh zat terlarut yang sukar menguap terhadap tekanan uap pelarut Menentukan tekanan uap jenuh larutan jika diketahui fraksi mol zat terlarut dan tekanan uap pelarut murni 1 PG 2 C1 Titik beku dan titik didih larutan elektrolit dan non elektrolit Mengamati penurunan titik beku suatu zat cair akibat penambahan zat terlarut melalui percobaan Menentukan titik beku larutan non elektrolit bila diketahui massa zat terlarut, massa pelarut ,dan tetapan penurunan titik beku molal air. 1 PG 3 C2 Menghitung penurunan titik beku larutan elektrolit dan non elektrolit berdasarkan data percobaan Menentukan titik beku larutan senyawa elektrolit jika diketahui massa zat, massa pelarut dan massa atom relatifnya 1 PG 4 C2 Menghitung kenaikan titik didih larutan elektrolit dan non elektrolit berdasarkan data percobaan Menentukan Mr suatu larutan elektrolit kuat jika diketahui massa senyawa, massa pelarut titik didih larutan dan titik didih molal air 1 PG 5 C2 Page 1 1.2. Membandingkan antara sifat koligatif larutan non elektrolit dengan sifat koligatif larutan elektrolit yang konsentrasinya sama berdasarkan data percobaan. Diagram PT Menganalisis diagram PT untuk menafsirkan penurunan tekanan uap, penurunan titik beku dan kenaikan titik didih larutan Menentukan daerah perubahan titik didih larutan bila ditunjukkan gambar diagram P dan T 1 PG 6 C3 Tekanan osmosis larutan elektrolit dan non elektrolit Menghitung tekanan osmosis larutan elektrolit dan non elektrolit Menghitung massa larutan non elektrolit yang isotonis dengan larutan elektrolit 1 Essay 36 C2 Menentukan tekanan osmotik larutan non elektrolit jika diketahui massa zat terlarut, massa molekul senyawa, harga tetapan gas, suhu dan volume larutan. 1 PG 7 C2 Perbedaan sifat koligatif larutan elektrolit dan non elektrolit Menganalisis data percobaan untuk membandingkan sifat koligatif larutan elektrolit dan non elektrolit Diberikan pilihan zat elektrolit dan non elektrolit dengan konsentrasi tertentu, siswa dapat menentukan larutan yang isotonis 1 PG 8 C2 Menentukan larutan yang mempunyai titik beku paling tinggi bila disebutkan beberapa larutan elektrolit dan non elektrolit beserta konsentrasinya 1 PG 9 C1 Diberikan contoh penerapan sifat koligatif larutan, siswa dapat menentukan sifat koligatif larutan 1 PG 10 C2 Menentukan perubahan biloks salah satu unsur dalam suatu persamaan reaksi 1 PG 11 C1 Diberikan beberapa reaksi, siswa dapat menentukan mana yang merupakan reaksi disproporsionasi 1 PG 12 C3 Menentukan zat yang menjadi reduktor dalam suatu reaksi redoks 1 PG 13 C2 2.1.Menerapkan Persamaan konsep reaksi reaksi oksidasi-reduksi redoks dalam system elektrokimia yang melibatkan energy listrik dan kegunaannya dalam mencegah Kimia – XII IPA – UAS – 2015/2016 Menyetarakan reaksi redoks dengan cara setengah reaksi (ion elektron) Page 2 korosi dan dalam industri 2 sel Volta 2.Menerapkan konsep reaksi oksidasireduksi dan elektrokimia dalam teknologi dan kehidupan sehari-hari 2.2.Menjelaskan reaksi oksidasi reduksi dalam sel elektrolisi Kimia – XII IPA – UAS – 2015/2016 Menyetarakan reaksi redoks dengan cara perubahan bilangan oksidasi (PBO) Diberikan suatu persamaan reaksi redoks, siswa dapat menentukan koefisien reaksi tersebut. 1 PG 14 C3 1 Essay 37 C2 Menyimpulkan ciri-ciri reaksi redoks yang berlangsung secara spontan melalui percobaan Diberikan beberapa reaksi reduksi logam dengan potensial reduksinya, siswa dapat menentukan reaksi yang dapat berlangsungspontan. 1 PG 15 C2 Menuliskan lambang sel dan reaksi-reaksi yang terjadi pada sel Volta Diberikan gambar sel volta dengan elektroda dan larutannya siswa dapat menentukan 1 PG 16 C3 Menghitung potensial sel berdasarkan data potensial standar Menghitung Eo Sel suatu sel volta bila diberikan data Eo potensial reduksi 1 Essay 38 C2 notasi atau lambang sel Aplikasi sel Volta dalam kehidupan Menjelaskan prinsip kerja Siswa dapat menentukan reaksi yang terjadi pada katoda saat aki bekerja/ dipakai sel Volta yang banyak digunakan dalam kehidupan (baterai, aki dll) 1 PG 17 C3 reaksi elektrolisis Mengamati reaksi yang terjadi di anoda dan katoda pada reaksi elektrolisis melalui percobaan Diberikan larutan senyawa golongan IA siswa dapat menentukan reaksi yang terjadi dikatoda jika larutan tersebut dielektrolisis menggunakan elektrode inert. 1 PG 18 C3 Menuliskan reaksi yang terjadi di anoda dan katoda pada larutan atau cairan dengan elektroda aktif ataupun elektroda inert Di berikan reaksi elektrolisis leburan suatu zat dengan elektroda inert, siswa dapat menentukan zat yang dihasilkan di katoda dan anoda 1 PG 19 C1 Page 3 korosi 2.3.Menerapkan hukum Faraday untuk elektrolisis larutan elektrolit hukum Faraday Menjelaskan faktor-faktor yang mempengaruhi terjadinya korosi melalui percobaan 1 PG 20 C3 Menjelaskan beberapa cara Siswa dapat menentukan cara mencegah untuk mencegah terjadinya korosi dalam kehidupan sehariterjadinya korosi hari yang paling tepat 1 PG 21 C2 Siswa menentukan 4 cara memcegah terjadinya korosi dalam kehidupan seharihari . 1 Essay 39 C2 Menghitung volume gas yang dihasilkan di anoda pada keadaan STP dari suatu elektrolisis larutan zat bila diketahui muatan listrik dalam satuan Faraday 1 PG 22 C2 Menghitung massa logam yang mengendap pada elektrolisis dua larutan yang dihubungkan seri 1 PG 23 C3 Siswa dapat menyebutkan kegunaan sel elektrolisis dalam kehidupan 1 PG 24 C2 1 PG 25 C1 Menerapkan konsep hukum Faraday dalam perhitungan sel elektrolisis Menuliskan reaksi elektrolisis pada penyepuhan dan pemurnian suatu logam 3 3. Memahami karakteristik unsur-unsur penting, kegunaan dan bahayanya serta terdapatnya di 3.1.Mengidentifikasi Unsurkelimpahan unsur unsur-unsur golongan utama dan transisi utama dan di alam dan transisi produk yang mengandung unsur tersebut Kimia – XII IPA – UAS – 2015/2016 Di berikan data gambar logam besi yang dimasukkan dalam tabung dengan berbagai perlakuan .siswa dapat mengurutkan peristiwa korosi yang paling lambat ke proses korosi yang paling cepat Mengidentifikasi sifat-sifat Diberikan sifat-sifat unsur transisi, siswa fisik unsur utama dan dapat menyebutkan contoh senyawa unsur transisi (titik didih, golongan transisi titik leleh, kekerasan, warna, kelarutan, dan sifat khusus lainnya) Page 4 Sifat-sifat fisik dan sifat-sifat kimia unsur alam. 3.2 Mendeskripsikan kecenderungan sifat fisik dan kimia unsur utama dan unsur transisi (titik didih, titik leleh, kekerasan, warna, kelarutan, kereaktifan, dan sifat khusus lainnya) 3.3 Menjelaskan manfaat, dampak dan proses pembuatan unsurKimia – XII IPA – UAS – 2015/2016 Manfaat dan dampak unsurunsur dalam kehidupan sehari-hari dan industri Mengidentifikasi daya pengoksidasi halogen dan daya pereduksi halida melalui percobaan Diberikan data reaksi pendesakan senyawa halida, siswa dapat menentukan reaksi yang tidak dapat berlangsung Mengidentifikasi reaksi nyala senyawa logam (terutama alkali dan alkali tanah) melalui percobaan Diberikan tabel warna nyala beberapa senyawa logam, siswa dapat menentukan warna nyala salah satu logam Mengidentifikasi keteraturan sifat fisik dan sifat kimia unsur-unsur periode ke tiga melalui percobaan Siswa dapat menentukan kekuatan oksidator unsur unsur dalam satu perioda atau satu golongan 1 PG 26 C2 1 PG 27 C2 1 PG 28 C2 1 PG 29 C1 1 PG 30 C1 1 PG 31 C1 Menjelaskancara Siswa dapat menentukan cara menghilangkan kesadahan menghilangkan kesadahan sementara air melalui percobaan Sifat fisik dan sifat kimia unsur Menjelaskan manfaat dan dampak unsur-unsur (seperti gas mulia, halogen, alkali, alkali tanah, aluminium, karbon, silikon, belerang, krom, tembaga, seng, besi, oksigen dan nitrogen) serta senyawanya dalam kehidupan sehari-hari dan industri. Diberikan kegunaan beberapa gas mulia, siswa dapat menyebutkan kegunaan Argondalamkehidupanseharihari Menjelaskan pembuatan unsur dan senyawanya di laboratorium dan industri Diberikan data cara pembuatan unsur, siswa dapat menyebutkan cara pembuatan dan unsur yang dihasilkan Page 5 unsur dan senyawanya dalam kehidupan sehari-hari 3.4.Mendeskripsikan unsur-unsur radioaktif dari segi sifat-sifat fisik dan sifatsifat kimia, kegunaan, dan bahayanya Kimia – XII IPA – UAS – 2015/2016 (misalnya H2SO4, N2, Fe, Al, NH3 dan O2) Menentukan komposisi unsur dalam pupuk 1 PG 32 C2 1 PG 33 C1 Siswa dapat menghitung kadar nitrogen dalam pupuk urea Sifat sinar radioaktif Mengidentifikasi sifat-sifat Siswa dapat menentukan daya tembus sinar radioaktif terbesar bila disajikan partikel-partikel yang dipancarkan oleh unsur radioaktif Persamaan reaksi inti Menuliskan persamaan reaksi inti Siswa dapat menentukan partikel yang dipancarkan dalam reaksi inti 1 PG 34 C2 Kegunaan unsur radioaktif Mendeskripsikan kegunaan unsur-unsur radioaktif Siswa dapat memilih salah satu unsur radioaktif yang berguna untuk sterilisasi alat kedokteran 1 PG 35 C2 Siswa dapat menyebutkan 3 contoh penggunaan radioisotop dalam bidang kedokteran dan bidang lain. 1 Essay 40 C2 Page 6