BAB 14
advertisement

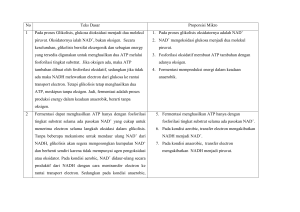
BAB 13. FERMENTASI Organisme membentuk energi dari nutrien melalui 2 cara, yaitu transfer elektron di membran sel dan transfer elektron di sitoplasma. Sumber elektron pada transfer elektron di sitoplasma adalah senyawa organik (heterotrof). Sumber elektron pada transfer elektron di membran sel ada 4, yaitu pigmen penangkap cahaya (fototrof), senyawa anorganik (autolitotrof), senyawa C1 (kemoautotrof), dan senyawa organik (heterotrof) Fotosintesis adalah pemanfaatan cahaya untuk pembentukan energi melalui transfer elektron di membran. Respirasi adalah pemanfaatan senyawa kimia (baik organik maupun anorganik) untuk pembentukan energi melalui transfer elektron di membran. Fermentasi adalah pemanfaatan senyawa organik untuk pembentukan energi melalui transfer elektron di sitoplasma. Pembentukan energi melalui transfer elektron di membran disebut juga fosforilasi oksidatif. Dengan demikian respirasi didefinisikan pembentukan energi melalui fosforilasi oksidatif. Pembentukan energi melalui transfer elektron di sitoplasma disebut fosforilasi tingkat substrat. Pembentukan energi dengan cara demikian ditemukan pada organisme fermentatif. Oleh karena itu, fermentasi didefinisikan sebagai pembentukan energi melalui fosforilasi tingkat substrat. Fermentasi sebenarnya proses yang tidak memerlukan oksigen. Fungi mampu melakukan fermentasi dalam kondisi aerob. Jadi fermentasi sebenarnya adalah metabolisme tanpa melibatkan oksigen, tetapi organisme fermentatif terkadang memerlukan oksigen untuk proses metabolisme lainnya maupun pertumbuhannya. Prokariota mampu melakukan fermentasi dan respirasi untuk menghasilkan energi. Respirasi aerob dilakukan, jika terdapat O2 sebagai akseptor elektron. Akan tetapi, jika tidak ada O2, maka prokariota melakukan respirasi anaerob (jika ada akseptor elektron selain oksigen) atau fermentasi (jika tidak ada akseptor elektron). Sebagian besar prokariota obligat anaerob terbunuh, jika ada oksigen di lingkungannya. Oksigen di dalam sel terakumulasi menjadi produk toksik, yaitu radikal hidroksil, radikal superoksida, dan hidrogen peroksida. Pada eukariota produk toksik ini dapat dinetralisir oleh peroksida dismutase atau katalase, tetapi prokariota obligat anaerob tidak memiliki enzim-enzim tersebut. Sebagian besar prokariota fermentatif menghasilkan semua ATP melalui fosforilasi tingkat substrat, kemudian ATP dihidrolisis oleh ATPsintase, sehingga dapat menghasilkan p yang dipakai untuk aktivitas membran. Pada lingkungan anaerob dapat terjadi rantai makanan. Karbohidrat, protein, lemak, dan senyawa organik lainnya difermentasi menjadi alkohol atau asam organik oleh organisme anaerob A. Asam organik atau etanol difermentasi menjadi CO2 oleh organisme anaerob B. CO2 ditambat oleh organisme anaerob C menjadi karbohidrat, protein, lemak, dan lainnya. Proses rantai makanan di lingkungan anaerob disebut rantai makanan anaerob. Pada organisme fermentatif permasalahan besar adalah mengoksidasi NADH yang dihasilkan dari proses glikolisis. Pada organisme respiratif masalah tersebut dapat diatasi, karena NADH langsung dioksidasi melalui serial transfer elektron sampai ke akseptor elektron. Fermentasi sebagian besar terjadi, karena ketiadaan akseptor elektron respiratif. Oleh karena itu, organisme fermentatif harus menyediakan akseptor elektron alternatif untuk menerima elektron dari NADH. Proses transfer elektron yang terjadi pada fermentasi disebut pembuangan elektron. Disebut demikian karena elektron bukan melewati serial transfer elektron, tetapi hanya sekali transfer elektron ke akseptor elektron. Biasanya produk yang dihasilkan dari pembuangan elektron disekresi ke luar sel (kalau produk hasil respirasi masih dapat dimanfaatkan lagi oleh sel), karena dapat meracuni sel prokariota, baik secara langsung, maupun tidak langsung. Etanol dapat membunuh prokariota, karena sebagian besar prokariota mati oleh akumulasi etanol dalam media. Asam organik dapat membunuh prokariota secara tidak langsung, karena asam organik akan menurunkan nilai pH, sehingga sebagian besar protein terdenaturasi. Beberapa hal yang perlu diperhatikan dalam meningkatkan produk fermentasi adalah meminimalisir pertambahan biomassa, menggunakan strain homofermentatif, dan mempertahankan lingkungan pada kondisi ideal. KESETIMBANGAN FERMENTASI Pada fermentasi sering dihasilkan lebih dari satu senyawa (multi-produk). Oleh karena itu, kita harus dapat menghitung apakah telah terjadi fermentasi sempurna atau tidak. Jika tidak, maka pasti terdapat produk lain yang tidak terukur. Kesetimbangan fermentasi dapat dihitung dengan 3 cara, yaitu metode O/R (O/R method), metode ketersediaan hidrogen (H available method), metode rekoveri karbon (C recovery method). Ketiga metode ini untuk menghitung keseimbangan konsumsi substrat dan produk yang dihasilkan oleh mikroba (Tabel 13.1). Nilai ideal dari kesetimbangan fermentasi adalah 1. Hal ini berarti semua substrat dikonversi menjadi produk fermentasi. Kesetimbangan fermentasi dapat dipakai untuk mengukur efisiensi fermentasi. Efisiensi fermentasi dapat diukur berdasarkan produk secara keseluruhan atau berdasarkan produk yang diinginkan. Pada kondisi aplikatif efisiensi fermentasi biasanya dihitung berdasarkan produk yang diinginkan. Pada fermentasi etanol efisiensi produksi etanol dihitung berdasarkan perbandingan berat etanol dengan konsumsi substrat. Misalnya 1 kg molase difermentasi menjadi 550 g etanol, efisiensi fermentasi adalah 550/1000 x 100% = 55% Hal ini berarti hanya 55% molase yang diubah menjadi etanol. Tabel 13.1 Kesetimbangan fermentasi glukosa oleh Lactobacillus pentoaceticus. Senyawa mmol Mmol Nilai Produk Produk Hidrogen Mmol karbon O/R teroksidasi tereduksi tersedia hidrogen Glukosa 100 600 0 24 2400 Laktat 100 300 0 12 1200 Gliserol 7 21 -1 7 14 98 Etanol 80 160 -2 160 12 960 Asetat 7 14 0 8 56 CO2 85 85 +2 170 0 Total 580 170 167 2314 Kesetimbangan fermentasi berdasarkan metode O/R adalah 167/170=0,98 metode ketersediaan H adalah 2314/2400=0,96 metode rekoveri karbon= 580/600=0,97 FERMENTASI ETANOL Fermentasi etanol dilakukan baik oleh eukariota dan prokariota. Eukariota yang paling sering dipakai sebagai fermentor etanol adalah khamir (Saccharomeces spp). Prokariota yang sering digunakan dalam fermentasi etanol adalah Pseudomonas dan Zymomonas mobilis. Fermentasi Etanol oleh Khamir (Saccharomeces cerevisiae) Khamir Saccharomeces cerevisiae menggunakan jalur EMP dalam memfermentasi glukosa menjadi etanol pada kondisi netral atau sedikit asam dan anaerob. Pada kondisi mikroaerofil S. cerevisiae melakukan respirasi. Pada kondisi tersebut 10% glukosa biasanya direspirasi menjadi CO2. Fermentasi etanol oleh S. cerevisiae menghasilkan etanol kurang dari 50%. Pada kondisi aerob khamir melakukan respirasi. Terdapat perubahan produk pada fermentasi etanol akibat perubahan kondisi media. Jika pada media terkandung natrium sulfit, maka menghasilkan gliserol sebagai produk yang dominan. Hal ini karena asetaldehid terjerat oleh sulfit, sehingga menjadi bisulfid. Pada kondisi ini asetaldehid tidak dapat menjadi akseptor elektron bagi NADH, sehingga gliserol fosfat berperan sebagai akseptor elektron bagi NADH dan gliserol fosfat diubah menjadi gliserol. Reaksi keseluruhan adalah sebagai berikut. C6H12O6 + HSO3- C3H8O3 + CO2 + C2H4O-HSO3glukosa sulfit gliserol asetaldehidbisulfid Jika media dalam kondisi alkali, terdapat perubahan komposisi produk. Pada kondisi alkali glukosa akan diubah menjadi gliserol, etanol, asetat, dan CO2. Pada kondisi alkali maka asetaldehid akan dioksidasi menjadi asetat dan NADH. NADH dipakai untuk mereduksi asetaldehid lainnya menjadi etanol. NADH hasil oksidasi glukosa menjadi 2 asetaldehid digunakan untuk mereduksi dihidroksiaseton fosfat menjadi gliserol fosfat, kemudian menjadi gliserol. glukosa + 2 NAD+ 2 asetaldehid + 2 NADH + 2 H+ + 2 CO2 glukosa + 2 ATP 2 dihidroksiaseton fosfat + 2 ADP asetaldehid + NAD+ + H2O asetat + NADH + H+ asetaldehid + NADH + H+ NAD+ + etanol 2 dihidroksiaseton fosfat + 2 NADH + 2 H+ 2 gliserol fosfat + 2 NAD+ 2 gliserol fosfat 2 gliserol + 2 Pi +. 2 C6H12O6 + 2 ATP + H2O 2 C3H8O3 + 2 CO2 + C2H6O + C2H4O2 +2(ADP+Pi) glukosa gliserol etanol asetat Gambar 13.1 Perbandingan jalur fermentasi etanol oleh S. cerevisiae (kiri) dan Z. mobilis (kanan). Fermentasi Etanol oleh Zymomonas mobilis Zymomonas mobilis merupakan prokariota obligat fermentatif dan mampu memfermentasi glukosa menjadi etanol dan karbon dioksida (Gambar 13.1). Glikolisis glukosa menjadi piruvat melalui jalur Entner Doudoroff. Etanol diperoleh dari dekarboksilasi piruvat menjadi asetaldehid dan reduksi asetaldehid menjadi etanol. Pada fermentasi etanol dihasilkan produk sampingan, yaitu karbon dioksida. Karena berat molekul etanol dan karbondioksida relatif sama, maka efisiensi produksi etanol dari glukosa adalah 50%. Beberapa keuntungan fermentasi etanol dengan menggunakan Z. mobilis dibandingkan S. cerevisiae. Keuntungan itu adalah sebagai berikut. Efisiensi produksi etanol dapat meningkat sampai mendekati 50%. Produksi etanol relatif cepat, karena Z. mobilis mempunyai piruvat dekarboksilase lebih banyak, sehingga dengan cepat piruvat didekarboksilasi menjadi asetaldehid, kemudian menjadi etanol. Produk samping relatif sedikit, itupun didominasi CO2. Hal ini karena Z. mobilis merupakan bakteri obligat fermentatif. Produksi etanol dalam media mampu mencapai 40%. Hal ini karena toleransi Z. mobilis yang tinggi terhadap etanol. FERMENTASI ASAM LAKTAT Bakteri asam laktat mampu mengubah glukosa menjadi asam laktat. Bakteri tersebut adalah Lactobacillus, Streptococcus, Leuconostoc, Pediococcus, dan Bifidobacterium. Ada 2 kelompok fermentasi asam laktat, yaitu homofermentatif dan heterofermentatif. Yang disebut lebih dulu menggunakan glikolisis melalui jalur EMP dan yang satunya menggunakan glikolisis melalui jalur HMP. Fermentasi Asam Laktat Homofermentatif Bakteri asam laktat homofermentatif menghasilkan mayoritas asam laktat dengan sedikit produk samping, yaitu gliserol, etanol, asetat, format dan CO2 (Gambar 13.2). Bakteri asam laktat homofermentatif mengoksidasi glukosa menjadi 2 piruvat melalui jalur EMP. Pada jalur ini menghasilkan 2 ATP. NADH yang dihasilkan pada jalur ini dipakai untuk mereduksi piruvat menjadi asam laktat. Reaksi keseluruhan adalah Glukosa + 2ADP + 2Pi 2 Laktat + 2 ATP Produk samping diperoleh, karena bakteri asam laktat homofermentatif mempunyai berbagai enzim yang dapat mengubah piruvat menjadi etanol dan CO2, asetat dan format, dan laktat. Jika piruvat tidak segera diubah menjadi produk di atas, NADH dipakai untuk mereduksi dihidroksi aseton fosfat menjadi gliserol. Gambar 13.2 Fermentasi asam laktat homofermentatif. Perubahan nilai pH pada media dapat mengubah komposisi produk fermentasi asam laktat homofermentatif Lactobacillus casei (Tabel 13.2). Fermentasi asam laktat idealnya dilakukan pada kondisi asam. Ketika kondisi diubah menjadi netral, sebagian piruvat dioksidasi menjadi asetil KoA dan format. Asetil KoA kemudian tereduksi menjadi asetat dan etanol. Tabel 13.2 Efek pH pada fermentasi laktat oleh Lactobacillus casei Produk pH 5 pH 7 Laktat 176,3 134,3 Asetat 9,5 19,2 Format 13,1 26,6 Etanol 5,0 12,7 Efisiensi fermentasi (%) 91,3 87,7 pH 8 102,0 31,5 47,3 18,7 84,0 Pada kondisi aerob S. faecalis mampu memfermentasi gliserol menjadi laktat. Hal ini karena oksigen digunakan untuk mereduksi koenzim Fp (flavoprotein) menjadi Fp dan hidrogen peroksida. Reaksi keseluruhan adalah sebagi berikut. Gliserol + ADP + Pi + O2 laktat + H2O2 + ATP Fermentasi Asam Laktat Heterofermentatif Bakteri asam laktat heterofermentatif menghasilkan asam laktat dan produk fermentasi lainnya (kebanyakan etanol) dengan rasio yang seimbang (Gambar 13.3). Hal ini karena mereka mengoksidasi glukosa menjadi piruvat dan asetil fosfat melalui jalur HMP. Piruvat kemudian direduksi menjadi asam laktat, sedangkan asetil fosfat kemudian direduksi menjadi etanol. Pada jalur ini menghasilkan 1 ATP. Reaksi keseluruhan adalah. Glukosa + ADP + Pi Laktat + etanol + CO2 + ATP Gambar 13.3 Fermentasi asam laktat heterofermentatif. Bakteri Streptococcus mutans mempunyai kemampuan dalam memfermentasi glukosa menjadi laktat (heterofermentatif) dalam suasana aerob. Pada kondisi aerob NADH dioksidasi menjadi NAD+ dengan bantuan oksigen dan NADH oksidase. Oleh karena itu, terdapat perubahan produk, di mana etanol diubah menjadi asetil KoA dan kemudian menjadi asetat. Perubahan asetil KoA menjadi asetat menghasilkan ATP. Jamur Rhizopus oryzae juga mempunyai kemampuan memfermentasi karbohidrat (pati dan glukosa) menjadi etanol dan asam laktat secara aerob. Gambar 13.4 Fermentasi asam laktat melalui jalur bifidium. Fermentasi Asam Laktat Melalui Jalur Bifidium Dinamakan jalur bifidium, karena ditemukan pada Bifidobacterium bifidium. Secara keseluruhan fermentasi asam laktat melalui jalur bifidium adalah 2 Glukosa + 5 ADP + 5 Pi 3 asetat + 2 laktat + 5 ATP Fermentasi asam laktat pada jalur ini melalui glikolisis melalui modifikasi jalur Pentosa Fosfat (Gambar 13.4). Dua molekul glukosa difosforilasi menjadi 2 molekul fruktosa 6-fosfat (perlu 2 ATP). Satu molekul fruktosa 6-fosfat dipecah menjadi eritrosa 4-fosfat dan asetil fosfat. Eritrosa 4-fosfat kemudian bereaksi dengan satu molekul fruktosa 6-fosfat lainnya menghasilkan sedoheptulosa 7-fosfat dan fosfogiseraldehid. Sedoheptulosa 7-fosfat bereaksi lagi dengan fosfogiseraldehid menghasilkan xilulosa 5fosfat dan ribulosa 5-fosfat. Ribulosa 5-fosfat berisomerasi menjadi xilulosa 5-fosfat. Dua molekul xilulosa 5-fosfat dipecah menjadi 2 fosfogliseraldehid dan 2 asetil fosfat. Dua molekul fosfogliseraldehid dioksidasi menjadi 2 piruvat kemudian direduksi menjadi 2 laktat (menghasilkan 4 ATP). Dua molekul asetil fosfat diubah menjadi 2 asetat (menghasilkan 2 ATP). FERMENTASI ASETAT Clostridium thermoaceticum mampu memfermentasi piruvat menjadi asetat melalui jalur asetil KoA. Karena produknya asetat, maka disebut juga asetogenesis. Selain C. thermoaceticum, bakteri pereduksi sulfat Desulfotomaculum thermobenzoicum juga mampu memfermentasi piruvat menjadi asetat (Gambar 13.5) di media tanpa sulfat. Kedua prokariota ini melakukan fermentasi piruvat menjadi asetat dengan model dan enzim yang sama. Kedua prokariota juga mampu menambat CO2 menjadi asetat juga dengan model yang sama. Yang membedakan adalah protein pembawa karbon (lihat penambatan CO2 pada bab sebelumnya). Piruvat diperoleh dari hasil glikolisis glukosa. Empat molekul piruvat dioksidasi oleh piruvat dehidrogense menjadi 4 molekul asetil KoA. Pergantian gugus KoA dengan fosfat oleh fosfotransasetilase membuat asetil KoA berubah menjadi asetil fosfat. Defosforilasi (dikopling dengan sintesis ATP) asetil fosfat oleh asetat kinase menghasilkan asetat. Pada proses fermentasi piruvat menjadi asetat menghasilkan 8 molekul NADH. NADH dipakai untuk menambat CO2 menjadi asetat. Enam elektron dipakai untuk menambat CO2 menjadi gugus metil [CH3] melalui jalur asetil KoA pada metanogen. Dua elektron dipakai untuk menambat CO2 menjadi kompleks karbonmonoksida karbonmonoksida dehidrogenase (CO-CODH). Selanjutnya, gugus metil diinkorporasi ke kompleks CO-CODH menjadi CH3-CO-CODH. Gugus CH3-CO- ditransfer ke KoA juga oleh karbonmonoksida dehidrogenase, sehingga menjadi asetil KoA. Selanjutnya asetil KoA diubah menjadi asetat sama seperti pada fermentasi piruvat menjadi asetat. Reaksi keseluruhan asetogenesis Desulfotomaculum thermobenzoicum adalah 4 Piruvat + 4 ADP + 4 Pi 5 asetat + 2 CO2 + 4 ATP Gambar 13.5 Asetogenesis dari piruvat pada Desulfotomaculum thermobenzoicum. Pada bakteri asam asetat lainnya, misalnya Acetobacter dan Gluconobacter mampu memfermentasi glukosa dan etanol menjadi asetat. Gluconobacter suboxydans tidak mempunyai enzim-enzim pada siklus asam sitrat, kecuali suksinat dehidrogenase. Modifikasi siklus pentosa fosfat digunakan untuk memfermentasi glukosa menjadi asetat (Gambar 13.6). Glukosa difosforilasi menjadi glukosa 6-fosfat, kemudian diisomerisasi menjadi 2 molekul fruktosa 6-fosfat. Fruktosa 6-fosfat dipecah menjadi asetil fosfat dan eritrosa 4-fosfat. Asetil fosfat dideforforilasi menjadi asetat. Eritrosa 4fosfat bereaksi dengan fruktosa 6-fosfat menjadi sedoheptulosa 7-fosfat dan gliseraldehid 3-fosfat. Reaksi ini dikatalisis transaldolase. Sedoheputosa 7-fosfat dan gliseraldehid 3-fosfat bereaksi menjadi ribulosa 5-fosfat dan xilulusa 5-fosfat. Reaksi ini dikatalisis transketolase. Xilulosa 5-fosfat diisomerisasi menjadi ribulosa 5-fosfat. Dua molekul Ribulosa 5-fosfat dipecah menjadi 2 molekul gliseraldehid 3-fosfat dan 2 molekul asetil fosfat. Dua molekul asetil KoA didefosforilasi menjadi asetat. Dua molekul gliseraldehid 3-fosfat berkondensasi menjadi fruktosa 1,6-bisfosfat. Fruktosa 1,6- bisfosfat terdefosforilasi menjadi fruktosa 6-fosfat. Fruktosa 6-fosfat menggantikan fruktosa 6-fosfat yang bereaksi dengan eritrosa 4-fosfat. Gambar 13.6 Fermentasi asetat dari glukosa oleh Gluconobacter. Karakteristik Asetobacter dan Gluconobacter adalah kemampuannya mengoksidasi etanol menjadi asetat. Dua dehidrogenase membran sel terlibat dalam oksidasi etanol menjadi asetat, yaitu etanol dehidrogenase dan asetaldehid dehidrogenase. Reaksi keseluruhan oksidasi fermentasi etanol menjadi asetat adalah sebagai berikut. CH3CH2OH + ½ O2 CH3COOH + 2H etanol asetat FERMENTASI BUTIRAT Fermentasi butirat dilakukan oleh Clostridium sp (Gambar 13.7). Clostridium adalah bakteri penghasil spora heterogenus. Mereka dapat sebagai sakarolitik atau proteolitik. Clostridium proteolitik sangat penting bagi dekomposisi anaerob yang disebut putrefaction. Clostridium butyricum mampu memfermentasi karbohidrat menjadi butirat. Produk fermentasi selain butirat adalah gas hidrogen, karbondioksida, sedikit asetat. Gambar 13.7 Fermentasi butirat oleh Clostridium sp. Glukosa dipecah menjadi piruvat melalui jalur EMP (menghasilkan 4 elektron dan 2 ATP). Piruvat didekarboksilasi oleh piruvatferedoksi eksidoreduktase menjadi asetil KoA, CO2. H2 diperoleh dari aktivitas oksidasi hidrogenase terhadap feredoksin. Dua molekul asetil KoA berkondensasi menghasilkan asetoasetil KoA dengan bantuan asetil KoA asetiltransferase. Asetoasetil KoA direduksi menjadi -hidroksibutiril KoA oleh dehidrogenase. -Hidroksibutiril KoA didehidrasi menjadi krotonil KoA oleh krotonase. Krotonil KoA direduksi menjadi butiril KoA oleh butiril KoA dehidrogenase. Pengantian gugus KoA oleh fosfat mengakibatkan butiril KoA menjadi butiril fosfat. Reaksi ini dikatalisis fosfotransbutirilase. Butiril fosfat didefosforilasi (dikopling dengan sintesis ATP) menjadi butirat oleh butirat kinase. C. tyrobutyricum mampu memproduksi butirat dan asetat dari glukosa (Gambar 13.7). Untuk menurunkan produksi asetat, gen pta yang mengkode asetat kinase dapat dihilangkan. Meskipun gen pta dihilangkan, tetapi C. tyrobutyricum masih mampu menghasilkan asetat. Hal ini menunjukkan bahwa terdapat jalur atau enzim lain yang mampu menghasilkan asetat. Bakteri rumen Butyrivibrio fibrisolvens mampu memfermentasi glukosa menjadi butirat. Fermentasi glukosa menjadi butirat oleh Butyrivibrio fibrisolvens melalui rute/jalur yang sama dengan Clostridium. Pada kondisi pertumbuhan tinggi (pada fase eksponensial) glukosa difermentasi menjadi butirat, asetat, H2 dan CO2. Asetat merupakan produk samping dan diperoleh dari forforilasi asetil KoA menjadi asetil fosfat oleh fosfotransasetilase. Asetil fosfat kemudian didefosforilasi menjadi asetat oleh asetat kinase. Tabel 13.3 Perbandingan kadar produk pada fermentasi butirat dan Butanol-aseton (mmol/100 mmol glukosa) Produk C. C. aceto- C. C. thermac- B. aceto- B. saccharo- butylicum butylicum charolyticum ethylicum polymyxa butyricum CO2 195,5 220,0 207,0 174,0 215,0 195,0 H2 233,0 165,9 111,1 229,4 137,0 54,0 Asetat 42,6 24,8 20,3 48,5 16,0 5,0 Butirat 75,3 7,1 14,5 59,5 Format Sedikit 10,0 Laktat 25,7 Etanol 4,9 122,0 95,0 Butanol 47,4 50,2 4,5 Aseton 22,3 28,0 6,0 Isopropanol 18,0 Asetoin 5,7 2,3-Butandiol 12,0 39,0 Rekoveri C % 97,0 98,0 93,5 98,0 105,0 100,0 Sumber: Moat A.G. & J.W. Foster. 1995. Microbial Physiology. Wiley-Lyss, New York Gambar 13.8 Fermentasi butirat dan butanol-aseton C. acetobutylicum. Garis takputus menunjukkan alur fermentasi pada fase perbanyakan, sedangkan garis terputus menunjukkan alur fermentasi pada fase statis. Ketika sel masuk ke fase statis dan kandungan butirat tinggi, terjadi fermentasi glukosa dan pentosa menjadi aseton. Selain itu, terjadi konsumsi butirat asetat menjadi butanol dan etanol (Gambar 13.8 dan Tabel 13.3). Glukosa dan pentosa diglikolisis menjadi piruvat. Piruvat didekarboksilasi menjadi asetil KoA oleh piruvatferedoksin oksidoreduktase. Kondensasi 2 molekul asetil KoA menjadi asetoasetil KoA oleh asetil KoA transasetilase. Asetoasetat dipecah menjadi aseton dan CO2 oleh asetoasetat dekarboksilase.Gugus KoA dari asetoasetil KoA ditransfer ke butirat atau asetat, sehingga menjadi butiril KoA atau asetil KoA . Reaksi ini dikatalisis asetoasetil KoA-butirat atau asetat-KoA transferase. Butiril KoA direduksi menjadi butiraldehid oleh butiraldehid dehidrogenase, kemudian direduksi menjadi butanol oleh butanol dehidrogenase. Sedangkan asetil KoA direduksi menjadi asetaldehid oleh asetaldehid dehidrogenase, kemudian direduksi menjadi etanol oleh etanol dehidrogenase. FERMENTASI PROPIONAT Propionat, asetat, dan karbon dioksida merupakan produk utama dari fermentasi laktat, glukosa, dan gliserol oleh Propiniobacterium, Veillonella, Bacteroides dan beberapa Clostridium spp. Hipotesis awal menyatakan bahwa langkah awal fermentasi propionat adalah dehidrasi laktat menjadi akrilat. Akrilat kemudian direduksi menjadi propionat. Rute tersebut teramati pada Clostridium propionicum, Bacteroides rumicola, dan Peptostreptoccus. Pada Propionibacterium dan Veillonella pembentukan propionat melalui rute yang lebih kompleks. Fermentasi Propionat oleh Clostridium propionicum C. propionicum mampu memfermentasi asam laktat menjadi asetat (melalui jalur asetil KoA) dan propionat (melalui jalur akrilil KoA) dan menghasilkan 1 ATP (Gambar 13.9). Satu molekul laktat didehidrogenasi menjadi piruvat oleh laktat dehidrogenase. Piruvat didehidrogenasi dan dekarboksilasi menjadi asetil KoA oleh piruvatferedoksin oksidoreduktase. Gugus fosfat menggantikan gugus KoA oleh fosfotransasetilase, sehingga Asetil KoA diubah menjadi asetil fosfat. Asetil fosfat didefosforilasi (dikopling dengan sintesis ATP) menjadi asetat oleh asetat kinase. Pada jalur ini menghasilkan 1 ATP, 1 CO2, dan 4 elektron. Empat elektron dipakai untuk mereduksi 2 molekul laktat menjadi 2 molekul propionat. Gugus KoA (berasal dari propionil KoA) ditransfer ke laktat oleh KoA transferase, sehingga menjadi laktil KoA. laktil KoA terdehidrasi menjadi akrilil KoA. Reaksi ini dikatalisis akrililase. Akrilil KoA direduksi menjadi propionil KoA oleh propionil KoA dehidrogenase. Propionil KoA diubah menjadi propionat. Reaksi keseluruhan adalah sebagai berikut. 3 Laktat + ADP + Pi 2 propionat + asetat + CO2 + ATP Gambar 13.9 Fermentasi propionat melalui jalur akrilat oleh C. propionicum. Fermentasi Propionat oleh Propionibacterium Propionibacterium memfermentasi laktat, triosa, dan heksosa menjadi propionat (jalur suksinat-propionat), asetat (jalur asetil KoA), dan karbon dioksida (Gambar 13.10 dan Tabel 13.4). Tiga molekul laktat diubah menjadi tiga molekul piruvat oleh laktat dehidrogenase. Satu molekul piruvat diubah menjadi satu molekul asetat sama seperti pada C. propionicum. Fermentasi laktat menjadi asetat menghasilkan 2 elektron dan perubahan 2 molekul laktat menjadi 2 molekul piruvat menghasilkan 6 elektron. Delapan elektron ini dipakai untuk mereduksi piruvat menjadi propionat. Piruvat dikarboksilasi (berasal dari dekarboksilasi metilmalonil KoA) menjadi oksaloasetat oleh transkarboksilase. Reduksi oksaloasetat menjadi malat oleh malat dehidrogenase. Malat dihidrasi menjadi fumarat oleh fumarase. Fumarat direduksi menjadi suksinat oleh fumarat reduktase. Transfer gugus KoA (berasal dari propionil KoA) ke suksinat, sehingga menjadi suksinil KoA. Reaksi ini dikatalisis suksinil KoA transferase. Re-aransemen suksinil KoA menjadi metil malonil KoA oleh metil malonil KoA rasemase. Dekarboksilasi metil malonil KoA oleh transkarboksilase, sehingga menjadi propionil KoA. Propionil KoA diubah menjadi propionat. Secara teoritis rasio propionat dan asetat adalah 2, tetapi tidak jarang rasionya lebih dari 2 (Tabel 13.4). Reaksi keseluruhan adalah sebagai berikut. 3 Laktat + 2 ADP + 2 Pi 2 propionat + asetat + CO2 + 2 ATP Gambar 13.10 Fermentasi propionat oleh Propionibacterium. Tampak bahwa reduksi piruvat menjadi suksinil KoA merupakan rute pada jalur reduktif-asam sitrat, Jadi boleh dikatakan bahwa fermentasi propionat pada Propionibacterium melalui jalur reduktif-asam sitrat. Produksi propionat dan asetat dapat ditingkatkan, jika tekanan gas CO2 diturunkan. FERMENTASI ASAM CAMPURAN Pada kondisi anaerob dan ketiadaan akseptor elektron, anggota Enterobacteriaceae (Escherichia, Enterobacter, Salmonella, Klebsiella, dan Shigella) memfermentasi glukosa menjadi campuran asetat, format, suksinat, etanol, CO2 dan H2 (Tabel 13.5). Semua produk diperoleh dari fosfoenol piruvat (PEP) (Gambar 13.11). Atau lebih tepatnya suksinat dari PEP. Lainnya dari piruvat (piruvat diperoleh dari PEP). Tabel 13.4 Fermentasi propionat oleh Propionibacterium (mmol/100 mmol glukosa) Bakteri Substrat Propionat Asetat CO2 Suksinat Rasio P/A Glukosa 134,0 52,6 46,2 12,6 2,56 P. freudenreichii Laktat 63,5 35,3 35,8 37,8 1,8 Gliserol 100,0 9,9 6,9 11,7 10,0 P. freudenreichii Glukosa 140,0 56,8 56,4 12,0 2,46 P. freudenreichii Laktat 62,5 36,5 37,0 9,3 1,7 P. shermanii Gliserol 102,0 10,6 7,3 11,2 10,0 P. shermanii Glukosa 114,0 54,0 51,0 11,1 2,1 P. shermanii Glukosa 148,0 10,0 63,6 7,9 14,8 P. peterssonii P. arabinosum Sumber: Moat A.G. & J.W. Foster. 1995. Microbial Physiology. Wiley-Lyss, New York Gambar 13.11 Fermentasi asam campuran. Suksinat diperoleh dari karboksilasi PEP melalui jalur reduktif-asam sitrat (jalur suksinat). PEP diubah menjadi oksaloasetat oleh PEP karboksilase. Perubahan oksaloasetat menjadi suksinat melalui rute dan melibatkan enzim yang sama seperti pada perubahan oksaloasetat menjadi suksinat pada fermentasi propionat pada bakteri Propionibacterium. Laktat diperoleh langsung dari reduksi piruvat oleh laktat dehidrogenase. Format diperoleh dari pemecahan piruvat (hasil lain adalah asetil KoA), kemudian dapat diubah CO2 dan H2. Asetil KoA dapat diubah menjadi etanol maupun asetat. Lactobaciilus helveticus memfermentasi sitrat dan laktosa menjadi laktat. Akan tetapi, jika laktosa ditiadakan, terjadi perubahan produk fermentasi, yaitu menghasilkan asetat dan suksinat, bukan laktat. Asetoin dan diasetil tidak terdeteksi pada produk fermentasi L. helveticus. Tampaknya produksi asetat dari piruvat (hasil konversi sitrat) diperantarai NADH okdidase, bukan asetat kinase. Tabel 13.5 Produk hasil fermentasi asam campuran (mmol/100 mmol glukosa) Produk Escherichia Salmonella Enterobacter coli typhii aerogenes Laktat 108,8 53,4 121,7 Etanol 41,3 59,4 25,4 Asetat 32,0 10,1 25,6 Format 1,6 5,5 39,3 CO2 54,0 126,9 0 H2 45,2 44,2 0 Suksinat 18,0 6,0 10,8 2,3-butandiol 0 34,6 0 Rekoveri C (%) 100,0 99,5 93,3 Sumber: Moat A.G. & J.W. Foster. 1995. Microbial Physiology. Wiley-Lyss, New York FERMENTASI BUTANDIOL Fermentasi butandiol ditandai dengan produksi 2,3-butandiol dan asetoin (juga laktat, etanol, dan format; Gambar 13.12).Glukosa dioksidasi melalui glikolisis jalur EMP menjadi piruvat. Terdapat 3 arah metabolisme piruvat pada fermentasi butandiol. Piruvat direduksi menjadi laktat oleh laktat dehidrogenase. Piruvat juga dapat dipecah menjadi asetil KoA dan format oleh piruvat format liase. Asetil KoA terduksi menjadi asetaldehid oleh asetaldehid dehidrogenase, kemudian direduksi menjadi etanol oleh etanol dehidrogenase. Piruvat juga mengalami dekarboksilasi menjadi asetaldehid aktif, kemudian diubah menjadi asetolaktat. Kedua reaksi ini dikatalisis asetolaktat sintase. Dekarboksilasi asetolaktat menjadi asetoin oleh asetolaktat dehidrogenase. Reduksi Asetoin menjadi 2,3-butandiol oleh 2,3-butandiol dehidrogenase. Produksi butandiol dipengaruhi oleh nilai pH media. Fermentasi glukosa menjadi butandiol mudah terjadi pada media dengan nilai pH sedikit asam, tetapi, jika nilai pH media menjadi asam, glukosa cenderung diubah menjadi asam campuran. Gambar 13.12 Fermentasi butandiol. FERMENTASI BAKTERI RUMEN Bakteri rumen Ruminococcus albus mampu memfermentasi glukosa menjadi etanol, asetat, hidrogen, dan karbondioksida melalui glikolisis jalur EMP (Gambar 13.13). Glukosa lebih dulu dioksidasi menjadi piruvat oleh enzim-enzim pada glikolisis jalur EMP. Piruvat kemudian didekarboksilasi oleh piruvat feredoksin oksidoreduktase menjadi asetil KoA dan gas hidrogen. Asetil KoA direduksi menjadi asetaldehid oleh asetaldehid dehidrogenase, kemudian direduksi menjadi etanol oleh etanol dehidrogenase. Asetil KoA dapat juga mengalami fosforilasi menjadi asetil fosfat oleh fosfotransasetilase. Asetil fosfat mengalami defosforilasi menjadi asetat oleh asetat kinase. Laktat pada fermentasi rumen dihasilkan oleh bakteri laktat rumen, tetapi butirat pada fermentasi rumen dapat dihasilkan oleh bakteri maupun protozoa rumen. Ketika R. albus ditumbuhkan bersama (kultur campuran) dengan bakteri metanogen terdapat perubahan produksi hasil fermentasi (Gambar 13.13). Hidrogen yang dihasilkan melalui glikolisis jalur EMP dan dekarboksilasi piruvat dimanfaatkan oleh bakteri metanogen untuk penambatan karbondioksida menjadi metana. Karena ketiadaan hidrogen, maka sedikit NADH yang diproduksi R. albus. Hal ini mengakibatkan asetil KoA bukan diubah menjadi etanol, tetapi diubah menjadi asetat. Perubahan asetil KoA menjadi asetat tidak memerlukan NADH. Gambar 13.13 Fermentasi etanol-asetat oleh bakteri rumen R. albus.