mesin carnot - arlynphysicskANDA
advertisement

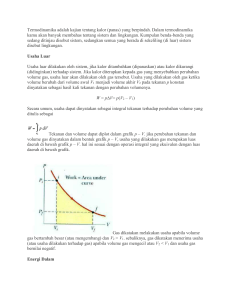
Pada akhir pembelajaran bab ini anda dapat : 1. Menerapkan konsep termodinamika 2. Menerapkan konsep mesin kalor TERMODINAMIKA Termodinamika (bahasa Yunani: thermos = 'panas' and dynamic = 'perubahan') adalah fisika energi , panas, kerja, entropi dan kespontanan proses. Termodinamika berhubungan dekat dengan mekanika statistik di mana banyak hubungan termodinamika berasal. Pada sistem di mana terjadi proses perubahan wujud atau pertukaran energi, termodinamika klasik tidak berhubungan dengan kinetika reaksi (kecepatan suatu proses reaksi berlangsung). Karena alasan ini, penggunaan istilah "termodinamika" biasanya merujuk pada termodinamika setimbang. Dengan hubungan ini, konsep utama dalam termodinamika adalah proses kuasistatik, yang diidealkan, proses "super pelan". Proses termodinamika bergantung-waktu dipelajari dalam termodinamika tak-setimbang. Karena termodinamika tidak berhubungan dengan konsep waktu, telah diusulkan bahwa termodinamika setimbang seharusnya dinamakan termostatik. Hukum termodinamika kebenarannya sangat umum, dan hukum-hukum ini tidak bergantung kepada rincian dari interaksi atau sistem yang diteliti. Ini berarti mereka dapat diterapkan ke sistem di mana seseorang tidak tahu apa pun kecual perimbangan transfer energi dan wujud di antara mereka dan lingkungan. Contohnya termasuk perkiraan Einstein tentang emisi spontan dalam abad ke-20 dan riset sekarang ini tentang termodinamika benda hitam. Konsep dasar dalam termodinamika Pengabstrakkan dasar atas termodinamika adalah pembagian dunia menjadi sistem dibatasi oleh kenyataan atau ideal dari batasan. Sistem yang tidak termasuk dalam pertimbangan digolongkan sebagai lingkungan. Dan pembagian sistem menjadi subsistem masih mungkin terjadi, atau membentuk beberapa sistem menjadi sistem yang lebih besar. Biasanya sistem dapat diberikan keadaan yang dirinci dengan jelas yang dapat diuraikan menjadi beberapa parameter ! Sistem termodinamika Sistem termodinamika adalah bagian dari jagat raya yang diperhitungkan. Sebuah batasan yang nyata atau imajinasi memisahkan sistem dengan jagat raya, yang disebut lingkungan. Klasifikasi sistem termodinamika berdasarkan pada sifat batas sistemlingkungan dan perpindahan materi, kalor dan entropi antara sistem dan lingkungan. Ada tiga jenis sistem berdasarkan jenis pertukaran yang terjadi antara sistem dan lingkungan: sistem terisolasi: tak terjadi pertukaran panas, benda atau kerja dengan lingkungan. Contoh dari sistem terisolasi adalah wadah terisolasi, seperti tabung gas terisolasi. sistem tertutup: terjadi pertukaran energi (panas dan kerja) tetapi tidak terjadi pertukaran benda dengan lingkungan. Rumah hijau adalah contoh dari sistem Modul Fisika XI Semester Gasal Tahun Ajaran 2012/2013 tertutup di mana terjadi pertukaran panas tetapi tidak terjadi pertukaran kerja dengan lingkungan. Apakah suatu sistem terjadi pertukaran panas, kerja atau keduanya biasanya dipertimbangkan sebagai sifat pembatasnya: o pembatas adiabatik: tidak memperbolehkan pertukaran panas. o pembatas rigid: tidak memperbolehkan pertukaran kerja. sistem terbuka: terjadi pertukaran energi (panas dan kerja) dan benda dengan lingkungannya. Sebuah pembatas memperbolehkan pertukaran benda disebut permeabel. Samudra merupakan contoh dari sistem terbuka. Dalam kenyataan, sebuah sistem tidak dapat terisolasi sepenuhnya dari lingkungan, karena pasti ada terjadi sedikit pencampuran, meskipun hanya penerimaan sedikit penarikan gravitasi. Dalam analisis sistem terisolasi, energi yang masuk ke sistem sama dengan energi yang keluar dari sistem. Keadaan termodinamika Ketika sistem dalam keadaan seimbang dalam kondisi yang ditentukan, ini disebut dalam keadaan pasti (atau keadaan sistem). Untuk keadaan termodinamika tertentu, banyak sifat dari sistem dispesifikasikan. Properti yang tidak tergantung dengan jalur di mana sistem itu membentuk keadaan tersebut, disebut fungsi keadaan dari sistem. Bagian selanjutnya dalam seksi ini hanya mempertimbangkan properti, yang merupakan fungsi keadaan. Jumlah properti minimal yang harus dispesifikasikan untuk menjelaskan keadaan dari sistem tertentu ditentukan oleh Hukum fase Gibbs. Biasanya seseorang berhadapan dengan properti sistem yang lebih besar, dari jumlah minimal tersebut. Pengembangan hubungan antara properti dari keadaan yang berlainan dimungkinkan. Persamaan keadaan adalah contoh dari hubungan tersebut. Hukum-hukum Dasar Termodinamika Terdapat empat Hukum Dasar yang berlaku di dalam sistem termodinamika, yaitu: Hukum Awal (Zeroth Law) Termodinamika Hukum ini menyatakan bahwa dua sistem dalam keadaan setimbang dengan sistem ketiga, maka ketiganya dalam saling setimbang satu dengan lainnya. Hukum Pertama Termodinamika Hukum ini terkait dengan kekekalan energi. Hukum ini menyatakan perubahan energi dalam dari suatu sistem termodinamika tertutup sama dengan total dari jumlah energi kalor yang disuplai ke dalam sistem dan kerja yang dilakukan terhadap sistem. Hukum kedua Termodinamika Modul Fisika XI Semester Gasal Tahun Ajaran 2012/2013 Hukum kedua termodinamika terkait dengan entropi. Hukum ini menyatakan bahwa total entropi dari suatu sistem termodinamika terisolasi cenderung untuk meningkat seiring dengan meningkatnya waktu, mendekati nilai maksimumnya. Hukum ketiga Termodinamika Hukum ketiga termodinamika terkait dengan temperatur nol absolut. Hukum ini menyatakan bahwa pada saat suatu sistem mencapai temperatur nol absolut, semua proses akan berhenti dan entropi sistem akan mendekati nilai minimum. Hukum ini juga menyatakan bahwa entropi benda berstruktur kristal sempurna pada temperatur nol absolut bernilai nol. Proses-proses Pada Hukum 1 Termodinamika : Isobaris Isokhoris Isotermis Adiabatis 1. Hukum I termodinamika untuk Proses Isobaris Pada proses ini gas dipanaskan dengan tekanan tetap. Proses Isobaris Dengan demikian pada proses ini berlaku persamaan Boyle-GayLussac V1 / T1 = V2 / T2 Jika grafik ini digambarkan dalam hubungan P dan V maka dapat grafik sebagai berikut : Usaha luar yang dilakukan adalah : W = p ( V2 – V1 ). karena itu hukum I termodinamika dapat dinyatakan : dQ = dU + p ( V2 – V1 ) Modul Fisika XI Semester Gasal Tahun Ajaran 2012/2013 Panas yang diperlukan untuk meningkatkan suhu gas pada tekanan tetap dapat dinyatakan dengan persamaan : dQ = m cp ( T2 – T1 ) Pertambahan energi dalam gas dapat pula dinyatakan dengan persamaan : dU = m cv ( T2 – T1 ) Karena itu pula maka usaha yang dilakukan pada proses isobaris dapat pula dinyatakan dengan persamaan : dW = dQ – dU = m ( cp - cv ) ( T2 – T1 ) m = massa gas cp = kalor jenis gas pada tekanan tetap cv = kalor jenis pada volume tetap. 2. Hukum I termodinamika untuk Proses Isokhoris Pada proses ini volume Sistem konstan. Proses Isokhoris Dengan demikian dalam proses ini berlaku Hukum Boyle-Gay Lussac dalam bentuk : P1 / T1 = P2 / T2 Jika digambarkan dalam grafik hubungan P dan V maka grafiknya sebagai berikut : Karena dV = 0 maka W = p . dV Modul Fisika XI Semester Gasal Tahun Ajaran 2012/2013 W = 0 ( tidak ada usaha luar selama proses ) dQ = U2 – U1 Kalor yang diserap oleh sistem hanya dipakai untuk menambah energi dalam (dU) dQ = dU dU = m . cv ( T2 – T1 ) Modul Fisika XI Semester Gasal Tahun Ajaran 2012/2013 3. Hukum I termodinamika untuk Proses Isotermis Selama proses suhunya konstan. Proses Isotermis Modul Fisika XI Semester Gasal Tahun Ajaran 2012/2013 4. Hukum I termodinamika untuk Proses Adiabatis Selama proses tak ada panas yang masuk / keluar sistem jadi Q = 0 Proses Adiabatis MESIN CARNOT Modul Fisika XI Semester Gasal Tahun Ajaran 2012/2013 Mesin Carnot adalah mesin kalor hipotetis yang beroperasi dalam suatu siklus reversibel yang disebut siklus Carnot. Model dasar mesin ini dirancang oleh Nicolas Léonard Sadi Carnot, seorang insinyur militer Perancis pada tahun 1824. Model mesin Carnot kemudian dikembangkan secara grafis oleh Émile Clapeyron 1834, dan diuraikan secara matematis oleh Rudolf Clausius pada 1850an dan 1860an. Dari pengembangan Clausius dan Clapeyron inilah konsep dari entropi mulai muncul. Setiap sistem termodinamika berada dalam keadaan tertentu. Sebuah siklus termodinamika terjadi ketika suatu sistem mengalami rangkaian keadaan-keadaan yang berbeda, dan akhirnya kembali ke keadaan semula. Dalam proses melalui siklus ini, sistem tersebut dapat melakukan usaha terhadap lingkungannya, sehingga disebut mesin kalor. Sebuah mesin kalor bekerja dengan cara memindahkan energi dari daerah yang lebih panas ke daerah yang lebih dingin, dan dalam prosesnya, mengubah sebagian energi menjadi usaha mekanis. Sistem yang bekerja sebaliknya, dimana gaya eksternal yang dikerjakan pada suatu mesin kalor dapat menyebabkan proses yang memindahkan energi panas dari daerah yang lebih dingin ke energi panas disebut mesin refrigerator. Pada diagram di samping, yang diperoleh dari tulisan Sadi Carnot berjudul Pemikiran tentang Daya Penggerak dari Api (Réflexions sur la Puissance Motrice du Feu), diilustrasikan ada dua benda A dan B, yang temperaturnya dijaga selalu tetap, dimana A memiliki temperatur lebih tinggi daripada B. Kita dapat memberikan atau melepaskan kalor pada atau dari kedua benda ini tanpa mengubah suhunya, dan bertindak sebagai dua reservoir kalor. Carnot menyebut benda A "tungku" dan benda B "kulkas".[1] Carnot lalu menjelaskan bagaimana kita bisa memperoleh daya penggerak (usaha), dengan cara memindahkan sejumlah tertentu kalor dari reservoir A ke B. Dibawah ini adalah diagram mesin Carnot sebagaimana biasanya dimodelkan dalam pembahasan modern Diagram mesin Carnot (modern) - kalor mengalir dari reservoir bersuhu tinggi TH melalui "fluida kerja", menuju reservoir dingin TC, dan menyebabkan fluida kerja memberikan usaha mekanis kepada lingkungan, melalui siklus penyusutan (kontraksi) dan pemuaian (ekspansi). Dalam diagram tersebut, sistem ("fluida kerja"), dapat berupa benda fluida atau uap apapun yang dapat menerima dan memancarkan kalor Q, untuk menghasilkan usaha. Carnot mengusulkan bahwa fluida ini dapat berupa zat apapun yang dapat mengalami ekspansi, seperti uap air, uap alkohol, uap raksa, gas permanen, udara, dll. Sekalipun begitu, pada tahun-tahun awal, mesin-mesin kalor biasanya memiliki beberapa konfigurasi khusus, yaitu QH disuplai oleh pendidih, di mana air didihkan pada sebuah tungku, QC biasanya adalah aliran air dingin dalam bentuk embun yang terletak di berbagai bagian Modul Fisika XI Semester Gasal Tahun Ajaran 2012/2013 mesin. Usaha keluaran W biasanya adalah gerakan piston yang digunakan untuk memutar sebuah engkol, yang selanjutnya digunakan untuk memutar sebuah katrol. Penggunaannya biasanya untuk mengangkut air dari sebuah pertambangan garam. Carnot sendiri mendefinisikan "usaha" sebagai "berat yang diangkat melalui sebuah ketinggian". Modul Fisika XI Semester Gasal Tahun Ajaran 2012/2013 Teorema Carnot Sebuah mesin nyata (real) yang beroperasi dalam suatu siklus pada temperatur and tidak mungkin melebihi efisiensi mesin Carnot. Sebuah mesin nyata (kiri) dibandingkan dengan siklus Carnot (kanan). Entropi dari sebuah material nyata berubah terhadap temperatur. Perubahan ini ditunjukkan dengan kurva pada diagram T-S. Pada gambar ini, kurva tersebut menunjukkan kesetimbangan uap-cair ( lihat siklus Rankine). Sifat irreversibel sistem dan kehilangan kalor ke lingkungan (misalnya, disebabkan gesekan) menyebabkan siklus Carnot ideal tidak dapat terjadi pada semua langkah sebuah mesin nyata. Teorema Carnot adalah pernyataan formal dari fakta bahwa: Tidak mungkin ada mesin yang beroperasi di antara dua reservoir panas yang lebih efisien daripada sebuah mesin Carnot yang beroperasi pada dua reservoir yang sama. Artinya, efisiensi maksimum yang dimungkinkan untuk sebuah mesin yang menggunakan temperatur tertentu diberikan oleh efisiensi mesin Carnot, Implikasi lain dari teorema Carnot adalah mesin reversibel yang beroperasi antara dua reservoir panas yang sama memiliki efisiensi yang sama pula. Efisiensi maksimum yang dinyatakan pada persamaan diatas dapat diperoleh jika dan hanya jika tidak ada entropi yang diciptakan dalam siklus tersebut. Jika ada, maka karena entropi adalah fungsi keadaan, untuk membuang kelebihan entropi agar dapat kembali ke keadaan semula akan melibatkan pembuangan kalor ke lingkungan, yang merupakan proses irreversibel dan akan menyebabkan turunnya efisiensi. Jadi persamaan di atas hanya memberikan efisiensi dari sebuah mesin kalor reversibel. Modul Fisika XI Semester Gasal Tahun Ajaran 2012/2013 1. Proses yang dialami gas dalam ruangan tertutup pada volum tetap disebut ... 2. Proses yang dialami gas dalam ruangan tertutup pada tekanan tetap disebut ... 3. Proses yang dialami gas dalam ruangan tertutup pada suhu tetap disebut ... 4. Hukum pertama termodinamika dinyatakan dengan rumus ... 5. Suatu gas dimampatkan sehingga volumnya berkurang dari 5,0 L menjadi 3,5 L pada tekanan konstan 105 Pa. Maka usaha luar yang dilakukan pada gas adalah ... 6. Penerapan Hukum I Termodinamika pada mesin.... 7. Penerapan Hukum II Termodinamika pada mesin.... 8. Pengertian dari efisiensi mesin Carnot adalah... 9. Jika sebuah mesin Carnot bekerja antara suhu 27°C dan 127°C, maka efisiensi mesin tersebut adalah ... 10. Tuliskan 4 ciri gas ideal! Modul Fisika XI Semester Gasal Tahun Ajaran 2012/2013 II.Essay 1. Tuliskan bunyi dan rumus hukum Gay Lussac, hukum Charles dan hukum BoyleGay Lussac! 2. Tuliskan bunyi Hukum I Termodinamika beserta rumusnya! 3. Tuliskan proses dan rumus untuk proses isotermis dan isokhoris! 4. Tuliskan proses dan rumus untuk proses isobaris dan adiabatis! 5. Sebuah tangki berisi gas dengan volume 0,5 m 3 dipanaskan pada tekanan tetap hingga volumenya menjadi 2 m3. Jika usaha yang dihasilkan 3 x 10 5 J, maka hitunglah tekanan gas dalam tangki! 6. Suatu sistem menyerap kalor 300 J dan dikenai kerja dari lingkungan 450 J pada saat bersamaan. Hitung perubahan energi dalam sistem! 7. Sebuah mesin mampu melakukan kerja 105 J dengan bahan bakar (energi) sebesar 2·105 J. Hitunglah efisiensi mesin tersebut! 8. Mesin Carnot menerima kalor dari reservoir suhu tinggi 227ºC dan melepaskannya pada reservoir bersuhu 77 ºC. Hitunglah efisiensi Mesin Carnot tersebut! 9. Sebuah mesin Carnot yang menggunakan reservoir suhu tinggi 800K mempunyai efisiensi 40 %. Agar efisiensinya naik menjadi 50 % , maka tentukan berapakah suhu reservoir tinggi harus dinaikkan! 10. Pada grafik PV mesin Carnot di bawah ini, W = 6.000 joule. Tentukan banyak kalor yang dilepas oleh mesin tiap siklus! Modul Fisika XI Semester Gasal Tahun Ajaran 2012/2013 EVALUASI AKHIR BAB 3 A 1. Persamaan gas ideal ditulis dalam bentuk 2. 3. 4. 5. pV bilangan tetap, yang T tergantung pada.... A. Kinds of gas B. Temperature of gas C. Pressure of gas D. Volume of gas E. Amount of particles Tekanan gas oksigen pada suhu 00C adalah 3 x 105 N/m2. Volume gas tersebut adalah 4,7 x 10 4 m3. Berapa massa gas oksigen tersebut? (R = 8314 J/k mol; M = 32 kg/ k mol) A. 0,2 g B. 0,1 g C. 4,0 g D. 2,0 g E. 0,01 g Suatu gas ideal tekanannya 30 N/m2, volumenya 1,38 L dan suhunya 270C. Jumlah partikel gas adalah.... A. 1014 B. 1019 C. 1020 D. 1022 E. 1025 Dalam suatu ruangan bersuhu T kelvin, sebuah partikel gas bergerak dengan kecepatan v . Apabila suhu ruangan tersebut berubah menjadi 4T, maka kecepatannya menjadi.... A. ¼ v B. ½ v C. 2 v D. 4 v E. 16 v Pada temperatur tertentu, kecepatan efektif molekul- molekul suatu gas ideal 6. 7. 8. 9. adalah v. Jika pada tekanan tetap temperatur gas diubah sehingga volumenya menjadi dua kali semula, maka kecepatan efektifnya menjadi.... A. 0,5 v B. 1/√2 v C. √2 v D. v E. 2 v Gas dalam tabung yang suhunya 270C dipanaskan pada volum tetap, sehingga kecepatan rata- rata partikel gas menjadi dua kali semula. Berapakah kenaikan suhu gas? A. 1200 0C B. 900 0C C. 627 0C D. 108 0C E. 90 0C Apabila usaha per siklus yang dilakukan suatu mesin Carnot sebesar 2000 J maka banyaknya kalor yang dilepas dalam tiap siklus adalah.... A. – 2000 J B. 0J C. 2000 J D. 4000 J E. 8000 J Jika suatu mesin Carnot bekerja pada suhu 300 K dan 400 K, maka efisiensinya adalah... A. 20 % B. 25 % C. 30 % D. 35 % E. 40 % Sebuah mesin Carnot yang menggunakan reservoir suhu tinggi 800 K mempunyai efisiensi 40 %. Agar Modul Fisika XI Semester Gasal Tahun Ajaran 2012/2013 efisiensinya naik menjadi 50 % maka suhu reservoir tinggi harus dinaikkan menjadi… a. 900 K b. 960 K c. 1.000K d. 1.180K e. 1.600K 10. Sebuah ruangan pada tekanan 105Pa berisi dua mol gas oksigen. Jika suhu gas 270C, maka volume ruang tersebut adalah… a. 30 liter b. 40 liter c. 50 liter d. 60 liter e. 70 liter Modul Fisika XI Semester Gasal Tahun Ajaran 2012/2013 B URAIAN 1. Suatu mesin Carnot yang bekerja antara suhu 270C dan 227 0C digunakan untuk mengoperasikan sebuah generattor yang tegangannya 220 V. Jika setiap detik mesin Carnot menyerap kalor 5500 J, berapakah kuat arus keluaran maksimum generator tersebut? 2. Koefisien performansi sebuah kulkas adalah 4. Berapa banyak energi listrik yang digunakan untuk memindahkan 4000 J kalor dari makanan yang terdapat di dalam kulkas? 3. Diketahui volum tabung B dua kali volume tabung A, keduanya diisi gas ideal. Volume tabung penghubung dapat diabaikan. Gas A bersuhu 300 K, maka gas B bersuhu ... N 4. A C 1. 3N B Remidiasi Suatu mesin menerima 200 kalori reservoir bersuhu tinggi dan melepaskan 175 kalori ke sebuah reservoir lain yang suhunya rendah. Efisiensi mesin itu adalah .. A. 12,5 % B. 14,3 % C. 25,0 % D. 87,5 % E. 2. 200 % Proses yang dialami gas dalam ruangan tertutup pada suhu tetap disebut ... A. proses Isokhorik Modul Fisika XI Semester Gasal Tahun Ajaran 2012/2013 B. proses Isotermik C. proses Isobarik D. proses Adiabatik E. proses Asimilasi 3. Hukum pertama termodinamika menyatakan ... A. kalor tidak dapat masuk ke dalam dan keluar suatu sistem B. energi adalah kekal C. energi dalam adalah kekal D. suhu adalah tetap E. sistem tidak mendapat usaha dari luar 4. Grafik-grafik berikut ini menunjukan hubungan antara tekanan (P) dengan volume (V) gas yang mengalami suatu proses. Modul Fisika XI Semester Gasal Tahun Ajaran 2012/2013 Proses yang menghasilkan usaha terbesar ditunjukkan pada grafik nomor … A. (1) B. (2) C. (3) D. (4) E. (5) 5. Jika sebuah mesin Carnot menggunakan reservoir dengan suhu tinggi 900oK dan mempunyai effisiensi 60 %, maka suhu yang rendah adalah … A. 700oK B. 400oK C. 387oC Modul Fisika XI Semester Gasal Tahun Ajaran 2012/2013 D. 360oK E. 187oC Modul Fisika XI Semester Gasal Tahun Ajaran 2012/2013