Termodinamika
advertisement

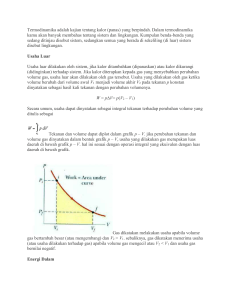
Dr. Nugroho Susanto PENGERTIAN TERMODINAMIKA Pengertian Menurut Bahasa Termodinamika berasal dari bahasa Yunani, yaitu thermos yang berarti panas, dan dynamic yang berarti perubahan. Pengertian Secara Umum Secara umum mempunyai pengertian kajian mengenai kalor (panas) yang berpindah. Usaha Luar Usaha luar dilakukan oleh sistem, jika kalor ditambahkan (dipanaskan) atau kalor dikurangi (didinginkan) terhadap sistem. Jika kalor diterapkan kepada gas yang menyebabkan perubahan volume gas, usaha luar akan dilakukan oleh gas tersebut. Usaha yang dilakukan oleh gas ketika volume berubah dari volume awal V1 menjadi volume akhir V2 pada tekanan p konstan dinyatakan sebagai hasil kali tekanan dengan perubahan volumenya. 𝑊 = 𝑝∆𝑉 = 𝑝(𝑉2 − 𝑉1 ) Secara umum, usaha dapat dinyatakan sebagai integral tekanan terhadap perubahan volume yang ditulis sebagai 𝑉1 𝑊= 𝑝 𝑑𝑉 𝑉1 Energi Dalam (U) Suatu gas yang berada dalam suhu tertentu dikatakan memiliki energi dalam. Energi dalam gas berkaitan dengan suhu gas tersebut dan merupakan sifat mikroskopik gas tersebut. Meskipun gas tidak melakukan atau menerima usaha, gas tersebut dapat memiliki energi yang tidak tampak tetapi terkandung dalam gas tersebut yang hanya dapat ditinjau secara mikroskopik. Berdasarkan teori kinetik gas, gas terdiri atas partikel-partikel yang berada dalam keadaan gerak yang acak. Gerakan partikel ini disebabkan energi kinetik rata-rata dari seluruh partikel yang bergerak. Energi kinetik ini berkaitan dengan suhu mutlak gas. Jadi, energi dalam dapat ditinjau sebagai jumlah keseluruhan energi kinetik dan potensial yang terkandung dan dimiliki oleh partikel-partikel di dalam gas tersebut dalam skala mikroskopik. Dan, energi dalam gas sebanding dengan suhu mutlak gas. Oleh karena itu, perubahan suhu gas akan menyebabkan perubahan energi dalam gas. Secara matematis, perubahan energi dalam gas dinyatakan sebagai untuk gas monoatomik 3 ∆𝑈 = 𝑛𝑅∆𝑇 2 untuk gas diatomik 5 ∆𝑈 = 𝑛𝑅∆𝑇 2 Usaha (W) Usaha alias kerja merupakan proses perpindahan energi melalui cara-cara mekanis. Usaha dalam gerak translasi : 𝑊 = 𝐹. 𝑠 Usaha dalam gerak rotasi: 𝑊 = 𝜏. 𝜃 Usaha pada termodinamika : 𝑊 = 𝑝∆𝑉 = 𝑝(𝑉2 − 𝑉1 ) Kalor (Q) Kalor mengalir dari benda bersuhu tinggi ke benda yang bersuhu rendah, dan akan berhenti hingga suhu kedua benda sama. Kalor bukanlah suatu jenis energi, melainkan energi yang berpindah. Jadi dapat disimpulkan bahwa kalor adalah energi yang berpindah akibat adanya perbedaan suhu. Proses-proses Termodinamika gas a. Proses isobarik Proses isobarik adalah proses perubahan keadaan gas pada tekanan tetap. Persamaan keadaan untuk proses isobarik adalah V Catau T V2 V1 T2 T1 Ini adalah hukum Gay Lussac. Sedangkan rumus usahanya adalah W pV p(V2 V1 ) b. Proses isokhorik Proses isokhorik adalah proses perubahan gas pada volum tetap. Persamaan keadaan untuk proses isokhorik adalah karena V tetap maka : p C T pV C T atau p2 p1 T2 T1 c. Proses isotermal Jika proses yang terjadi berlangsung dalam suhu konstan, proses ini dinamakan proses isotermik. Karena berlangsung dalam suhu konstan, tidak terjadi perubahan energi dalam dan berdasarkan hukum I termodinamika kalor yang diberikan sama dengan usaha yang dilakukan sistem (Q = W ). Persamaan keadaan untuk proses isokhorik adalah pV C , karena T tetap maka : T pV C atau p2V2 p1V1 d. Proses adiabatik Proses adiabatik adalah proses perubahan keadaan sistem tanpa adanya kalor yang masuk ke atau keluar dari sistem (gas), yaitu Q = 0. P V P V 1 1 2 2 PV tetap atau TV ( 1) tetap atau T1V1 ( 1) T2V2 ( 1) Dengan > 1, merupakan hasil perbandingan kapasitas kalor gas padatekanan tetap CP dan kapasitas kalor pada volume tetap CV. Yang disebut konstanta Laplace. CP CV Usaha yang dilakukan oleh sistem (gas) hanya mengubah energi dalam, sebab sistem tidak menerima ataupun melepas kalor. Besarnya usaha yang dilakukan oleh sistem dapat ditentukan dengan menerapkan rumus umum usaha, maka diperoleh persamaan 1 W ( P1V1 P2V2 ) 1 Hukum I Termodinamika Jika kalor diberikan kepada sistem, volume dan suhu sistem akan bertambah (sistem akan terlihat mengembang dan bertambah panas). Sebaliknya, jika kalor diambil dari sistem, volume dan suhu sistem akan berkurang (sistem tampak mengerut dan terasa lebih dingin). Prinsip ini merupakan hukum alam yang penting dan salah satu bentuk dari hukum kekekalan energi. Sistem yang mengalami perubahan volume akan melakukan usaha dan sistem yang mengalami perubahan suhu akan mengalami perubahan energi dalam. Jadi, kalor yang diberikan kepada sistem akan menyebabkan sistem melakukan usaha dan mengalami perubahan energi dalam. Prinsip ini dikenal sebagai hukum kekekalan energi dalam termodinamika atau disebut hukum I termodinamika. Secara matematis, hukum I termodinamika dituliskan sebagai 𝑄 = 𝑊 + ∆𝑈 Secara sederhana, hukum I termodinamika dapat dinyatakan sebagai berikut. Jika suatu benda (misalnya krupuk) dipanaskan (atau digoreng) yang berarti diberi kalor Q, benda (krupuk) akan mengembang atau bertambah volumenya yang berarti melakukan usaha W dan benda (krupuk) akan bertambah panas yang berarti mengalami perubahan energi dalam ∆𝑈 Hukum II Termodinamika Formulasi Kelvin-Planck menyatakan bahwa tidak mungkin untuk membuat sebuah mesin kalor yang bekerja pada suatu siklus yang semata-mata mengubah energi panas yang diperoleh dari suatu sumber pada suhu tertentu seluruhnya menjadi usaha mekanik. Hukum kedua termodinamika juga menjelaskan bahwa kalor mengalir secara spontan dari benda bersuhu tinggi ke benda yang bersuhu rendah dan tidak pernah secara spontan mengalir ke arah yang sebaliknya. Sesuai dengan Formulasi Clausius yang menyatakan bahwa “Tidak mungkin untuk membuat sebuah mesin kalor yang bekerja semata-mata memindahkan energi panas dari suatu benda dingin ke benda panas.” Mesin Carnot Mesin Carnot adalah mesin kalor hipotesis yang beroperasi dalam siklus yang disebut siklus Carnot. Sebuah siklus termodinamika terjadi ketika suatu sistem mengalami rangkaian keadaan yang berbeda dan akhirnya kembali keadaan semula. Dalam siklus ini, sistem dapat melakukan usaha terhadap lingkungannya, sehingga disebut mesin kalor. Perumusan Carnot menyatakan bahwa sebuah mesin nyata (real) yang beroperasi dalam suatu siklus pada temperatur TH dan TC tidak mungkin melebihi efisiensi mesin Carnot. Δ𝑊 𝑇𝑐 𝜂= =1− Δ𝑄𝐻 𝑇𝐻 Kapasitas Kalor Gas Kapasitas kalor (C) adalah jumlah kalor yg diperlukan untuk menaikkan temperatur dari suatu sampel bahan sebesar 1K. THANK YOU :))