Schrodinger`s Wave Function
advertisement

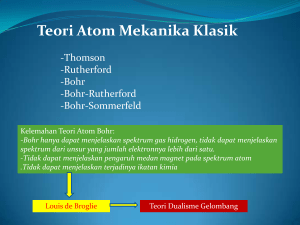
SPEKTRA RADIASI ELEKTROMAGNET SPEKTRUM KONTINYU TEORI MAX PLANK TEORI ATOM BOHR TEORI MEKANIKA KUANTUM SIFAT GELOMBANG Schrodinger’s Wave Function MODEL ATOM MEKANIKA KUANTUM Persamaan gelombang Schrodinger ORBITAL S ORBITAL p PERBEDAAN MATERI & GELOMBANG MENU UTAMA MENU UTAMA MENU HYDROGEN ATOM SPECTRUM Cahaya yang dihasilkan oleh atom-atom gas hidrogen dan dianalisa dengan spektrometer membentuk spektrum garis yaitu terdiri warna merah (656 nm)-hijau (486 nm)-biru (434 nm)-ungu (410 nm). TEORI KUANTUM MAX PLANCK Tahun 1900 Max Planck mengajukan teori kuantum yang pada dasarnya merupakan gagasan tentang partikel gelombang, menurut Max Planck radiasi elektromagnet bersifat diskrit, terdiri dari paket-paket kecil (kuanta) atau partikel. Gagasan Max Planck ini bertentangan dengan teori fisika klasik yang menganggap radiasi elektromagnet sebagi gelombang kontinu, tidak merupakan partikel. MENU UTAMA Einstein mendukung gagasan max Planck dan menamai partikel radiasi tersebut dengan foton. Setiap foton mempunyai energi tertentu yang bergantung pada frekuensi atau panjang gelombangnya. E=hxf atau E = h x c E = energi radiasi h = tetapan Planck = 6,63 . 10-34 J det makin besar panjang gelombang makin kecil energinya. Diantara sinar tampak, sinar ungu mempunyai energi terbesar. MENU UTAMA Sample Problem 1. Garis merah dari spektrum gas hidrogen mempunyai panjang gelombang 656 nm, Hitunglah: a. energi dari 1 foton b. energi dari 1 mol foton sinar merah tersebut. ( h = tetapan Planck = 6,63 . 10-34 J det ) 2. Manakah yang mempunyai energi lebih besar, sinar merah atau sinar biru? Jelaskan. 3. Tentukan energi dari satu foton sinar biru dalam spektrum gas hidrogen yang panjang gelombangnya 486 nm. Tentukan pula energi dari satu mol foton sinar tersebut. MENU UTAMA Jawab: Energi radiasi bergantug pada frekuensi atau panjang gelmbang dengan rumus E = h x c/ λ a. Energi 1 foton, E = 6,63. 10-34 j det x 3 x108 m det-1 656 x 10-9 m = 3,01 x 10-19 J b. Energi 1 mol foton = 6,02x 1023 foton x 3,01 x 10-19 J foton-1 = 1,81 x 105 J MENU UTAMA Bohr’s Atomic Model Berdasarkan teori atom Rutherford dan teori kuantum Planck, Bohr mengajukan postulat tentang model atom, yaitu: a.Elektron-elektron dalam suatu atom mengelilingi inti pada lintasan tertentu yang disebut lintasan stasioner. Pada lintasan ini, elektron tidak menyerap atau melepaskan energi. b. Elektron akan melepaskan energi (berupa foton) jika elektron tersebut berpindah ke lintasan yang lebih rendah tingkat energinya, dan elektron akan menyerap energi jika berpindah ke lintasan dengan tingkat energi lebih tinggi (lintasan lebih luar). MENU UTAMA The total energy of electron in each orbit is as follows 13,6 En eV 2 n Energy levels of electron n = 1 -13,60 eV n = 2 - 3,40 eV n = 3 - 1,51 eV n = 4 - 0,85 eV n = 5 - 0,54 eV n = 6 - 0,38 eV n = 7 - 0,28 eV n = ~ - 0 eV MENU UTAMA Perpindahan electron dari kulit dalam ke kulit luar disebut eksitasi (excitation) elektron menyerap energi Perpindahan elektron dari keadaan eksitasi ke keadaan semula disebut transisi elektron memancarkan energi. Energi yang diserap atau dipancarkan dalam bentuk foton atau cahaya, dirumuskan : E=hxf atau E = h x ∆E= E MENU UTAMA final - Einitial c Sample problem 1. An electron of hydrogen atom is in transition from the 2nd to the 1st shell, determine: a. the energy released (dilepas) b. the frequency of photon emitted Solution ∆E= E MENU UTAMA 13,6 En eV 2 n final - Einitial The frequency of photon ∆E = h x ƒ ƒ = ∆E / h = -1,63 x 10-18 J / 6,63 x 10-34 Js = 2,45 x 1015 Hz MENU UTAMA Bohr’s atomic models has several weakness: a. Bohr’s atomic models can only explain hydrogen atom while many electrons atoms cannot be explained using the Bohr’s atomic model. b. The Bohr’s atomic theory cannot explain to occurrences (pengaruh) in chemical bonds c. The Bohr’s atomic theory cannot explain the effect of magnetic field to an atomic spectrum. MENU UTAMA QUANTUM MECHANICS THEORY The Bohr’s atomic theory was developed and corected by other scientists and finally there obtained (diperoleh) a modern atomic theory known as quantum mechancs theory. The followings are explanations about the quantum mechanics theory initiated (diawali) by de Broglie wave and Heisenberg uncertainty principle. Teori Kuantum Modern memiliki tiga dasar: 1. Sifat gelombang materi yang dikembangkan oleh De Broglie (1924) 2. Persamaan gelombang yang dikembangkan oleh Schrodinger (1927) 3. Prinsip ketidakpastian yang dikembangkan oleh Heisenberg (1927). 1. Tahun 1923 seorang fisikawan Perancis, Louis De Broglie mengusulkan bahwa elektron mempunyai sifat gelombang dan sebagai partikel. De Broglie menghitung bahwa setiap partikel mempunyai panjang gelombang yang sama dengan konstanta plank (h) yang dibagi dengan momentum partikel (p). MENU UTAMA λ= h p = h m.v λ = wavelength of particle (m) h = Planck’s constant = 6,63 x 10-34 Js m = mass of particle (Kg) v = speed of particle (m/s) SOAL: 1. Tentukan panjang gelombang electron yang bergerak dengan kecepatan 6 x 107 m/s dengan massa elektron 9,11 x 10-31 Kg, Tentukan pula radiasidengan panjang gelombang tersebut ada di daerah .... 2. Tentukan panjang gelombang bola tenis yang bergerak dengan kecepatan 200 Km/detik dan masa bola 20 gram, tentukan pula apakah termasuk spektrum elektromagnet gerak bola terserbut. MENU UTAMA Perbedaan Materi dan Gelombang • Gelombang jika melalui batas fasa (udara – air) akan mengalami refraksi sedangkan materi tidak • Gelombang ketika melalui slit (lubang kecil) akan mengalami difraksi atau melengkung disekitar slit sedangkan materi tidak mengalami difraksi • Difraksi gelombang pada dua slit menghasilan interferensi menguatkan dan saling meniadakan MENU UTAMA Dualitas Gelombang-Partikel: Materi dan Energi • Kesimpulan dari 3 fenomena yang telah dibahas adalah materi dan energi adalah dua entitas yang saling berganti satu sama lain • Energi memiliki sifat partikel dan materi memiliki sifat gelombang MENU UTAMA Panjang Gelombang de Broglie • Jika energi memiliki sifat partikel maka materi juga memiliki sifat gelombang • Jika elektron memiliki gerak mirip gelombang dan orbitnya dibatasi pada jari-jari tertentu maka ini merujuk pada frekuensi dan energi tertentu pula h mu MENU UTAMA Sifat Gelombang Cahaya MENU UTAMA c=νxλ 2. Heisenberg Uncertainty Principle Adanya sifat partikel dari cahaya (gelombang elektromagnetik) dan sifat gelombang dari partikel menyebabkan adanya ketidakpastian dalam pengukuran besaran-besaran, seperti momentum dan posisi partikel. Berdasarkan prinsip tumbukan dalam tinjauan mekanika klasik, maka pada tumbukan antara foton dan electron akan diperoleh ketidakpastian pengukuran momentum yang mempunyai harga sekurang-kurangnya sama dengan momentum foton, yaitu h ∆p ≥ ∆p = momentum uncertainty MENU UTAMA ∆x ≥ λ ∆x = position uncertainty (ketidakpastian posisi) Berdasarkan hal tersebut warner Heisenberg (fisikawan Perancis) merumuskan sebuah prinsip yang dikenal dengan ketidakpastian Heisenberg atau prinsip ketidaktentuan. In this case, the Heisenberg uncertainty principle prescrible that ”It is impossible to measure or to specify the momentum and the position of a particle simultaneously with unlimited precision:. Or in other words “The measurement of momentum and position of a particle simultaneously always results in an uncertainty which is never less than planck’s constant”. MENU UTAMA 3. Schrodinger’s Wave Function Berdasarkan gagasan de Broglie dan prinsip ketidakpastian Heisenberg Erwin Schrodinger mengajukan pendapat bahwa apabila elektrom mempunyai sifat gelombang. Maka tentu elektron mempunyai fungsi gelombang yang menyatakan keadaan elektron tersebut. Karena elektron mempunyai fungsi gelombang, maka menurut Schrodinger electron pada atom tidak mengorbit inti, tetapi lebih bersifat sebagai gelombang yang bergerak pada jarak tertentu dan dengan energi tertentu di sekeliling inti. Model atom Schrodinger terbukti lebih tepat dan berdasarkan model ini, para ahli fisika tidak lagi mencoba untuk menemukan lintasan electron dan posisinya dalam sebuah atom, akan tetapi mereka menggunakan persamaan yang menggambarkan gelombang electron tersebut untuk menemukan daerah dimana electron paling mungkin ditemukan. MENU UTAMA MODEL ATOM MEKANIKA KUANTUM Menurut Bohr, elektron beredar mengitari inti menurut suatu orbit berbentuk lingkaran dengan dengan jari-jari tertentu. Hal ini tidak sesuai dengan fakta bahwa gerakan elektron menyerupai gelombang elektromagnet. Gelombang tidak bergerak menurut suatu garis melainkan menyebar pada suatu daerah tertentu. Tahun 1927 Erwin Schrodinger ahli matematika dari Rusia mengajukan teori atom yg disebut teori atom mekanika kuantum. Menurut teori ini, kedudukan elektron dalam atom tidak dapat ditentukan dengan pasti; yang dapat ditentukan adalah probabilitas menemukan elektron sebagai fungsi jarak dari inti atom. Daerah dengan probabilitas terbesar menemukan elektron disebut orbital. Orbital digambarkan berupa awan yang tebal tipisnya menyatakan besar kecilnya kebolehjadian menemukan elektron didaerah tersebut. Bentuk awan dan tingkat energi orbital diperoleh dari persamaan gelombang dari elektron. MENU UTAMA Persamaan gelombang Schrodinger untuk atom Hidrogen: 2 2 2 8 2 m .(E V ) 0 2 2 2 2 X y Z h V = Energi potensial partikel (elektron) E = Energi total partikel m = massa partikel ψ = fungsi gelombang MENU UTAMA Bentuk Orbital s MENU UTAMA Model Mekanika Kuantum Atom MENU UTAMA MENU UTAMA Orbital p MENU UTAMA Orbital d MENU UTAMA Salah satu dari 7 orbital f MENU UTAMA MENU UTAMA MENU UTAMA