BAB II TINJAUAN KEPUSTAKAAN II.1 Struktur dan fungsi saraf
advertisement

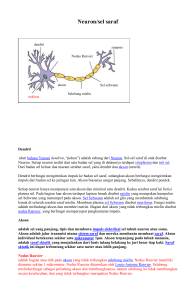
BAB II TINJAUAN KEPUSTAKAAN II.1 Struktur dan fungsi saraf perifer Saraf perifer merupakan ikatan-ikatan akson yang mengkonduksi impulimpul eferen (motorik) dari sel-sel di anterior horn dari medulla spinalis menuju otot, dan impul-impul aferen (sensorik) dari reseptor-reseptor perifer melalui selsel di dorsal root ganglia menuju medulla spinalis. Saraf perifer juga membawa serabut-serabut sudomotor dan vasomotor dari sel-sel ganglion di rantai simpatis. Beberapa saraf perifer dominan motorik, beberapa lainnya dominan sensorik, pada badan yang lebih besar bersifat campuran, dengan akson motorik dan sensorik berjalan dalam ikatan yang terpisah. (Lee, Wolfe, 2000), (Solomon, Warmick, Nayagam, 2010) Masing-masing akson adalah kepanjangan dari prosesus sel saraf, atau neuron. Badan sel dari motor neuron yang menyuplai otot-otot perifer terkumpul di anterior horn medulla spinalis; oleh sebab itu, sebuah motor neuron tunggal dengan aksonnya dapat memiliki ukuran panjang lebih dari satu meter. Badan sel dari neuron sensorik yang menyuplai badan dan anggota gerak terletak di dorsal root ganglia dan masing-masing neuron memiliki satu prosesus (akson) yang memanjang dari perifer menuju badan sel dan prosesus lainnya dari badan sel menuju medulla spinalis. (Solomon, Warmick, Nayagam,2010) Gambar 1. Skema struktur neuron 1 Gambar 2. Potongan melintang anatomi saraf perifer (Lee et al. 2000). Gambar 2 memperlihatkan potongan melintang saraf perifer. Akson tertutup oleh lapisan jaringan ikat yaitu endoneurium. Akson-akson yang menyusun saraf terbagi menjadi ikatan-ikatan atau fascicle oleh jaringan membrane yang padat yaitu perineurium. Sistem saraf perifer tertutup oleh lapisan terluar jaringan ikat yaitu epineurium. (Lee et al. 2000) Ujung-ujung perifer dari semua neuron memiliki cabang-cabang. Sebuah motor neuron tunggal dapat menyuplai dari 10 hingga beberapa ribu serabut otot, rasionya tergantung pada derajat keterampilan yang dibutuhkan pada otot tertentu (semakin kecil rasionya semakin baik gerakannya). Begitu juga halnya, cabangcabang perifer dari masing-masing neuron sensorik dapat menyuplai dari muscle spindle tunggal hingga sebidang kulit yang luas; semakin sedikit end reseptor yang disuplai, semakin besar derajat diskriminasinya. (Salter, 1999), (Solomon, Warmick, Nayagam, 2001) 2 Gambar 3. Bagian – bagian sebuah saraf perifer (Lee et al. 2000) Gambar 3 memperlihatkan bagian-bagian saraf perifer. Saraf perifer terdiri dari neuron-neuron yang tersusun dalam fasikulus di dalam badan sel saraf. Akson terkumpul dalam ikatan-ikatan yang terselubung membentuk endoneurium, endoneurium ini akan terkumpul dalam fasikulus yang padat yaitu perineurium. Kelompok fasikulus yang membentuk trunkus saraf tertutup dalam lapisan jaringan ikat yang lebih tebal yaitu epineurium. (Lee et al. 2000) II. 2 Sinyal Saraf Sinyal atau aksi potensial yang dibawa oleh motor neuron ditransmisikan menuju serabut-serabut otot melalui pelepasan transmitter kimia, asetilkolin, pada terminal akson saraf. Sinyal sensoris dengan cara yang sama dibawa menuju dorsal root ganglia dan menuju keatas ke kolumna ipsilateral medulla spinalis melalui batang otak dan thalamus menuju ke korteks (sensorik) yang berlawanan. Impul-impul proprioseptif dari muscle spindle dan sendi melewati rute ini dan dibawa ke sel-sel anterior hornsebagai bagian dari arkus reflek lokal. Tingkat kepraktisan dari sistem ini menjamin bahwa mekanisme pertahanan seperti keseimbangan dan rasa posisi dalam ruang diaktivasi dalam kecepatan yang tinggi. (Salter, 1999),(Solomon, Warmick, Nayagam, 2001) 3 Pada saraf perifer semua motor akson dan akson sensorik besar yang mensuplai rasa sentuh, nyeri, dan proprioseptif terselubung dengan myelin, yaitu membrane lipoprotein berlapis yang berasal dari Schwann sel. Setiap beberapa milimeter selubung myelin akan terhambat, meninggalkan segmen pendek akson kosong yang disebut nodes of Ranvier. Impuls-impuls saraf melompat dari node ke node dengan kecepatan listrik, jauh lebih cepat dibandingkan bila akson tersebut tidak terselubung myelin. Penipisan dari selubung myelin akan menyebabkan pelambatan dan pada akhirnya terjadi blok total dari konduksi aksonal. (Solomon, Warmick, Nayagam, 2010) Sebagian besar akson umumnya serabut yang berdiameter kecil yang membawa sensasi kasar dan serabut simpatis eferen tidak terselubung myelin tetapi terbungkus dengan sitoplasma sel Schwann. Kerusakan pada akson ini akan menyebabkan sensasi yang kurang nyaman atau aneh serta berbagai efek sudomotor dan vasomotor.(Lee, Wolfe, 2000) Di luar membrane sel Schwann, akson tertutup oleh lapisan jaringan ikat yaitu endoneurium. Akson-akson yang menyusun saraf terbagi menjadi ikatanikatan atau fascicle oleh jaringan membran yang padat yaitu perineurium. Pada saraf yang terpotong fascicle ini tampak dari permukaan potongan, selaput perineurial akan tampak dengan jelas cukup kuat untuk dipegang oleh instrumen. Kelompok fascicle yang membentuk trunkus saraf tertutup dalam lapisan jaringan ikat yang lebih tebal yaitu epineurium. Ketebalan epineurium bervariasi dan cukup kuat pada lokasi dimana saraf menjadi subjek dari pergerakan dan traksi contohnya pada daerah sekitar sendi. (Lee, Wolfe, 2000), (Solomon, Warmick, Nayagam, 2010) II.3 Pembuluh darah pada saraf perifer Saraf kaya akan suplai pembuluh darah yang berjalan secara longitudinal dalam epineurium sebelum menembus berbagai lapisan yang menjadi kapiler endoneurial. Pembuluh darah halus ini mungkin akan mengalami kerusakan dengan adanya peregangan atau penanganan yang kasar pada saraf, tetapi 4 pembuluh darah ini mampu menahan mobilisasi ekstensif dari saraf, sehingga memungkinkan untuk dilakukan perbaikan atau penggantian segmen yang rusak dengan tranposisi atau transfer saraf. Pembuluh darah kecil ini memiliki suplai saraf simpatisnya sendiri yang berasal dari saraf induknya. Stimulasi dari serabutserabut tersebut (menyebabkan vasokonstriksi intraneural) mungkin penting dalam kondisi seperti distrofi refleks simpatis dan sindrom nyeri yang tidak biasa lainnya. (Lee, Wolfe, 2000),(Solomon, Warmick, Nayagam, 2010) Gambar 4. Suplai perdarahan pada saraf perifer. (Lee et al. 2000) Dalam saraf perifer, mikrovaskularisasi berjalan disepanjang lapisan luar (epineurium) bersama jaringan kapiler transversal yang memberikan perfusi pada endoneurium. 5 II.4 Klasifikasi Cidera saraf perifer Cidera saraf perifer di klasifikasikan oleh 2 peneliti yaitu Seddon (1943) dan Sunderland (1978). Seddon membagi berdasarkan kelainan anatomi cidera yaitu - Neurapraxia :Struktur pendukung (epineurium, perineurium dan endoneurium) utuh, terjadi gangguan konduksi listrik dan kimia, akibatnya akan terjadi kekacauan transportasi aksonal dan de myelinasi selektif.Gangguan penurunan fungsi motorik lebih besar daripada fungsi sensorik, fungsi otonom normal. Dapat sembuh tanpa intervensi bedah. - Aksonotmesis: Struktur pendukung epineurium dan perineurium terganggu,sedangkan endoneurium utuh yang memungkinkan terjadinya regenerasi aksonal. Terjadi penurunanan fungsi motorik, sensorik dan otonom. Tingkat kesembuhan belum bisa diperkirakan tergantung dari jarak antara struktur pendukung yang rusak. Cidera kearah proksimal menunjukan hasil yang tidak menggembirakan. - Neurotmesis :Struktur pendukung epineurium, perineurium dan endoneurium semua terganggu, dan kadang kadang terjadi gap. Penyembuhan total sangat sulit terjadi dan membutuhkan intervensi bedah. Klasifikasi lain diperkenalkan oleh Sunderland (1978). Klasifikasi ini berdasarkan pada anatomis, prognosis dan strategi pengobatan pada cidera saraf perifer dan terbagi dalam 5 derajat cidera saraf perifer.Cidera derajat satu sesuai dengan neurapraksia, derajat dua sesuai dengan aksonotmesis pada klasifikasi Seddon. Derajat tiga sesuai dengan neurotmesis dimanaa terjadi kerusakan sebagian (parsial) pada struktur pendukungnya termasuk endoneurium yang berfungsi sebagai panduan untuk regenerasi aksional. Dapat terjadi fibrosis karena masuknya sel sel inflamasi dan fibroblast kedalam struktur perineurium.Cidera derajat keempat terjadi kerusakan struktur pendukung epineurium, perineurium dan endoneurium. Pada epineurium terjadi kerusakan parsial. Penanganannya membutuhkan intervensi bedah dan memerlukan pencangkokan saraf.Cidera derajat kelima terjadi hilangnya sebagian saraf ujung proksimal dan distal yang 6 tidak memungkinkan terjadi penyembuhan spontan, memerlukan pencangkokan saraf.(Burnett, 2004) Gambar 5. Perubahan anatomi dan morfologi cidera saraf perifer . (Kim J. 2013) Keberhasilan dari proses perbaikan saraf perifer tergantung pada derajat berat ringan cedera dan lingkungan yang memungkinkan. Sistem grading cedera menurut Seddon dapat digunakan untuk memberikan gambaran hubungan perubahan mikroskopik yang terjadi setelah cedera saraf dan simtomatologi pasien. Waktu intervensi bedah juga memegang peranan yang sangat penting dalam proses penyembuhan cidera saraf perifer. (Jun-Ming Zhang, 2007) II.5 Proses degenerasi dan regenerasi pada cidera saraf perifer Segera setelah terjadi cidera pada saraf tepi, akan disusul dengan proses degenerasi pada ujung saraf. Perubahan histologis terutama melibatkan fragmentasi fisik dari akson dan myelin. Neurotubulus dan neurofilamen akan terputus dan bentuk akson menjadi tidak teratur, kontinuitas akson akan hilang dan konduksi impuls tidak terjadi serta terjadi disintegrasi myelin.Sel Schwann memegang peranan penting dalam proses degenerasi saraf perifer, aktif dalam 24 jam paska cidera dengan mengaktifkan diri melalui pembesaran inti dan 7 sitoplasma serta meningkatkan mitosis sel. Peranan sel Schwann adalah membantu menghilangkan debris-debris aksonal dan myelin. Makrofag bermigrasi kearah tempat cidera melalui rute pembuluh darah yang dinding kapilernya telah menjadi permeabel. Sel Schwann bersama sama dengan makrofag melakukan fagositosis ditempat cidera. Pada cidera saraf derajat tiga (Sunderland) terjadi cidera intrafasikular, trauma vaskuler disekitar endoneurium menyebabkan oedem dan perdarahan, sehingga mengakibatkan reaksi inflamasi. Terjadi proliferasi fibroblas yang dapat merangsang terbentuknya jaringan parut. Cidera interfasikular dapat merusak regenerasi akson.Pada cidera saraf perifer derajat empat dan lima, struktur pendukung endoneurium beserta struktur interfasikuler, epineurium dan perineurium terputus, fibroblast terbentuk pada seluruh strukur tabung pendukung yang dapat menyebabkan terbentuknya jaringan parut.Pembentukan jaringan parut ini dapat menghambat fungsi dan arsitektur saraf perifer. Proses regenerasi terjadi setelah proses degenerasi, pada cidera saraf perifer neurapraksia dan axonotmesis (klasifikasi Sunderland satu dan dua) proses dimulai segera setelah cideradan sesuai dengan prosedur. Hal ini terjadi melalui blok konduksi atau regenerasi akson. Perubahan morfologi dan fisiologi dapat kembali seperti sebelum cidera. Pada cidera saraf perifer derajat tiga, empat dan lima dimana tabung endoneural terganggu,maka regenerasi akson berliku liku sehingga terjadi ketidaktepatan melakukan inervasi organ target. (Gaudet, 2011). Pemulihan fungsional setelah terjadi cidera melalui tahapan yang kompleks, yang memungkinkan terjadi gangguan pada proses regenerasi. 8 Gambar 6. Tahapan regenerasi saraf perifer. (Burnett, 2004) Gambar diatas menjelaskan tentang tahapan regenerasi saraf setelah cidera. Step1. Terjadi fragmentasi akson dan myelin pada ujung distal, Step 2. Schwan sel membentuk tabung menuju ke ujung bagian distal, makrofag akan memfagositosis sisa-sisa akson dan debris-debris myelin, Step 3. Akson akan tumbuh dalam tabung yang dibentuk sel Schwann, Step 4. Akson berkembang terus sampai ke ujung distal yang dibuat oleh sel Schwann.(Burnett, 2004). Aksoplasma berperan dalam regenerasi ujung akson yang muncul dari segmen proksimal akson dan sel tubuh saraf(nerve cell body), terjadi kenaikan sintesa protein dan lemak yang mempengaruhi tingkat kemajuan dan kaliber akhir dari regenerasi akson. Tingkat pertumbuhan kembali aksonal ditentukan oleh perubahan dalam sel tubuh, aktivitas kerucut pertumbuhan pada ujung akson, resistensi jaringan yang terluka antara sel tubuh dan organ akhir. Regenerasi akson dapat membentuk selubung endoneurium yang memungkinkan segmen proksimal dapat bertemu dengan segmen distal, namun tidak ada yang bisa menjamin bahwa setiap cidera akan terjadi perbaikan seperti itu, walaupun dengan intervensi pembedahan. 9 II.6 Matriks Ekstraseluler Matriks ekstraseluler merupakan substrat disekitar sel yang memberikan dukungan structural untuk elemen seluler, mempengaruhi perilaku mereka selama perkembangan dan maturitas. Matriks ekstraseluler timbul secara alami dan digunakan oleh sel untuk bermigrasi, berproliferasi, dan berdiferensiasi. Empat molekul utama matriks ekstraseluler yang ditemukan dalam system saraf perifer dan disintesis oleh sel Schwann yaitu laminin, fibronectin, collagen tipe IV dan berbagai macam proteoglikan. Laminin merupakan protein yang memiliki aktivitas biologi yang banyak termasuk promosi adhesi sel, migrasi, pertubuhan dan diferensiasi. Laminin yang merupakan glycoprotein dengan struktur cruciform terdiri dari tiga rantai polipeptida, ditemukan pada bagian dalam lamina basal sel Schwann. Laminin, yang dikenal sebagai promoter pertumbuhan neurit in vitro yang paling efektif, dan membantu regenerasi axonal, juga biasa digunakan dalam penelitian kultur jaringan sebagai substrat untuk menumbuhkan eksplant seperti dorsal root ganglion (DRG). Gambar 7. Gambaran skematis struktur Laminin. 10 Laminin terdiri atas G-chain, b-chain, A-chain dan membentuk three standed coil. Pada ujung g-chain dan b-chain terdapat kolagen tipe IV binding domain. Pada ujung a-chain terdapat cell surface binding domain (Cummings. 2007). Fibronectin merupakan glikoprotein yang besar dan asimetris yang diperkirakan membantu adhesi dan penyebaran sel dengan mengikatnya pada substrat kolagen. Gambar 8. Gambaran skematis struktur Fibronectin. Pada ujung COOH berlekatan dengan fibrin binding domain, sedangkan pada ujung NH2 berlekatan dengan heparin and fibrin binding domain. (Wiley J, Sons. 1999) Fibronectin terdiri dari pengulangan tandem dari tiga jenis yang berbeda (I, II, III) dari modul yang terlipat secara individual. Modul fibronectin tipe III (FN III) mengandung titik ikatan bagi beberapa reseptor membrane dan komponen matriks ekstraseluler yang memainkan peranan dalam penyusunan matriks ekstraseluler. Kolagen tipe IV yang juga merupakan glikoprotein ditemukan secara eksklusif dalam membrane dasar sel Schwann. Protein ini berfungsi sebagai scaffold untuk pembentukan komponen matriks lainnya dan menyediakan dukungan struktur utama bagi matriks. Kolagen IV berperan dalam regulasi pertumbuhan sel, diferensiasi dan adhesi, serta formasi jaringan serta berguna sebagai substrat bagi pertumbuhan epithelial, endothelial, sel otot dan saraf. Kolagen tipe IV telah 11 diketahui berperan dalam regenerasi axonal serta menstimulasi pertumbuhan neurit saraf perifer dan dorsal root ganglia. Gambar 9. Struktur kimia kolagen Tipe IV. (Plaisier. 2008) Heparan sulfat proteoglikan (HSPG) dan chondroitin sulfat proteoglikan (CSPG) juga ditemukan pada lamina basal. HSPG terdiri dari polipeptida (core protein) dan rantai linear polisakarida yang ditandai dengan pengulangan disakarida dari residu hexuronate dan N-substituted glucosamine. Kompleks HSPG membantu pertumbuhan neurit, mempromosikan kemampuan laminin atau N-CAM. Salah satu CSPG yang ditemukan di saraf perifer yaitu NG2. NG 2 terdiri dari rantai core protein bearing GAG yang tersusun seluruhnya oleh condroitin sulfat. Kadar NG2 meningkat seiring dengan cedera pada system saraf pusat dan molekulnya menghambat pertumbuhan axon. Secara serupa, studi in vitro pada saraf perifer tikus yang mengalami kerusakan menunjukkan bahwa NG2 merupakan komponen jaringan parut fibroblastic yang signifikan dan berperan terhadap gagalnya pertumbuhan axon melalui jaringan parut. Secara umum, CSPG diperkirakan menghambat regenerasi axon dan sebaliknya HSPG mempromosikan pertumbuhan neurit. (Naidu, 2005),(Elmstedt, 2006) II.7. Membran Amnion Pengobatan untuk regenerasi jaringan melibatkan penggunaan sel-sel yang hidup untuk menggantikan atau mengembalikan fungsi normal dari jaringan yang telah rusak. Sel punca sudah diteliti dan merupakan kandidat yang menjanjikan, yang memiliki kemampuan untuk meregenerasi diri sendiri dan berdiferensiasi 12 menjadi berbagai macam sel progenitor. Sumber dari sel punca penting untuk diperhatikan, baik sel punca yang berasal dari dewasa dan embrionik sel punca sama-sama digunakan untuk mengembangkan terapi terhadap berbagai macam kondisi klinis dari cedera dan penyakit.(Rennie K et al. 2012; Niknejad H et al. 2008) Membran amnion (AM) memiliki struktur yang tipis dengan bahan yang sangat fleksibel yang biokompatibel dan biodegradable. Membran ini berasal dari lapisan, meliputi jaringan ekstra-embrio yang terdiri dari lempeng korion dan desidua maternal. Pada saat kelahiran, AM menjadi terpisah dari lapisan lempeng korion dibalik lapisan jaringan ini. AM muncul sebagai matriks tipis yang terdiri dari lapisan sel epitel amnion , membran basal dan matriks stromal. AM telah digunakan dalam berbagai aplikasi medis, seperti penutup luka, barrier pencegah adhesi jaringan, dan pada operasi ophthalmologi. (Khrisnamurithy et al. 2011) Beberapa sumber juga menunjukkan adanya fungsi sebagai anti-perekat, anti-inflamasi dan memiliki komponen antibiotik. Sudah dijelaskan bahwa komponen ECM yang meliputi kolagen, fibronectin, laminin, dan proteoglikan lain terdapat dalam membran sel basal yang menghasilkan pertumbuhan yang lebih baik Molekul-molekul ini membentuk ligand dengan integrin binding receptor yang terletak pada permukaan sel, yang memberikan adhesi sel pada permukaan kontak. Adanya peningkatan interaksi sel-ECM juga dapat meningkatkan ekpresi dari sel. (Niknejad H et al. 2008; Khrisnamurithy et al. 2011) Akhir-akhir ini, sel induced pluripotent stem (IPS) sel yang diambil dari sel somatik dewasa menjadi bentuk pluripoten, menjadi solusi alternatif untuk pengobatan regeneratif. Embrionik sel punca mempunyai tingkat proliferasi yang tinggi dan mampu berdiferensiasi menjadi semua tipe sel dewasa, akan tetapi mempunyai risiko untuk membentuk formasi tumor dan masalah etik. Sedangkan, pada sel punca dewasa selain risiko untuk menjadi tumor dan masalah etik, jumlahnya sangat terbatas, tingkat proliferasi rendah dan diferensiasi terbatas. Adanya kekurangan yang dimiliki oleh embrional sel punca , sel punca dewasa 13 dan sel IPS telah digunakan sebagai sumber alternatif untuk sel dalam pengobatan regeneratif.(Rennie K et al. 2012) Populasi dari sel multipoten dapat ditemukan pada membran amnion (AM) dan cairan amnion (AF). Cairan amnion didapatkan pada saat amniosintesis. Epitel amnion dan sel amniotic mesenchimal stromal (AMS) dipisahkan dari amnion pada saat proses persalinan. Sel-sel ini sudah siap tersedia, mudah diproses dan menghindari isu etik seperti pada penggunaan embrional sel punca. Tidak seperti ES sel, AF dan AE tidak ditemukan terbentuknya teratoma ketika di transplantasi secara in vivo, dan mungkin menjadi alternatif yang lebih aman dari ES sel. (Rennie K et al.2012, Khrisnamurithy et al. 2011) Gambar 10. Proses isolasi membran fetus manusia dari plasenta. (Rennie K et al. 2012) Tampak tekstur dan sifat elastisitas dari membran (a). Membran amnion dan korian yang telah dipisahkan keduanya untuk persiapan prosedur purifikasi.(Rennie K et al. 2012) Membran amnion berkembang dari jaringan ekstraembrionik yang terdiri atas komponen fetal (lempeng korion) dan komponen material (lapisan desidua). 14 Kedua bagian tersebut saling bergabung oleh adanya villi korion dan berhubungan dengan bagian sitotropoblastik dari kantung korion ke lapisan desidua basalis. Pada komponen fetal, yang terdiri atas membran fetal amniotik dan korionik, terpisah dengan fetus dari endometrium. Membran amniokorionik membentuk batas luar dari dari katung yang dekat dengan fetus sedangkan bagian lapisan dalam dari kantung adalah membran amnion.(Niknejad H et al. 2008) Membran amnion terdiri dari satu lapis epitel, membran basal yang tebal dan stroma yang avaskuler. Membran amnion tidak memiliki pembuluh darah dan saraf, sedangkan nutrisi nya didapatkan melalui proses difusi keluar dari cairan amnion dan atau berasal dari decidua. Pada bagian lapisan terdalam yang paling dekat dengan fetus, disebut dengan epitel amnion dan terdiri atas satu lapis sel yang tersusun uniform pada membran basal. Membran basal merupakan salah satu membran paling tebal pada keseluruhan jaringan manusia. Matriks stromal yang tersusun berlapis merupakan struktur penunjang utama dari membran amnion. Kolagen disekresi oleh sel mesenkimal pada lapisan fibroblasr dimana kolagen tipe 1 dan 2 mendominasi dan membentuk bundle yang paralel untuk mempertahankan integritas dari membran amnion. Sedangkan kolagen tipe V dan VI membentuk hubungan filamen diantara kolagen intersisial dan membran basal epitel. Lapisan intermediet (spongiosa) dari matriks stroma berada didekat dari membran korion. Lapisan ini memiliki proteoglikan dan glikoprotein yang sangat banyak yang membentuk struktur spongios pada sediaan histologis dan sebagian besar terdiri dari kolagen tipe III. Lapisan spongiosa ini melekat lemah dengan membran korion, sehingga membran amnion sangat mudah dipisahkan dari korion dengan menggunakan diseksi tumpul saja.(Niknejad H et al. 2008) 15 Gambar 11. Struktur fetal membran dan penjelasan masing-masing lapisan dari komponen matriks ekstraseluler (ECM). (Niknejad H et al. 2008) Membran amnion merupakan lapisan terdalam dari fetal layer, yaitu pelindung fetus selama kehamilan. Lapisan paling luar, chorionic membrane, memisahkan fetus dari jaringan maternal. Selain sebagai pelindung, membran amnion juga membantu metabolisme langsung dari cairan amnion. Transportasi dari cairan, material terlarut, faktor pertumbuhan, sitokin, dan molekul bioaktif lainnya diregulasi oleh membran amnion.(Niknejad H et al. 2008) Sifatnya yang translusen, avaskular, immunogenic yang rendah, anti inflamasi, anti scar, dan bahan penyembuhan luka dari membran amnion menyebabkan material ini dapat diaplikasikan untuk terapi regeneratif. Pada abad yang lalu penggunaan membran amnion pernah digunakan untuk rekostruksi kornea dan permukaan konjungtiva, terapi ulkus dan luka traumatik, serta transplantasi kulit.(Niknejad H et al. 2008) 16 Sel punca pada membran amnion memiliki struktur histologis, biokimia dan biologi selular telah dipelajari untuk mengidentifikasi sel pada membran amnion untuk aplikasi klinis yang lain. Sel epitel dapat diidentifikasi sebagai layer tunggal, berbatasan dengan cairan amnion, serta sisi satunya pada membran basal. Sel epitel pada inner layer dan sel mesenkimal pada outer layer, keduanya sudah dilakukan penelitian menggunakan beberapa model invitro dan invivo. Pada kultur yang dilakukan pada keduanya didapatkan adanya sel punca. Subpopulasi dari keduanya didapatkan pluripoten marker, diantaranya OCT4, SOX2, dan NANOG. Sel AE menampilkan embrionik sel punca marker seperti SSEA4, TRA-1-60, dan TRA 1-81. Mutiple cell type dapat diperoleh dari melakukan kultur, baik pada AE atau Sel AMS dengan kondisi yang optimal. Dari beberapa laboratorium telah dilaporkan diferensiasi neural, hepar, cardiac, osteogenik, kondrogenik, dan adipogenik dari sel AE maupun AMS.(Rennie K et al. 2012, Khrisnamurithy et al. 2011) Sel AE dan AMS telah dikembangkan untuk beberapa tujuan diantaranya untuk pengembangan substitusi biologis untuk mengganti jaringan yang rusak, dan administrasi langsung dari sel pada jaringan yang cedera. Sebagai contoh, setelah induksi diferensiasi osteogenik dari AMS manusia, ditujukan pada mikrocarrier, struktur tulang menjadi seperti building blocks untuk membentuk tulang yang lebar (2x1 cm) secara in vitro. AE sel telah digunakan untuk membentuk struktur seperti tendon, dan skin graft double layer. Sel AE dan AMS manusia menunjukkan pengurangan dari cedera liver .pada sirosis, dan meningkatkan fungsi kardiak pada kardiak infark.(Rennie K et al. 2012,Khrisnamurithy et al. 2011) 17 Gambar 12. Persiapan membran amnion manusia. (Khrisnamurithy et al. 2011) Syarat utama untuk memilih menjadi scaffold adalah biokompatibilitas. Biokompatibilitas merupakan suatu sifat keadaan dimana sisi biologis yang kompatibel dimana tidak menghasilkan racun, tidak menciderai, tidak bersifat karsinogenik ataupun tidak menimbulkan reaksi imunologis terhadap jaringan yang hidup. Karrier harus tidak dapat dihancurkan oleh adanya proses peradangan dan dapat bereaksi dengan respon host yang sesuai. Selain itu, sifat mekanik yang harus dimiliki mencakup sifat permeabilitas, stabilitas, elastisitas, fleksibilitas, plastisitas, dan mudah diresorbsi pada tingkat tertentu oleh jaringan pengganti. Karrier juga harus memungkinkan sel untuk terjadi adhesi dan potensial dalam pengiriman agen biomodulator seperti faktor pertumbuhan dan bahan genetik. (Niknejad H et al. 2008) Ikatan antara sebuah sel dan karrier nya sangat dipengaruhi oleh komponen dari extracelluler matrix (ECM) karrier itu sendiri. Keberadaan dari molekul ECM tertentu seperti kolagen, laminin, fibronektin dan vitronektin dalam setiap membran basal memiliki pengaruh besar pada tingkat adhesi dan 18 pertumbuhan sel-sel induk diatasnya serta memungkinkan sel untuk menempelkan dan bermigrasi. Molekul ECM juga berfungsi sebagai ligan adhesi, yang dapat mengirimkan sinyal melalui interaksi mereka pada reseptor permukaan sel.(Niknejad H et al. 2008) Membran amnion merupakan sebuah scaffold yang merupakan struktur dari ECM. AEC mensekresikan kolagen tipe III dan IV dan glikoprotein nonkolagen (laminin, nidogen, dan fibronektin) yang membentuk membran basal dari membran amnion. Lapisan spons pada bagian stroma amnion memiliki proteoglikan dan glikoprotein terhidrasi yang sangat banyak dan berisi jaringan nonfibril yang sebagian besar merupakan kolagen tipe III. Perlecan, sebuah heparan sulfat proteoglikan yang besar (467 kDa) merupakan komponen dari membran basal yang sangat penting. Perlecan terlibat dalam mengikat faktor pertumbuhan dan berinteraksi dengan berbagai protein ekstraseluler dan adhesi molekul sel.(Niknejad H et al. 2008) Membran amnion dapat digunakan baik dengan epitel amnion (intak) atau tanpa nya (denudasi). Untuk membuang epitel amnion, membran amnion diinkubasi di EDTA pada suhu 37°C dan sel-sel tersebut dibersihkan dengan halus dibawah mikroskop. Meskipun pembuangan komponen sel dari membran amnion penting namun diharapkan komponen struktural masih terjaga. Penggunaan membran amnion pada transplantasi jaringan manusia memiliki preservasi jaringan yang khusus seperti penyimpanan pada suhu 40C, pengeringan dengan pembekuan, sterilisasi dengan sinar gamma, preservasi gliserol dan cryopreservation.(Niknejad H et al. 2008) 19