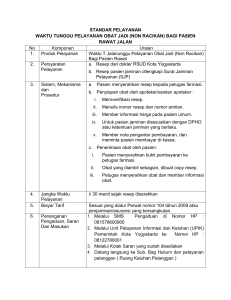
ikalep - PT. Ikapharmindo Putramas
advertisement

IKALEP ® SODIUM VALPROATE Sirup Obat antiepilepsi tidak boleh dihentikan secara tiba-tiba pada pasien yang diberikan antiepilepsi untuk mencegah kejang mayor karena kemungkinan menimbulkan status epileptikus dengan hipoksia dan menimbulkan kegawatan. Pada kasus individual di mana tingkat keparahan dan frekuensi dari gangguan kejang sedemikian rupa sehingga penghentian dosis obat tidak menimbulkan ancaman serius bagi pasien, penghentian obat dapat dipertimbangkan sebelum dan selama kehamilan, walaupun kejang ringan itu sendiri yang dapat menimbulkan bahaya atau kegawatan kepada embrio atau janin. EFEK SAMPING: Gastrointestinal: Efek samping yang sering dilaporkan pada awal terapi adalah mual, muntah dan gangguan pencernaan. Efek ini biasanya bersifat sementara dan jarang memerlukan penghentian terapi. Diare, kram perut dan sembelit telah dilaporkan. Baik anoreksia disertai dengan penurunan berat badan dan nafsu makan maupun adanya pertambahan berat badan juga telah dilaporkan. Pemberian sediaan lepas-lambat natrium divalproex dapat menurunkan kejadian efek samping. Dokter sangat menitikberatkan pertimbangan dalam mengobati atau konseling wanita epilepsi yang berpotensi hamil. Jika obat ini digunakan selama kehamilan, atau jika pasien menjadi hamil saat menggunakan obat ini, pasien harus diberitahu tentang potensi bahaya terhadap janin. Tes untuk mendeteksi kemungkinan terjadi neural tube defects (NTD) dan tes lainnya sebagai prosedur harus dianggap sebagai bagian dari penatalaksanaan rutin prenatal pada wanita subur yang menerima pengobatan valproat. SSP: Efek sedatif dapat terjadi pada pasien yang menerima valproat saja, tetapi paling sering terjadi pada pasien yang menerima terapi kombinasi. Sedasi biasanya mereda setelah pengurangan obat antiepilepsi lainnya. Tremor (mungkin terkait dosis), halusinasi, ataksia, sakit kepala, nistagmus, diplopia, asterixis "bintik-bintik di depan mata", disarthria, pusing, kebingungan, hiperestesia, vertigo, inkoordinasi dan parkinson telah dilaporkan pada penggunaan valproat. Kejadian yang jarang terjadi dari koma telah dilaporkan pada pasien yang menerima valproat saja atau bersama dengan fenobarbital. Kejadian yang jarang terjadi telah dilaporkan adanya ensefalopati dengan atau tanpa demam segera setelah pemberian awal monoterapi valproat pada pasien tanpa disfungsi hati atau kadar valproat plasma yang tinggi. Walaupun ada pemulihan setelah penghentian obat, hiperamonemia ensefalopatik, kadang-kadang bersifat fatal, telah dilaporkan setelah terapi valproat pada pasien dengan Gangguan Siklus Urea (UCD), terutama pada pasien dengan gangguan siklus urea yang mendasari (Lihat "Peringatan” dan “Gangguan Siklus Urea (UCD)” ). Telah dilaporkan adanya demensia reversibel dan pseudoatrofi reversibel berkaitan dengan terapi valproat. KOMPOSISI: Tiap sendok takar (5 ml) mengandung: Natrium valproat setara dengan Asam valproat............................ 250 mg PERHATIAN: Gangguan fungsi hati: Lihat "Kontraindikasi" dan "Peringatan". DESKRIPSI: Asam valproat adalah asam karboksilat. Nama kimia lainnya untuk senyawa ini adalah asam 2-propilpentanoat, asam 2-propilvalerat dan asam n-dipropilasetat, dengan memiliki struktur kimia berikut ini: Pankreatitis: Lihat "Peringatan" CH3 CH2 CH2 CH3 CH2 CH2 O CH C OH Asam valproat (pKa 4,8) adalah cairan tak berwarna dengan bau yang khas. Bersifat sedikit larut dalam air (1.3 mg/ml) dan sangat larut dalam pelarut organik. Rumus kimia empiris adalah C8H16O2 dan memiliki berat molekul 144. Sirup Asam valproat adalah antiepileptik untuk pemberian oral. Sirup ini mengandung setara dengan asam valproat 250 mg per 5 ml sebagai garam natrium. EFEK FARMAKOLOGI: Farmakodinamik Asam valproat berdisosiasi sebagai ion valproat dalam saluran pencernaan. Mekanisme kerja valproat dalam menimbulkan efek antiepilepsi masih belum ditetapkan. Ada penjelasan bahwa aktivitas dalam mengatasi epilepsinya berhubungan dengan meningkatkan konsentrasi otak dari Gamma-aminobutyric acid (GABA). INDIKASI: IKALEP® Sirup dapat digunakan sebagai terapi tunggal atau tambahan pada pengobatan kejang parsial (baik bersifat elementer maupun yang kompleks) dan kejang petit mal. KONTRAINDIKASI: • Asam valproat tidak boleh diberikan kepada pasien dengan penyakit hati atau disfungsi hati yang signifikan. • Asam valproat merupakan kontraindikasi pada pasien yang diketahui hipersensitif terhadap obat tersebut. • Asam valproat merupakan kontraindikasi pada pasien yang diketahui memiliki gangguan siklus urea (Lihat “Peringatan”). PERINGATAN: Hepatotoksisitas Telah dilaporkan adanya kegagalan fungsi hati yang mengakibatkan kematian telah terjadi pada pasien yang menerima pengobatan Asam valproat. Insiden ini dapat terjadi pada periode 6 bulan pertama pengobatan. Hepatotoksisitas fatal yang serius dapat didahului oleh gejala nonspesifik seperti malaise, kelemahan, lesu, edema wajah, anoreksia dan muntah. Pada pasien dengan epilepsi, kehilangan kontrol kejang juga dapat terjadi. Pasien harus dipantau ketat atas gejala yang ada. Tes fungsi hati harus dilakukan sebelum terapi, dan pada interval yang sering sesudahnya, terutama selama 6 bulan pertama. Dokter tidak harus bergantung sepenuhnya pada biokimia serum karena tes ini mungkin dapat tidak normal pada beberapa hal, tetapi juga harus dengan mempertimbangkan hasil rekam medis secara seksama dan hasil pemeriksaan fisik. Dibutuhkan perhatian lebih pada pemberian Asam valproat untuk pasien dengan riwayat penyakit hati. Pasien yang mendapatkan kombinasi beberapa antikonvulsan, misalnya anak-anak, orang dengan gangguan metabolisme bawaan, dengan gangguan kejang yang parah disertai dengan keterbelakangan mental, dan orang dengan penyakit otak organik mungkin memiliki risiko yang tinggi kegagalan fungsi hati. Dilaporkan bahwa anak-anak di bawah usia dua tahun meningkatkan risiko adanya kejadian hepatotoksisitas yang fatal, terutama mereka dengan kondisi pencetus tersebut. Bila Asam valproat digunakan pada kelompok pasien tersebut, harus digunakan sangat hati-hati. Manfaat terhadap kontrol kejang harus lebih dititikberatkan dibandingkan risiko. Pada kelompok di atas usia 2 tahun ini, pengalaman menunjukkan bahwa kejadian hepatotoksisitas yang fatal akan berkurang jauh pada pasien yang semakin tua. Obat ini harus dihentikan bila ditemukan adanya disfungsi hati yang signifikan. Pada beberapa kasus, disfungsi hati masih ada meskipun setelah penghentian obat. Pankreatitis Kasus yang gawat dari pankreatitis telah dilaporkan pada anak-anak dan orang dewasa yang menerima pengobatan valproat. Beberapa kasus digambarkan sebagai hemoragik dengan progresifitas yang cepat dari gejala awal sampai pada kematian. Beberapa kasus telah terjadi tak lama setelah awal penggunaan dan setelah beberapa tahun penggunaan obat. Tingkat kasus yang dilaporkan ternyata lebih dari perkiraan pada populasi umum dan di mana pankreatitis kambuh setelah pemberian ulang dengan valproat. Pasien dan perawat harus diperingatkan bahwa sakit perut, mual, muntah dan/atau anoreksia dapat timbul sebagai gejala pankreatitis yang memerlukan evaluasi medis yang segera. Jika didiagnosis terjadi pankreatitis, valproat harus segera dihentikan. Pengobatan lain untuk kondisi penyakit lain yang mendasari harus dimulai sebagaimana ditunjukkan dalam gejala klinik. Gangguan Siklus Urea (UCD) Hiperamonemia ensefalopatik, kadang-kadang bersifat fatal, telah dilaporkan setelah terapi awal valproat pada pasien dengan gangguan siklus urea (UCD), kelainan genetik yang jarang, khususnya defisiensi transcarbamylase ornithine. Sebelum memulai terapi dengan valproat, evaluasi untuk UCD harus dipertimbangkan pada pasien berikut: 1) mereka yang tidak dijelaskan, tetapi memiliki riwayat ensefalopati atau koma, ensefalopati terkait dengan gangguan protein, ensefalopati terkait dengan kehamilan atau postpartum, keterbelakangan mental, atau riwayat peningkatan amonia atau glutamin plasma; 2) mereka dengan siklus muntah dan kelesuan, episodik lekas marah yang ekstrim, ataksia, BUN rendah, dan yang menghindari protein; 3) mereka yang memiliki riwayat keluarga UCD atau riwayat keluarga dengan kematian bayi (terutama laki-laki); 4) mereka dengan tanda-tanda lain atau gejala dari UCD. Pasien yang mengalami gejala hiperamonemia ensepalopati saat menerima terapi valproat harus menerima pengobatan yang tepat (termasuk penghentian terapi valproat) dan dievaluasi untuk kemungkinan adanya gangguan siklus urea yang mendasari (Lihat “Kontraindikasi” dan “Perhatian”). Hiperamonemia Hiperamonemia telah dilaporkan ada kaitannya dengan terapi valproat dan bisa terjadi meskipun tes fungsi hati normal. Pada pasien yang mengalami kelesuan dan muntah atau perubahan status mental, harus dipertimbangkan mengarah pada ensefalopati hiperamonemia, sehingga diperlukan dan tingkat amonia diukur. Jika amonia meningkat terapi valproat harus dihentikan. Intervensi untuk pengobatan hiperamonemia harus dimulai, dan pasien tersebut harus menjalani pemeriksaan yang mendasari gangguan siklus urea (UCD) (lihat "Kontraindikasi”, “Peringatan” dan “Gangguan Siklus Urea (UCD)”). Dermatologi: Dapat terjadi rambut rontok bersifat sementara, ruam kulit, fotosensitifitas, pruritus, eritema multiformis dan sindroma Stevens-Johnson. Kejadian yang jarang terjadi dari nekrolisis epidermal toksik telah dilaporkan termasuk kasus fatal pada bayi usia 6-bulan yang diberikan valproat dan beberapa obat bersamaan obat kombinasi lainnya. Dilaporkan 1 kasus nekrosis epidermal toksik mengakibatkan kematian pada pasien usia 35-tahun dengan AIDS diberikan bersamaan beberapa kombinasi obat dengan riwayat beberapa reaksi pada kulit bersifat multiple. Efek samping serius pada kulit telah dilaporkan pada pemberian kombinasi lamotrigin dan valproat (Lihat "Perhatian” dan “Interaksi Obat”). Sering terjadi peningkatan amonia asimtomatik, oleh karena itu bila terjadi maka lakukan monitoring yang ketat terhadap kadar amonia plasma. Jika peningkatan amonia terus berlanjut, penghentian terapi valproat harus dipertimbangkan. Psikiatri: Marah emosional, depresi, psikosis, agresi, hiperaktif, rasa bermusuhan dan perburukan berperilaku. Umum Adanya laporan trombositopenia (Lihat "Peringatan”), penghambatan fase sekunder agregasi platelet dan abnormal parameter koagulasi, dianjurkan melakukan tes jumlah trombosit dan koagulasi sebelum memulai terapi dan secara berkala. Bila akan menjalani operasi, pasien yang menerima Asam valproat dilakukan monitoring jumlah trombosit dan parameter koagulasinya sebelum operasi direncanakan. Adanya perdarahan, memar atau gangguan hemostasis/koagulasi merupakan indikasi untuk pengurangan dosis atau penghentian terapi. Hematologi: Trombositopenia dan penghambatan fase sekunder agregasi platelet dapat tercermin karena adanya peningkatan waktu perdarahan, petekiae, memar, pembentukan hematoma, epistaksis dan perdarahan. Limfositosis relatif, makrositosis, hipofibrinogenemia, leukopenia dan eosinofilia, anemia makrositik termasuk dengan atau tanpa kekurangan folat, penekanan sumsum tulang, anemia aplastik, agranulositosis dan porfiria intermiten akut. Musculoskeletal: Rasa lemah. Karena valproat berinteraksi dengan obat-obatan yang diberikan secara bersamaan dengan induksi enzim, dianjurkan monitoring konsentrasi plasma secara periodik baik valproat maupun obat-obatan penyertanya selama awal masa terapi (Lihat "Perhatian” dan “Interaksi Obat”). Hepatik: Sering adanya peningkatan bersifat minor terhadap transaminase (misalnya, SGOT dan SGPT) dan LDH dan tampaknya terkait dosis. Dari hasil tes laboratorium, kadang-kadang termasuk adanya peningkatan bilirubin serum dan perubahan abnormal pada tes fungsi hati lainnya. Hasil ini mencerminkan kemungkinan hepatotoksisitas berpotensi serius. (Lihat "Peringatan"). Valproat sebagian dieliminasi di dalam urin sebagai metabolit-keto yang dapat mengakibatkan interpretasi semu dari tes keton di dalam urine. Endokrin: Menstruasi tidak teratur, amenore sekunder, pembesaran payudara, galaktorea, dan pembengkakan kelenjar parotis. Abnormal tes fungsi tiroid (Lihat "Perhatian"). Dilaporkan yang jarang terjadi bersifat spontan dari penyakit ovarium polisistik. Hubungan sebab-akibatnya belum ditetapkan. Dilaporkan adanya gangguan fungsi tiroid terkait dengan valproat. Informasi untuk Pasien Pasien dan perawat harus diperingatkan bahwa bila terjadi sakit perut, mual, muntah, dan/atau anoreksia yang merupakan gejala pankreatitis, segera dilakukan evaluasi medis lebih lanjut. Pasien dan perawat harus diberitahu tentang tanda-tanda dan gejala yang berhubungan dengan hiperamonemia ensefalopati (Lihat "Perhatian” dan “Hiperamonemia”) dan untuk segera menginformasikan kepada dokter tentang gejala tersebut. Karena Asam valproat dapat menimbulkan depresi SSP, terutama bila dikombinasikan dengan obat yang bekerja mendepresi SSP (misalnya alkohol), pasien harus disarankan untuk tidak melakukan pekerjaan yang menimbulkan risiko berbahaya, seperti mengemudi mobil atau mengoperasikan mesin, sampai diketahui bahwa tidak menjadi mengantuk karena obat ini. Karena telah dikaitkan dengan beberapa jenis cacat lahir, penggunaan Asam valproat pada pasien wanita usia subur harus diberitahukan risiko yang terkait dengan penggunaan Asam valproat selama kehamilan (Lihat "Peringatan"). INTERAKSI OBAT: Pengaruh Kombinasi Obat Terhadap Bersihan Valproat Obat yang mempengaruhi kadar enzim hati, terutama meningkatkan kadar glucuronosyltransferase, dapat meningkatkan bersihan valproat. Sebagai contoh, fenitoin, karbamazepin, dan fenobarbital (atau primidone) dapat menggandakan bersihan valproat. Dengan demikian, pasien monoterapi umumnya akan memiliki waktuparuh lebih lama dan konsentrasi yang lebih tinggi dibandingkan pasien yang menerima politerapi obat antiepilepsi. Sebaliknya, obat yang menghambat isoenzim sitokrom P450, misalnya, antidepresan, hanya sedikit pengaruhnya pada bersihan valproat karena oksidasi yang dimediasi mikrosomal sitokrom P450 merupakan jalur metabolisme sekunder yang relatif kecil dibandingkan dengan glucuronidation dan beta-oksidasi. Dengan kemungkinan adanya perubahan dalam bersihan valproat, memulai atau menghentikan kombinasi obat harus dilakukan monitoring konsentrasi valproat dan obat lain karena adanya induksi enzim. Meropenem: Telah dilaporkan tingkat kadar Asam valproat berada pada kadar subterapeutik saat bila diberikan bersamaan dengan meropenem. Pankreas: Pankreatitis akut, termasuk fatalitasnya (Lihat "Peringatan"). Metabolik: Hiperamonemia (lihat "Perhatian"), hiponatremia dan sekresi ADH berlebihan. Dilaporkan kejadian yang langka sindrom Fanconi, terutama pada anak-anak. Penurunan konsentrasi karnitin telah dilaporkan meskipun relevansi klinisnya tidak diketahui. Hiperglisinemia (peningkatan konsentrasi plasma glisin) telah terjadi dan dikaitkan dengan fatalitas pada pasien yang sudah memiliki dengan hiperglisinemia nonketotik. Genitourinari: Enuresis dan infeksi saluran kemih. Indera khusus: Telah dilaporkan kejadian gangguan pendengaran, baik reversibel atau ireversibel, namun hubungan sebab-akibatnya belum ditetapkan. Sakit telinga juga telah dilaporkan. Lainnya: Reaksi alergi, anafilaksis, edema ekstremitas, lupus eritematosus, nyeri tulang, batuk, pneumonia, otitis media, bradikardia, vaskulitis kulit, demam, dan hipotermia. OVERDOSIS: Overdosis dengan valproat dapat mengakibatkan mengantuk, blok jantung dan koma. Telah dilaporkan adanya fatalitas, namun, pasien telah pulih dari kadar valproat setinggi 2120 mcg/ml. Dalam situasi overdosis, kadar fraksi obat tak-terikat protein adalah tinggi. Hemodialisis atau hemodialisis tandem ditambah hemoperfusi signifikan menarik kadar obat. Manfaat dari lavage lambung atau emesis akan bervariasi menurut lamanya sejak minum obat. Langkah-langkah suportif umum harus diterapkan dengan perhatian khusus pada pemeliharaan output urin. Nalokson dilaporkan dapat membalikkan efek depresi SSP dari overdosis valproat. Karena nalokson secara teoritis bisa membalikkan efek antiepilepsi dari valproat, penggunaannya harus dengan hati-hati. DOSIS DAN CARA PEMBERIAN: IKALEP® Sirup diberikan secara oral. Dosis awal yang dianjurkan adalah 15 mg/kg/hari, meningkat dengan interval 1 minggu dengan dosis 5-10 mg/kg/hari, sampai kejang terkendalikan atau sampai adanya efek samping terjadi bila dosis dinaikkan. Dosis maksimum yang dianjurkan adalah 60 mg/kg/hari. Jika dosis harian total melebihi 250 mg, harus diberikan dalam rejimen terbagi. Tabel berikut adalah panduan untuk dosis harian awal Asam valproat (15 mg/kg/hari): (kg) (lb) Total Dosis Harian (mg) 10 – 24.9 25 – 39.9 40 – 59.9 60 – 74.9 75 – 89.9 22 – 54.9 55 – 87.9 88 – 131.9 132 – 164.9 165 – 197.9 250 500 750 1000 1250 Berat Simetidin dan Ranitidin: Simetidin dan Ranitidin tidak mempengaruhi bersihan valproat. Pengaruh Valproat Terhadap Obat Lain: Dilaporkan bahwa valproat merupakan inhibitor yang lemah terhadap isoenzim P450, hydrase epoksida, dan glucuronyltransferase. Clonazepam: Penggunaan bersamaan Asam valproat dan clonazepam bisa mendorong adanya gejala kejang pada pasien dengan riwayat kejang jenis absence-seizure. Lamotrigin: Dosis Lamotrigin harus dikurangi bila diberikan bersamaan dengan valproat. Reaksi kulit yang serius (seperti sindroma Stevens-Johnson dan nekrolisis toksik epidermal) telah dilaporkan pada pemberian bersamaan lamotrigin dan valproat. Fenobarbital: Dilaporkan adanya depresi SSP berat, dengan atau tanpa peningkatan signifikan konsentrasi serum barbiturat atau valproat. Semua terapi dengan barbiturat harus dimonitor secara seksama untuk mengamati toksisitas neurologis. Bila konsentrasi serum barbiturat sudah tercapai, dosis barbiturat dapat diturunkan. Jumlah Sendok takar (5 ml) dari Sirup Dosis 1 Dosis 2 Dosis 3 0 1 1 1 2 0 0 1 1 1 1 1 1 2 2 Frekuensi efek samping (terutama peningkatan enzim hati) mungkin terkait dosis. Walaupun dapat tercapai pada dosis yang lebih tinggi, manfaat dari kontrol kejang karenanya harus lebih dititikberatkan dibandingkan risiko kemungkinan timbulnya efek samping. Penggunaan pada Kehamilan Dari data yang dipublikasi maupun tidak dipublikasikan, dilaporkan bahwa Asam valproat dapat menimbulkan efek teratogenik, seperti neural tube defects (misalnya spina bifida) pada wanita hamil yang menerima valproat. Primidone: Primidone dimetabolisme menjadi barbiturat dan karena itu memiliki interaksi yang sama dengan valproat sebagai fenobarbital. Belum ditetapkan adanya korelasi antara dosis harian, kadar serum dan efek terapeutik. Namun, kadar terapeutik serum kebanyakan pasien akan berkisar dari 50 hingga 100 mcg/ml. Beberapa pasien dapat dikontrol dengan tingkat serum yang lebih rendah atau lebih tinggi dari kisaran ini. Beberapa laporan yang menunjukkan bahwa penggunaan obat antiepilepsi selama kehamilan akan meningkatkan insiden cacat lahir pada bayinya. Meskipun data yang lebih luasnya dihubungkan dengan trimetadion, parametadion, fenitoin dan fenobarbital, diduga menunjukkan adanya kemungkinan dengan penggunaan obat antiepilepsi lainnya. Oleh karena itu, obat antiepilepsi bisa diberikan pada wanita yang berpotensi hamil hanya jika pengobatan menjadi manfaat yang sangat penting dalam pengendalian kejang. Fenitoin: Pada pasien dengan epilepsi, ada laporan dari kejang terobosan terjadi dengan kombinasi valproat dan fenitoin. Dosis fenitoin harus disesuaikan sebagaimana disyaratkan oleh situasi klinis. Karena dosis IKALEP® Sirup bersifat dititrasi ke atas, kadar dalam darah dari kadar Fenobarbital dan/atau Fenitoin mungkin akan terpengaruh. Kesuburan Pengaruh valproat terhadap perkembangan testis, produksi sperma dan kesuburan pada manusia tidak diketahui. Iritasi Gastrointestinal: Pasien yang mengalami iritasi gastrointestinal dapat mengambil manfaat dengan menggunakan IKALEP® Sirup bersamaan dengan makanan atau dengan perlahan-lahan meningkatkan dosis awal yang rendah. Gangguan pada susunan saraf tulang belakang janin dapat terjadi pada ibu menerima valproat selama trimester pertama kehamilan. Telah dilaporkan adanya anomali kongenital lainnya (misalnya, cacat kraniofasial, malformasi kardiovaskular dan anomali yang melibatkan berbagai sistem tubuh), pada mereka yang masih hidup atau sudah meninggal. Belum ada data yang cukup untuk keterkaitan kejadian anomali kongenital ini. Insiden anomali kongenital yang lebih tinggi pada wanita dengan gangguan kejang yang diobati antiepilepsi tidak dapat dianggap memiliki hubungan sebab-akibat dan efeknya. Terdapat masalah metodalogis intrinsik untuk mendapatkan data teratogenitas obat yang memadai pada manusia, faktor genetik atau kondisi epilepsi itu sendiri, mungkin lebih penting dibandingkan kontribusi pengaruhnya terhadap anomali kongenital. Pasien yang menggunakan valproat dapat mengalami kelainan pembekuan darah. Seorang pasien yang memiliki fibrinogen rendah menggunakan kombinasi antikonvulsan termasuk valproat melahirkan bayi dengan afibrinogenemia yang bisa meninggal karena perdarahan. Jika valproat digunakan dalam kehamilan, parameter pembekuan harus dipantau secara hati-hati. Dilaporkan adanya gagal hati yang mengakibatkan kematian neonatus dan bayi, pada penggunaan valproat selama kehamilan. Kehamilan Lihat "Peringatan". Ibu Menyusui Valproat diekskresikan dalam ASI. Perlu diperhatikan untuk berhenti menyusui bila Asam valproat diberikan kepada wanita menyusui. Penggunaan pada Anak-Anak Dilaporkan bahwa anak-anak di bawah usia dua tahun memiliki risiko adanya kejadian hepatotoksisitas yang fatal, terutama mereka dengan kondisi pencetus tersebut (Lihat "Peringatan"). Bila Asam valproat digunakan pada kelompok pasien tersebut, harus digunakan sangat hati-hati. Manfaat terhadap kontrol kejang harus lebih dititikberatkan dibandingkan risiko. Pada kelompok di atas usia 2 tahun pengalaman menunjukkan bahwa kejadian hepatotoksisitas yang fatal akan berkurang jauh pada pasien yang semakin tua. Anak-anak muda, terutama mereka yang menerima obat yang dapat menginduksi enzim, akan memerlukan dosis pemeliharaan lebih besar untuk mencapai konsentrasi kadar yang ditargetkan dan asam valproat takterikat. Berdasarkan monitoring konsentrasi serum Asam valproat, variabilitas fraksi bebasnya membatasi kegunaan klinis. Interpretasi konsentrasi Asam valproat pada anak-anak harus mencakup pertimbangan faktorfaktor yang mempengaruhi metabolisme hati dan ikatan protein. PENYIMPANAN: Simpan pada suhu di bawah 30°C dan terlindung dari cahaya. KEMASAN: Dus, Botol kaca @ 120 ml No. Reg. : DKL1309321937A1 HARUS DENGAN RESEP DOKTER Diproduksi oleh : PT. IKAPHARMINDO PUTRAMAS PHARMACEUTICAL LABORATORIES JAKARTA - INDONESIA