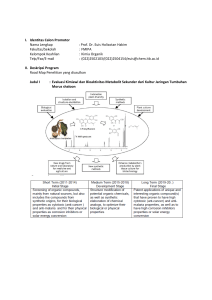
i SINTESIS SENYAWA 4-ASETAMIDOFENIL
advertisement

PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI SINTESIS SENYAWA 4-ASETAMIDOFENIL BENZOAT DARI PARASETAMOL DAN BENZOIL KLORIDA BERDASARKAN REAKSI SUBSTITUSI NUKLEOFILIK ASIL SKRIPSI Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm.) Program Studi Farmasi Oleh: Dolorosa Lintang Suminar NIM : 098114047 FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA YOGYAKARTA 2016 i PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI HALAMAN PERSEMBAHAN Life is not something that flow like a river, it is not something that we should follow and let go effortlessly. Life is the stage for us actors to challenge ourselves, it is where we have to decide, be brave, take responsibility, be committed, be passionate, and live fully. Dream on! For no dream is a crime. Live on! For our souls are our own. Be who we are and who we always want to be.. And be ourselves! Kupersembahkan karya ini untuk: IBU HEBAT, Enny Anggraini, Ph.D.; yang selalu menjadi cita-citaku, yang hampir 5 tahun terpisah benua, namun selalu kirimkan cinta. BAPAK, Dwi Koratno, M.A.; yang selalu mengalah, yang terlalu sabar menghadapi kerasnya tuturku, namun setia memperhatikanku. Belahan jiwaku, mas Heronimus HERU Adityo, suporter setiaku, generator bagi semangatku, yang menemaniku malam hingga pagi via telpon, meskipun dipisahkan jarak tapi kaulah yang memberiku kekuatan untuk berjuang. Eyang-eyangku tercinta, keluarga yang terlalu besar, dan sahabat-sahabatku. iv PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI PRAKATA Puji syukur ke hadirat Tuhan Yang Maha Esa atas berkat dan rahmat-Nya yang melimpah sehingga penulis dapat menyelesaikan skripsi yang berjudul “Sintesis Senyawa 4-Asetamidofenil Benzoat dari Parasetamol dan Benzoil Klorida berdasarkan Reaksi Substitusi Nukleofilik Asil” dengan baik. Skripsi ini disusun untuk memenuhi salah satu syarat untuk memperoleh gelar Sarjana Strata Satu (S1) Program Studi Farmasi (S.Farm.) Fakultas Farmasi Universitas Sanata Dharma Yogyakarta. Penulis mengucapkan terima kasih atas segala bantuan yang diberikan oleh berbagai pihak, yakni: 1. Aris Widayati, M.Si., Ph.D., Apt., selaku Dekan Fakultas Farmasi, Universitas Sanata Dharma Yogyakarta. 2. Dr. Sri Hartati Yuliani, M.Si., Apt., selaku Ketua Program Studi Fakultas Farmasi, Universitas Sanata Dharma Yogyakarta. 3. Jeffry Julianus, M.Si., selaku dosen pembimbing yang memberikan bimbingan serta arahan dengan penuh kesabaran, sekaligus sebagai dosen penguji atas kritik dan saran yang diberikan kepada penulis. 4. Enade Perdana Istyastono, Ph.D., Apt., selaku dosen penguji atas saran, kritik, dan solusi yang diberikan kepada penulis. 5. F. Dika Octa Riswanto, M.Sc., selaku dosen penguji atas saran, kritik, dan solusi yang diberikan kepada penulis. vi PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 6. Pak Parlan, mas Kunto, mas Bimo, serta segenap laboran Fakultas Farmasi yang berkenan membantu selama proses di laboratorium, dan menjadi partner bertukar pikiran yang luar biasa. 7. Ibu, Bapak, mas Heru dan keluarga, eyang A’uk di surga, eyang Uti, bulik Ida, budhe Ninik, Ian, Nanto, eyang Benny (alm.), tante Dien, om Norman, keluarga besar Kusumadi, keluarga besar Bhe Yu Hie, keluarga besar Ratidjo, serta seluruh keluarga besar penulis atas dukungan, doa, kasih sayang, dan reminder dalam menyelesaikan tulisan ini. 8. Para sahabat: Maria Indah, Agnes Wilis, Luthfi, Sani, Neo, Aldo, Majid, atas dukungan, semangat, kesempatan untuk bertukar pikiran, dan persahabatan luar biasa yang diberikan kepada penulis. 9. Teman-teman seperjuangan: Dino, Ita, Gita, Meta, Ria, Ella, Albet, Calista, teman-teman FST 2010, dan teman-teman angkatan 2009, atas bantuan, dukungan, serta persahabatan yang diberikan. 10. Semua pihak yang tidak dapat disebutkan satu per-satu, yang berperan dalam memberikan dukungan serta bantuan selama penyusunan skripsi ini. Atas segala kekurangan dalam proses penelitian maupun penulisan yang dilakukan oleh penulis, maka penulis mengharapkan kritik serta saran yang membangun demi memperbaiki kesalahan-kesalahan tersebut. Semoga skripsi ini dapat bermanfaat bagi pembaca dan mendukung pengembangan ilmu pengetahuan. Penulis vii PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI DAFTAR ISI Halaman HALAMAN JUDUL ………………………………………………………………i HALAMAN PERSETUJUAN PEMBIMBING …………………………………..ii HALAMAN PENGESAHAN…………………………………………………… iii HALAMAN PERSEMBAHAN ………………………………………………….iv HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH …………………………………………………………………………...v PRAKATA………………………………………………………………………..vi PERNYATAAN KEASLIAN KARYA ………………………………………..viii DAFTAR ISI ……………………………………………………………………..ix DAFTAR TABEL………………………………………………………………..xii DAFTAR GAMBAR……………………………………………………………xiii DAFTAR LAMPIRAN…………………………………………………………..xv ABSTRAK …………….………………………………………………………..xvi ABSTRACT……………………………………………………………………...xvii BAB I. PENDAHULUAN …..…………………………………………………….1 A. Latar Belakang ………………………………………………………...………1 1. Rumusan Masalah .………………………………………………………...3 2. Keaslian Penelitian………………………………………………………...3 3. Manfaat penelitian…………………………………………………............4 B. Tujuan Penelitian ……………………………...………………………………4 BAB II. TINJAUAN PUSTAKA………………………………………………….5 ix PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI A. Parasetamol ……………………………………………………………………5 B. Benzoil Klorida ………………………………………………………………..6 C. Piridina ………………………………………………………………………...9 D. Reaksi Substitusi Nukleofilik Asil …………………………………………...10 E. Rekristalisasi …………………………………………………………………12 F. Uji Kelarutan………………………………………………………………....12 G. Uji Titik Lebur ……………………………………………………………….15 H. Identifikasi dan Uji Kemurnian dengan Kromatografi Lapis Tipis (KLT)…..17 I. Spektrofotometri Inframerah/Infrared (IR)…..………………………………19 J. Kromatografi Gas ……………………………………………………………22 K. Spektrometri Massa ………………………………………………………….27 L. Landasan Teori……………………………………………………………….31 M. Hipotesis……………………………………………………………………...33 BAB III. METODE PENELITIAN ……………………………………………...34 A. Jenis Penelitian……………………………………………………………….34 B. Definisi Operasional Penelitian ……………………………………………...34 C. Bahan Penelitian……………………………………………………………...35 D. Alat Penelitian ……………………………………………………………….35 E. Tata Cara Penelitian ………………………………………………………….35 1. Sintesis 4-Asetamidofenil Benzoat ……………………………………....35 2. Pemeriksaan Pendahuluan Senyawa Hasil Sintesis ……………………...36 3. Elusidasi Struktur Senyawa Hasil Sintesis ………………………………37 F. Analisis Hasil ………………………………………………………………...38 x PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 1. Perhitungan Rendemen …………………………………………………..38 2. Uji Pendahuluan ………………………………………………………….38 3. Pemeriksaan dan Uji Kemurnian Senyawa Hasil Sintesis ……………….38 4. Elusidasi Struktur ………………………………………………………..38 BAB IV. PEMBAHASAN……………………………………………………….39 A. Sintesis 4-Asetamidofenil Benzoat …………………………………………..39 B. Analisis Pendahuluan ………………………………………………………...44 1. Pemeriksaan Organoleptis ……………………………………………….44 2. Pemeriksaan Kelarutan…………………………………………………...44 3. Pemeriksaan Titik Lebur …………………………………………………49 4. Kromatografi Lapis Tipis (KLT) ………………………………………...50 C. Elusidasi Struktur Senyawa Hasil Sintesis …………………………………..52 1. Elusidasi Struktur dengan Spektrofotometri Inframerah (IR) …………...52 2. Elusidasi Struktur dengan Kromatografi Gas-Spektrometri Massa (GC-MS) …………………………………………………………………55 BAB V. KESIMPULAN DAN SARAN ………………………………………...61 A. Kesimpulan ……………………...…………………………………………...61 B. Saran …………………………………………………………………………61 DAFTAR PUSTAKA …………………………………………………………....62 LAMPIRAN……………………………………………………………………...65 BIOGRAFI PENULIS …………………………………………………………...75 xi PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI DAFTAR TABEL Tabel I. Perbandingan sifat fisik senyawa produk sintesis dan starting material …………………………………………………………….44 Tabel II. Perbandingan tingkat kelarutan produk sintesis dengan parasetamol ………………………………………………………...45 Tabel III. Uji titik lebur terhadap produk sintesis dan starting material ……..50 Tabel IV. Perbandingan nilai Rf dan hRf produk sintesis dengan parasetamol ………………………………………………………...51 Tabel V. Interpretasi spektra inframerah senyawa produk sintesis ………….54 xii PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI DAFTAR GAMBAR Gambar 1. Struktur parasetamol……………………………………….....…..5 Gambar 2. Struktur benzoil klorida …………………………………………..6 Gambar 3. Mekanisme reaksi antara asam klorida dengan alkohol ………….8 Gambar 4. Struktur piridina ……………………………………………….....9 Gambar 5. Reaksi substitusi nukleofilik asil ……………………………......11 Gambar 6. Interaksi dipol-dipol dan dipol-terinduksi dipol …………….......23 Gambar 7. Pemisahan 10 senyawa dalam (a) dimetilsiloksan (non-polar) dan (b) etilen glikol (polar) ………………………………………….26 Gambar 8. Reaksi umum sintesis 4-asetamidofenil benzoat ……………......33 Gambar 9. Reaksi substitusi nukleofilik asil dalam sintesis 4-asetamidofenil benzoat………………………………………………………......40 Gambar 10. Kelarutan (a) parasetamol dan (b) 4-asetamidofenil benzoat dalam NaOH 5% ………………………..……………………………...46 Gambar 11. Sisi donor dan akseptor proton pada parasetamol dan 4asetamidofenil benzoat ………………………………………….47 Gambar 12. Hasil elusi KLT terhadap parasetamol (PCT), produk orientasi (a), dan produk sintesis replikasi I (b), II (c), dan III (d); fase diam=silika gel GF254, fase gerak=aseton:etil asetat (2:3), deteksi pada UV 254 nm………………………………………………...51 Gambar 13. Spektra inframerah senyawa produk (pelet KBr) ……………….52 Gambar 14. Spektra inframerah parasetamol ………………………………...53 xiii PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Gambar 15. Kromatogram senyawa hasil sintesis……………………………55 Gambar 16. Spektra massa EI senyawa produk pada waktu retensi 33,683 menit ……………………………………….................................56 Gambar 17. Spektra massa EI senyawa produk pada waktu retensi 34,183 menit …………………………………………………………….56 Gambar 18. Spektra massa EI senyawa produk pada waktu retensi 34,942 menit …………………………………………………………….56 Gambar 19. Usulan mekanisme fragmentasi ion molekul 4-asetamidofenil benzoat……………………………………………………...…...58 Gambar 20. Spektra massa EI senyawa produk pada waktu retensi 45,392 menit …………………………………………………………….59 Gambar 21. Spektra massa EI senyawa produk pada waktu retensi 47,092 menit …………………………………………………………….59 xiv PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI DAFTAR LAMPIRAN Lampiran 1. Data penimbangan starting material dan perhitungan rendemen teoretis …………………………………………………………….65 Lampiran 2. Data penimbangan dan perhitungan rendemen …………………...66 Lampiran 3. Spektra inframerah produk sintesis ……………………………….67 Lampiran 4. Kondisi alat spektrometri massa ………………………………….68 Lampiran 5. Kromatogram spektrometri massa produk sintesis ……………….69 Lampiran 6. Pola fragmentasi produk sintesis ………………………………….70 xv PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI ABSTRAK Senyawa 4-asetamidofenil benzoat merupakan senyawa derivat paminofenol yang diduga mempunyai aksi analgetika dan anti-inflamasi, yang bekerja dengan menghambat enzim siklooksigenase-2 (COX-2). Penghambatan pada COX-2 berarti terjadi penghambatan pada interaksi enzim tersebut dengan asam arakhidonat yang memicu pembentukan prostaglandin sebagai penghasil respon inflamasi. Sintesis senyawa 4-asetamidofenil benzoat melalui reaksi substitusi nukleofilik asil (SNA) antara parasetamol (N-asetil-p-aminofenol) dan benzoil klorida dalam piridina dilakukan berdasarkan pemodelan molekul derivat p-aminofenol pada penelitian sebelumnya, yang memperoleh hasil yang menjanjikan sebagai senyawa dengan aksi yang lebih poten sebagai analgetika dan anti-inflamasi. Identifikasi senyawa hasil sintesis dilakukan melalui analisis terhadap organoleptis dan kelarutan, dilengkapi dengan uji kromatografi lapis tipis (KLT), uji titik lebur, elusidasi struktur malalui spektrofotometri inframerah, kromatografi gas, dan spektrometri massa (GC-MS), serta perhitungan rendemen. Hasil penelitian menunjukkan bahwa terjadi reaksi yang membentuk senyawa baru dengan rendemen rata-rata 26,152% b/b yang memiliki karakteristik golongan ester sesuai dengan senyawa tujuan. Kata kunci: substitusi nukleofilik asil, 4-asetamidofenil benzoat, anti-inflamasi, parasetamol, benzoil klorida, sintesis organik xvi PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI ABSTRACT 4-acetamidophenyl benzoate is a p-aminophenol derivative which is believed to have actions as analgesic and anti-inflammation, that blocks cyclooxygenase-2 (COX-2) enzyme in its mechanism. Blocking in COX-2 causes the inhibition of enzyme interaction with arachidonic acid which originally produces prostaglandine, resulting in inflammation response. Synthesis of 4acetamidophenyl benzoate through nucleophilic acyl substitution reaction between paracetamol (N-acetyl-p-aminophenol) and benzoyl chloride in pyridine was done based on the previous study in p-aminophenol derivatives molecular modelling, resulting a promising conclusion as a substance with more potent actions as analgesic and anti-inflammation. Identification of the product substance were done by organoleptic and solubility analysis, completed with thin layer chromatography (TLC), melting point test, structure elutidation by infrared spectrophotometry, gas chromatography and mass-spectrometry (GC-MS), and yield calculation. The study shows that a new substance was formed through the reaction process with average yield of 26,152% w/w which has the characteristics of ester group substances as the expected product. Keywords: nucleophilic acyl substitution, 4-acetamidophenyl benzoate, antiinflammation, paracetamol, benzoil chloride, organic synthesis xvii PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI BAB I PENDAHULUAN A. Latar Belakang Inflamasi adalah suatu respon sel hidup terhadap luka yang terjadi akibat interaksi antara asam arakhidonat dan enzim siklooksigenase 2 (COX-2) yang memicu pembentukan prostaglandin (Vane, 1996). Untuk mencegah atau menghambat terjadinya inflamasi, maka interaksi antara asam arakhidonat dan COX-2 harus dihambat. Analgesik merupakan suatu agen atau senyawa yang memiliki kemampuan untuk mengurangi rasa sakit/ nyeri dengan cara meningkatkan ambang rasa sakit, tanpa mengganggu kesadaran maupun mempengaruhi agen sensori lainnya (Hanson, 2000). Salah satu analgesik yang populer dan paling sering diresepkan adalah N-asetil-p-aminofenol atau asetaminofen (parasetamol), yang telah digunakan hampir selama 100 tahun akan tetapi belum diketahui dengan jelas dalam hal mekanisme aksinya. Mekanisme aksi asetaminofen/parasetamol sebagai analgesik dan antiinflamasi seperti mekanisme obat-obat antiinflamasi nonsteroid (NSAIDs). Akan tetapi, seringkali dinyatakan bahwa parasetamol bekerja secara khusus, terpusat, dan terbaik sebagai inhibitor lemah sintesis prostaglandin (PG) oleh enzim siklooksigenase (COX)-1 dan COX-2. Menurut Hinz et al. (2008), penggunaan parasetamol dalam dosis standar menyebabkan inhibisi hampir secara menyeluruh 1 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI terhadap COX-2 manusia, sementara itu hanya ditemukan inhibisi tingkat moderat terhadap COX-1. Penghambatan COX-1 oleh parasetamol nampak pada lemahnya aktivitas antiplatelet serta keamanan bagi gastrointestinal yang baik. Dalam penelitian yang dilakukan Hinz et al. (2008), fungsi platelet terhambat dengan pemberian dosis tinggi parasetamol secara parenteral; pola yang serupa terjadi pada pengaruhnya terhadap gastrointestinal. Dosis parasetamol yang lebih tinggi menimbulkan peningkatan kemungkinan terjadinya gangguan gastrointestinal, seperti dispepsia, dibandingkan dengan dalam dosis rendah. Suatu studi epidemiologi menyatakan bahwa parasetamol yang diberikan dengan dosis harian 2 hingga 2,6 gram mampu meningkatkan risiko efek samping yang severe/berat pada gastrointestinal, termasuk pendarahan atau perforasi. Meskipun parasetamol masih diakui sebagai obat yang bebas dari toksisitas gastrointestinal, sebaiknya tetap dilakukan uji coba terhadap pasien yang menerima pengobatan dengan parasetamol dalam jangka panjang. Senyawa 4-asetamidofenil benzoat adalah suatu senyawa turunan paminofenol yang diduga mempunyai aksi analgetika dan anti-inflamasi. Berdasarkan pada penelitian Pudjono et al., 2011, pemodelan molekul 4asetamidofenil benzoat berpotensi sebagai analgesik anti-inflamasi dan merupakan salah satu senyawa yang disarankan untuk disintesis. Perhitungan statistik menggunakan persamaan QSAR, dengan deskriptor-deskriptor yang telah ditentukan, di mana angka-angka yang ditunjukkan dalam deskriptor tersebut merupakan angka yang potensial. Untuk senyawa 4-asetamidofenil benzoat yang 2 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI disebut sebagai senyawa nomer 10 dalam jurnal tersebut, deskriptor-deskriptor yang diperhitungkan adalah: muatan substituen R No. 3 (qR3)= 0,035078 Coulomb; momen dwi kutub (µ)= 4,243 Debye; koefisien partisi n-oktanol–air (Log P)= 2,08; bobot molekul (BM)= 255,273 a.m.u; luas permukaan van der Waals (Avdw)= 274,765 Å2. Senyawa 4-asetamidofenil benzoat merupakan senyawa golongan ester, yang ditandai dengan adanya karbonil yang mengikat gugus –OR. Reaksi yang secara umum digunakan sebagai dasar sintesis senyawa ester dari benzoil klorida adalah reaksi substitusi nukleofilik asil, yaitu dengan mereaksikan benzoil klorida dengan alkohol dalam suasana basa. Jika nukleofil mengikat karbonil, maka klor dan gugus alkoksi berfungsi sebagai gugus pergi (leaving group). Pengikatan klor pada karbonil akan tergantikan oleh nukleofil, yang memicu terjadinya reaksi substitusi; sehingga pelepasan gugus pergi klorida memudahkan pembentukan ikatan π baru (Sastrohamidjojo, 2009). 1. Rumusan masalah Apakah 4-asetamidofenil benzoat dapat disintesis dari N-asetil-paminofenol dan benzoil klorida? 2. Keaslian penelitian Penelitian mengenai sintesis senyawa berdasarkan reaksi substitusi nukleofilik asil telah dilakukan oleh Ramdani (2011), dalam sintesis benzoil eugenol dari eugenol dan benzoil klorida. Ratnawati (2007) telah menggunakan reaksi esterifikasi dalam penelitian tentang sintesis turunan benzofenon. Sejauh penelusuran penulis, penelitian tentang sintesis 4-asetamidofenil benzoat dari N- 3 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI asetil-p-aminofenol dan benzoil klorida berdasarkan reaksi substitusi nukleofilik asil belum pernah dilakukan. 3. Manfaat penelitian a. Manfaat teoretis. Penelitian ini diharapkan mampu memperkaya pengetahuan khususnya di bidang sintesis organik senyawa 4-asetamidofenil benzoat dari N-asetil-p-aminofenol dan benzoil klorida berdasarkan reaksi substitusi nukleofilik asil. b. Manfaat metodologis. Penelitian ini diharapkan dapat memberikan manfaat dalam pengembangan metode sintesis senyawa 4-asetamidofenil benzoat turunan p-aminofenol melalui reaksi substitusi nukleofilik asil. c. Manfaat praktis. Penelitian ini diharapkan dapat menghasilkan senyawa 4asetamidofenil benzoat yang berpotensi dalam penelitian aktivitas farmakologis sebagai analgesik anti-inflamasi yang lebih poten daripada senyawa turunan p-aminofenol yang telah tersedia di pasaran. B. Tujuan Penelitian Penelitian ini bertujuan untuk: Melakukan sintesis 4-asetamidofenil benzoat dari N-asetil-p-aminofenol dan benzoil klorida berdasarkan reaksi substitusi nukleofilik asil. 4 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI BAB II TINJAUAN PUSTAKA A. Parasetamol Parasetamol atau dikenal dengan N-asetil-p-aminofenol merupakan suatu serbuk granular putih yang mudah mengalir serta tidak berbau dan berasa pahit. Mempunyai bobot molekul 151,16 g/mol, serta titik lebur 169-172oC. kelarutaannya adalah larut dalam 70 bagian air, 7 bagian etanol p (95%), 13 bagian aseton p, dalam 40 bagian gliserol p dan dalam 9 bagian propilenglikol p; serta larut dalam larutan alkali hidroksida (Dirjen POM, 1979). H N CH3 O HO Gambar 1. Struktur Parasetamol Parasetamol merupakan salah satu pilihan umum yang digunakan secara luas dalam penanganan nyeri serta demam. Akan tetapi, ditemukan bahwa efek analgesik parasetamol disebabkan karena adanya aktivasi secara tidak langsung dari reseptor kanabinoid CB1. Pada otak dan spinal cord, parasetamol, diikuti dengan deasetilasi menjadi amina primernya (p-aminofenol), terkonjugasi dengan asam arakhidonat untuk membentuk N-arakhi-donoilfenolamin, suatu senyawa yang telah diketahui sebagai kanabinoid endogen. Enzim yang terlibat di dalamnya adalah amida asam lemak hidrolase. N-arakhi-donoilfenolamin merupakan agonis pada reseptor reseptor vaniloid subtipe 1 (TRPV1) dan inhibitor uptake/penyerapan anandamida seluler, yang mengakibatkan terjadinya 5 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI peningkatan jumlah kanabinoid endogen; terlebih lagi, menghambat siklooksigenase dalam otak, akan tetapi dalam konsentrasi yang tidak sebesar dosis analgesik yang diperlukan dalam penggunaan parasetamol (Bertolini et al., 2006). Profil farmakologi parasetamol sangat mirip dengan inhibitor selektif COX-2 (coxibs). Sebagai coxib, parasetamol diberikan secara per-oral dalam dosis tunggal yang disarankan sehingga tidak menimbulkan efek toksik dalam jalur gastrointestinal, tidak menghalangi fungsi platelet, dan memiliki kemungkinan kecil menyebabkan terjadinya bronkokonstriksi dalam asma aspirinsensitif (Hinz et al., 2008). B. Benzoil Klorida Merupakan suatu cairan transparan atau tidak berwarna yang mudah terbakar, memiliki bau menusuk, serta uap yang juga iritatif terhadap mukosa. Benzoil klorida memiliki bobot molekul sebesar 140,57 g/mol serta titik didih 197,2oC. Senyawa ini mengandung tidak kurang dari 97% C7H5ClO. Kelarutannya praktis tidak larut dalam air, namun larut dalam kebanyakan pelarut organik; selain itu larut secara perlahan dan hampir sempurna dalam larutan NaOH p (Dirjen POM, 1979). O Cl Gambar 2. Struktur benzoil klorida 6 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Benzoil klorida termasuk ke dalam derivat asam karboksilat, berupa suatu asam halida atau asil halida, yang merupakan derivat teraktivasi dalam sintesis senyawa asil lainnya seperti ester, amida, serta asilbenzena. Adapun asil klorida didapatkan melalui reaksi antara asam karboksilat dengan tionil klorida (SOCl2) atau oksalil klorida [(COCl)2], karena menghasilkan by-products berupa gas yang tidak mengkontaminasi produk sintesis (Wade, 2013). Ion-ion halida merupakan gugus pergi yang sangat baik untuk reaksi substitusi nukleofilik asil; karena itulah asil halida merupakan intermediet yang berguna dalam membuat derivat asam. Asil klorida dibuat dengan mudah dan banyak digunakan sebagai bentuk aktif suatu asam karboksilat. Oksigen karbonil dan atom klorin sama-sama menarik densitas elektron dari atom karbon asil, membuatnya menjadi elektrofil yang kuat (Wade, 2013). Asam klorida bereaksi dengan alkohol untuk menghasilkan suatu ester melalui substitusi nukleofilik asil dengan mekanisme adisi-eliminasi. Penyerangan gugus karbonil yang elektrofilik oleh alkohol memberikan intermediet tatrahedral, kemudian hilangnya klorida dan terjadinya deprotonasi memberikan produk ester. Reaksi tersebut merupakan reaksi yang efisien untuk menghasilkan ester dari asam karboksilat. Piridina atau basa lainnya seringkali ditambahkan untuk menetralkan HCl yang terbentuk, karena apabila dibiarkan, alkohol—terutama alkohol tersier—dapat terdehidrasi di bawa kondisi asam kuat (Wade, 2013). 7 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Gambar 3. Mekanisme reaksi antara asam klorida dengan alkohol (Wade, 2013) Benzoil klorida yang termasuk asam klorida merupakan derivat asam karboksilat yang paling reaktif dibandingkan dengan derivat-derivat yang lainnya (asam klorida > anhidrida > ester > amida > karboksilat), berbanding terbalik terhadap kebasaan gugus perginya (Cl < OCOR < OR < NH2 < O). Basa-basa kuat bukanlah gugus pergi yang baik, dan reaktivitas derivatnya menurun seiring dengan peningkatan kebasaan gugus perginya (Wade, 2013). Reaktivitas derivat asam karboksilat juga dipengaruhi oleh stabilisasi resonansinya. Resonansi yang terjadi pada asam klorida sangat kecil, sehingga membuatnya lebih reaktif dibandingkan dengan anhidrida, ester dan amida. Pasalnya pada anhidrida, stabilisasi terjadi antara dua gugus karbonil, sehingga masing-masing gugus karbonil terstabilkan lebih rendah daripada karbonil pada ester. Sementara itu suatu senyawa ester beresonansi dengan lemah namun terjadi hanya pada satu gugus karbonil. Resonansi yang cukup kuat dibandingkan dengan derivat-derivat yang disebutkan sebelumnya terjadi pada amida. Meskipun demikian, pada derivat-derivat tersebut resonansi akan terhenti ketika terjadi penyerangan atom C karbonil oleh nukleofil. Sehingga, asam klorida yang kurang stabil di antara yang lainnya merupakan senyawa paling reaktif dan mudah mengadakan reaksi dengan nukleofil (Wade, 2013). Asil klorida merupakan agen asilasi yang sangat reaktif dan bereaksi dengan sangat cepat dengan amina. Prosedur preparatif untuk alkohol seringkali 8 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI menggunakan piridin sebagai katalis. Katalisis piridin melibatkan pembentukan ion asilpiridinium, yang kemudian bereaksi dengan alkohol. Piridin merupakan nukleofil yang lebih baik daripada alkohol netral, tetapi ion asilpiridinium bereaksi lebih cepat dengan alkohol daripada dengan asil klorida. Efek katalisis lebih kuat dihasilkan ketika 4-dimetilaminopiridin (DMAP) digunakan sebagai katalis nukleofilik. Gugus dimetilamino berlaku sebagai substituen donor elektron, meningkatkan nukleofilisitas dan kebasaan nitrogen piridin (Carey and Richard, 2001). C. Piridina Piridina (C5H5N) merupakan suatu cairan jernih tidak berwarna, memiliki bau tidak sedap yang khas, serta higroskopis. Kelarutannya dapat campur dengan air, etanol (95%) p, serta dengan kloroform p. Memiliki jarak didih tidak kurang dari 95% tersuling pada suhu 114o dan 117oC, bobot per mL sebesar 0,981 g hingga 0,983 g (Dirjen POM, 1979). N Gambar 4. Struktur piridina Senyawa piridina merupakan suatu senyawa nukleofilik pada atom nitrogennya, dikarenakan pasangan elektron bebas pada atom tersebut tidak dapat terdelokalisasi di sekitar cincinnya. Pasangan elektron bebas itu terdapat pada orbital ortogonal sp2 terhadap orbital p dalam cincin senyawa yang mengakibatkan tidak adanya interaksi antara orbital-orbital ortogonal. Orbital p 9 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI dalam sistem aromatis piridina sebenarnya serupa dengan benzena, akan tetapi peningkatan elektronegativitas atom nitrogen berperan dalam menurunkan energi seluruh orbital. Orbital-orbital berenergi rendah berarti nukleofil tersebut kurang reaktif, namun LUMO (lowest unoccupied molecular orbital/orbital molekul kosong berenergi rendah) dengan energi lebih rendah berarti elektrofil yang lebih reaktif. Maka dari itu, senyawa piridina kurang reaktif daripada benzena dalam reaksi substitusi elektrofilik aromatik, tetapi sebaliknya dalam reaksi substitusi nukleofilik lebih mudah bagi piridina dibandingkan dengan benzena (Szolcsànyi, 2016). D. Reaksi Substitusi Nukleofilik Asil Substitusi nukleofilik asil disebut juga reaksi transfer asil dikarenakan reaksi tersebut melepaskan gugus asil dari gugus perginya menuju nukleofil yang menyerang. Mekanisme reaksi substitusi nukleofilik asil bermula dari adisi nukleofil pada atom C gugus karbonil (C=O) yang mendorong terbentuknya intermediet tetrahedral. Kemudian terjadi stabilisasi pasangan elektron bebas pada atom oksigen kembali membentuk ikatan ganda karbonil dan melepaskan gugus pergi sehingga terbentuklah produk dan satu atom gugus pergi (Wade, 2013). Adisi nukleofil pada ikatan C=O polar merupakan kunci dari reaksi gugus karbonil. Saat suatu nukleofil ditambahkan ke dalam suatu derivat asam karboksilat, akan mengalami pembentukan intermediet tetrahedral; karenanya terjadi eliminasi satu dari dua substituen yang pada mulanya terikat pada karbon karbonil, yang merujuk pada terjadinya reaksi substitusi nukleofilik asil (SNA). 10 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Asam klorida atau halida dapat bereaksi secara cepat pada suhu ruangan dengan senyawa alkohol baik primer, sekunder, maupun tersier; dan juga dengan fenol. Produk yang dihasilkan berupa ester, suatu derivat asam karboksilat, di mana gugus hidroksi (–OH) pada asam karboksilat telah digantikan oleh –OR atau –OAr (Johnson, 1999). Konversi asil halida menjadi ester disebut juga dengan istilah alkoholisis yang berlangsung dengan adanya piridina tau NaOH untuk bereaksi dengan asam klorida (HCl) yang terbentuk dari reaksi tersebut. Perlu diperhatikan bahwa asam klorida selain bereaksi cepat dengan alkohol juga merupakan reaksi yang eksotermis sehingga perlu dipastikan bahwa reaksi berlangsung dalam suhu rendah untuk menghindari dehidrasi alkohol, dikarenakan asam klorida merupakan agen dehidrasi yang kuat. Maka dari itu piridin (atau basa lainnya) seringkali ditambahkan dalam reaksi untuk menetralisasi hasil reaksi samping (by-product) berupa HCl (Wade, 2013). Suatu kelebihan dari reaksi ini adalah pembentukan ester dari alkohol enansiomer di mana gugus –OH berada pada bagian tengah molekul tidak menimbulkan rasemisasi dikarenakan berdasarkan mekanisme reaksinya, ikatan antara karbon dan oksigen tidak pernah terputus selama reaksi berlangsung: Gambar 5. Reaksi substitusi nukleofilik asil (Johnson, 1999) 11 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI E. Rekristalisasi Presipitasi yang diatur sedemikian rupa dengan cara memanipulasi kelarutan menjadi teknik yang sering dilakukan dalam pemurnian produk hasil reaksi dalam sintesis kimia. Reaksi samping yang tidak diharapkan dapat menghasilkan sejumlah pengotor dalam produk; pengotor yang lainnya didapatkan dari starting material atau senyawa lain yang digunakan misalnya sebagai katalis reaksi. Rekristalisasi yang merupakan salah satu metode paling ampuh dalam pemurnian senyawa, menerapkan teknik seperti yang telah disebutkan, yakni bergantung pada perbedaan kelarutan antara senyawa tujuan dengan pengotorpengotor lainnya. Produk hasil sintesis tadi dilarutkan dan diendapkan/ dipresipitasi, bila diperlukan berulang kali, dengan memperhatikan faktor-faktor yang mempengaruhi kelarutannya, serta dilakukan kontrol terhadap faktor-faktor tersebut. Namun bagaimanapun juga, dalam melakukan manipulasi terhadap kelarutan diperlukan pemahaman terhadap kesetimbangan yang terdapat antara senyawa yang tidak larut dengan larutannya (Oxtoby et al., 2008). F. Uji Kelarutan Gaya inter-molekuler berperan dalam menentukan sifat kelarutan senyawa organik, atau disebut dengan istilah like dissolves like. Senyawa-senyawa polar akan larut dalam solven polar, sebaliknya senyawa-senyawa non-polar akan larut dalam solven non-polar. Adapun terdapat empat (4) hubungan kepolaran antara solut dengan solven: 12 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 1. Solut polar dalam solven polar, Kelarutan NaCl dalam air contohnya, memerlukan energi yang besar untuk memisahkan ion-ion berlawanan muatan dalam NaCl. Solven polar seperti air mampu mensolvatasinya, maka dengan solven air peristiwa ini disebut hidrasi. Larutnya garam terjadi karena molekul-molekul air menyelubungi masing-masing ion dengan ujung momen dipol yang sesuai bagi masingmasing muatannya. Atom oksigen dalam molekul air akan menyelubungi ion natrium yang bermuatan positif, sementara atom hidrogennya menyelubungi ion klorida yang bermuatan negatif. 2. Solut polar dengan solven non-polar, Solut NaCl dalam solven non-polar seperti terpentin atau gasoline tidak menyebabkan larutnya NaCl. Molekul non-polar solven tidak mensolvatasi ion-ion secara kuat, dan tidak mampu mengatasi energi lattice dari kristal garam. Ini merupakan peristiwa di mana interaksi ionion dalam solut lebih besar daripada interaksinya dengan solven. 3. Solut non-polar dengan solven non-polar, Parafin larut dalam gasoline, keduanya merupakan campuran hidrokarbon non-polar. Molekul-molekul parafin sebagai senyawa non-polar menarik satu sama lain secara lemah, dan interaksi van der Waals tersebut sangat mudah diputuskan dengan interaksi van der Waals solven. 4. Solut non-polar dengan solven polar, Parafin tidak larut dalam solven air yang polar, dikarenakan molekulmolekul non-polar hanya berinteraksi lemah terhadap satu sama lain, dan 13 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI hanya memerlukan sedikit energi untuk memisahkannya. Permasalahannya adalah molekul air berinteraksi dengan kuat satu sama lain karena adanya interaksi hidrogen. Saat solut parafin dilarutkan dalam air, molekul-molekul air di sekitarnya akan membentuk rongga. Molekulmolekul air pada tepi rongga memiliki lebih sedikit atom untuk mengalami interaksi hidrogen, sehingga menghasilkan struktur yang lebih mampat dan kaku di sekitar rongga tersebut. Struktur seperti ini menghasilkan penurunan entropi sistem: ∆𝐺 = ∆𝐻 − 𝑇∆𝑆, dan ∆𝐻 seringkali bernilai kecil. Karenanya nilai negatif ∆𝑆 membuat ∆𝐺 positif (tidak diinginkan), sehingga senyawa non-polar tidak dapat larut (Wade, 2013). Suatu senyawa organik yang belum diketahui dapat ditentukan strukturnya melalui pengujian kelarutan dalam air, larutan NaOH 5%, larutan NaHCO3 5%, larutan HCl 5%, dan H2SO4 pekat. Keberadaan gugus fungsional menjadi hal pertama yang diuji, misalnya senyawa hidrokarbon tidak larut dalam air, sehingga bila sampel senyawa sebagian larut dalam air, menunjukkan bahwa terdapat gugus fungsi bersifat polar dalam senyawa tersebut. Kedua, kelarutan dalam solven tertentu seringkali memberikan informasi spesifik mengenai gugus fungsi, misalnya asam benzoat yang tidak larut dalam solven polar (air), tetapi diubah oleh larutan NaOH 5% ke dalam bentuk garam dan dapat larut dalam air; sehingga dapat disimpulkan bahwa adanya indikasi keberadaan gugus fungsi bersifat asam. Dugaan tentang ukuran molekul dan komposisinya terkadang dilakukan setelah pengujian awal, contohnya dalam beberapa seri homolog dari senyawa monofungsi, senyawa dengan jumlah kurang dari lima atom karbon akan 14 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI larut air, sementara lebih dari itu berarti tidak larut air. Dalam hal kelarutannya dalam air, suatu senyawa dikatakan larut dalam air apabila memenuhi 3,3 g/100 mL solven (AJM, 2010). G. Uji Titik Lebur Suhu di mana terjadi peleburan suatu zat padat menjadi zat cair disebut dengan titik lebur. Karena perubahan wujud zat tersebut memerlukan pemutusan gaya inter-molekuler yang mengikat zat padat, maka suhu peleburan menjadi bergantung pada struktur molekul bersangkutan; hal ini merupakan hubungan nyata antara struktur dengan sifat senyawa. Maka dari itu, senyawa satu memiliki titik lebur yang berbeda dengan senyawa lainnya (Calgary, 2010). Suatu senyawa organik kristalin, non-ionik, dan murni, biasanya mempunyai titik lebur tertentu yang tajam (pada umumnya antara 0,5-1,0o C). Adanya campuran senyawa pengotor dapat menyebabkan penurunan titik lebur serta peningkatan rentang titik leburnya. Akibatnya, titik lebur suatu senyawa menjadi kriteria kemurnian selain digunakan dalam identifikasi (Calgalry, 2010). Observasi visual dilakukan dalam uji titik lebur karena dalam prosesnya akan nampak perubahan fisik serbuk sampel dalam pipa kapiler, baik secara fisika maupun kimiawi. Terdapat beberapa hal yang sebaiknya diperhatikan dalam pengujian ini: 1. Tanda-tanda perubahan sampel, meliputi: dehidrasi, perubahan fase kristalisasi, permulaan dekomposisi atau perubahan warna (misalnya menghitam), kondensasi solven pada bagian dengan suhu rendah dalam pipa 15 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI kapiler, serta dimulainya peleburan kristal tanpa diikuti kemunculan fase cair dalam fase kohesif (sintering point). 2. Onset point, atau permulaan peleburan, di mana fase cair mulai nampak dengan jelas sebagai fase yang terpisah dari kristal; berbeda dengan sintering point yang hanya merupakan beberapa titik pada permukaan kristal yang mulai melebur. 3. Meniscus point, yakni nampaknya meniskus fase cair dalam proses peleburan; terdapat fase padat pada dasarnya serta fase cair yang nampak jelas dengan meniskusnya. 4. Clear/liquefaction point, tahap saat fase dalam pipa kapiler telah seluruhnya berubah menjadi fase cair tanpa keberadaan fase padat sama sekali, atau kristal terakhir yang melebur. 5. Tanda-tanda akhir peleburan yang meliputi: sublimasi (munculnya kristal pada dasar pipa kapiler) serta dekomposisi (munculnya gelembung atau perubahan warna selama dan setelah peleburan) (Stanford, 2010). Titik lebur suatu padatan merupakan temperatur saat cairan dan padatan berada pada titik ekuilibrium pada tekanan 1 atmosfer. Berlawanan dengan terjadinya perubahan volume karena adanya penguapan cairan, perubahan volume saat peleburan padatan sangatlah kecil. Hal ini membuat titik lebur padatan tidak bergantung pada perubahan tekanan biasa (WISC, 2013). 16 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI H. Identifikasi dan Uji Kemurnian dengan Kromatografi Lapis Lipis (KLT) Kromatografi Lapis Tipis (KLT) merupakan cara pemisahan berdasarkan pembagian 2 senyawa dalam fase diam yang berupa bidang datar. Campuran yang akan dipisah berupa larutan, ditotolkan dalam bentuk pita atau bercak. Setelah plat ditaruh dalam bejana tertutup rapat yang berisi larutan pengembang yang cocok (fase gerak), pemisahan terjadi selama perambatan kapiler (Stahl, 1985). Plat atau fase diam yang digunakan dalam KLT merupakan penjerap berukuran kecil dengan diameter partikel antara 10-30 𝜇m. Semakin kecil ukuran rata-rata partikel dan semakin sempit kisaran ukurannya, maka kinerja KLT dalam hal efisiensi serta resolusinya semakin meningkat. Penjerap yang paling sering digunakan berupa silika dan serbuk selulosa; sementara mekanisme sorpsi yang utama pada KLT adalah partisi dan adsorbsi. Terdapat fase diam berupa Silika Gel 60 F254 yang berarti fase diam tersebut berupa silika gel (dari E. Merck) yang mempunyai ukuran pori 60 A0 (10 A0 = 1 nm), dengan adanya penambahan bahan yang berfluoresensi seperti seng silikat teraktivasi mangan yang akan mengalami eksitasi dan berfosforesensi pada panjang gelombang 254 nm. Dengan demikian berarti terdapat pula fase diam dengan beberapa ukuran pori lain, bahan penambah lain, maupun panjang gelombang eksitasi dengan nilai berbeda; pemilihannya tergantung pada kebutuhan analisis senyawa yang bersangkutan (Gandjar dan Abdul, 2007). Fase gerak yang bergerak di sepanjang plat fase diam untuk membawa sampel yang telah ditotolkan dan terjerembab dalam fase diam tersebut merambat akibat adanya pengaruh kapiler dalam pengembangan ke atas (ascending), serta 17 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI akibat adanya gaya gravitasi dalam pengembangan menurun (descending). Pemilihan fase gerak KLT dapat dilakukan melalui studi pustaka untuk menentukan kombinasi yang umum digunakan untuk suatu senyawa tertentu. Atau dapat juga dengan tabel yang menunjukkan misibilitas atau mampu tidaknya lebih dari satu macam fase gerak untuk saling campur, dengan dilengkapi angka polaritas dari literatur. Hal ini dapat dilakukan ketika telah diketahui nilai polaritas fase gerak yang dibutuhkan. Hal ini dilakukan tidak lain agar pemisahan dapat terjadi secara optimal (Gandjar dan Abdul, 2007). Penentuan nilai polaritas serta perbandingan campuran lebih dari satu fase gerak dapat dilakukan melalui kalkulasi sebagai berikut: 𝑝! = ! 𝑝! ′𝜙! ′ dengan , 𝑝! ′ = indeks polaritas solven i 𝜙! ′ = fraksi volume solven i (Cazes, 2005). Adapun pemilihan dan optimalisasi fase gerak menurut (Gandjar dan Abdul, 2007) dapat dilakukan melalui petunjuk-petunjuk berikut ini: 1. Fase gerak harus mempunyai kemurnian sangat tinggi karena KLT merupakan teknik yang sensitif. 2. Daya elusi fase gerak harus diatur sehingga nilai Rf terletak antara 0,2-0,8 dengan tujuan memaksimalkan pemisahan. 3. Untuk pemisahan menggunakan fase diam polar seperti silika gel, polaritas fase gerak akan menentukan kecepatan migrasi solut yang berarti juga menentukan nilai Rf. Penambahan pelarut yang bersifat sedikit polar seperti 18 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI dietil eter ke dalam pelarut non polar seperti metil benzena akan meningkatkan harga Rf secara signifikan. 4. Analisis solut-solut ionik dan solut-solut polar lebih baik menggunakan campuran pelarut sebagai fase geraknya, seperti campuran air dan metanol dengan perbandingan tertentu. Penambahan sedikit asam etanoat atau amonia masing-masing akan meningkatkan solut-solut bersifat basa dan asam. Pengamatan bercak pemisahan dalam KLT seringkali dilakukan melalui cara khusus secara kimia, fisika, maupun biologi, dikarenakan sebagian besar bercak merupakan bercak tidak berwarna. Cara kimia dilakukan dengan cara penyemprotan bercak menggunakan pereaksi kimia, sementara itu cara fisika dilakukan dengan pencacahan radioaktif dan fluoresensi sinar ultraviolet. Pengamatan plat di bawah lampu ultraviolet dengan emisi panjang gelombang 254 atau 366 untuk menampakkan solut sebagai bercak gelap atau bercak yang berfluoresensi terang pada dasar yang berfluoresensi seragam (Gandjar dan Abdul, 2007). Jarak pengembangan senyawa pada kromatogram biasanya dinyatakan dengan angka Rf atau hRf. Harga Rf didefinisikan sebagai perbandingan antara jarak senyawa dari titik awal dan jarak tepi muka pelarut dari awal (Stahl, 1985). I. Spektrofotometri Inframerah/Infrared (IR) Radiasi inframerah yang berkisar antara 10.000-100 cm-1 diabsorbsi untuk kemudian dikonversikan oleh suatu senyawa organik menjadi energi vibrasi molekuler. Nilai absorbsi dapat dikuantifikasi melalui pita-pita spektra yang 19 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI muncul akibat dari energi vibrasi dari suatu senyawa organik selalu diiringi dengan beberapa perubahan energi rotasi. Adapun besarnya frekuensi atau panjang gelombang absorbsi bergantung pada massa relatif atom, gaya konstan ikatan, serta struktur atom yang terlibat atau menyusun suatu senyawa (Silverstein, 2005). Vibrasi molekuler terdiri dari dua macam, yakni stretching dan bending. Vibrasi stretching/ulur merupakan pergerakan ritmis dalam sepanjang ikatan aksis yang menyebabkan perubahan jarak/panjang antar-atom. Vibrasi bending/tekuk adalah perubahan pada besar sudut ikatan, antara ikatan-ikatan dengan atom yang umum atau pergerakan dari sekumpulan atom terhadap sisa suatu molekul tanpa gerakan atom dalam grup antara satu sama lain; misalnya twisting, rocking, serta vibrasi torsional. Meskipun demikian, hanya vibrasi yang menghasilkan perubahan pada momen dipol molekul saja yang dapat terbaca dalam inframerah (Silverstein, 2005). Sebuah molekul organik memiliki lebih dari satu derajat kebebasan sebagai hasil dari derajat kebebasan masing-masing atom yang menyusunnya. Setiap atom memiliki tiga derajat kebebasan berdasarkan pada koordinat Cartesian (x, y, z), yakni menentukan posisinya secara relatif terhadap atom-atom lain dalam molekul tersebut. Sebuah molekul suatu atom berjumlah n memiliki 3n derajat kebebasan, namun aturan tersebut berlaku berbeda pada molekul nonlinear dan linear: 20 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI a. Molekul non-linear, tiga buah derajat kebebasan menunjukkan rotasi dan tiga yang lainnya menunjukkan translasi, sehingga 3n-6 derajat kebebasan merupakan derajat kebebasan vibrasi/vibrasi fundamental. b. Molekul linear, Memiliki 3n-5 derajat kebebasan vibrasi, dengan hanya dua derajat kebebasan yang diperlukan untuk menyatakan terjadinya rotasi (Silverstein, 2005). Vibrasi fundamental tidak melibatkan perubahan pada pusat gravitasi molekul. Untuk membedakan keduanya, dapat dibandingkan antara vibrasi fundamental dari molekul air serta molekul karbon dioksida. Molekul air memiliki tiga vibrasi dasar, yaitu vibrasi ulur simetris (vs OH, 3652 cm-1), vibrasi ulur asimetris (vas OH, 3756 cm-1), dan scissoring (𝛿! OH, 1596 cm-1). Molekul CO2 adalah molekul linear dan terdiri dari tiga buah atom, sehingga membuat molekul ini memiliki empat vibrasi dasar. Vibrasi ulur simetris bersifat inaktif pada IR dikarenakan tidak menghasilkan perubahan apapun terhadap momen dipol molekulnya. Kedua macam vibrasi tekuk pada molekul CO2 adalah setara, serta merupakan komponen-komponen yang dipisahkan antara gerakan tekuk yang berpusat pada sudut manapun terhadap aksis antar-inti; memiliki frekuensi yang sama, atau ganda. Sementara itu untuk gugus-gugus AX2 yang menjadi suatu bagian dari molekul seperti gugus CH2 suatu molekul hidrokarbon tidak dapat diberlakukan aturan 3n-6. Hal tersebut dikarenakan gugus CH2 hanya sebagai satu bagian dari molekul yang lebih besar (Silverstein, 2005). 21 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI J. Kromatografi Gas Kromatografi gas merupakan teknik pemisahan solut-solut volatil yang stabil terhadap suhu tinggi, bermigrasi melalui kolom yang mengandung fase diam dengan kecepatan yang bergantung pada rasio distribusinya. Solut akan terelusi berdasarkan peningkatan titik didihnya dikurangi dengan semua interaksi yang mungkin terjadi antara solut dengan fase diamnya. Fase gerak berupa gas akan mengelusi solut dari ujung kolom lalu menghantarkannya ke detektor. Peningkatan suhu yang dilakukan dilakukan untuk dapat menguapkan solut sehingga mampu cepat terelusi (Gandjar dan Abdul, 2009). Jenis-jenis kromatografi gas: 1. Kromatografi gas cair Digunakan fase diam berupa cairan yang dijerap dalam suatu pendukung sehingga solut dapat terlarut; mekanisme sorpsinya berupa partisi. 2. Kromatografi gas padat Digunakan fase diam berupa padatan (misalnya polimerik); mekanisme sorpsinya berupa adsorpsi (Gandjar dan Abdul, 2009). Sistem peralatan kromatografi gas: 1. Fase gerak Suatu zat cair (liquid chromatography, LC) ataupun gas (gas chromatography, GC) yang mengalami perkolasi melalui fase diam menuju ke arah tertentu. Dalam kromatografi gas, yang disebut dengan karier gas digunakan untuk fase gerak, sementara itu dalam kromatografi elusi/cair disebut dengan eluent. 22 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 2. Ruang suntik sampel Tempat di mana sampel mengalami volatilisasi sehingga menyebabkan gas masuk ke aliran zat pembawa dalam kolom kromatografi gas. Beberapa tipe inlet yang ada misalnya split/splitless, Programmed Thermal Vaporizing (PTV), serta cool-on-column (COC). 3. Kolom Dalam kromatografi gas, retensi molekul-molekul analit timbul karena terjadinya interaksi yang lebih kuat dengan fase diam daripada fase geraknya; karenanya interaksi analit dengan fase diam menjadi hal yang penting. Interaksi yang terjadi dapat berupa interaksi dispersi, dipol, maupun interaksi hidrogen (Crawford Scientific, 2016). Gambar 6. Interaksi dipol-dipol dan dipol-terinduksi dipol (Crawford Scientific, 2016) 4. Detektor dan macamnya (TCD, FID, ECD, NPD, fotometri nyala, konduktivitas elektrolitik, foto-ionisasi, MS) 23 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI a. Thermal Conductivity Detector (TCD) Konduktivitas termal mengukur kemampuan senyawa untuk memindahkan panas dari daerah panas menuju dingin. Dalam TCD, gas mengalir dari aliran kolom kromatografi melalui filamen tungsten-rhenium panas. Saat solut mengalir dari kolom, konduktivitas termal aliran gas menurun, filamennya memanas, resistensi elektriknya meningkat, dan tegangannya turun karena adanya perubahan filamen. Detektor merespon perubahan yang terjadi dalam konduktivitas termal, sehingga konduktivitas solut dan gas pembawa menjadi sangat berbeda. Adapun sensitivitas TCD berbanding tebalik (inversely proportional) terhadap kecepatan alirnya: lebih sensitif dalam kecepatan aliran lebih rendah. b. Flame Ionization Detector (FID) Dalam FID, eluat dibakar dalam campuran H2 dan udara. Atom karbon (kecuali karbon karbonil dan karboksil) memproduksi radikal CH, yang selanjutnya menghasilkan ion CHO+ dalam flame. CH + O à CHO+ + e-. Hanya sekitar 1 dalam 105 atom karbon diproduksi suatu ion, namun produksi ion sebanding terhadap jumlah atom karbon yang masuk ke dalam flame. FID relatif tidak sensitif terhadap O2, CO2, H2O, dan NH3. Batas deteksi FID 100 kali lebih kecil daripada TCD dan berkurang 50% saat tidak digunakan gas pembawa He, melainkan N2. Untuk open tubular columns, gas N2 ditambahkan dalam eluat H2 atau He sebelum masuk ke dalam detektor. 24 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI c. Detektor lainnya, antara lain: capture detector, flame photometric detector, alkali flame detector, sulfur chemiluminescence detector, atomic emission detector (Harris, 1982). 5. Komputer Sinyal yang dihasilkan dari detektor terdigitalisasi dan disimpan ke dalam penyimpanan yang memudahkan akses data, sehingga waktu retensi, area puncak, dan data lain yang dibutuhkan dapat dengan mudah didapatkan kembali. 6. Derivatisasi (esterifikasi, asilasi, alkilasi, sililasi, kondensasi, siklisasi) Derivatisasi dilakukan dengan tujuan sebagai berikut: a. Sifat fisik solut yang tidak mendukung dalam hal volatilitas serta stabilitasnya b. Meningkatkan batas deteksi dan bentuk kromatogram; dalam analisis belum tentu kromatogram yang dihasilkan sesuai dengan kriteria atau terkadang ditemui adanya tumpang tindih, atau tidak terdeteksinya sampel tujuan c. Meningkatkan volatilitas seperti senyawa-senyawa gula yang tidak mudah menguap; biasanya senyawa dengan bobot molekul yang rendah, disebabkan keberadaan gaya tarik inter-molekuler antara gugus-gugus polar yang dapat ditutup melalui derivatisasi sehingga meningkatkan volatilitas senyawa secara dramatis d. Meningkatkan deteksi, misalnya untuk kolesterol dan senyawa-senyawa steroid 25 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI e. Meningkatkan stabilitas; biasanya dialami oleh senyawa volatil yang mengalami dekomposisi parsial karena panas sehingga diperlukan derivatisasi f. Meningkatkan batas deteksi pada penggunaan electron capture detector (ECD) (Rohman, 2009). Penentu dasar retensi solut umumnya adalah volatilitasnya, namun tergantung pula pada fase diam yang digunakan. Fase diam yang sangat polar menahan solut-solut polar dengan kuat. Interaksi hidrogen pada fase diam mungkin merupakan gaya terkuat yang berperan dalam retensi; maka dari itu tiga alkohol adalah yang terakhir terelusi, dikuti dengan empat keton, dan empat alkena berdasarkan contoh kromatogram pada gambar 7. Interaksi dipol pada keton merupakan gaya terkuat kedua (Harris, 1982). Gambar 7. Pemisahan 10 senyawa dalam (a) dimetilsiloksan (non-polar) dan (b) etilen glikol (polar) (Harris, 1982) 26 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI K. Spektrometri Massa Spektrometri massa merupakan metode spektral yang berdasar bukan dari absorbsi energi oleh molekul senyawa organik, namun berdasarkan fragmentasi senyawa organik yang terjadi karena adanya tumbukan antara sebuah molekul organik dengan elektron berenergi tinggi. Tumbukan yang terjadi mengakibatkan sebuah elektron terlepas dari molekul sehingga terbentuk ion organik. Fragmenfragmen yang lebih kecil dari suatu molekul organik terbentuk akibat instabilitas ion organik yang dihasilkan dari pembombardiran elektron, yang kemudian ditemukan dalam bentuk radikal bebas maupun ion-ion lain. Spektrum massa merupakan alur kelimpahan (abundance) versus nisbah massa/muatan (m/e atau m/z) dari fragmen-fragmen itu. Muatan ion dari kebanyakan partikel yang dideteksi dalam suatu spektrometer massa adalah + 1; nilai m/e untuk suatu ion semacam itu sama dengan massanya. Oleh karena itu, spektrum massa merupakan suatu rekaman dari massa partikel versus kelimpahan relatif partikel tersebut (Fessenden dan Joan, 1986). Pada umumnya, analisis menggunakan spektrometer massa dipadukan dengan instrumen kromatografi seperti kromatografi gas (GC-MS) maupun kromatografi cair (LC-MS). Spektrometer massa berguna dalam analisis senyawa organik yang belum diketahui bentuk molekulnya berdasarkan analisis terhadap spektra massa yang nampak, sehingga dapat dikatakan merupakan suatu metode yang bersifat luas. Dalam analisis suatu senyawa organik yang telah diketahui atau ada sebelumnya, perangkat komputer menelusuri basis data untuk membandingkan analit dengan data spektra massa dari senyawa-senyawa yang 27 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI telah tersimpan dalam sistem sehingga dapat menjawab senyawa tersebut dengan detil. Sementara itu, dalam suatu analisis senyawa yang belum diketahui, ion molekuler, pola fragmentasi, serta pembuktian dari analisis spektrometri lainnya (seperti IR dan NMR) dapat membantu ditemukannya senyawa baru (Silverstein, 2005). Pola fragmentasi suatu molekul bergantung pada kerangka karbon dan gugus fungsional yang terikat pada molekul tersebut. Karenanya, struktur dan massa fragmen memberikan petunjuk mengenai struktur molekul induknya; serta seringkali untuk menentukan bobot molekul suatu senyawa dari spektrum massanya (Fessenden dan Joan, 1986). Suatu aturan dalam fragmentasi yang disebut dengan “aturan nitrogen” digunakan sebagai pertimbangan dalam menentukan pola fragmentasi. Suatu molekul dengan massa molekuler genap harus tidak mengandung nitrogen atau mengandung atom nitrogen dalam jumlah genap; sementara molekul dengan massa molekuler ganjil harus mengandung atom nitrogen dalam jumlah ganjil pula. Aturan ini berlaku untuk semua senyawa yang mengandung karbon, hidrogen, oksigen, nitrogen, sulfur, dan halogen, juga atom-atom yang tidak lazim seperti fosfor, boron, silikon, arsen dan alkali tanah. Menurut pembuktian, dinyatakan bahwa fragmentasi ikatan tunggal sebuah ion molekuler berjumlah genap memberikan fragmen ion ganjil; sebaliknya ion molekuler berjumlah ganjil memberikan fragmen ion dalam jumlah genap. Pernyataan tersebut berlaku dengan catatan bahwa fragmen ion harus mengandung seluruh nitrogen (apabila ada) dari ion molekuler tersebut (Sliverstein, 2005). 28 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Intensitas puncak ion molekuler bergantung pada stabilitas ion molekulernya. Ion molekuler yang paling stabil berasal dari sistem aromatis murni. Apabila substituen yang memiliki jalur pemutusan yang lebih mungkin terjadi, puncak ion molekuler akan tidak terlalu intens, sehingga puncak fragmennya menjadi lebih intens secara relatif. Pada umumnya, gugus-gugus senyawa berikut ini diurutkan berdasarkan penurunan kemampuannya, menghasilkan puncak molekuler yang utama: senyawa aromatis > alkena terkonjugasi > senyawa siklik > sulfida organik > alkana rantai pendek > merkaptan. Ion-ion molekuler yang terdeteksi berdasarkan penurunan kemampuan: keton > amina > ester > eter > asam karboksilat ~ aldehida ~ amida ~ halida. Ion molekuler seringkali tidak dapat dideteksi pada alkohol alifatik, nitrit, nitrat, senyawa nitro, nitril, dan senyawa-senyawa dengan jumlah percabangan yang banyak (Silverstein, 2005). Dalam menentukan puncak pola fragmentasi pada spektra EI, terdapat beberapa peraturan yang didasarkan pada konsep kimia organik fisik. Akan tetapi perlu dipahami terlebih dulu bahwa aturan fragmentasi ini berlaku bagi spektrometri massa EI. Hal ini dikarenakan teknik-teknik ionisasi (CI, dan lainnya) lainnya seringkali menghasilkan ion molekuler dengan energi lebih rendah atau ion kuasimolekuler dengan pola fragmentasi yang sangat berbeda, sehingga berlaku aturan yang berbeda. Berikut ini merupakan peraturan bagi spektra EI: 29 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 1. Tinggi relatif suatu puncak ion molekuler tertinggi pada senyawa dengan rantai lurus dan berkurang seiring dengan peningkatan jumlah percabangan (lihat aturan 3). 2. Tinggi relatif puncak ion molekuler biasanya berkurang dengan adanya peningkatan massa molekuler dalam deret homolog. Lemak ester menjadi suatu pengecualian. 3. Pemaksapisahan (cleavage) terjadi lebih pada atom karbon tersubstitusi alkil: semakin tersubstitusi, semakin besar kemungkinan terjadinya pemaksapisahan. Hal ini terjadi akibat peningkatan stabilitas karbokation tersier apabila dibandingkan dengan sekunder, yang lebih stabil daripada karbokation primer, yakni dengan urutan stabilitas sebagai berikut: CH3+ < R2CH2+ < R3CH+ < R3C+ Pada umumnya, substituen terbesar pada suatu cabang menjadi subtituen yang paling mudah dieliminasi dalam bentuk radikal, diduga karena radikal rantai panjang dapat mencapai stabilitas melalui delokalisasi elektron bebas. 4. Ikatan rangkap, struktur siklik, terlebih cincin aromatis (atau heteroatomik) menstabilkan ion molekuler sehingga meningkatkan kemungkinan kemunculannya. 5. Dalam ikatan rangkap, pemaksapisahan alilik lebih mungkin terjadi dan memberikan karbokation alilik terstabilisasi resonansi. Aturan ini tidak berlaku untuk alkena sederhana karena adanya migrasi ikatan rangkap, namun berlaku bagi sikloalkena. 30 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 6. Cincin jenuh lebih mudah untuk kehilangan rantai samping berupa alkil pada ikatan 𝛼. Hal ini hanya pada kasus khusus dari percabangan (aturan 3). Muatan positif cenderung berada pada fragmen cincinnya. 7. Dalam senyawa aromatis tersubstitusi alkil, pemaksapisahan sangat mungkin terjadi pada ikatan 𝛽 dalam cincin, sehingga membentuk ion benzyl yang terstabilisasi resonansi, atau seringkali ion tropilium. 8. Ikatan C—C yang terletak di sebelah heteroatom seringkali mengalami pemaksapisahan yang menghasilkan muatan pada fragmen yang mengandung heteroatom di mana elektron yang tidak berpasangan menyediakan stabilisasi resonansi. 9. Pemaksapisahan sering dihubungkan dengan eliminasi molekul-molekul yang kecil, stabil, netral, seperti karbon monoksida, olefin, air, amonia, hidrogen sulfida, hydrogen sianida, merkaptan, ketena, atau alkohol, yang seringkali muncul dengan mengalami penataan ulang (rearrangement) (Silverstein, 2005). L. Landasan Teori Pembentukan senyawa melalui reaksi substitusi nukleofilik asil terjadi antara senyawa alkohol dengan derivat asam karboksilat, yang umumnya menghasilkan sintesis suatu senyawa golongan ester. Reaksi substitusi nukleofilik asil diawali dengan terjadinya adisi nukleofil pada atom C gugus karbonil (C=O) yang memicu terjadi pembentukan intermediet tetrahedral yang mengikat dua substituen pada atom C yang mulanya berupa karbonil. Selanjutnya terjadi 31 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI stabilisasi pasangan elektron bebas pada atom oksigen yang menyebabkan terbentuknya ikatan ganda karbonil kembali dan berakibat pada pelepasan gugus pergi yakni ion klorida (Cl-), sehingga terbentuk produk dan sebuah atom gugus pergi. Benzoil klorida termasuk ke dalam derivat asam karboksilat yang teraktivasi dalam sintesis senyawa asil, senyawa tersebut merupakan agen asilasi yang sangat reaktif dalam reaksi. Reaktivitas benzoil klorida berbanding terbalik terhadap kebasaannya, maka gugus pergi Cl yang merupakan basa lemah menjadi gugus pergi yang lebih baik daripada gugus pergi lain yang lebih tinggi kebasaannya. Oksigen karbonil dan atom klorin sama-sama menarik densitas elektron dari atom karbon asil, sehingga menjadikannya elektrofil yang kuat. Sementara itu parasetamol yang berperan sebagai senyawa alkohol mampu bertindak sebagai nukleofil karena terdapat gugus hidroksi (-OH) yang mempunyai pasangan elektron bebas. Nukleofil tersebut akan menyerang gugus karbonil benzoil klorida menghasilkan senyawa 4-asetamidofenil benzoat dengan gugus pergi atom klorin (Cl-). Reaksi antara benzoil klorida dengan alkohol merupakan reaksi eksotermis sehingga perlu diperhatikan suhu reaksi untuk menghindari hidrolisis maupun penurunan stabilitas reaksi. Di samping itu, piridina (atau basa non-nukleofilik lainnya) ditambahkan ke dalam reaksi untuk menetralisasi dan mencegah pembentukan by-product terutama asam klorida (HCl). Persamaan reaksi yang terjadi ditunjukkan dalam gambar berikut: 32 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI O H N Cl H N CH3 Benzoil klorida O O O N HO CH3 O N-asetil-p-aminofenol 4-asetamidofenil benzoat piridina Gambar 8. Reaksi umum sintesis 4-asetamidofenil benzoat M. Hipotesis Senyawa 4-asetamidofenil benzoat yang merupakan senyawa ester dapat disintesis dari parasetamol dan benzoil klorida melalui reaksi substitusi nukleofilik asil. Adisi Nukleofilik O H N Cl CH3 + O O+ O Cl H H Benzoil klorida N-asetil-p-aminofenol Eliminasi Halida H N O– 33 CH3 O PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI BAB III METODE PENELITIAN A. Jenis Penelitian Penelitian ini termasuk jenis penelitian non-eksperimental deskriptif karena berupa pemaparan terhadap fenomena yang terjadi tanpa adanya perlakuan terhadap subjek uji maupun melibatkan hubungan sebab-akibat. B. Definisi Operasional Penelitian 1. Starting material (SM) merupakan senyawa yang digunakan dalam sintesis yang merupakan senyawa asal, dalam penelitian ini adalah parasetamol dan benzoil klorida. 2. Molekul target (MT) merupakan senyawa tujuan yang diharapkan terbentuk dalam penelitian, yakni 4-asetamidofenil benzoat. 3. Katalis merupakan senyawa yang digunakan dalam reaksi untuk meningkatkan laju reaksi kimia, yaitu piridin. 4. Rendemen merupakan jumlah molekul target yang terjadi dan dapat diperhitungkan dari jumlah starting material yang digunakan. Rendemen senyawa hasil sintesis yang diharapkan dalam penelitian ini adalah rendemen 4-asetamidofenil benzoat. 34 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI C. Bahan Penelitian Parasetamol (teknis, Brataco Chemika), benzoil klorida (p.a, Merck), piridina (p.a, Merck), etanol 96% (teknis, General Labora), etanol absolut (p.a, Merck), NaOH (Laboratorium Sanata Dharma), kloroform (p.a, Merck), etil asetat (teknis, Brataco Chemika; p.a, Merck), n-heksana (p.a, Merck), aseton (p.a, Merck), silika gel GF254 (Merck), akuades (General Labora), kertas saring, kertas timbang, dan es batu (Laboratorium Sanata Dharma). D. Alat Penelitian Gelas beker, labu erlenmeyer, pipet tetes, gelas ukur, kaca pengaduk, magnetic stirrer, mantle heater, labu hisap, corong Buchner, sendok spatel, pompa vakum, pH indikator (E. Merck), cawan petri, waterbath (Memmert W350), neraca analitik (Ohaus PA413), tabung reaksi, Melting Point System (Mettler Toledo MP70), chamber KLT, micropipette, oven (Memmert Oven Model 400), lampu UV, spektrometer inframerah (IR Shimadzu Prestige-21), spektrometer massa EI (Shimadzu QP2010S), spektrometer massa FD (JMST100GCV), spektrometer 1H-NMR, aluminium foil, dan baskom. E. Tata Cara Penelitian 1. Sintesis 4-asetamidofenil benzoat Parasetamol sebanyak 5 gram (0,033 mol) dimasukkan dalam erlenmeyer 500 mL, kemudian ditambahkan piridin 12 mL dan diaduk selama 5 menit dengan kecepatan 5.000 rpm menggunakan magnetic stirrer. Ke 35 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI dalam larutan tersebut ditambahkan benzoil klorida sejumlah 7,7 mL (0,066 mol) sedikit demi sedikit sambil terus diaduk, hingga merata dan terjadi perubahan konsistensi (60 menit). Akuades dingin sebanyak ± 200 mL ditambahkan ke dalam campuran untuk disaring dengan corong Buchner dan dicuci dengan akuades yang sama. Padatan/filtrat yang didapatkan kemudian direkristalisasi dengan melarutkannya dalam etanol 96% panas, disaring dengan corong Buchner, sehingga filtrat dapat didinginkan sampai terbentuk kristal produk secara optimal (± 60 menit). Setelah rekristalisasi selesai, kristal dikeringkan dalam oven dengan temperatur 80o C selama ± 2 jam. Hasil pengeringan kemudian direkristalisasi lagi dengan cara yang sama menggunakan ± 250 mL etanol 96% panas, dikeringkan dalam oven dengan temperatur 80º C selama 24 jam, ditimbang, dan dihitung rendemennya dengan rumus: %Rendemen = berat senyawa hasil percobaan x100% berat senyawa secara teoretis 2. Pemeriksaan pendahuluan senyawa hasil sintesis a. Uji organoleptis. Dilakukan dengan pengamatan terhadap warna, bentuk, bau, dan rasa senyawa hasil sintesis. Kemudian hasil pengamatan dibandingkan dengan starting material yang digunakan dalam penelitian, yaitu parasetamol dan benzoil klorida. b. Pemeriksaan kelarutan senyawa hasil sintesis. Akuades sebanyak 2 mL dimasukkan ke dalam tabung reaksi. Kristal hasil sintesis dalam wadah (misalnya cawan arloji), ditimbang di atas neraca analitik dan dicatat bobotnya. Kristal tersebut sedikit demi sedikit dimasukkan dalam tabung 36 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI reaksi, diamati kelarutannya hingga tepat jenuh, lalu dicatat kembali bobot sisanya. Prosedur yang serupa dilakukan dengan larutan NaOH 10%, etanol 96%, kloroform, dan etil asetat; kemudian dibandingkan dengan kelarutan parasetamol dalam pelarut-pelarut yang sama. c. Pemeriksaan senyawa hasil sintesis dengan kromatografi lapis tipis (KLT). Senyawa hasil sintesis yang dilarutkan dalam pelarut yang sesuai (kloroform), ditotolkan sebanyak ± 1 µL pada lempeng KLT silika gel GF254 menggunakan micropipette 0,5-10 µL. Sebagai pembanding, digunakan starting material dan dilakukan dengan cara serupa. Pengembangan dilakukan dengan jarak rambat fase gerak 8 cm dalam bejana yang berisi fase gerak aseton:etil asetat (2:3) dengan p’ = 4,680; dan fase diam berupa silika gel 60 GF254. Pengamatan terhadap bercak yang terbentuk dilakukan pada lampu UV 254 nm, kemudian dihitung Rf masing-masing bercak hasil elusi. d. Pengujian titik lebur. Kristal senyawa hasil sintesis diisikan ke dalam electrothermal capillary tubes, kemudian dimasukkan ke dalam alat pengukur titik lebur (Melting Point System). Amati peleburan kristalnya dan catat suhu waktu pertama kali melebur hingga semua kristal melebur dengan kenaikan suhu 1o C per-menit. 3. Elusidasi struktur senyawa hasil sintesis a. Spektrofotometri inframerah (IR). Kurang lebih 1 mg kristal hasil sintesis dicampur homogen dengan kurang lebih 150 mg KBr, kemudian dikempa 37 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI dan dibuat menyerupai pelet. Selanjutnya dibuat spektra inframerah dengan spektrofotometer inframerah. b. Spektrometri massa (MS). Kristal hasil sintesis dilarutkan dalam pelarutnya, yakni kloroform (CHCl3), kemudian dilakukan pemeriksaan dengan alat kromatografi gas-spektroskopi massa (GC-MS) dalam kondisi: alat pengionan Electron Impact (EI) 70 eV, suhu injektor 310o C, jenis kolom AGILENT HP Rastek Rxi-5MS (30 m), suhu kolom 1200C, gas pembawa Helium, tekanan 13,7 kPa, kecepatan alir fase gerak 16,6 mL/ menit. F. Analisis Hasil 1. Perhitungan rendemen %Rendemen = berat senyawa hasil percobaan x100% berat senyawa secara teoretis 2. Uji pendahuluan: a. Organoleptis. Analisis dilakukan berdasarkan data uji organoleptis. b. Data kelarutan. Analisis dilakukan berdasarkan hasil uji kelarutan. c. Data kromatografi lapis tipis. Analisis dilakukan berdasarkan hasil elusi senyawa dengan kromatografi lapis tipis (KLT). 3. Pemeriksaan dan uji kemurnian senyawa hasil sintesis Analisis dilakukan berdasarkan hasil uji titik lebur serta KLT. 4. Elusidasi struktur Analisis dilakukan berdasarkan data spektra inframerah dan spektra massa EI. 38 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI BAB IV PEMBAHASAN A. Sintesis 4-Asetamidofenil Benzoat Penelitian sintesis senyawa 4-asetamidofenil benzoat dari parasetamol berdasarkan reaksi substitusi nukleofilik asil (SNA) bertujuan untuk membuktikan bahwa senyawa 4-asetamidofenil benzoat dapat disintesis melalui reaksi SNA, serta mengetahui secara kuantitatif rendemen produk hasil sintesis reaksi substitusi nukleofilik asil yang dilakukan terhadap parasetamol dan benzoil klorida tersebut. Sintesis 4-asetamidofenil benzoat berlangsung melalui reaksi substitusi nukleofilik asil antara reaktan parasetamol dan benzoil klorida dalam pelarut piridina. Substitusi nukleofilik asil merupakan reaksi yang terjadi ketika derivat asam karboksilat atau halida, direaksikan dengan alkohol, baik primer, sekunder, maupun alkohol tersier sehingga sebuah nukleofil alkohol mensubstitusi elektrofil atom karbon pada gugus karbonil (C=O) asil klorida. Dalam penelitian ini, senyawa benzoil klorida berperan sebagai derivat asam karboksilat, sementara parasetamol sebagai alkohol yang dalam dengan aktivitasnya dalam reaksi sebagai nukleofil terhadap atom C-karbonil yang terikat pada satu substituen, yakni Cl- (klorin). Dalam kondisi basa, seperti yang dilakukan dalam penelitian ini karena kehadiran basa piridina, nukleofil kuat dapat ditambahkan dalam gugus karbonil untuk mendorong terbentuknya intermediet tetrahedral. Intermediet tersebut menstabilisasi dirinya dengan “menendang” gugus pergi yang terikat pada atom C-asil. Gugus hidroksida dalam 39 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI parasetamol (pKa=9,5) bereaksi dengan gugus karbonil dalam benzoil klorida (pKa=-8,97), membentuk intermediet tetrahedral yang segera menstabilisasi diri dengan menendang gugus pergi ion klorin (Cl-) untuk menghasilkan ester berupa 4-asetamidofenil benzoat. Reaksi substitusi nukleofilik asil merupakan reaksi yang reversibel apabila dilakukan dengan reaktan serta dalam kondisi tertentu; maka untuk menghindari terjadinya pembentukan reaktan kembali serta memicu pembentukan produk sintesis, dilakukan penambahan salah satu reaktan secara berlebih, dalam penelitian ini benzoil klorida. Adisi Nukleofilik O H N Cl CH3 CH3 O + O O+ O O Cl H H Benzoil klorida H N – N-asetil-p-aminofenol Eliminasi Halida Gambar 9. Reaksi substitusi nukleofilik asil dalam sintesis 4-asetamidofenil benzoat Piridina bekerja sebagai pelarut serta untuk menangkap ion H+ yang dihasilkan dari reaksi antara parasetamol dan benzoil klorida agar tidak terjadi pembentukan gas HCl dalam reaksi. Penambahan benzoil klorida dilakukan secara perlahan dan bertahap mengingat reaksi antara benzoil klorida (asil halida) dengan alkohol (parasetamol) merupakan reaksi cepat yang eksotermis. 40 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Kehadiran HCl dapat menurunkan pH campuran sehingga reaksi serta produk dapat berkurang stabilitasnya. Apabila stabilitas reaksi berkurang, maka rendemen yang diharapkan pun tidak optimal. Namun demikian, meskipun ke dalam reaksi dilakukan penambahan piridina, peneliti membiarkan reaksi eksotermis terjadi tanpa mempertahankan temperatur ruang. Seluruh proses reaksi tersebut dilakukan tanpa manipulasi suhu karena reaksi substitusi nukleofilik asil mudah terjadi meskipun tidak diberikan perlakuan khusus antara alkohol dengan asil klorida (Wade, 2013). Berlangsungnya reaksi nampak dari perubahan warna campuran yang menguning tepat setelah benzoil klorida mulai ditambahkan, hingga warna kuning tersebut semakin kuat. Selain itu nampak perubahan wujud campuran dari bentuk cair dan bening menjadi kuning pekat dan mengental, sehingga kecepatan rotasi magnetic stirrer ditingkatkan menjadi 6.000 rpm agar rotasi tidak terhenti. Gaya yang diberikan tersebut bertujuan untuk meyakinkan bahwa reaksi berjalan merata serta meningkatkan tumbukan antar-molekul sehingga terjadi reaksi yang lebih intens dengan harapan mengoptimalkan rendemen sintesis. Pencucian hasil sintesis dengan akuades dingin bertujuan untuk membuang sisa benzoil klorida yang tidak terlibat dalam reaksi serta membawa asam klorida, yakni senyawa larut air yang terbentuk sebagai by-product sintesis. Akuades dingin digunakan agar risiko terjadinya hidrolisis produk sintesis yang diharapkan berupa suatu senyawa ester tersebut dapat dicegah. Senyawa yang dihasilkan hingga tahap ini mempunyai pH 4-5. 41 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Serbuk kuning yang tertahan di atas kertas saring dilarutkan kembali dalam etanol panas hingga terlarut dengan sempurna sebagai permulaan dari proses rekristalisasi senyawa organik. Prinsip rekristalisasi adalah kelarutan hasil sintesis dalam solven yang tepat pada suhu tinggi, serta dengan menurunnya suhu solven tersebut kelarutan senyawa target juga diharapkan mengalami penurunan sehingga terbentuk kristal yang tidak larut dalam solven ketika suhu rendah. Tujuan rekristalisasi adalah membuang sisa-sisa asam klorida, benzoil klorida berlebih, piridina, hasil reaksi samping yang tidak diharapkan, juga pengotorpengotor berupa zat padat seperti serat ataupun debu yang bisa jadi mengkontaminasi selama proses sintesis, untuk kemudian mendapatkan kristal murni 4-asetamidofenil benzoat. Meskipun keberadaan partikel-partikel melayang tidak ditemukan di dalam kertas saring, proses rekristalisasi membantu meyakinkan bahwa pengotor dalam bentuk apapun tertinggal dan tercampur dalam produk. Dalam proses rekristalisasi, solven etanol dipilih karena merupakan pelarut yang tergolong universal dan terbukti tidak melarutkan kristal hasil sintesis, sehingga senyawa target yang karakteristik kelarutannya belum diketahui secara spesifik ini dapat direkristalisasi dengan baik. Dalam rekristalisasi, suatu larutan mulai menunjukkan keberadaan senyawanya ketika diarahkan pada titik jenuh terhadap senyawa bersangkutan. Perbedaannya dengan kelarutan adalah solven menyerang zat padat dan mensolvatasi padatan tersebut sampai pada tingkat partikel. Karena senyawa hasil sintesis yang didapatkan belum cukup murni setelah dilakukan uji coba penentuan melting range yang menghasilkan angka di atas 2 42 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI o C, yakni produk mulai melebur pada 152,9 oC dan berakhir pada 155,9 oC dengan rentang 3,0 oC; maka rekristalisasi kedua dilakukan dengan metode serupa menggunakan pelarut yang sama. Setelah didinginkan kembali dan terbentuk kristal, produk dikeringkan dalam oven untuk menghilangkan sisa kandungan air di dalamnya. Senyawa ester sebaiknya diperlakukan dengan hati-hati karena karakteristiknya yang mudah terhidrolisis oleh suhu tinggi, keberadaan air, serta pH lingkungan. Sintesis terhadap 3 replikasi menghasilkan masing-masing 2,286 g; 2,263 g; dan 2,060 g produk, yakni dengan rata-rata 2,203 g senyawa dalam satu reaksi. Dengan demikian, persentase rendemen yang dihasilkan secara berurutan sejumlah 27,137% b/b; 26,864% b/b; dan 24,454% b/b, dengan rata-rata persentase rendemen sebesar 26,152% b/b. Kristal hasil sintesis reaksi substitusi nukleofilik asil tersebut dapat dikatakan memberikan hasil dalam jumlah yang cukup kecil. Hal tersebut terutama disebabkan karena langkah-langkah sintesis yang dilakukan dalam penelitian, antara lain: terdapatnya air yang memicu terjadinya hidrolisis ester akibat beberapa langkah dalam pemurnian yang melibatkan air namun diuapkan dengan kurang sempurna, proses pemurnian dan isolasi senyawa produk yang memicu hilangnya sejumlah produk sintesis, terjadinya reaksi samping yang menghasilkan produk sintesis tidak diinginkan, dan penggunaan starting material dengan kualitas teknis yang tingkat kemurniannya tidak cukup tinggi. 43 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI B. Analisis Pendahuluan 1. Pemeriksaan organoleptis Pemeriksaan organoleptis bertujuan untuk mengidentifikasi karakteristik fisik senyawa hasil sintesis, yang meliputi bentuk fisik, warna, dan aroma; juga berguna dalam membandingkan senyawa hasil sintesis dengan starting material. Tabel I. Perbandingan sifat fisik senyawa produk sintesis dan starting material Benzoil Klorida Parasetamol Produk Sintesis Bentuk Cair Kristal Kristal halus Warna Putih bening Putih Putih tulang Bau Menyengat Khas Khas Senyawa hasil sintesis hampir menunjukkan warna dan bentuk yang serupa dengan starting material parasetamol, yakni berwana putih dan berbentuk kristal. Akan tetapi dengan pengamatan yang lebih jeli, tampak perbedaan di antara keduanya. Warna kristal parasetamol cenderung putih bersih, sementara produk sintesis berwarna putih tulang; bentuk kristal produk pun berupa kristal halus menyerupai kapas, sementara kristal parasetamol nampak lebih kasar. Selain itu, masing-masing senyawa memiliki aroma khasnya yang berbeda satu sama lain. Dikarenakan adanya perbedaan fisik tersebutlah disimpulkan bahwa senyawa produk sintesis merupakan suatu senyawa baru. 2. Pemeriksaan kelarutan Pemeriksaan kelarutan suatu senyawa organik dilakukan untuk menentukan dan mengetahui karakteristik kelarutan, serta kepolaran suatu 44 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI senyawa organik. Senyawa organik dilarutkan hingga jenuh dalam pelarut dengan kepolaran yang bervariasi, yakni air/akuades, etanol 96%, kloroform, etil asetat, dan NaOH 5%. Tabel II. Perbandingan tingkat kelarutan produk sintesis dengan parasetamol PCT Produk Sintesis Air Sedikit larut Praktis tidak larut NaOH 5% Mudah larut Praktis tidak larut Etanol 96% Sangat mudah larut Praktis tidak larut Kloroform Praktis tidak larut Mudah larut Etil asetat Larut Sangat mudah larut Berdasarkan tabel di atas, starting material parasetamol sedikit larut dalam air, sementara produk sintesis praktis tidak larut dalam solven air. Parasetamol memiliki potensi untuk membentuk interaksi hidrogen dengan air, akan tetapi strukturnya yang cukup meruah dengan jumlah atom karbon relatif banyak (lebih dari 5), massa molekuler parasetamol yang tinggi (151,16 g/mol), serta keberadaan gugus benzena yang hidrofobik mengakibatkan senyawa hanya sedikit larut dalam air; karenanya produk sintesis diperkirakan memiliki struktur yang lebih kompleks dan massa molekuler lebih tinggi dari parasetamol. Senyawa-senyawa organik yang larut dalam larutan basa (contohnya NaOH 5%) disebabkan oleh pembentukan garam natrium yang bersifat larut dalam air atau larutan yang mengandung air. Dalam gambar 10, reaksi antara parasetamol dengan kehadiran NaOH (suasana basa) menyebabkan terjadinya bentuk basa terkonjugasi dari parasetamol berupa senyawa garam yang dapat 45 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI larut dalam air; tidak lain karena keberadaan atom hidrogen bersifat asam pada gugus fenol parasetamol, meskipun hal tersebut tidak selalu menjamin. Dalam beberapa kasus, senyawa organik yang besar (berbobot molekul tinggi) belum tentu dapat larut atau bahkan ada kemungkinan terjadi presipitasi. Hasil pengujian menunjukkan perbedaan tingkat kelarutan antara starting material dengan produk sintesis, yakni mudah larut untuk parasetamol, dan praktis tidak larut untuk produk sintesis. Tidak larutnya produk sintesis dikarenakan dalam struktur senyawa hasil reaksi substitusi nukleofilik asil tidak lagi terdapat hidrogen bersifat asam; sebagai gantinya dalam senyawa baru suatu gugus ester terbentuk akibat reaksi substitusi nukleofilik asil, sehingga tidak terjadi pembentukan basa konjugat antara produk sintesis dalam larutan NaOH 5%. Gambar 10. Kelarutan (a) parasetamol dan (b) 4-asetamidofenil benzoat dalam NaOH 5% Kelarutan suatu senyawa dalam solven golongan alkohol pada umumnya dipengaruhi oleh kemampuan keduanya untuk membentuk interaksi hidrogen. Interaksi hidrogen dapat terjadi antara atom oksigen pada etanol 46 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI sebagai akseptor dengan atom hidrogen pada solut, maupun juga sebaliknya, antara atom hidrogen pada etanol sebagai donor dengan atom oksigen maupun nitrogen pada solut. Dalam penelitian yang dilakukan, parasetamol sangat mudah larut dalam etanol 96%, sementara produk sintesis praktis tidak larut di dalamnya. Gambar 11 menunjukkan sisi donor dan akseptor proton dari senyawa parasetamol serta 4-asetamidofenil benzoat. Parasetamol berperan sebagai asam Lewis dalam larutan, dengan dua donor proton pada gugus hidroksi (-OH) dan amina (-NH), serta tiga akseptor proton pada gugus karbonil (C=O), hidroksi, dan amina; yang mengalami interaksi hidrogen dengan proton (atom H) maupun oksigen (atom O) etanol. Di sisi lain, produk sintesis yang diharapkan berupa 4-asetamidofenil benzoat memiliki sebuah donor proton pada gugus amina serta empat akseptor proton bagi etanol; namun struktur molekul yang lebih meruah (bulky) menyebabkan interaksi hidrogen lebih terhalangi. D = donor A = akseptor parasetamol 4-asetamidofenil benzoat Gambar 11. Sisi donor dan akseptor proton pada parasetamol dan 4-asetamidofenil benzoat Kloroform merupakan solven non-polar yang digunakan untuk menentukan seberapa polar senyawa organik yang dapat larut dalam air; apabila senyawa organik tersebut bersifat polar maka tidak dapat larut dalam kloroform. Dalam penelitian ini, parasetamol praktis tidak dapat larut dalam solven kloroform, sedangkan produk sintesis yang mudah larut di dalamnya. 47 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Melalui kelarutan dalam solven kloroform ini, dapat dikatakan bahwa parasetamol merupakan senyawa polar, sedangkan produk sintesis diduga kuat merupakan senyawa non-polar. Dalam penelitian, kedua senyawa yakni parasetamol dan produk sintesis larut dalam solven etil asetat, namun dengan perbedaan tingkat kelarutan. Parasetamol sebagai starting material dapat larut, sedangkan produk sintesis sangat mudah larut di dalam etil asetat. Mengacu pada ketentuan umum like dissolves like, senyawa-senyawa polar akan lebih mudah larut dalam solven polar, demikian berlaku bagi senyawa dan solven nonpolar. Etil asetat merupakan solven yang memiliki polaritas menengah dengan koefisien distribusi log (minyak/air) = 0,7; berarti bahwa etil asetat lebih larut dalam minyak dibandingkan dengan dalam air. Dengan polaritas sedemikian rupa, maka produk sintesis 4-asetamidofenil benzoat yang lebih non-polar dibandingkan dengan parasetamol menjadi sangat mudah larut dalam solven etil asetat dibandingkan dengan parasetamol. Berdasarkan perbedaan hasil uji kelarutan antara starting material parasetamol dengan produk sintesis, diprediksikan bahwa produk sintesis merupakan senyawa dengan struktur lebih kompleks dan meruah (bulky) yang memiliki massa molekuler lebih tinggi dari parasetamol dan berupa senyawa nonpolar atau lebih non-polar dibandingkan dengan parasetamol. Dengan demikian, dapat dikatakan bahwa kedua senyawa yang diuji merupakan senyawa yang berbeda, serta menunjukkan bahwa reaksi substitusi nukleofilik asil berjalan menghasilkan senyawa baru yang berbeda dari starting material-nya. 48 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 3. Pemeriksaan titik lebur Titik lebur suatu senyawa organik diuji dengan tujuan menentukan identitas suatu senyawa. Setiap senyawa organik memiliki struktur kimia yang berbeda, ikatan yang berbeda, sehingga kekuatan ikatan yang berbeda tersebut akan memberikan titik lebur yang berbeda pula. Misalnya senyawa dengan banyak ikatan kovalen yang kuat memiliki titik lebur lebih tinggi daripada senyawa dengan ikatan ionik yang cenderung lebih lemah dan lebih mudah diputuskan. Dalam penelitian ini tidak dilakukan pengujian titik lebur senyawa, melainkan rentang titik lebur senyawa. Rentang titik lebur dilakukan untuk mengetahui kemurnian senyawa organik terutama dalam suatu sintesis senyawa organik baru. Disebutkan bahwa parasetamol melebur pada rentang suhu 169-170,5oC sedangkan dalam penelitian, parasetamol mulai melebur pada suhu 169,6o C dan berakhir pada suhu 170,7oC; sedangkan produk sintesis menunjukkan rentang titik lebur 157,91 oC hingga titik akhir meleburnya senyawa pada 159,12oC, dengan nilai rentang titik lebur sebesar 1,21 oC. Berdasarkan pengujian, dapat dikatakan bahwa rentang titik lebur produk sintesis berbeda dari rentang titik lebur parasetamol, sehingga dapat disimpulkan bahwa produk sintesis merupakan suatu senyawa baru yang berbeda dari starting material. Sedangkan rentang titik lebur yang lebih kecil dari 2 oC menunjukkan tingkat kemurnian senyawa produk sintesis yang tinggi, atau merupakan suatu senyawa yang murni. Dalam penelitian yang ditampilkan pada tabel III, jarak suhu peleburan produk sintesis lebih kecil daripada parasetamol disebabkan karena produk 49 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI sintesis telah mengalami proses rekristalisasi yang merupakan bagian dari proses pemurnian, sedangkan parasetamol berkualitas teknis yang tidak murni sehingga masih terdapat bahan-bahan serta senyawa lain di dalamnya. Tabel III. Uji titik lebur terhadap produk sintesis dan starting material Produk Parasetamol Suhu awal melebur (oC) 157,91 170,2 Suhu akhir melebur (oC) 159,12 172,3 4. Kromatografi Lapis Tipis (KLT) Pengujian kromatografi lapis tipis (KLT) dilakukan untuk menguji kemurnian suatu senyawa, serta membandingkan antara starting material dengan produk sintesis. Pengujian dilakukan di atas plat silika gel GF254, dan dikembangkan dalam bejana elusi dengan fase gerak berupa aseton:etil asetat (2:3), kemudian deteksi bercak di bawah lampu UV pada panjang gelombang 254 nm. Hasil pengujian menunjukkan bahwa produk sintesis lebih non-polar dibandingkan dengan parasetamol sebagai starting material. Hal ini diketahui dari posisi spot hasil elusi produk sintesis yang bergerak lebih cepat daripada parasetamol, dikarenakan parasetamol terikat secara hidrofilik terhadap silika gel, sehingga memerlukan waktu lebih lambat untuk terelusi. Sementara itu, produk sintesis bersifat cenderung lebih non-polar sehingga mampu lebih mudah terbawa oleh fase gerak yang digunakan. 50 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI titik akhir elusi d c b a PCT titik awal elusi Gambar 12. Hasil elusi KLT terhadap parasetamol (PCT), produk orientasi (a), dan produk sintesis replikasi I (b), II (c), dan III (d); fase diam=silika gel GF254, fase gerak=aseton:etil asetat (2:3), deteksi pada UV 254 nm Perbedaan tersebut juga dapat diamati dengan lebih jelas melalui hasil perhitungan Rf masing-masing senyawa yang diuji. Secara berurutan, nilai Rf parasetamol, produk orientasi, produk hasil replikasi I, replikasi II, dan replikasi III berturut-turut sebesar: 0,675; 0,7625; 0,7688; 0,7688; dan 0,775, dengan nilai hRf sebesar: 67,5; 76,25; 76,88; 76,88; dan 77,5. Dengan demikian secara kuantitatif dapat disimpulkan bahwa reaksi berjalan dan menghasilkan produk senyawa yang berbeda dari starting material parasetamol. Tabel IV. Perbandingan nilai Rf dan hRf produk sintesis dengan parasetamol Parasetamol Orientasi Produk 1 Produk 2 Produk 3 Nilai Rf 0,675 0,7625 0,7688 0,7688 0,775 NIlai hRf 67,5 76,25 76,88 76,88 77,5 51 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI C. Elusidasi Struktur Senyawa Hasil Sintesis Elusidasi struktur senyawa organik dilakukan dengan tujuan memprediksikan struktur produk hasil sintesis yang belum diketahui. Dalam penelitian ini, elusidasi struktur dilakukan melalui beberapa metode, yaitu: 1. Elusidasi struktur dengan spektrofotomeri inframerah (IR) Informasi yang dapat diperoleh dari spektrofotometri inframerah (IR) berupa pita-pita spektra yang menunjukkan gugus fungsional khas pada senyawa hasil sintesis organik. Gambar 13 menunjukkan spektra inframerah produk sintesis yang didapatkan dari pengujian. Spektra tersebut menunjukkan karakteristik senyawa produk yang diuji dengan pita serapan spesifik untuk masing-masing gugus fungsi dalam intensitas yang bervariasi. C=O ester C-O ester Gambar 13. Spektra inframerah senyawa produk (pelet KBr) 52 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Gambar 14. Spektra inframerah parasetamol (Shayani-Jam and Davood, 2009) Pita-pita serapan penentu identitas nampak pada daerah frekuensi di bawah 3.000 cm-1 mengindikasikan bahwa senyawa yang diuji merupakan senyawa alifatis. Pita serapan lemah pada daerah 3.016,67 cm-1, 2.931,8 cm-1, dan 2.854,65 cm-1 menunjukkan kemungkinan keberadaan senyawa tak jenuh atau gugus aromatis. Kemunculan pita serapan dengan intensitas kuat pada daerah 1.8501.650 cm-1 mengindikasikan secara khas gugus karbonil dalam suatu senyawa organik. Dalam spektra IR di atas nampak serapan kuat vibrasi ulur C=O pada pita di daerah 1.735,93 cm-1, menunjukkan bahwa senyawa organik tersebut berupa senyawa ester yang cukup sederhana. Pita serapan tersebut secara signifikan berbeda dengan pola serapan spektra inframerah pada parasetamol (gambar 14) pada daerah yang sama. Pada frekuensi 1.257,59 cm-1 terdapat spektra dengan intensitas kuat yang menggambarkan vibrasi C-O, di mana bersama indikasi gugus C=O menguatkan keberadaan senyawa ester dalam senyawa organik produk 53 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Pita serapan juga ditemukan pada daerah 1.689,64 cm-1 yang sintesis. menunjukkan bahwa senyawa dapat mungkin mengandung gugus karboksilat. Gugus-gugus senyawa aromatis ditunjukkan pada daerah bervariasi yang dapat saling mendukung interpretasi spektra inframerah; dengan cukup meyakinkan pada daerah serapan antara 1.615-1.495 cm-1. Dalam penelitian terhadap produk sintesis, nampak spektra tajam dengan intensitas moderat pada 1.504,48 cm-1. Spektra tersebut didukung dengan spektra dengan intensitas lemah pada 3.016,67 cm-1, menunjukkan lebih spesifik stretching/regangan C-H aromatis. Pada daerah antara 2.000-1.700 cm-1 terlihat rangkaian spektra dengan intensitas lemah yang juga menunjukkan bahwa produk sintesis berupa senyawa aromatis. Spektra dengan intensitas moderat tampak pada frekuensi 709,80 cm-1, yang menunjukkan vibrasi tekuk C-H out of plane (OOP) gugus aromatis. Data tersebut membuktikan bahwa produk sintesis merupakan senyawa ester dengan keberadaan pita serapan C=O pada 1.735,93 cm-1 serta vibrasi C-O pada 1.257,59 cm-1. Tabel V. Interpretasi spektra inframerah senyawa produk sintesis Gugus Fungsional Aromatis (C=C) 1.504,48 cm-1 Aromatis (C—H) 3.016,67 cm-1, 2.931,8 cm-1, dan 2.854,65 cm-1 Aromatis (C—H OOP) 709,80 cm-1 Karbonil (C=O) 1.735,98 cm-1 C—O 1.257,59 cm-1 Keterangan : Produk Sintesis (Silverstein, 2005) = pita serapan identitas yang muncul 54 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 2. Elusidasi struktur dengan kromatografi gas – spektrometri massa (GCMS) Elusidasi struktur dengan spektrometri massa bertujuan untuk menentukan bobot massa serta pola fragmentasi yang dialami suatu molekul. Asal pembentukan senyawa hasil sintesis dapat ditentukan dengan mengamati fragmen-fragmen yang dihasilkan dari pola fragmentasi. Produk sintesis diuji dengan metode ionisasi EI (electron impact) yang secara umum digunakan dalam spektrometri massa. Senyawa A Senyawa X Gambar 15. Kromatogram senyawa hasil sintesis Hasil yang diperoleh dari pengujian GC-MS berupa kromatogram dan spektra massa EI; dengan informasi kemurnian produk sintesis yang dapat diamati dari kromatogram, serta spektra massa EI berupa bobot molekul dengan pengamatan terhadap nilai m/z yang paling besar. Berdasarkan gambar 15, senyawa hasil sintesis dapat dikatakan belum terpisah sempurna dikarenakan kemunculan tiga peak yang saling berdekatan pada waktu retensi ± 33 menit dan mengindikasikan kemungkinan hadirnya pengotor dalam kolom retensi yang digunakan. Namun pada waktu retensi ± 45 menit muncul peak yang lebih tinggi intensitasnya, sehingga dimungkinkan terbentuknya senyawa organik lain selain produk sintesis yang diharapkan 55 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI selama proses sintesis berlangsung. Area puncak pada kromatogram menunjukkan perbandingan keberadaan senyawa A, senyawa X, serta senyawa-senyawa pengotor lainnya dari hasil reaksi dalam rendemen adalah 22,79%:70,31%:6,90%=1:3,09:0,30. Gambar 16. Spektra massa EI senyawa produk pada waktu retensi 33,683 menit Gambar 17. Spektra massa EI senyawa produk pada waktu retensi 34,183 menit Gambar 18. Spektra massa EI senyawa produk pada waktu retensi 34,942 menit Berdasarkan spektra massa EI yang didapatkan (gambar 16, 17, dan 18), ion molekul terbesar terdapat pada nilai m/z 255. Jika diamati ketiga spektra massa tersebut, produk sintesis diduga berupa satu senyawa yang sama, yaitu 4-asetamidofenil benzoat. Dari total luas area puncak kromatogram, dalam 2,203 g rendemen terdapat senyawa A sebanyak 22,79% atau setara dengan 0,502 g. Ketiga spektra massa tersebut menunjukkan pola 56 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI fragmentasi serupa, dengan base peak m/z senilai 105. Base peak merupakan kelimpahan massa tertinggi, di mana ion yang paling stabil ditunjukkan pada satu peak. Nilai m/z dari beberapa peak dalam spektra dapat dijelaskan melalui usulan mekanisme fragmentasi yang tercantum pada gambar 19. Gambar 19 memaparkan pola mekanisme fragmentasi ion molekuler yang menghasilkan peak A, B, C, dan D. Peak A merupakan ion molekuler dengan nilai m/z = 255. Nilai m/z tersebut sama dengan bobot molekul senyawa target sehingga dapat dipastikan bahwa senyawa yang terbentuk merupakan 4-asetamidofenil benzoat. Peak B (M – 150) memiliki nilai m/z = 105 muncul karena ion molekuler melepaskan C! H! O! N ∙ melalui pemisahan homolitik antara gugus karbonil (C=O) dengan atom oksigen. Keberadaan fragmen tersebut menegaskan bahwa reaksi substitusi nukleofilik asil telah berjalan. Peak C merupakan hasil fragmentasi lanjutan dari ion C! H! O ! yang melepaskan C=O, sehingga nilai m/z menjadi 77. Peak D muncul karena terjadi pemisahan homolitik antara gugus karbonil (C=O) dengan atom nitrogen pada ion molekul. Ion molekul melepaskan C!" H!" O! N ∙ sehingga menghasilkan fragmen ion C! H! O dengan nilai m/z = 43 yang ditunjukkan pada peak D dalam spektra massa. 57 ! PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Gambar 19. Usulan mekanisme fragmentasi ion molekul 4-asetamidofenil benzoat 58 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Spektra massa dalam gambar 20 dan 21 menunjukkan kehadiran senyawa lain (disebut senyawa X) di samping senyawa produk sintesis yang diharapkan; hal ini berarti produk sintesis bukanlah senyawa murni. Kedua gambar tersebut menampilkan hasil spektra massa X pada menit ke-45,392 dan 47,092; yang lebih lama dibandingkan dengan gambar 16, 17, dan 18. Hal ini disebabkan karena bobot molekul produk sintesis yang diharapkan berupa 4asetamidofenil benzoat lebih kecil daripada bobot molekul senyawa X dalam gambar 20 dan 21. Dari total luas area puncak kromatogram, dalam 2,203 g rendemen terdapat senyawa X dengan persentase 70,31%, atau setara dengan 1,549 g. Adapun nilai ion molekul terbesar dari 4-asetamidofenil benzoat adalah m/z 255, sedangkan senyawa X memiliki nilai m/z 317. Gambar 20. Spektra massa EI senyawa produk pada waktu retensi 45,392 menit Gambar 21. Spektra massa EI senyawa produk pada waktu retensi 47,092 menit Berdasarkan analisis pada struktur dan kondisi starting material serta reaksi yang dapat terjadi dalam campuran maka diperkirakan terdapat senyawa dengan rumus molekul C!" H!" O! N yang dapat terbentuk apabila salah satu 59 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI starting material yakni parsetamol mengalami hidrolisis. Diduga bahwa sebagian parasetamol telah mengalami hidrolisis menjadi p-aminofenol di dalam penyimpanannya ataupun selama pencampuran, sehingga memungkinkan terjadinya reaksi lanjutan pada atom N parasetamol. Seperti reaksi substitusi nukleofilik asil yang diharapkan oleh peneliti, atom O pada gugus fenol p-aminofenol sebagai nukleofil menyerang atom C karbonil benzoil klorida, menghasilkan 4-aminofenil benzoat. Keberadaan benzoil klorida berlebih bisa jadi memicu reaksi lanjutan, dengan atom N sebagai nukleofil melalui reaksi serupa, menyebabkan substitusi amina sehingga menghasilkan senyawa 4-benzamidofenil benzoat atau senyawa X. 60 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI BAB V KESIMPULAN DAN SARAN A. KESIMPULAN Senyawa 4-asetamidofenil benzoat yang merupakan senyawa golongan ester dapat disintesis dari parasetamol dan benzoil klorida melalui reaksi substitusi nukleofilik asil. Senyawa produk sintesis masih berupa senyawa campuran yang terdiri dari 4-asetamidofenil benzoat, parasetamol, benzoil klorida, serta piridina. B. SARAN Saran yang diajukan dalam penelitian: 1. Dilakukan pemurnian produk sintesis secara lebih lanjut serta spesifik agar terbebas dari senyawa-senyawa organik hasil reaksi samping lainnya. 2. Dilakukan optimasi kondisi jalannya reaksi substitusi nukleofilik asil, yakni optimasi suhu reaksi serta waktu berjalannya reaksi. 3. Dilakukan elusidasi struktur lebih spesifik menggunakan Resonansi Magnetik Nuklir Proton (H1-NMR). 61 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI DAFTAR PUSTAKA AJM, 2010, BioOrg. Chem.: Classification Of Organic Compounds by Solubility, http://www.uobabylon.edu.iq/eprints/publication_10_5343_904.pdf, diakses tanggal 13 Juli 2015. Bertolini, A., et al., 2006, Paracetamol: New Vistas of an Old Drug, CNS Drug Reviews, Vol. 12, No. 3-4, pp. 250-275. Calgary, 2010, Organic Laboratory Techniques 4, http://www.chem.ucalgary.cacourses/351/laboratory/meltingpoint.pdf, diakses tanggal 8 Agustus 2015. Carey, F.A., and Richard, J.S., 2001, Advanced Organic Chemistry, Part B: Reactions and Synthesis, Fourth Edition, Springer Science+Business Media, NY, pp. 166-167. Cazes, J., 2005, Encyclopedia of Chromatography: Vol. 1, Second Edition, Taylor & Francis Group, FL, pp. 550. Crawford Scientific, 2016, Theory and Instrumentation of GC: Introduction, http://www.chromacademy.com/lms/sco10/Theory_and_Instrumentation_ Of_GC_Introduction.pdf, diakses tanggal 12 Juli 2016. Dirjen POM, 1979, Farmakope Indonesia, Edisi III, Departemen Kesehatan RI, Jakarta, pp. 37, 658, 722. EbuyChem, 2011, 4-asetamidofenil benzoat, http://www.ebuychem.com/product/537-52-0.html, diakses tanggal 13 April 2013. Fessenden, R.J., dan Joan, S.F., 1986, Kimia Organik Jilid 2, diterjemahkan oleh Aloysius Hadyana Pudjaatmaka, Edisi III, Penerbit Erlangga, Jakarta, pp. 454. Gandjar, I. G., dan Abdul, R., 2007, Kimia Farmasi Analisis, Pustaka Pelajar, Yogyakarta, pp. 353-354, 356, 359-360, 362, 420. Gritter, J.R., Bobbit, J.M., and Scharting, A.E., 1991, Pengantar Kromatografi, diterjemahkan oleh Kosasih Padmawinata, Edisi II, ITB, Bandung, pp. 109-112. Hanson, G.R., 2000, Remington the Science and Practice of Pharmacy, Twentieth Edition, Lippincott Williams & Wilkins, PA, pp. 83. Harris, D.C., 1982, Quantitative Chemical Analysis, Fourth Edition, W.H. Freeman and Company, NY, pp. 659-661, 666-669. 62 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Hinz, B., et al., 2008, Acetaminophen (Paracetamol) is a Selective Cyclooxygenase-2 Inhibitor in Man, The FASEB Journal, vol. 22 no. 2, pp. 383-390. Johnson, A.W., 1999, Invitation to Organic Chemistry, Jones and Bartlett Publishers, MA, pp. 533. Makone, S.S., & Sandeep, N.N., 2013, Environmentally Benign Un-catalyzed Esterification of Alcohols under Solvent Free Condition using Acetyl Chloride, Chemistry and Materials Research, Vol. 3 No.2, pp. 8-18. Oxtoby, D.W., et al., 2008, Principles of Modern Chemistry, Sixth Edition, Thomson Brooks/Cole, CA, pp. 678-679. Pudjono, et al., 2011, Pemodelan Senyawa Turunan p-Aminofenol sebagai Analgetik Anti-Inflamasi Berdasarkan Hubungan Struktur dan Aktivitas Biologisnya, Majalah Farmasi Indonesia, 22(2), 144-150. Ramdani, E. D., 2011, Sintesis Benzoil Eugenol dari Eugenol dan Benzoil Klorida dalam Piridina, Tesis, Universitas Sanata Dharma, Yogyakarta. Ratnawati, D., 2007, Sintesis Turunan Benzofenon melalui Reaksi Penataan Ulang Fries dari Senyawa Para-Tersier Butilfenilbenzoat, Jurnal Gradien, 3 (1), 215-218. Rohman, A., 2009, Kromatografi untuk Analisis Obat, Graha Ilmu, Yogyakarta, pp. 181, 187. Sastrohamidjojo, H., & Harno, D.P., 2009, Sintesis Senyawa Organik, Erlangga, Jakarta, pp. 31. Shayani-Jam, H., and Davood, N., 2009, Electrochemical Evidences in Oxidation of Acetaminophen in the Presence og Glutathione and N-acetylcysteine, The Royal Society of Chemistry, Supplementary Information, pp. VIII. Silverstein, R.M., and Francis, X.W., 2005, Spectrometric Identification of Organic Compounds, John Wiley&Sons, NJ, pp. 1, 14, 18, 72-73, 127. Szolcsányi, P., 2016, Aromatic Heterocycles 1: Structures and Reactions, http://www.chtf.stuba.sk/~szolcsanyi/education/files/Chemia%20heterocy klickych%20zlucenin/Prednaska%201/Odporucane%20studijne%20materi aly/Pyrid%EDn-vlastnosti%20a%20reaktivita.pdf, diakses tanggal 12 Juli 2016. Stahl, E., 1985, Analisis Obat secara Kromatografi dan Mikroskopi, ITB Press, Bandung, pp. 3. 63 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Stanford Research Systems, 2010, Melting Point Determination, http://www.thinksrs.com/downloads/PDFs/ApplicationNotes/MPProcedure.pdf, diakses tanggal 17 Juli 2015. Vane, S.J., et al., 1996, Improved Non Steroid Anti-Inflammatory Drugs COX-2 Enzyme Inhbitors, Kluver Academic Publishers, London. Wade, L. G., 2013, Organic Chemistry, Eighth Edition, Pearson Education, IL, pp. 70-71, 782, 960-962, 969, 970-971, 986, 997-1000. WISC, 2013, Melting Point Determination, http://www.chem.wisc.edu/courses/342/Fall2004/Melting_Point.pdf, diakses tanggal 11 Mei 2013. 64 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI LAMPIRAN Lampiran 1. Data penimbangan starting material dan perhitungan rendemen teoretis Penimbangan parasetamol Replikasi I Replikasi II Replikasi III Berat wadah (g) 0,256 0,261 0,261 Berat wadah + zat (g) 5,258 5,263 5,262 Berat wadah + sisa 0,257 0,261 0,262 Berat zat (g) 5,001 5,002 5,000 Jumlah (mol) 0,033 0,033 0,033 (g) Persamaan reaksi O H N Cl H N CH3 O CH3 O O HO O N Mula-mula 0,033 mol 0,066 mol - Reaksi 0,033 mol 0,033 mol 0,033 mol Sisa - 0,033 mol 0,033 mol Massa teoretis rendemen = n x BM = 0,033 mol x 255,27 g/mol = 8,424 g 65 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Lampiran 2. Data penimbangan dan perhitungan rendemen Replikasi I Replikasi II Replikasi III Berat wadah (g) 49,317 47,044 48,065 Berat wadah + zat (g) 51,603 49,307 50,125 Berat zat (g) 2,286 2,263 2,060 Replikasi I Replikasi II Replikasi III Massa zat (g) 2,286 2,263 2,060 Massa teoretis (g) 8,424 8,424 8,424 % Rendemen (b/b) 27,137% 26,864% 24,454% Rata-rata % rendemen: % rendemen = = rata − rata % rendemen 3 27,137% + 26,864% + 24,454% = 26,152% b/b 3 Senyawa hasil sintesis: 66 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Lampiran 3. Spektra inframerah produk sintesis 67 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Lampiran 4. Kondisi alat spektrometri massa 68 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Lampiran 5. Kromatogram spektrometri massa produk sintesis 𝚺 %Area = senyawa A = 𝟐𝟐, 𝟕𝟗% bobot senyawa A = 22,79% x m rendemen = 22,79% x 2,203 g = 𝟎, 𝟓𝟎𝟐 𝐠 𝚺 %Area = senyawa X = 𝟕𝟗, 𝟑𝟏% bobot senyawa X = 79,31% x m rendemen = 79,31% x 2,203 g = 𝟏, 𝟓𝟒𝟗 𝐠 69 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Lampiran 6. Pola fragmentasi produk sintesis Line 5 70 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Line 6 71 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Line 7 72 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Line 8 73 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Line 9 74 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI BIOGRAFI PENULIS Dolorosa Lintang Suminar lahir di Yogyakarta pada tanggal 15 Maret 1991 sebagai putri tunggal dari pasangan Th. Enny Anggraini, Ph.D. dan Y. Dwi Koratno, M.A.. Penulis mengawali pendidikan di TK Tarakanita Bumijo, Yogyakarta pada tahun 1995 serta pendidikan dasar di SD Tarakanita Bumijo IV, Yogyakarta pada tahun 1997 sampai dengan tahun 2003, kemudian melanjutkan sekolah menengah di SMP Negeri 5 Yogyakarta pada tahun 2003 sampai dengan tahun 2006, serta SMA Negeri 8 Yogyakarta pada tahun 2006 hingga 2009. Setamatnya dari tingkat menengah, penulis melanjutkan pendidikan di Fakultas Farmasi Universitas Sanata Dharma sampai dengan tahun 2016. Sejak duduk di bangku SMP, penulis telah aktif dalam berbagai kegiatan, organisasi, serta kesenian, seperti menjabat di dalam Organisasi Siswa IntraSekolah, pertukaran pelajar ke Swan Hill College di Victoria, Australia, terlibat dalam proyek artikel internasional Doors to Diplomacy (2008) dan mendapatkan predikat “Honorable Mention”, berpartisipasi dalam perlombaan seni, bahkan menjuarai lomba piano serta tari kreasi baru di tingkat kota Yogyakarta. Selama masa kuliahnya, penulis aktif dalam berbagai kegiatan di sekitarnya, antara lain sebagai Divisi Advokasi Ikatan Senat Mahasiswa Farmasi Indonesia (ISMAFARSI) Komisariat Universitas Sanata Dharma, kepanitiaan seminar yang diadakan oleh ISMAFARSI, aktif sebagai anggota paduan suara mahasiswa (PSM), meraih medali emas dalam Bali International Choir Competition (2012), berpartisipasi sebagai sukarelawan dalam kegiatan kesenian internasional Biennale Jogja XI, serta menjuarai perlombaan band tingkat Jawa Tengah. Pada tahun 2009 hingga 2010, penulis sempat hidup di kota Columbus, Ohio, Amerika Serikat dan berkesempatan membantu sebagai volunteer di sebuah panti wredha Wesley Glen Retirement Community, juga belajar berbagai bahasa, yakni bahasa Jepang, Spanyol, dan Italia di Ohio State University. 75



![SINTESIS SEhIYAWA TABIR SURYA TT`RT]NAI\I BENZOFENOI](http://s1.studylibid.com/store/data/000021403_1-08993e9cd2bed24b8ed359829b00854d-300x300.png)