IDENTIFIKASI26 ISOLAT BAKTERI ENDOFITIK DAN FILOSFER
advertisement

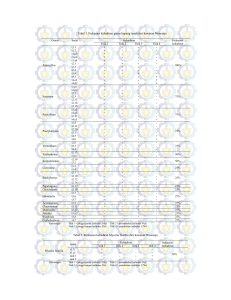
Berita Biologi 10(4) - April 2011 IDENTIFIKASI26 ISOLAT BAKTERI ENDOFITIK DAN FILOSFER PADI DENGAN ANALISIS SEKUEN16S RDNA1 [Identification of 26 Endophytic and Phyllosphere Bacteria Isolated from Rice by 16S rDNA Sequence Analyses] Nurul Hidayatun0*, Dwi N Susilowati dan K Mulya Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian, Badan Penelitian dan Pengembangan Pertanian JlnTentaraPelajar3A,Bogor-16111 Tip. 0251-8337975, Fax. 0251-8338820 HP 081802969600; *e-mail: [email protected] ABSTRAK Penelitian dimaksudkan untuk mengidentifikasi 26 isolat bakteri endofit dan filosfer yang diisolasi dari 4 varietas padi, dengan menggunakan metode sequencing terhadap 16S rDNA. Sekuen DNA kemudian disejajarkan dengan sekuen referen dari perpustakaan data bank gen dengan menggunakan program BLAST dari NCBI untuk menemukan identitas yang paling dekat keterkaitannya dengan isolate yang dianalisis. Analisis sekuensing menunjukkan bahwa beberapa isolat yang dianalisis memiliki identitas yang dekat dengan Staphyllococcus dan Serratia (masing-masing 5 isolat), Bacillus (4 isolat), Microbacteria (3 isolat), Pseudomonas (2 isolat) dan Klebsiella, Acidovorak, Bulkholderiaceae, Agrobacterium and Shewanella (masing-masing satu isolat). Tidak ada isolate tertentu yang mendominasi pada kedua kelompok bakteri endofit dan filosfer, dan juga tidak ditemukan isolat spesifik-inang pada keempat varietas padi. Kata kunci: BLAST, bakteri endofit, 16S rDNA, sekuensing ABSTRACT The research was subjected to identify 26 endophytic and phyllosphere bacteria isolated from 4 rice varieties using sequencing method of 16S rDNA. The sequences were then aligned with reference sequence from Gen-Bank data library by BLAST program from NCBI to find the most related identity of the isolates analysed. The sequencing analysis revealed that some isolates have a high identity to Staphylococcus and Serratia (5 isolates each), Bacillus (4 isolates), Microbacteria (3 isolates), Pseudomonas (2 isolates) and Klebsiella, Acidovorak, Bulkholderiaceae, Agrobacterium and Shewanella (1 isolate each). No specific isolate dominated in both endophytic and phyllosphere group, nor host-specific isolate found in the four rice varieties. Key words: BLAST, endophytic bacteria, 16S rDNA, sequence PENDAHULUAN Bakteri endofit didefinisikan sebagai bakteri yang terdapat di permukaan dan di dalam jaringan tumbuhan, yang bersifat tidak berbahaya bagi tumbuhan (Mano and Morisaki, 2008). Bakteri endofit diduga berasal dari lingkungan luar tumbuhan dan kemudian masuk ke dalam jaringan tumbuhan melalui stomata, lentisel, luka, daerah pemunculan tunas akar lateral dan tunas perkecambahan (Huang, 1986). Di dalam jaringan tumbuhan biasanya bakteri endofit akan berkoloni pada daerah ruang interseluler dan sistem vaskular (Hallman et al, 1997). Beberapa bakteri endofit telah diketahui bermanfaat bagi tumbuhan yang ditumpanginya melalui sebuah interaksi berupa hubungan saling ketergantungan yang bersifat mutualisme. Beberapa bakteri endofit telah diketahui bermanfaat dalam menunjang pertumbuhan tumbuhan misalnya sebagai biofertiliser dengan cara bersimbiosa dengan tanaman padi dalam penambatan nitrogen, produsen senyawa antibiotik dan antifungi (Strobel and Daisy, 2003), dan produsen regulator pemacu tumbuh seperti etilen, auksin, dan sitokinin (Kloepper et al, 1991; Hoflich et al., 1994). Bakteri endofit pada tanaman padi memiliki gen fungsional yang diduga terkait dengan penyebarannya di dalam jaringan tanaman. (Mano and Morisaki, 2008). Eksplorasi terhadap bakteri endofit yang bermanfaat dapat dilakukan pada tumbuhan yang memiliki keunikan dalam beberapa hal seperti kemampuan tumbuh pada suatu kondisi lingkungan tertentu, strategi pertahanan terhadap hama/penyakit, sejarah etnobotani dan pemanfaatannya oleh masyarakat, dan keberadaannya sebagai tumbuhan endemik ataupun tumbuhan yang berasal dari daerah dengan keragaman biodiversitas yang tinggi (Strobel and Daisy, 2003). Untuk menjembatani pemanfaatan kultur hasil eksplorasi diperlukan studi lanjutan yang meliputi berbagai tahapan karakterisasi secara morfologi, 'Diterima: 01 Mi 2010 - Disetujui: 16 Nopember 2010 455 Hidayatun, Susilowati dan Mulya - Identjfikasi Isolat Bakteri Endofitik dan Filosfer Padi dengan Analisis Sekuen 16S rDNA fisiologi, biokimia hingga tingkat molekuler. Karakterisasi pada tingkat molekuler dapat dilakukan dengan mengamati profil gen 16s rDNA (Weidner et al, 1996). Berdasarkan sekuen DNA-nya dapat diduga identitifikasi dan direkonstruksi pohon filogenetik yang akan mengelompokkan bakteri berdasarkan jarak kekerabatannya. Penggunaan sekuen 16S rDNA untuk identifikasi dan studi kerabatan telah banyak dilakukan (Drancourt et al, 2000; Wesburg et al, 1991). Saat ini telah tersedia piranti program untuk mengelompokkan dan mengetahui identitas suatu isolat misalnya program BLAST {Basic Local Alignment Search Tool) yang merupakan program penjajaran sekuens (sequence alignment) yang digunakan untuk membandingkan sekuens informasi biologi. Bermacam kegunaan dalam riset gen telah dibuat berdasarkan program tersebut misalnya identifikasi spesies, membuat pohon filogeni, memetakan DNA, pembandingan, dan melokasikan domains (Soendoro, 2010). Sebanyak 155 isolat bakteri telah diisolasi dari bagian batang, daun, dan akar tanaman padi dari varietas Cirata, Limboto, Code dan IR64 dari pertanaman padi di daerah Cikembar, Sukabumi, Jawa Barat pada tahun 2004. Beberapa isolat merupakan isolat endofitik tanaman padi setelah dilakukan pengujian autentifikasi terhadap koleksi ini di rumah kaca dengan tanaman inang yang sama (Mulya et al., 2004). Cirata merupakan varietas lokal yang peka terhadap Pyricularia grissea penyebab penyakit bias; Limboto merupakan varietas lokal tahan terhadap fungi tersebut; Varietas Code adalah turunan IR64 yang tahan terhadap bakteri Xanthomonas oryzae penyebab penyakit Hawar Daun Bakteri (HDB); sedangkan varietas IR64 sendiri bersifat peka (Lesmana et al, 2003). Studi lanjutan terhadap isolat bakteri endofit dan filosfer yang meliputi karakterisasi morfologi dan fisiologi telah dilakukan. Beberapa isolat bakteri menunjukkan karakter sebagai penambat N2 dan antifungi (Mulya et al, 2004; Susilowati et al, 2006). Penelitian ini dilakukan sebagai tahapan lanjutan untuk karakterisasi molekular bakteri endofit tanaman padi yang dilakukan dengan pendekatan teknik sekuensing terhadap gen 16S rDNA. Melalui penelitian ini diharapkan dapat diperoleh informasi mengenai jenis- 456 jenis bakteri endofit pada tanaman padi Indonesia. BAHANDANMETODE Penelitian dilakukan di Laboratorium Mikrobiologi dan Laboratorium Terpadu Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian-Badan Penelitian dan Pengembangan Pertanian (BB Biogen) pada tahun 2006. Bahan penelitian adalah beberapa isolat bakteri endofit dan filosfer koleksi BB Biogen. Isolat-isolat tersebut merupakan bakteri yang diisolasi dari tanaman padi varietas IR64, Cirata, Limboto, dan Code yang telah diautentifikasi untuk mengkonfirmasi kembali keterkaitan asal bakteri dengan tanaman inangnya (Mulya et al, 2004). Primer yang digunakan adalah 63F (CAGGCCTAACACATGCAAGTC), 1387-R (GGGCGGCGTGTACAAGGCC) dari lnvitrogen dan bahan-bahan pendukung lain. Tahapan kerja meliputi kegiatan isolasi dan amplifikasi gen 16S rDNA, purifikasi produk PCR, sekuensing, presipitasi, deteksi sekuen, dan analisis sekuen . Isolasi dan Amplifikasi Gen 16S rDNA Isolasi DNA bakteri dilakukan dengan protokol dari Lazo et al. (1997) yang diawali dengan tahap pembiakan pada media cair King's B dan proses ekstraksi dengan bufer STE, SDS 10% dan proteinaseK (Susilowati et al., 2006). Amplifikasi DNA/ Polymerase Chain Reaction (PCR) dilakukan pada mesin PCR DNA Engine Tetrad® 2 Peltier Thermal Cycler MJ Research. Sebanyak 2 ul DNA genom bakteri konsentrasi 10-20 ng/ul dicampurkan dalam larutan komponen PCR yang terdiri diri: 2,5 ul 1 Ox bufer PCR, 1,50 ul25 mM MgCL,, 0,50 ul 10 mMdNTP, masingmasing 0,50 ul 10 mM primer Forward dan Reverse, dan 0,20 ul enzim Taq DNApolimerase dengan pelarut air deionisasi hingga volume total menjadi 25 ul. PCR dijalankan dengan profil sebagai berikut: predenaturasi pada suhu 94°C selama 2 menit, diikuti dengan 30 siklus tahapan dari denaturasi pada suhu 94°C Selama 30 detik, penempelan primer (annealing) dengan variasi suhu 50°C dan 55°C selama 30 detik, polimerasi pada suhu 72°C selama 1 menit. Pada siklus terakhir waktu polimerasi diperpanjang menjadi 7 menit dan pada tahap terakhir dilakukan penurunan suhu ke 4°C untuk menghentikan reaksi PCR (Rodiyah, 20Q3). Berita Biologi 10(4) - April 2011 Tabel 1. Hasil identifikasi bakteri endofit berdasarkan hasil penyejajaran data sekuen DNA dengan program BLAST No Kode Isolat Tanaman inang Karakter * Sifat Gram* Panjang nukleotida 1 Endo-20 Cirata - Negatif 2 Endo-26 Cirata Antifungi 3 Endo-40 Cirata 4 Endo-41 5 Endo-42 6 Endo-47 Cirata 7 Endo-51 Cirata 8 Endo-63 Cirata 98 Endo-65 Limboto 10 Endo-68 11 12 Spesies referen terdekat Tingkat homologi 661 Pseudomonasfulva 97 Negatif 893 Serratia marcescens 95 - Negatif 953 Sen alia sp. 96 Cirata - Positif 886 Staphylococcus sp. 96 Cirata - Positif 698 Staphylococcus sp. 96 - Negatif 586 Serratia Marcescens 98 - Positif 688 Bacillus cereus 98 Antifungi Positif 757 Microbacterium sp. 78 Positif 863 Bacillus subtilis 97 Limboto Penambat N2 dan Antifungi - Positif 835 Microbacteriaceae 98 Endo-69 Limboto Antifungi Positif 828 Microbacteriaceae 95 Endo 76 Limboto Antifungi Positif 948 Staphylococcus sp. 95 13 Endo-79 Limboto Antifungi Positif 505 Staphylococcus sp. 78 14 Endo-89 Limboto Penambat N2 Positif 659 Staphylococcus sp. 96 15 Endo-91 Limboto Penambat N2 dan Antifungi Negatif 861 Pseudomonas syringae 92 16 Endo-105 Limboto Negatif 753 Klebsiella sp. 97 17 Endo-107 Limboto Penambat N2 Negatif 518 Acidovorax sp. 91 18 Endo-127 Limboto Penambat N2 Negatif 760 Burkholderiaceae 97 692 Bacillus subtilis 94 Agrobacterium larryymoorei 96 19 Endo-128 Limboto Positif 20 Endo-135 Code Negatif 716 21 Endo-136 Code Positif 866 Bacillus sp. 95 900 930 Serratia marcescens Serratia marcescens 96 96 23 Endo-147 Filo-10 IR64 IR64 Penambat N2 Penambat N2 Negatif Negatif 24 Filo-20 Limboto Penambat N2 Negatif 678 Enterobacter sp. 96 541 Pseudomonas sp. 85 636 Enterobacter sp. 98 22 25 Filo-22 Limboto Penambat N2 Negatif 26 Filo-44 Limboto Penambat N2 Negatif •Karakter diperoleh dari laporan hasil penelitian (Mulya et al., 2004 dan Susilowati et al., 2006). Purifikasi Produk PCR Purifikasi produk PCR dilakukan untuk menghilangkan residu primer atau dNTP dari produk PCR 16s ribosomal DNA yang berpotensi menghasilkan produk-produk yang tidak spesifik. Proses ini dilakukan dengan menginkubasikan produk PCR dalam larutan Shrimp Alkaline Phosphatase (SAP) dan Exonucleasel (Exol) dengan perbandingan2 unit SAP : 1 unit exol untuk 6ul produk PCR. Inkubasi dilakukan jrada suhu 37°C selama 1 jam, yang dilanjutkan dengan inaktivasi enzim pada suhu 80°C selama 15 menit dan 4°C untuk penyimpanan reaksi yang sudah murni. Pengecekan di agarosa dilakukan untuk memastikan bahwa produk PCR masih ada dan sudah murni yang ditunjukkan oleh tidak adanya fragmen lain. Reaksi Sekuensing dengan Kit DTCS (Dye Terminator Cycle Sequencing) Reaksi sekuensing dilakukan dengan formula 8,3 ul dH20,6 ul template DNA, 1,7 ul primer tunggal (63-F) dan 4 ul DTCS mix. Program sekuensing dilakukan dengan kondisi sebanyak 44 siklus yang terdiri atas suhu 96°C selama 20 detik, 50°C selama 20 detik, dan 60°C selama 4 menit dan kemudian dilanjutkan dengan satu tahap pada suhu 4°C selama 1 jam. 457 Hidayatun, Susilowati dan Mulya - Identifikasi Isolat Bakteri Endofitik dan Filosfer Padi dengan Analisis Sekuen 16S rDNA Endo 107 Ends 63 Endo 79 Gambar 1. Kontruksi pohon filogenetik dari isolat bakteri endofit dan filosfer. Presipitasi ethanol Pencucian diawali dengan menambahkan 2 ul 3M NaOAc, 2 ul 100 mM EDTA dan 1 ul glikogen pada produk sekuensing. Larutan dicampur dan ditambah 60 ul95% etanol dingin (-20°C), divorteks, kemudian disentrifugasi pada kecepatan 4100 rpm pada suhu 4°C selama 10 menit. Kemudian supernatan dibuang dan pada presipitat ditambahkan 200 ul etanol 70% dingin (-20°C) dan disentrifugasi selama 3 menit. Proses pencucian ini dilakukan dua kali dan kemudian hasil pencucian terakhir dikering anginkan. Deteksi sekuen Deteksi hasil sekuensing dilakukan dengan menambahkan 40 SLS sebagai pelarut. Proses deteksi sekuen dilakukan dengan elektroforesis kapiler pada mesin sequencer CEQ 8000 Genetic Analyser dari Beckman. Analisis Hasil Keluaran dari proses sekuensing adalah berupa sekuen urutan basa nukleotida. Hasil sekuen kemudian disejajarkan dengan data GenBank menggunakan program BLAST-N {Basic Local Alignment Search Tool-Nucleotida) untuk mengetahui kemiripan spesies dari isolat yang diuji. Program untuk analisis ini tersedia secara online dari situs NCBI {National Center for Biotechnology Information). Hubungan kekerabatan antar isolat dianalisis berdasarkan kontruksi pohon filogeninya. Sekuen DNA isolat disejajarkan dengan 458 menggunakan program multiple sequences alignment ClustalW2 dari European Bioinformatics Institute (EBI), dan pohon filogenetik dibuat dengan menggunakan program TreeCon. HASIL Identitas isolat Hasil deteksi sekuen 16S rDNA mempunyai kisaran panjang dari 505 sampai 953 basa nukleotida. Hasil analisis kesejajaran sekuen 16S rDNA dengan sekuen database yang dilakukan dengan program BLAST dari NCBI menunjukkan kemiripan dengan berbagai macam species bakteri dengan berbagai tingkat kemiripan. Sebanyak4 isolat terdeteksi sebagai Serratia, 5 isolat Staphyllococcus, 4 isolat Bacillus, 3 Pseudomonas, 3 Microbacterium, 2 Enterobacter dan masing-masing satu isolat teridentifikasi sebagai Klebsiella sp., Acidovorak sp., Burkholderiaceae, Agrobacterium larrymoorei dan Methilococcus capsulatus (Tabel 1). Hubungan kekerabatan antarisolat Pohon filogenetik mengelompokkan isolat yang diteliti dalam beberapa klaster. Tidak ada kecenderungan pengelompokan isolat berdasarkan pada varietas tanaman inangnya. Klaster-klaster yang terbentuk menunjukkan kekhususan pada sifat Gram isolat dan identitasnya. Isolat yang bersifat gram positif membentuk tiga klaster yaitu klaster Staphylococcus, Berita Biologi 10(4) - April 2011 klaster Bacillus dan klaster Microbacteriaceae; sedangkan isolat yang bersifat Gram negatif membentuk klaster Serratia dan klaster Pseudomonas (Gambarl.) PEMBAHASAN Terdapat kesamaan identitas dua strain bakteri yang diisolasi dari dalam jaringan tanaman (endofit) dan yang diisolasi dari daun (filosfer) yaitu Serratia dan Pseudomonas yang ditemukan pada kedua lokasi jaringan tersebut. Kesamaan jenis mikroba pada jaringan tubuh yang berbeda adalah hal yang biasa. Beberapa bakteri endofit yang terdeteksi di dalam akar, biji dan daun juga ditemukan di lingkungan sekitarnya. Mano et al. (2007) yang mengamati flora endofit dan permukaan pada biji dan daun padi di sawah menemukan bahwa beberapa bakteri endofit yang tinggal di dalam biji dan daun juga ditemukan pada permukaan kedua lokasi tersebut. Diduga sangat mungkin terjadi perpindahan dari masing-masing bagian tanaman tersebut. Sebagaimana dikemukakan oleh Di Fiori and Del Gallo (1995) bahwa kebanyakan bakteri endofitik yang berhasil diisolasi dari jaringan tumbuhan bersifat endofitik fakultatif dan mampu berada di bagian luar jaringan tumbuhan sebagai bakteri rhizosfer. Hal lain yang dapat dikemukakan berdasarkan Tabel 1 adalah bahwa tanaman padi baik varietas Limboto, Code, Limboto dan IR64 ternyata secara simultan dapat dikolonisasi oleh beragam jenis bakteri endofit yang berkisar dari bakteri gram positif dan gram negatif. Tanaman padi merupakan mikroekosistem yang kompleks sehingga beragam jenis mikroba dapat ditemukan berinteraksi dan berada dalam keadaan keseimbangan (ekuilibrium), walaupun beberapa jenis tetap menjadi spesies yang dominan dan beberapa lainnya sebagai spesies yang jarang (Van Peer et al., 1990). Fenomena ini didapati oleh Gardner et al. (1982), yang melakukan identifikasi bakteri yang berada di dalam cairan xylem dari akar tanaman jeruk lemon Florida. Diantara 13 jenis yang ditemukan, jenis yang paling sering ditemukan atau disebut sebagai spesies dominan adalah Pseudomonas (40%) dan Enterobacter (18%); sedangkan jenis lainnya hanyalah spesies yang jarang. Kestabilan biodiversitas inilah yang dipertimbangkan sebagai kondisi yang paling penting untuk keberlanjutan suatu ekosistem. Empat isolat endofit (Endo-26, Endo-40, Endo 47, Endo-147) dan satu isolat Filosfer (Filo-10) teridentifikasi sebagai Serratia. Keberadaan dan fungsi Serratia pada pertanaman padi telah disebutkan pada beberapa penelitian. Gyaneshwar et al. (2001) yang mengisolasi bakteri diazotrofik dari akar dan batang beberapa varietas padi juga menemukan bakteri yang teridentifikasi sebagai Serratia marcescens; sementara Someya et al. (2002) memiliki strain Serratia yang mampu mengontrol penyakit blast yang disebabkan oleh Pyricularia orizae. Keempat isolat Serratia yang yang terdeteksi dalam penelitian ini diperoleh dari tanaman varietas padi yang peka terhadap patogen blast dan hawar daun bakteri (HDB). Dua isolat hasil isolasi dari IR64 memiliki kapasitas penambatan terhadap N2 dan satu isolat dari padi varietas Cirata memiliki aktivitas antifungi. Cirata diketahui merupakan tanaman yang peka terhadap penyakit bias dan IR 64 peka terhadap HDB. Dimungkinkan bahwa isolat yang teridentifikasi sebagai Serratia dalam penelitian ini merupakan strain yang berbeda. Empat isolat bakteri endofit teridentifikasi sebagai Bacillus. Kelompok Bacillus yang hidup di dalam jaringan tanaman padi diketahui cukup bervariasi dan tersebar luas dalam berbagai bagian jaringan tanaman seperti biji, daun, batang dan akar (Mano et al., 2007). Diketahui bahwa banyak isolat kelompok Bacillus yang mempunyai efek biologis terhadap beberapa jenis pathogen tanaman. Isolat Endo-65 yang memiliki kemampuan sebagai penambat N2 dan antifungi teridentifikasi sebagai Bacillus subtilis. Isolat ini sebelumnya juga telah teridentifikasi sebagai bakteri kelompok Bacillus berdasarkan karakter morfologi, fisiologi dan biokimianya (Susilowati et al., 2005). Isolat ini diperoleh dari tanaman inang padi varietas Limboto yang bersifat tahan terhadap penyakit bias. Perlu penelitian lebih lanjut untuk mengetahui apakah sifat ketahanan ini terkait dengan simbiosa tanaman ini dengan isolat Endo-65 ataukah terkait oleh mekanisme yang lain. Sebanyak lima isolat endofit teridentifikasi sebagai Staphylococcus. Bakteri kelompok Firmicutes 459 Hidayatun, Susilowati dart Mulya - Identifikasi Isolat Bakteri Endofitik dan Filosfer Padi dengan Analisis Sekuen 16S rDNA ini telah dilaporkan ditemukan pada isolat yang berasal dari bagian permukaan dan di dalam padi gilingan melalui metode non kultur (Huang 1986 dalam Mano dan Morisaki, 2008). Satu dari lima isolat ini memiliki kapasitas antifungi dan dua isolat merupakan penambat Nr Beberapa isolat lain teridentifikasi dekat dengan Pseudomonas, Microbacterium, Acidovorax, Klebsiella, Bulkholderiaceae, Agrobacterium dan Methilococcus capsulatus. Jenis-jenis bakteri ini juga telah dilaporkan keberadaannya pada tanaman padi (Mano and Morisaki, 2008). Isolat Endo-63 dan Endo69 yang memiliki potensi sebagai antifungi teridentifikasi sebagai Microbacteriaceae. Pohon filogenetik memberikan hasil yang mendukung analisis BLAST. Pengelompokan terjadi berdasarkan identitas dan sifat bakteri dan tidak ditemukan adanya pengelompokan isolat berdasarkan varietas tanaman inangnya. Bakteri gram positif dan Gram negatif terpisah dalam dua klaster besar. Dalam masing-masing klaster tersebut kemudian terbentuk sub-sub klaster yang lebih spesifik seperti sub-klaster Staphylococcus, Bacillus dan Microbacteriaceae dari kelompok bakteri gram positif, dan sub-klaster Pseudomonas dan Serratia dari kelompok bakteri gram negatif. Tidak ditemukan suatu isolat yang spesifik pada tanaman inang (varietas padi) tertentu. Beberapa isolat antifungi ditemukan pada tanaman yang peka terhadap patogen yang disebabkan oleh fungi dan tidak ditemukan pada tanaman yang tahan. Hal ini dimungkinkan oleh karena gen fungsional bakteri ini berkaitan dengan distribusinya di dalam jaringan tanaman (Mano dan Morisaki, 2008). Selain itu keragaman jenis isolat pada beberapa bagian tanaman juga mengalami perubahan pada stadia pertumbuhan yang berbeda, sehingga untuk mengetahui peran fungsional dari isolat diperlukan eksplorasi jenis-jenis isolat endofit pada berbagai stadia pertumbuhan (Mano et al., 2007). KESIMPULAN Bakteri endofit dan filosfer pada tanaman padi varietas IR64, Cirata, Limboto dan Code teridentifikasi sebagai bakteri kelompok Staphylococcus dan Serratia (5 isolat), Bacillus (4 isolat), Microbacteria (2 isolat), 460 Pseudomonas (3 isolat), Enterobacter (2 isolat) dan Klebsiella, Acidovorak, Bulkholderiaceae, dan Agrobacterium (masing-masing 1 isolat). Tidak ditemukan kekhasan antara varietas padi dan isolat yang ditemukan di dalamnya. SARAN Jenis-jenis bakteri yang diteliti diketahui bermanfaat bagi tumbuhan. Akan tetapi untuk mengetahui manfaatnya secara lengkap dibutuhkan studi lanjut yang lebih mendalam. UCAPANTERIMAKASIH Penelitian ini merupakan bagian dari Proyek Penelitian yang dibiayai dengan sumber dana DIPA APBN TA 2006 Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian (No. DIPA 503 8.0460 A1). Penanggung jawab Dwi Ningsih Susilowati, M.Si. Penulis mengucapkan terima kasih kepada Siti Aminah atas bantuannya dalam penyelesaian kegiatan ini. DAFTARPUSTAKA Di Fiori S and M Del Gallo. 1995. Endophytic bacteria: their possible role in the host plant. In: Azospirillum VI and Related Microorganisms. I Fendrik, M Del Gallo, J Vanderleyden and M de Zamaroczy (Eds.). Springer-Verlag, Berlin. Drancoutr M, C Boiler, A Carlioz, R Martelin, JP Gayral and D Raoult. 2000. 16S ribosomal DNA sequence analysis of a large collection of environmental and clinical unidentifiable bacterial isolates. Journal of Clinical Microbiology 38(10), 3623-30. Gardner JM, AW Feldman and DH Stamper. 1983. Role and fate of bacteria in vascular occlusion of citrus. Physiological Plant Pathology 23, 295-303. Gyaneshwar P, EK James, N Mathan, PM Reddy, B Reinbold-Hurek and J Ladha. 2001. Endophytic colonization of rice by a diazotrophic strain of Serratia marcescens. Journal of Bacteriology. 183, 2634-2645. Hallman J, AQ Hallman, WF Mahaffee and JW Kloeper. 1997. Bacterialendophytes in agricultural crops. Canadian Journal of Microbiology 43(10), 895-914. Hoflich G, W Wiehe and G Kihn. 1994 Plant growth stimulation by inoculation with symbiotic and associative rhizosphere mechanisms. Experientia 50, 897-905. Huang JS. 1986. Ultrastructure of bacterial penetration in plants. Annual Review of Phytopatology 24, 141- 57. Kloepper JW, EM Tipping and R Lifshitz. 1991. Plant growth promotion mediated by bacteria] rhizosphere colonizers. In: The Rhizosphere and Plant Growth, 315-326. DL Keister and PB Cregan (Eds.). Kluwer Academic Publishers, Dordrecht, The Netherlands. Lazo GR, R Roffey and DW Gabriel. 1987. Conservation Berita Biologi 10(4) - April 2011 of plasmid DNA sequences and pathovar identification of strains of Xanthomonas campestris. Phytopathology 77, 448-453. Lesmana OS, HM Toha dan I Las. 2003. Deskripsi Varietas Unggul Baru Padi. Balai Penelitian Tanaman Padi, Sukamandi. Mano H and H Morisaki. 2008. Minireview: Endophytic bacteria in the rice plant. Microbes and Environments 23, 109-117. Mano H, F Tanaka, C Nakamura, H Kaga and H Morisaki. 2007. Cultivable endophytic bacterial flora of the maturing leaves and roots of rice plants (Oryza saliva) cultivated in a paddy field. Microbes and Environments 22, 175-185. Mulya K, DN Susilowati, A Akhdiya, I Manzila, H Purwanti, RD Hastuti, D Wahyuno, D Manohara, H Kurniawan, N. Azizah, S Soedjono dan Simanungkalit. 2004. Konservasi dan Karakterisasi Genetik Mikroba Pertanian. Laporan Hasil Penelitian. Balai Besar penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian, Bogor. Rodiyah. 2003. Distribusi dan Diversitas Genetik Bakteri Diazotrof Endofitik pada Tebu (Saccharum qfficinarum L). Tesis. Program Pasca Sarjana UGM, Yogyakarta. Soendoro D. 2010. Dynammic programming dalam menentukan arti urutan untaian gen IF3051 strategi algoritmik Tahun 2009/2010. Makalah. Program Studi Teknik Informatika, Sekolah Teknik Elektro dan Informatika, Institut Teknologi Bandung. Someya N, M Nakajima, T Hibi, I Yamaguci and K Akutsu. 2002. Induced resistance to rice blast by antagonistic bacterium Serratia marcescens Strain B2. General Plant Pathology 68, 177-182. Strobel G and B Daisy. 2003. Bioprospecting for microbial endophytes and their natural products. Microbiology and Molecular Biology Reviews 67 (4), 491-502. Susilowati DN, K Mulya, N Azizah, H Purwanti, A Suhendar, I Manzila, RD Hastuti, D Wahyuno, D Manohara, N Hidayatun, S Salma, Nurichana, S Soedjono, R Saraswati dan K Herlina. 2005. Konservasi dan Karakterisasi Mikroba Pertanian. Laporan Hasil Penelitian. Balai Besar penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian, Bogor. Susilowati DN, A Akhdiya, K Mulya, E Pratiwi, H Purwanti, A Suhendar, I Manzila, RD Hastuti, D Wahyuno, D Manohara, N Hidayatun, S Salma, Nurichana, S Soedjono, R Saraswati dan K Herlina. 2006. Konservasi dan Karakterisasi Mikroba Pertanian. Laporan Hasil Penelitian. Balai Besar penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian, Bogor. Van Peer R, HLM Punte, LA De Wega and B Schippers. 1990. Characterization of root surface and endorhizosphere Pseudomonads in relation to their colonization of roots. Applied and Environmental Microbiology 56, 2462-2470. Weidner S, W Arnold and A Pukle. 1996. Diversity of uncultured microorganisms associated with the seagrass Halophila stipulacea estimated by retriction fragmenth length polymorphim analysis of gen encoding 16S rRNA and 23S rRNA intergenic spacers, repetitive extragenic palindromic PCR genomic finger printing and partial 16S rRNA sequencing. Applied and Environmental Microbiology 64, 2096-2104. Wiesburg WG, SM Barns, DA Pelletier and DJ Lane. 1991. 16S ribosomal DNA amplification for phylogenetic study. Journal of bacteriology, 173(2), 697-703. 461