8 BAB II TINJAUAN PUSTAKA A. Ciri-ciri Salmonella sp. Gambar 1
advertisement

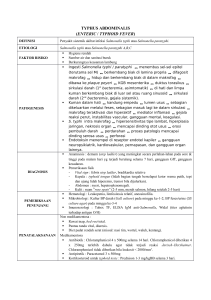
BAB II TINJAUAN PUSTAKA A. Ciri-ciri Salmonella sp. Gambar 1. Mikroskopis kuman Salmonella www.Mikrobiologi Lab.com) sp. (http//. Salmonella sp. adalah bakteri batang lurus, gram negatif, tidak berspora, bergerak dengan flagel peritrik, berukuran 2-4 µm x 0.5-0,8 µm. Salmonella sp. tumbuh cepat dalam media yang sederhana (Jawet’z, dkk, 2005), hampir tidak pernah memfermentasi laktosa dan sukrosa, membentuk asam dan kadang gas dari glukosa dan manosa, biasanya memporoduksi hidrogen sulfide atau H2S, pada biakan agar koloninya besar bergaris tengah 2-8milimeter, bulat agak cembung, jernih, smooth, pada media BAP tidak menyebabkan hemolisis, pada media Mac Concey koloni Salmonella sp. Tidak memfermentasi laktosa (NLF), konsistensinya smooth (WHO, 2003) Salmonella sp. tahan hidup dalam air yang dibekukan dalam waktu yang lama, bakteri ini resisten terhadap bahan kimia tertentu 85 (misalnya hijau brillian, sodium tetrathionat, sodium deoxycholate) yang menghambat pertumbuhan bakteri enterik lain, tetapi senyawa tersebut berguna untuk ditambahkan pada media isolasi Salmonella sp. pada sampel feses. Klasifikasi kuman Salmonella sp. sangat kompleks, biasanya diklasifikasikan menurut dasar reaksi biokimia, serotipe yang diidentifikasi menurut struktur antigen O, H dan Vi yang spesifik (Jawet’z, dkk, 2005 ; Bennasar, A., et al, 2000), menurut reaksi biokimianya, Salmonella sp. dapat diklasifikasikan menjadi tiga spesies yaitu S. typhi, S. enteritidis, S. cholerasuis, disebut bagan kauffman-white (Irianto, 2006). Berdasarkan serotipenya di klasifikasikan menjadi empat serotipe yaitu S. paratyphi A (Serotipe group A), S. paratyphi B (Serotipe group B), S. paratyphi C (Serotipe group ), dan S. typhi dari Serotipe group D (Jawet’z, 2005). Perbedaan karakteristik dari masing-masing spesies Salmonella sp. berdasarkan sifat-sifat biokimianya dapat dilihat pada tabel 1 sebagai berikut: 8 6 Tabel 1. Perbedaan Karakteristik Salmonella sp. No Sifat Biokimia 1. 2. 3. 4. 5. 6. 7. Indol MR Vp Citrat Motilitas Urease TSIA 8. 9. 11. Glukosa Laktosa Sukrosa Salmonella typhi + + K/A G (-), H2S (+) A, G (-) - Salmonella paratyphi A + + K/A G (+), H2S (-) A, G (+) - Salmonella paratyphi B + + + K/A G (+), H2S (+) A, G (+) - Salmonella paratyphi C + + K/A G (+), H2S (+) A, G (+) - (WHO, 2003). B. Patogenesis S. typhi, S. paratyphi A, B dan C merupakan penyebab infeksi utama pada manusia, bakteri ini selalu masuk melalui jalan oral, biasanya dengan cara mengkontaminasi makanan dan minuman. Diantara faktorfaktor yang dapat mempengaruhi ketahanan tubuh terhadap infeksi Salmonella sp adalah keasaman lambung, flora normal dalam usus dan ketahanan usus lokal (Jawet’z, 2005). C. Cara Penularan Pola penyebaran penyakit ini adalah melalui saluran cerna (mulut, esofagus, lambung, usus 12 jari, usus halus, usus besar). S typhi, paratyphi A, B, dan C masuk ke tubuh manusia bersama bahan makanan atau minuman yang tercemar (Fathiariani, 2009). Saat kuman masuk ke saluran pencernaan manusia, sebagian kuman mati oleh asam lambung dan sebagian kuman masuk ke usus halus. Dari usus halus kuman 87 beraksi sehingga bisa ” menjebol” usus halus. Setelah berhasil melampaui usus halus, kuman masuk ke kelenjar getah bening, ke pembuluh darah, dan ke seluruh tubuh (terutama pada organ hati, empedu, dan lain-lain). Sehingga feses dan urin penderita bisa mengandung kuman S. typhi, S. paratyphi A, B dan C yang siap menginfeksi manusia lain melalui makanan atau minuman yang tercemari. Pada penderita yang tergolong carrier kuman Salmonella bisa ada terus menerus di feses dan urin sampai bertahun-tahun (Widianto, 2009). Setelah memasuki dinding usus halus, S. typhi, S. paratyphi A, B dan C mulai melakukan penyerangan melalui system limfa ke limfa yang menyebabkan pembengkakan pada urat dan setelah satu periode perkembangbiakan bakteri tersebut kemudian menyerang aliran darah. Aliran darah yang membawa bakteri juga akan menyerang liver, kantong empedu, limfa, ginjal, dan sumsum tulang dimana bakteri ini kemudian berkembangbiak dan menyebabkan infeksi organ-organ ini. Melalui organ-organ yang telah terinfeksi inilah mereka terus menyerang aliran darah yang menyebabkan bakteremia sekunder. Bakteremia sekunder ini bertanggung jawab sebagai penyebab terjadinya demam dan penyakit klinis (Wardani, 2008). D. Demam Tipoid Demam tipoid atau typhoid fever, atau thypus abdominalis, merupakan suatu penyakit yang disebabkan oleh infeksi S. typhi. Demam 8 tifoid merupakan masalah kesehatan utama di negara berkembang, tidak hanya karena insiden dan angka kematiannya yang tinggi, tetapi juga karena waktu yang diperlukan agar penderita " fully recover " dapat berbulan-bulan (Sjahrurachman, A., 2009). Demam tipoid juga merupakan penyakit masyarakat dengan standar hidup dan kebersihan rendah, cenderung meningkat dan terjadi secara endemis. Biasanya angka kejadian tinggi pada daerah tropik. Sumber penularan penyakit demam tifoid adalah penderita yang aktif, penderita dalam fase konvalesen, dan kronik karier. Demam Tifoid atau typhus abdominalis, typhoid fever atau enterik fever adalah penyakit sistemik yang akut yang mempunyai karakteritik demam, sakit kepala dan ketidakenakan abdomen berlangsung lebih kurang 3 minggu yang juga disertai gejala-gejala perut pembesaran limpa dan erupsi kulit. Demam tifoid (termasuk para-tifoid) dsebabkan oleh kuman Salmonella typhi, S paratyphi A, B dan C (Purwanto, 2009). E. Metode Pemeriksaan Demam Tipoid 1. Kultur Gal Diagnosis pasti penyakit demam tipoid yaitu dengan melakukan isolasi bakteri Salmonella typhi, paratyphi A, B dan C dari spesimen yang berasal dari darah, feses, dan urin penderita demam tipoid. 8 9 Pengambilan spesimen darah sebaiknya dilakukan pada minggu pertama timbulnya penyakit, karena kemungkinan untuk positif mencapai 80-90%, khususnya pada pasien yang belum mendapat terapi antibiotik. Pada minggu ke-3 kemungkinan untuk positif menjadi 20-25% dan minggu ke-4 hanya 10-15%. 2. Widal Penentuan kadar aglutinasi antibodi terhadap antigen O dan H dalam darah (antigen O muncul pada hari ke 6-8, dan antibodi H muncul pada hari ke 10-12). Pemeriksaan Widal memberikan hasil negatif sampai 30% dari sampel biakan positif penyakit tifus, sehingga hasil tes Widal negatif bukan berarti dapat dipastikan tidak terjadi infeksi. Pemeriksaan tunggal penyakit tifus dengan tes Widal kurang baik karena akan memberikan hasil positif bila terjadi: infeksi berulang karena bakteri Salmonella sp., imunisasi penyakit tifus sebelumnya, Infeksi lainnya seperti malaria dan lain-lain. 3. TubexRTF Pemeriksaan Anti S. typhi IgM dengan reagen TubexRTF sebagai solusi pemeriksaan yang sensitif, spesifik, praktis untuk mendeteksi penyebab demam akibat infeksi bakteri S. typhi Pemeriksaan Anti S. typhi IgM dengan reagen TubexRTF dilakukan untuk mendeteksi antibody terhadap antigen lipopolisakarida O9 yang sangat spesifik terhadap bakteri S. typhi. 8 10 Pemeriksaan ini sangat bermanfaat untuk deteksi infeksi akut lebih dini dan sensitive, karena antibodi IgM muncul paling awal yaitu setelah 3-4 hari terjadinya demam sensitivitasnya > 95% (Prasetyo, dkk, 2009). 4. Metode Enzyme-Linked Immunosorbent Assay (ELISA) Uji Enzyme-Linked Immunosorbent Assay (ELISA) dipakai untuk melacak antibodi IgG, IgM dan IgA terhadap antigen LPS O9, antibodi IgG terhadap antigen flagella d (Hd) dan antibodi terhadap antigen Vi S. typhi. Uji ELISA yang sering dipakai untuk mendeteksi adanya antigen S. typhi dalam spesimen klinis adalah double antibody sandwich ELISA. Chaicumpa dkk (1992) mendapatkan sensitivitas uji ini sebesar 95% pada sampel darah, 73% pada sampel feses dan 40% pada sampel sumsum tulang. 5. Pemeriksaan Dipstik Uji serologis dengan pemeriksaan dipstik dikembangkan di Belanda dimana dapat mendeteksi antibodi IgM spesifik terhadap antigen LPS S. typhi dengan menggunakan membran nitroselulosa yang mengandung antigen S. typhi sebagai pita pendeteksi dan antibodi IgM anti-human immobilized sebagai reagen kontrol. Metode ini mempunyai sensitivitas sebesar 63% bila dibandingkan dengan kultur darah (13.7%) dan uji Widal (35.6%). Kendala yang sering dihadapi pada penggunaan metode PCR ini meliputi risiko kontaminasi yang menyebabkan hasil positif palsu yang terjadi bila prosedur teknis tidak dilakukan secara 811 cermat, adanya bahan-bahan dalam spesimen yang bisa menghambat proses PCR antara lain hemoglobin dan heparin dalam spesimen darah serta bilirubin dan garam empedu dalam spesimen feses, biaya yang cukup tinggi dan teknis yang relatif rumit (Prasetyo, dkk., 2009). 12 8