Teori Dalton mengenai atom
advertisement

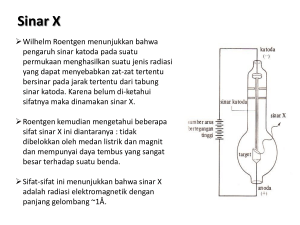
TEORI ATOM Awal Perkembangan Teori Atom Teori atom pada masa peradaban Yunani Demokritus, Epicurus, Strato, Carus Socrates, Plato, Aristoteles • Materi tersusun dari partikel yang sangat kecil yang tidak dapat dibagi lagi • Partikel yang merupakan bahan dasar penyusun materi itu disebut Atom • Materi dapat terbagi terus menerus tanpa batas • Keempat unsur alam (api, air, tanah, udara) memiliki bentuk struktur yang berbeda Hukum kekekalan massa Antoine Lavoisier (1743-1794) “Massa sebelum reaksi sama dengan massa sesudah reaksi” Yang terjadi pada reaksi kimia adalah penataan ulang susunan atom dalam senyawa Teori Dalton mengenai atom Atom tidak dapat dimusnahkan atau diciptakan selama reaksi kimia Pb2+ NO3- H2O IK+ Teori Dalton mengenai atom Semua atom dari suatu unsur yang sama mempunyai sifat dan massa yang sama Teori Dalton mengenai atom Atom dari suatu unsur yang berbeda memiliki massa dan sifat yang berbeda M awal= 2,156 g M akhir= 2,166 g Ar Cu = 63,5 Ar Fe = 56 SO42- Fe(s) + CuSO4(aq) → Cu(s) + FeSO4(aq) Cu H2O Fe Elektrolisis Air Henry Cavendish (1731-1810) Air terbentuk dari penggabungan dua unsur yang berbeda yaitu hidrogen dan oksigen dengan perbandingan 2:1 Hukum Perbandingan Tetap Joseph Proust (1754-1826) Senyawa-senyawa yang sama akan selalu mengandung unsur-unsur dengan perbandingan atom yang sama karbon monoksida karbon dioksida Hukum Perbandingan Berganda karbon monoksida karbon dioksida Misal : C1 = massa atom karbon pada gas karbon monoksida C2 = massa atom karbon pada gas karbon dioksida O1 = massa atom oksigen pada gas karbon monoksida O2 = massa atom oksigen pada gas karbon dioksida Jika : C1 = C2, berapakah perbandingan O1 dan O2? Jawab : C1 : O1 O1 : O2 C2 : O2 Maka, O1 : O2 = 1 : 2 1xO1 : 2xO1 Hukum Perbandingan Berganda John Dalton(1766-1844) Ketika dua unsur membentuk beberapa senyawa, perbedaan massa dari satu unsur yang bergabung dengan unsur lain yang memiliki massa yang sama memiliki perbandingan dengan kelipatan bilangan bulat sederhana karbon monoksida karbon dioksida Teori atom Dalton • Atom merupakan pertikel terkecil berbentuk bola pejal yang tidak bisa dibagi lagi dan tidak bisa dimusnahkan atau diciptakan selama perubahan kimia • Atom–atom dari unsur yang berlainan melakukan ikatan dengan perbandingan numerik yang sederhana • Semua atom dari suatu unsur yang sama mempunyai massa dan sifat yang sama dan atom dari suatu unsur yang berbeda memiliki massa dan sifat yang berbeda TEORI ATOM Penemuan Partikel-Partikel Sub-Atom Tabung Crookes • Tabung sinar katoda merupakan tabung yang divakumkan hingga berisi sedikit udara • Jika tabung Crookes dihubungkan dengan sumber arus searah tegangan tinggi maka katode akan memancarkan berkas sinar menuju anode. Sinar itu dinamakan sinar katode. katoda anoda layar pemendaran Sinar Katoda yang Memutar Baling-Baling Sinar katoda merupakan suatu partikel karena suatu benda Jika bahan katode diganti dengan logam lain, sinar katode Apakah sebenarnya Sinar Katoda itu dapat bergerak jika diberikan suatu gaya oleh benda? lain (Hk. yang dihasilkan selalu sinar katoda yang sama. Newton III) Kecenderungan Sinar Katoda Terhadap Medan Magnet Sinar Katoda merupakan partikel bermuatan karena terpengaruh oleh medan magnet Karena sinar katoda dapat tertarik oleh medan bermuatan positif dan APAKAH SINARbermuatan KATODA negatif, ITU MERUPAKAN ATOM?? ditolak oleh medan maka diketahui bahwa sinar katoda memiliki muatan negatif . Thomson menyebut partikel itu dengan sebutan elektron. APAKAH ATOM MEMILIKI MUATAN LISTRIK ?? • Karena atom merupakan partikel tak bermuatan (netral), maka atom harus mengandung muatan positif • Muatan positif tersebut akan menetralkan partikel elektron yang bermuatan negatif Penemuan Sinar Kanal, Eugene Goldstein (1850-1930) Jika tabung Crookes dengan katode berlubang diisi dengan gas hidrogen dan dihubungkan dengan sumber arus listrik, di bagian belakang katode yang dilubangi maka akan terbentuk berkas sinar. Menurut Wilhelm Wein (1864-1928), sinar kanal tiada lain adalah ion hidrogen. hidrogen elektron Ion hidrogen Oleh karena ion hidrogen hanya mengandung satu proton maka disimpulkan bahwa sinar positif adalah proton Goldstein menamakan sinar itu sebagai sinar kanal (Penggantian gas hidrogen oleh gas lain selalu dihasilkan sinar yang sama dengan sinar terusan yang dihasilkan oleh gas hidrogen) Model Atom Thomson Atom merupakan bola bermuatan positif yang pada tempat-tempat tertentu terdapat elektron yang bermuatan negatif. Bagaimana dengan pendapat Dalton mengenai konsep Atom?? Dengan ditemukanya elektron dan proton sebagai partikel penyusun atom (partikel Subatom), maka atom bukanlah partikel dasar penyusun materi. Penembakan Lempeng Tipis Emas dengan Sinar Alfa Penemuan Inti Atom Ernest Rutherford (1871-1937) Model Atom Rutherford Sebagian besar dari atom merupakan ruang kosong Dipusat inti atom terdapat pusat massa bermuatan positif (proton) yang dikelilingi oleh elektron-elektron yang bermuatan negatif Kelemahan Teori Atom Rutherford Massa Hidrogen Massa Helium Keterangan 1 2 Teori Rutherford 1 4 Kenyataan • Dari data perbandingan atom di atas, dapat disimpulkan bahwa ada partikel lain di dalam atom yang memiliki massa setara dengan proton. Partikel apakah itu? Penemuan Neutron James Chadwick, 1932 Penyempurnaan Model Atom Rutherford Selain proton yang bermuatan positif, inti atom mengandung partikel lain yang disebut neutron yang tak bermuatan dan memiliki massa setara massa proton. Neutron berada di dalam inti atom untuk membuat partikelMENGAPA NEUTRON BERADA DALAM INTI?? partikel proton yang bermuatan positif stabil di dalam inti, karena partikel-partikel yang memiliki jenis muatan yang sama akan tolak menolak jika didekatkan Penemuan Partikel-Partikel Sub-Atom • Partikel Sub-Atom adalah partikel-partikel penyusun atom • Partikel Sub-Atom – Elektron – Proton – Neutron TEORI ATOM Spektrum Atom Hidrogen Apakah yang akan terjadi bila ujung 2 buah magnet yang memiliki perbedaan muatan didekatkan? Ketika dua buah materi yang memiliki perbedaan muatan berdekatan maka kedua materi tersebut akan saling tarik menarik Apa yang akan terjadi pada elektron yang bermuatan negatif dan inti yang bermuatan positif? Menurut hukum fisika klasik, jika elektron yang bermuatan negatif bergerak melingkar (mengelilingi inti bermuatan positif) maka elektron akan kehilangan energinya sehingga gerakan elektron akan berkurang, yang akhirnya akan jatuh ke inti Coba kalian lihat materi yang ada di sekitar kalian!!! Atom merupakan suatu partikel yang Stabil Bagaimana keadaan materi di sekitar kalian itu?! stabil atau tidak stabil Kedudukan Elektron dalam Atom Bila melihat kenyataan yang ditemukan, seperti apakah struktur atom yang benar? • Neils Bohr pada tahun 1913 mencoba untuk menjawab pertanyaan di atas: Dalam mengelilingi inti atom, elektron berada pada kulit (orbit) tertentu Selama elektron berada pada lintasan stasioner tertentu, energi elektron tetap dan stabil sehingga tidak ada energi yang diemisikan atau diserap. Spektrum Atom Hidrogen Spektrum pancar menunjukan radiasi energi yang dipancarkan oleh suatu materi Berasal dari manakah energi yang dipancarkan oleh materi tersebut?! Spektrum Atom Hidrogen Energi yang dipancarkan suatu zat dihasilkan akibat perpindahan elektron dari kulit dengan tingkat energi tinggi ke kulit dengan tingkat energi yang lebih rendah Pemendaran • Ketika suatu atom menyerap energi maka elektron akan mengalami perpindahan dari kulit keadaan dasar ke kulit keadaan tereksitasi • Ketika suatu elektron dalam keadaan tereksitasi jatuh ke kulit dengan energi yang lebih rendah, maka atom akan memancarkan energi berupa cahaya (berpendar) Contoh : pemendaran lampu argon