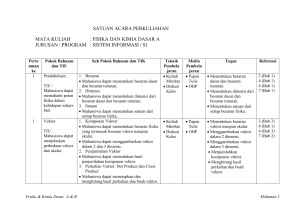
- SAP Gunadarma
advertisement
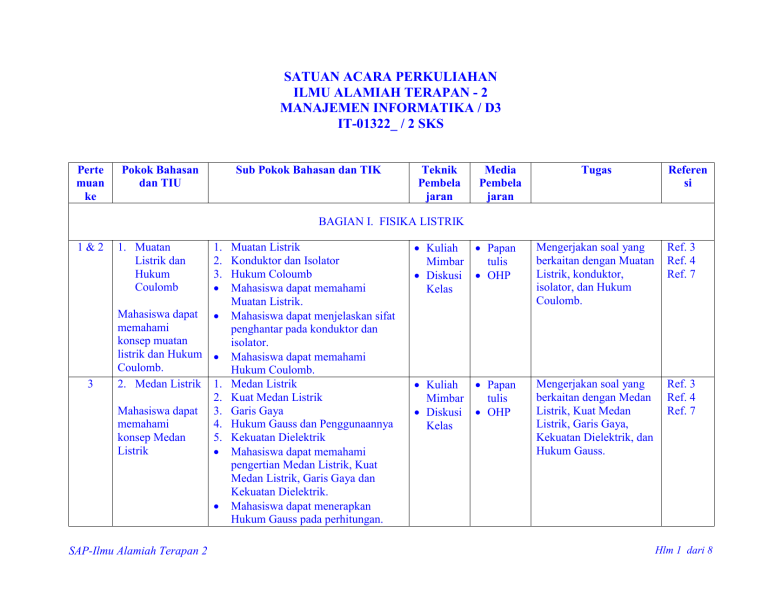
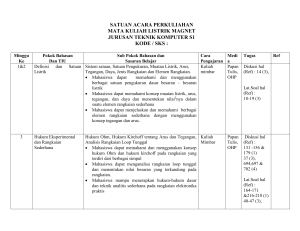
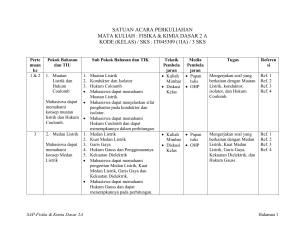
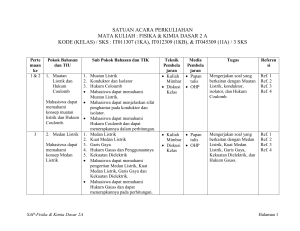
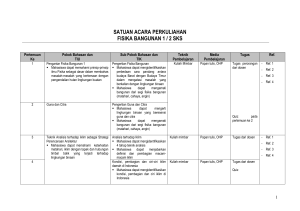
SATUAN ACARA PERKULIAHAN ILMU ALAMIAH TERAPAN - 2 MANAJEMEN INFORMATIKA / D3 IT-01322_ / 2 SKS Perte muan ke Pokok Bahasan dan TIU Sub Pokok Bahasan dan TIK Teknik Pembela jaran Media Pembela jaran Tugas Referen si BAGIAN I. FISIKA LISTRIK 1&2 3 1. Muatan Listrik dan Hukum Coulomb 1. 2. 3. Mahasiswa dapat memahami konsep muatan listrik dan Hukum Coulomb. 2. Medan Listrik 1. 2. Mahasiswa dapat 3. memahami 4. konsep Medan 5. Listrik SAP-Ilmu Alamiah Terapan 2 Muatan Listrik Konduktor dan Isolator Hukum Coloumb Mahasiswa dapat memahami Muatan Listrik. Mahasiswa dapat menjelaskan sifat penghantar pada konduktor dan isolator. Mahasiswa dapat memahami Hukum Coulomb. Medan Listrik Kuat Medan Listrik Garis Gaya Hukum Gauss dan Penggunaannya Kekuatan Dielektrik Mahasiswa dapat memahami pengertian Medan Listrik, Kuat Medan Listrik, Garis Gaya dan Kekuatan Dielektrik. Mahasiswa dapat menerapkan Hukum Gauss pada perhitungan. Kuliah Papan Mimbar tulis Diskusi OHP Kelas Mengerjakan soal yang berkaitan dengan Muatan Listrik, konduktor, isolator, dan Hukum Coulomb. Ref. 3 Ref. 4 Ref. 7 Kuliah Papan Mimbar tulis Diskusi OHP Kelas Mengerjakan soal yang berkaitan dengan Medan Listrik, Kuat Medan Listrik, Garis Gaya, Kekuatan Dielektrik, dan Hukum Gauss. Ref. 3 Ref. 4 Ref. 7 Hlm 1 dari 8 Perte muan ke 4&5 6&7 Pokok Bahasan dan TIU 3. Potensial Listrik dan Kapasitor Sub Pokok Bahasan dan TIK Teknik Media Pembela Pembela jaran jaran Kuliah Papan Mimbar tulis Diskusi OHP Kelas 1. Energi Potensial Listrik 2. Potensial Listrik 3. Hubungan antara Potensial dengan Kuat Medan Listrik Mahasiswa dapat 4. Bidang Ekipotensial memahami 5. Kapasitor dan Energi pada Kapasitor konsep Potensial Mahasiswa dapat memahami Energi Listrik dan Potensial Listrik. Kapasitor Mahasiswa dapat memahami Potensial Listrik. Mahasiswa dapat memahami hubungan antara Kuat Medan Listrik dengan Potensial Listrik, Beda Potensial Listrik, Gradien Potensial Bidang Ekipotensial, dan Kapasitor. 6. Arus Listrik, 1. Arus Listrik Kuliah Papan Hambatan dan 2. Konduktivitas Listrik Mimbar tulis Rangkaian 3. Hambatan Listrik Diskusi OHP Listrik 4. Resistivitas Listrik Kelas 5. Hukum Ohm Mahasiswa dapat 6. GGL dan Rangkaian Listrik memahami 7. Hukum Kirchoff dan Daya Listrik konsep Arus Mahasiswa dapat memahami Listrik, Hambatan pengertian arus listrik, dan Rangkaian konduktivitas, resistivitas, dan Listrik hambatan. Mahasiswa dapat memahami hukum Ohm dan hukum Kirchpff, dan dapat menerapkannya dalam perhitungan. SAP-Ilmu Alamiah Terapan 2 Tugas Referen si Mengerjakan soal yang Ref. 3 berkaitan dengan Energi Ref. 4 Potensial Listrik, Ref. 7 hubungan antara Kuat Medan Listrik dengan Potensial Listrik, Beda Potensial Listrik, Gradien Potensial Bidang Ekipotensial, Kapasitor, dan Energi pada Kapasitor. Mengerjakan soal yang berkaitan dengan Arus Listrik, Konduktivitas Listrik, Hambatan Listrik, Resistivitas Listrik, Hukum Ohm, GGL dan Rangkaian Listrik, Hukum Kirchoff dan Daya Listrik Ref. 3 Ref. 4 Ref. 7 Hlm 2 dari 8 Perte muan ke Pokok Bahasan dan TIU Sub Pokok Bahasan dan TIK Teknik Pembela jaran Media Pembela jaran Tugas Referen si BAGIAN II. KIMIA DASAR 8&9 1. Ikatan Kimia Mahasiswa dapat: Menerangkan macammacam ikatan kimia. Menerangkan terjadinya ikatan kimia. Menjelaskan bentuk molekul suatu senyawa. SAP-Ilmu Alamiah Terapan 2 1. Peranan Elektron dalam Pembentukan Ikatan Kimia Mahasiswa dapat memahami konsep pembentukan ikatan kimia. Mahasiswa dapat memahami peranan elektron valensi dalam pembentukan Ikatan Kimia. 2. Aturan oktet, Lambang Lewis dan Struktur Lewis Mahasiswa dapat memahami Aturan Oktet. Mahasiswa dapat memahami Lambang Lewis dan Struktur Lewis. 3. Pembentukan Ikatan Ion Mahasiswa dapat memahami pembentukan Ikatan Ion. 4. Pembentukan Ikatan Kovalen 1. Ikatan Kovalen Tunggal 2. Ikatan Kovalen Rangkap 3. Ikatan Kovalen Koordinat Mahasiswa dapat memahami pembentukan Ikatan Kovalen. Mahasiswa dapat memahami perbedaan antara Ikatan Ion dengan Ikatan Kovalen. Kuliah Papan Mimbar tulis Diskusi OHP Kelas Menjelaskan konsep pembentukan ikatan kimia. Menjelaskan peranan elektron valensi dalam pembentukan Ikatan Kimia. Menjelaskan Aturan Oktet. Menjelaskan Lambang Lewis dan Struktur Lewis. Menggambarkan Struktur Lewis suatu unsur tertentu. Menjelaskan pembentukan Ikatan Ion. Menjelaskan pembentukan Ikatan Kovalen. Menjelaskan perbedaan antara Ikatan Ion dengan Ikatan Kovalen. Ref. 1 Ref. 2 Ref. 5 Ref. 6 Hlm 3 dari 8 Perte muan ke Pokok Bahasan dan TIU Sub Pokok Bahasan dan TIK Mahasiswa dapat membedakan antara Ikatan Kovalen Tunggal, Kovalen Rangkap dan Kovalen Koordinat. Mahasiswa dapat menjelaskan dengan contoh Ikatan Kovalen Tunggal, Kovalen Rangkap dan Kovalen Koordinat. 5. Penyimpangan Aturan Oktet 1. Oktet Tak Lengkap 2. Oktet Berkembang 3. Spesies Ganjil Mahasiswa dapat menjelaskan dengan contoh Oktet Tak Lengkap dan Oktet Berkembang. Mahasiswa dapat menjelaskan Spesies Ganjil. 6. Kepolaran Ikatan dan Keelektronegatifan Mahasiswa dapat membedakan antara Ikatan Polar dan Non Polar. Mahasiswa dapat menjelaskan jenis Ikatan Kimia yang terbentuk dengan konsep Keelektronegatifan. 8. Bentuk Molekul Mahasiswa dapat memahami bentuk molekul Diatomik, Triatomik, Caturatomik, dan Pancaatomik. SAP-Ilmu Alamiah Terapan 2 Teknik Pembela jaran Media Pembela jaran Tugas Referen si Menjelaskan dengan contoh perbedaan antara Ikatan Kovalen Tunggal, Kovalen Rangkap dan Kovalen Koordinat. Menjelaskan dengan contoh yang dimaksud Oktet Tak Lengkap dan Oktet Berkembang. Menjelaskan Spesies Ganjil. Membedakan antara Ikatan Polar dan Non Polar. Menjelaskan jenis Ikatan Kimia yang terbentuk dengan konsep Keelektronegatifan. Menjelaskan bentuk molekul Diatomik, Triatomik, Caturatomik, dan Pancaatomik. Hlm 4 dari 8 Perte muan ke 10 11 & 12 Pokok Bahasan dan TIU 2. Persamaan Reaksi Kimia Sub Pokok Bahasan dan TIK Teknik Pembela jaran Kuliah Mimbar Diskusi Kelas Media Pembela jaran Papan tulis OHP 1. Cara Menentukan Koefisien Reaksi Mahasiswa dapat memahami konsep Reaksi Kimia dan Mahasiswa dapat: Persamaan Kimia. Memahami dan Mahasiswa dapat menentukan menjelaskan Koefisien Reaksi pada suatu apa yang Persamaan Reaksi. disebut reaksi 2. Jenis-jenis Reaksi Kimia kimia. Mahasiswa dapat menyebutkan Menerangkan macam-macam reaksi kimia. bagaimana Mahasiswa dapat membedakan suatu reaksi antara Reaksi Kombinasi, Reaksi kimia Penguraian, Reaksi Pembakaran, dituliskan. Reaksi Pertukaran Tunggal, Mengetahui Reaksi Pertukaran Ganda, dan prinsip utama Reaksi Netralisasi. reaksi kimia. 3. Stoikiometri 1. Bilangan Avogadro Kuliah Papan Mimbar tulis Mahasiswa dapat memahami Mahasiswa dapat konsep Bilangan Avogadro. Diskusi OHP mengenal dan 2. Konsep Mol Kelas menerangkan Mahasiswa dapat memahami cara-cara konsep Mol. pengukuran yang Mahasiswa dapat menerapkan meliputi konsep Mol dalam hitungan perhitungan zat kimia. dan campuran 3. Massa Atom Relatif dan Massa Molekul Relatif Mahasiswa dapat memahami konsep Massa Atom Relatif dan Massa Molekul Relatif. SAP-Ilmu Alamiah Terapan 2 Tugas Menjelaskan pengertian Reaksi Kimia dan Persamaan Kimia. Menentukan Koefisien Reaksi pada suatu Persamaan Reaksi. Menyebutkan macammacam reaksi kimia. Membedakan antara Reaksi Kombinasi, Reaksi Penguraian, Reaksi Pembakaran, Reaksi Pertukaran Tunggal, Reaksi Pertukaran Ganda, dan Reaksi Netralisasi. Menjelaskan pengertian Bilangan Avogadro. Menjelaskan pengertian Mol. Menerapkan konsep Mol dalam hitungan kimia. Menjelaskan pengertian Massa Atom Relatif dan Massa Molekul Relatif. Referen si Ref. 1 Ref. 2 Ref. 5 Ref. 6 Ref. 1 Ref. 2 Ref. 5 Ref. 6 Hlm 5 dari 8 Perte muan ke 13 & 14 Pokok Bahasan dan TIU 4. Termokimia Mahasiswa dapat memahami dan menentukan perubahan entalpi dalam reaksi. SAP-Ilmu Alamiah Terapan 2 Sub Pokok Bahasan dan TIK Teknik Pembela jaran Media Pembela jaran 4. Reaksi Kimia dalam Larutan 1. Konsentrasi dalam Satuan Fisika Mahasiswa dapat menentukan konsentrasi larutan dalam persen (% massa, % volume, % massa/volume). 2. Konsentrasi dalam Satuan Kimia Mahasiswa dapat memahami cara menentukan konsentrasi larutan dalam satuan kimia (Normalitas, Molaritas, Molalitas, dan Fraksi Mol). 5. Rumus Empirik dan Rumus Molekul Mahasiswa dapat menentukan Rumus Empirik dan Rumus Molekul suatu senyawa. 1. Termodinamika Kuliah Papan Mahasiswa dapat membedakan Mimbar tulis bentuk energi Kalor dan Kerja. Diskusi OHP 2. Kalor dan Kalor Reaksi Kelas Mahasiswa dapat memahami pengertian Kalor. Mahasiswa dapat menjelaskan hubungan antara Jumlah Kalor, Perubahan Suhu dan Kalor Jenis Zat. 3. Entalpi dan Perubahan Entalpi Mahasiswa dapat menerangkan pengertian Entalpi Reaksi dan Perubahan Entalpi Reaksi. Tugas Referen si Menentukan konsentrasi larutan dalam persen (% massa, % volume, % massa/volume). Menentukan konsentrasi larutan dalam satuan kimia (Normalitas, Molaritas, Molalitas, dan Fraksi Mol). Menentukan Rumus Empirik dan Rumus Molekul suatu senyawa. Membedakan bentuk energi Kalor dan Kerja. Menjelaskan pengertian Kalor. Menjelaskan hubungan antara Jumlah Kalor, Perubahan Suhu dan Kalor Jenis Zat. Menerangkan pengertian Entalpi Reaksi dan Perubahan Entalpi Reaksi. Ref. 1 Ref. 2 Ref. 5 Ref. 6 Hlm 6 dari 8 Perte muan ke Pokok Bahasan dan TIU Sub Pokok Bahasan dan TIK 4. 5. 6. 7. SAP-Ilmu Alamiah Terapan 2 Mahasiswa dapat membedakan antara entalpi Pembentukan, Penguraian, dan Pembakaran. Reaksi Eksoterm dan Endoterm Mahasiswa dapat membedakan reaksi eksoterm dan endoterm. Hukum-hukum yang berlaku dalam Termokimia 1. Hukum Laplace 2. Hukum Hess Mahasiswa dapat menerangkan hubungan-hubungan yang melibatkan entalpi. Mahasiswa dapat menerapkan hukum Laplace untuk menentukan entalpi reaksi. Mahasiswa dapat menerapkan hukum Hess untuk menentukan entalpi reaksi. Energi Ikatan Mahasiswa dapat memahami konsep dasar cara menentukan energi ikatan. Mahasiswa dapat menentukan entalpi reaksi dari data energi ikatan. Arah Proses Mahasiswa dapat memahami pengertian dasar dan ciri-ciri proses spontan dan tidak spontan. Teknik Pembela jaran Media Pembela jaran Tugas Referen si Membedakan entalpi Pembentukan, Penguraian, dan Pembakaran. Membedakan antara reaksi eksoterm dan endoterm. Menerangkan hubungan-hubungan yang melibatkan entalpi. Menerapkan hukum Laplace untuk menentukan entalpi reaksi. Menerapkan hukum Hess untuk menentukan entalpi reaksi. Menjelaskan cara menentukan energi ikatan. Menentukan entalpi reaksi dari data energi ikatan. Menjelaskan pengertian dasar dan ciri-ciri proses spontan dan tidak spontan. Hlm 7 dari 8 Daftar Referensi: 1. Charles W. Keenan, 1999, Kimia untuk Universitas, Edisi Keenam-Jilid 1 (Terjemahan: Aloysius Hadyana Pudjaatmaka), Penerbit Erlangga, Jakarta 2. Petrucci, R.H., 1996, Kimia Dasar, Prinsip dan Terapan Modern, Edisi Keempat-Jilid 1 (Terjemahan: Suminar dan Achmadi), Penerbit Erlangga, Jakarta 3. Sears & Zemansky, Fisika Listrik Magnet 4. Sutrisno, 1982, Seri Fisika Dasar Listrik, Magnet, dan Termofisika, Penerbit ITB, Bandung 5. Syukri S., 1999, Kimia Dasar 1, ITB, Bandung 6. Tety Elida Dkk, 1993, Pengantar Kimia, Penerbit Gunadarma, Jakarta 7. Umar Yahdi, 1991, Pengantar Fisika Listrik Magnet, Penerbit Gunadarma, Jakarta SAP-Ilmu Alamiah Terapan 2 Hlm 8 dari 8