BAB I PENDAHULUAN Sistem saraf adalah suatu jalinan
advertisement

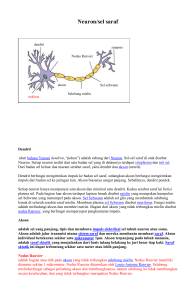
BAB I PENDAHULUAN Sistem saraf adalah suatu jalinan jaringan saraf yang kompleks, sangat khusus dan saling berhubungan satu dengan yang lain. Sistem saraf mengkoordinasi, menafsirkan dan mengontrol interaksi antara individu dengan lingkungan sekitarnya. Sistem tubuh yang penting ini juga mengatur kebanyakan aktivitas sistem-sistem tubuh lainnya. Karena pengaturan saraf tersebut maka terjalin komunikasi antara berbagai sistem tubuh hingga menyebabkan tubuh berfungsi sebagai unit yang harmonis. Dalam sistem inilah berasal segala fenomena kesadaran, pikiran, ingatan, bahasa, dan memberi respon terhadap suatu rangsangan merupakan hasil kerja integrasi dari sistem saraf yang puncaknya dalam bentuk kepribadian dan tingkah laku individu. 1 Kemampuan sel-sel saraf untuk regenerasi dalam tubuh dapat mengurangi efek trauma dan penyakit dengan cara yang dramatis.2 Para ilmuwan di University of California, San Diego School of Medicine melaporkan bahwa regenerasi akson sistem saraf pusat dapat dicapai pada tikus bahkan ketika pengobatan yang terlambat lebih dari setahun setelah cedera saraf tulang belakang asli.3 Sejumlah mekanisme menciptakan hambatan hebat untuk regenerasi akson terluka dalam cedera saraf tulang belakang kronis. Ini termasuk pembentukan bekas luka di lokasi cedera, kekurangan parsial dalam kapasitas pertumbuhan intrinsik neuron dewasa, kehadiran inhibitor terhadap pertumbuhan, dan kadang-kadang peradangan luas.3 Saat ini bentuk yang paling sukses pengobatan adalah untuk mengambil bagian dari saraf yang sehat (autograft) dari bagian lain tubuh pasien untuk jembatan yang rusak, autograft ini kemudian berfungsi sebagai panduan bagi serat saraf untuk 1 menyeberangi kesenjangan cedera. Meskipun berhasil, prosedur autograft memiliki kelemahan utama termasuk hilangnya fungsi di lokasi donor, dan beberapa operasi, cukup sering, hanya saja tidak mungkin untuk menemukan syaraf yang cocok untuk digunakan sebagai suatu cangkokan. Berbagai cangkokan syaraf sintetis yang saat ini tersedia tetapi bekerja tidak lebih baik dari autograft dan tidak dapat menjembatani kesenjangan yang lebih besar dari 4 cm. 2 Para ilmuwan juga melakukan studi genetika untuk mengukur seberapa luas set gen dalam sel dapat diaktifkan bila pengobatan tertunda setelah cedera. Mereka menemukan bahwa, meskipun keterlambatan yang cukup besar, gen sebagian besar masih bisa dihidupkan untuk mendukung regenerasi, yang menunjukkan bahwa sel kronis terluka masih bisa "prima" untuk tumbuh.3 2 BAB II TINJAUAN PUSTAKA 2.1 JARINGAN SARAF Jaringan saraf terdiri dari neuroglia dan sel Schwann (sel-sel penyokong) serta neuron (sel-sel saraf). Kedua jenis sel tersebut demikian erat berkaitan dan terintegrasi satu sama lainnya sehingga bersama-sama berfungsi sebagai satu unit.4 Neuroglia mengandung berbagai macam sel yang secara keseluruhan menyokong,melindungi, dan sumber nutrisi sel saraf (neuron) pada otak dan medula spinalis, sedangkan sel Schwann merupakan pelindung dan penyokong neuronneuron di luar sistem saraf pusat. Neuroglia menyusun 40 % volume otak dan medulla spinalis. Neuroglia jumlahnya lebih banyak dari sel-sel neuron dengan perbandingan sekitar sepuluh banding satu. Ada empat sel neuroglia yang berhasil diidentifikasi yaitu: oligodendroglia, ependima, astroglia, dan microglia. Masingmasing mempunyai fungsi yang khusus.4 Oligodendroglia merupakan sel glia yang bertanggung jawab menghasilkan myelin dalam susunan saraf pusat. Sel ini mempunyai lapisan dengan substansi lemak mengelilingi penonjolan atau sepanjang sel saraf sehingga terbentuk selubung myelin. Mielin pada susunan saraf tepi dibentuk oleh sel Schwann.4 Sel Schwann membentuk mielin maupun neurolemma saraf tepi. Tidak semua neuron susunan saraf tepi bermielin. Neurolema adalah membran sitoplasma halus yang dibentuk olehsel-sel Schwann yang membungkus semua neuron sistem saraf tepi (bermielin atau tidak bermielin). Neorolema merupakan struktur penyokong dan pelindung bagi tonjolan saraf.4 3 Gambar 1. Bagian-bagian Neuron Mielin merupakan suatu kompleks protein lemak berwarna putih yang mengisolasi tonjolan saraf. Mielin menghalangi aliran ion Natrium dan Kalium melintasi membran neuronal dengan hampir sempurna. Selubung mielin tidak kontinu di sepanjang tonjolan saraf, dan terdapat celah-celah yang tidak memiliki myelin, dinamakan nodus ranvier. Tonjolan saraf pada susunan saraf pusat dan tepi dapat bermielin atau tidak bermielin. Serabut saraf yang mempunyai selubung myelin dinamakan serabut bermielin, dan dalam sistem saraf pusat dinamakan massa putih (substansia alba). Serabut-serabut yang tak bermielin dinamakan serabut tak bermielin dan terdapat dalam massa kelabu (substansia grisea) sistem saraf pusat. Transmisi impuls saraf di sepanjang serabut bermielin lebih cepat dari transmisi di sepanjang serabut tidak bermielin, karena impuls berjalan dengan cara “meloncat” dari nodus ke nodus yang lain di sepanjang selubung myelin. Cara transmisi seperti ini dinamakan konduksi saltatorik.4 Hal terpenting dari peran mielin pada proses transmisi di serabut saraf dapat terlihat dengan mengamati hal yang terjadi jika tidak lagi terdapat myelin. Pada orang-orang dengan multiple sclerosis, lapisan yang mengelilingi serabut saraf 4 menjadi hilang. Sejalan dengan hal itu, orang tersebut mulai kehilangan kemampuan untuk mengontrol otot-ototnya dan akhirnya menjadi tidak mampu sama sekali.4 Ependima berperan dalam produksi Cerebro Spinal Fluid (CSF). Ependima adalah neuroglia yang membatasi sistem ventrikel Sistem Saraf Pusat. Sel-sel inilah yang merupakan epithel dari plexus coroideus ventrikel otak.4 Mikroglia merupakan sifat-sifat fagosit yang menyingkirkan debris-debris yang dapat berasal dari sel-sel otak yang mati,bakteri, dan lain-lain. Sel jenis ini ditemukan di seluruh sistem saraf pusat dan dianggap berperanan penting dalam proses melawan infeksi.3,4 Astrocytes atau astroglia berfungsi sebagai “sel pemberi makan” bagi neuron yang halus. Badan sel astroglia berbentuk bintang dengan benyak tonjolan dan kebanyakan berakhir pada pembuluh darah sebagai kaki perivaskuler atau foot processes. Bagian ini juga membentuk dinding perintang antara aliran kapiler darah dengan neuron, sekaligus mengadakan pertukaran zat diantara keduanya. Dengan kta lain membantu neuron mempertahankan potensial bioelektris yang sesuai untuk konduksi impuls dan transmisi sinaptik. Dengan cara ini pula sel-sel saraf terlindungi dari substansia yang berbahaya yang mungkin saja terlarut dalam darah. Tetapi fungsinya sebagai sawar darah otak tersebut masih memerlukan pemastian lebih lanjut, karena diduga celah endotel kapiler darahlah yang lebih berperan sebagai sawar darah otak.3,4 Walaupun neuroglia secara struktur menyerupai neuron tetapi tidak dapat menghantarkan impuls saraf, suatu fungsi yang merupakan bagian yang paling berkembang pada neuron. Perbedaan lain yang penting adalah neuroglia tidak pernah kehilangan kemampuan untuk membelah dimana tidak dipunyai oleh neuron. Karena alasan inilah kebanyakan tumor-tumor otak adalah glioma atau tumor yang berasal dari sel-sel glia.3 5 Gambar 2. Neuroglia Neuron adalah suatu sel saraf dan merupakan unit anatomis dan fungsional sistem saraf. Setiap neuron mempunyai badan sel yang mempunyai satu atau beberapa tonjolan. Dendrit adalah tonjolan yang menghantarkan informasi menuju badan sel. Tonjolan tunggal dan panjang yang menghantarkan informasi keluar dari badan sel disebut axon. Dendrit dan akson secara kolektif sering disebut sebagai serabut saraf atau tonjolan saraf. Kemampuan untuk menerima, menyampaikan dan meneruskan pesan-pesan neural disebabkan oleh karena sifat khusus membran sel neuron yang mudah dirangsang dan dapat menghantarkan pesan elektrokimia.4 Neuron dapat diklasifikasikan menurut bentuknya atas neuron unipolar, bipolar, atau multipolar. Neuron unipolar hanya mempunyai satu serabut yang dibagi menjadi satu cabang sentral yang befungsi sebagai satu akson dan satu cabang perifer yang beguna sebagai satu dendrit. Jenis neuron ini merupakan neuron-neuron sensorik saraf perifer (misalnya sel-sel ganglion cerebrospinalis). Neuron bipolar mempunyai dua serabut, satu dendrit, dan satu akson. Jenis neuron ini dijumpai dalam epitel olfaktorius, dalam retina mata, dan dalam telinga dalam. 6 Neuron multipolar mempunyai beberapa dendrit dan satu akson. Jenis neuron ini merupakan yang paling sering dijumpai pada sistem saraf sentral (misalnya sel-sel motoris pada cornu anterior dan lateralis medula spinalis, sel-sel ganglion otonom). Neurotrasmitter merupakan zat kimia yang disintesis dalam neuron dan disimpan dalam gelembung sinaptik pada ujung akson terminal dan juga direabsorpsi untuk daur ulang. Neurotansmiter merupakan cara komunikasi antar neuron. Setiap neuron melepaskan satu transmiter. Zat-zat kimia ini menyebabkan perubahan permeabilitas sel neuron, sehingga neuron menjadi lebih kurang dapat menyalurkan impuls. Diketahui atau diduga terdapat sekitar tiga puluh macam neurotransmiter, diantaranya adalah Norephinefrin, Acetylcholin, Dopamin, Serotonin, Asam GamaAminobutirat (GABA) dan Glisin.4 Tempat-tempat dimana neuron mengadakan kontak dengan neuron lain atau dengan organ-organ efektor disebut sinaps. Sinaps merupakan satu-satunya tempat dimana suatu impuls dapat lewat dari satu neuron ke neuron lainnya atau efektor. Ruang antara satu neuron dan neuron berikutnya (atau organ efektor) dikenal dengan nama celah sinaptik (synaptic cleft). Neuron yang menghantarkan impuls saraf menuju ke sinaps disebut neuron prasinaptik. Neuron yang membawa impuls dari sinaps disebut neuron postsinaptik.4 7 Gambar 3. Structure of Typical Motor Neuron (inset shown enlarge synapse) 2.2 IMPULS SARAF Komponen listrik dari transmisi saraf menangani transmisi impuls sepanjang neuron. Permeabilitas membran sel neuron terhadap ion natrium dan kalium bervariasi dan dipengaruhi oleh perubahan kimia serta listrik dalam neuron tersebut (terutama neurotransmiter dan stimulus organ receptor). Dalam keadaan istirahat, permeabilitas membran sel menciptakan kadar kalium intrasel yang tinggi dan kadar natrium intrasel yang rendah, bahkan pada kadar natrium ekstrasel yang tinggi. Impuls listrik timbul oleh pemisahan muatan akibat perbedaan kadar ion intrasel dan ekstrasel yang dibatasi membran sel.1,4 Secara skematis perjalanan impuls saraf dapat dilihat pada bagan berikut ini: 8 Jika stimulus cukup kuat, potensial aksi akan dialirkan secara cepat ke sepanjang membran sel. 9 Potensial aksi yang terjadi atau impuls pada saat depolarisasi dialirkan ke ujung saraf dan mencapai ujung akson (akson terminal). Saat potensial aksi mencapai akson terminal akan dikeluarkanlah neurotransmitter, yang melintasi sinaps dan dapat saja merangsang saraf berikutnya.5 2.3 REGENERASI AKSON Bila sebuah akson dihancurkan atau diputuskan, degenerasi meluas sedikit proksimal dan pemulihan segera dimulai dengan tampaknya kuncup-kuncup akson baru. Namun ke distal, akson, selubung mielinnya, dan cabang-cabang terminalnya berdegenerasi total. Proses ini biasanya disebut degenerasi wallerian, diambil dari Augustus Waller, seorang dokter Inggris abad XIX. Dalam 24-48 jam mitokondria akson membengkak dan menggumpal, neurofilamen hancur, dan akson tampak berbintik-bintik. Bersamaan waktu selubung myelin hancur, mula-mula berupa kolom-kolom lamel konsentris, kemudian menjadi tetes-tetes lipid sekitar akson. Makrofag kemudian datang dan membersihkan debris.6 Sel Schwann tetap utuh selama degenerasi akson, namun tak lama kemudian terjadi hipertrofi dan juga membelah, berderet sepanjang saraf sebagai rentetan sel panjang, masing-masing terpisah dari yang lain, namun dengan ujung yang saling meliputi, sehingga membentuk tabung yang mengandung cairan dan residu dari 10 akson. Dengan menebalnya dinding tabung, lumennya mengecil dan akhirnya menutup berubah menjadi pita utuh (pita Bungner) yang dapat dikenali dari deretan inti sel Schwann sepanjangnya. Bersamaan dengan perubahan ini, plasmalema sel Schwann dan lamina basal berdekatan memisah dan lamina basal tambahan diletakkan konsentris sekitar pita. Ini berfungsi untuk menghasilkan banyak kompartemen tubuler di antara sel Schwann dan endoneurium, melalui mana kuncup akson tumbuh dari daerah akson yang tak cedera proksimal darinya atau dari akson berdekatan yag utuh. Pita demikian berbulan-bulan menanti tumbuhnya akson yang perlahan ke sasaran perifernya. Jika tidak terjadi regenerasi akson, pita berangsur mengecil oleh jaringan ikat endoneurium yang membungkusnya.6 Degenerasi singkat dan terbatas dari ujung proksimal saraf tepi yang putus biasanya diikuti regenerasi akson. Konus pertumbuhan dan filopodia halus muncul pada ujung proksimal akson yang masih hidup dan mereka dengan perlahan merembet sepanjang permukaan luar kolom sel-sel Schwann dan dengan progresif dibungkus oleh mereka. Kecepatan memanjang akson adalah 3-4 mm per hari, namun jarak yang harus ditempuh mencapai 1 m atau lebih, tergantung tempat cedera awal. Banyaknya kuncup regeneratif dari akson bersangkutan dan kapasitas kolom untuk menampung dan mengarahkan ratusan akson, menjamin reinervasi yang sukses. Pemulihan fungsi tergantung keberhasilan pemulihan hubungan sensoris dan motoris yang sesuai di perifer. Dalam kasus otot yang putus sarafnya, ia pasti telah mengalami sedikit atrofi, dan pemulihan sempurna harus menunggu pemulihannya juga, selain pemulihan transmisi neuromuskuler efektif. Ujung tidak sesuai juga perlu dihilangkan dan remodeling sentral dari lengkung refleks. Fisioterapi intensif untuk mempertahankan dan menguatkan serat-serat otot yang tetap disarafi agaknya juga berperan penting dalam proses pemulihan, yang dapat menghabiskan waktu 2 tahun atau lebih.6 11 Gambar 3. Langkah-langkah Regenerasi Akson Serat saraf dalam susunan saraf pusat mengalami degenerasi Waller yang lebih lambat. Hilangnya myelin mungkin tidak nyata dalam sediaan pulasan Weigert rutin untuk 2 bulan, namun metode perak selektif khusus dari Nauta, pada mana impregnasi akson normal dihambat, akan menampakkan perubahan degeneratf dalam myelin lebih awal, dan hal ini berguna untuk melacak hubungan setelah pemutusan eksperimental dari inti dan jalur dalam penelitian neuroanatomi.6 Perubahan dalam badan sel saraf setelah pemutusan akson dijelaskan oleh Nissl dalam 1982. Yang terpenting diantaranya adalah kromatolisis rektograd, yaitu hilangnya badan basofilik sitoplasma yang telah lama dikenal sebagai substansi Nissl. Kini diketahui bahwa ia terdiri atas deretan parallel sisterna reticulum endoplasma 12 kasar. Dengan mikroskop cahaya, hancurnya bahan ini pertama kali tampak dekat hilok akson. Ia kemudian menjalar sekitar inti ke bagian lain badan sel. Selain itu, perikarion menarik air dan membengkak dan inti bergeser dari posisi sentralnya yang biasa ke tepian, menjauhi hilok akson. Mikrograf electron menunjukkan terurainya deretan sisterna dari reticulum endoplasma, berkurangnya jumlah ribosom, dan munculnya banyak neurofilamen. Proses ini dimulai kira-kira sehari setelah cederanya akson dan mencapai puncaknya dalam 2 minggu. Ia paling jelas pada neuron motoris namun juga terdapat dalam sel saraf lain dalam derajat bervariasi. Ahli neuroanatomi yang terbiasa dengan pola normal substansi Nissl dalam sel berbagai daerah SSP dapat memutuskan saraf atau jalur dan menetapkan lokasi awalnya dengan mencari neuron dengan kromatolisis. Sebelum adanya teknik untuk mengikuti transport akson ortograd dan retrograde, penelusuran kromatolisis dan degenerasi Waller yang memakan waktu begitu lama itu adalah satu-satunya metoda yang ada untuk mengetahui organisasi SSP.6 Pada umumnya, makin banyak aksoplasma terlepas dari badan sel, makin banyak pula kromatolisisnya. Memotong akson dekat ujung distalnya hampir tidak menimbulkan respons apa-apa. Sebaliknya, jika kerusakan terjadi dekat badan selnya, sel itu mungkin mati, dengan reaksi kromatolisis itu berakibat lisis dari neuron itu. Jika terjadi regenerasi akson itu, perubahan dalam badan sel perlahan pulih, dengan terbentuknya substansi Nissl, kadang-kadang sedemikian rupa sampai kebanyakan. Kembali ke normal memakan waktu berbulan-bulan karena diperlukan usaha metabolik luar biasa untuk membuat jumlah aksoplasma yang mencapai 100-200 kali volume badan selnya. Tidak perlu heran bahwa setelah pemulihan, neuron dapat mati kemudian.6 Kromatolisis dapat terjadi dalam perikaria neuron untuk alasan selain pemutusan akson. Hilangnya substansi Nissl berbeda arah menghilangnya di dalam badan sel, menghilang dari tepian sel kearah inti, dan bukannya keluar menjauhi inti, seperti halnya kromatolisis retrograde atau sentral.6 13 Dalam beberapa hal, kromatolisis perifer ini dianggap mencerminkan tahap lanjut degenerasi neuron atau “fight for life” neuron. Ini tampak pada penyakit infeksi atau degeneratif tertentu dari susunan saraf, seperti poliomyelitis dan atrofi muscular progresif. Interpretasi lain adalah bahwa kromatolisis perifer yang cepat timbul setelah cedera neuron adalah selangkah mendekati kematian sel, sedangkan reaksi lambat adalah tanda berlangsungnya pemulihan. Keabsahan interpretasi demikian masih dipertanyakan.7 Electron micrograph: From R E Schmidt MD Denervated Schwann cell band Collagen pockets (Band of Bungner) Due to loss of myelinated axon Basement membrane is irregular Size: > 3 μm 14 Large Denervated Schwann Cell Band 15 Electron micrograph: From R E Schmidt MD 2.4 Pertumbuhan dan Perkembangan Axon Keseimbangan antara pengambilan dan penyisipan membran plasma yang menentukan bentuk dan dimensi neuron harus diatur untuk memungkinkan pertumbuhan dan perkembangan akson setelah cedera. Mekanisme yang mengatur penyisipan membran, dan bagaimana sejumlah besar bahan membran yang dibutuhkan untuk perpanjangan aksonal setelah trauma yang dipasok ke akson belum diketahui secara pasti. Penelitan terdahulu mengimplikasikan bahwa protein dan lipid disintesis dalam sel tubuh melalui retikulum endoplasma dan kompleks Golgi dan kemudian diangkut sepanjang mikrotubulus dalam bentuk vesikel untuk mencapai lokasi penyisipan membran. Selama 10 tahun terakhir, penelitian menunjukkan bahwa akson memiliki komponen retikulum endoplasma dan Golgi, sehingga mampu melakukan sintesis lipid dan protein sendiri.7 Biogenesis membran dalam regenerasi neuron berbeda dengan neuron yang pertumbuhannya tidak aktif. Perluasan retikulum endoplasma dalam badan sel yang terjadi setelah cedera mencerminkan peningkatan sintesis membran. Mekanisme yang mengatur biogenesis membran tidak sepenuhnya dipahami. Baru-baru ini, telah diusulkan bahwa faktor transkripsi memainkan peran non-genomik dalam mengatur 16 regenerasi. Faktor transkripsi c-FOS memiliki, peranan aktivitas faktor transkripsi, untuk mengaktifkan biosintesis fosfolipid dan glikolip yang diperlukan untuk membran biogenesis.7 Ekspansi aksolemma memerlukan fusi vesikel dengan membran plasma. Demikian pula dengan membran baru, untuk perluasan neurite diperlukan Synaptotagmin VII yang berfungsi pada regenerasi sel. Sebuah populasi vesikel axonal diangkut dengan bantuan protein Syd dan Synaptotagmin VII pada permukaan sel.7 Selain protein, perpanjangan akson membutuhkan penggunaan lipid ke akson. Akson tidak perlu mendapatkan semua lipid dari badan sel karena akson memiliki kapasitas untuk mensintesis fosfolipid. Terpenting, sintesis fosfolipid dari aksonal diperlukan untuk pertumbuhan akson. Sebaliknya, kolesterol tidak dibuat dalam akson, tetapi secara eksklusif dalam badan sel. Dari penelitian didapatkan pasokan kolesterol endogen cukup untuk pertumbuhan akson. Beberapa penelitian telah menyatakan bahwa lipoprotein seperti apoE dapat berfungsi dalam daur ulang lipid dan digunakan kembali untuk membantu perakitan dan regenerasi membran.7 Transfer lipid dari akson untuk Sel Schwann bersamaan dengan pengalihan ribosom dari sel Schwann ke akson mencerminkan hubungan yang erat antara sel Schwann dan akson. Dalam kasus akson sangat panjang di mana badan sel tidak mungkin menyediakan bahan yang cukup untuk mendukung regenerasi di ujung akson, maka akson distal dapat mengandalkan sumber-sumber non-saraf untuk mendukung penyediaan regenerasi akson.7 2.5 Regenerasi pada Cedera Saraf pada Sistem Saraf Perifer Degenerasi Wallerian Akson yang terpisah secara fisik dari sel saraf tubuh setelah cedera saraf dapat mengalami penurunan hingga kehilangan fungsi. Cajal's melakukan pemeriksaan histologis rinci untuk mengidentifikasi degenerasi aksonal, dimulai infiltrasi leukosit ke tunggul saraf distal, pembentukan 17 ovoid sebagai fragmen sel Schwann selubung myelin, dan diferensiasi dari sel Schwann dari myelinating menjadi nonmyelinating. Proses degeneratif ini disebut sebagai degenerasi Wallerian. Degenerasi aksonal dimediasi oleh masuknya kalsium melalui pompa ion yang pada gilirannya, mengaktifkan protease aksonal. Disintegrasi dan degenerasi dari axolemma dan axoplasma terjadi dalam waktu 24 jam pada saraf kecil dan 48 jam di saraf besar. Dalam dua hari pasca cedera, regulasi gen sel Schwann diubah sejak sel-sel mulai meregulasi ulang gen yang menyalin protein mielin dan mulai mengekspresikan regenerasi gen terkait (Regeneration associated genes = RAGs). RAGs termasuk gen yang dapat menyalin protein-43 yang terkait pertumbuhan (GAP-43), faktor-faktor neurotropik dan reseptor terpotong mereka, faktor proliferatif sel Schwann, neuregulin, dan reseptor ERB-nya. Sel Schwann yang mengalami diferensiasi mengumpulkan sisa-sisa sel mielin, bentuk ovoid dari sisa-sisa mielin mereka sendiri, berproliferasi, dan membentuk pita Bungner. Pita ini menyokong akson yang beregenerasi dari tunggul saraf proksimal ke dan melalui tabung endoneurial dari tunggul saraf distal. Pelepasan faktor neurotropik prototipikal, faktor pertumbuhan saraf (NGF) dari fibroblas dan sel Schwann di tunggul saraf distal, mungkin memainkan peran penting dalam proliferasi dan migrasi sel Schwann di seluruh situs cedera, sehingga membantu dalam membimbing neurit tumbuh ke dalam saraf puntung distal. Makrofag hematogen memainkan peran penting baik dalam fagositosis mielin pasca cedera saraf serta perubahan di bagian fungsional dari sel Schwann. Makrofag direkrut ke dalam tunggul saraf distal dengan jumlah besar pada hari ketiga pasca cedera. Makrofag ini kemudian menyusup ke dalam tunggul saraf untuk menanggapi faktor chemoattractive, termasuk sitokin seperti interleukin-1β leukemia inhibitory factor, tumor necrosis factor-α (TNF-α) dan monocyte chemoattractant protein-1, yang dirilis oleh sel-sel Schwann. Keterlibatan kritis sitokin pro peradangan, TNF-α, untuk menarik makrofag ini terbukti dari penurunan invasi makrofag pada tunggul 18 saraf distal TNF-α pada tikus percobaan. Makrofag menembus saraf seluruh puntung distal dimana mereka berada setidaknya selama waktu satu bulan dan bertanggung jawab untuk mengeluarkan sebagian besar sisa-sisa mielin. Sisa-sisa ini mencakup protein mielin terkait seperti myelin terkait glikoprotein (MAG) yang telah terbukti memiliki efek menghambat yang kuat pada pertumbuhan aksonal (Section Oligodendrocyte derived myelin associated inhibitors). Ada pola yang sangat mencolok pada pelepasan sitokin pro dan anti inflamasi dari sel Schwann setempat, fibroblas dan penarikan makrofag selama degenerasi Wallerian di sistem saraf perifer. Contoh sitokin pro inflamasi adalah TNF- α yang diekspresikan dalam makrofag dan sel Schwann seperti pada fibroblas dan sel endotel dalam cedera saraf perifer. Sitokin anti inflamasi termasuk IL-10. Pola pelepasan sitokin pada saraf perifer yang cedera secara erat mengikuti pola pelepasan sitokin yang sama pada luka yang menginduksi inflamasi dari jaringan nonneural, yang mengatur produksi sitokin yang berfungsi untuk memprovokasi inflamasi respon yang terbatas waktu. Respon inflamasi yang terbatas waktu efektif dalam menghilangkan sisa mielin di sistem saraf perifer yang cedera, dimana efek ini kontras dengan pemusnahan sisa-sisa mielin dalam SSP yang cedera oleh populasi makrofag mikroglia (Baca: degenerasi Wallerian). Respon Neuronal Ketika akson bagian distal mengalami cedera, dimulailah degenerasi Wallerian, dimana akson dari saraf proksimal tunggul mengalami "mati kembali" sampai ke nodus Ranvier pertama. Badan sel dari neuron yang teraxotomi neuron mengalami perubahan karakteristik morfologis yang secara kolektif disebut sebagai "Khromatolisis". Hal ini termasuk pecahnya kode dari retikulum endoplasma kasar dan perpindahan inti dari pusat sel tubuh, perubahan ini diyakini menjadi dasar bagi perubahan yang ditandai dalam sintesis mRNA dan perubahan dalam ekspresi gen dalam neuron yang teraxotomi, bersamaan dengan konversi neuron dari biasanya 19 bersifat transmitting menjadi mode growth yang memungkinkan untuk terjadinya regenerasi aksonal. Ekspresi gen yang terganggu, termasuk upregulasi dari RAGs memungkinkan perbaikan untuk stabilitas dan perpanjangan pertumbuhan kerucut, serta aksonal. RAGs ditingkatkan regulasinya termasuk gen yang mentranskripsikan protein sitoskeletal, tubulin dan aktin, dan protein terkait pertumbuhan, GAP-43 dan protein-23 terkait sitoskeleton (CAP-23), yang telah terbukti mediator yang sangat penting perpanjangan pertumbuhan kerucut. Secara bersamaan, gen lain diturunkan regulasinya, termasuk gen untuk protein sitoskeletal neurofilamen. Penurunan pengangkutan protein neurofilamen dibutuhkan untuk mengurangi diameter saraf yang terpotong. Peningkatan regulasi tubulin dan aktin, mungkin berkaitan dengan penurunan rasio neurofilamen-tubulin dan pada gilirannya, menurunkan interaksi mikrotubulus neurofilamen, memungkinkan akson untuk bertumbuh sekitar 1-3mm/hari, tingkat yang sesuai dengan tingkat lambat komponen aksonal b yang mengangkut protein sitoskeletal. Axotomized PNS neuron juga menyatakan protein yang penting untuk interaksi antara pertumbuhan dan kerucut sel Schwann di lingkungan pertumbuhan permisif dari saraf distal tunggul. Ini termasuk reseptor untuk faktor neurotropik yang diekspresikan dalam sel Schwann yang terdenervasi sebagaimana diuraikan di bawah ini (Bagian Respon Sel Non-Neuron), serta protein seperti neuregulin yang mengikat reseptor erb pada sel Schwann sebagai mediasi, setidaknya sebagian, interaksi dari akson yang tumbuh dan sel-sel Schwann dalam jalur pertumbuhan. Neuregulin berasal baik dari kerucut pertumbuhan dan sel Schwann berkontribusi pada sinyal mitogenik untuk proliferasi sel Schwann pada kontak dari pertumbuhan kerucut dengan yang sel Schwann. Pertumbuhan kerucut yang muncul dari akson di tunggul saraf proksimal memanjang sepanjang permukaan sel Schwann dan/atau permukaan bagian dalam dari lamina basal dari Sel Schwann kolom di tunggul saraf distal. 20 Neuron mengekspresikan beberapa molekul adhesi dalam membran pertumbuhan kerucut, termasuk molekul adhesi saraf, sebagai tambahan integrins yang mengikat protein matriks ekstraseluler seperti laminin. Respon Sel Nonneuronal Ekspresi sitokin dan respon inflamasi yang dihasilkan selama degenerasi Wallerian memainkan peran penting dalam mengatur degradasi myelin dan konversi denervasi sel Schwann dari proses myelinisasi untuk pertumbuhan mereka mendukung fenotip nonmyelinating. Fenotip yang terakhir ini mirip dengan sel Schwann yang tidak bermielinisasi yang biasanya mengelilingi beberapa akson tidak bermielin dan yang tidak membentuk mielin. Penghubung di fenotip dari sel-sel Schwann denervasi di tunggul saraf distal melibatkan penurunan regulasi dari mielin terkait gen dan peningkatan regulasi dari beberapa RAGs. Gen yang diregulasi termasuk untuk beberapa faktor neurotropik, reseptor trk dipotong dan reseptor faktor neurotropik P75.2 Faktor-faktor neurotropik adalah tiga famili, neurotrophin, glial cell derived neurotrophic factor (GDNF) dan neuropoetic cytokine family.2 Famili neurotrophin terdiri dari NGF, faktor neurotropik yang berasal dari otak (BDNF), neurotrophin-3, dan neurotrophin-4/5. Sel glial yang berasal dari faktor neurotropik meliputi GDNF, neurturin, persephin, dan artemin. Dari semua faktor neurotropik, NGF, BDNF, GDNF dan sitokin interleukin-6 dan leukemia inhibitory factor adalah faktor yang meningkatkan regulasi di sel Schwann yang terdenervasi. Beberapa sitokin, termasuk transforming growth factor-β (TGF-β) yang disekresikan oleh kedua makrofag dan denervasi sel Schwann dirilis pada puntung saraf distal setelah cedera saraf, terlibat dalam ekspresi faktor neurotropik pada denervasi sel Schwann. Saat ini teknik termasuk susunan gen dan penyaringan gen diferensial sekarang digunakan untuk mengidentifikasi luka-diinduksi gen dan waktu mereka tentu saja ekspresi selama transisi dari fenotif sel Scwhann bermyelin dan non-myelin. 21 2.6 Regenerasi pada Cedera Saraf pada Sistem Saraf Pusat Degenerasi Wallerian Sementara akson pada SSP mengalami degenerasi Wallerian kira-kira pada kecepatan yang sama seperti pada saraf perifer, penghapusan dari mielin yang berdegenarasi dari oligodendrosit membutuhkan waktu yang sangat lama. Setelah cedera, mikroglia menjadi fagositosis di lokasi cedera. Namun, karena kapasitas fagositosis mereka terbatas, mikroglia gagal untuk membersihkan sisa-sisa mielin dari denervasi oligodendrosit dan yang paling penting, mereka tidak efektif menghapus mielin dan penghambat pertumbuhan terkait, yang meliputi Nogo dan MAG. The mikroglia juga melepaskan sitokin. Hal ini lebih lanjut mengaktifkan respon imun ke wilayah tersebut, tetapi karena miskin aliran darah pada area luka, respon imun diperlambat secara signifikan dan, pada gilirannya, menyebabkan peradangan yang berkepanjangan. Makrofag hematogen terakumulasi dalam kepadatan tinggi hanya di lokasi cedera baik dalam SSP dan sistem saraf perifer. Namun, makrofag gagal berakumulasi di lebih jauh situs di SSP, lebih lanjut mengurangi pembuangan sisasisa mielin dalam SSP berbeda dengan saraf perifer. Hal ini berarti bahwa pembuangan sisa mielin terbatas pada titik cedera dalam SSP, dan respon imun secara keseluruhan tertunda. Akibatnya, sisa myelin tetap dalam saluran white matter untuk jangka waktu yang lama dan, dengan tidak adanya fagositosis yang efektif oleh mikroglia, maka neuron yang cedera akan menghambat regenerasi aksonal yang secara langsung terkait dengan mielin (Lihat bagian Oligodendrocyte derived myelinassociated inhibitor). Respon Neuronal Sebelum cedera, sebagian besar neuron SSP, seperti neuron dari PNS, tidak mengungkapkan tingkat tinggi RAGs. Namun, Berbeda dengan saraf perifer, cedera neuron pada SSP secara normal gagal meningkatkan regulasi dan/atau untuk 22 mendukung regenerasi aksonal. Co-ekspresi dari RAGs tertentu mungkin diperlukan untuk memungkinkan regenerasi aksonal SSP: ekspresi GAP-43 atau CAP-23 tidak cukup untuk mendorong regenerasi aksonal sedangkan co-ekspresi kedua RAG pada tikus transgenik sangat efektif untuk mempromosikan regenerasi SSP. Kegagalan cedera untuk mendorong perubahan yang kuat dalam ekspresi RAG mungkin timbul karena akson neuron SSP yang teraxotomi memiliki beberapa jaminan yang tetap untuk terhubung ke target, terutama untuk akson panjang traktat di sumsum tulang belakang. Oleh karena itu, transisi dari neuron yang terluka dari transmisi terhadap mode pertumbuhan yang terjadi pada sistem saraf perifer tidak dapat terjadi dalam neuron SSP. Temuan minimal peningkatan regulasi RAG di neuron SSP teraxotomi, kecuali axotomi dilakukan sangat dekat dengan sel tubuh.8 Kapasitas untuk pertumbuhan aksonal pada neuron SSP yang mengalami cedera jelas ditunjukkan dalam percobaan klasik Aguayo dan rekannya. Para pekerja ini menunjukkan bahwa regenerasi akson neuron SSP melalui cangkok saraf tepi yang dimasukkan ke dalam SSP. Neuron sistem saraf pusat juga dapat merangsangregenerasi akson melalui implan sel Schwann dan dimurnikan mielin saraf tulang belakang sesuai dengan temuan sebelumnya regenerasi saraf pusat melalui sel Schwann yang mengandung saraf cangkokan dari saraf perifer. Meski begitu, jumlah akson yang beregenerasi dan jarak yang kecil adalah terbaik.8 Setidaknya komponen regeneratif ini miskin kapasitas karena disebabkan rendahnya tingkat ekspresi faktor neurotropik di neuron SSP karena endogen pengiriman NGF, BDNF dan neurotrophin-3 untuk populasi cedera saraf yang mengekspresikan reseptor trk yang sesuai telah menunjukkan mendapatkan hasil yang lebih kuat aksonal melalui permisif sel cangkokan dalam konser dengan efektivitas mereka dalam mempromosikan kelangsungan hidup saraf. 8 Kemampuan faktor neurotropik untuk memperoleh hasil aksonal mungkin tergantung pada reseptor dimana mereka berada: kemampuan kontras mengeluarkan sel cangkok-neurotrophin untuk mempromosikan perkembangan akson di lesi neuron 23 coerulospinal dan tidak dalam lesi kortikospinalis neuron disebabkan oleh lokalisasi TRK reseptor pada akson, di samping dendrit dan soma, dari yang pertama namun tidak yang kedua neuron.8 Sel Non-Neuronal Oligodendrosit dan mikroglia dalam SSP gagal menahan sisa-sisa mielin, berbeda dengan efektivitas dalam hal ini sel-sel Schwann dan makrofag setelah cedera dalam saraf perifer. Kelompok oligodendrosit denervasi yang tidak berdifernsiasi dalam cara yang sama seperti sel-sel Schwann denervasi dalam saraf perifer. Mereka gagal untuk membentuk pita Bungner yang menyokong regenerasi akson di sistem saraf perifer. Molekul penghambat pertumbuhan dari mielin SSP yang tidak efektif dihapus oleh sel nonneuronal, yang juga mempromosikan proliferasi astrosit. 8 Astrosit mentransfer nutrisi ke akson dan perikarya dari SSP, mereka melindungi neuron oleh berkontribusi ke sawar darah otak dengan penyaluran limbah metabolik dari parenkim dan kelebihan neurotransmitter dari sinaps. Setelah cedera, proliferasi astrosit merupakan faktor pembatas utama dalam diferensiasi dari oligodendrosit yang berdenervasi. Akhirnya proliferasi astrosit menciptakan bekas luka glial yang tidak hanya membentuk penghalang fisik untuk pertumbuhan kerucut, tetapi juga menghasilkan penghambatan senyawa tambahan. Senyawa ini termasuk tenascin dan proteoglikan yang selanjutnya menghambat regenerasi aksonal. Namun, tidak jelas apakah senyawa itu adalah penghalang fisik molekul dilepaskan oleh jaringan parut glia, yang memiliki efek menghambat pertumbuhan yang lebih besar pada kerucut maju. Secara tradisional penghalang fisik yang padat diciptakan oleh glial jaringan parut telah dipercaya sebagai inhibitor utama regenerasi aksonal.8 Bukti terakhir menunjukkan bahwa penghalang fisik bekas luka glial mungkin memainkan peran yang relatif kecil dibandingkan dengan molekul penghambatan yang dirilis pada bekas luka, terutama chondrotin sulfate proteoglycan (CSPGs) 24 seperti NG2, versican, neurocan, dan phosphocan, oleh sel glial termasuk astrosit, prekursor oligodendrocyte, sel meningeal dan mikroglia tersebut. 8 25 DAFTAR PUSTAKA 1. Guyton, Arthur C. 1987. Fisiologi Kedokteran 148-168, Edisi ke 5. Jakarta: EGC. 2. Anonimous. 2007. Kemampuan untuk regenerasi sel-sel saraf dalam tubuh dapat mengurangi efek trauma dan penyakit dengan cara yang dramatis.http://www.news-medical.net/news/2007/05/22/43/Indonesian.aspx. 3. Anonimous. 2011. Nano membuka jalan untuk regenerasi sel saraf. http://www.news-medical.net/news/2007/05/22/43/Indonesian.aspx. 4. Price, A. Silvia; Wilson, M. Lorraine. 1995. Patofisiologi, Konsep Klinis Proses-proses Penyakit. Jakarta: EGC. 5. Anonimous. 2009. Regenerasi sistem saraf pusat akson dapat dicapai: Studi http://www.news-medical.net/news/20091029/85/Indonesian.aspx. 6. Bloom & Fawcett. 2002. Buku Ajar Histologi. Jakarta: EGC. 7. Tuck, E, Cavalli, V. 2010. Roles of Mebrane Trafficking in Nerve Repair and Regeneration. Communicative and Integrative Biology. 2010 May–Jun; 3(3): 209–214. 8. Keith Fenrich, Tessa Gordon. Axonal Regeneration in the Peripheral and Central Nervous Systems. Canadian Association of Neuroscience Review: Can. J. Neurol. Sci. 2004; 31: 142-156. 26