BAB 2 TINJAUAN PUSTAKA 2.1 Anatomi dan histologi ovarium
advertisement

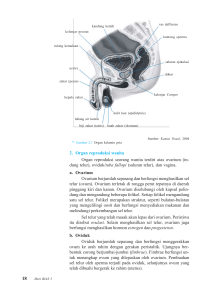
6 BAB 2 TINJAUAN PUSTAKA 2.1 Anatomi dan histologi ovarium Ovarium adalah organ reproduksi wanita yang mempunyai fungsi ganda yaitu menghasilkan serta melepaskan oosit, dan menghasilkan serta mensekresi hormon-hormon. Ovarium berbentuk lonjong, agak gepeng, sepasang, panjangnya 3 cm, lebar 2 cm, dan tebal 1 cm dengan berat kira-kira 12-15 gr. Ukurannya bervariasi selama siklus menstruasi dan selama kehamilan. Warnanya merah pucat dan permukaannya ada tonjolan-tonjolan yang tidak beraturan.9,10 Ovarium diletakkan pada postero-superior ligamentum latum oleh lipatan pendek peritoneum yang disebut mesovarium, melalui jaringan ini pembuluh darah menuju ke ovarium. Permukaan ovarium ditutupi oleh selapis epitel kubus yang melanjutkan diri ke dalam mesotel peritoneum pada mesovarium.10,11 Gambar 2.1. Gambaran anatomi organ reproduksi wanita.10 Pada pemotongan ovarium tampak terdiri atas lapisan korteks sebelah luar yang tebal dan tidak berbatas tegas dengan medulla pada bagian tengahnya. Medula ovarium terdiri atas jaringan ikat jarang yang berisi pembuluh darah 7 besar yang berkelok-kelok, pembuluh limfe dan saraf, dikarenakan medulla berhubungan langsung dengan hilus. Korteks ovarium sendiri terdiri atas stroma jaringan ikat yang mengandung banyak sekali sel-sel, yang didalamnya terbenam folikel-folikel ovarium. Sel-sel stroma berbentuk seperti kumparan dengan inti memanjang dan mirip dengan sel-sel otot polos yang kecil. Sel-sel ini tersusun padat dalam serat-serat kolagen yang halus. Pada stroma korteks membentuk suatu kapsul yang padat dan tipis yang disebut dengan tunika albuginea, yang terletak di bawah basement membrane dari epitel germinativum.10,11 Gambar 2.2. Struktur mikroskopis dari ovarium. Tampak bagian korteks dan medulla serta folikel-folikel ovarium.10 Folikel-folikel ovarium terdiri atas satu oosit dan suatu lapisan epitel yang mengelilinginya. Kebanyakan folikel-folikel ovarium adalah folikel primordial, sebagian besar dijumpai pada bagian korteks ovarium yang terletak langsung di bawah tunika albuginea. Suatu sel folikel primordial terdiri atas satu oosit dan dikelilingi oleh selapis sel-sel epitel gepeng yang disebut dengan sel-sel folikuler. Folikel primer merupakan sel-sel folikel primordial yang sedang tumbuh. Oosit membesar dan sel-sel folikular yang gepeng berkembang menjadi kubus dan kemudian menjadi kolumnar. Sitoplasmanya menjadi granular dan sel-sel ini 8 disebut dengan sel-sel granulosa. Sel-sel ini mengalami proliferasi melalui pembelahan mitosis dan tumbuh menjadi epitel berlapis yang disebut sebagai lapisan sel-sel granulosa dan mempunyai membran basalis yang jelas untuk membatasinya dengan jaringan disekitarnya. Setelah folikel berkembang, folikel akan berpindah ke lapisan yang lebih dalam di korteks, dan selanjutnya sel-sel stroma disekelilingnya tersusun menjadi selubung yang konsentris yang disebut dengan teka folikuli. Folikel ovarium dengan antrum yang berkembang penuh disebut dengan folikel sekunder. Folikel ini nantinya akan berkembang menjadi folikel de graf yang matang, yang terdiri dari ovum, stratum granulosum, teka interna dan teka eksterna.10,11 A Gambar 2.3(A) Skematik perkembangan sel-sel folikel 9 B c Gambar 2.3. Perkembangan folikel pada ovarium;(B). Gambaran mikroskopis folikel primer;(C). Gambaran mikroskopis folikel sekunder.11 Pada fase ovulasi, folikel yang matur akan keluar dari permukaan ovarium dan akan membentuk stigma. Aktifitas proteolitik pada teka eksterna dan tunika albuginea, akan diinduksi oleh peningkatan luteinizing hormones (LH), yang akan memfasilitasi pemecahan dari folikel de graf. Beberapa jam sebelum ovulasi terjadi, lapisa sel folikular dan teka interna akan memulai transformasi menjadi korpus luteum. Regresi dari korpus luteum (luteolysis) akan menjadi korpus albikans, yang dihasilkan dari stroma jaringan ikat yang menggantikan massa selsel lutein dari korpus luteum. Korpus albicans akan tetap ada pada ovarium tetapi akan menyusut ukurannya.10,11 Ada dua hormon pada anterior hipofisis yang meregulasi pertumbuhan folikel; (1). Follicle-stimulating hormones (FSH) yang merupakan hormon yang menstimulasi folikogenesis dan ovulasi serta produksi estrogen; (2). Luteinizing hormone (LH), menstimulasi sekresi dari progesteron oleh korpus luteum. Sekresi LH yang terus menerus akan menginduksi luteinisasi dari lapisan sel-sel folikel setelah ovulasi. Produksi dari FSH dan LH akan berhenti ketika level dari progesteron dan estrogen tinggi, dan korpus luteum akan berevolusi. Pada awal menstruasi, level estrogen dan progesteron akan turun dan meningkat bertahap 10 selama periode preovulasi. Estrogen akan mencapai level maksimum sebelum LH mencapai level puncak diawal ovulasi. Sintesis dari FSH yang tergantung pada estrogen oleh sel-sel folikuler akan merangsang proliferasi dari kelenjar endometrium, sebaliknya sintesis LH yang tergantung pada progesteron oleh korpus luteum akan menginisisasi dan mempengaruhi aktifitas sekresi dari kelenjar endometrium.10 Ovarium terutama mendapat perdarahan dari arteri ovarika yang dipercabangkan dari aorta. Cabang-cabang arteri mencapai hilus melalui mesovarium dan bercabang-cabang dalam medula. Cabang-cabang ini sangat berkelok-kelok dan berjalan kearah korteks dan disisni bercabang-cabang lagi dan membentuk jala-jala kapiler. Vena mengikuti arteri dan membentuk pleksus yang luas di ligamentum latum. Pembuluh limfe sangat banyak, mulai sebagai kapiler limfe di korteks, terutama di teka eksterna dan menjadi satu untuk membentuk pembuluh limfe yang lebih besar yang selanjutnya melalui medula ke hilus. Sebelah luar ovarium dibentuk pembuluh limfe yang lebih besar, yang mengikuti arteri ovarika ke nodus limfatikus aorta lateralis dan nodus limfatikus preaorta. Saraf-saraf membentuk pleksus ovarika yang mengikuti arteri ovarika. Saraf-saraf melalui hilus dan terdiri atas serat-serat simpatis dan parasimpatis.10,11 11 Gambar 2.4. Gambar sistem aliran darah pada ovarium.11 2.2 Epidemiologi dan Faktor Risiko Kanker ovarium menurut WHO merupakan 30% kasus keganasan yang dijumpai pada organ reproduksi wanita. Pada negara-negara berkembang, kanker ini umum terjadi sebagaimana kanker uteri dan kanker serviks yang invasif. Didunia, setiap tahunnya hampir 204.000 wanita didiagnosis dengan kanker ovarium dan 125.000 wanita meninggal akibat penyakit ini (Sankaranarayanan,2006). Untuk kasus kanker ovarium yang berasal dari epitel ini hampir menduduki 90-95% dari semua kasus. Secara umum, tidak adanya screening test untuk kanker ovarium ini sendiri dan sedikitnya gejala-gejala yang dirasakan menjadikan sepertiga pasien didiagnosis pada keadaan yang sudah lanjut. Pembedahan debulking yang agresif, diikuti oleh kemoterapi berbasis platinum biasanya menghasilkan kondisi klinis yang mengalami remisi dan 80% akan berkembang menjadi relaps dan akan menuju kearah kematian. Satu dari 78 wanita Amerika akan mendapatkan kanker ovarium selama kehidupannya. Pada tahun 2007, ada 22.430 kasus baru yang berkembang di Amerika Serikat dan sedikit yang datang pada stadium dini sehingga 15.280 wanita meninggal 12 olehkarenanya dan menyebabkan kanker ovarium ini sebagai pembunuh kelima yang menyebabkan kematian oleh kanker (Jemal, 2007). Usia rata-rata pada saat didiagnosis adalah pada decade ke-6.10,12 Banyaknya reproduksi, lingkungan serta faktor risiko genetik dihubungkan dengan perkembangan dari kanker ovarium. Yang paling penting adalah adanya sejarah keluarga yang menderita kanker payudara atau kanker ovarium dan sedikitnya 5-10% pasien memiliki predisposisi genetik. Ada beberapa faktor risiko untuk kanker ovarium yang berasal dari epitel, antara lain adalah: nulliparitas, menarche yang terlalu dini, menopause yang terlalu lama, berkulit putih, usia tua dan adanya sejarah keluarga yang juga menderita kanker ovarium. Sejarah keluarga yang menderita kanker ovarium dihubungkan dengan tingkat pertama kekerabatan, yaitu ibu anak dan saudara perempuan.12,13,14 2.3 Patogenesis Patogenesis dari kanker ovarium belum diketahui dengan jelas karena belum adanya model perkembangan tumor yang diakui. Surface epithelial stromal tumor ovarium (SETO) diyakini berasal dari lapisan mesotelium yang melapisi permukaan ovarium/ovarian mesothelium (OM) dan atau invaginasi OM ke dalam korteks ovarium yang membentuk kista. Epitel yang melapisi ovarium atau OM merupakan bagian continue dari mesotelium yang melapisi peritoneum. OM normal secara morfologi bervariasi mulai dari simple squamous, cuboidal atau low pseudostratified columnar. Secara embriologis OM berasal dari epitelium mesodermal pada gonadal ridge. Tetapi terdapat beberapa perbedaan yang dapat ditemukan antara OM dengan mesotelium pada peritoneum (MP); 13 (1). OM melekat secara sangat longgar dengan struktur dibawahnya sehingga dapat dengan mudah dilepaskan dari ovarium dan terpisah dari stroma ovarium dan dari sirkulasi. Hal ini menunjukkan bahwa akses OM terhadap faktor regulator lokal dan sistemik dan pertukaran terhadap zat metabolit berkurang jika dibandingkan dengan MP atau bagian ovarium lainnya; (2). Terdapat reseptor hormone dan faktor pertumbuhan yang ditemukan pada sel OM tetapi tidak pada MP. Sebagai contoh, pada OM dijumpai reseptor untuk follicle stimulating hormone (FSH), Human chorionic gonadotropin (HCG)/luteinizing hormone (LH) dan hormon-hormon ini merupakan mitogen untuk OM. Tetapi reseptor untuk hormon ini tidak dijumpai pada MP; dan (3). Tumor marker ovarium dan diferensiasi marker CA 125 disekresikan oleh MP, epitel yang melapisi tuba uterine, endometrium dan derivat lainnya yang berasal dari epitel coelomic kecuali OM. Hal ini menunjukkan perbedaan antara diferensiasi yang dialami MP dengan OM dimana OM tidak mencapai tahap diferensiasi yang dialami oleh MP. Sehingga dapat diinterpretasikan bahwa OM lebih immatur dan kurang menunjukkan fenotip mesotelium sehingga dapat diartikan bahwa OM lebih mudah mengalami transformasi neoplastik.10,11,14,15 14 Gambar 2.5. Gambaran ovarian tumoregenesis. OM dibentuk oleh simple epitel yang melekat ke basement membrane pada permukaan ovarium. Setelah ovulasi, luka pada permukaan OM akan diperbaiki dengan proliferasi sel OM. Proses penyembuhan luka dapat menyebabkan pembentukan kripta dalam stroma. Ekspresi sejumlah gen diinduksi pada invaginasi epitel dan pada kista sehingga struktur ini lebih peka terhadap transformasi neplastik. Pada keadaan yang belum pasti, akan menjadi tumor.10 Permukaan ovarium pada awal kehidupan terlihat mulus, seiring dengan pertambahan usia maka akan tampak berkelok. Invaginasi epitel akan menghasilkan kripta atau kelenjar dapat terlepas dan membentuk kista inklusi epitel di dalam stroma. Hal ini mungkin saja terjadi proliferasi OM postovulasi, folikel yang berkembang dan/atau akibat inflamasi yang disebabkan oleh karsinogenik atau iritasi kimia seperti talcum powder. Walaupun kista inklusi ini dapat dijumpai pada semua tingkatan umur termasuk pada infan dan dewasa. Tetapi angka kejadiannya meningkat sesuai dengan peningkatan umur sehingga merupakan hal yang umum dijumpai pada usia pasca menopause. Angka kejadian kanker ovarium meningkat secara dramatis pada wanita pasca menopause. Hal ini mungkin disebabkan terjadinya perbedaan antara wanita pre dan pasca menopause yang mempengaruhi ovarium; 1). Berkurangnya oosit yang merupakan sebab terjadinya menopause; 2). Penurunan kadar estrogen yang bersirkulasi akibat berkurangnya folikel yang berkembang; dan 3). Peningkatan bermakna produksi FSH, LH yang diakibatkan oleh menurunnya kadar estrogen.10,12,14,15 15 Setidaknya ada tiga jalur tumorigenesis yang diperhitungkan dalam perjalanan kanker ovarium yang berasal dari epitel. Pertama, walaupun sedikit kasus tampaknya muncul dari perubahan genetik yang menyebabkan transformasi ganas dari kista jinak menjadi tumor low malignant potential dan akhirnya berkembang menjadi karsinoma ovarium invasif (Makarla, 2005). Pada tumortumor ini, mutasi onkogenik K-ras terjadi lebih awal. Keluarga ras onkogen termasuk K-ras, H-ras dan N-ras. Produk protein keluarga ras ini berpartisipasi dalam regulasi siklus sel dan kontroling proliferasi sel. Dengan demikian, mutasi ras terlibat dalam karsinogenesis dengan menghambat apoptosis sel dan akan merangsang proliferasi sel. Kedua, sekitar 5-10 persen kanker ovarium yang berasal dari epitel berasal dari predisposisi herediter. Wanita dengan mutasi BRCA hanya memerlukan satu “hit” pada kopian sel nomal untuk “knock out” produk tumor supresor gen BRCA. BRCA terkait kanker ovarium dan peritoneal memiliki patogenesis molekul yang cukup unik, ia membutuhkan p53 inaktif untuk berkembang. p53 adalah tumor supresor gen yang dipetakan pada kromosom 17. Produk protein ini menghambat sel-sel memasuki tahap berikutnya dari proses pembelahan sel dan menghentikan ketidakkontrolan dari replikasi sel tumor. Mutasi pada p53 terkait pada berbagai kanker, bahkan hilangnya fungsi BRCA dan p53 telah terdeteksi sebelum terjadinya proses invasi dan mendukung sebagai pemicu awal terjadinya kanker. Ketiga, sebagian besar karsinoma tampaknya berasal secara de novo dari sel epitel permukaan ovarium.7,10,16,17 16 2.4 Gejala Klinis Hampir 70% pasien datang dengan kanker ovarium stadium lanjut dan seperti telah bermetastasis ke rongga obdomen atas atau keluar dari rongga abdomen. Beberapa hal yang menyebabkan hal ini adalah tidak adanya gejala awal penyakit dan tidak adanya tes diagnostik yang memungkinkan deteksi dini neoplasma ini. Gejala yang umumnya yang diderita oleh penderita kanker ovarium biasanya terselubung dan sering kali memiliki kemiripan dengan berbagai penyebab gangguan gastrointertinal.3 Pada pemeriksaan klinis pada penderita dengan stadium awal (stadium I), hasil pemeriksaan palpasi rongga pelvik didapati massa yang mobil tetapi irregular. Pada stadium II, saat neoplasma menyebar ke rongga pelvik, nodul dapat dijumpai pada cavum douglas terutama pada saat pemeriksaan bimanual rectovaginal. Asites dapat dijumpai pada stadium IC dimana keganasan terbatas pada satu atau dua ovarium. Jika keganasan telah melibatkan rongga abdomen atas, maka asites akan semakin jelas yang ditandai dengan abdomen buldging dan gerakan cairan pada rongga abdomen. Pada stadium III, metastasis yang umumnya dijumpai adalah metastasis ke omentum yang biasanya teraba sebagai massa di bagian tengah abdomen di atas umbilical. Pada stadium IV, biasanya telah menyebar melalui limfe ke kelenjar limfe inguinal atau kelenjar supraklavikula kiri yang dapat dengan jelas diraba, Juga dapat menyebar ke rongga pleura sebagai efusi pleura yang malignan, biasanya sisi kanan atau bilateral. Pada penyebaran massa intra abdominalyang luas, maka dapat menyebabkan timbulnya gejala obstruksi intestinal seperti nausea, muntah dan nyeri abdomen.1,3,4,9,14,15 17 Walaupun kadar CA 125 meningkat pada lebih dari 80% kasus dengan ovarian karsinoma yang sudah lanjut, tetapi pengukuran kadar CA 125 tanpa disertai dengan pemeriksaan lainnya tidak cukup sensitif atau spesifik dalam menegakkan diagnosis. Kadar CA 125 yang meningkat biasanya dihubungkan dengan keadaaan seperti kehamilan, endometriosis, adenomyosis, uterine fibroid, pelvic inflammatory disease, menstruasi dan kista yang benign. Kadar CA 125 yang meningkat juga dijumpai pada kanker pancreas, payudara, paru-paru, gaster dan kolon. Sehingga pengukuran CA 125 tidak memberikan manfaat pada evaluasi preoperatif pada kanker ovarium. Tetapi jika kadar CA 125 meningkat pada wanita postmenapause dengan terdapatnya massa intra abdomen atau pelvik, dapat dicurigai sebagai kanker ovarium.3,7,11,15 18 2.5 Klasifikasi Klasifikasi surface epithelial-stromal tumor ovarium (SETO) menurut WHO tahun 2003 adalah : Klasifikasi WHO I. Serous Tumor (30%) 1. Serous Adenocarcinoma 2. Serous Borderline Tumour 3. Benign Serous Tumor A. Serous papillary (75%) cystadenoma B. Serous cystadenoma C. Serous surface papilloma D. Serous adenofibroma cystadenofibroma II. Mucinous Tumor 1. Mucinous adenocarcinoma (15%) (20%) 2. Mucinous cystadenocarcinofibroma 3. Mucinous borderline tumor 4. Mucinous cystadenoma 5. Mucinous adenofibroma III. Endometrioid 1. Endometrioid A. Not otherwise tumor (20%) adenocarcinoma (10specified 20%) B. Variant with squamous differentiation C. Cilliated variant D. Oxyphilic variant E. Secretory variant 2. Adenocarcinofibroma 3. Malignant Mullerian mixed tumor 4. Adenosarcoma IV. Clear cell tumor 1. Clear cell adenocarcinoma 2. Clear cell adenocarcinofibroma 3. Clear cell tumour of borderline malignancy 4. Clear cell adenofibroma of borderline malignancy 5. Clear cell cystadenoma 6. Clear cell cystadenofibroma V. Transitional cell 1. Transitional cell carcinoma (non brenner) Tumor 2. Malignant Brenner tumor 3. Borderline Brenner tumor 4. Brenner tumor VI. Squamous cell 1. Squamous cell carcinoma lesions 2. Epidermoid cyst VII. Mixed epithelial 1. Malignant mixed epithelial tumor tumor 2. Borderline mixed epithelial tumor 3. Benign mixed epithelial tumor VIII. Undifferentiated carcinoma & Unclassified adenocarcinoma Tabel 2.1. Klasifikasi kanker ovarium menurut WHO.4 Kode ICDO 8441/3 8442/1 8460/0 8441/0 8461/0 9014/0 8480/3 9015/3 8472/1 8470/0 9015/0 8380/3 8570/3 8383/3 8290/3 8392/3 8381/3 8950/3 8933/3 8310/3 8313/3 8310/1 8313/1 8310/0 8313/0 8120/3 9000/3 9000/1 9000/0 8070/3 8323/3 8323/1 8323/0 8020/3 & 8140/3 19 2.6 Serous Adenocarcinoma Defenisi serous adenocarcinoma menurut WHO adalah neoplasma epitel ovarium yang terdiri dari sel dengan tampilan yang bervariasi, pada tumor dengan diferensiasi baik, sel mirip dengan epitel yang melapisi tuba fallopi, sedangkan pada tumor dengan diferensiasi yang jelek, tumor dibentuk oleh sel epitel yang anaplastik dengan atipia inti berat.4,12,14,15 Secara makroskopis tumor bervariasi dari yang tidak terdeteksi sampai yang berukuran besar lebih dari 20 cm, dan biasanya bilateral yang dijumpai pada hampir 2/3 kasus. Hanya 1/3 kasus yang dijumpai pada stadium I.4 Permukaan tumor ini menunjukkan gambaran massa yang padat yang irregular dan kistik. Permukaan luar massa tumor terlihat irregular karena infiltrasi tumor.1,4,9 Tumor dengan differensisasi baik adalah tumor yang padat dan kistik dengan papila yang lunak diantara ruangan yang kistik atau pada permukaan tumor. Papilla lebih lunak dan berkumpul pada kasus yang borderline. Sangat jarang tumor berbatas pada permukaan ovarium. Tumor dengan diferensiasi buruk adalah tumor yang padat, rapuh, multinoduler dengan massa nekrosis dan perdarahan.17,18,19 Gambar 2.7. Gambaran makroskopis dari serous adenocarcinoma.(A). Massa solid dengan nekrosis fokal.(B).Tampak permukaan yang berbenjol-benjol.14 20 Secara histopatologi, massa tumor menunjukkan gambaran yang bervariasi mulai dari glandular, papiler sampai bentuk yang padat. Kelenjar baisanya dengan lumen yang tipis atau irregular. Papila biasanya bercabang irregular dan sangat seluler. Dinding pelapis epitel biasanya mempunyai membentuk struktur papiller dengan sel yang berlapis, sel atipik dan tampak infiltrasi pada stroma atau kapsul.9 Pada tumor dengan diferensiasi yang buruk, tampak massa padat yang luas dan dijumpai sel-sel yang berdiferensiasi jelek dengan struktur papiler yang dipisahkan oleh stroma yang myxoid atau hyline. Psammoma body biasanya dapat dijumpai dengan jumlah yang bervariasi. Stroma sedikit atau desmoplastik.9,16,17 Gambar 2.8. Gambaran mikroskopis high grade serous adenocarcinoma. (A). Tampak sarang-sarang tumor dengan pseudoglandular space dan struktur papilla.(B). Tampak sel-sel epitel yang pleomorfik dengan anak inti menonjol.12 Pemeriksaan imunohistokimia menunjukkan reaksi yang positif dengan cytokeratin 7 dan reaksi negatif dengan cytokeratin 20. Reaksi positif lainnya antara lain dengan epithelial membrane antigen, CAM5.2, AE1/AE3, B72.3 dan CA 125 (pada 75% kasus). Reaksi negatif untuk calretinin dan petanda mesotelial lainnya.15,17 21 Serous adenocarcinoma adalah neoplasma yang sangat ganas, infiltrating dan bisa bermetastasis pada awal perkembangan penyakitnya. Penyebaran ke rongga peritoneum dan omentum terjadi pada awal perkembangan penyakit, begitu juga dengan penyebaran melalui kelenjar limfe dan bermetastasis awal pada kelenjar limfe pelvik dan paraaorta. Metastasis jauh biasanya terjadi pada tahap lanjut dari penyakit terutama pada paru-paru dan hepar.7,19 Angka ketahanan hidup 5 tahun secara keseluruhan hampir 40%. Pada kasus yang sudah bermetastasis maka angka ketahanan hidup 5 tahun menjadi 1020%. Pada kasus dengan karsinoma terbatas pada ovarium saja atau pada pelvik, angka ketahanan hidup selama 5 tahun mencapai 80%.12 2.7 Mucinous adenocarcinoma Defenisi mucinous adenocarcinoma menurut WHO adalah tumor epitelial ovarium yang malignan dimana pada daerah yang berdiferensiasi baik, epitelnya akan menyerupai epitel pada endoserviks atau intestinal. Ovarium mucinous adenocarcinoma berbeda dengan tumor borderline dengan dijumpainya invasi pada stroma.4 Mucinous adenocarcinoma terjadi sekitar 10% pada kanker ovarium dengan 1/6 kasus adalah bilateral. Kanker musinosum biasanya multicollar dengan ratusan bahkan ribuan kista yang kecil-kecil. Tumor ovarium musinosum sering terdiri dari area-area yang solid atau dengan projeksi papillary. Area yang kistik biasanya merupakn tumor borderline dan gambaran ganas dijumpai pada area solid.14,15,16,17 22 Mucinous adenocarcinoma biasanya memiliki gejala awal yang tidak jelas, tampak adanya distensi abdomen dengan asites dan nyeri pada keadaan lanjut. Stadium I terbatas pada ovarium, stadium II melibatkan pelvik, stadium III menyebar ke rongga abdomen dan stadium IV dengan metastasis jauh. Mucinous adenocarcinoma cenderung menginvasi organ sekitar seperti saluran cerna, dinding abdomen dan kandung kemih. Metastasis ke tempat jauh jarang terjadi. Kadang-kadang disertai dengan deposit mucin intraabdomen yang disebut dengan pseudomyxoma peritonei.1,12,16,17 Gambar 2.9. Gambaran makroskopis mucinous adenocarcinoma dengan kista yg multilokus dgn bagian padat lebih dominan & kista berukuran kecil.12 Mucinous adenocarcinoma biasanya berukuran besar, unilateral dengan permukaan yang licin, multiokular atau uniokular dengan isi materi yang cair atau kental berlendir. Area perdarahan, nekrosis, solid atau papillary relatif sering dijumpai dan pada beberapa kasus lebih sering dijumpai bagian yang solid. Mucinous adenocarcinoma secara histopatologis menunjukkan gambaran menyerupai kelenjar yang banyak atau pertumbuhan papillary dengan inti yang atipik dan berlapis serta menyerupai tubuler adenoma atau villous adenoma dari usus halus. Gambaran susunannya bervariasi mulai dari well differentiated 23 sampai dengan yang poorly differentiated. Tumor mucinous yang well differentiated terdiri dari kelenjar-kelenjar neoplastik yang dibatasi oleh sel-sel kolumnar tinggi, sel-sel penghasil mucin, biasanya dengan beberapa area yang solid atau cribriform. Tumor mucinous yang poorly differentiated menunjukkan sarang-sarang dan kumpulan sel-sel tumor yang ireguler dan mitosis yang banyak. Invasi stroma dan serosa umum terjadi.9,12,19,20 Gambar 2.10. Gambaran mikroskopis mucinous adenocarcinoma dengan gambaran kelenjar yang back to back dengan invasi minimal pada stroma (tipe ekspansil).19 Berdasarkan tipe invasinya, terdapat dua tipe ekspansil dan tipe infiltratif. Pada invasi tipe ekspansil, kelenjar-kelenjar dan kista-kista dibatasi oleh sel-sel yang ganas. Kelenjar tersusun back to back, bercabang-cabang dibatasi sel-sel epitel atau rongga kistik yang dibatasi complex papillae dan mengandung materi eosinofilik dan nuclear debris. Sel-sel epitelnya adalah kolumnar dengan sitoplasma eosinofilik atau mucinous, kadang-kadang dengan sel-sel goblet. Pada invasi tipe infiltratif, lapisan kelenjar atau sel-sel epitel tunggal secara sembaranagan menginvasi stroma. Sel-sel invasi mungkin menyerupai endoserviks atau intestinal dan memiliki sitoplasma eosifilik. Kadang-kadang pada karsinoma musinous ini memiliki gambaran seperti karsinoma koloid. Mungkin juga tampak gambaran signet ring cells yang sering juga mencerminkan 24 adanya metastasis. Stroma bisa desmoplastik dengan atau tanpa sel-sel inflamasi atau menjadi seluler dan fibromatous. Pada tipe infiltratif secara biologi lebih agresif dibanding dengan invasif tipe ekspansil.3,16,17,20,21 Secara imunohistokimia, sel-sel tumor dari tumor mucinous ovarium mengekspresikan CEA, keratin (CK7 dan CK20), EMA, MUC5AC dan Dpc4. Pewarnaan positif kuat terhadap CK7 dan negatrif untuk CK20 yang membedakannya dengan adenocarcinoma colorectal yang bermetastasis ke ovarium dimana pada kasus ini negative terhadap CK7 dan positif kuat terhadap CK20.19,20,21 2.8 Grading dan staging Stadium kanker ovarium menurut klasifikasi FIGO: Tabel 2.2. Stadium kanker ovarium.13 25 Grading untuk kanker ovarium umumnya berdasarkan sistem grading dari Silverberg. score Architecture Cytologic atypia Mitoses/10HPFs 1 Glandular Slight 0-9 2 Papillary Moderate 10-24 3 Solid Marked ≥ 25 Tabel 2.3. Grading berdasarkan sistem Silverberg.13 Keterangan : Grade 1 atau well differenciated skor : 3-5 Grade 2 atau moderate differenciated skor : 6-7 Grade 3 atau poorly differenciated skor : 8-9 Pola pertumbuhan dari kanker ovarium yang berasal dari epitel dapat dinilai dari arsitektural berdasarkan struktur dominan arsitektural yang dijumpai, bentuk glandular, papiler dan solid. Atipia inti diperhatikan dan dievaluasi pada daerah yang paling atipik, dimana penilaian untuk atipia ringan jika variasi ukuran dan bentuk inti ≤2:1, atipia sedang jika variasi bentuk dan ukuran inti sel sudah lebih variatif (antara 2:1 dan 4:1), anak inti dapat dilihat tetapi dengan ukuran yang kecil, kromatin menggumpal, tetapi belum ditemukannnya sel-sel bizarre. Atipia berat dapat dinilai jika ukuran dan bentuk inti sangat bervariasi (>4:1), pleomorfik, kromatin menggumpal, anak inti sangat prominen dan dapat dijumpainya sel-sel bizarre. Untuk menilai banyaknya mitotik, digunakan mikroskop dengan pembesaran besar (lensa optik 10x dan lensa objektif 40x) dan biasanya dilakukan pada daerah yang paling aktif pertumbuhannya. Penilaian dilakukan dengan fase mitotik metafase, anafase dan telofase. Inti yang hiperkromatik dan yang mengalami apoptotik harus dieksklusikan. Mitotik ringan jika dijumpai <10 mitotik abnormal per 10 lapangan pandang besar, mitotik 26 sedang jika dijumpai 10-24 mitotik abnormal per 10 lapangan pandang besar dan mitotik yang berat jika dijumpai >25 mitotik abnormal per 10 lapangan pandang besar. 2.9. Protein Gen Product (PGP9.5) PGP9.5, dikenal juga sebagai ubiquitin C-terminal hydrolase 1 (UCHL1), adalah peptida-neuro tertentu yang menghilangkan ubiquitin dari protein ubiquinated dan mencegahnya dari degradasi yang ditargetkan oleh proteasom. Ubiquitin merupakan protein yang berukuran kecil yang berperan penting dalam identifikasi dan membuang protein yang menjadi sasaran untuk dihancurkan. Modifikasi protein melalui proses ubiquinisasi atau proses deubiquinisasi sangat penting pada berbagai jaras seluler termasuk pada pengaturan siklus sel, respon sel terhadap stress dan perbaikan DNA. Beberapa studi telah menunjukkan PGP9.5 diinaktivasi oleh Promoter Hypermethylitation (PH) di beberapa tumor yang solid. Mizukami et al. telah mengamati metilasi PGP9.5 sering pada kanker kolorektal dan didapati lebih termetilasi pada pasien stadium awal dari pada kasus metastasis. Mariana Brait et al. (2013) melaporkan untuk pertama kalinya PGP9.5 secara signifikan lebih termetilasi pada tahap awal dan low grade dari kanker ovarium. Ada kontroversi mengenai peran PGP9.5 sebagai tumor surpresor gen atau onkogen kanker. Dalam studi oleh Tokumaru et al. (2008) PGP9.5 ditemukan memiliki frekuensi tinggi sebagai Promoter Hypermethylitation (PH) dalam tumor primer, dan data mereka mendukung bahwa gen ini sebagai tumor surpresor gen yang tidak aktif oleh Promoter Hypermethylitation (PH). Pada sisi lain, banyak laporan bahwa PGP9.5 yang 27 diekspresikan pada kanker primer. Overekspresi pada jaringan kanker primer bisa menjadi penyebab atau akibat dari transformasi. Jika sebagai penyebab transformasi, PGP9.5 akan menjadi molekul onkogenik, tapi profil klinis yang dilaporkan di sini tidak mendukung gagasan ini untuk kanker ovarium yang secara signifikan PGP9.5 lebih dimetilasi di tahap awal kanker ovarium dan tidak ditemukannya metilasi pada epitel ovarium normal. Dalam kanker ovarium, PGP9.5 telah dianalisis sebelumnya dengan konvensional methylation specific PCR (MSP) dan bisulfite sequencing, dan menunjukkan frekuensi yang sangat rendah yaitu hanya sekitar 6%.8,21,22,23 28 2.10. Kerangka Konsepsional Mutasi Genetik Muncul secara de novo Faktor risiko Sel epitel Permukaan Jejas Promoter hypermethylation oleh mutasi PGP9.5 Hilangnya tumor suppressor Induksi dari onkogen Defek pada stimulasi differensiasi mitosis, tidak terkontrolnya siklus sel yang menghambat proses apoptosis Kanker Ovarium Kanker ovarium yang berasal dari epitel permukaan (WHO) Adenocarcinoma serosum Adenocarcinoma mucinosum Endometrioid carcinoma Clear cell Transisional cell