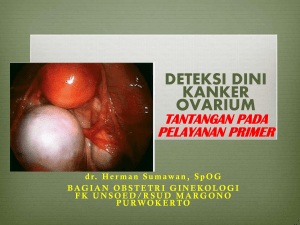
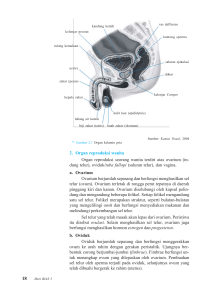
terdapat perbedaan ekspresi her-2/neu pada kanker
advertisement

TERDAPAT PERBEDAAN EKSPRESI HER-2/NEU PADA KANKER OVARIUM DERAJAT DIFERENSIASI BAIK DAN BURUK dr. I Gede Mega Putra, Sp.OG(K) BAGIAN/SMF OBSTETRI DAN GINEKOLOGI FAKULTAS KEDOKTERAN UNIVERSITAS UDAYANA/ RSUP SANGLAH DENPASAR 2014 1 ABSTRAK TERDAPAT PERBEDAAN EKSPRESI HER-2/NEU PADA KANKER OVARIUM DERAJAT DIFERENSIASI BAIK DAN BURUK Kanker ovarium masih menjadi masalah kesehatan di dunia terkait dengan insiden dan mortalitasnya. HER-2/neu merupakan salah satu faktor yang diduga berperan dalam mekanisme karsinogenesis kanker ovarium epithelial. Penelitian ini merupakan studi cross-sectionaldi Bagian Kebidanan dan Penyakit Kandungan, Patologi Anatomi dan Rekam Medis Rumah Sakit Umum Pusat (RSUP) Sanglah, Denpasar yang dilakukan mulaiJuli 2011 sampai Juli 2013 dengan sampelpenelitian sebanyak 44 buah blok parafin. Sampel blok parafin ini dikelompokkan berdasarkan atas derajat diferensiasi kanker ovarium, yaitu: kanker ovarium derajat diferensiasi baik, sedang, dan buruk. Kemudian masingmasing kelompok stadium dilakukan pemeriksaan ekspresi HER-2/neu dengan teknik imunohistokimia. Selanjutnya dilakukan penilaian perbedaan ekspresi HER-2/neu pada kanker ovarium derajat diferensiasi baik,sedang, dan buruk Uji Chi-square. Penelitian ini memperoleh adanya perbedaan ekspresi HER-2/neu pada kanker ovarium derajat diferensiasi baik dan buruk (p =0,034). Sedangkan pada analisis statistik ekspresi HER-2/neu pada kanker ovarium derajat diferensiasi baik dan sedang (p =0,330) demikian pula ekspresi HER-2/neu pada kanker ovarium derajat diferensiasi sedang dan buruk (p =0,358) masing-masing tidak terdapat perbedaan. Disimpulkan bahwa terdapat perbedaan ekspresi HER-2/neu pada kanker ovarium derajat diferensiasi baik dan buruk. Kata kunci: ekspresi HER-2/neu, derajat diferensiasi kanker ovarium. ABSTRACT DIFFERENCES OF HER-2/NEU EXPRESSION WAS OBTAINED FROM WELL AND POOR DIFFERENTIATED OVARIAN CANCER Ovarian cancer is still one of the health problems throughout the world regarding to its incidence and mortality rate. HER-2/neu is one of the factors that involve in the carcinogenesis mechanism of epithelial type ovarian cancer. This study was a cross-sectional study in Obstetrics and Gynecology Department, Anatomical Pathology Department and Medical Record of Sanglah Hospital, Denpasar in July 2011 until July 2013 with 44 paraffin block samples. These paraffin block samples were categorized based on the degree of ovarian cancer differentiation, which are well, moderate and poor differentiated. Afterwards, immunohistochemistry test toward HER-2/neu expression was conducted upon each group. Finally, the analysis of differences between HER2/neuexpression in well, moderate and poor differentiated ovarian cancer was done with Chi-square test. From this study, it was obtained that there was difference of HER-2/neu expression from well and poor differentiated ovarian cancer (p = 0,034). While based on the statistical analysis, the HER-2/neu expression in well and moderate differentiated ovarian cancer (p = 0,330) and HER-2/neu expression in moderate and poor differentiated ovarian cancer (p = 0,358) both showing no differences. It was concluded that there was different HER-2/neu expression obtained from well and poor differentiated ovarian cancer. Keywords : HER-2/neu expression, differentiation degree of ovarian cancer BAB I PENDAHULUAN 1.1 Latar Belakang Sampai saat ini, kanker ovarium masih menjadi masalah kesehatan di dunia terkait dengan insiden dan mortalitasnya. Insiden kanker ovarium menempati urutan ke-6 akan tetapi angka kematian menempati urutan pertama diantara seluruh jenis kanker. Di dunia, diperkirakan insiden kanker ovarium adalah 250.000 kasus baru dan menempati urutan ke enam. Di Amerika Serikat, neoplasma ini menempati urutan kedua di antara kanker ginekologi dan cenderung meningkat. Pada tahun 2004, terdapat lebih dari 25.580 kasus baru dengan jumlah kematian sekitar 16.090 wanita tiap tahunnya (Santin, 2006) dan merupakan yang paling mematikan dimana terhitung lebih dari 15.000 kematian setiap tahunnya (Jemal dkk, 2008). Diperkirakan pada tahun 2010 akan terdiagnosis kasus baru sebesar 21.880, dengan angka kematian ± 63,30% (American Cancer Society, 2010). Di Indonesia, kanker ovarium menduduki urutan ke-6 terbanyak dari tumor ganas pada wanita setelah kanker serviks uteri, payudara, kolorektal, kulit dan limfoma (Busmar, 2006). Sementara, di Rumah Sakit Umum Pusat (RSUP) Sanglah, pada tahun 2005 diperoleh angka kejadian kanker ovarium sebesar 35% dari seluruh kanker ginekologis dengan angka harapan hidup selama lima tahunnya hanya sebesar 15% (Karyana, 2005). Penyebab pasti kanker ovarium belum diketahui sehingga mekanisme karsinogenesisnya juga belum diketahui. Beberapa faktor risiko dilaporkan seperti pola makan, paritas, hamil usia dini, indeks masa tubuh (IMT), akseptor pil kontrasepsi, induksi ovulasi, riwayat keluarga kanker payudara, kolon, dan uterus. Akan tetapi, nomenklatur histopatologiknya telah mendapat kesepakatan luas. Kanker ovarium berasal dari sel-sel yang menyusun ovarium yaitu sel epitel, sel germinal dan sel stromal. Sel kanker dalam ovarium juga dapat terjadi sekunder berupa metastasis dari organ lainnya; terutama sel kanker payudara dan kanker kolon (Omranipous, 2009; Abasahl, 2009). Sebagian besar, kanker ovarium berupa sel epitelial baik skuamous maupun adenous (Berek, 2002; Busmar, 2006) dimana derajat diferensiasi sel merupakan salah satu yang menentukan progonosisnya. Derajat diferensiasi sel epitel pada kanker ovarium dibedakan atas baik, sedang, dan buruk berdasarkan atas pola arsitektur yang dominan, derajat atipia inti sel, dan indeks mitosis (Malpica, 2004; Sriwidyani, 2008). Derajat diferensiasi sel baik berkaitan dengan progonosis dubia ad bonam; demikian juga sebaliknya. Berbagai faktor mungkin terkait dengan derajat diferensiasi dalam mekanisme patogenesisnya, namun belum dapat menjelaskan mekanisme biokimia dan biomolekuler. Di tingkat klinik, operasi dengan pengangkatan jaringan ovarium diikuti oleh sitostatika dan radiasi belum menunjukkan hasil memuaskan. Dengan demikian, moleculer targeted therapy pada kanker ovarium lebih menjanjikan keberhasilan terapi. Sementara, terapi tersebut membutuhkan studi mekanisme karsinogenesis biomolekuler dengan mengidentifikasi berbagai jenis protein yang berperan. Pemahaman mengenai biomolekuler pada kanker ovarium terus meningkat pada beberapa tahun terakhir. Hal ini membawa pada ditemukannya sejumlah target terapi dan faktor prognostik molekuler yang baru. Human epidermal growth factor receptor (HER-2/neu) merupakan salah satu faktor yang diduga berperan dalam mekanisme karsinogenesis kanker ovarium epithelial (Reses,1997; Helstrom 2001) dan juga sebagai faktor prognostik (Sasaki, 2007). Protein HER2/neu merupakan suatu protoonkogen yang termasuk dalam golongan epidermal growth factor receptor (EGFR) yang berperan dalam proses transduksi sinyal untuk proliferasi dan diferensiasi sel kanker (Andrijono, 2004). Sekitar 25-30% kasus kanker ovarium menunjukkan overekspresi HER-2/neu (Reese, 1997; Hellstrom, 2001). Bila terdapat overekspresi protein HER-2/neu pada jaringan kanker maka aktifitas proliferasi dari kanker akan meningkat. Penelitian yang dilakukan oleh Lassus dkk (2004) menemukan bahwa ekspresi HER-2/neu positif banyak terdapat pada derajat diferensiasi jelek. Hal ini juga berhubungan dengan prognosis yang jelek dan angka kekambuhan yang tinggi (Crump dkk., 2000; Camilleri dkk., 2003). Secara klinis, setiap pemeriksaan histopatologik kanker ovarium harus mencantumkan derajat diferensiasi terkait dengan terapi dan prognosis. Dengan memperhatikan hal-hal tersebut maka sangat penting dilakukan penelitian untuk mengetahui apakah ada perbedaan ekspresi her-2/neu pada kanker ovarium derajat diferensiasi baik dan sedang, baik dan buruk, sedang dan buruk. Pentingnya mengetahui status Her-2/neu dari suatu jaringan kanker ovarium dapat menjadi landasan yang kuat bagi para klinisi untuk menentukan pendekatan terapi yang paling efektif yakni menentukan jenis kemoterapi yang paling tepat dan memperkirakan prognosis dari pasien. Disamping itu dapat digunakan sebagai dasar pemikiran bagi para peneliti dalam mendukung pengembangan ide penggunaan gen HER 2/neu sebagai deteksi dini dalam kanker ovarium. 1.2 Rumusan Masalah Berdasarkan uraian dalam latar belakang masalah di atas dapat dirumuskan pertanyaan penelitian adakah perbedaan ekspresi HER-2/neu pada kanker ovarium derajat diferensiasi baik dan buruk? 1.3 Tujuan Penelitian Adapun tujuan penelitian ini adalah untuk mengetahui perbedaan ekspresi HER-2/neu pada kanker ovarium derajat diferensiasi baik dan buruk. 1.4 Manfaat Penelitian 1. Sebagai data dasar untuk pengembangan penelitian selanjutnya terutama dalam bidang biologi molekuler mengenai patomekanisme ekspresi HER2/neu dan pemahaman tentang peran HER-2/neu dalam perkembangan kanker ovarium derajat diferensiasi baik, sedang, dan buruk. 2. Hasil penelitian ini diharapkan HER-2/neu dapat digunakan sebagai biomarker baru dalam melakukan deteksi dini, prognostik, dan penilaian efektifitas kemoterapi pada kanker ovarium derajat diferensiasi baik, sedang, dan buruk. BAB II TINJAUAN PUSTAKA 2.1 Kanker Ovarium Kanker ovarium merupakan penyebab utama kematian wanita yang disebabkan penyakit keganasan ginekologi. Di Amerika Serikat pada tahun 2006, lebih dari 20.000 kasus baru kanker ovarium ditemukan dan neoplasma ini menempati urutan kedua di antara kanker ginekologi, namun sejauh ini merupakan yang paling mematikan (John dkk, 2008). Sampai saat ini penyebab pasti dari kanker ovarium masih diperdebatkan. Adapun beberapa faktor risiko yang dianggap dapat menjadi penyebab timbulnya kanker ovarium antara lain: adanya riwayat keluarga penderita kanker ovarium, mamae, dan kolon, mutasi pada gen BRCA 1 dan BRCA 2, umur di atas 50 tahun, wanita yang tidak memiliki anak pada umur lebih dari 35 tahun (Ari,2008). Kanker ovarium merupakan tumor ganas yang secara histologis sangat bervariasi dengan karakteristik klinis maupun histopatologisnya masing-masing. Tumor ovarium dapat berasal dari ketiga dermoblast yakni ektodermal, mesodermal, dan endodermal. Berdasarkan struktur asalnya, tumor ovarium dibagi menjadi 3 tipe, yaitu tipe epitelial yang merupakan 90-95% dari tumor ganas ovarium, kemudian tumor ovarium tipe germinal (germ cell) serta tipe mesenkim (sex cord-stromal) (Havrilesky,2001; Schorge et al,2008). Berdasarkan tipe histologisnya, neoplasma ovarium epitelial terdiri dari tipe serus, musinus, 8 endometrioid, clear cell, Brenner, dan tipe karsinoma undifferentiated (Berek, 2007;Stricker,2007). Berdasarkan luas proliferasi serta pola diferensiasi lapisan epitelnya, tumor dibagi menjadi tumor jinak, tumor borderline atau Low Malignant Potential (LMP), dan tumor ganas (Schorge et al,2008;Kumar et al, 2010). Pada kanker ovarium 90% merupakan tipe epitelial, ± 15% nya merupakan tipe bordeline ovarian tumor (BOT) dan 85% adalah tipe epithelial ovarium cancer (EOC). Pada stroma ovarium BOC dan EOC mempunyai sifat yang berlawanan, dimana pada BOT terjadi pada wanita yang lebih muda, gejala akan tampak pada stadium yang lebih dini dan kemampuan untuk metastasis kurang bila dibandingkan dengan EOC, sehingga mempunyai prognosis yang lebih baik bila dibandingkan dengan EOC (Riman dkk, 2004). Berdasarkan histologi, 75% dari kanker ovarium tipe epitelial adalah jenis serosa, sedangkan jenis musinosa 20%, endometrioid 2%, clear cell 1%, Brenner 1%, dan undifferentiated carsinoma 1% ( Berek, 2002). Walaupun mayoritas kanker ovarium adalah jenis epitelial, kanker ovarium berasal dari sel lain yang terdapat di ovarium, seperti sel germinall yang dikelompokkan sebagai disgerminoma dan teratoma, dan dari sel folikel dikelompokkan sebagai sex tumor cord-stromal. Angka kejadian kanker ovarium non epitelial kecil sekali sehingga angka kejadian kanker epitelial ovarium dianggap angka kejadian seluruh kanker ovarium (Busmar B, 2006). Meskipun penyebab dari kanker ovarium masih belum pasti, terdapat beberapa hipotesis untuk menjelaskan etiologi kanker ovarium yaitu : 1. Hipotesis Incessant Ovulation Teori ini pertama kali diperkenalkan oleh Fathalla pada tahun 1972. Perusakan dan perlukaan sel pada epitel ovarium yang terjadi pada setiap ovulasi memerlukan waktu untuk memperbaiki bentuk supaya dapat kembali seperti semula, tanpa periode istirahat yang adekuat proses perbaikan akan menjadi terganggu, hal ini dapat mencetuskan perubahan bentuk menjadi ganas. Untuk lebih lanjut pada setiap siklus haid perlukaan dan perbaikan sel dapat meningkatkan kemungkinan salah fungsi dari DNA repair. Proses ini mendasari kemungkinan terjadinya mutasi spontan (Busmar, 2006; Berek, 2002; Kramer, 2004). 2. Hipotesis Gonadotropin Peningkatan level gonadotropin dalam sirkulasi, meningkatkan risiko untuk terjadinya kanker ovarium. Menurut teori Cramer dan Welch bahwa peningkatan kadar gonadotropin menyebabkan ovarium mensekresi estrogen yang mana dapat menyebabkan proliferasi dan transformasi dari sel epitel ovarium. Keadaan ini dipercaya banyak terjadi pada awal postmenapouse, dimana kanker ovarium juga banyak terjadi pada wanita dengan usia postmenapouse (Busmar, 2006; Berek, 2002; Kramer, 2004). 3. Hipotesis Androgen Teori ini pertama kali ditemukan oleh Risen 1998, berdasarkan pada sel epitel ovarium mengandung reseptor androgen yang dapat memberikan respon dari sinyal androgenik. Penelitian invitro mengatakan bahwa androgen dapat menstimulasi pertumbuhan dari sel epitel ovarium normal sama baiknya dengan pertumbuhan dari sel kanker ovarium, hal ini didukung oleh penelitian kasus kontrol, didapatkan kadar androgen yang tinggi (androstenedion dan dehydroepiandrosterone) pada wanita yang menderita kanker ovarium dibandingkan dengan kontrol. Pada polycystic ovary syndrome juga terdapat peningkatan kadar androgen yang diikuti dengan peningkatan risiko kanker ovarium (Busmar, 2006; Berek, 2002; Kramer, 2004). 4. Hipotesis Progesteron Progesterone mempunyai peranan protektif terhadap tejadinya kanker ovarium. Progesteron menginduksi terjadinya apoptosis sel epitel ovarium, sedangkan estrogen menghambatnya (Busmar, 2006). Ada beberapa faktor risiko yang diduga ikut berperan timbulnya kanker ovarium antara lain : 1. Paritas dan kehamilan Penelitian menunjukan bahwa wanita dengan paritas yang tinggi memiliki risiko terjadinya kanker ovarium yang lebih rendah dari pada nullipara, pada wanita yang mengalami empat atau lebih kehamilan aterm, risiko terjadinya kanker ovarium berkurang sebesar 40% jika dibanding nulipara Menurut data terkini, wanita yang sudah pernah hamil memiliki resiko untuk mengalami kanker ovarium sekitar 50% lebih rendah daripada wanita yang belum pernah hamil atau nulipara. Bahkan pada wanita yang telah beberapa kali hamil resiko terjadinya kanker ovarium cenderung berkurang (Busmar, 2006). 2. Indek Massa Tubuh (IMT) Beberapa penelitian juga menyebutkan peningkatan indeks massa tubuh (IMT) dapat meningkatkan resiko terjadinya tumor ovarium (Reeves, 2007). Penelitian yang dilakukan oleh Europeran Prospective Investigation into Cancer and Nutrition tahun 2006 memiliki risiko relatif sebesar 1,59 untuk terjadinya kanker ovarium dibandingkan dengan wanita dengan IMT normal (Lahman, 2009). 3. Umur Kejadian kanker ovarium meningkat seiring dengan bertambahnya umur. Sebanyak 80% dari kasus kanker ovarium ditemukan pada umur wanita diatas 45 tahun, walaupun pada beberapa kasus kanker ovarium juga dapat ditemukan pada umur yang relatif mudah daripada kanker pada wanita lainnya, yaitu pada umur 20 sampai 30 tahun (Fauzan, 2009). 4. Pil kontrasepsi Penelitian dari center for disease control menemukan penurunan risiko kanker ovarium sebesar 40% pada wanita usia 20-54 tahun, dimana efek protektif ini makin baik dengan makin lama wanita menggunakan pil kontrasepsi, bahkan efek protektif ini terus berlangsung hingga 10 tahun setelah pil dihentikan( Busmar, 2006; Baziad, 2002 ). 5. Talk Pemakaian talk (hydrous magnesium silicate) pada daerah perineum dilaporkan meningkatkan risiko terjadinya kanker ovarium dengan risiko relatif 19%. Akan tetapi, penelitian prospektif yang mencakup kohort 78.000 wanita ternyata tidak mendukung teori di atas ( Busmar, 2008 ). 6. Ligasi Tuba Dengan pengikatan tuba akan menurunkan risiko terjadinya kanker ovarium dengan terputusnya akses talk atau karsinogen lainnya dengan ovarium (Busmar, 2008). 7. Terapi Hormon Pengganti pada Masa Menopause Pemakaian terapi hormon pengganti pada masa menopause (Menopausel Hormone Therapy = MHT) dengan estrogen saja selama 10 tahun meningkatkan risiko relatif 2.2. Sementara itu, jika masa pemakaian MHT selama 20 tahun atau lebih, risiko relatif meningkat menjadi 3.2. Pemakaian MHT dengan estrogen yang kemudian diikuti dengan pemberian progestin, ternyata masih menunjukkan meningkatnya risiko relatif menjadi 1.5 (Busmar, 2006). 8. Obat-obat yang Meningkatkan Kesuburan Obat-obat yang meningkatkan fertilitas seperti klomifen sitrat, yang diberikan secara oral, dan obat - obat gonadotropin yang diberikan dengan suntikan seperti Follicle stimulating hormone (FSH), kombinasi FSH dengan Luteinizing hormone (LH), akan menginduksi terjadinya ovulasi atau multipel ovulasi (Busmar, 2008). 9. Faktor Herediter Berdasarkan Studi Kanker Ovarium Genetik, faktor herediter memegang peranan ± 5-10%, dikaitkan dengan The breast-ovarian syndrome dan hereditary nonpoliposus colorectal cancer (HNPCC) atau sindroma Lynch II. Sebagian besar disebabkan oleh mutasi BRCA-1 (Breast Cancer Antigene-1) ± 90-95% dan HNPCC sebesar 5-10% (Andrijono, 2004; Hellstrom dkk, 2001). Mutasi gen BRCA1 (carier), bersifat autosomal dominan, mempunyai resiko (40-60%) yang akan berkembang menjadi kanker ovarium selama masa hidupnya. HNPCC merupakan suatu autosomal dominan yang dihubungkan dengan DNA missmatch repair (Busmar, 2006; Paley, 2001; Kramer, 2004; Arai, 2004). Kanker ovarium herediter dibedakan dari kanker ovarium sporadik berdasarkan mekanisme terjadinya mutasi. Pada kanker ovarium herediter perubahan genetik tingkat awal diturunkan melalui germline mutations (sejak saat konsepsi) dan mutasi ke dua secara somatik (terjadi pada salah satu saat sepanjang hidup individu) untuk terbentuknya sel pre kanker, sedangkan pada kanker ovarium sporadik semua mutasi terjadi secara somatik (Sasaki, 2007). Gejala klinis dari kanker ovarium tidak spesifik. Pada kanker ovarium tipe epitelial biasanya tanpa gejala untuk waktu yang lama, dan bila menimbulkan gejala biasanya tidak jelas dan tidak spesifik, sehingga 75% kanker ovarium pada saat diagnosa ditegakkan telah menyebar di luar ovarium atau telah bermetastase jauh (Berek, 2002). Angka harapan hidup lima tahun penderita kanker ovarium sekitar 30-40 persen. Beberapa faktor yang berperan pada prognosis secara independen antara lain faktor stadium tumor, derajat diferensiasi tumor, dan ploidisitas DNA. Sedangkan faktor yang mempengaruhi prognosis secara dependen antara lain volume residual tumor setelah sitoreduksi, asites, ruptur, adesi tumor, peningkatan usia, dan kadar CA 125 serum (Scully dkk,1998). Menurut sebuah penelitian multisenter yang menilai ekspresi pada karsinoma ovarium dan pengaruhnya pada prognosis tumor berpendapat bahwa overekspresi dari HER-2/neu merupakan petanda independen prognosis yang buruk pada kasus karsinoma ovarium stadium lanjut (Boet dkk, 2004; Wang dkk, 2005). Klasifikasi menurut WHO membagi tumor ovarium berdasarkan asal sel dan jaringannya yaitu : a. Epitel permukaan yang berasal dari epitel selom atau epitel endometrium ektopik. Epitel selom akan menjadi epitel mullerian pada perkembangan embrio. Dari epitel ini akan terbentuk tuba fallopii, pelapis endometrium atau kelenjar endoservikal. b. Germ sel yang bermigrasi ke ovarium dari yolk sac dan bersifat totipotensial. c. Stroma ovarium, yang termasuk didalamnya sex cords dan berperan dalam apparatus endokrin pada ovarium setelah kelahiran. Terdapat juga pengelompokan di luar pembagian tersebut di atas yang merupakan metastase tumor pada ovarium. Tumor ovarium berasal dari satu diantara tiga komponen : (1) derivat epitelium permukaan dari epitelium coelomic; (2) sel germ, yang mana bermigrasi ke ovarium dari yolk sac dan pluripoten, serta (3) stroma ovarium, termasuk sex cord, yang merupakan pelopor dari apparatus endokrin dari ovarium postnatal. Tetapi terdapat juga grup tumor yang tidak dapat diklasifikasikan, dan terakhir terdapat tumor ovarium sekunder atau metastasis (Robbins et al, 2010). Gambar 2.1 Pembagian tumor ovarium berdasarkan sel asalnya (Kumar et al, 2010) 2.1.1. Tumor epiteliel 2.1.1.1 Tumor serus Suatu tumor kistik yang terdiri dari lapisan sel-sel epitel kolumnar tinggi, bersilia maupun tanpa silia, dengan cairan serus jernih di dalamnya. Tumor serous merupakan 30% dari tumor ovarium, dan lebih dari 50% dari semua tumor epithelial. Serous tumor jinak, borderline dan ganas kurang lebih 30 % dari keseluruhan tumor ovarium, dimana tipe jinak dan borderline sebesar 75 % dan sisanya 25 % berupa tipe ganas. (Sutoto,2007; Berek,2007; Kumar et al,2010). Tumor serous jinak biasanya tampak sebagai dinding kista yang tipis, halus mengkilat serta terdapat papiler yang kecil tanpa penebalan epitel. Tumor serus jinak secara histologi berupa struktur kista dengan lapisan epitel kolumnar bersilia banyak, dan dapat ditemukannya papil mikroskopis. Pada Borderline tumor akan tampak penonjolan papiler yang lebih banyak, peningkatan beragam dari stroma papila dan stratifikasi epitel tanpa adanya infiltrasi kerusakan pada stroma. Dikatakan suatu keganasan bila dijumpai massa solid dengan papiler yang banyak, massa tumor yang tidak teratur, kapsul yang nodular dan terfixir. Sifat biologi tumor serous tergantung pada derajat differensiasi, distribusi dan karakteristik pertumbuhannya pada peritoneum. Tumor serus borderline dapat menginvasif ke peritoneum dimana terjadi proliferasi papil dari sel-sel atipik yang membentuk invaginasi, terlokalisir, tanpa gejala, penyebaran yang lambat, dan perlahan akan menyebabkan obstruksi intestinal atau komplikasi lainnya. Serous cystadenocarcinoma kurang lebih 40 % dari semua keganasan di ovarium dan merupakan keganasan ovarium yang terbanyak. Tipe jinak dan borderline biasanya timbul antara umur 20-50 tahun sedangkan untuk cystadenocarcinoma muncul pada umur yang lebih tua. Tumor serus adenofibroma sebagian besar merupakan tumor solid yang terdiri dari jaringan ikat fibrus (Kaku et al, 2003). Angka harapan hidup lima tahun pada tumor borderline 100% dan angka ini berkurang menjadi 90% jika pada saat ditemukan telah menginvasif peritoneum. Sedangkan pada ganas dengan massa terbatas pada ovarium adalah 70%, dan berkurang menjadi 25% jika telah menginvasif peritoneum (Berek, 2007; Kumar et al, 2010). 2.1.1.2 Tumor musinus Prevalensi tumor ini leih kecil dibandingkan serous tumor yaitu sebesar 25% dari semua tumor ovarium. Muncul pada wanita usia pertengahan, jarang terjadi sebelum pubertas dan setelah menopause. Tipe jinak dan borderline sekitar 80% dan tipe ganas sekitar 15%. Sedangkan Mucinous cystadenocarcinoma hanya berkisar 10% dari semua keganasan ovarium. Kista pada Mucinous tumor bervariasi dalam bentuk ukuran, sering menjadi kista yang besar serta biasanya unilateral. Karsinoma musinus primer relatif jarang ditemukan, kurang dari 5% dari semua kanker ovarium. Tumor bilateral hanya terjadi pada 8-10% kasus. Cenderung memiliki massa tumor yang lebih besar dibandingkan tumor serus. Karsinoma musinus, begitu pula karsinoma endometrioid dan clear cell, lebih cenderung ditemukan pada stadium yang lebih awal (Berek, 2007; Copeland, 2007; Kumar et al, 2010). Pada penampakan histologis tumor musinus jinak terdiri atas lapisan sel epitel kolumnar tinggi, musin pada bagian apical sel dan tidak bersilia. Cystadenocarcinoma musinus mengandung mayoritas pertumbuhan tumor yang solid, area nekrosis dan hilangnya struktur kelenjar (Kaku et al, 2003; Kumar et al, 2010). Peudomyxoma peritonei adalah suatu keadaan yang dihubungkan dengan tumor mucinous ovarium. Gangguan ini berupa suatu tumor ovarium dengan asites mucinous yang luas dan adanya perlekatan epitel kistik pada permukaan peritoneum yang bisa mengakibatkan obstruksi intestinal dan kematian (Berek dan Natarajan, 2007). Angka harapan hidup 10 tahun rata-rata untuk borderline, noninvasive ganas dan invasive ganas masing-masing 95%, 90%, dan 66% (Robbin dan Cotran, 2010). 2.1.1.3 Tumor endometrioid Tumor endometrioid merupakan 20% dari semua kanker ovarium, Tumor endometrioid memiliki karakteristik adanya elemen epitel, elemen stroma, atau kombinasi keduanya mirip dengan yang ada pada endometrium (Kaku et al, 2003). Umumnya bilateral pada 40% kasus. Angka harapan hidup untuk 5 tahunnya adalah 75% pada stadium I (Berek, 2007; Kumar et al, 2010). Tumor endometrioid sekitar 15-30 % disertai oleh suatu tumor endometrium, apabila timbul bersamaan akan mempunyai prognosis yang lebih baik dibandingkan yang timbul akibat metastase dari yang lain. Kejadian tumor endometrioid timbul bersama dengan endometriosis sekitar 15%. Kasus karsinoma endometrioid dengan endometriosis biasanya terjadi pada usia lebih muda 10 tahun dibandingkan dengan kasus yang tidak berhubungan dengan endometriosis. Tumor endometrioid biasanya berbentuk kombinasi tumor kistik dan solid, terdapat cairan berwarna coklat gelap, dengan pola adenomatous dan dalam bentuk beragam dari variasi epitel pada uterus (Kaku et al, 2003; Berek, 2007; Kumar et al, 2010). 2.1.1.4 Tumor clear-cell Karakteristik tumor ini adalah lapisan sel epitel dengan ukuran besar, dengan sitoplasma jernih yang luas, yang memiliki kemiripan dengan endometrium gestational yang mengalami hipersekresi. Dianggap berasal dari perkembangan duktus mülleri dan merupakan variasi dari karsinoma endometrioid. Dapat bersifat solid atau kistik (Kumar et al,2010). Dapat ditemukan beberapa pola pada adenokarsinoma clear cell, dapat berupa tubulokistik, papil, recticular, dan solid pada pemeriksaan histologi. Sel berukuran tinggi dengan vakuola sitoplasma yang jernih akibat disolusi glikogen, inti hiperkromatik yang ireguler, serta nukleoli dalam berbagai ukuran (Berek, 2007; Schorge et al, 2008). Tumor clear cell dari ovarium dapat berupa padat atau kistik. Pada tumor solid clear cell diatur dalam suatu tubulus sedangkan pada tumor kistik clear cell membatasi suatu ruangan. Angka harapan hidup 5 tahun rata-rata sekitar 65 % bila tumor masih terbatas ovarium, namun tumor ini cenderung bersifat agresif dengan perluasan di luar ovarium (Kumar et al, 2010). 2.1.1.5 Tumor Brenner/sel transisional Tumor Brenner merupakan suatu adenofibroma dimana epitelnya terdiri atas kumpulan sel transisional yang menyerupai sel yang melapisi kandung kencing. Tumor ini sangat jarang, umumnya tumor Brenner ditemukan dalam bentuk jinak (99%)dan biasanya unilateral (90%), dengan ukuran yang bervariasi (Kumar et al,2010). kadang-kadang ditemui pada mucinous cystadenoma tanpa diketahui penyebabnya.Tumor Brenner ganas merupakan area residu proliferasi tumor jinak disertai komponen karsinoma epitelial infiltratif yang ganas dengan gambaran histologis berupa sel transisional, sel skuamus, atau undifferentiated (Berek, 2007). Secara histologis karsinoma sel transisional ditandai dengan tidak ditemukannya komponen tumor brenner, menyerupai dengan karsinoma primer kandung kemih, namun pola imunoreaktivitas yang konsisten dengan ovarium. Karsinoma sel transisional memiliki perangai biologis yang berbeda dengan tumor Brenner ganas. Karsinoma sel transisional lebih sering terdiagnosis pada stadium yang lebih lanjut sehingga memiliki prognosis yang lebih buruk. Karsinoma ovarium yang lebih dari 50% bagiannya merupakan karsinoma sel transisional, ternyata menunjukkan sensitivitas yang lebih baik terhadap kemoterapi sehingga memiliki prognosis yang baik jika dibandingkan dengan jenis karsinoma ovarium poorly differentiated lainnya pada stadium yang sama (Wheeler, 2001; Berek, 2007; Schorge et al, 2008). Walaupun sering dikaitkan dengan transitional cell carcinoma insiden tumor ini lebih sering terjadi bersama dengan serous atau endometrioid karsinoma yang menyebabkan perubahan diferensiasi dari sel tumor (Katz et al. 2007). Tabel 2.1 Klasifikasi Histologis Tumor Ovarium Epitelial-Stromal (WHO) Klasifikasi Histologis Tumor Ovarium Epitelial-Stromal 1. Serous tumors Benign (cystadenoma) Borderline tumors (serous borderline tumor) Malignant (serous adenocarcinoma) 2. Mucinous tumors, endocervival-like and intestinal type Benign (cystadenoma) Borderline tumors (mucinous borderline tumor) Malignant (mucinous adenocarcinoma) 3. Endometrioid tumors Benign (cystadenoma) Borderline tumor (endometrioid borderline tumor) Malignant (endometrioid adenocarcinoma) 4. Clear-cell tumors Benign Borderline tumors Malignant (clear cell adenocarcinoma) 5. Transitional cell tumors Brenner tumor Brenner tumor of borderline malignancy Malignant Brenner tumor Transitional cell carcinoma (non-Brenner type) 6. Epithelial-stromal Adenosarcoma Malignant mixed müllerian tumor (Sumber : Kumar et al, 2010) Klasifikasi tumor ovarium epitelial dibuat berdasarkan pola diferensiasi dan luas proliferasi lapisan epitel. Luas proliferasi epitel berhubungan dengan perangai biologis tumor. Berdasarkan proliferasinya, tumor dibagi menjadi: (1) Tumor jinak dengan proliferasi epitel minimal, (2) Tumor borderline atau Low Malignant Potential (LMP) dengan proliferasi sedang, dan (3) Tumor ganas atau karsinoma dengan proliferasi nyata dan terjadinya invasi stroma (Kaku et al, 2003; Schorge et al, 2008; Kumar et al, 2010). Stadium kanker ovarium dibagi berdasarkan kriteria FIGO (Federation Internationale de Gynecologie et de Obstetrique) Tabel 2.2 Stadium kanker ovarium menurut FIGO Stadium Kriteria I Pertumbuhan tumor terbatas pada ovarium Ia Pertumbuhan tumor terbatas pada satu ovarium, cairan ascites tidak mengandung sel-sel ganas, tidak ada pertumbuhan tumor pada permukaan luar tumor, kapsul utuh Ib Pertumbuhan tumor terbatas pada kedua ovarium, cairan ascites tidak mengandung sel-sel ganas, tidak ada pertumbuhan tumor pada permukaan luar tumor, kapsul utuh. Ic Tumor pada stadium Ia atau Ib tetapi dengan pertumbuhan tumor pada permukaan luar dari satu atau kedua atau kapsul pecah atau cairan ascites atau cairan bilasan peritoneum mengandung sel-sel ganas II Pertumbuhan tumor pada satu atau kedua ovarium dengan perluasan ke rongga pelvis IIa Penyebaran dan atau metastasis ke uterus dan atau tuba fallopi IIb Penyebaran tumor ke organ pelvis lainnya IIc Tumor dengan stadium IIa atau IIb, tetapi dengan pertumbuhan tumor pada pemukaan luar dari satu atau kedua ovarium atau kapsul pecah atau cairan ascites atau cairan bilasan peritoneum mengandung sel-sel ganas III Tumor melibatkan satu atau kedua ovarium dengan implantasi di luar pelvis dan atau terdapat pembesaran kelenjar limfe inguinal atau retroperitoneal. Metastasis pada pemukaan liver sesuai dengan stadium III. Tumor terbatas pada pelvis, tetapi pemeriksaan histologi menunjukkan penyebaran tumor ke usus halus atau omentum IIIa Tumor secara makroskopis terbatas pada pelvis dan tidak ada pembesaran kelenjar limfe, tetapi pemeriksaan histologi menunjukkan penyebaran ke permukaan peritoneum abdominal IIIb Tumor pada satu atau kedua ovarium dengan penyebaran di permukaan peritoneum berdiameter tidak lebih dari 2 cm dan didukung oleh hasil pemeriksaan histologi. Tidak ada penyebaran ke kelenjar limfe IIIc Terdapat penyebaran pada peritoneum abdominal dengan diameter lebih dari 2 cm atau terdapat penyebaran ke kelenjar limfe retroperitoneal atau inguinal atau keduanya IV Pertumbuhan tumor meliputi satu atau kedua ovarium dengan metastase jauh. Bila terdapat efusi pleura, harus ditemukan sel-sel ganas pada pemeriksaan sitologi. Metastasis pada parenkim liver sesuai dengan stadium IV (Sumber : Berek dan Natarajan, 2007) 2.1.2. Germ Cell Tumor Sekitar 15 – 20 % dari keseluruhan tumor ovarium adalah tipe tumor ini. pada anak-anak dan dewasa muda memiliki insiden yang lebih tinggi untuk menjadi ganas dan menimbulkan masalah dalam diagnosis histologis dan terapi. a. Teratoma Terdapat tiga bagian besar yaitu : 1. Teratoma matur (jinak) 2. Teratoma immatur (ganas) 3. Teratoma monodermal 1. Teratoma matur Tumor ini diperkirakan berasal dari diferensiasi sel totipotensial. Teratoma kistik biasanya ditemukan pada wanita usia reproduksi. di klinik lebih dikenal sebagai dermoid cyst. Biasanya bilateral sebanyak 10 – 15 % kasus dan secara morfologi merupakan kista yang unilokuler yang terdiri dari rambut dan material lemak berkeju. Biasanya akan ditemukan struktur gigi dan daerah kalsifikasi. Pada pemeriksaan histologis tampak dinding kista dibentuk dari epitel squamous dengan kelenjar sebasea, batang rambut serta struktur kulit. Pada kebanyakan kasus struktur dari lapisan germ yang lainnya dapat ditentukan seperti misalnya tulang, tulang rawan, jaringan tiroid dan lainnya.sekitar 1% Dermoid cyst dapat menjadi suatu keganasan seperti thyroid carcinoma, melanoma, dan squamous cell carcinoma (Katz et al. 2007). 2. Teratoma immatur Secara morfologi tumor ini besar dan mempunyai menembus kepermukaan luar yang halus, berkembang cepat dan sering mpsul dengan penyebaran lokal atau metastase. Tumor ini berstruktur padat dan terdapat daerah nekrosis, perdarahan, tulang rawan, tulang, rambut dan kalsifikasi. Ditemukan pada usia wanita muda (18 tahun) dan sebelum pubertas .(Kumar et al, 2010). 3. Teratoma Monodermal Angka kejadian nya jarang dan yang paling sering adalah struma ovarii dan carcinoid, biasanya bersifat unilateral. Carcinoid ovarium diperkirakan timbul dari epitel intestinum dalam teratoma dan biasanya jarang kurang dari 2 % keganasan. Struma ovarii terdiri dari jaringan thyroid matur dan mempunyai fungsi yang meningkat disebabkan oleh hiperthyroidism. (Kumar et al, 2010). b. Dysgerminoma Hampir semua dysgerminoma adalah ganas tetapi tingkat histologis atypianya bermacam-macam dan hanya sepertiganya yang agresif. Dysgerminoma yang unilateral dan belum menembus kapsul serta belum metastase mempunyai prognosis yang baik dimana angka kesembuhannya mencapai 96 %. Dapat dianggap sebagai seminoma pada testis terdiri dari sel vesikuler yang besar dengan sitoplasma yang jelas, batas sel tegas dan nukleus ditengah. Secara keseluruhan angka kelangsungan hidup lebih dari 80 % (Kumar et al, 2010). c. Tumor endodermal sinus (yolk sac) Secara histologis terdapat struktur seperti glomerulus yang dibentuk oleh suatu pembuluh darah sentral yang dikelilingi oleh germ cell dalam ruang yang dibatasi oleh germ cell . Menempati urutan kedua dari keganasan germ cell dani timbul biasanya pada unilateral pada ovarium yang kemudian tumbuh secara agresif. Biasanya terjadi pada anak-anak dan wanita muda dengan keluhan nyeri perut dengan pertumbuhan massa dengan cepat di daerah pelvis. (Kumar et al, 2010). d. Choriocarcinoma Tumor ini memproduksi kadar chorionic gonadotropin yang tinggi dan berbeda dengan choriocarcinoma yang timbul dalam plasenta. Mirip dengan endodermal sinus tumor yang berasal dari diferensiasi extraembryonic keganasan germ cell. Tumor primer ovarium biasanya agresif dan mengalami metastase melalui pembuluh darah menuju paru-paru, hati, tulang dan organ lainnya. choriocarcinoma yang timbul di ovarium tidak responsif terhadap kemoterapi sehingga berakibat fatal (Katz et al. 2007). e. Tumor germ cell lainnya Termasuk disini antara lain embryonal carcinoma yang secara histologis mirip dengan tumor yang timbul di testis, Polyembryoma suatu tumor ganas yang terdiri dari embryoid bodies, Mixed germ cell tumor yang merupakan kombinasi dari dysgerminoma, teratoma, endodermal sinus tumor, dan choriocarcinoma (Kumar et al, 2010). 2.1.3. Sex Cord Stromal Tumors Tumor ini berasal dari stroma ovarium dan oleh karena gonad mesenkim tidak berdiferensiasi akhirnya menghasilkan suatu struktur sel yang khusus pada laki-laki (sertoli dan leydig) dan pada wanita (granulosa theca). tumor ini dapat menyebabkan feminisasi (granulosa theca cell tumors) dan maskulinisasi (Leydig cell tumor), karena sel ini menghasilkan estrogen (sel theca) dan androgen (sel leydig). Angka kejadian tumor ini hanya 5 % dari semua tumor ovarium dan terjadi pada semua umur tetapi paling banyak terjadi pada usia post menopause. Granulosa cell tumor biasanya unilateral dengan berbagai ukuran dari terkecil sampai besar serta dapat berbentuk massa padat atau kistik. Pada pemeriksaan histologis dapat ditemukan sel kuboid dan sel poligonal pada granulosa theca sel tumor. Sekitar 10-15 % pada tumor yang menghasilkan steroid dapat berkembang menjadi keganasan endometrium. Angka harapan hidup 10 tahun rata-rata sekitar 85 %. (Kumar et al, 2010). a. Fibroma Thecomas Tumor ini bersifat unilateral sekitar 90 % biasanya berbentuk padat sedikit bulat dan tampak putih keabu-abuan. Pada pemeriksaan histologis tampak fibroblast yang berdiferensiasi baik dengan jaringan kolagen diantara sel. Tumor ini bisa menyebabkan asites sekitar 40 % kasus dan hydrothorax yang biasanya hanya di sebelah kanan. Apabila ketiga kejadian tersebut ditemukan (tumor ovarium, asites, dan hydrothorax) disebut sebagai Meigs syndrome (Katz et al. 2007). b. Sertoli Leydig Cell Tumors (Androblastomas) Tumor ini menyebabkan maskulinisasi atau setidaknya mengurangi feminisasi tetapi beberapa tumor mempunyai efek estrogenik. Tumor ini dapat terjadi pada semua usia tetapi paling banyak terjadi pada usia 20 tahunan dan 30 tahunan, bersifat unilateral dan mempunyai kesamaan dengan granulosa theca cell tumor. Tumor ini mungkin menghambat perkembangan seksual pada anakanak dan menyebabkan berkurangnya feminisasi pada wanita yang ditandai dengan payudara yang atropi, amenorhoe, steril dan hilangnya rambut (Kumar et al, 2010). c. Sex Cord Stromal Tumor lainnya Hilus ovarium terdiri dari sekelompok sel poligonal yang mengelilingi pembuluh darah (hillar cells), bersifat unilateral, jarang terjadi dan secara histologis ditemukan sel besar lipid laden dengan batas yang tegas. Tumor ini menyebabkan maskulinisasai, hirsutism, suara membesar dan pembesaran klitoris. Tumor ini biasanya timbul pada orang yang mengalami perkembangan seksual yang terganggu. Secara mikroskopis ditemukan tumor ini terdiri dari gabungan germ cell dan sex cord yang menyerupai sel sertoli dan granulosa sel. Tumor ini timbul bersama dengan dysgerminoma terjadi sekitar 50%. (Kumar et al, 2010). d. Metastatic tumors Yang termasuk dalam kelompok ini juga kasus yang jarang yaitu pseudomyxoma peritoneum yang berasal dari tumor appendik. Metastatic tumors yang paling banyak adalah tumor yang berasal dari mullerian seperti uterus, tuba fallopii, ovarium kontralateral, dan peritoneum pelvis. Extramullerian primer yang paling banyak adalah payudara dan intestinal termasuk kolon, lambung, saluran empedu, dan pankreas (Katz et al, 2007). 2.2 Derajat Diferensiasi Faktor diferensiasi merupakan salah satu faktor prognosis yang berpengaruh terhadap survival dan faktor ini sering kali terlupakan dalam pelaporan histologi. Diferensiasi baik mempunyai prognosis yang lebih baik dibandingkan dengan diferensiasi sedang (pada tumor ovarium jenis epitelial stadium I diferensiasi baik kejadian rekurensi hanya berkisar 2,4% dan yang berdiferensiasi sedang 14,8%). Diferensiasi sedang mempunyai prognosis yang lebih baik dari pada diferensiasi buruk (kejadian rekurensi 33,3% (Andrijono, 2004). Grading histologi pada tumor mempunyai nilai prognostic yang cukup signifikan, seperti system grading FIGO, yang dibuat berdasarkan arsitektural (Stefan et al, 2009). Selain itu, terdapat grading Nottingham untuk kanker payudara dapat yang dapat digunakan pada berbagai tipe dari kanker ovarium (Silverberg, 2000; Stefan et al, 2009). Beberapa pengarang melaporkan grading Silverberg untuk memiliki nilai prognostik yang lebih dibandingkan sistem grading FIGO (Ishioka et al, 2003; Stefan et al, 2009). Terdapat tiga pembagian derajat diferensiasi tumor, yakni berdasarkan pola arsitektur yang dominan, derajat atipia inti dan indeks mitosis pada sistem grading Shimizu-Silverberg (Malpica et al, 2004; Sriwidyani, 2008) Selama ini telah diterapkan berbagai sistem penilaian derajat diferensiasi tumor pada kanker ovarium karena belum adanya persamaan sistem dalam penilaian derajat diferensiasi tumor. Terdapat sistem yang membagi menjadi dua kelompok yaitu low grade dan high grade, namun ada sistem yang membagi menjadi tiga kelompok yaitu grade 1(well differentiated), grade 2 (moderate differentiated), dan grade 3 (poorly differentiated). Adapun yang direkomendasikan adalah penggunaan grading system yang membagi menjadi tiga kelompok, karena derajat diferensiasi memiliki implikasi terhadap prognosis dan terapi (Tavasolli dkk, 2003). Penatalaksanaan kanker ovarium meliputi berbagai modalitas antara lain kemoterapi, operasi, radioterapi ataupun kombinasi. Terapi yang sedang dalam uji coba saat ini adalah terapi biologi dengan memakai angiogenesis sebagai target terapi dan terapi gen dengan memakai berbagai teknik molekuler (Andrijono, 2004). 2.3 Karsinogenesis Karsinogenesis merupakan proses perubahan sel normal menjadi kanker. Mutasi pada DNA akan mengarah pada proses terjadinya kanker. Karsinogenesis disebabkan oleh mutasi genetik dari sel normal tersebut (Fearon dkk, 2009 ). proses ini melalui tahapan yang disebut sebagai multistep carcinogenesis. Proses karsinogenesis secara bertahap, diawali dengan proses inisiasi, promosi dan berlanjut dengan progresi dari sel normal menjadi sel kanker atau malignant cell. Setiap tahap karsinogenesis terjadi akibat perubahan gen selular, perubahan gen selular menyebabkan terjadinya perubahan atau penyimpangan biokimia sehingga menyebabkan perubahan proses pembelahan sel serta morfologi sel (Busmar, 2006; Andrijono, 2004). Perubahan-perubahan malignitas tersebut diakibatkan oleh adanya kelainan atau mutasi pada beberapa gen antara lain tumor suppressor gene, DNA mismatch repair, protoonkogen-onkogen dan gen apoptosis (Andrijono, 2004; Azis, 2006). Tumor suppressor gene (TSG) merupakan gen yang sangat penting terhadap fungsi pengontrolan siklus sel. Hilangnya fungsi TSG akan menyebabkan kegagalan penghentian siklus sel, sehingga bila terjadi kelainan gen pada sel maka perbaikan sel tidak dimungkinkan. Kegagalan perbaikan sel akan terjadi bila gen yang mengatur atau mengontrol perbaikan mengalami mutasi sehingga gen tersebut tidak berfungsi lagi. Peningkatan onkogen akan menyebabkan proliferasi sel yang berlebihan sehingga merangsang untuk terjadinya keganasan (Busmar, 2006; Andrijono, 2004; Azis, 2006). Salah satu mekanisme penting untuk mencegah terjadinya kanker adalah mekanisme apoptosis, yaitu mekanisme kematian sel yang terjadi akibat kerusakan gen. Dengan terjadinya apoptosis maka sel yang mengalami mutasi akan mati sehingga keganasan tidak terjadi. Gen mismatch berperan dalam mempertahankan sel tetap normal, berfungsi memulihkan gen rusak sehinga gen menjadi normal kembali. Tetapi mutasi berkelanjutan akibat paparan karsinogen yang terus berlangsung merupakan faktor yang sangat penting untuk berlanjutnya karsinogenesis (Azis, 2006; Sudoyo, 2005). Proses terjadinya mutasi (perubahan urutan DNA pada gen) disebut mutagenesis dan proses ini dapat berupa perubahan pada urutan nukleotida coding DNA atau perubahan susunan fisik kromosom (Astuti, 2005). Mutasi dapat terjadi secara spontan dengan bermacam mekanisme termasuk replikasi DNA yang salah dan kerusakan spontan DNA. Mutasi bersifat permanen, dapat disebabkan karena salah transfer (copying errors) pada materi genetik selama pembelahan sel (cell division) dan oleh karena pengaruh radiasi, kimia, atau virus atau dapat terjadi dibawah kontrol selular selama proses meiosis atau hypermutilation (Busmar, 2006; Astuti, 2005). 2.4 Siklus Sel Siklus sel adalah fungsi sel yang paling mendasar berupa duplikasi akurat sejumlah besar DNA di dalam kromosom, yang akhirnya terjadi pemisahan hasil duplikasi tersebut sehingga terbentuk dua sel baru yang identik (Bruce dkk, 2002). Sel mampu melakukan pembelahan sel yang merupakan mekanisme proliferasi sel. Siklus sel berlangsung dengan mekanisme yang sangat kompleks, mekanisme pembentukan protein, mekanisme aktivasi, mekanisme penghentian, mekanisme perbaikan protein atau gen yang rusak, mekanisme istirahat, dan mekanisme lain. Berbagai mekanisme dan aktivitas sel pada siklus sel berlangsung dalam keadaan yang seimbang dan gangguan salah satu aktivitas akan menyebabkan gangguan fungsi dan siklus suatu sel (Andrijono, 2008). Siklus sel terbagi empat fase: (Andrijono, 2008 dan Gondhowiardjo, 2005). 1. Fase gap I (G1) Fase persiapan sel untuk replikasi DNA, berlangsung kurang lebih 2 jam, dimana terjadi pembentukan berbagai RNA dan protein yang berperan dan diperlukan dalam proses replikasi. 2. Fase synthesis (S) Fase terjadinya replikasi genomik DNA, selama fase S jumlah DNA keseluruhan akan bertambah dari diploid (2n) hingga replikasi komplit (4n), umumnya terjadi selama 8 jam. 3. Fase G2 Terjadi proses sintesis spindel mitosis dan komponennya. Berlangsung kurang lebih 6 jam sampai beberapa hari. Pada fase ini sel akan mempersiapkan diri untuk membelah dan mempersiapkan data set kromosom. Pada fase ini juga beberapa kontrol (check point) bekerja. 4. Fase Mitosis (M) Merupakan fase tersingkat (berlangsung 1 jam) dimana terjadi pemecahan DNA yang telah berduplikasi secara komplit. Proses ini akan menghasilkan dua sel anak dengan kromosom diploid (2n). Setelah fase M sel akan memasuki lagi fase G1 atau masuk kedalam fase GO. 5. Fase GO Fase dimana sel dalam keadaan istirahat, tidak aktif melakukan proses proliferasi. Setiap fase dalam siklus sel ini terjadi secara berurutan dan teratur dimana suatu fase dapat terjadi bila fase sebelumnya telah selesai dilaksanakan. Setiap fase dalam siklus sel ini dikendalikan secara ketat dan waktu yang diperlukan bagi setiap fase salalu tetap (Gondhowiardjo, 2005). Gambar 2.2 Skema siklus sel Dikutip dari kepustakaan (Busmar, 2006) Aktivitas regulasi pada siklus sel merupakan bagian yang sangat penting. Beberapa protein bekerja sebagai regulator pada tiap-tiap fase siklus sel. Lima protein regulator yang sangat penting: Cyclins, cyclin-dependent protein kinase (CDK), protein pada keluarga Rb, cyclin-dependent protein kinase activating kinases (CAK), Cyclin-dependent protein kinase inhibitors (OKI) (Riman, 2004). Kompleks cyclin-Cdk merupakan inti dari mesin pengatur siklus sel. Dari berbagai penelitian terungkap bahwa ada 2 gen dengan produknya yang mempunyai fungsi penting dalam cell cycle checkpoints yaitu protein retinoblastoma (Rb) dan protein p53 (Andrijono, 2008; Gondhowiardjo, 2005 ; Kresno, 2005). Terdapat dua mekanisme check point yang utama untuk sel yang melangsungkan pembelahannya. Check point adalah istirahat dari siklus sel, untuk menjamin bahwa DNA berduplikasi dengan akurat dan separasi kromosom terjadi dengan benar. Pada saat check point memungkinkan dilakukan penyusunan kembali dan reparasi dari informasi genetik sehingga menjamin sel anak akan mendapat informasi genetik yang identik dengan sel asal (Gondhowiardjo, 2005). Kontrol pertama terdapat pada fase G1/S, menyebabkan pertumbuhan terhenti pada fase G1 untuk memberi kesempatan pada DNA repair genes untuk memperbaiki DNA sebelum siklus berlanjut ke fase S untuk sintesis DNA, kontrol pertama merupakan kontrol yang lebih dominan. Kontrol ke dua adalah fase G2/M, sebelum terjadi mitosis, merupakan kelanjutan dari kontrol pertama (Gondhowiardjo, 2005 ; Kresno, 2005). Sel yang mengalami defek p53 tidak mampu menghentikan fase G1 maupun G2/M, akibatnya tidak ada kesempatan dari DNA repair genes untuk memperbaiki DNA, sehingga DNA yang rusak diwariskan pada sel-sel turunannya. Hal ini menyebabkan ketidakstabilan genetik dan peningkatan mutagenesis misalnya peningkatan mutation rate, amplifikasi onkogen, defek kromosom, dll sehingga kemungkinan transformasi ganas menjadi lebih besar (Gondhowiardjo, 2005 ; Kresno, 2005). 2.5 Onkogen Protoonkogen merupakan gen yang memegang peran kunci pada proses pertumbuhan dan diferesiasi sel. Dalam sel normal ekspresi protoonkogen ini diperlukan untuk perkembangan dan pertumbuhan sel normal dan tidak mengakibatkan keganasan karena aktivitasnya dikontrol secara ketat. Onkogen terjadi melalui mutasi somatik protoonkogen, yang mempunyai sifat biologis berbeda dari counterpartnya, yaitu memiliki kemampuan untuk transformasi sel menjadi ganas (Sudoyo, 2005 ; Andrijono, 2008). Mutasi protoonkogen menjadi onkogen dapat terjadi karena virus, paparan radiasi, kontaminasi zat kimia yang karsinogenik, baik yang terjadi secara langsung dan tidak langsung. Mutasi dapat terjadi melalui perubahan struktural dalam gen, translokasi kromosom, amplifikasi gen atau mutasi dalam berbagai elemen yang dalam keadaan normal berfungsi mengontrol ekspresi gen bersangkutan (Sudoyo, 2005 ; Andrijono, 2006). Mutasi protoonkogen relatif sering terjadi dalam sel yang berproliferasi aktif, namun perubahan ke arah ganas dapat dicegah dengan bantuan ekspresi berbagai gen supresor (tumor suppresor genes atau anti-onkogen) yang berperan menginduksi terhentinya siklus sel atau menginduksi proses apoptosis (Sudoyo, 2005). Protein yang dihasilkan oleh proto-onkogen disebut wild type protein, sedangkan protein yang dihasilkan onkogen disebut onkoprotein. Onkoprotein bisa mempunyai struktur yang sama dengan wild type protein, tetapi dapat pula mengalami perubahan struktur protein, dapat berupa penambahan atau pengurangan asam amino dapat pula berupa perubahan asam amino. Protoonkogen merupakan gen yang dominan. Perubahan satu alel saja karena mutasi akan menyebabkan aktivasi fungsi gen tersebut (Sudoyo, 2005 ; Andrijono, 2008). Produk onkogen mempunyai peran sebagai faktor pertumbuhan (growth factors), reseptor faktor pertumbuhan (growth factor receptors), transduksi sinyal (signal transducers), faktor transkripsi (transcription factors), tirosine kinase, protein mitokhondria, dan faktor penghambat apoptosis (Sudoyo, 2005 ; Andrijono, 2008). Faktor pertumbuhan akan membentuk kompleks atau berikatan dengan reseptornya yang merupakan reseptor protein tirosine kinase dan reseptor serine/ threonine kinase. Berdasarkan strukturnya, factor pertumbuhan terdiri dari beberapa keluarga antara lain fibroblast growth factor (FGF), keratinocyte growth factor (KGF), epidermal growth factor (EGF), platelet derived growth factor (PDGF), transforming growth factor (TGF), hepatocyte growth factor (HGF), insulins growth factors (IGFs), chemokines, cytokines (Andrijono, 2008). Reseptor GF (GFR) adalah protein yang terdapat dalam sel (membrana sel, sitoplasma, ataupun inti sel) yang berfungsi sebagai penghubung sinyal baik sinyal ekstraseluler dengan sitoplasma dan inti sel maupun sinyal di dalam sitoplasma ataupun inti sel. Dua reseptor penting pada proses sinyal faktor pertumbuhan (sitokin) yaitu reseptor protein tirosine kinase dan reseptor protein serine/treonine kinase. Kedua reseptor tersebut penting dalam fungsinya meregulasi pertumbuhan negatif ataupun pertumbuhan positif. Reseptor tersebut terbagi menjadi tiga domain, yaitu domain ekstraselular (the extracellular ligandbinding domain), domain transmembran (the transmembrane domain), dan domain intraseluler (the intracellular tyrosine kinase catalytic domain) Domain transmembran umumnya tidak mempengaruhi sinyal transduksi, tetapi bila terjadi mutasi pada domain tersebut dapat menimbulkan perkembangan ke arah keganasan, contohnya mutasi salah satu protein pada erbB-/neu (Andrijono, 2008). Onkogen erbB-/neu yang menghasilkan onkoprotein EGFR abnormal berupa reseptor tanpa domain ekstraseluler. Onkogen neu (disebut juga erb-B2 atau HER-2) mengalami single point mutation yang mengubah valine pada residu transmembran menjadi asam glutamat. Substitusi ini menginduksi dimerisasi onkoprotein neu pada membran sel sehingga menyerupai induksi proses aktivasi oleh pengikatan dengan faktor pertumbuhan. Konsekuensinya adalah terjadi aktivasi walaupun tidak ada rangsangan faktor pertumbuhan dari luar (Sudoyo, 2005 ; Serrano dkk, 2006). 2.6 HER-2/neu pada Kanker ovarium HER-2/neu adalah protoonkogen yang disebut juga ErbB-2 merupakan salah satu famili dari human epidermal growth factor receptor (EGFR). HER2/neu mengkode 185 kDA (kilo Dalton) transmembran protein reseptor, yang mempunyai aktivitas suatu jenis tirosin kinase, dan termaksud dalam keluarga ErbB (ErbB1/HER-1, ErbB3/HER-3, dan ErbB4/HER-4). HER-2/neu berlokasi di lengan panjang kromosom 17q 12-21. Sekitar 25-30% jaringan kanker ovarium mengekspresi protein HER-2/neu (santin, 2006; Sasaki dkk, 2007; Crump dkk, 2000; Sudoyo, 2005 ). HER-2/neu sangat penting dalam proses pertumbuhan dan diferensiasi dari berbagai macam epitel normal maupun yang sudah transformasi. Reseptor ini merupakan molekul kecil ekstraseluler yang berikatan pada ligan, bentuk ikatan biasanya dimer/homogen ataupun heterogen. Dari ikatan ini bisa dilepaskan sinyal transduksi ke sitoplasma sehingga merangsang proliferasi/pertumbuhan sel. Bila reseptor HER-2/neu tidak terkontrol maka akan terjadi proses pertumbuhan tidak terkendali, angiogenesis, kehilangan kontrol apoptosis migrasi sel dan adesi sel, invasi sel dan metastasis (Azis, 2006; Reese, 1997; Purbadi, 2006). Reseptor akan teraktifasi bila terdapat tiga variabel yaitu suatu ligan, reseptor dan pasangan dimerisasi. Setelah terjadi pengikatan ligan dengan sebuah reseptor maka reseptor tersebut harus melalui proses dimerisasi yaitu berinteraksi dengan resepor lain yang identik atau yang strukturnya mirip untuk memicu terjadinya fosforilasi dan mengaktifkan kaskade pengkodean. HER-2/neu berfungsi sebagai penghubung dalam pembentukan heterodinamer) dengan anggota kelompok EGFR lain (seperti HER-1, HER-3, dan HEIM). sehingga mempunyai peranan penting dalam jalur signaling kompleks ErbB dan akan dapat mengikat ligan pada domain ekstraseluler dan selanjutnya terjadi penerusan sinyal melalui segmen transmembran ke segmen intrasel dan terjadi aktifasi tirosin kinase. Sinyal ini menyebabkan aktifasi gen dalam inti dan selanjutnya menyebabkan proliferasi sel (Santin, 2006;Sasaki, 2007; Sudoyo, 2005; Reese, 1997). Dalam sel yang normal, terdapat 2 kopi gen dalam setiap kromosom 17q. Dalam transformasi neoplastik amplifikasi gen HER-2/neu, dimana hal ini dianggap merupakan inisiasi aktifitas onkogenik HER-2/neu. Dengan terjadinya amplifikasi gen HER-2/neu jumlah gen bisa mencapai 50 atau 100 gen HER-2/neu per sel tumor. Adanya amplifikasi gen akan meningkatkan transkripsi gen yang selanjutnya akan meningkatkan m-RNA HER-2/neu dan akhirnya meningkatkan produksi protein HER-2/neu. Dengan bertambahnya protein HER-2/neu, maka aktifitas proliferasi akan bertambah, akibatnya bukan 20.000-50.000 molekul HER-2/neu per sel, namun bisa mencapai 2 juta molekul HER-2/neu per sel neoplasma (Santin, 2006; Sudoyo, 2005; Reese, 1997). Bila terjadi overekspresi HER-2/neu, terjadi juga aktivasi enzim kinase, hal ini mungkin disebabkan oleh proses auto-aktivasi karena bertambahnya jumlah molekul reseptor HER-2/neu dalam membran sel. Akibat hal ini bisa terjadi aktivasi reseptor HER-2/neu yang tidak tergantung pada keberadaan ligand, sehingga terjadi peningkatan dalam sistim signaling mitogen activated protein kinase (MARK) dan phosphatidylinositol-3 kinase (PI-3K) yang akan menyebabkan terjadinya proliferasi sel. Peningkatan aktivitas tirosin kinase akan menyebabkan sifat kanker yang lebih agresif dan merupakan petanda/prognosis yang buruk (Santin, 2006; Reese, 1997; Purbadi, 2006). Gambar 2.3. Oncogenic transformation of HER-2/neu Dikutip dari kepustakaan (Reese, 1997) HER-2/neu telah menjadi salah satu tumor marker dari kanker yang sangat mempengaruhi prognostik dari pasien. Kadar HER-2/neu yang tinggi berhubungan dengan waktu harapan hidup yang pendek, resisten terhadap terapi, dan resisten terhadap tumor necrosis factor alpha (TNF-) yang diaktivasi oleh makrofag dan lymphocyte-activated killer cell. Disamping itu, overekspresi HER2/neu pada sel tumor berhubungan dengan down-regulasi dari E-cadherin (suatu kondisi yang berkaitan dengan invasifitas dari sel tumor) dan meningkatkan sekresi vascular endothelial growth factor (salah satu mediator penting dalam angiogenesis tumor) (Camilleri dkk, 2003; Sudoyo, 2005; Juhl, 2006 ). Peningkatan ekspresi HER-2/neu telah ditemukan pada berbagai kanker pada manusia yang sepertinya berperan pada pertumbuhan sel tumor. Adapun penyebab overekspresi ini pada kebanyakan kasus karena amplifikasi gen. Overekspresi HER-2/neu pada kanker ovarium ditemukan pada 25-30% kasus (Reese dkk, 1997; Hellstrom dkk, 2001). Overekspresi HER-2/neu dapat dinilai dengan metode imunohistokimia atau FISH, dan kedua metode tersebut mempunyai korelasi yang baik (Rosai, 2004). Beberapa penelitian pada kanker payudara, ovarium dan endometrium melaporkan bahwa amplifikasi gen HER-2/neu berhubungan dengan resistensi terhadap kemoterapi dan mempunyai angka harapan hidup yang rendah, hal ini menunjukan bahwa overekspresi HER-2/neu menyebabkan manifestasi sel tumor yang lebih agresif dan memiliki sifat pertumbuhan yang lebih baik dibandingkan dengan sel yang tidak memiliki gen HER-2/neu. Hal yang sama ditemukan dalam penelitian sebelumnya, ekspresi HER-2/neu ditemukan lebih tinggi pada pasien kanker ovarium yang mengalami relaps setelah kemoterapi bila dibandingkan dengan pasien yang belum dikemoterapi (Santin, 2006; Sudoyo 2005; Reese dkk, 1997). Pengobatan kanker melalui target pada EGFR telah berkembang pesat dengan ditemukannya berbagai penghambat EGFR. Penghambat EGFR dengan Monoklonal Antibodi (Mabs) yang bekerja pada domain reseptor ekstraseluler dan tidak berikatan dengan reseptor kinase yang lain sehingga mempunyai spesifitas yang sangat tinggi. Trastuzumab adalah suatu antibodi monoklonal yang menghambat, sel kanker yang over ekspresi HER-2/neu dan mempunyai efek potensiasi kemoterapi dengan sisplatin, karboplatin, doksrubisin, paklitaksel, dan doksetaksel (Purbadi, 2006). Terapi ini awalnya diberikan pada pasien kanker payudara yang relaps dengan overekspresi protein HER-2/neu. Pada masa kini trastuzumab menjadi pilihan terapi yang penting pada setiap penderita kanker payudara dengan HER2/neu yang positif (Clifford, 2007). BAB III KERANGKA BERPIKIR, KONSEP DAN HIPOTESIS PENELITIAN 3.1 Kerangka Berpikir Kanker merupakan suatu penyakit dimana terjadi kegagalan pengaturan pada siklus sel yang normal. Ada empat kelompok gen pengatur yang mempengaruhi siklus sel tersebut yaitu tumor suppressor gene, DNA mismatch repair, protoonkogen-onkogen dan gen apoptosis. Perubahan-perubahan malignitas tersebut diakibatkan oleh adanya kelainan atau mutasi pada keempat gen tersebut. Tumor Suppressor Gene (TSG) merupakan gen yang sangat penting terhadap fungsi pengontrolan siklus sel. Hilangnya fungsi TSG akan menyebabkan kegagalan penghentian siklus sel, sehingga bila terjadi kelainan gen pada sel maka perbaikan sel tidak dimungkinkan. Kegagalan perbaikan sel akan terjadi bila gen yang mengatur atau mengontrol perbaikan mengalami mutasi sehingga gen tersebut tidak berfungsi lagi. Peningkatan onkogen akan menyebabkan proliferasi sel yang berlebihan sehingga merangsang untuk terjadinya keganasan. Pada kanker ovarium overekspresi HER-2/neu ditemukan pada 25-30% kasus dan pemeriksaan genetik menunjukkan adanya amplifikasi gen yang menyandi protein tersebut. Overekspresi HER-2/neu akan meningkatkan proliferasi sel, mempercepat pertumbuhan tumor, dan selanjutnya akan mempengaruhi derajat diferensiasi dari kanker ovarium, dalam hal ini derajat diferensiasi baik, sedang, dan buruk. Dimana pembagian derajat diferensiasi 42 tumor, yakni berdasarkan pola arsitektur yang dominan, derajat atipia inti dan indeks mitosis pada sistem grading Shimizu-Silverberg. Beberapa faktor yang diduga berperan dalam terjadinya kanker ovarium antaralain adalah: umur, paritas, penggunaan kontrasepsi, terapi hormon pengganti pada masa menopause, IMT, riwayat keluarga dengan kanker ovarium, mamae, kolon, dan genetik. 3.2 Konsep Penelitian Secara skematis kerangka konsep penelitian diperlihatkan pada gambar 3.1 HER-2/neu Kanker Ovarium Derajat diferensiasi baik Derajat diferensiasi sedang Gambar 3.1 Konsep Penelitian Derajat diferensiasi buruk 3.3 Hipotesis Penelitian Adapun hipotesis pada penelitian ini adalah ada perbedaan ekspresi HER- 2/neu pada kanker ovarium derajat diferensiasi baik dan buruk. BAB IV METODE PENELITIAN 4.1 Rancangan Penelitian Rancangan penelitian ini merupakan suatu penelitian cross sectional Study. Kanker ovarium Derajat diferensiasi baik Her2/neu(+) )) Her2/neu(-) Derajat diferensiasi sedang Her2/neu(+) ) Her2/neu(-) Derajat diferensiasi buruk Her2/neu(+) Her2/neu(-) Gambar 4.1 Rancangan Penelitian 4.2 Tempat dan Waktu Penelitian 4.2.1 Tempat penelitian Penelitian ini dilaksanakan di Bagian Obstetri dan Ginekologi, Patologi Anatomi dan Rekam Medis Rumah Sakit Umum Pusat (RSUP) Sanglah, Denpasar. 4.2.2 Waktu penelitian Waktu penelitian dilaksanakan mulai Juli 2011 sampai Juli 2013. 4.3 Populasi Penelitian Adapun populasi target penelitian adalah semua pasien dengan kanker ovarium. Populasi terjangkau penelitian adalah semua pasien kanker ovarium yang telah menjalani pembedahan di RSUP Sanglah dari tahun 2011 sampai 2013, dimana jaringan hasil pembedahannya tersebut telah dibuat blok parafin di Bagian Patologi Anatomi RSUP Sanglah. 4.4 Sampel Penelitian Sampel penelitian ini adalah semua pasien kanker ovarium yang telah menjalani pembedahan di RSUP Sanglah dari tahun 2011 sampai 2013, dimana jaringan hasil pembedahannya tersebut telah dibuat blok parafin di Bagian Patologi Anatomi RSUP Sanglah serta memenuhi kriteria inklusi dan eksklusi. 4.4.1 Kriteria inklusi Adapun kriteria inklusi penelitian adalah sebagai berikut. a. Blok parafin telah diperiksa secara histopatologis, sehingga telah terdiagnosis pasti kanker ovarium. b. Data rekam medis meliputi: identitas, umur, paritas, derajat diferensiasi. 4.4.2 Kriteria eksklusi Adapun kriteria eksklusi penelitian adalah pasien pernah menjalani kemoterapi atau radiasi sebelum pembedahan (neoadjuvan). 4.4.3 Perhitungan besar sampel Besar sampel pada penelitian ini dihitung dengan menggunakan rumus sebagai berikut (Araoye, 2003): Zα 2 (pq) n= d2 Keterangan: n = besar sampel Zα = 1,96 (α = 0,05) p = 13,8% (prevalensi kanker ovarium di populasi) q = 86,2% (1-p) d = 10% (penyimpangan absolut penelitian) Berdasarkan hasil perhitungan dengan menggunakan rumus di atas, diperoleh besar sampel penelitian adalah 43,8 buah. Sehingga dalam penelitian ini diambil sampel penelitian sebanyak 44 buah. 4.4.4 Cara pengambilan sampel Blok parafin dari semua pasien kanker ovarium yang telah menjalani pembedahan di RSUP Sanglah dari tahun 2011 sampai 2013 serta telah memenuhi kriteria inklusi dan eksklusi, kemudian dipilih dengan cara random sampling sebanyak 44 buah. 4.5 Variabel Penelitian 4.5.1 Identifikasi Variabel Variabel bebas dalam penelitian ini adalah ekspresi HER-2/neu. Variabel tergantung adalah derajat diferensiasi. Variabel terkontrol adalah umur, paritas, riwayat kontrasepsi, riwayat keluarga dengan kanker ovarium, mamae, kolon.. 4.5.2 Definisi Operasional Variabel 1. Ekspresi HER-2/neu adalah penilaian protein HER-2/neu secara imunohistokimia menggunakan antibodi monoklonal HER-2/neu Labvision, secara semikuantitatif, diantara 200 epitel ganas, diamati dengan mikroskop cahaya binokuler merk Olympus dengan pembesaran 400 kali. Penghltungan dilakukan pada 10 lapangan pandang dimulai dari bagian tumor dengan ekspresi HER-2/neu terkuat ke bagian yang lebih lemah. Interpretasi ekspresi HER-2/neu dilakukan tanpa mengetahui data klinikopatologik pasien. Sel yang mengekspresikan HER-2/neu akan tampak berwarna coklat pada membran sel. Penilaian ekspresi HER-2/neu dibuat berdasarkan analisis sel tumor yang positif dan intensitas pewarnaan. Ekspresi HER-2/neu diberi skor 0,1+, 2+, dan 3+. 2. Derajat diferensiasi adalah tingkat diferensiasi tumor yang dinilai menurut Shimizu-Silverberg grading system. Sistem ini membagi derajat diferensiasi tumor menjadi tiga yaitu 1, 2, atau 3 berdasarkan pola arsitektur yang dominan, derajat atipia inti, dan indeks mitosis. Tabel 4.1 Shimizu-Silverberg grading system untuk kanker ovarium Skor Pola arsitektur dominan Atipia sitologi Mitosis per 10 HPF 1 Glandular Ringan 0-9 2 Papiler Sedang 10-24 3 Solid Berat >/=25 (Sumber : Malpica, et al, 2004; Sriwidyani N.P, 2008) Skor total: 3-5 = derajat diferensiasi baik; 6-7 = derajat diferensiasi sedang; 89 = derajat diferensiasi jelek. Sel atipia dievaluasi pada area tumor yang paling atipik. Atipia ringan jika sel dengan inti vesikuler relatif uniform, tanpa adanya penggumpalan kromatin atau anak inti yang prominen. Atipia sedang jika variasi bentuk dan ukuran inti sedang, anak inti dapat diamati tetapi kecil, kromatin inti menggumpal, tidak ada sel bizarre. Atipia berat jika bentuk dan ukuran inti sangat bervariasi, kromatin inti sangat menggumpal, membran inti tebal, anak inti prominen eosinofilik, dan dapat dijumpai adanya sel bizarre. Jumlah mitosis dihitung pada area yang paling aktif. 3. Kanker ovarium adalah tumor ganas pada ovarium, yang berasal dari sel-sel yang menyusun ovarium yaitu sel epitel, sel germinal dan sel stromal. Data diperoleh dari rekam medis pasien. 4. Umur adalah usia pasien dalam tahun. Data diperoleh dari rekam medis pasien. 5. Paritas adalah jumlah janin viabel yang dilahirkan. Data diperoleh dari rekam medis pasien. 6. Riwayat penyakit keluarga kanker ovarium adalah adanya keluarga pasien yang pernah atau sedang menderita kanker ovarium. 4.6. Alur Penelitian Blok parafin kanker ovarium di Bagian Patologi Anatomi RSUP Sanglah diambil dari pasien kanker ovarium yang menjalani pembedahan di RSUP Sanglah dari tahun 2011 sampai 2013. Blok parafin tersebut telah diperiksa secara histopatologis di Bagian Patologi Anatomi dan telah terdiagnosis secara histopatologis sebagai kanker ovarium baik tipe epitel, germinal maupun stromal. Blok parafin pasien kanker ovarium selanjutnya harus memenuhi kriteria inklusi dan eksklusi penelitian. Blok parafin yang telah memenuhi kriteria inklusi dan eksklusi, kemudian dipilih dengan cara random sampling sebanyak 44 buah. Sampel blok parafin ini dikelompokkan berdasarkan atas derajat diferensiasi kanker ovarium, yaitu: kanker ovarium derajat diferensiasi baik, sedang, dan buruk. Apabila pada blok parafin belum terdapat data derajat diferensiasi maka sebelum dilakukan pemeriksaan imunohistokimia HER-2/neu dilakukan penentuan derajat diferensiasi terlebih dahulu. Kemudian masing-masing kelompok derajat diferensiasi dilakukan pemeriksaan ekspresi HER-2/neu dengan teknik imunophistokimia. Akhirnya, dilakukan analisis terhadap hasil pemeriksaan ekspresi HER-2/neu pada masing-masing kelompok derajat diferensiasi kanker ovarium. Kemudian blok paraffin tersebut disimpan kembali di laboratorium Patologi Anatomi RSUP Sanglah, Denpasar. Blok parafin kanker ovarium Kriteria eksklusi Kriteria inklusi Sampel penelitian Derajat diferensiasi kanker ovarium Pemeriksaan imunohistokimia ekspresi HER-2/neu Analisis Gambar 4.2 Alur Penelitian 4.7. Instrumen Penelitian dan Metode Pemeriksaan 4.7.1 Instrumen penelitian Instrumen penelitian terdiri dari perlengkapan alat tulis seperti kertas, komputer, formulir penelitian, alat tulis dan lainnya. 4.7.2 Metode pemeriksaan Metode pemeriksaan yang digunakan dalam penelitian ini adalah tehnik imunohistokimia. Pemeriksaan imunohistokimia adalah sebagai berikut : 1. Nomor-nomor sediaan penderita kanker ovarium yang melakukan pemeriksaan patologi dari tahun 2011 sampai 2013 dikumpulkan dan dilihat apakah memenuhi kriteria inklusi dan eksklusi. 2. Preparat hasil pulasan Hematoksilin dan Eosin sesuai nomor-nomor diatas dikumpulkan dan dievaluasi ulang. Yang dinilai adalah semua parameter patologik yang akan dianalisis. Preparat yang sulit dievaluasi dilakukan potong ulang blok dan dipulas dengan pulasan rutin menggunakan Harris's hematoksilin dan eosin. Adapun langkah dari tehnik pewarnaan ini adalah : a. Deparafinisasi dengan dicelupkan pada xilol sebanyak 3 kali masingmasing celupan selama 5 menit. b. Hidrasi dengan alkohol 96% senbanyak 2 kali, masing celupan selama 2 menit, kemudian dicelupkan kedalam alkohol 80% selama 2 menit. c. Masukkan ke air selama 10 menit. d. Celupkan ke cat utama yaitu Harris's hematoksilin selama 10 menit e. Cuci dengan air mengalir selama 20 menit f. Lihat dibawah mikroskop, inti sel akan telihat biru terang sedangkan sitoplasma tidak berwarna g. Celupkan pada cat pembanding eosin 1% selama 0,5-1 menit h. Dehidrasi dengan alkohol 80% selama 2 menit, selanjutnya menggunakan alkohol 96% sebanyak 2 kali, masing-masing celupan selama 2 menit i. Penjernihan dengan xilol sebanyak 3 kali celupan , lama masing-masing celupan selama 5 menit. j. Tutup dengan cover glass. 3. Memilih preparat yang akan dipulas HER-2/neu. Preparat yang dipilih untuk pemeriksaan imunohistokimia HER-2/neu adalah preparat yang paling banyak mengandung bagian tumor dengan area nekrosis yang sedikit atau tidak ada. Jika satu kasus mempunyai lebih dari satu sediaan yang mengandung tumor, maka dipilih sediaan yang mengandung bagian tumor dengan diferensiasi yang lebih jelek. 4. Preparat yang terpilih kemudian dicari blok parafinnya. 5. Pulasan imunohistokimia HER-2/neu dengan langkah sbb.: a. Potong jaringan 4 mikrometer, ditempelkan pada gelas objek yang telah dilapisi poly-L-lysine. b. Inkubasi dalam oven suhu 37°C selama 1 malam c. Deparafinisasi dengan xylene d. Dehidrasi dengan alkohol. e. Cuci dengan PBS 2x5 menit. f. Rendam dengan buffer sitrat pH 6,0. Kemudian panaskan di dalam mikrowave oven selama 10 menit, mula-mula dengan pemanasan tinggi selama 5 menit kemudian dengan pemanasan sedang selama 5 menit. g. Dinginkan pada suhu kamar. h. Cuci dengan PBS 2x5 menit. i. Tetesi H2O2 0,3% selama 30 menit. j. Cuci dengan aquadest 1x5 menit. k. Cuci dengan PBS 2x5 menit. l. Tetesi 100 ul blocking solution (normal serum dengan pengenceran 100 x) selama 20 menit. m. Tetesi 100 ul antibodi primer menggunakan antibodi monoklonal n. HER-2/neu Labvision yang telah diencerkan (pengenceran 1 : 50). o. Diinkubasi selama 1 malam pada suhu 4°C. n. Cuci dengan PBS 2 x 5 menit 0. Tetesi 100 ul antibodi sekunder (pengenceran 100 x) selama 30 menit. p. Cuci dengan PBS 2x5 menit. q. Tetesi 100 ul SBC selama 30 menit. r. Cuci dengan PBS 2x5 menit. s. Tetesi reagen DAB 10 menit. t. Cuci dengan air. u. Counterstain dengan Hematoksilin selama 1 menit. v. Dehidrasi dengan alkohol. w. Tutup dengan cover glass. 6. Interpretasi sediaan yang telah dipulas HER-2/neu: a. Sebagai kontrol positif adalah kasus karsinoma payudara dengan ekspresi HER-2/neu yang kuat. b. Interpretasi HER-2/neu dilakukan tanpa mengetahui data klinis dan patologik dari setiap kasus. c. Dilakukan penghitungan ekspresi HER-2/neu secara semikuantitatif. Pertama, dihitung persentase sel epitel ganas yang tercat positif diantara 200 epitel ganas, menggunakan mikroskop cahaya binokuler merk Olympus, dengan pembesaran 400 kali. d. Hanya pewarnaan coklat pada membran sel yang dinilai positif. Intensitas pewarnaan dievaluasi secara subyektif yaitu lemah, sedang, dan kuat. e. Skor diperoleh berdasarkan gabungan antara persentase sel yang terpulas dan intensitas pewarnaannya, dengan rentang skor 0, 1+, 2+, 3+ Tabel 4.2 Interpretasi pulasan imunohistokimia HER-2/neu Pola pulasan Skor Tidak ada sel yang terpulas atau terpulas pada kurang dari 10% sel 0 Terpulas pada lebih dari 10% sel dengan intensitas pulasan lemah, 1+ membran sel yang terpulas hanya sebagian. Terpulas pada lebih dari 10% sel dengan intensitas lemah sampai 2+ sedang, membran sel terpulas komplit. Terpulas pada lebih dari 10% sel dengan intensitas kuat dan komplit. (Sumber : Rosai, 2004) 3+ 4.8 Pengumpulan dan Analisis Data 4.8.1 Pengumpulan data Data yang didapatkan pada bagian Obstetri dan Gynecologi, Patologi Anatomi, dan Rekam Medis RSUP Sanglah dikumpulkan kemudian dimasukan ke dalam formulir penelitian (terlampir). 4.8.2 Analisis data Data pada formulir penelitian kanker ovarium diolah dengan menggunakan SPSS 17,0 for windows. Kemudian dilakukan beberapa tes atau uji, antara lain adalah sebagai berikut. a. Karakteristik sampel disajikan secara deskriptif, dengan menggunakan grafik dan tabel. b. Uji One Sample Kolmogorov-Smirnov dan Levene’s Test untuk mengetahui normalitas dan homogenitas data. c. Uji Komparasi ekspresi HER-2/neu pada kanker ovarium derajat diferensiasi baik, sedang, buruk dilakukan dengan uji Chi-square. BAB V HASIL PENELITIAN Selama periode penelitian, sebanyak 44 sampel dimana bahannya adalah blok parafin dengan diagnosis kanker ovarium epitelial yang dilaksanakan di Bagian Obstetri dan Ginekologi, Patologi Anatomi dan Rekam Medis RSUP Sanglah. 5.1 Karakteristik Sampel Penelitian Pada penilitan ini dilakukan uji normalitas data dengan uji KolmogorovSmirnov dan uji homogenitas data dengan Levene’s test terhadap variabel umur, IMT, paritas, dan kontrasepsi. Hasil analisis menunjukkan bahwa data pada variabel umur, IMT dan paritas berdistribusi normal (p>0,05) dan homogen (p>0,05), sedangkan untuk membandingkan nilai rerata masing-masing variabel digunakan uji One Way Anova. Tabel 5.1 Distribusi Umur, IMT, Paritas, dan Kontrasepsi pada Kelompok Derajat Diferensiasi Kanker Ovarium Derajat Diferensiasi Kanker Ovarium Baik (n=12) rerata±2SD Sedang (n=14) rerata±2SD Buruk (n=18) rerata±2SD P 50,00±9,89 41,29±13,14 47,76± 8,14 0,087 23,36±5,60 22,65±4,95 20,68±2,35 0,227 Paritas 1,92±1,11 1,79 ±0,97 1,88±1,26 0,949 Kontrasepsi 1,77±0,43 1,73±0,45 1,94±0,25 0.306 Variabel Umur (tahun) IMT (kg/m2) 53 Tabel 5.1 menunjukkan bahwa antar kelompok derajat diferensiasi kanker ovarium tidak memiliki perbedaaan pada variabel umur, IMT, paritas, dan kontrasepsi dengan nilai p>0,05. 5.2 Perbedaan Ekspresi HER-2/neu pada Kanker Ovarium Derajat Diferensiasi Baik dan Sedang Untuk mengetahui perbedaan ekspresi HER-2/neu pada kanker ovarium derajat diferensiasi baik dan sedang digunakan uji Chi-Square. Hasil analisis disajikan pada Tabel 5.2. Tabel 5.2 Perbedaan Ekspresi HER-2/neu pada Kanker Ovarium Derajat Diferensiasi Baik dan Sedang HER2/neu Kanker Ovarium Derajat Diferensiasi Sedang Baik Positif Negatif 4 10 1 RP IK 95% p 3,43 0,44-26,66 0,330 11 Pada tabel 5.2 di atas menunjukkan bahwa tidak terdapat perbedaan ekspresi HER-2/neu pada kanker ovarium derajat diferensiasi baik dan sedang (p =0,330). 5.3 Perbedaan Ekspresi HER-2/neu pada Kanker Ovarium Derajat Diferensiasi Baik dan Buruk Untuk mengetahui perbedaan ekspresi HER-2/neu pada kanker ovarium derajat diferensiasi baik dan buruk digunakan uji Chi-Square. Hasil analisis disajikan pada Tabel 5.3. Tabel 5.3 Perbedaan Ekspresi HER-2/neu pada Kanker Ovarium Derajat Diferensiasi Baik dan Buruk HER2/neu Kanker Ovarium Derajat Diferensiasi Buruk Baik Positif Negatif 8 10 1 RP IK 95% p 5,33 1,162-37,35 0,034 11 Tabel 5.3 di atas menunjukkan bahwa terdapat perbedaan ekspresi HER2/neu pada kanker ovarium derajat diferensiasi baik dan buruk (p =0,034). 5.4 Perbedaan Ekspresi HER-2/neu pada Kanker Ovarium Derajat Diferensiasi Sedang dan Buruk Untuk mengetahui perbedaan ekspresi HER-2/neu pada kanker ovarium derajat diferensiasi baik dan sedang digunakan uji Chi-Square. Hasil analisis disajikan pada Tabel 5.4. Tabel 5.4 Perbedaan Ekspresi HER-2/neu pada Kanker Ovarium Derajat Diferensiasi Sedang dan Buruk HER2/neu Kanker Ovarium Derajat Diferensiasi Buruk Sedang Positif Negatif 8 10 4 10 RP IK 95% p 1,56 0,59-4,13 0,358 Tabel 5.4 di atas menunjukkan bahwa tidak terdapat perbedaan ekspresi HER-2/neu pada kanker ovarium derajat diferensiasi sedang dan buruk (p= 0,358). BAB VI PEMBAHASAN 6.1 Karakteristik Sampel Penelitian Pada penelitian ini rerata umur pada kelompok kanker ovarium derajat diferensiasi baik adalah 50,00 ± 9,89 tahun, derajat diferensiasi sedang adalah 41,29 ± 13,14 tahun, dan derajat diferensiasi buruk adalah 47,76 ± 8,14 tahun. Penelitian ini sesuai dengan angka kejadian kanker ovarium pada umumnya di mana cenderung meningkat seiring dengan bertambahnya umur, terutama pada umur di atas 50 tahun. Sebanyak 80% dari kejadian kanker ovarium ditemukan pada umur wanita lebih dari 45 tahun, namun pada beberapa kasus kanker ovarium juga dapat ditemukan pada umur yang relatif lebih muda daripada kanker pada wanita lainnya, yaitu antara umur 20 sampai 30 tahun (Fauzan, 2009). Penelitian yang sama juga dilakukan oleh Rauf dan Masadah (2009) di mana diperoleh rerata umur penderita kanker ovarium adalah 55 tahun. Penelitian yang dilakukan oleh Faizal (2011) di Rumah Sakit Wahidin Sudirohusodo, Makasar memperoleh hasil yang serupa di mana kelompok umur yang paling banyak menderita kanker ovarium adalah kelompok umur 41 sampai 50 tahun yaitu sebanyak 62,7% dan paling sedikit adalah 31 sampai 40 tahun yaitu sebanyak 10,8%. Hal tersebut sesuai dengan salah satu mekanisme terjadinya kanker ovarium yaitu berdasarkan pada teori Incessant ovulation. Teori Incessant ovulation ini beranggapan bahwa adanya trauma berulang pada ovarium selama proses ovulasi, 57 mengakibatkan epitel ovarium mudah terpajan atau terpapar oleh berbagai faktor risiko sehingga dapat mengakibatkan terjadinya kelainan atau abnormalitas genetik. Adanya ovulasi dan semakin bertambahnya umur seorang wanita dapat menyebabkan terperangkapnya fragmen epitel permukaan ovarium pada cleft atau invaginasi pada permukaan dan badan inklusi pada kortek ovarium. Beberapa penelitian telah membuktikan bahwa terdapat hubungan antara frekuensi metaplasia dan neoplasma pada daerah-daerah ovarium yang mengalami invaginasi dan terbentuknya badan inklusi (Choi, 2007). Pada penelitian ini diperoleh rerata Indek Massa Tubuh (IMT) dalam rentang normal. Rerata IMT pada masing-masing kelompok kanker ovarium derajat diferensiasi baik adalah 23,36 ± 5,60 kg/m2, derajat diferensiasi sedang adalah 22,65 ± 4,95 kg/m2, dan derajat diferensiasi buruk adalah 20,68 ± 2,35 kg/m2. Beberapa penelitian membuktikan bahwa peningkatan IMT dapat meningkatkan risiko terjadinya kanker ovarium (Reeves, 2007). Penelitian yang dilakukan oleh Anders (2003) memperoleh hasil bahwa risiko relatif terjadinya kanker ovarium memiliki kecenderungan meningkat sesuai dengan peningkatan IMT. Pada IMT kurang dari 18,5 kg/m2 memiliki risiko sebesar 1,09, IMT antara 18,5 sampai 24,9 kg/m2 memiliki risiko sebesar 1,00, IMT antara 25,0 sampai 29,9 kg/m2 memilki risiko sebesar 1.43, dan IMT lebih dari 30,0 kg/m2 memiliki risiko sebesar 1,56 untuk menderita kanker ovarium. Penelitian yang dilakukan oleh European Prospective Investigation into Cancer and Nutrition tahun 2006 memperoleh hasil bahwa pada wanita dengan IMT di atas 30 kg/m2 atau obesitas memiliki risiko relatif sebesar 1,59 untuk terjadinya kanker ovarium dibandingkan dengan wanita dengan IMT normal. Penelitian yang berbeda memperoleh hasil bahwa peningkatan IMT pada wanita premenopause meningkatkan risiko terjadinya kanker ovarium dengan risiko relatif sebesar 1,72 (Schouten, 2008). Penelitian yang dilakukan oleh Lahmann (2009) juga memperoleh hasil di mana risiko terjadinya kanker ovarium pada wanita obesitas dengan IMT lebih dari 30 kg/m2 sebesar 1,26 lebih besar dibandingkan dengan IMT normal. Penelitian yang dilakukan oleh Faizal (2011) di Rumah Sakit Wahidin Sudirohusodo, Makasar memperoleh hasil di mana pada IMT yang lebih dari 30 kg/m2 memiliki risiko 2,03 kali lebih besar dibandingkan dengan wanita yang memiliki IMT yang kurang dari 30 kg/m2. Obesitas menyebabkan kadar estrogen dalam tubuh juga meningkat serta beberapa zat lemak dapat menghasilkan estrogen yang pada umumnya berbentuk estrion dan estradiol. Cadangan lemak di dalam tubuh memainkan peranan yang penting sebagai bahan untuk memproduksi hormon, khususnya hormon estrogen. Berbagai penelitian telah mengemukakan bahwa Estrogen Reseptor-α (ER-α) bertanggung jawab dalam proses proliferasi ovarium, sementara Estrogen Reseptor-β (ER-β) bertanggung jawab dalam proses modulasi dan differensiasi sel. Peningkatan estrogen tersebut meningkatan suatu molekul Vascular Endothelial Growth Factor (VEGF), meningkatan kemampuan adhesi sel, dan meningkat kemampuan sel dalam melakukan migrasi. Pada akhirnya, semua hal tersebut berdampak pada proliferasi abnormal pada sel yang membelah sehingga sel akan masuk menuju proses menuju transformasi ganas dalam hal ini adalah kanker ovarium (Capen et al., 2004). Pada penelitian ini diperoleh rerata paritas adalah dua. Rerata paritas pada kelompok kanker ovarium derajat diferensiasi baik adalah 1,92 ± 1,11, derajat diferensiasi sedang adalah 1,79 ± 0,97, derajat diferensiasi buruk adalah 1,88 ± 1,26. Paritas merupakan salah satu faktor risiko yang penting dalam menentukan terjadinya kanker ovarium. Wanita yang sudah pernah hamil memiliki risiko mengalami kanker ovarium sebesar 50% lebih rendah daripada wanita yang belum pernah hamil atau nullipara. Bahkan, wanita yang telah beberapa kali hamil risiko terjadinya kanker ovarium menjadi semakin berkurang (Czyz, 2008). Penelitian yang dilakukan oleh Cancer Research United of Kingdom pada tahun 2006 menyimpulkan bahwa semakin tinggi jumlah paritas maka semakin rendah kemungkinan risiko terjadinya kanker ovarium. Pada wanita yang tidak memiliki anak atau nullipara memiliki risiko dua kali lipat lebih besar untuk terjadinya kanker ovarium daripada wanita dengan paritas tiga atau lebih (Granstrom, 2008). Penelitian yang dilakukan oleh Sriwidyani (2008) juga memperoleh 78,1 kasus kanker ovarium adalah multiparitas, terutama adalah paritas dua. Penelitian yang dilakukan oleh Faizal (2011) di Rumah Sakit Wahidin Sudirohusodo, Makasar memperoleh hasil yang berbeda di mana kejadian kanker ovarium tidak memiliki hubungan dengan tingkat paritas. Paritas adalah banyaknya kelahiran hidup atau jumlah anak yang dimiliki oleh seorang wanita. Pada saat terjadinya ovulasi akan terjadi kerusakan pada epitel ovarium dan untuk proses perbaikan kerusakan ini maka diperlukan waktu tertentu. Apabila kerusakan epitel ini terjadi berkali-kali terutama jika sebelum penyembuhan sempurna tercapai, atau dengan kata lain waktu yang dibutuhkan oleh sel untuk istirahat tidak cukup, maka proses perbaikan tersebut akan mengalami gangguan sehingga dapat terjadi transformasi menjadi sel-sel neoplastik. Hal tersebut menjelaskan bahwa wanita yang memiliki paritas lebih dari dua akan menurunkan risiko terjadinya kanker ovarium. Pada penelitian ini diperoleh bahwa sebagian besar sampel penelitian tidak memiliki riwayat penggunaan kontrasepsi hormonal baik pada kanker ovarium derajat diferensiasi baik, sedamg, dan buruk. Penelitian lainnya melaporkan bahwa penggunaan pil kontrasepsi selama kurang lebih satu tahun dapat menurunkan risiko kejadian kanker ovarium sebesar 11%, sedangkan apabila pemakaian mencapai lima tahun maka risiko terjadinya kanker ovarium dapat semakin menurun, bahkan mencapai 50% (Fauzan, 2009). Penelitian yang dilakukan oleh Beral (2008) juga memperoleh hasil bahwa penurunan risiko relatif terjadinya kanker ovarium sesuai dengan lamanya pemakaian kontrasepsi oral, di mana pada wanita yang memakai kontrasepsi oral selama kurang dari satu tahun memiliki risiko relatif 1 dan semakin menurun mencapai 0,42 pada pemakaian yang lebih dari lima belas tahun. Setelah dilakukan analisis lanjutan terhadap jenis hormon pada obat kontrasepsi, diperoleh bahwa hormon yang berperan dalam menurunkan risiko terjadinya kanker ovarium tersebut adalah progesteron. Penggunaan obat yang menggandung hormon estrogen saja khususnya pada wanita pascamenopause justru meningkatkan risiko terjadinya kanker ovarium. Pada penggunaan kombinasi progesteron dan estrogen atau progesteron saja akan menurunkan risiko terjadinya kanker ovarium (Busman, 2008). Pada penelitian ini seluruh sampel tidak memiliki riwayat terapi hormonal pada masa menopause dan riwayat keluarga kanker ovarium, mamae, kolon. 6.2 Perbedaan Ekspresi HER-2/neu pada Kanker Ovarium Derajat Diferensiasi Baik, Sedang, dan Buruk Pada penelitian ini telah dilakukan pemeriksaan imunohistokimia terhadap 44 sampel blok parafin kanker ovarium. Sebanyak 13 dari 44 (29,5%) sampel blok parafin yang didapatkan ekspresi HER-2/neu yang positif, di mana masing-masing 1 buah pada derajat diferensiasi baik, 4 buah pada derajat diferensiasi sedang, dan 8 buah pada derajat diferensiasi buruk. Ekspresi HER-2/neu pada kanker ovarium derajat diferensiasi baik dan buruk memiliki nilai Rasio Prevalen (RP) sebesar 5,33. Hal tersebut berarti bahwa pada kanker ovarium derajat diferensiasi buruk terdapat ekspresi protein HER-2/neu sebesar 5,33 kali lebih banyak daripada derajat diferensiasi baik. Pada kanker ovarium derajat diferensiasi baik dan sedang serta sedang dan buruk masing-masing memiliki nilai RP sebesar 3,43 dan 1,56. Hal tersebut berarti bahwa pada kanker ovarium derajat diferensiasi sedang terdapat ekspresi protein HER-2/neu sebesar 3,43 kali lebih banyak daripada derajat diferensiasi baik dan kanker ovarium derajat diferensiasi buruk memiliki ekspresi protein HER-2/neu sebesar 1,56 kali lebih banyak daripada derajat diferensiasi sedang. Setelah dilakukan analisis statistik diperoleh adanya perbedaan ekspresi HER-2/neu pada kanker ovarium derajat diferensiasi baik dan buruk (p =0,034). Sedangkan pada analisis statistik ekspresi HER-2/neu pada kanker ovarium derajat diferensiasi baik dan sedang (p =0,330) demikian pula ekspresi HER-2/neu pada kanker ovarium derajat diferensiasi sedang dan buruk (p =0,358) masing-masing tidak terdapat perbedaan. Penelitian ini memperoleh hasil yang serupa dengan penelitian yang dilakukan oleh Tomic dkk. (2003) di mana menyimpulkan bahwa ekspresi HER2/neu berhubungan dengan derajat diferensiasi sel kanker ovarium, dimana ekspesi HER-2/neu paling banyak ditemukan pada diferensiasi buruk. Penelitian yang dilakukan oleh Katrina (2008) memperoleh bahwa ekspresi HER-2/neu berhubungan dengan derajat diferensiasi kanker ovarium dan terdapat perbedaan bermakna pada derajat diferensiasi baik dan buruk. Penelitian ini memperoleh hasil yang berbeda dengan penelitian lainnya yang menilai ekspesi HER-2/neu dengan derajat diferensiasi kanker ovarium. Penelitian yang dilakukan oleh Tuefferd dkk. (2007) memperoleh bahwa ekspresi HER2/neu tidak berhubungan dengan derajat differensiasi kanker ovarium. Penelitian yang dilakukan oleh Sri (2008) memperoleh bahwa tidak terdapat perbedaan dan hubungan antara ekspresi HER-2/neu dengan derajat diferensiasi kanker ovarium, dimana ekspresi HER-2/neu pada derajat diferensiasi baik sebanyak 25%, sedang 25% dan buruk 50%. Pada penelitian ini diperoleh hasil adanya ekspresi HER-2/neu yang berbeda pada derajat diferensiasi kanker ovarium baik dan buruk, dimana ekspresi HER2/neu cenderung meningkat pada derajat diferensiasi buruk. Hal ini disebabkan oleh karena pada kanker ovarium dengan derajat diferensiasi sel yang buruk di mana sel normal ovarium semakin banyak yang mengalami kehilangan fungsi dari gen HER-2/neu, ekspresi HER-2/neu terjadi dalam jumlah berlebih atau overekspresi. Ekspresi HER-2/neu yang berlebih disebabkan oleh karena adanya mutasi dari gen HER-2/neu. Berbagai penelitian telah membuktikan bahwa mutasi terhadap HER-2/neu dapat terjadi melalui perubahan struktural dalam gen, translokasi kromosom, amplifikasi gen atau mutasi dalam berbagai elemen yang dalam keadaan normal berfungsi mengontrol ekspresi gen bersangkutan (Sudoyo, 2005; Andrijono, 2006). Apabila terjadi overekspresi HER-2/neu, maka selanjutnya mengakibatkan aktivasi enzim kinase, hal ini mungkin disebabkan oleh proses auto-aktivasi karena bertambahnya jumlah molekul reseptor HER-2/neu dalam membran sel. Aktivasi reseptor HER-2/neu yang tidak tergantung pada keberadaan ligan, selanjutnya mengakibatkan peningkatan dalam sistim signaling mitogen activated protein kinase (MARK) dan phosphatidylinositol-3 kinase (PI-3K) yang akan menyebabkan terjadinya proliferasi sel yang berlebih dalam hal ini adalah kanker ovarium (Santin, 2006; Reese, 1997; Purbadi, 2006). Kadar HER-2/neu yang tinggi berhubungan dengan waktu harapan hidup yang pendek, resisten terhadap terapi, dan resisten terhadap tumor necrosis factor alpha (TNF-) yang diaktivasi oleh makrofag dan lymphocyte-activated killer cell. Selain itu, overekspresi HER-2/neu pada kanker ovarium berhubungan dengan down-regulasi dari E-cadherin (suatu kondisi yang berkaitan dengan invasifitas dari sel tumor) dan meningkatkan sekresi vascular endothelial growth factor yang salah satu mediator penting dalam angiogenesis kanker ovarium (Camilleri dkk, 2003; Sudoyo, 2005; Juhl,2006 ). Pada penelitian yang memperoleh hasil tidak adanya perbedaan antara ekspresi HER-2/neu dengan derajat diferensiasi sel kanker ovarium, menjelaskan bahwa hal tersebut kemungkinan disebabkan oleh karena jalur karsinogenesis dari kanker ovarium yang bersifat multistep dan kegagalan HER-2/neu pada kondisi kanker ovarium. Kanker ovarium merupakan suatu keganasan ginekologi yang memiliki patofisiologi penyakit yang bersifat multistep, dimana terdapat berbagai jalur karsinogenesis yang diduga berperan penting dalam menentukan terjadinya kanker ovarium. Selain jalur HER-2/neu yang merupakan suatu onkogen yang dianalisis pada penelitian ini. Beberapa gen dan ekspresi protein gen yang mengalami kelainan dan terlibat dalam jalur karsinogenesis terjadinya kanker seperti inaktivasi gen supresor tumor, perubahan pada gen apoptosis dan kerusakan gen yang terlibat pada perbaikan DNA (Kumar dkk., 2010). Selain itu, pada sel yang telah berubah menjadi kanker, dalam hal ini adalah kanker ovarium maka sel tersebut telah kehilangan fungsi dari gen HER-2/neu, sehingga sudah dapat dipastikan tidak terjadi ekspresi HER-2/neu yang normal dimana berperan dalam mengaktivasi reseptor HER-2/neu tergantung pada keberadaan ligan. Aktivasi reseptor HER-2/neu oleh protein ekspresi gen bersifat terkontrol, dimana setelah pertumbuhan sel dianggap cukup, maka terdapat mekanisme spontan untuk menghentikan aktivasi pada reseptor HER-2/neu. Sehingga mengakibatkan peningkatan dalam sistim signaling mitogen activated protein kinase (MARK) dan phosphatidylinositol-3 kinase (PI-3K) yang akan menyebabkan terjadinya proliferasi sel yang berlebih atau tidak terkontrol dalam hal ini adalah kanker ovarium (Santin, 2006; Purbadi, 2006). 6.3 Kelemahan Penelitian Pada penelitian ini jumlah sampel penelitian ditentukan berdasarkan data Badan Registrasi Kanker pada tahun 2006, dimana angka kejadian kanker ovarium di populasi sebesar 11,9%. Oleh karena penelitian ini mengetahui perbedaan ekspresi HER-2/neu pada kanker ovarium derajat diferensiasi baik dan buruk, maka jumlah sampel penelitian seharusnya ditentukan berdasarkan atas jumlah sampel terbanyak yang diperoleh dari angka prevalensi kelompok derajat diferensiasi baik dan buruk kanker ovarium, bukan berdasarkan angka prevalensi dari kanker ovarium di populasi. Penelitian ini menggunakan angka prevalensi dari kanker ovarium di populasi sebagai patokan dalam menentukan jumlah sampel penelitian oleh karena belum ditemukannya angka prevalensi kelompok derajat diferensiasi baik dan buruk kanker ovarium di populasi. BAB VII SIMPULAN DAN SARAN 7.1 Simpulan Adapun simpulan pada penelitian ini adalah terdapat perbedaan ekspresi HER-2/neu pada kanker ovarium derajat diferensiasi baik dan buruk. 7.2 Saran Berdasarkan simpulan di atas, terdapat beberapa rekomendasi yang diajukan antara lain adalah: 1. Oleh karena jalur karsinogenesis dari kanker ovarium yang bersifat multistep, maka diperlukan penelitian lanjutan guna menilai jalur karsinogenesis yang lain, seperti pada jalur gen supresor tumor, apoptosis, dan perbaikan DNA terkait dengan derajat diferensiasi sel. 2. Ekspresi protein HER-2/neu dapat diaplikasikan secara klinis sebagai suatu biomarker baru dalam melakukan deteksi dini, prognostik, dan penilaian efektifitas kemoterapi pada kanker ovarium derajat diferensiasi baik dan buruk. DAFTAR PUSTAKA American Cancer Society. 2010. Cancer Facts and Figures 2010. [online] Available from: http://document.cancer.org/acs/groups/cid/documents/ webcontent/003130-pdf. [Accessed: 10th Agustus 2010 ]. Andrijono. 2006. Siklus Sel. In: Aziz, M.F., Andrijono, Saifuddin, A.B., editors. Onkologi Ginekologi. 1st Ed. Jakarta: Yayasan Bina Pustaka Sarwono Prawirodharjdo. p.17-19. Andrijono. 2006. Onkogen. In: Aziz, M.F., Andrijono, Saifuddin, A.B., editors. Onkologi Ginekologi. 1st Ed. Jakarta: Yayasan Bina Pustaka Sarwono Prawirodharjdo. p. 33-35. Andrijono. 2004. Sinopsis Kanker Ginekologi. Jakarta: Divisi Onkologi Departemen Obstetri dan Ginekologi FKUI RSUPN dr. Cipto Mangunkusumo. Arai, M., Utsunomiya, J., Miki, Y. 2004. Familial Breast and Ovarian Cancers. Int J Clin Oncol, 9: 270-82. Astuti, I. 2005. Proses Transformasi dan Mutagenesis. In: The 8th Course & Workshop Basic Science in Oncology. Modul A putaran ke-3. Jakarta. Azis, M.F. 2006. Karsinogenesis. In: Aziz, M.F., Andrijono, Saifuddin, A.B., editors. Buku Acuan Nasional Onkologi Ginekologi. 1st Ed. Jakarta: Yayasan Bina Pustaka Sarwono Prawirodiharjdo, p. 20-32. Baziad, A. 2002. Kontrasepsi Hormonal. 1st Ed. Jakarta: Yayasan Bina Pustaka Sarwono Prawirodihardjo. Berek, J.S. 2002. Ovarian Cancer. In: Berek, J.S., editors. Novak's Gynecology. 13th Ed. Philadelphia: Lippincott Williams and Wilkins, p. 1245-1319. Berek, J.S., Natarajan, S. 2007. Ovarian and Fallopian Tube Cancer. In: Berek, J.S., editors. Berek & Novak’s Gynecology. 14th Ed. Philadhelpia: Lippincott William & Wilkins, p.1457-1548. Boet, S.C., Bessard, A.C., Tourneau, A.L., Paraiso, D., Levrel, O., Leduc, B., Bain, S., Orfeuvre, H., Audouin, J., Lauraine, E.P. 2004. HER-2 Over-expression is an Independent Marker of Poor Prognosis of Advanced Primary Ovarian Carcinoma: A Multi-center Study of The GINECO Group. Annals of Oncology, 15: 104-112. Bruce, A., Alexander, J., Julian, L., Martin, R., Keith, R., and Peter, W. 2002. Moleculer Biology of The Cell-an Overview of The Cell Cycle. 4th Ed. Garland Science. Busmar, B. 2006. Kanker Ovarium. In: Aziz, M.F., Andrijono, Saifuddin, A.B., editors. Buku Acuan Nasional Onkologi. 1st Ed. Jakarta: Yayasan Bina Pustaka Sarwono Prawirodihardjo, p. 468-527. Camilleri-Broet, S., Hardy-Bessard, A., Toumeau, A.L., Paraiso, D., Levrel, O., Leduc, B., et al. 2003. HER-2 Overexpression is an Independent Marker of Poor Prognosis of Advanced Primary Ovarian Carcinoma: a Multicenter Study of The GINECO Group. Annals of Oncology, 15: 104-12. Crump, C., Mclntosh, M.W., Urban, N., Anderson, G., Karlan, B.Y. 2000. Ovarian Cancer Tumor Marker Behavior in Asymtomatic Healthy Women: Implications for Screening. Cancer epidemiology, biomarkers & prevention, 9: 1107-1111. Fauzan, R. 2009. Gambaran Faktor Penggunaan Kontransepsi Terhadap Angka Kejadian Kanker Ovarium di RSUPN Dr. Cipto Mangkusumo Jakarta Berdasarkan Pemeriksaan Histopatologik Tahun 2003-2007 (tesis). Jakarta: Universitas Indonesia. Gondhowiardjo, S. 2005. Disregulasi Proses Proliferasi Sel Kanker. In: The 8th Course & Workshop Basic Science in Oncology. Modul A putaran ke-3. Jakarta. Gubbels, J.A. 2010. The Detection, Treatment and Biology of Epithelial Ovarian Cancer. [Online] Available from : http : //www.ncbi.nlm.nih.gov/pmc/ articles/pmc2856581. [Accessed : 17th September 2010]. Havrilesky, L.J., Berchuck, A. 2001. Molecular Alteration in Sporadic Cancer. In: Havrilesky, L.J., Berchuck, A. Ovarian Cancer. 2nd Ed. Philadelphia: Lippincott William & Wilkins Publisher. Heffner, L.J. 2001. Human Reproduction at a Glance: Normal Human Reproduction. 1st Ed. London: Blackwell Science. Hellstrom, I., Goodman, G., Pullman, J., Yang, Y., Hellstrom, K.E. 2001. Overexpression of HER-2 on Ovarian Carcinomas. Cancer Research, 61: 2420-3. Ishioka, S., Sagae, S., Terasawa, K. 2003. Comparison of The Usefulness Between a New Universal Grading System for Epithelial Ovarian Cancer and The FIGO Grading System. Gynecol Oncol, 89(4): 7–452. Jemal, A., Siegel, R., Ward, E. 2008. Cancer Statistics, 2008. CA: Journal Cancer for Doctor, 58(2) 2: 71-96. Juhl, H., Downing, S.G., Wellstein, A., Czubayko, F. 1997. HER-2/neu is Rate Limiting for Ovarian Cancer Growth: Conditional Depletion of HER-2/neu by Ribozyme Targeting. The Journal of Biological Chemistry, 272(47): 29482-86. Kaku, T., Ogawa, S., Kawano, Y., Ohishi, Y., Kobayasi, H., Hirakawa, T., Nakano, H. 2003. Histological Classification of Ovarian Cancer. Med Electron Microsc, 36: 9-17. Karyana, K. 2004. Profil Kanker Ovarium Di Rumah Sakit Sanglah Denpasar Periode Januari-Desember 2002. PPDS I Obstetri dan Ginekologi FK UNUD/RSUP Sanglah Denpasar, 205:13-6. Kramer, J.L., Greene, M.H. 2004. Epidemiology of Ovarian, Fallopian Tube and Primary Peritoneal Cancers. In: Kramer, J.L., Greene, M.H. Controversis in Management on Ginecologic Cancers. Philadelphia: Elsevier Churchill Livingstone, p. 327-40. Kresno, S.B. 2005. Tumor Suppressor Genes. In: The 8th Course & Workshop Basic Science in Oncology. Modul A putaran ke-3, Jakarta. Kumar, V., Abbas, A.K., Fausto, N. 2004. The Female Genital Tract: Pathologic Basis of Disease. 7th Ed. Pennsylvania: William Schmitt. Kumar, V., Abbas, A.K., Fausto, N. 2005. Robbins and Cotran Pathologic Basis of Disease. 7th Ed. Philadelphia: Saunders. Malpica, A., Deavers, M.T., Lu, K., Bodurka, D.C., Atkinson, E.N., Gershenson, D., Asilva, E.G. 2004. Grading Ovarian Serous Carcinoma Using a Two-Tier System. Am J Surg Pathol, 28: 496-504. Omranipous, R., Abasahl, A. 2009. Ovarian Metastases in Colorectal Cancer. International Journal of Gynecological Cancer, 9: 123-137. Paley, P.J. 2001. Screening for The Major Malignancies Affecting Women: Current Guidelines. Am J Obstet Gynecol, 184:1021-30. Permuth-Whey, J., and Sellers, T.A. 2009. Epidemiology of Ovarian Cancer. Methode of Biology Molecular, 472: 413-437. Purbadi, S. 2006. Terapi Bertarget Molekul (Targeted Molecular Therapy). In: Aziz, M.F., Andrijono, Saifuddin, A.B., editors. Onkologi Ginekologi. 1st Ed. Jakarta: Yayasan Bina Pustaka Sarwono Prawirodihardjo, p. 387-98. Reese, D.M., Slamon, D.J. 1997. HER-2/neu Signal Transduction in Human Breast and Ovarian Cancer. Stem Cells, 15:1-8. Reeves, G.K. 2007. Cancer Incidence and Mortality in Relation to Body Mass Index in The Million Women Study : Cohort Study. (Online). Available from : http://www.bmj.com/content/335/7630/1134.abstrac [Accessed: 5th August 2010] Riman, T., Nilsson, S., Persson, I.R. 2004. Review of Epidemiological Evidence for Reproductive and Hormonal Factors in Relation to The Risk of Epithelial Ovarium Malignancies. Acta Obstet Gynecol Scand, 83: 783-95. Robbins, Cotran. 2010. Molecular Basis of Cancer. In: Robbins, Cotran. Pathologic Basis of Disease. 8th Ed. Philadelphia: Saunders. Rossa, J.S., Fletcher, J.A., Linette, G.P., Stec, J., Clark, E., Ayers, M. 2003. The HER-2/neu Gene and Protein in Breast Cancer 2003: Biomarker and Target of Therapy. The Oncologist, 8(4): 307-25. Santin, A.D. 2006. Role of Immunohistochemical Expression of HER2/neu in High-Grade Ovarian Serous Papillary Cancer. In: Hayat, M.A. editor. Handbook of Immunohistochemistry and in situ Hybridization of Human Carcinomas. London: Elsevier Academic Press, p. 333-338. Schorge, J.O., Schaffer, J.I., Halvorson, L.M., Hoffman, B.L., Bradshaw, K.D., Cunningham, F.G. 2008. Epithelial Ovarian Cancer, Ovarian Germ Cell and Sex Cord-Stromal Tumors. In: Schorge, J.O., Schaffer, J.I., Halvorson, L.M., Hoffman, B.L., Bradshaw, K.D., Cunningham, F.G. Williams Gynecology. Texas: The McGraw-Hill Companies Inc. Section 4, Chapter 35-36. Sasaki, N., Kudoh, K., Tsuda, H., Furuya, K., Kikuchi, Y. 2007. Effect of HER2/neu Overexpression on Chemoresistance and Prognosis in Ovarian Carcinoma. J Obstet Gynecol Res, 33(1): 17-23. Serrano-Olvera, A., Duenas-Gonzalez, A., Gallardo-Rincon, D., Candelaria, M., Garza-Salazar, J.D.I. 2006. Prognostic, Predictive and Therapeutic Implications of HER2 in Invasive Epithelial Ovarian Cancer. Elsevier Cancer Treatment reviews, 32:180-190. Simpkins, F., Zahurak, M. 2005. Ovarian Malignancy in Breast Cancer Patient with an Adnexal Mass. The American Collage of Obstetrical and Gynecologist, 105: 507-513. Sriwidnyani, N.P. 2008. Korelasi Ekspresi HER-2/neu dengan Tipe Histologik dan Derajat Diferensiasi Karsinoma Ovarium (tesis). Denpasar: Universitas Udayana. Stricker, T.P., Kumar,V. 2007. Neoplasia. In: Stricker, T.P., Kumar,V. Robbin Basic Pathology. 8th Ed. Philadelphia: Saunders Elsevier, p.173-208. Sudoyo, A.W. 2005. Onkogen. In: Sudoyo, A.W. The 8th Course and Workshop Basic Science in Oncology. Modul A putaran ke-3, Jakarta. Tvassoli, F.A. Devilee, P. 2003. Tumours of the Ovary and Peritoneum. Lyon: IARC Press, p.113-202. Voet, D., Voet, J.G. 1995. Biochemistry. 2nd Ed. Canada: John Willey and Sons, Inc. Wang, Y. Kristensen, G.B., Helland, A., Nesland, J.M., Borresen-Dale, A., Holm, R. 2005. Protein Expression and Prognostic Value of Genes in The erb-b Signaling Pathway in Advanced Ovarian Cancer. Am J Clin pathol, 124: 393-401. Wheeler, J.E. 2001. Histopathology of Ovarian Cancer. In: Rubin, S.C., Sutton, G.P. (editor). Ovarian Cancer. 2nd Ed. Philadelphia: Lippincott Williams & Wilkins. Lampiran 1. FormulirPenelitian PENELITIAN PERBEDAAN EKSPRESI HER-2/NEU PADA KANKER OVARIUM DERAJAT DIFERENSIASI BAIK, SEDANG, BURUK A IDENTITAS PASIEN Nama Umur Alamat NomorParafin Blok NomorRekamMedis B DATA KLINIS JumlahParitas DerajatdiferensiasiKankerOvarium RiwayatKontrasepsi RiwayatKeluargaKankerOvarium, MamedanKolon C PEMERIKSAAN HER 2/neu Skor IMUNOHISTOKIMIA Lampiran 2.Data Penelitian No Namapasien CM Umur diff intensitas % hasil Paritas rwykel mnp IMT KB HOR No Parafin 1 Suatiniwayan 01.44.62.10 50 IIIC negatif 0 - 2 tidak ya 18.9 tidak tidak 245/pp/2011 2 Surianininengah 01.44.94.40 34 IC negatif 0 - 2 tidak tidak 18.3 ya tidak 385/PP/2011 3 Mawe Ni wayan 01.45.18.86 48 IA negatif 0 - unmarried tidak tidak 21.2 tidak tidak 442/pp/2011 4 Gandrini made 01.45.44.57 59 IIIC negatif 0 - 3 tidak ya 22.0 tidak tidak 554/pp/2011 5 Nuryani 00.44.13.72 49 IIIC negatif 0 - 3 tidak ya 21.6 ya tidak 668/pp/2011 6 Yuliarminiketut 01.46.84.91 30 IIB negatif 0 - 1 tidak tidak 26.8 ya tidak 1151/pp/2011 7 Rumiati 01.46.67.88 40 IIIC negatif 0 - unmarried tidak tidak 29.6 tidak tidak 1246/pp/2011 8 Sabin ni made 01.44.95.40 64 IV negatif 0 - 3 tidak ya 17.3 tidak tidak 1306/pp/2011 9 Sri suartini 01.46.61.79 44 IC negatif 0 - 2 tidak tidak 20.0 tidak tidak 1391/pp/2011 10 Luhwiti 01.47.05.36 60 IV negatif 0 - 3 tidak ya 22.8 ya tidak 1460/pp/2011 11 Sari wiyani 01.38.48.90 48 III negatif 0 - 2 tidak tidak 19.4 ya tidak 1737/pp/2011 12 nurminahhusen 01.47.90.00 45 IIIC negatif 0 - 2 tidak ya 19.1 tidak tidak 1914/pp/2011 13 sitinuria 01.47.69.39 28 IIA negatif 0 - 2 tidak tidak 28.3 ya tidak 1992/pp/2011 14 Sukarini 01.47.21.38 44 IIIB kuat 90 + unmarried tidak tidak 21.2 tidak tidak 2024/pp/2011 15 widiastrini made 01.23.13.40 43 IV negatif 0 - 2 tidak tidak 23.8 tidak tidak 2139/pp/2011 16 nartininyoman 01.48.31.89 36 IIA negatif 0 - 2 tidak tidak 19.4 tidak tidak 2208/pp/2011 17 mertaninengah 01.49.25.03 50 IIC negatif 0 - 2 tidak ya 22.5 tidak tidak 2527/pp/2011 18 Latrinyoman 01.49.63.90 47 IIA negatif 0 - 0 tidak tidak 32.3 tidak tidak 2667/pp/2011 19 sudiasihkadek 01.46.20.82 37 IIIB negatif 0 - 3 tidak tidak 38.2 tidak tidak 2965/pp/2011 20 taluhwayan 01.52.30.28 61 IV negatif 0 - 2 tidak ya 26.8 tidak tidak 4335/pp/2011 21 rasmininiwayan 01.52.52.09 36 IC negatif 0 - 2 tidak tidak 18.9 tidak tidak 4474/pp/2011 22 sari nikt 01.48.35.96 48 IV negatif 0 - 2 tidak ya 23.5 ya tidak 4497/pp/2011 23 suwartinini made 01.50.80.92 39 IA negatif 0 - 1 tidak ya 20.5 ya tidak 175/pp/2012 24 tinggennikt 01.53.48.73 52 IIIC sedang 5 + 4 tidak ya 24.6 tidak tidak 263/pp/2012 25 surtinikeetut 01.53.50.97 55 IIC negatif 0 - 0 tidak ya 22.0 tidak tidak 0479/pp/2012 26 alit ruktininigusti 01.53.39.11 39 IC negatif 0 - 0 tidak tidak 18.2 tidak tidak 507/pp/2012 27 Nyemploniketut 01.53.95.99 67 IIA negatif 0 - 0 tidak ya 28.4 tidak tidak 721/pp/2012 28 komangseniwati 01.54.14.54 35 IIIC negatif 0 - 2 tidak tidak 23.3 tidak tidak 917/pp/2012 29 sontrininyoman 01.54.80.49 56 IIIA kuat 5 + 3 tidak ya 15.2 tidak tidak 1097/pp/2012 30 komangseniwati 01.55.67.92 44 IIC kuat 50 + 2 tidak tidak 23.3 tidak tidak pp0016912012 31 01.55.81.11 58 IIIC negatif 0 - 1 tidak ya 24.5 tidak tidak pp0017092012 32 niluhmurti putri sang ayu made 01.18.69.85 39 IIIC negatif 0 - 2 tidak tidak 15.5 tidak tidak pp0012852012 33 ernimutiara 01.55.43.48 48 IIIC kuat 90 + unmarried tidak tidak 23.8 tidak tidak pp0013212012 34 Nurzannah 01.55.04.87 63 IV negatif 0 - 4 tidak ya 17.7 tidak tidak pp0013242012 35 Ni made tirta 01.14.23.14 35 IIC sedang 30 + 0 tidak tidak 23.4 tidak tidak pp0013482012 36 made suparingsih 01.55.66.84 66 IV sedang 40 + 4 tidak ya 17.8 tidak tidak 554/pp/2012 37 wayantaluh 01.52.30.28 46 IIIC negatif 0 - 0 tidak tidak 20.0 tidak tidak 4335/pp/2011 38 Nyoman Sari 01.60.66.47 46 IA negatif 0 - 2 tidak tidak 22.2 tidak tidak 0022/pp/2013 39 Ni Made Nili 01.60.65.71 45 IIIC negatif 0 - 2 tidak tidak 19.8 tidak tidak 0154/pp/2013 40 Karmini 01.61.98.89 51 IIIC negatif 0 - 4 tidak tidak 20.4 tidak tidak pp/000829/2013 41 Mihin 01.61.89.00 50 IIIC negatif 0 - 4 tidak tidak 22.0 tidak tidak pp/0012462013 42 nikadekastini 01.55.59.01 44 IIIC negatif 0 - 3 tidak tidak 21.2 tidak tidak pp0014632013 43 No name tidakada 13 IIIC kuat 100 + unmarried tidak tidak 17.6 tidak tidak pp004202/pp/12 44 No name tidakada 48 IIIC negatif 0 2 tidak tidak 19,2 tidak tidak pp004103/pp/12 Lampiran 3.PerhitunganStatistik G * HER2 Crosstabulation Count HER2 positif G negatif Total grade buruk 8 10 18 grade sedang 4 10 14 grade baik 1 11 12 13 31 44 Total Chi-Square Tests Value df Asymp. Sig. (2-sided) Pearson Chi-Square 4.520a 2 .104 Likelihood Ratio 5.047 2 .080 Linear-by-Linear Association 4.396 1 .036 N of Valid Cases 44 a. 2 cells (33.3%) have expected count less than 5. The minimum expected count is 3.55. G * HER2 Crosstabulation Count HER2 positif G negatif Total grade sedang 4 10 14 grade baik 1 11 12 5 21 26 Total Chi-Square Tests Value Pearson Chi-Square Exact Sig. (2- Exact Sig. (1- (2-sided) sided) sided) df 1.704a 1 .192 .650 1 .420 1.821 1 .177 Continuity Correctionb Likelihood Ratio Asymp. Sig. Fisher's Exact Test Linear-by-Linear Association .330 1.638 N of Valid Casesb 1 .213 .201 26 a. 2 cells (50.0%) have expected count less than 5. The minimum expected count is 2.31. b. Computed only for a 2x2 table Risk Estimate 95% Confidence Interval Value Odds Ratio for G (grade sedang / grade Lower Upper 4.400 .418 46.261 For cohort HER2 = positif 3.429 .441 26.664 For cohort HER2 = negatif .779 .537 1.131 baik) N of Valid Cases 26 G * HER2 Crosstabulation Count HER2 positif G negatif Total grade buruk 8 10 18 grade baik 1 11 12 9 21 30 Total Chi-Square Tests Value Pearson Chi-Square Continuity Correction b Likelihood Ratio df Asymp. Sig. Exact Sig. (2- Exact Sig. (1- (2-sided) sided) sided) 4.471a 1 .034 2.917 1 .088 5.037 1 .025 Fisher's Exact Test Linear-by-Linear Association .049 4.322 N of Valid Casesb 1 .040 .038 30 a. 1 cells (25.0%) have expected count less than 5. The minimum expected count is 3.60. b. Computed only for a 2x2 table Risk Estimate 95% Confidence Interval Value Lower Upper Odds Ratio for G (grade buruk / grade baik) 8.800 .929 83.353 For cohort HER2 = positif 5.333 1.162 37.348 For cohort HER2 = negatif .606 .388 .948 N of Valid Cases 30 G * HER2 Crosstabulation Count HER2 positif G negatif Total grade buruk 8 10 18 grade sedang 4 10 14 12 20 32 Total Chi-Square Tests Value Pearson Chi-Square Continuity Correction b Likelihood Ratio df Asymp. Sig. Exact Sig. Exact Sig. (1- (2-sided) (2-sided) sided) .847a 1 .358 .305 1 .581 .858 1 .354 Fisher's Exact Test Linear-by-Linear Association N of Valid Casesb .471 .820 1 .292 .365 32 a. 0 cells (.0%) have expected count less than 5. The minimum expected count is 5.25. b. Computed only for a 2x2 table Risk Estimate 95% Confidence Interval Value Lower Upper Odds Ratio for G (grade buruk / grade sedang) 2.000 .452 8.841 For cohort HER2 = positif 1.556 .586 4.129 For cohort HER2 = negatif .778 .458 1.321 N of Valid Cases 32 Lampiran 4.HasilPemeriksaanImunohistokimia HER-2/neu Positif Negatif