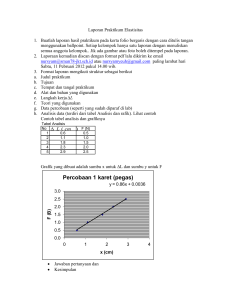
IbM Kelompok Tani Kopi di Desa Belatungan
advertisement

LAPORAN AKHIR PROGRAM IPTEKS BAGI MASYARAKAT (IbM) IbM KELOMPOK PENGELOLA LABORATORIUM KIMIA SMA OLEH Dr. I Dewa Ketut Sastrawidana, M.Si NIDN. 0017046804 Drs. I Wayan Suja, M.Si NIDN. 0020036701 Dibiayai oleh Direktorat Penelitian dan Pengabdian kepada Masyarakat Direktorat Jenderal Pendidikan Tinggi Kementerian Pendidikan dan Kebudayaan Sesuai dengan Surat Perjanjian Pelaksanaan Penugasan Program Pengabdian Kepada Masyarakat No.128/UN48.15/LPM/2015 LEMBAGA PENGABDIAN KEPADA MASYARAKAT UNIVERSITAS PENDIDIKAN GANESHA OKTOBER 2015 HALAMAN PENGESAHAN 1 Judul IbM : Kelompok Pengelola Laboratorium Kimia SMA 2 Unit Lembaga Pengusul : Universitas Pendidikan Ganesha 3 Ketua Tim Pelaksana Nama : Dr. I Dewa Ketut Sastrawidana, S.Si., M.Si NIDN : 0017046804 Jabatan/Golongan : Lektor Kepala/IVa Jurusan/ Fakultas : Pendidikan Kimia/MIPA Perguruan Tinggi : Universitas Pendidikan Ganesha Bidang Keahlian : Ilmu Lingkungan/Kimia Analitik Alamat Kantor/Telp. : Jl. Udayana 12 Singaraja/0362-25735 Alamat Rumah/Telp./E-mail : LC 8 Dusun Seraya-Desa BaktiseragaBuleleng/081236781968/[email protected] 4 Anggota Tim pelaksana Nama Anggota/Keahlian : Dosen 1 Orang : Drs. I Wayan Suja, M.Si/Kimia Organik 5 Rencana Belanja Total 6 Belanja Tahun Pertama Dikti Sumber Lain 7 Tahun Pelaksanaan : Rp. 45.000.000 : Rp. 45.000.000 :: 2015 Singaraja, 28 Oktober 2012 PRAKATA Puji syukur penulis panjatkan kehadapan Tuhan Yang Maha Esa/Ida Sang Hyang Widhi Wasa atas segala rahmat dan karunia-Nya sehingga kami dapat melaksanakan program pengabdian masyarakat skim Ipteks bagi Masyarakat dan menyusun laporannya sesuai dengan batas waktu yang telah ditetapkan. Pengabdian kepada masyarakat tentang pengelolaan laboratorium kimia SMA menjadi salah satu unsur penting dalam menunjang keberhasilan pembelajaran terlebih pembelajaran kimia yang menekankan aspek proses dan produk. Proses pembelajaran kimia sangat banyak dilakukan melalui praktikum di Laboratorium. Untuk itu, pengelolaan laboratorium yang ditujukan untuk menjadikan laboratorium siap digunakan untuk praktikum menjadi aspek yang penting diperhatikan. Melalui program Pengabdian Kepada Masyarakat skim IbM yang berjudul kelompok pengelola laboratorium kimia SMA, kami telah melakukan beberapa kegiatan diantaranya melakukan pelatihan kepada guru untuk berinovasi membuat peralatan praktikum kimia sederhana, menggunakan berbagai bahan alternatif alami untuk keperluan praktikum, membuat buku penuntun dan LKS praktikum kimia sederhana. Program ini, diharapkan dapat membantu kelancaran pelaksanaan praktikum kimia terutama bagi sekolah-sekolah yang jauh dari perkotaan yang pada umumnya memiliki sarana laboratorium yang sangat terbatas. Dalam pelaksanaan pengabdian kepada masyarakat ini, pelaksana program telah banyak mendapatkan dukungan baik berupa dana maupun moril dari berbagai pihak. Untuk itu, melalui kesempatan ini kami sampaikan terimakasih yang sebesar-besarnya kepada: 1. Direktur Penelitian dan Pengabdian kepada Masyarakat, Direktorat Penelitian dan Pengabdian kepada Masyarakat, Direktorat Jendral Pendidikan Tinggi, Kemeterian Riset Teknologi dan Pendidikan Tinggi, selaku pemberi dana pada program ini. 2. Ketua Lembaga Pengabdian kepada Masyarakat Universitas Pendidikan Ganesha dan Staf atas pembinaan dan layanan administrasi dalam pelaksanaan IbM ini. 3. Kepada kepala sekolah SMA Negeri Sukasada dan SMA Negeri 2 Busungbiu beserta stafnya atas partisifasi aktifnya mendukung kelancaran program. 4. Pihak-pihak lain yang tidak dapat kami sebutkan satu persatu atas berbagai bantuan dan kerjasamanya. Kami menyadari, untuk mewujudkan peran laboratorium yang efektif dan efisien dalam menunjang pembelajaran kimia di sekolah masih banyak kendala. Untuk itu, saransaran yang konstruktif masih sangat diperlukan sehingga pelaksanaan praktikum bisa dijalankan secara optimal. Akhir kata semoga laporan ini bermanfaat bagi pembaca. Singaraja, 28 Oktober 2015 Tim Pelaksana program, DAFTAR ISI LEMBAR PENGESAHAN PRAKATA DAFTAR ISI Halaman BAB I BAB II BAB III BAB IV BAB V BAB VI PENDAHULUAN 1.1 Analisis Situasi .............................................................................. 1.2 Permasalahan Mitra........................................................................ 1.3 Solusi yang Ditawarkan................................................................. 1 4 4 TARGET DAN LUARAN 2.1 Rencana Kegiatan.......................................................................... 2.2 Luaran............................................................................................. 5 5 METODE PELAKSANAAN KEGIATAN 3.1 Metode Pemecahan Masalah......................................................... 6 KELAYAKAN PERGURUAN TINGGI 4.1 Kinerja LPM Dalam Pengabdian Kepada Masyarakat.................. HASIL KEGIATAN 5.1 Topik-Topik Praktikum Kimia SMA............................................. 5.2 Peralatan dan Bahan Praktikum Kimia SMA................................ 5.3 Buku Penuntun dan LKS Praktikum Kimia SMA 5.4 Uji Coba Praktikum Kimia SMA 8 10 10 13 15 SIMPULAN DAN SARAN 6.1 Simpulan ........................................................................................ 6.2 Saran .............................................................................................. 18 18 DAFTAR PUSTAKA 19 Lampiran: 1. Lampiran 1. Dokumentasi kegiatan 2. Lampiran 2. LKS Praktikum Kimia 3. Lampiran 3. Buku Penuntun Praktikum Kimia 20 25 69 DAFTAR TABEL 1 2 3 Halaman Tahapan Rencana Kegiatan dan Target Luaran yang Dihasilkan...................... 5 Rencana Pemecahan Masalah 6 Topik Praktikum pada Buku Penuntun Praktikum Kimia SMA ...................... 14 DAFTAR GAMBAR 1 2 3 4 5 6 7 8 9 10 11 Halaman Laboratorium Kimia di SMAN 1 Sukasada................................................... 2 Peralatan praktikum yang dimiliki oleh SMAN 1 Sukasada......................... 2 Ruang Laboratorium Kimia di SMAN 2 Busungbiu..................................... 3 Rencana Pemecahan Masalah……………………………………………… 6 Pelaksanaan Pengabdian Kepada Masyarakat LPM Undiksha 2008-2014.... 8 Bantuan Peralatan ke Sekolah Mitra melalui Pembelian............................... 11 Peralatan yang di Buat oleh Guru Mitra Program......................................... 11 Bahan Alami Pengganti Bahan Kimia Sintetik Praktikum Kimia SMA....... 12 Bantuan Bahan Kimia Ke Sekolah Mitra...................................................... 13 Pelatihan Penyusunan LKS Praktikum Kimia SMA...................................... 14 Ujicoba Peralatan Praktikum Kimia............................................................... 15 DAFTAR LAMPIRAN 1 2 3 Dokumentasi Kegiatan Lembar kerja Siswa Praktikum Kimia SMA Buku Penuntun Praktikum Kimia SMA Halaman 20 25 69 BAB I. PENDAHULUAN 1.1 Analisis Situasi Pembelajaran kimia mengembangkan ranah kognitif, afektif dan psikomotor secara simultan. Untuk mengembangkan ranah afektif dan psikomotor tidak cukup hanya mengandalkan pembelajaran di kelas saja tetapi memerlukan pengamatan langsung di laboratorium. Laboratorium kimia menjadi suatu kebutuhan untuk memaksimalkan proses pembelajaran. Menurut Permendiknas RI No. 24 tahun 2007 tentang standar sarana dan prasarana disebutkan bahwa laboratorium sebagai tempat berlangsungnya pembelajaran praktek harus didukung dengan peralatan yang memadai. Namun pada kenyataannya, pemanfaatan laboratorium di beberapa sekolah masih sangat kurang karena keterbatasan peralatan laboratorium dan pengelolaan laboratorium belum maksimal. SMA Negeri 1 Sukasada dan SMA Negeri 2 Busungbiu yang rencananya menjadi mitra program IbM ini merupakan dua sekolah katagori baru berdiri di Kabupaten Buleleng. Berdasarkan profil sekolah tahun 2013, kedua sekolah ini sama-sama berdiri pada tahun 2002, dimana SMA Negeri 1 Sukasada berlokasi di Desa Sukasada kecamatan Sukasada sekitar 7 km dari kampus Undiksha sedangkan SMAN 2 Busungbiu berlokasi di Desa Pucak Sari Kecamatan Busungbiu sekitar 60 km dari kota Singaraja. SMAN Negeri 1 Sukasada sampai saat ini memiliki 14 ruang kelas, sebuah perpustakaan serta ruangan laboratorium yaitu laboratorium fisika, biologi, kimia, bahasa, dan laboratorium komputer. Siswa di sekolah ini pada umumnya berasal dari desa Sukasada dan sekitarnya dengan kondisi sosial ekonominya tergolong rendah sampai sedang. Secara umum, proses belajar mengajar bidang kimia masih mengalami masalah yang disebabkan oleh motivasi belajar siswa relatif rendah dan minimnya sarana laboratorium kimia. Keberadaan laboratorium kimia di SMA ini masih sangat terbatas dan kurang terkelola. Hal ini terekam dari informasi koordinator pengelola laboratorium kimia pada saat tim pengusul program melakukan observasi langsung ke sekolah disebutkan bahwa kondisi laboratorium tampak kosong, sementara di ruang penyimpanan alat dan bahan hanya tersedia sangat sedikit peralatan dan bahan kimia untuk praktikum yang kondisinya kurang terawat (Gambar 1). 1 (a) (b) (Dok. Sastrawidana, 2014) Gambar 1. Laboratorium Kimia di SMAN 1 Sukasada (a) ruang praktikum, (b) ruang penyimpanan alat Informasi dari guru-guru kimia yang sekaligus anggota pengelola laboratorium menyebutkan bahwa secara teoritis materi kimia dari kelas X sampai kelas XII terdapat 23 kompetensi dasar yang seharusnya memanfaatkan laboratorium dalam proses pembelajaran. Namun, pada kenyataannya hanya sedikit praktikum yang bisa dilakukan seperti untuk di kelas X hanya praktikum tentang sifat larutan elektrolit dan elektrolit, kelas XI tentang laju reaksi, sifat asam-basa, titrasi asam-basa sedangkan pada kelas XII sama sekali praktikum tidak bisa berlangsung. Dari sejumlah praktikum, dilakukan melalui demo atau siswa terbagi dalam kelompok besar karena jumlah alat yang tersedia sangat sedikit. Sebagai contoh, dilaboratorium hanya tersedia 2 set alat penentuan sifat larutan elektrolit dan non elektrolit, 1 buah buret dan beberapa tabung reaksi untuk praktikum lainnya (Gambar 2). (a) (b) (Dok. Sastrawidana, 2014) Gambar 2. Peralatan praktikum yang dimiliki oleh SMAN 1 Sukasada (a) peralatan penentuan larutan elektrolit dan nonelektrolit, (b) peralatan digunakan dalam praktikum laju reaksi, titrasi dan kepolaran senyawa. 2 Kondisi yang tidak jauh berbeda juga dialami oleh SMA Negeri 2 Busungbiu yang terletak sangat jauh dari pusat kota yaitu di lereng bukit Kutul di desa Pucaksari, Kecamatan Busungbiu. SMA memiliki 9 kelas, sebuah perpustakaan, dan beberapa leboratorium, yaitu lab fisika, lab komputer, dan laboratorium kimia-biologi yang digabung menjadi satu. Laboratorium kimia terbagi menjadi dua bagian yaitu ruang praktikum dan ruang penyimpanan alat dan bahan (Gambar 3). Ruangan untuk penyimpanan alat dan bahan tampak belum sesuai dengan pungsinya akan tetapi menjadi tempat meletakkan kertas-kertas. Informasi dari Ibu Casmini, yaitu guru kimia sekaligus ketua pengelola laboratorium kimia menyebutkan peralatan laboratorium kimia yang ada di Lab. SMA N 2 Busungbiu sangat kurang dan sejak berdiri tahun 2002 sampai sekarang ini belum ada penambahan peralatan dan bahan praktikum. Sekolah nampaknya lebih memprioritaskan pada pengadaan sarana teknologi informasi dan komunikasi, seperti komputer, laptop, LCD, fasilitas internet dibandingkan dengan peralatan dan bahan untuk praktikum. Kondisi laboratorium yang kurang alat dan bahan diikuti pengadministrasian tidak baik membuat kegiatan praktikum di sekolah ini praktis tidak terlaksana. (a) (b) (Dok. Sastrawidana, 2014) Gambar 3. Ruang laboratorium kimia di SMAN 2 Busungbiu (a) Ruang tempat praktikum, (b) ruang penyimpanan alat dan bahan Berdasarkan analisis situasi di kedua sekolah ini, tim pengusul IbM mencoba mengidentifikasi permasalahan yang dihadapi mitra program dan menggali keinginan para guru kimia serta menawarkan beberapa solusi alternatif agar guru-guru kimia di sekolah mitra bisa menyelenggarakan pembelajaran dengan menyasar kompetensi kognitif, afektif dan psikomotor secara proporsional. Hasil wawancara yang dilakukan oleh tim pengusul ke 3 mitra terungkap beberapa keluhan dari guru kimia pengelola laboratorium di kedua sekolah ini diantaranya, (1) kurang tersedianya alat dan bahan kimia untuk mendukung pelajaran praktikum di laboratorium karena sekolah belum adanya dana untuk pengadaan, (2) Kurangnya pengetahuan dan inovasi dari guru-guru kimia untuk menciptakan peralatan sederhana untuk mendukung legiatan praktikum, (3) Penataan alat dan bahan yang tersedia belum terkelola dengan baik, dan (3) Belum adanya laboran khusus yang ditugaskan untuk menata laboratorium. 1.2 Permasalah Mitra Permasalahan utama yang dihadapi mitra diantaranya (1) Kurangnya dana yang dialokasikan sekolah untuk pengadaan alat dan bahan untuk laboratorium kimia (2) kurangnya pengetahuan guru-guru pengelola laboratorium kimia untuk berinovasi dalam pembuatan peralatan praktikum kimia sederhana, dan (3) kurangnya penataan sarana laboratorium. 1.3 Solusi yang Ditawarkan Berdasarkan permasalah pokok dihadapi oleh mitra program, maka beberapa solusi yang ditawarkan oleh tim pengusul program IbM dan telah disepakati oleh mitra yaitu. 1) Pemecahan terhadap masalah kurangnya ketersediaan peralatan serta tidak adanya alokasi dana untuk pengadaan peralatan laboratorium kimia dilakukan melalui kegiatan pelatihan para guru kimia mitra program untuk membuat peralatan praktikum kimia sederhana dengan memanfaatkan bahan-bahan disekitar kita. 2) Pemecahan masalah terhadap minimnya ketersediaan bahan kimia dilakukan upaya peningkatan pengetahuan guru kimia tentang pemanfaatan lingkungan dalam praktikum kimia melalui ceramah, diskusi dan informasi dan pemberian bantuan beberapa bahan kimia yang diperlukan dalam praktikum. 3) Permasalahan terhadap kurangnya pengetahuan dan pemahaman guru dalam pembuatan peralatan praktikum kimia sederhana dilakukan pelatihan pembuatan peralatan praktikum kimia. 4) Permasalahan terhadap kurang tertatanya pengelolaan peralatan dan bahan di laboratorium dilakukan dengan ceramah dan diskusi tentang kiat-kiat pengelolaan laboratorium. Dalam kegiatan ini, guru juga dilatih membuat buku penuntun praktikum kimia sederhana dengan memanfaatkan peralatan yang dibuat. 4 BAB II. TARGET DAN LUARAN 2.1 Rencana Kegiatan Kegiatan program IbM kelompok pengelola laboratorium kimia direncanakan berlangsung selama 8 bulan. Pemecahan masalah yang dihadapi oleh kedua mitra sekolah diatasi melalui pelatihan, pemberian bantuan bahan-bahan kimia praktikum, diskusi dan informasi tentang pemanfaatan lingkungan sekolah untuk mendukung pelaksanaan praktikum, kunjungan laboratorium, penyusunan buku penuntun praktikum dan penataan administrasi laboratorium kimia. 2.2 Luaran yang Ditargetkan Luaran yang ditargetkan adalah menghasilkan peralatan praktikum kimia sederhana yang digunakan untuk menunjang kelancaran praktikum di sekolah mitra. Disamping itu, dihasilkannya naskah publikasi yang diterbitkan pada jurnal ilmiah nasional. Secara garis besar luaran dari kegiatan pengabdian masyarakat IbM ini disajikan pada Tabel 1 berikut. Tabel 1. Tahapan rencana kegiatan dan target luaran yang dihasilkan No Kegiatan 1 Identifikasi topik-topik praktikum kimia yang diselenggarakan di SMA berpedoman pada kurikulum 2013. Konsultasi dan diskusi tentang model peralatan praktikum yang dibuat dalam pelatihan Pelatihan pembuatan peralatan praktikum 2 3 4 5 6 Hasil yang ditargetkan Ditetapkannya topik-topik praktikum mata pelajaran kimia dari kelas X sampai XII Guru memiliki pengetahuan dan wawasan tentang model peralatan yang akan dibuat dalam pelatihan Setiap guru mitra mampu merancang peralatan praktikum kimia sederhana kimia sederhana sesuai dengan materi pelajaran Menyusun buku penuntun praktikum Setiap guru mitra menyusun topiktopik praktikum kimia beserta kimia prosedur kerja sesuai peralatan yang telah buat. Guru mempunyai LKS praktikum Menyusun LKS praktikum kimia kimia yang digunakan dalam pembelajaran Pemberian bantuan bahan-bahan kimia Tersedianya bahan-bahan kimia yang digunakan untuk praktikum yang digunakan untuk praktikum 5 BAB III. METODE PELAKSANAAN KEGIATAN 3.1 Metode Pemecahan Masalah Permasalahan utama yang dihadapi mitra adalah pelaksanaan praktikum kimia disekolah sangat kurang. Pembelajaran kimia pada dasarnya menekankan pada aspek kognitif, afektif dan psikomotor. Ketidakseimbangan penekanan pembelajaran kimia membuat siswa merasa sangat sulit memahami konsep kimia yang bersifat abstrak. Kondisi ini menyebabkan nilai kimia di kedua sekolah ini relatif rendah, dan motivasi belajar kimia juga kurang. Metode yang telah disepakati antara tim pengusul program dengan mitra program untuk memecahkan permasalahan disajikan pada Tabel 2. Tabel 2. Rencana Pemecahan Masalah Permasalahan Akar masalah Metode Pemecahan yang direncanakan 1. Belum tersedianya 1. Dana yang dikelola Memberikan peralatan dan bahan oleh sekolah sangat pengetahuan tentang kimia untuk terbatas dan sekolah pemanfaatan lingkungan melakukan praktikum lebih memprioritaskan dalam menunjang kimia pada pengadaan sarana praktikum teknologi informasi Membelikan peralatan dan komunikasi, gelas untuk mendukung seperti komputer, kelancaran praktikum laptop, LCD, fasilitas internet Membelikan bahanbahan kimia pokok mendukung kelancaran praktikum 2. Guru belum 2. Guru jarang mengenal mempunyai peralatan praktikum pengetahuan yang dan belum punya cukup pembuatan keterampilan membuat keterampilan tentang peralatan praktikum peralatan praktikum pembuatan dan kimia Memberikan pelatihan penggunaan alat-alat 6 3. Tidak tersedianya 3. Kurangnya waktu bagi praktikum kimia . penuntun praktikum guru mitra untuk dan LKS penunjang menyusun penuntun praktikum kimia praktikum dan LKS menyusun buku praktikum kimia SMA penuntun praktikum 4. Guru kurang Melatih guru-guru untuk Melatih guru untuk berpengalaman dalam menyusun LKS menyusun LKS praktikum kimia dengan memanfaatkan sederhana dengan lingkungan sebagai memanfaatkan bahan- pendukung praktikum bahan serta peralatan kimia sederhana yang sederhana 7 BAB IV. KELAYAKAN PERGURUAN TINGGI 4.1 Kinerja LPM Dalam Pengabdian Kepada Masyarakat Lembaga Pengabdian Pada Masyarakat (LPM) Universitas Pendidikan Ganesha memiliki komitmen yang tinggi untuk menjalin hubungan yang sinergi dengan lingkungan masyarakat. Peran Undiksha menjalin mitra dengan masyarakat melalui pengabdian masyarakat baik pada bidang pendidikan maupun non kependidikan. Dalam 7 tahun terakhir yaitu dari tahun 2008 sampai tahun 2014, jumlah pelaksanaan Pengabdian Kepada Masyarakat yang dilakukan oleh dosen dan tenaga fungsional lainnya dikalangan Undiksha sebanyak 582 kegiatan dengan rincian pelaksanaan pertahunnya dapat dilihat pada Gambar 4. 140 Jumlah P2M 120 100 80 60 40 20 0 2008 2009 2010 2011 2012 2013 2014 Tahun Gambar 4. Pelaksanaan pengabdian kepada masyarakat yang dilakukan oleh LPM Universitas Pendidikan Ganesha tahun 2008-2014 Pelaksanaan program pengabdian pada masyarakat yang dilakukan oleh LPM bersumber dari dana DIPA Undiksha, kerjasama dengan Pemda dan dari dana DIKTI. Berdasarkan data pada Gambar 5 di atas, dari 582 P2M yang dilakukan oleh LPM Undiksha sebanyak 401 kegiatan dibiayai dari dana DIPA Undiksha, 1 kegiatan 8 kerjasama dengan Pemda dan 180 kegiatan didanai dari Dikti. Pelaksanaan program P2M yang didanai oleh Dikti diantaranya adalah Hi-Link, IbIKK, IbK, IbM, IbPE, IbW, KKN-PPM dan PMPMP. Beberapa kegiatan yang telah dilakukan oleh ketua tim pengusul sebagai penunjang kinerja LPM dibagi menjadi dua bidang yaitu bidang pendidikan dan non kependidikan. Kegiatan bidang pendidikan diantaranya (1) Pelatihan penelitian tidakan kelas untuk meningkatkan profesionalisme guru SD dan SMP di Kecamatan Buleleng (2010), Pelatihan penerapan strategi pemecahan masalah dan penyegaran materi menuju olimpiade Fisika bagi guru SMP Di Kabupaten Tabanan(2011), Pelatihan guru SMP dan SMA pembina ekstrakulikuler elektronika di Kecamatan Buleleng dan Sukasada untuk meningkatkan keterampilan guru pembina ekstrakulikuler elektronika(2013). Kegiatan pengabdian masyarakat di bidang non kependidikan diantaranya (1) Peningkatan pengetahuan sanitasi dan konsep sehat para pengrajin jamu gendong di Kelurahan Kampung Bugis Kecamatan Buleleng sebagai Upaya Hidup Sehat (2014), dan IbM Perajin Tahu dan Tempe (2014) 9 BAB V. HASIL KEGIATAN Pelaksanaan Program pengabdian kepada masyarakat skim IbM kelompok pengelola laboratorium kimia SMA ini berlangsung selama 8 bulan dengan rincian kegiatan meliputi pelatihan pembuatan peralatan praktikum kimia, penyusunan LKS praktikum kimia, Penyusunan buku penuntun praktikum, pemberian bantuan peralatan dan bahan-bahan kimia. 5.1 Identifikasi Topik-Topik Praktikum Pada tahap awal kegiatan program ini, tim pelaksana kegiatan melakukan identifikasi terhadap pokok bahasan yang ada di mata pelajaran kimia SMA dari kelas X sampai kelas XII berdasarkan kurikulum 2013. Hasil identifikasi terhadap materi kimia yang mempersyaratkan praktikum sebanyak 13 mata acara praktikum yang terdiri dari di kelas X terdapat 3 mata acara praktikum, kelas XI terdiri dari 8 mata acara praktikum dan kelas XII 2 mata acara praktikum. Dari sejumlah mata acara praktikum tersebut, selanjutnya dilakukan kordinasi terhadap guru-guru kimia di kedua sekolah yaitu di SMA Negeri Sukasada dan SMA Negeri 2 Busungbiu. Hasil dari diskusi tersebut, dengan berpedoman pada kurikulum 2013 beberapa mata acara praktikum yang telah disepakati untuk dibuat diantaranya (1) identifikasi kepolaran senyawa, (2) reaksi redoks, (3) larutan elektrolit dan non elektrolit, (4) reaksi eksoterm dan endoterm, (5) penentuan panas reaksi menggunakan kalorimeter sederhana, (6) kesetimbangan kimia, (7) laju reaksi (8) titrasi asam-basa, (9) sifat koligatif larutan, dan (10) elektrolisis. (LKS praktikum terlampir). 5.2 Peralatan dan Bahan Praktikum Kimia SMA 5.2.1 Peralatan Praktikum Kimia SMA Berdasarkan topik praktikum yang disepakati untuk dilakukan, selanjutnya merancang peralatan yang diperlukan untuk menunjang pelaksanaan peraktikum. Diskusi dengan guru kimia di kedua sekolah mitra, pengadaan peralatan dilakukan dengan dua cara, yaitu membuat peralatan dengan menggunakan bahan-bahan yang mudah dicari dan harganya relatif murah serta pengadaan dengan membelikan peralatan seperti neraca digital, penyangga asbes, buret, termometer, ball filler, batang pengaduk, pipet tetes, dan kalorimeter. 10 (a) Neraca digital (b) penyangga asbes (c) kalorimeter Gambar 6. Bantuan Peralatan ke Sekolah Mitra melalui Pembelian (a) alat uji larutan elektrolit dan non elektrolit (b) alat elektrolisis model Hopmant Gambar 7. Peralatan yang di Buat oleh Guru Mitra Program Pada Gambar 7, diperlihatkan peralatan praktikum yang dibuat untuk digunakan dalam praktikum diantaranya, alat untuk mengidentifikasi larutan elektrolit dan non elektrolit berdasarkan daya hantar, serta elektrolisis hopmant (peralatan elektrolisis yang bisa mengukur volume gas yang terbentuk pada masing-masing elektroda). 11 5.2.2 Bahan Praktikum Kimia SMA Berdasarkan topik-topik praktikum yang dirancang bersama guru mitra, selanjutnya dipersiapkan bahan-bahan kimia yang nantinya digunakan dalam praktikum di laboratorium. Pengadaan bahan praktikum juga dilakukan dengan dua cara yaitu (1) menggantikan bahan kimia sintetik dengan bahan kimia alami pada topik-topik praktikum tertentu, dan (2) membelikan bahan kimia di toko bahan kimia Brata chem. di Denpasar. Banyak praktikum-praktikum kimia SMA dapat menggunakan bahanbahan alami sebagai pengganti bahan kimia sintetik di laboratorium. Beberapa diantaranya (1) pada topik identifikasi larutan elektrolit dan nonelektrolit dapat menggunakan larutan uji berupa larutan garam dapur, larutan cuka, larutan urea, larutan gula dan air sabun. (2) pada topik laju reaksi (kinetika reaksi), untuk mempelajari luas permukaan dan konsentrasi terhadap laju reaksi dapat menggunakan kulit telur berbagai ukuran (serbuk, kecil dan sedang) direaksikan dengan HCl, untuk mempelajari pengaruh suhu terhadap laju reaksi, dapat dilakukan dengan pelarutan vitamin C (CDR) dengan menggunakan air dingin, air suhu normal dan air panas.(3) pada topik titrasi asam basa, dilakukan dengan menggunakan titrasi cuka pengganti HCl dengan larutan NaOH, (4) pada topik identifikasi asam-basa dapat menggunakan ekstrak kulit ketela ungu sebagai indikator, (5) Pada topik reaksi eksoterm dan endoterm dapat menggunakan larutan detergen dan urea. (a) kulit telur (c) cuka (b) vitamin C Gambar 8. Bahan Alami Pengganti Bahan Kimia Sintetik Praktikum Kimia SMA 12 Topik-topik praktikum tertentu yang mana bahan kimia yang diperlukan belum bisa digantikan dengan alami diupayakan melalui pembelian. Beberapa bahan kimia yang dibeli melalui program ini diantaranya Natrium karbonat (Na2CO3), Soda kue (NaHCO3), Feriklorida, Alkohol 96%, Spritus, Kloroform, asam asetat, Natrium hidroksida, Natrium klorida, Tembaga sulfat dan HCl. (a) di SMA Negeri Sukasada (b) di SMA N 2 Busungbiu Gambar 9. Bantuan Bahan Kimia Ke Sekolah Mitra 5.3 Lembar Kerja Siswa dan Buku Penuntun Praktikum Kimia SMA 5.3.1 Lembar Kerja Siswa Praktikum Kimia Penyusunan lembar kerja siswa (LKS) pada praktikum kimia pada mulanya disusun tim pelaksana kegiatan bersama guru-guru kimia di SMA Negeri Sukasada. Draf LKS tersebut selanjutnya disempurnakan kembali oleh tim pelaksana bersama guru kimia di SMA negeri 2 Busungbiu. Hasil diskusi dan pelatihan penyusunan LKS praktikum dapat diselesaikan sebanyak 12 LKS praktikum kimia SMA. Topik-topik praktikum yang disusun dalam bentuk LKS praktikum melalui kegiatan pelatihan adalah sebanyak 10 LKS praktiku (Tabel 3) sedangkan isi LKS praktikum kimia selengkapnya disajikan pada Lampiran 2. 13 Gambar 10. Pelatihan Penyusunan LKS Praktikum Kimia SMA Tabel 3. Topik Praktikum pada Buku Penuntun Praktikum Kimia SMA No Materi Buku Penuntun Praktikum Kimia SMA 1 Kepolaran Senyawa 2 Reaksi Redoks 3 Larutan elektrolit dan non-elektrolit 4 Faktor-Faktor Mempengaruhi Laju Reaksi 5 Pergeseran Kestimbangan Kimia 6 Penentuan panas reaksi menggunakan kalorimeter sederhana 7 Reaksi Endoterm dan Eksoterm 8 Titrasi Asam Basa 9 Kenaikan Titik Didih dan Penurunan Titik Beku Larutan 10 Elektrolisis larutan 5.3.2 Buku Penuntun Praktikum Kimia Di kedua sekolah mitra sampai saat ini belum memiliki buku penuntun praktikum kimia dijadikan sebagai buku pegangan. Buku penuntun praktikum sangat penting untuk digunakan sebagai petunjuk kerja bagi guru-guru dalam melaksanakan praktikum di laboratorium. Untuk itu, melalui program IbM ini, guru-guru kimia di kedua sekolah mitra dilatih untuk menyusun buku penuntun praktikum kimia. Buku penuntun 14 praktikum kimia berisikan 12 mata acara praktikum dari kelas X sampai kelas XII. Isi buku penuntun praktikum kimia selengkapnya disajikan pada Lampiran 3. 5.4 Uji Coba Peralatan Praktikum Kimia SMA Dari peralatan yang disusn, beberapa sudah diujicobakan di Laboratorium Jurusan Pendidikan Kimia dengan melibatkan mahasiswa jurusan pendidikan kimia. Gambar 11. Ujicoba Peralatan Praktikum Kimia 15 Beberapa peralatan kimia sederhana yang telah dibuat oleh guru-guru kimia juga telah diujicobakan di laboratoriumnya. Hal ini ditujukan untuk lebih meyakinkan bahwa peralatan yang dibuat bisa digunakan dalam praktikum kimia di sekolah. Gambar 12. Uji Coba Praktikum Penentuan Kepolaran Senyawa Gambar 13. Uji Coba Praktikum Daya Hantar Listrik Larutan 16 Gambar 14. Uji Coba Praktikum Titrasi Asam-Basa Gambar 15. Uji Coba Praktikum Kalorimetri 17 BAB VI. SIMPULAN DAN SARAN 6.1 Simpulan Berdasarkan hasil pelaksanaan program pengabdian masyarakat skim IbM tentang pengelola laboratorium kimia SMA di sekolah mitra dapat disimpulkan sebagai berikut. 1. Melalui kegiatan pelatihan pembuatan peralatan praktikum kimia SMA, guru-guru kimia di SMA Negeri Sukasada dan SMA Negeri 2 Busungbiu dapat mengurangi kesulitan terhadap keterbatasan kesediaan peralatan praktikum. 2. Melalui pemberian bantuan bahan kimia dan sosialisasi pemanfaatan bahan alami dalam praktikum, guru-guru kimia di sekolah mitra menjadi lebih termotivasi dalam melakukan praktikum. 3. Pelatihan penyusunan lembar kerja siswa praktikum kimia SMA terhadap guru kimia di sekolah SMA negeri Sukasada dan SMA Negeri 2 Busungbiu telah dihasilkan sebanyak 10 LKS praktikum yang siap digunakan dalam pembelajaran praktikum. 4. Pelatihan penyusunan buku penuntun praktikum bagi guru kimia di sekolah mitra telah memberikan pengalaman bagi guru untuk menyusun penuntun praktikum dan menjadi dokumen yang penting sebagai acuan dalam melakukan praktikum di laboratorium 6.2 Saran Pelaksanaan praktikum di beberapa sekolah SMA masih mengalami hambatan karena disebabkan oleh berbagai faktor, diantaranya tidak tersedianya laboran khusus yang mempreparasi kegiatan praktikum dan belum tersedianya buku penuntun praktikum. Hal ini menyebabkan waktu pelaksanaan praktikum menjadi sangat singkat dan pelaksanaan praktikum menjadi kurang terstruktur. Untuk itu, perlu diupayakan di setiap sekolah disediakan minimal satu tenaga laboran yang berperan melakukan pengelolaan laboratorium serta disetiap laboratorium dilengkapi dengan buku penuntun praktikum sebagai panduan dalam melaksanakan pembelajaran di laboratorium. 18 DAFTAR PUSTAKA Asep Kadarohman. 2007. Managemen Laboratorium IPA. Departemen Agama Republik Indonesia Djupri Padmawinata, Habiburrahman, Rangke L. Tobing, arosa Purwadi, S. Dirjosoemarto,Iswojo PIA. 1983. Pengelolaan Laboratorium IPA. Jakarta: Departemen Pendidikan dan Kebudayaan Peraturan Menteri Pendidikan dan Kebudayaan Republik Indonesia Nomo3 103. 2014 Tentang Pembelajaran pada pendidikan dasar dan Menegah Peraturan Menteri Pendidikan Nasional Republik Indonesia Nomor 24 Tahun 2007. Sistem Pendidikan Nasional. Permendiknas. No. 24 tahun 2007. Permendiknas Nomor 41 Tahun 2007 Tentang Standar Proses. 19 Lampiran 1. Dukumentasi Kegiatan dalam Pengabdian Kepada Masyarakat Skim IbM Kelompok Pengelola Laboratorium. Percobaan kepolaran senyawa Guru melakukan pengujian penimbangan terhadap neraca digital yang diberikan oleh Tim pelaksana program 20 Uji Coba peralatan uji daya hantar larutan elektrolit Diskusi penyusunan lember kerja siswa praktikum kimia 21 Diskusi penyusunan lember kerja siswa praktikum kimia Diskusi penyusunan lember kerja siswa praktikum kimia 22 Monitoring internal kegiatan oleh ketua LPM Undiksha Guru merangkai peralatan elektrolisis dan menelaah buku penuntun praktikum 23 Guru praktek membuat peralatan daya hantar listrik Guru mengecek bahan kimia yang diberikan oleh Tim pelaksana kegiatan 24 Lampiran 2. Lembar Kerja Siswa Praktikum Kimia Lembar Kerja Siswa (1) Kelompok : Anggota : 25 KEPOLARAN SENYAWA “Identifikasi Kepolaran suatu Senyawa Berdasarkan Interaksinya dengan Medan Magnet dan Kelarutan Dalam Air” KOMPETENSI DASAR : Merancang, melakukan, dan menyimpulkan serta menyajikan hasil percobaan kepolaran senyawa. I. Tujuan Percobaan Melalui percobaan siswa diharapkan dapat : 1. Membedakan senyawa polar dan non polar siswa 2. Merancang dan melakukan percobaan serta menyajikan hasil percobaan dalam bentuk laporan II. Dasar Teori Perbedaan keelektronegatifan dua atom menimbulkan kepolaran molekul. Adanya perbedaan keelektroegatifan tersebut menyebabkan pasangan elektron ikatan lebih tertarik ke salah satu unsur sehingga membentuk dipol. Adanya dipol inilah menyebabkan molekul polar. Sebagai contoh pada senyawa HCl, yang pasangan elektron milik bersama akan lebih dekat pada Cl dibandingkan ke H karena daya tarik terhadap elektronnya lebih besar ke arah Cl dibandingkan H (keelektronegatifan Cl = 3,0 dan H = 2,1 ). Hal itu menyebabkan terjadinya polarisasi atau pengkutuban muatan atau dipol pada ikatan H – Cl Jika dalam suatu ikatan kovalen terjadi pengkutuban muatan maka ikatan tersebut dinamakan ikatan kovalen polar. Molekul yang dibentuknya dinamakan molekul polar. Kepolaran suatu senyawa dapat ditentukan melalui percobaan sederhana yaitu dengan mengalirkan suatu senyawa uji melalui buret yang alirannya didekatkan dengan mistar plastik yang telah diberi muatan (menggosokkan terlebih dahulu pada rambut atau wool). Jika aliran senyawa tersebut mendekat (ditarik) atau menjauh (ditolak) dari mistar plastik maka senyawa tersebut disebut polar sedangkan bila alirannya lurus (tidak mendekat atau menjauh) dikatakan senyawa non polar. III. Alat dan Bahan Alat: 1. Buret 2. Klem dan statif 3. Sisir plastik/magnet 4. Gelas kimia Bahan: 1. Air 2. Alkohol 3. Benzin 4. Cuka 26 III. Kegiatan Siswa A. Perhatikan simulasi dan jawablah pertanyaan berikut ini! 1. Apakah ada perbedaan pengaruh medan listrik terhadap beberapa senyawa pada simulasi? ........................................................................................................................ 2. Jika ada, sebutkan perbedaan yang teramati! ........................................................................................................................ ........................................................................................................................ IV. Prosedur Kerja Percobaan 1. 1. Rangkailah peralatan percobaan seperti pada Gambar di bawah 6. … … … … … … dengan 2. Isi buret dengan air, selanjutnya alirkan air keluar secara kontinyu … cara membuka kran buret secara pelan-pelan. ….. 3. Dekatkan magnet batang pada aliran air serta amati apakah aliran air tertarik magnet / tidak. Catatan: jika magnet tidak tersedia, dapat digunakan penggaris plastik yang digosok terlebih dahulu rambut. 4. Dengan cara yang sama, ulangi percobaan untuk pengujian alkohol, bensin dan cuka. (Ingat, cuci buret sampai bersih pada setiap penggantian pengujian zat cair) 27 Data Pengamatan No 1. 2. 3. 4. Zat cair uji Aliran zat cair Dibelokkan Tidak dibelokkan Air Alkohol Benzin Cuka Percobaan 2. 1. Masukkan masing-masing 25 mL air kedalam 3 buah gelas kimia ukuran 100 mL. 2. Tambahkan 25 mL minyak tanah pada gelas kimia 1, 25 mL bensin pada gelas kimia 2, 25 mL cuka pada gelas kimia 3. 3. Amati dan catat perubahan yang terjadi Data Hasil Pengamatan No 1 2 3 Zat cair Kelarutan dalam air Larut Tidak larut Alkohol Benzin Cuka V. Diskusi 1.Dari zat cair yang diuji, zat cair yang mana saja dapat terbelokkan dan yang tidak dapat terbelokkan alirannya setelah didekatkan pada magnet/penggaris yang digosokkan pada rambut? 2.Mengapa zat cair ada yang dibelokkan dan tidak dibelokkan alirannya setelah didekatkan pada magnet/penggaris yang digosokkan pada rambut? 3. Dari zat cair yang diuji, zat cair yang mana saja dapat larut dalam air? 4. Buatlah kesimpulan dari percobaan yang dilakukan! 28 Lembar Kerja Siswa (2) Kelompok : Anggota : 29 LARUTAN ELEKTROLIT DAN NON ELEKTROLIT “Identifikasi larutan elektrolit dan non elektrolit berdasarkan daya hantar listrik” KOMPETENSI DASAR : Merancang, melakukan, dan menyimpulkan serta menyajikan hasil percobaan untuk mengetahui sifat larutan elektrolit dan larutan non- elektrolit. I. Tujuan Percobaan Melalui percobaan siswa diharapkan dapat : 1. Siswa dapat merancang percobaan untuk menguji daya hantar listrik larutan elektrolit kuat, elektrolit lemah dan non elektrolit 2. Siswa dapat menguji daya hantar listrik larutan elektrolit dan non-elektrolit 3. Siswa dapat menyajikan hasil analisis uji daya hantar larutan elektrolit kuat, elektrolit lemah dan non-elektrolit II. Dasar Teori Larutan elektrolit adalah larutan yang dapat menghantarkan listrik. Sedangkan larutan non-elektrolit adalah larutan yang tidak dapat menghantarkan arus listrik. Larutan elektrolit dalam air terdisosiasi ke dalam partikel-partikel bermuatan listrik positif dan negatif yang disebut ion (ion positif dan ion negatif) Jumlah muatan ion positif akan sama dengan jumlah muatan ion negatif, sehingga muatan ion-ion dalam larutan netral’’ Ion-ion inilah yang bertugas mengahantarkan arus listrik. Larutan ini memberikan gejala berupa menyalanya lampu atau timbulnya gelembung gas dalam larutan. Larutan elektrolit mengandung partikel-partikel yang bermuatan (kation dan anion). Larutan ini dapat bersumber dari senyawa ion (senyawa yang mempunyai ikatan ion) atau senyawa kovalen polar (senyawa yang mempunyai ikatan kovalen polar) Larutan elektrolit kuat adalah larutan yang dapat menghantarkan arus listrik dengan baik. Hal ini disebabkan karena zat terlarut akan terurai sempurna (derajat ionisasi ? = 1) menjadi ion-ion sehingga dalam larutan tersebut banyak mengandung ion-ion. Larutan elektrolit lemah adalah larutan yang dapat menghantarkan arus listrik dengan lemah. Hal ini disebabkan karena zat terlarut 30 akan terurai sebagian (derajat ionisasi ? << 1) menjadi ion-ion sehingga dalam larutan tersebut sedikit mengandung ion. III. Alat dan Bahan Alat: 5. Gelas kimia 50 mL 6. Gelas ukur 50 mL 7. Kabel 8. Baterai 9 volt 9. Elektroda karbon 10. Lampu 2,5 watt Bahan: 1. Larutan garam dapur 2. Larutan HCl 1 M 3. Larutan CH3COOH 1 M 4. Alkohol 70% 5. Air Sabun 6. Larutan Gula 7. Larutan Urea IV. Kegiatan Siswa 1. Perhatikan Foto peralatan uji larutan elektrolit dan non elektrolit di bawah ini, kemudian cobalah merangkainya kembali dari peralatan yang telah disediakan di laboratorium! Keterangan 1 = sumber arus listrik/baterray 2 = lampu 3 = ampere meter 4 = elektroda karbon 5 = larutan uji 2 3 1 4 5 2. Uji larutan-larutan yang disediakan dengan cara memasukkan kedua batang elektroda ke dalam larutan. 3. Amati yang terjadi pada lampu dan sekitar elektroda (nyala lampu, amper meter dan ada tidaknya gelembung gas)’ 4. Untuk menguji larutan lain, pastikan elektroda sudah dicuci bersih dengan akuades dan dilap dengan tisu. 5. Catat hasil pengamatan pada tabel yang telah disediakan. 31 V. Data Hasil Pengamatan Lampu Nama Larutan Terang Redup HASIL PENGAMATAN Gelembung Pergerakan pada elektroda jarum penunjuk milliamper Mati Banyak Sediki Besar Kecil t Larutan HCl Larutan garam dapur Larutan Cuka Larutan Urea Larutan Gula Alkohol 70% Air sabun VI. Diskusi Dari data pengamatan yang dicatat, diskusikan dengan anggota kelompok kemudian jawablah pertanyaan dibawah ini. 1. Dari semua larutan yang diuji daya hantarnya, larutan mana yang mampu menyebabkan lampu menyala dan lampu tidak menyala ketika kedua elektroda dicelupkan ke dalam larutan tersebut,? Lautan yang menyebabkan lampu menyala : Lautan yang menyebabkan lampu tidak menyala : 2. Sebutkan larutan yang dapat menimbulkan gelembung-gelembung gas (perubahan skala pada amper meter)! 3. Kelompokkanlah larutan-larutan tersebut ke dalam golongan larutan elektrolit kuat, lemah dan larutan non elektrolit! Elektrolit Kuat : Elektrolit Lemah : Non elektrolit : 32 4. Berikan penjelasan mengapa larutan elektrolit dapat menghantarkan listrik! VII. Menyimpulkan Dengan mengamati sifat daya hantar larutan, buatlah simpulan tentang: (a) Difinisi larutan elektrolit kuat dan non elektrolit. (b) Tiga contoh larutan elektrolit dan non elektrolit (c) Perbedaan elektrolit kuat, elektrolit lemah dan larutan non elektrolit 33 Lembar Kerja Siswa (3) Nama : Kelas : Kelompok : 34 REAKSI REDUKSI DAN OKSIDASI Mengamati kespontanan reaksi reduksi dan oksidasi KOMPETENSI DASAR : Merancang, melakukan, dan menyimpulkan serta menyajikan hasil percobaan reaksi oksidasi-reduksi. I. Tujuan Percobaan Melalui percobaan siswa diharapkan dapat mengamati: Mengamati reaksi redoks pada beberapa logam dengan larutan Mengidentifikasi reaksi redoks spontan dan tidak spontan II. Dasar Teori Reaksi redoks adalah gabungan dari reaksi reduksi dan reaksi oksidasi yang berlangsung bersamaan. Tidak ada peristiwa pelepasan elektron (reaksi oksidasi) tanpa disertai peristiwa penangkapan elektron (reaksi reduksi). Reaksi redoks dapat berlangsung spontan maupun tidak spontan. Reaksi redoks berlangsung secara spontan atau tidak sangat bergantung pada mudah atau sukarnya logam itu mengalami oksidasi (kuat atau lemahnya sifat reduktor). Alessandro Volta melakukan eksperimen dan berhasil menyusun deret keaktifan logam atau deret potensial logam yang dikenal dengan deret Volta. Li K Ba Ca Na Mg Al Nu Zn Cr Fe Cd Co Ni Sn (H) Cu Ag Hg Pt Au. Semakin ke kiri suatu unsur dalam deret Volta, sifat reduktornya semakin kuat. Artinya, suatu unsur akan mampu mereduksi ion-ion unsur di sebelah kanannya, tetapi tidak mampu mereduksi ion-ion dari unsur di sebelah kirinya. III. Alat dan Bahan Alat: 1. Rak tabung reaksi 2. Tabung reaksi 3. Pipet tetes Bahan: 1. Logam magnesium (Mg) 2. Logam seng (Zn) 3. Logam tembaga (Cu) 4. Larutan CuSO4 1 M 5. Larutan ZnSO4 1 M 6. Larutan HCl 1 M IV. Kegiatan Siswa 1. Siapkan 5 buah tabung reaksi dan beri label 1 sampai 5 35 2. Tambahkan ± 10 mL larutan CuSO4 1 M ke dalam tabung 1, ± 10 mL larutan ZnSO4 ke dalam tabung 2, dan ± 10 mL larutan HCl 1 M ke dalam tabung reaksi 3 sampai 5. 3. Ambil logam tembaga, seng, dan magnesium yang sudah di ampelas 4. Masukkan logam seng (Zn) ke dalam tabung reaksi 1 dan 4, logam tembaga (Cu) ke dalam tabung reaksi 2 dan 5 sedangkan logam magnesium (Mg) ke dalam tabung reaksi 3. 5. Amati dan catat perubahan yang terjadi V. Data Hasil Pengamatan Percob. Logam 1 2 3 4 5 Zn Cu Mg Zn Cu Larutan Warna larutan sebelum reaksi Hasil pengamatan Warna Gelembung gas larutan setelah Ada tidak reaksi Reaksi Spontan Tidak spontan CuSO4 ZnSO4 HCl HCl HCl VI. Diskusi Diskusikan data percobaan yang diperoleh, kemudian jawablah pertanyaan berikut 1. Tuliskan reaksi antara Zn dengan CuSO4, apakah reaksi spontan? Zn + CuSO4 ..................... 2. Tuliskan reaksi antara Cu dengan ZnSO4, apakah reaksi spontan? Cu + ZnSO4 ..................... 3. Tuliskan reaksi antara Mg dengan HCl, apakah reaksi spontan? Mg + HCl ..................... 4. Tuliskan reaksi antara Cu dengan HCl, apakah reaksi spontan? Cu + HCl ..................... 4. Tuliskan reaksi antara Zn dengan HCl, apakah reaksi spontan? Zn + HCl ..................... VII. Menyimpulkan Buatlah kesimpulan berdasarkan data percobaan yang diperoleh 36 LEMBAR KERJA SISWA (4) Kelompok : Anggota : 37 REAKSI EKSOTERM DAN ENDOTERM “Idenfikasi reaksi eksoterm dan endoterm” KOMPETENSI DASAR : Merancang, melakukan, menyimpulkan serta menyajikan hasil percobaan reaksi eksoterm dan reaksi endoterm. I. Tujuan Percobaan Menganalisis reaksi-reaksi yang bersifat eksoterm dan endoterm. II. Dasar Teori Termokimia dapat didefinisikan sebagai bagian ilmu kimia yang mempelajari dinamika atau perubahan reaksi kimia dengan mengamati panas/termal nya . Berdasarkan perubahan panas atau suhu yang mengikutinya, reaksi dibedakan menjadi reaksi eksoterm dan reaksi endoterm. Pada reaksi eksoterm terjadi perpindahan kalor dari sistem ke lingkungan atau pada reaksi tersebut dikeluarkan panas. Pada reaksi eksoterm harga ΔH = negatif ( – ), hal ini menunjukkan bahwa panas reaksi produk (Hp) lebih kecil dari panas reaksi reaktan (Hr) sehingga ∆H bertanda negatif (-). Pada reaksi endoterm terjadi perpindahan kalor dari lingkungan ke sistem atau pada reaksi tersebut dibutuhkan panas. Pada reaksi endoterm harga ΔH = positif ( + ) yaitu panas reaksi produk (Hp) lebih besar dari panas reaksi reaktan (Hr), karena ada sejumlah kalor yang diserap oleh sistem III. Alat dan Bahan Alat: 1. Tabung reaksi 2. Batang pengaduk 3. Termometer 4. Gelas ukur Bahan: 1. larutan HCl 1 M 2. Larutan NaOH 1 M 3. kristal Urea 4. detergent IV. Kegiatan Siswa 1. Masukkan 2 ml larutan HCl 1 M ke dalam tabung reaksi dan ukur suhu larutan tersebut serta catat hasilnya 2. Tambahkan 2 ml larutan NaOH 1 M, biarkan bereaksi, selanjutnya ukur suhu campuran dan catat hasinya 3. Masukkan air suling 10 mL ke dalam tabung reaksi. Ukur suhu air dan catat hasilnya. 4. Masukkan satu sendok urea ke dalam tabung reaksi yang berisi air, diamkan sebentar kemudian ukur suhu campuran dan catat hasilnya 5. Masukkan suling 10 mL ke dalam tabung reaksi. Ukur suhu air dan catat hasilnya. 6. Masukkan satu sendok detergen ke dalam tabung reaksi yang berisi air, diamkan sebentar kemudian ukur suhu campuran dan catat hasilnya. 38 V. Data Pengamatan Bahan Suhu awal (oC) HCl 1 M, 2 mL Air suling, 10 mL Air suling, 10 mL Penambahan Suhu akhir pencampuran Jenis Reaksi Eksoterm Endoterm NaOH 1 M Urea Detergen VI. Diskusi 1. Dari data percobaan yang diperoleh, golongkan jenis reaksi yang terjadi pada. (a) HCl(aq) + NaOH(aq) (b) Urea dilarutkan dalam air (c) Detergent dilarutkan dalam air 2. Pelarutan NaOH padat dengan air pada tabung reaksi, larutnya NaOH disertai kenaikan suhu pada tabung reaksi. Dalam proses pelarutan tersebut, yang mana disebut dengan sistem dan lingkungan? VII. Menyimpulkan Buatlah kesimpulan dari percobaan yang dilakukan 39 LEMBAR KERJA SISWA (5) Kelompok : Anggota : 40 TERMOKIMIA “Penentuan Panas Reaksi Menggunakan Kalorimeter Sederhana” KOMPETENSI DASAR : Merancang, melakukan, dan menyimpulkan serta menyajikan hasil percobaan penentuan H suatu reaksi. I. Tujuan Percobaan Menentukan ∆H reaksi netralisasi menggunakan kalorimeter sederhana II. Dasar Teori Panas netralisasi adalah jumlah panas yang dilepaskan ketika 1 mol air terbentuk akibat reaksi netralisasi asam oleh basa atau sebaliknya. Kalorimeter merupakan alat yang di gunakan untuk mengukur perubahan panas. Hal ini karena kalorimeter mengisap panas, sehingga tidak semua panas terukur. Kalorimeter yang di gunakan dalam keadaan sederhana adalah kalorimeter adiabatik. Di laboratorium alat ini merupakan alat ukur yang teliti dan secara sederhana kita mengatakan bahwa bejana panas mengalir ke dalam atau keluar dari sistem. Prinsip pada kalor netralisasi adalah Azas Black, yang menyatakan bahwa kalor yang dilepas sama dengan kalor yang diterima. Kalor netralisasi adalah panas yang timbul pada penetralan asam atau basa kuat, tetap untuk tiap-tiap mol H2O yang terbentuk. Bila asam lemah, kalor netralisasi tidak tetap, karena ada kalor untuk ionisasi. Cara kerja kalorimeter adalah sebagai berikut: Sebelum zat-zat pereaksi direaksikan di dalam kalorimeter, terlebih dahulu suhunya diukur, dan usahakan agar masing-masing pereaksi ini memiliki suhu yang sama. Setelah suhunya diukur kedua larutan tersebut dimasukkan ke dalam kalorimeter sambil diaduk agar zat-zat bereaksi dengan baik, kemudian suhu akhir diukur. Jika reaksi dalam kalorimeter berlangsung secara eksoterm maka kalor yang timbul akan dibebaskan ke dalam larutan itu sehingga suhu larutan akan naik, dan jika reaksi dalam kalorimeter berlangsung secara endoterm maka reaksi itu akan menyerap kalor dari larutan itu sendiri, sehingga suhu larutan akan turun. Besarnya kalor yang diserap atau dibebaskan reaksi itu adalah sebanding dengan perubahan suhu, kalor jenis dan massa larutan 41 III. . Alat dan Bahan Alat: 1. Kalorimeter 2. batang pengaduk 3. Termometer 4. Gelas ukur Bahan: 1. larutan HCl 1 M 2. Larutan NaOH 1 M IV. Kegiatan Siswa 4.1 Penetapan Kapasitas Kalor Kalorimeter 1. Masukkan 20 mL air dingin ke dalam kalorimeter, catat suhunya sebagai Ta. 2. Masukkan 20 mL air panas ± 70 °C ke dalam gelas beaker, catat suhunya sebagai Tb lalu tambahkan segera ke dalam kalorimeter yang telah berisi air dingin. 3. Aduk dan ukur suhu campuran selama selang waktu 0,5 menit sampai suhu menunjukkan konstan. 4. Buat kurva suhu terhadap waktu pengamatan perubahan suhu campuran 5. Hitung tetapan/kapasitas panas kalorimeter. Catatan: • Massa jenis air dianggap konstan = 1 g cm–3 • Kalor jenis air dianggap konstan = 4,2 J g–1 °K–1 4.2 Penentuan Kalor Reaksi Netralisasi Larutan Asam-Basa 1. Masukkan 25 ml larutan NaOH 1 M ke dalam kalorimeter sederhana, kemudian tutup rapat dan catat suhunya. 2. Masukkan 25 ml larutan HCl 1 M ke dalam gelas ukur dan catat suhunya. (sebelum pencampuran dikondisikan agar suhu larutan NaOH = suhu larutan HCl) 3. Tuangkan larutan HCl ke dalam kalorimeter sederhana yang berisi larutan NaOH. 4. Aduk dan ukur suhu campuran selama selang waktu 0,5 menit sampai suhu menunjukkan konstan. 42 5. Buat kurva untuk menentukan perubahan suhu larutan 6. Hitung kalor reaksinya. Catatan: Massa jenis larutan = 1,03 g cm–3 Kalor jenis larutan = 3,96 J g–1 K–1 V. Data Pengamatan 1. Penetapan Kapasitas Kalor Kalorimeter Suhu awal air dingin (Ta) = ... oC = ... K Suhu awal air panas (Tb) = ... oC = ... K Suhu setelah pencampuran : Waktu (menit) 0,5 1 1,5 2 2,5 3 3,5 4 4,5 5 Suhu (oC) 2. Penentuan Kalor Reaksi Netralisasi Larutan Asam – Basa Suhu awal HCl (T1) = ... oC = ... K Suhu setelah pencampuran : Waktu (menit) 0,5 1 1,5 2 2,5 3 3,5 4 4,5 5 Suhu (oC) 43 Perhitungan kapasitas kalor kalorimeter Massa air (m) = volume air x massajenis air = ... mL x ... g/mL = ... g Kalor yang dihasilkan (q) q = m x c x ∆T = ... g x... J K-1 g-1x ... K = ... J = ... kJ Jumlah kalor yang dilepas dan diterima q lepas = q terima q air panas = q air dingin + q kalorimeter ( m x c x ∆Tair panas) = ( m x c x ∆Tair dingin) + ( C x ∆Tkaloimeter) ............................ = ....................................................... ............................ = ....................................................... C = ... J K-1 Perhitungan kalor reaksi netralisasi Massalarutan (m) = volume larutan x massajenis larutan = ... mL x ... g/mL = ... g q larutan = m x c x ∆T q kalorimeter = C x ∆T = ... g x... J K-1 g-1x ... K = ... J Jumlah kalor yang dilepasdan diterima q reaksi= -(q larutan +q kalorimeter) Jadi ΔH reaksi = -q reaksi = ... Joule = ... J K-1x ... K = ... J VI. Diskusi 1. Dengan menggunakan data percobaan, hitung capasitas panas dari kalorimeter 2. Hitung perubahan panas reaksi (ΔH) dari reaksi NaOH dengan HCl berdasarkan hasil percobaan. VII. Menyimpulkan Buatlah kesimpulan terkait percobaan yang dilakukan 44 Lembar Kerja Siswa (6) Kelompok : Anggota : 45 PERGESERAN KESETIMBANGAN KIMIA “Perubahan suhu dan konsentrasi pereaksi terhadap pergeseran kesetimbangan reaksi Kimia” Kompetensi Dasar : Merancang, melakukan, dan menyimpulkan serta I. Tujuan Percobaan menyajikan hasil percobaan faktor-faktor yang mempengaruhi pergeseran arah kesetimbangan Melalui praktikum siswa dapat : 1. Merancang percobaan tentang pengaruh perubahan konsentrasi terhadap pergeseran kesetimbangan 2. Mengetahui pengaruh perubahan suhu dan konsentrasi terhadap pergeseran kesetimbangan 3. Menyajikan hasil percobaan tentang pengaruh perubahan suhu dan konsentrasi terhadap pergeseran kesetimbangan II. Dasar Teori Sesuai dengan azas Le Chatelier yang berbunyi “bila terhadap suatu kesetimbangan dilakukan suatu tindakan (aksi) maka sistem itu akan mengadakan reaksi yang cenderung mengurangi pengaruh aksi tersebut. Reaksi sistem terhadap aksi dari luar adalah dengan melakukan pergeseran kesetimbangan ke kiri atau ke kanan. Salah satu kegunaan konstanta kesetimbangan kimia adalah memprediksi arah reaksi. Untuk mempelajari kecenderungan arah reaksi, digunakan besaran Qc, yaitu hasil perkalian konsentrasi awal produk dibagi hasil perkalian konsentrasi awal reaktan yang masing-masing dipangkatkan dengan koefisien reaksinya. Jika nilai Qc dibandingkan dengan nilai Kc, terdapat tiga kemungkinan hubungan yang terjadi, antara lain : 1. Qc < Kc berarti terjadi peningkatan jumlah reaktan dan kekurangan produk. Untuk mencapai kesetimbangan, sejumlah reaktan diubah menjadi produk. Akibatnya, reaksi cenderung ke arah produk. 2. Qc = Kc berarti reaksi berada dalam keadaan kesetimbangan.dimana laju reaksi ke arah reaktan maupun produk adalah sama. 46 3. Qc > Kc berarti peningkatan jumlah produk dan kekurangan reaktan. Untuk mencapai kesetimbangan, sejumlah produk diubah menjadi reaktan. Akibatnya, reaksi cenderung ke arah reaktan.Reaksi kimia pada umumnya berada keadaan stimbang. Reaksi pada keadaan stimbang dapat dikenal dari sifat makroskopisnya. Sifat makroskopik yang paling mudah untuk mengamati keadaan setimbang adalah warna dimana warna larutan yang tidak berubah pada suhu tetap setelah dicapai keadaan setimbang. III. Alat dan Bahan Alat: 1. Batang pengaduk 2. Gelas kimia 100 mL 3. Gelas ukur 25 mL 4. Pipet tetes 5. Tabung reaksi Bahan: 1. Larutan FeCl3 1M 2. Larutan KSCN 1M 3. Larutan Na2HPO4 1 M IV. Kegiatan Siswa Percobaan 1: Pengaruh Konsentrasi Pereaksi terhadap Pergeseran Kesetimbangan 1. Masukkan sebanyak 25 mL air suling ke dalam gelas kimia 100 mL 2. Tambahkan 3 tetes larutan KSCN 1 M dan 3 tetes larutan FeCl3 ke dalam gelas kimia tersebut kemudian aduk hingga bercampur sempurna. 3. Masukkan masing-masing 5 mL campuran tersebut ke dalam 5 buah tabung reaksi. 4. Lakukan tahapan percobaan berikut. a. Tabung reaksi 1 : gunakan sebagai kontrol b. Tabung 2: tambahkan FeCl3 1 M sebanyak 3 tetes c. Tabung 3 : tambahkan KSCN 1 M sebanyak 3 tetes d. Tabung 4. tambahkan Na2HPO4 sebanyak 3 tetes e. Tabung 5: tambahkan air suling sebanyak 3 tetes 5. Bandingkan warna larutan pada tabung 2,3,4 dan 5 dengan warna larutan pada tabung 1 (kontrol) 47 V. Data Pengamatan Tab. Perlakuan Perubahan warna Arah pergeseran (dibandingkan dengan kestimbangan tabung 1) 1 2 3 4 5 Warna larutan pada tabung 1 : ............................................................. Penambahan FeCl3 Penambahan KSCN Penambahan Na2HPO4 Penambahan air suling Kegiatan 2: Pengaruh suhu terhadap Pergeseran Kesetimbangan No. Alat Bahan 1. Tabung reaksi Iodine 2 Rak tabung reaksi Pati 3. Pipet tetes Air 4. Gelas kimia Es batu 5. Penjepit 1. Masukkan sebanyak 5 tetes iodine kedalam gelas kimia yang telah berisi 25 mL larutan pati. 2. Masukkan masing-masing 5 mL larutan iodine-pati ke dalam 3 buah tabung reaksi. Tandai tabung tersebut (misal tabung 1, 2 dan 3) 3. Lakukan tahapan percobaan berikut. a. Tabung reaksi 1 : gunakan sebagai kontrol b. Tabung 2 : dipanaskan dalam penangas air suhu ± 70oC c. Tabung 3 : Direndam dalam air es 4. Bandingkan perubahan warna larutan iodine-pati pada tabung 2 dan 3 dengan larutan iodine-pati pada tabung 1. Tab. Perlakuan 1 Tabung 1: didiamkan 2 Tabung dipanaskan Tabung didinginkan 3 Perubahan warna (dibandingkan dengan tabung 1) Arah pergeseran kestimbangan 2: 3: 48 VI. Diskusi 1. Reaksi kestimbangan Fe3+ dengan SCN- ditulis sebagai berikut. Fe3+ (aq) + SCN- (aq) Fe(SCN)2+(aq) kearah mana reaksi kestimbangan akan bergeser jika : a. ditambahkan Fe3+ b. ditambahkan SCNc. ditambahkan Na2HPO4 2. Mengapa terjadi perbedaan warna pada larutan kompleks iodine-pati jika direndam dalam air panas maupun air es? VII. Menyimpulkan Berdasarkan data hasil percobaan yang dilakukan, buatlah kesimpulan tentang pengaruh konsentrasi pereaksi dan suhu terhadap arah pergeseran kesetimbangan kimia 49 LEMBAR KERJA SISWA (7) Kelompok : Anggota : 50 LAJU REAKSI “Pengaruh luas pemukaan, konsentrasi dan suhu terhadap laju reaksi” Kompetensi Dasar : Merancang, melakukan, dan menyimpulkan serta menyajikan hasil percobaan mempengaruhi laju reaksi faktor-faktor yang I. Tujuan Percobaan Menganalisis pengaruh luas permukaan terhadap laju reaksi Menganalisis pengaruh konsentrasi terhadap laju reaksi Menganalisis pengaruh suhu terhadap laju reaksi II. Dasar Teori Reaksi kimia tidak akan pernah terlepas dalam kehidupan kita. Reaksi tersebut terjadi dengan kecepatan yang bervariasi. Misalnya saja ketika ibu membuat teh. Mengapa harus dengan air mendidih? Mengapa tidak menggunakan air yang sudah dingin? Atau mengapa ketika kalian membuat minuman teh manis, gula yang dimasukkan ke dalam larutan teh harus kalian aduk? Mengapa tidak dibiarkan saja melarut dengan sendirinya. Mengapa makanan seperti daging, tempe,ketika dimasukkan lemari es menjadi lebih awet dibandingkan jika ditaruh di lemari biasa? Mengapa ibu saat memasak daging harus dibungkus dengan daun papaya atau daging tersebut dipotong dadu terelebih dahulu? Dan masih banyak pertanyaan lain dalam kehidupan seharihari yang berhubungan dengankecepatan berlangsungnya reaksi suatu zat. Reaksi kimia dapat dipercepat atau diperlambat dengan cara memberi perlakuan tertentu. Beberapa perlakuan yang dapa tmempengaruhi kecepatan terjadinya reaksi dinamakan faktor- faktor yang berpengaruh terhadap laju reaksi. Faktorfaktor tersebut antara lain adalah luas permukaan, suhu, konsentrasi, dan katalis. III. Kegiatan Siswa Kegiatan I: Pengaruh Konsentrasi Reaktan Alat: 1. Tabung reaksi 2. Neraca analitik 3. Stopwatch Bahan: 1. Kulit telur 2. Cuka 51 IV. Prosedur Percobaan: 1. Buatlah 3 konsentrasi larutan asam cuka yang berbeda (1) 10 mL asam cuka + 0 mL air, (2) 5 mL asam cuka + 5 mL air, dan (3) 3 mL asam cuka + 7 mL air. 2. Masukkan masing-masing larutan asam cuka tersebut ke dalam tabung reaksi 3. Tambahkan serbuk kulit telur dengan berat yang sama ke dalam masingmasing tabung reaksi yang sudah berisi larutan asam cuka. 4. Amati adanya buih dan Catat waktunya. V. Data Pengamatan Konsentrasi Cuka Tabung 1: 10 mL Cuka Tabung 2 : 5 mL cuka + 5 mL air Tabung 3 : 3 mL cuka + 7 mL air Kulit telur (gram) Buih Waktu muncul Jumlah buih* 1 gram 1 gram 1 gram VI. Diskusi 1. Berdasarkan data pengamatan manakah reaksi yang berlangsung paling cepat? 2. Berdasarkan jawabanmu pada nomor 1, mengapa reaksi tersebut berlangsung lebih cepat? Kegiatan II: Pengaruh Luas Permukaan 1. Siapkan kulit telur dalam tiga variasi ukuran ( ukuran sedang, ukuran kecil dan serbuk) yang dibuat dengan cara menggunting, ditumbuk atau diremas dengan tangan. 2. Timbang ketiga kulit telur dalam berat yang sama. 3. Masukkan masing-masing 5 mL asam cuka ke dalam 3 buah tabung reaksi. 52 4. Masukkan kulit telur ukuran sedang pada tabung reaksi 1, ukuran kecil dalam tabung reaksi 2 dan ukuran serbuk pada tabung reaksi 3. 5. Amati perubahan yang terjadi dan catat waktunya. Data Pengamatan Ukuran Kulit Telur Tabung 1: ( 1 gram kulit telur ukuran sedang) Tabung 2 : ( 1 gram kulit telur ukuran kecil) Tabung 3 : (1 gram kulit telur ukuran serbuk) Cuka ( mL) Buih Waktu muncul Jumlah buih* 5 mL 5 mL 5 mL Jumlah buih : diisi dengan hasil pengamatan banyak atau sedikit buih Diskusi 1. Dari data pengamatan di atas manakah reaksi yang berlangsung paling cepat? 2. Berdasarkan jawabanmu pada nomor 1, mengapa reaksi tersebut berlangsung lebih cepat? 3. Apakah faktor ukuran dari kulit telur (CaCO3) dapat mempengaruhi kecepatan reaksinya? Jelaskan! Kegiatan III: Pengaruh Suhu Alat dan Bahan: No 1 2 3 4 5 Alat dan Bahan Gelas kimia ukuran 100 mL Termometer Stopwatch Air panas Air dingin/air es Jumlah 3 1 1 25 mL 25 mL 53 6 7 Air suhu ruang (±25oC) Vitamin C (Redoxon) 25 mL 3 tablet Prosedur Kerja: 1. Siapkan gelas gelas kimia ukuran 100 mL sebanyak 3 buah selanjutnya pada gelas kimia 1 tambahkan 25 mL air panas, gelas kimia 2 tambahkan 25 mL air suhu ruang dan pada gelas kimia 3 tambahkan 25 mL air dingin. 2. Masukkan Vitamin C dengan berat yang sama secara bersamaan ke dalam masing-masing gelas kimia. 3. Catat waktu yang dibutuhkan untuk melarutkan semua vitamin C masing-masing gelas kimia berisi air tersebut. pada Data Pengamatan Vitamin C Hasil Pengamatan Air panas Air suhu ruang Air dingin Waktu mulai pelarutan Waktu vitamin C habis terlarut Waktu total pelarutan 1. Berdasarkan data pengamatan manakah reaksi yang berlangsung paling cepat? 2. Berdasarkan jawabanmu berlangsung lebih cepat? pada nomor 1, mengapa reaksi tersebut 3. Apakah faktor suhu pelarut (air) dapat mempengaruhi kecepatan reaksinya? Jelaskan! 4. Apa pengaruh suhu terhadap tumbukan dan laju reaksi? Jelaskan! VII. Menyimpulkan Dari percobaan yang telah dilakukan, buatlah kesimpulan tentang: Pengaruh luas permukaan, konsentrasi reaktan dan suhu terhadap laju reaksi. 54 LEMBAR KERJA SISWA (8) Kelompok : Anggota : 55 TRASI ASAM-BASA “Penentuan konsentrasi asam menggunakan basa kuat secara titrasi netralisasi” Kompetensi Dasar : Merancang, melakukan, dan menyimpulkan serta menyajikan hasil percobaan titrasi asam-basa. I. Tujuan Percobaan Menentukan titik akhir dari titrasi asam lemah dengan basa kuat Menentukan konsentrasi larutan asam lemah menggunakan basa kuat II. Dasar Teori Titrasi merupakan suatu metoda untuk menentukan kadar suatu zat dengan menggunakan zat lain yang sudah dikethaui konsentrasinya. Titrasi asam basa disebut juga titrasi netralisasi yaitu terjadinya reaksi asam dengan basa menghasilkan garam dan air. Zat yang digunakan untuk menitrasi disebut dengan titrant sedangkan zat yang dititrasi disebut dengan titrat. Titrant dialirkan ke dalam titrat sedikit demi sedikit melalui buret sampai mencapai keadaan ekuivalen ( artinya secara stoikiometri titrant dan titrat tepat habis bereaksi). Keadaan ini disebut sebagai “titik ekivalen”. Pada saat titik ekivalen tercapai, maka proses titrasi dihentikan, kemudian kita mencatat volume titrant yang diperlukan untuk mencapai keadaan tersebut. Dengan menggunakan data volume titrant, volume dan konsentrasi titrat dapat ditentukan. Dalam prakteknya, penghentian titrasi dilakukan pada saat terjadinya titik akhir titrasi dengan menggunakan bantuan indikator. Untuk menghindari kesalahan titrasi tinggi, indikator yang digunakan harus sesuai yaitu mampu menunjukkan perubahan warna yang jelas pada saat tercapainya titik akhir titrasi dan titik akhir titrasi harus mendekati keadaan titik ekivalen. Beberapa contoh indikator asam-basa beserta trayek pHnya adalah sebagai berikut Indikator Trayek pH Perubahan warna Metil jingga 3,1-4,4 Merah-jingga Metil merah 4,2-6,2 Merah-kuning 56 Bromothimol biru 6,0-7,6 Kuning-biru Phenolphtalein 8,3-10,0 Tak berwarna-merah Pada saat titik ekivalen maka mol-ekivalen asam akan sama dengan molekivalen basa, maka hal ini dapat kita tulis mol-ekivalen asam = molekivalen basa Mol-ekivalen diperoleh dari hasil perkalian antara Normalitas dengan volume maka rumus diatas dapat kita tulis sebagai NxV asam = NxV basa. Normalitas diperoleh dari hasil perkalian antara molaritas (M) dengan jumlah ion H+ pada asam atau jumlah ion OH- pada basa, sehingga rumus diatas menjadi: nxMxV asam = nxVxM basa, dimana N = Normalitas,V = Volume, M = Molaritas, n = jumlah ion H+ atau OH– III. Alat dan Bahan: No. 1 2 3. 4. 5. 6 Alat Buret Erlenmeyer Pipet tetes Gelas kimia Statif dan klem Corong Bahan Larutan asam asetat Larutan NaOH 0,1 M Indikator PP IV. Kegiatan Siswa 1. Rangkai peralatan titrasi seperti pada gambar berikut. 57 2. Masukkan 10 mL larutan asam asetat ke dalam erlenmeyer ukuran 100 mL menggunakan pipet volume. 3. Tambahkan 3 tetes indikator PP ke dalam erlenmeyer yang telah berisi asam asetat. 4. Isi buret ukuran 25 mL dengan larutan NaOH 0,1 M dan atur volumenya hingga tepat 25 mL. 4. Titrasi larutan asam asetat dengan menggunakan larutan NaOH 0,1 M sampai terjadi perubahan warna menjadi merah muda, kemudian catat volume NaOH yang digunakan. 5. Ulangi prosedur di atas hingga 3 kali. V. Data Pengamatan No. titrasi 1 2 3 Volume larutan CH3COOH (mL) 10,00 10,00 10,00 Volume NaOH 0,1 M yang digunakan ( mL) Volume rata-rata NaOH VI. Diskusi 1. Kapan kita menghentikan proses tititrasi asam asetat dengan larutan NaOH menggunakan indikator PP? 2. Mengapa indikator PP yang digunakan sebagai indikator dalam titrasi asam asetat dengan larutan NaOH? 3. Jika di laboratorium tidak tersedia indikator PP, namun yang ada adalah metil jingga, metil merah dan bromothymol biru. Indikator mana yang paling baik untuk menggantikan PP dalam menitrasi asam asetat dengan NaOH 4. Dengan menggunakan data volume larutan NaOH 0,1 M yang digunakan untuk menitrasi larutan asam asetat (CH3COOH), hitunglah konsentrasi larutan CH3COOH dalam satuan Molar (M) dan Normal (N) VII. Menyimpulkan Buatlah kesimpulan dari percobaan yang telah dilakukan 58 LEMBAR KERJA SISWA (9) Kelompok : Anggota : 59 SIFAT KOLIGATIF LARUTAN KENAIKAN TITIK DIDIH DAN PENURUNAN TITIK BEKU Kompetensi Dasar : Mengolah dan menganalisis data percobaan sifat koligatif larutan I. TUJUAN PERCOBAAN Mengetahui kenaikan titik didih dan penurunan titik beku beberapa larutan. II. DASAR TEORI Sifat koligatif larutan didefinisikan sebagai sifat fisik larutan yang hanya ditentukan oleh jumlah partikel dalam larutan dan tidak tergantung pada jenis partikelnya. Adanya zat pelarut didalam pelarut menyebabkan perubahan sifat fisik pelarut dan larutan tersebut. Sifat fisik yang mengalami perubahan misalnya, penurunan tekanan uap, penurunan titik beku, kenaikan titik didih, dan tekanan osmosis. Keempat sifat tersebut merupakan bagian dari sifat koligatif larutan. Titik didih suatu zat cair adalah suhu pada saat tekanan uap zat cair tersebut sama dengan tekana atmosfer di sekitarnya. Pada saat zat cair mencapai titk didih, tekanan zat cair cukup tinggi untuk menyebabkan penguapan pada setiap titik di dalam zat cair itu. Proses mendidih suatu zat cair dapat diamati dengan timbulnya gelembung-gelembung udara yang terbentuk secara terus-menerus pada berbagai bagian dalam zat cair itu. Dengan adanya zat-zat terlarut dalam suatu zat cair, misalnya larutan garam, maka titik didih zat cair itu akan naik. Kenaikan titik didih ini sebanding dengan konsentrasi zat terlarut. Bila konsentrasi zat terlarut semakin kecil, makan kenaikan titik didih juga semakin kecil, dan sebaliknya. Jadi, dengan adanya zat terlarut dalam air, maka titik didih air menjadi lebih besar dari 100ºC pada tekanan 1 atmosfer Peningkatan titik didih sebanding dengan konsentrasi fraksi molnya. Untuk larutan encer, perbandingannya dinyatakan dalam molalitas. Peningkatan titik didih dirumuskan: 60 ∆TB = m . KB Keterangan : ∆ Tb = besar penurunan titik didih KB = konstanta kenaikan titik didih m = molalitas dari zat terlarut Titik didih suatu larutan dapat lebih tinggi maupun lebih rendah dari pada titik didih pelarut, bergantung pada kemudahan zat terlarut itu menguap, dibandingkan dengan pelarutnya. Jika zat terlarut itu tak atsiri (tidak mudah menguap) misalnya gula, larutan air mendidih pada temperatur yang lebih tinggi dari pada titik didih air, jika zat terlarut itu mudah menguap misalnya alkohol, larutan air mendidih pada temperatur di bawah titik didih air. Titik beku suatu larutan adalah temperatur pada saat tekanan uapnya sama dengan tekanan uap pelarut. Karena tekanan uap lebih rendah daripada pelarutnya, larutan belum membeku pada temperatur 0ºC. Oleh karena itu, temperatur harus diturunkan agar larutan dapat membeku. Jika temperatur terus diturunkan, suatu saat pelarut akan membeku ( berubah menjadi pelarut padat ). Penurunan tekanan uap pada pelarut padat lebih cepat daripada zat cair. Akibatnya, pada temperatur dibawah titik beku pelarut terjadi kesetimbangan tekanan uap larutan dengan tekanan uap pelarut padat. Pada saat seperti itu pelarut akan membeku, sedangkan zat terlarutnya masih dalam fase cair. Hal itu menyebabkan larutan menjadi makin pekat sehingga titik bekunya makin rendah. Dengan kata lain, larutan tidak memiliki titik beku yang tetap. Hal itu menyebabkan pengertian titik beku larutan harus didefinisikan. Definisi dari titik beku larutan adalah temperatur pada saat membeku. Selisih antara titik beku pelarut dan titik beku larutan disebut penurunan titik beku (∆Tf = freezing point depression) Titik beku larutan merupakan titik beku pelarut murni dikurangi dengan penurunan titik bekunya. Pengukuran penurunan titik beku, seperti halnya peningkatan titik didih, dapat digunakan untuk menentukan massa molar zat yang tidak diketahui. Pada larutan encer, nilai fraksi mol zat terlarut sangat 61 kecil dan jumlah pelarut sangat besar. Maka molalitas zat terlarut dapat diabaikan sehingga persamaan penurunan titik beku dirumuskan: ∆Tf = m . K f Keterangan : ΔTf = penurunan titik beku m = molalitas dari zat terlarut Kf = konstanta penurunan titik beku besarnya tergantung pada jenis larutan. III. ALAT DAN BAHAN No 1 2 3 4 5 6 Alat Gelas Kimia Termometer Pembakar bunsen Spatula Spritus Es batu Bahan 1. Air 2. Gula 3. Garam dapur (NaCl) IV. PROSEDUR KERJA KENAIKAN TITIK DIDIH 1. Masukkan masing-masing 100 mL air suling ke dalam 3 buah gelas kimia. 2. Tambahkan 5 gram gula pada gelas kimia pertama dan 5 gram NaCl pada gelas kimia kedua. 3. Panaskan ketiga gelas kimia tersebut dan catat suhu pelarut (air suling) dan larutan (larutan NaCl dan larutan gula) setiap 5 menit sampai mendidih. V.A. DATA PENGAMATAN Waktu (menit) Suhu Air suling (oC) Suhu Larutan NaCl (oC) Suhu Larutan gula (oC) 0 5 10 15 20 25 30 62 PENURUNAN TITIK BEKU Percobaan 1. 1. Masukkan 100 mL es batu yang telah dihancurkan kedalam 3 gelas kimia yang diberi label A, B dan C. 2. Ukur suhu es batu yang ada di gelas kimia A 3. Tambahkan 1 gram gula pada gelas kimia B sambil diaduk, kemudian diukur suhunya 4. Tambahkan 5 gram gula pada gelas kimia C sambil diaduk, kemudian diukur suhunya Percobaan 2. 5. Masukkan 100 mL es batu yang telah dihancurkan kedalam 3 gelas kimia yang diberi label A, B dan C. 6. Ukur suhu es batu yang ada di gelas kimia A 7. Tambahkan 1 gram garam dapur (NaCl) pada gelas kimia B sambil diaduk, kemudian diukur suhunya. 8. Tambahkan 5 gram garam dapur (NaCl) pada gelas kimia C sambil diaduk, kemudian diukur suhunya V.B. DATA PENGAMATAN Waktu (menit) Suhu Es batu (oC) Suhu Es batu +Gula (oC) 1 gram 5 gram Suhu Es batu + NaCl (oC) 1 gram 5 gram 0 1 2 3 4 5 63 VI. DISKUSI 1. Bagaimana perbandingan titik didih tiap larutan dengan titik didh pelarut murni (air)? 2. Dengan menggunakan data percobaan kenaikan titik didih, hitunglah kenaikan titik didih larutan dan bandingkan hasilnya dengan kenaikan titih didih larutan secara teoritis. 3. Dengan menggunakan data percobaan penurunan titik beku, hitunglah penurunan titik beku larutan dan bandingkan hasilnya dengan penurunan titik beku larutan secara teoritis. VII. MENYIMPULKAN Buatlah kesimpulan dari percobaan yang telah dilakukan 64 LEMBAR KERJA SISWA (10) Kelompok : Anggota : 65 ELEKTROLISIS LARUTAN I. TUJUAN PERCOBAAN Menyelidiki reaksi-reaksi yang terjadi di anode dan katoda pada sel elektrolisis Menentukan rasio volume gas H2 dan O2 yang dihasilkan pada elektroda pada elektrolisis larutan NaOH Mengidentifikasi hasil reaksi (sifat asam-basa) di anode dan katode pada elektrolisis larutan NaOH dan NaCl II. DASAR TEORI Pada sel elektrolisis terjadi reaksi redoks , yaitu reaksi reduksi dan oksidasi yang berjalan dalam satu waktu . pada sel elektrolisis terdiri dua elektroda yaitu kutub katoda ( kutub negatif ) terjadi reaksi reduksi. Dan kutub anoda ( kutub positif ) terjadi reaksi oksidasi. Electrolysis adalah dekomposisi suatu senyawa dengan arus listrik. Reaksi oksidasi reduksi pada sel elektrolisis dapat ditunjukan adanya peristiwa perbedaan zat yang dihasilkan pada kedua elektrode. Dengan menggunakan indicator tertentu dapat diamati sifat - sifat zat hasil elektrolisis baik disekitar katoda dan anode. III. ALAT DAN BAHAN No 1 2 3 4 Alat Gelas Kimia Peralatan elektrolisis Batang pengaduk Sumber arus Bahan 1. 2. 3. 4. Air suling Larutan NaOH 1 M Larutan NaCl 1 M Indikator PP IV. PROSEDUR KERJA Percobaan 1: ELEKTROLISIS LARUTAN NaOH 1. Tempatkan 100 mL larutan NaOH kedalam beaker gelas, kemudian tambahkan 5 tetes indikator PP. 2. Tuangkan larutan tersebut pada peralatan elektrolisis 66 2. Dengan menggunakan syringe, isi kedua elektroda dengan larutan NaOH dan jepit selang menggunakan penjepit jika masing-masing elektrode sudah penuh dengan larutan NaOH.(penjepit berfungsi untuk mempertahankan agar larutan NaOH tidak keluar dari masing-masing elektrode) 3. Hubungkan masing-masing elektrode dengan sumber arus DC 9 Volt. 4. Amati reaksi elektrolisis yang terjadi dan cata volume gas yang dihasilkan pada anode dan katode. 4. Amati pula perubahan warna larutan yang terjadi di anode dan katode V.A. DATA PENGAMATAN Elektrolisis larutan NaOH Yang diamati Hasil pengamatan Sebelum proses elektrolisis Setelah proses elektrolisis Anode Katode Anode Katode Volume gas Warna larutan Percobaan 2: ELEKTROLISIS LARUTAN NaCl 1. Tempatkan 100 mL larutan NaCl kedalam beaker gelas, kemudian tambahkan 5 tetes indikator PP. 2. Tuangkan larutan tersebut pada peralatan elektrolisis 3. Dengan menggunakan syringe, isi kedua elektroda dengan larutan NaCl dan jepit selang menggunakan penjepit jika masing-masing elektrode sudah penuh dengan larutan NaCl.(penjepit berfungsi untuk mempertahankan agar larutan NaCl tidak keluar dari masing-masing elektrode) 3. Hubungkan masing-masing elektrode dengan sumber arus DC 9 Volt. 4. Amati reaksi elektrolisis yang terjadi dan catat volume gas yang dihasilkan pada anode dan katode. 5. Amati pula perubahan warna larutan yang terjadi di anode dan katode 67 V. B. DATA PENGAMATAN Elektrolisis larutan NaCl Yang diamati Hasil pengamatan Sebelum proses elektrolisis Setelah proses elektrolisis Anode Katode Anode Katode Volume gas Warna larutan VI. DISKUSI 1. Tuliskan reaksi di anode dan di katode pada elektrolisis larutan NaOH. 2. Amati rasio volume gas yang terbentuk di anoda dan di katoda. Bandingkan dengan hasil teoritisnya, apakah sesuai dan mengapa demikian? 3. Mengapa terjadi perbedaan warna larutan pada anode dan katode? 4. Tuliskan reaksi yang terjadi di anode dan katode pada elektrolisis larutan NaCl 5. Mengapa terjadi perbedaan warna larutan pada anode dan katode? VII. MENYIMPULKAN Buat kesimpulan dari percobaan yang kalian lakukan 68 IbM Kelompok Pengelola Laboratorium Kimia SMA tahun 2015 oleh I Dewa Ketut Sastrawidana I Wayan Suja Ketut Darmada Made Budiada Made Sinar Dewi Penelaah Putra Adnyana Ni Luh Casmini Disusun pada kegiatan pengabdian masyarakat IbM Kelompok Pengelola Laboratorium Kimia SMA yang didanai dari DP2M Dikti Kementerian Riset dan Pendidikan Tinggi Tahun 2015 TATATERTIB KERJA DI LABORATORIUM KIMIA 1. Siswa tidak di benarkan memasuki laboratorium kimia tanpa seizin guru 2. Di dalam laboratorium, siswa / pratikum : Menggunakan jas lab lengan panjang dalam melakukan praktikum. Rambut panjang harus di ikat rapi dan bagi siswi yang memiliki poni harus memakai bando. Jangan menggosok-gosok mata atau anggota badan lain dengan tangan yang mungkin sudah terkontaminasi bahan kimia. Memperhatikan petunjuk bahaya dan pertolongan pertama pada kecelakan laboratorium. Tidak bersenda gurau, maka, minum, dan merokok dalam ruang lanoratorium. Selalu cuci tangan dan lengan sebelum meninggalkan laboratorium 3. Mintalah petunjuk kepada guru pembimbing mengenai alat dan bahan serta cara kerjanya sebelum pratikum dimulai. 4. Cek semua peralatan sebelum digunakan. Apabila terdapat kerusakan, segera laporkan kepada guru pembimbing untuk segera diganti/diperbaiki 5. Kerjakan pratikum sesuai prosedur percobaan yang ada di penuntun pratikum 6. Jangan meninggalkan suatu percobaan tanpa pengawasan, terutama percobaan yang menggunakan bahan-bahan yang mudah meledak atau mudah terbakar 7. Setelah selesai pratikum, kembalikan alat / bahan yang digunakan dalam keadaan rapi dan bersih KESEHATAN DAN KESELAMATAN KERJA LABORATORIUM SIMBUL, ARTI DAN TINDAKAN PENCEGAHAN BAHAN KIMIA DI LABORATORIUM SIMBOL CONTOH BAHAN ARTI DAN PENCEGAHANNYA BERACUN/TOKSIK Merkuri, Sianida Metanol, Benzena Arti: Beracun artinya dapat menyebabkan kecelakaan, penderitaan ataupun kematian apabila tertelan, terhirup atau terserap melalui kulit. Pencegahan : Hindari kontak langsung LAMBANG : T KOROSIF dengan kulit. Asam dan basa kuat (HCl, H2SO4, NaOH) merusak jaringan hidup, dapat menyebabkan iritasi pada kulit, gatal-gatal dan dapat membuat kulit mengelupas. Pencegahan : Hindari kontak langsung LAMBANG : C FLAMEABLE Arti : Bahan yang bersifat korosif, dapat Minyak terpentin, Aseton, logam natrium. dietil eter,propana dengan kulit dan benda-benda bersifat logam. Arti : Bahan kimia yang mempunyai titik nyala rendah, mudah terbakar dengan api bunsen, permukaan metal panas atau loncatan bunga api. Pencegahan : Jauhkan dari benda-benda LAMBANG : F EKSPLOSIF yang berpotensi mengeluarkan api. KClO3, NH4NO3, Trinitro Toluena (TNT). LAMBANG : E IRITASI/BERBAHAYA NaOH, C6H5OH, Cl2 Arti : Bahan kimia yang mudah meledak dengan adanya panas atau percikan bunga api, gesekan atau benturan. Pencegahan : Hindari benturan, gesekan, pemanasan, api dan sumber nyala lain bahkan tanpa oksigen atmosferik. Arti : Bahan yang dapat menyebabkan iritasi, gatal-gatal dan dapat menyebabkan luka bakar pada kulit. Pencegahan : Hindari dengan kulit. LAMBANG : I kontak langsung KATA PENGANTAR Puji syukur penulis panjatkan kehadapan Tuhan yang Maha Esa karena berkat rahmat anugrahNya, kami dapat menyusun buku penuntun praktikum Kimia SMA sesuai dengan waktu yang ditentukan. Materi praktikum yang dikemas dalam buku penuntun praktikum kimia SMA ini diadaptasikan dengan kondisi lingkungan terutama menggunakan bahan-bahan yang murah dan mudah diperoleh serta peralatan yang sederhana sehingga harapannya dapat diimplementasikan disekolah. Buku penuntun praktikum kimia SMA ini disusun dalam kaitannya dengan pengabdian pada masyarakat skim ipteks bagi masyarakat (IbM) kelompok pengelola Laboratorium kimia SMA di SMAN 1 Sukasada dan SMAN 2 Busungbiu yang pelaksanaannya didanai oleh DP2M dikti tahun 2015 melalui lembaga pengabdian pada masyarakat Undiksha. Untuk itu, terima kasih yang sebesarbesarnya kepada DP2M dikti atas bantuan dana yang diberikan serta Lembaga Pengabdian kepada Masyarakat, Universitas Pendidikan Ganesha atas kesempatan dan segala fasilitas pendukung yang diberikan selama proses pelaksanaan program ini. Buku penuntun praktikum Kimia SMA ini diharapkan mampu membantu kelancaran siswa dalam melaksanakan praktikum di laboratorium sesuai dengan hakikat pembelajaran kimia yang menyasar aspek kognitif dan psikometor secara berimbang. Namun, dalam penyusunan buku ini masih banyak ada kekurangankekurangan sehingga sangat diperlukan masukan yang konstruktif untuk penyempurnaannya. Akhir kata, dengan kehadiran buku ini dapat bermanfaat bagi kita semua. Singaraja, Agustus 2015 Tim penyusun. DAFTAR ISI 1 2 3 Halaman Kepolaran Senyawa : Identifikasi kepolaran suatu senyawa berdasarkan interaksinya dengan medan magnet dan kelarutan dalam air 1 Larutan Elektrolit dan Non elektrolit : Identifikasi larutan elektrolit dan non elektrolit berdasarkan daya hantar listrik 4 Reaksi Redoks : Identifikasi kespontanan reaksi reduksi-oksidasi 7 4 Reaksi Eksoterm dan Endoterm : Idenfikasi reaksi eksoterm dan endoterm 10 5 Penentuan Panas Reaksi : menggunakan kalorimeter sederhana 12 6 Laju Reaksi : Pengaruh luas pemukaan, konsentrasi dan suhu terhadap laju reaksi 17 7 Kestimbangan Kimia: Perubahan suhu dan konsentrasi pereaksi terhadap pergeseran kesetimbangan reaksi 21 8 Titrasi Asam-Basa: Penentuan konsentrasi asam menggunakan basa kuat secara titrasi netralisasi 25 9 Garam Terhidrolisis : Penentuan jenis garam yang mengalami hidrolisis 28 10 Larutan Penyangga : Sifat larutan penyangga 30 11 Koligatif Larutan : Kenaikan titik didih dan titik beku larutan 33 12 Elektrolisis : Elektrolisis larutan 38 Penentuan panas reaksi PERCOBAAN I KEPOLARAN SENYAWA Identifikasi kepolaran suatu senyawa berdasarkan interaksinya dengan medan magnet dan kelarutan dalam air I. TUJUAN PERCOBAAN 1. Membedakan senyawa polar dan non polar berdasarkan pengaruh interaksinya bila didekatkan pada partikel yang bermuatan. 2. Mengidentifikasi sifat polar suatu senyawa berdasarkan kelarutannya dalam air. II. DASAR TEORI Perbedaan keelektronegatifan dua atom menimbulkan kepolaran molekul. Adanya perbedaan keelektroegatifan tersebut menyebabkan pasangan elektron ikatan lebih tertarik ke salah satu unsur sehingga membentuk dipol. Adanya dipol inilah menyebabkan molekul polar. Kepolaran suatu senyawa dapat ditentukan melalui percobaan sederhana yaitu dengan mengalirkan suatu senyawa uji melalui buret yang alirannya didekatkan dengan mistar plastik yang telah diberi muatan (menggosokkan terlebih dahulu pada rambut atau wool). Jika aliran senyawa tersebut mendekat (ditarik) atau menjauh (ditolak) dari mistar plastik maka senyawa tersebut disebut polar sedangkan bila alirannya lurus (tidak mendekat atau menjauh) dikatakan senyawa non polar. III. ALAT DAN BAHAN Alat: 11. Buret 12. Klem dan statif 13. Mistar plastik atau magnet batang 14. Gelas kimia Bahan: 5. Air 6. Alkohol 7. Benzin 8. Cuka 1 IV. PROSEDUR KERJA Percobaan I. 1. Rangkai peralatan percobaan seperti pada Gambar di bawah 6. Keterangan : 1. Corong, 2. Buret, 3. Larutan uji 4. Clamp, 5. Statif dan 6. Mistar plastik 2. Masukkan senyawa uji ( air, alkohol, cuka, benzin, dll) ke dalam buret, selanjutnya alirkan keluar secara kontinyu dengan cara membuka keran secara perlahan-lahan. 3. Dekatkan magnet batang pada aliran senyawa yang keluar serta amati apakah alirannya mendekati(ditarik magnet), menjauh (ditolak magnet) atau lurus (tidak dipengaruhi magnet) Catatan: jika magnet tidak tersedia, dapat digunakan penggaris plastik yang digosok terlebih dahulu rambut. 4. Ulangi percobaan di atas dengan mengganti larutan uji yang lain ( Ingat: cuci buret dengan bersih pada setiap pengujian zat cair) 2 V.A. DATA PENGAMATAN No 5. 6. 7. 8. Zat cair uji Aliran zat cair Dibelokkan Tidak dibelokkan Air Alkohol Benzin Cuka Percobaan 2. 4. Masukkan masing-masing 25 mL air suling kedalam 3 buah gelas kimia ukuran 100 mL. 5. Tambahkan 25 mL alkohol pada gelas kimia 1, 25 mL bensin pada gelas kimia 2, 25 mL cuka pada gelas kimia 3. 6. Amati dan catat perubahan yang terjadi V.B. DATA PENGAMATAN No 1 2 3 Zat cair Kelarutan dalam air Larut Tidak larut Alkohol Benzin Cuka VI. DISKUSI 1. Kelompokkan senyawa yang diuji kedalam larutan elektrolit kuat, elektrolit lemah dan non elektrolit. 2. Mengapa senyawa polar dapat membelokkan aliran air sedangkan senyawa non polar tidak? 3. Pada molekul air (H2O) terdapat 2 pasang elektron ikatan. Jika harga elektronegativitas atom O = 3,5 dan H = 2,1 ; atom manakah yang lebih kuat menarik elektron ? 3 PERCOBAAN II LARUTAN ELEKTROLIT DAN NON ELEKTROLIT Identifikasi larutan elektrolit dan non elektrolit berdasarkan daya hantar listrik I. TUJUAN PERCOBAAN: 1. Merancang percobaan penentuan daya hantar listrik larutan. 2. Menguji daya hantar larutan elektrolit dan non elektrolit 3. Mengidentifikasi larutan elektrolit kuat, elektrolit lemah, dan non elektrolit. II. DASAR TEORI Larutan elektrolit adalah larutan yang dapat menghantarkan listrik. Sedangkan larutan non-elektrolit adalah larutan yang tidak dapat menghantarkan arus listrik. Larutan elektrolit dalam air terdisosiasi ke dalam partikel-partikel bermuatan listrik positif dan negatif yang disebut ion (ion positif dan ion negatif) Jumlah muatan ion positif akan sama dengan jumlah muatan ion negatif, sehingga muatan ion-ion dalam larutan netral’’ Ion-ion inilah yang bertugas mengahantarkan arus listrik. Larutan ini memberikan gejala berupa menyalanya lampu atau timbulnya gelembung gas dalam larutan. Larutan elektrolit mengandung partikel-partikel yang bermuatan (kation dan anion). Larutan ini dapat bersumber dari senyawa ion (senyawa yang mempunyai ikatan ion) atau senyawa kovalen polar (senyawa yang mempunyai ikatan kovalen polar) Larutan elektrolit kuat adalah larutan yang dapat menghantarkan arus listrik dengan baik. Hal ini disebabkan karena zat terlarut akan terurai sempurna (derajat ionisasi ? = 1) menjadi ion-ion sehingga dalam larutan tersebut banyak mengandung ion-ion. Larutan elektrolit lemah adalah larutan yang dapat menghantarkan arus listrik dengan lemah. Hal ini disebabkan karena zat terlarut akan terurai sebagian (derajat ionisasi ? << 1) menjadi ion-ion sehingga dalam larutan tersebut sedikit mengandung ion. 4 III. ALAT DAN BAHAN Alat: 1. Gelas kimia 50 mL 2. Gelas ukur 50 mL 3. Kabel 4. Baterai 9 volt 5. Elektroda karbon 6. Lampu 2,5 watt Bahan: 8. Larutan garam dapur 9. Larutan HCl 1 M 10. Larutan CH3COOH 1 M 11. Alkohol 70% 12. Air Sabun 13. Larutan Gula 14. Larutan Urea IV. PROSEDUR PERCOBAAN 1. Rangkailah peralatan seperti pada Gambar di bawah. Keterangan 1 = sumber arus listrik/baterray 2 = lampu 3 = ampere meter 4 = elektroda karbon 5 = larutan uji (2) (3) (1) (4) (5) 2. Tempatkan secara terpisah masing-masing 20 mL larutan garam dapur, larutan HCl, larutan gula, alkohol 70%, larutan cuka, larutan Urea dan air sabun ke dalam gelas beaker ukuran 100 mL. 3. Uji daya hantar listrik larutan-larutan tersebut dengan cara memasukkan kedua bagian elektroda karbon pada larutan tersebut. Ingat : Cuci kedua elektroda setiap pergantian pengujian daya hantar listrik larutan. 4. Amati dan catat perubahan yang terjadi pada lampu, miliamper dan ada tidaknya gelembung pada elektroda karbon. 5 V. DATA PENGAMATAN HASIL PENGAMATAN Nama Larutan Lampu Terang Redup Mati Gelembung pada elektroda Banyak Sedikit Pergerakan jarum penunjuk milliamper Besar Kecil Larutan HCl Larutan garam dapur Larutan Cuka Larutan Urea Larutan Gula Alkohol 70% Air sabun VI. DISKUSI 1. Kelompokkan larutan-larutan berikut ke dalam elektrolit kuat, elektrolit lemah dan larutan non elektrolit dengan mengisi tabel berikut. Nama Larutan Larutan HCl Larutan garam dapur Larutan Cuka Larutan Urea Larutan Gula Alkohol 70% Air sabun Larutan Elektrolit Larutan Non elektrolit 2. Tulislah ciri-ciri larutan elektrolit kuat, elektrolit lemah dan larutan non elektrolit. 6 PERCOBAAN III REAKSI REDUKSI DAN OKSIDASI Mengamati kespontanan reaksi reduksi dan oksidasi I. TUJUAN PERCOBAAN Mengamati reaksi redoks pada beberapa logam dengan larutan Mengidentifikasi reaksi redoks spontan dan tidak spontan II. DASAR TEORI Reaksi Redoks merupakan reaksi dimana terdapat perubahan bilangan oksidasi,valensi atau muatan. Konsep reduksi dan oksidasi (redoks) berdasarkan pengikatan dan pelepasan oksigen, penyerahan dan penerimaan elektron, serta peningkatan dan penurunan bilangan oksidasi. Reaksi reduksi-oksidasi merupakan reaksi yang berlangsung pada proses-proses elektrokimia, yaitu proses kimia yang menghasilkan arus listrik dan proses kimia yang menggunakan arus listrik. Reaksi redoks adalah gabungan dari reaksi reduksi dan reaksi oksidasi yang berlangsung bersamaan. Tidak ada peristiwa pelepasan elektron (reaksi oksidasi) tanpa disertai peristiwa penangkapan elektron (reaksi reduksi). Reaksi redoks dapat berlangsung spontan maupun tidak spontan. Reaksi redoks berlangsung secara spontan atau tidak sangat bergantung pada mudah atau sukarnya logam itu mengalami oksidasi (kuat atau lemahnya sifat reduktor). Alessandro Volta melakukan eksperimen dan berhasil menyusun deret keaktifan logam atau deret potensial logam yang dikenal dengan deret Volta. Li K Ba Ca Na Mg Al Nu Zn Cr Fe Cd Co Ni Sn (H) Cu Ag Hg Pt Au. Semakin ke kiri suatu unsur dalam deret Volta, sifat reduktornya semakin kuat. Artinya, suatu unsur akan mampu mereduksi ion-ion unsur di sebelah kanannya, tetapi tidak mampu mereduksi ion-ion dari unsur di sebelah kirinya. 7 III. ALAT DAN BAHAN Alat: 1. Rak tabung reaksi 2. Tabung reaksi 3. Pipet tetes Bahan: 1. Logam magnesium (Mg) 2. Logam seng (Zn) 3. Logam tembaga (Cu) 4. Larutan CuSO4 1 M 5. Larutan ZnSO4 1 M 6. Larutan HCl 1 M IV. PROSEDUR KERJA 1. Siapkan 5 buah tabung reaksi dan beri label 1 sampai 5 2. Tambahkan ± 10 mL larutan CuSO4 1 M ke dalam tabung 1, ± 10 mL larutan ZnSO4 ke dalam tabung 2, dan ± 10 mL larutan HCl 1 M ke dalam tabung reaksi 3 sampai 5. 3. Ambil logam tembaga, seng, dan magnesium yang sudah di ampelas 3. Masukkan logam seng (Zn) ke dalam tabung reaksi 1 dan 4, logam tembaga (Cu) ke dalam tabung reaksi 2 dan 5 sedangkan logam magnesium (Mg) ke dalam tabung reaksi 3. 4. Amati dan catat perubahan yang terjadi V. DATA PENGAMATAN Percob. Logam 1 2 3 4 5 Zn Cu Mg Zn Cu Larutan Warna larutan sebelum reaksi Hasil pengamatan Warna Gelembung larutan gas setelah Ada tidak reaksi Reaksi Spontan Tidak spontan CuSO4 ZnSO4 HCl HCl HCl 8 VI. DISKUSI 1. Tuliskan reaksi antara Zn dengan CuSO4, apakah reaksi spontan? Zn + CuSO4 ..................... 2. Tuliskan reaksi antara Cu dengan ZnSO4, apakah reaksi spontan? Cu + ZnSO4 ..................... 3. Tuliskan reaksi antara Mg dengan HCl apakah reaksi spontan? Mg + HCl ..................... 4. Tuliskan reaksi antara Cu dengan HCl apakah reaksi spontan? Cu + HCl ..................... 4. Tuliskan reaksi antara Zn dengan HCl apakah reaksi spontan? Zn + HCl ..................... 9 PERCOBAAN IV REAKSI EKSOTERM DAN ENDOTERM Idenfikasi reaksi eksoterm dan endoterm I. TUJUAN PERCOBAAN Menganalisis reaksi-reaksi yang bersifat eksoterm dan endoterm. II. DASAR TEORI Termokimia dapat didefinisikan sebagai bagian ilmu kimia yang mempelajari dinamika atau perubahan reaksi kimia dengan mengamati panas/termal nya . Berdasarkan perubahan panas atau suhu yang mengikutinya, reaksi dibedakan menjadi reaksi eksoterm dan reaksi endoterm. Pada reaksi eksoterm terjadi perpindahan kalor dari sistem ke lingkungan atau pada reaksi tersebut dikeluarkan panas. Pada reaksi eksoterm harga ΔH = negatif ( – ), hal ini menunjukkan bahwa panas reaksi produk (Hp) lebih kecil dari panas reaksi reaktan (Hr) sehingga ∆H bertanda negatif (-). Pada reaksi endoterm terjadi perpindahan kalor dari lingkungan ke sistem atau pada reaksi tersebut dibutuhkan panas. Pada reaksi endoterm harga ΔH = positif ( + ) yaitu panas reaksi produk (Hp) lebih besar dari panas reaksi reaktan (Hr), karena ada sejumlah kalor yang diserap oleh sistem. III. ALAT DAN BAHAN Alat: 1. Tabung reaksi 2. Batang pengaduk 3. Termometer 4. Gelas ukur Bahan: 1. larutan HCl 1 M 2. Larutan NaOH 1 M 3. kristal Urea 4. detergent IV. PROSEDUR KERJA 1. Masukkan 2 ml larutan HCl 1 M ke dalam tabung reaksi dan ukur suhu larutan tersebut serta catat hasilnya 2. Tambahkan 2 ml larutan NaOH 1 M, biarkan bereaksi, selanjutnya ukur suhu campuran dan catat hasinya 10 3. Masukkan air suling 10 mL ke dalam tabung reaksi. Ukur suhu air dan catat hasilnya. 4. Masukkan satu sendok urea ke dalam tabung reaksi yang berisi air, diamkan sebentar kemudian ukur suhu campuran dan catat hasilnya 5. Masukkan suling 10 mL ke dalam tabung reaksi. Ukur suhu air dan catat hasilnya. 6. Masukkan satu sendok detergen ke dalam tabung reaksi yang berisi air, diamkan sebentar kemudian ukur suhu campuran dan catat hasilnya. V. DATA PENGAMATAN Bahan Suhu awal (oC) HCl 1 M, 2 mL Air suling, 10 mL Air suling, 10 mL Penambahan Suhu akhir pencampuran Jenis Reaksi Eksoterm Endoterm NaOH 1 M Urea Detergen VI. DISKUSI 1. Dari data percobaan yang diperoleh, golongkan jenis reaksi yang terjadi pada. (a) HCl(aq) + NaOH(aq) (b) Urea dilarutkan dalam air (c) Detergent dilarutkan dalam air 2. Pelarutan NaOH padat dengan air pada tabung reaksi, larutnya NaOH disertai kenaikan suhu pada tabung reaksi. Dalam proses pelarutan tersebut, yang mana disebut dengan sistem dan lingkungan? 11 PERCOBAAN V PENENTUAN KALOR REAKSI MENGGUNAKAN KALORIMETER I. TUJUAN PERCOBAAN Menentukan ∆H reaksi netralisasi menggunakan kalorimeter sederhana II. DASAR TEORI Panas netralisasi adalah jumlah panas yang dilepaskan ketika 1 mol air terbentuk akibat reaksi netralisasi asam oleh basa atau sebaliknya. Kalorimeter merupakan alat yang di gunakan untuk mengukur perubahan panas. Hal ini karena kalorimeter mengisap panas, sehingga tidak semua panas terukur. Kalorimeter yang di gunakan dalam keadaan sederhana adalah kalorimeter adiabatik. Di laboratorium alat ini merupakan alat ukur yang teliti dan secara sederhana kita mengatakan bahwa bejana panas mengalir ke dalam atau keluar dari sistem. Prinsip pada kalor netralisasi adalah Azas Black, yang menyatakan bahwa kalor yang dilepas sama dengan kalor yang diterima. Kalor netralisasi adalah panas yang timbul pada penetralan asam atau basa kuat, tetap untuk tiap-tiap mol H2O yang terbentuk. Bila asam lemah, kalor netralisasi tidak tetap, karena ada kalor untuk ionisasi. Cara kerja kalorimeter adalah sebagai berikut: Sebelum zat-zat pereaksi direaksikan di dalam kalorimeter, terlebih dahulu suhunya diukur, dan usahakan agar masing-masing pereaksi ini memiliki suhu yang sama. Setelah suhunya diukur kedua larutan tersebut dimasukkan ke dalam kalorimeter sambil diaduk agar zat-zat bereaksi dengan baik, kemudian suhu akhir diukur. Jika reaksi dalam kalorimeter berlangsung secara eksoterm maka kalor yang timbul akan dibebaskan ke dalam larutan itu sehingga suhu larutan akan naik, dan jika reaksi dalam kalorimeter berlangsung secara endoterm maka reaksi itu akan menyerap kalor dari larutan itu sendiri, sehingga suhu larutan akan turun. Besarnya kalor yang diserap atau dibebaskan reaksi itu adalah sebanding dengan perubahan suhu, kalor jenis dan massa larutan. 12 III. ALAT DAN BAHAN Alat: 1. Kalorimeter 2. batang pengaduk 3. Termometer 4. Gelas ukur Bahan: 1. larutan HCl 1 M 2. Larutan NaOH 1 M IV. PROSEDUR KERJA Penetapan Kapasitas Kalor Kalorimeter 1. Masukkan 20 mL air dingin ke dalam kalorimeter, catat suhunya sebagai Ta. 2. Masukkan 20 mL air panas ± 70 °C ke dalam gelas beaker, catat suhunya sebagai Tb lalu tambahkan segera ke dalam kalorimeter yang telah berisi air dingin. 3. Aduk dan ukur suhu campuran selama selang waktu 0,5 menit sampai suhu menunjukkan konstan. 4. Buat kurva suhu terhadap waktu pengamatan perubahan suhu campuran 5. Hitung tetapan/kapasitas panas kalorimeter. Catatan: • Massa jenis air dianggap konstan = 1 g cm–3 • Kalor jenis air dianggap konstan = 4,2 J g–1 °K–1 Penentuan Kalor Reaksi Netralisasi Larutan Asam-Basa 1. Masukkan 25 ml larutan NaOH 1 M ke dalam kalorimeter sederhana, kemudian tutup rapat dan catat suhunya. 2. Masukkan 25 ml larutan HCl 1 M ke dalam gelas ukur dan catat suhunya. (sebelum pencampuran dikondisikan agar suhu larutan NaOH = suhu larutan HCl) 3. Tuangkan larutan HCl ke dalam kalorimeter sederhana yang berisi larutan NaOH. 4. Aduk dan ukur suhu campuran selama selang waktu 0,5 menit sampai suhu menunjukkan konstan. 5. Buat kurva untuk menentukan perubahan suhu larutan 13 6. Hitung kalor reaksinya. Catatan: Massa jenis larutan = 1,03 g cm–3 Kalor jenis larutan = 3,96 J g–1 K–1 V. DATA PENGAMATAN 3. Penetapan Kapasitas Kalor Kalorimeter Suhu awal air dingin (Ta) = ... oC = ... K Suhu awal air panas (Tb) = ... oC = ... K Suhu setelah pencampuran : Waktu (men it) 0,5 1 1,5 2 2,5 3 3,5 4 4,5 5 Suhu (oC) 4. Penentuan Kalor Reaksi Netralisasi Larutan Asam – Basa Suhu awal HCl (T1) = ... oC = ... K Suhu setelah pencampuran : Waktu (menit) 0,5 1 1,5 2 2,5 3 3,5 4 4,5 5 Suhu (oC) Perhitungan kapasitas kalor kalorimeter Massa air (m) = volume air x massajenis air 14 = ... mL x ... g/mL = ... g Kalor yang dihasilkan (q) q = m x c x ∆T = ... g x... J K-1 g-1x ... K = ... J = ... kJ Jumlah kalor yang dilepas dan diterima q lepas = q terima q air panas = q air dingin + q kalorimeter ( m x c x ∆Tair panas) = ( m x c x ∆Tair dingin) + ( C x ∆Tkaloimeter) ............................ = ....................................................... ............................ = ....................................................... C = ... J K-1 Perhitungan kalor reaksi netralisasi Massalarutan (m) = volume larutan x massajenis larutan = ... mL x ... g/mL = ... g q larutan = m x c x ∆T = ... g x... J K-1 g-1x ... K = ... J Jumlah kalor yang dilepasdan diterima q reaksi= -(q larutan +q kalorimeter) Jadi ΔH reaksi = -q reaksi = ... Joule q kalorimeter = C x ∆T = ... J K-1x ... K = ... J VI. DISKUSI 1. Dengan menggunakan data percobaan, hitung capasitas panas dari kalorimeter 2. Hitung perubahan panas reaksi (ΔH) dari reaksi NaOH dengan HCl berdasarkan hasil percobaan. 15 PERCOBAAN VI. LAJU REAKSI Pengaruh luas pemukaan, konsentrasi dan suhu terhadap laju reaksi 1. TUJUAN PERCOBAAN Menganalisis pengaruh luas permukaan terhadap laju reaksi Menganalisis pengaruh konsentrasi terhadap laju reaksi Menganalisis pengaruh suhu terhadap laju reaksi II. DASAR TEORI Laju reaksi kimia bertambah dengan naiknya suhu, umumnya kenaikan suhu sebesar 100Celcius menyebabkan kenaikan laju reaksi 2 sampai 3 kali.kenaikan laju reaksi ini dapat diterangkan dari gerak molekulnya.molekul molekul dalam suatu zat kimia selalu bergerak-gerak. Oleh karena itu, Kemungkinan terjadi tabrakan antar molekul selalu ada.Tabrakan yang efektif Dapat menghasilkan suatu reaksi.Energi yang dapat menghasilkan tabrakan yang efektif disebut energy pengaktifan. Pada suhu tertentu ada molekul molekul yang bertabrakan secara efektif dan ada yang bertabrakan tidak efektif.Menaikkan suhu reaksi berarti menambah Energi.energi diserap oleh molekul molekul sehingga energy kinetic molekul menjadi lebih besar.Akibatnya,molekul molekul bergerak lebih cepat dan tabrakan dengan benturan yang lebih besar sering terjadi.Jadi,benturan antara molekul yang mempunyai energy kinetiikyang cukup tinggi menyebabkan reaksi kimia juga makin banyak terjadi berarti pula laju reaksi makin tinggi dengan naiknya temperatur. 16 III. ALAT DAN BAHAN Alat: 6. Tabung reaksi 7. Neraca analitik 8. Stopwatch Bahan: 1. Kulit telur 2. Cuka IV. PROSEDUR KERJA Percobaan 1. PENGARUH LUAS PERMUKAAN TERHADAP LAJU REAKSI 1. Siapkan kulit telur dalam tiga variasi ukuran ( ukuran sedang, ukuran kecil dan serbuk) yang dibuat dengan cara menggunting, ditumbuk atau diremas dengan tangan. 2. Timbang ketiga kulit telur dalam berat yang sama. 3. Masukkan masing-masing 5 mL asam cuka ke dalam 3 buah tabung reaksi. 4. Masukkan kulit telur ukuran sedang pada tabung reaksi 1, ukuran kecil dalam tabung reaksi 2 dan ukuran serbuk pada tabung reaksi 3. 5. Amati perubahan yang terjadi dan catat waktunya. V. A. DATA PENGAMATAN Ukuran Kulit Telur Tabung 1: ( 1 gram kulit telur ukuran sedang) Tabung 2 : ( 1 gram kulit telur ukuran kecil) Tabung 3 : (1 gram kulit telur ukuran serbuk) Cuka ( mL) Buih Waktu muncul Jumlah buih* 5 mL 5 mL 5 mL Jumlah buih : diisi dengan hasil pengamatan banyak atau sedikit buih Percobaan 2. PENGARUH KONSENTRASI TERHADAP LAJU REAKSI 1. Buatlah 3 konsentrasi larutan asam cuka yang berbeda (1) 10 mL asam cuka + 0 mL air, (2) 5 mL asam cuka + 5 mL air, dan (3) 3 mL asam cuka + 7 mL air. 2. Masukkan masing-masing larutan asam cuka tersebut ke dalam tabung reaksi 17 3. Tambahkan serbuk kulit telur dengan berat yang sama ke dalam masingmasing tabung reaksi yang sudah berisi larutan asam cuka. 4. Amati adanya buih dan Catat waktunya. V.B. DATA PENGAMATAN Konsentrasi Cuka Tabung 1: 10 mL Cuka Tabung 2 : 5 mL cuka + 5 mL air Tabung 3 : 3 mL cuka + 7 mL air Kulit telur (gram) Buih Waktu muncul Jumlah buih* 1 gram 1 gram 1 gram Jumlah buih : diisi dengan hasil pengamatan banyak atau sedikit buih Perconaan 3. PENGARUH SUHU TERHADAP LAJU REAKSI No 1 2 3 4 5 6 7 Alat dan Bahan Gelas kimia ukuran 100 mL Termometer Stopwatch Air panas Air dingin/air es Air suhu ruang (±25oC) Vitamin C (Redoxon) Jumlah 3 1 1 25 mL 25 mL 25 mL 3 tablet 4. Siapkan gelas gelas kimia ukuran 100 mL sebanyak 3 buah selanjutnya pada gelas kimia 1 tambahkan 25 mL air panas, gelas kimia 2 tambahkan 25 mL air suhu ruang dan pada gelas kimia 3 tambahkan 25 mL air dingin. 5. Masukkan Vitamin C dengan berat yang sama secara bersamaan ke dalam masing-masing gelas kimia. 6. Catat waktu yang dibutuhkan untuk melarutkan semua vitamin C masing-masing gelas kimia berisi air tersebut. pada V.C. DATA PENGAMATAN Vitamin C Air panas Hasil Pengamatan Air suhu ruang Air dingin Waktu mulai pelarutan Waktu vitamin C habis terlarut Waktu total pelarutan 18 VI. DISKUSI 1. Tuliskan reaksi yang terjadi antara bahan pada kulit telur (CaCO3) dengan CH3COOH 2. Laju reaksi antara CH3COOH dengan CaCO3 yang terkandung pada kulit telur sangat dipengaruhi oleh luas permukaan kulit telur. Dari hasil percobaan reaksi CH3COOH dengan 3 ukuran kulit telur yang berbeda (ukuran sedang, ukuran kecil dan serbuk), urutkan laju reaksi yang terjadi (dari yang paling cepat ke yang paling lambat). Kemudian beri alasan mengapa demikian? 3. Pelarutan vitamin C (asam askorbat) menggunakan air dingin, air suhu normal dan air panas berlangsung pada laju yang berbeda-beda. Bagaimana pengaruh temperatur terhadap laju pelarutan vitamin C tersebut?. Mengapa demikian? 19 PERCOBAAN VII KESETIMBANGAN KIMIA Perubahan suhu dan konsentrasi pereaksi terhadap pergeseran kesetimbangan reaksi I. TUJUAN PERCOBAAN 1. Menganalisis pengaruh perubahan suhu dan konsentrasi pereaksi terhadap arah pergeseran kesetimbangan 2. Menghitung harga konstanta kestimbangan dari data hasil percobaan II. DASAR TEORI Kesetimbangan dalam larutan adalah keadaan ketika laju reaksi pembentukan ion dari molekulnya sama dengan laju reaksi pembentukan molekul dari ionnya. Pada saat reaktan berkurang laju reaksi maju menurun, sedang pada saat hasil reaksi bertambah dan laju reaksi balik naik. Pada saat reaksi maju sama dengan laju reaksi balik maka kesetimbangan kimia terjadi. Sesuai dengan azas Le Chatelier yang berbunyi “bila terhadap suatu kesetimbangan dilakukan suatu tindakan (aksi) maka system itu akan mengadakan reaksi yang cenderung mengurangi pengaruh aksi tersebut. Reaksi sestem terhadap aksi dari luar adalah dengan melakukan pergeseran kesetimbangan ke kiri atau ke kanan. Salah satu kegunaan konstanta kesetimbangan kimia adalah memprediksi arah reaksi. Untuk mempelajari kecenderungan arah reaksi, digunakan besaran Qc, yaitu hasil perkalian konsentrasi awal produk dibagi hasil perkalian konsentrasi awal reaktan yang masing-masing dipangkatkan dengan koefisien reaksinya. Jika nilai Qc dibandingkan dengan nilai Kc, terdapat tiga kemungkinan hubungan yang terjadi, antara lain : 1. Qc < Kc berarti terjadi peningkatan jumlah reaktan dan kekurangan produk. Untuk mencapai kesetimbangan, sejumlah reaktan diubah menjadi produk. Akibatnya, reaksi cenderung ke arah produk. 20 2. Qc = Kc berarti reaksi berada dalam keadaan kesetimbangan.dimana laju reaksi ke arah reaktan maupun produk adalah sama. 3. Qc > Kc berarti peningkatan jumlah produk dan kekurangan reaktan. Untuk mencapai kesetimbangan, sejumlah produk diubah menjadi reaktan. Akibatnya, reaksi cenderung ke arah reaktan. Reaksi kimia pada umumnya berada keadaan stimbang. Reaksi pada keadaan stimbang dapat dikenal dari sifat makroskopisnya. Sifat makroskopik yang paling mudah untuk mengamati keadaan setimbang adalah warna dimana warna larutan yang tidak berubah pada suhu tetap setelah dicapai keadaan setimbang. III. ALAT DAN BAHAN Alat: 1. Batang pengaduk 2. Gelas kimia 100 mL 3. Gelas ukur 25 mL 4. Pipet tetes 5. Tabung reaksi Bahan: 1. Larutan FeCl3 1M 2. Larutan KSCN 1M 3. Larutan Na2HPO4 1 M IV. PROSEDUR KERJA Percobaan 1: PENGARUH KONSENTRASI PEREAKSI TERHADAP PERGESERAN KESETIMBANGAN 1. Masukkan sebanyak 25 mL air suling ke dalam gelas kimia 100 mL 2. Tambahkan 3 tetes larutan KSCN 1 M dan 3 tetes larutan FeCl3 ke dalam gelas kimia tersebut kemudian aduk hingga bercampur sempurna. 3. Masukkan masing-masing 5 mL campuran tersebut ke dalam 5 buah tabung reaksi. 4. Lakukan tahapan percobaan berikut. a. Tabung reaksi 1 : gunakan sebagai kontrol b. Tabung 2: tambahkan FeCl3 1 M sebanyak 3 tetes c. Tabung 3 : tambahkan KSCN 1 M sebanyak 3 tetes d. Tabung 4. tambahkan Na2HPO4 sebanyak 3 tetes e. Tabung 5: tambahkan air suling sebanyak 3 tetes 21 5. Bandingkan warna larutan pada tabung 2,3,4 dan 5 dengan warna larutan pada tabung 1 (kontrol) V.A. DATA PENGAMATAN Tab. 1 2 3 4 5 Perlakuan Perubahan warna (dibandingkan dengan tabung 1) Arah pergeseran kestimbangan Warna larutan pada tabung 1 : ............................................................. Penambahan FeCl3 Penambahan KSCN Penambahan Na2HPO4 Penambahan air suling Percobaan 2: PENGARUH SUHU TERHADAP PERGESERAN KESETIMBANGAN No. 2. 2 3. 4. 5. Alat Tabung reaksi Rak tabung reaksi Pipet tetes Gelas kimia Penjepit Bahan Iodine Pati Air Es batu 1. Masukkan sebanyak 5 tetes iodine kedalam gelas kimia yang telah berisi 25 mL larutan pati. 2. Masukkan masing-masing 5 mL larutan iodine-pati ke dalam 3 buah tabung reaksi. Tandai tabung tersebut (misal tabung 1, 2 dan 3) 3. Lakukan tahapan percobaan berikut. a. Tabung reaksi 1 : gunakan sebagai kontrol b. Tabung 2 : dipanaskan dalam penangas air suhu ± 70oC c. Tabung 3 : Direndam dalam air es 4. Bandingkan perubahan warna larutan iodine-pati pada tabung 2 dan 3 dengan larutan iodine-pati pada tabung 1. 22 V.B. DATA PENGAMATAN Tab. Perlakuan 1 2 3 4 5 Perubahan warna (dibandingkan dengan tabung 1) Arah pergeseran kestimbangan Warna larutan pada tabung 1 : ............................................................. Penambahan FeCl3 Penambahan KSCN Penambahan Na2HPO4 Penambahan air suling VI. DISKUSI 1. Reaksi kestimbangan Fe3+ dengan SCN- ditulis sebagai berikut. Fe3+ (aq) + SCN- (aq) Fe(SCN)2+(aq) kearah mana reaksi kestimbangan akan bergeser jika : a. ditambahkan Fe3+ b. ditambahkan SCNc. ditambahkan Na2HPO4 2. Mengapa terjadi perubahan warna pada larutan kompleks iodine-pati jika direndam dalam air panas maupun air es? 23 PERCOBAAN VIII. TITRASI ASAM-BASA Penentuan konsentrasi asam menggunakan basa kuat secara titrasi netralisasi I. TUJUAN PERCOBAAN Menentukan titik akhir dari titrasi asam lemah dengan basa kuat Menentukan konsentrasi larutan asam lemah menggunakan basa kuat II. DASAR TEORI Titrasi merupakan suatu metoda untuk menentukan kadar suatu zat dengan menggunakan zat lain yang sudah dikethaui konsentrasinya. Titrasi asam basa disebut juga titrasi netralisasi yaitu terjadinya reaksi asam dengan basa menghasilkan garam dan air. Zat yang digunakan untuk menitrasi disebut dengan titrant sedangkan zat yang dititrasi disebut dengan titrat. Titrant dialirkan ke dalam titrat sedikit demi sedikit melalui buret sampai mencapai keadaan ekuivalen ( artinya secara stoikiometri titrant dan titrat tepat habis bereaksi). Keadaan ini disebut sebagai “titik ekivalen”. Pada saat titik ekivalen tercapai, maka proses titrasi dihentikan, kemudian kita mencatat volume titrant yang diperlukan untuk mencapai keadaan tersebut. Dengan menggunakan data volume titrant, volume dan konsentrasi titrat dapat ditentukan. Dalam prakteknya, penghentian titrasi dilakukan pada saat terjadinya titik akhir titrasi dengan menggunakan bantuan indikator. Untuk menghindari kesalahan titrasi tinggi, indikator yang digunakan harus sesuai yaitu mampu menunjukkan perubahan warna yang jelas pada saat tercapainya titik akhir titrasi dan titik akhir titrasi harus mendekati keadaan titik ekivalen. Beberapa contoh indikator asam-basa beserta trayek pHnya adalah sebagai berikut Indikator Trayek pH Perubahan warna Metil jingga 3,1-4,4 Merah-jingga Metil merah 4,2-6,2 Merah-kuning Bromothimol biru 6,0-7,6 Kuning-biru Phenolphtalein 8,3-10,0 Tak berwarna-merah 24 Pada saat titik ekivalen maka mol-ekivalen asam akan sama dengan molekivalen basa, maka hal ini dapat kita tulis mol-ekivalen asam = molekivalen basa Mol-ekivalen diperoleh dari hasil perkalian antara Normalitas dengan volume maka rumus diatas dapat kita tulis sebagai NxV asam = NxV basa. Normalitas diperoleh dari hasil perkalian antara molaritas (M) dengan jumlah ion H+ pada asam atau jumlah ion OH- pada basa, sehingga rumus diatas menjadi: nxMxV asam = nxVxM basa, dimana N = Normalitas,V = Volume, M = Molaritas, n = jumlah ion H+ atau OH– III. ALAT DAN BAHAN No. 1 2 3. 4. 5. 6 Alat Buret Erlenmeyer Pipet tetes Gelas kimia Statif dan klem Corong Bahan Larutan asam asetat Larutan NaOH 0,1 M Indikator PP IV. PROSEDUR KERJA 1. Rangkai peralatan titrasi seperti pada gambar berikut. 2. Masukkan 10 mL larutan asam asetat ke dalam erlenmeyer ukuran 100 mL menggunakan pipet volume. 25 3. Tambahkan 3 tetes indikator PP ke dalam erlenmeyer yang telah berisi asam asetat. 4. Isi buret ukuran 25 mL dengan larutan NaOH 0,1 M dan atur volumenya hingga tepat 25 mL. 4. Titrasi larutan asam asetat dengan menggunakan larutan NaOH 0,1 M sampai terjadi perubahan warna menjadi merah muda, kemudian catat volume NaOH yang digunakan. 5. Ulangi prosedur di atas hingga 3 kali. V. DATA PENGAMATAN No. titrasi Volume larutan CH3COOH Volume NaOH 0,1 M yang (mL) digunakan ( mL) 1 10,00 2 10,00 3 10,00 Volume rata-rata NaOH VI. DISKUSI 1. Kapan kita menghentikan proses tititrasi asam asetat dengan larutan NaOH menggunakan indikator PP? 2. Mengapa indikator PP yang digunakan sebagai indikator dalam titrasi asam asetat dengan larutan NaOH? 3. Jika di laboratorium tidak tersedia indikator PP, namun yang ada adalah metil jingga, metil merah dan bromothymol biru. Indikator mana yang paling baik untuk menggantikan PP dalam menitrasi asam asetat dengan NaOH 4. Dengan menggunakan data volume larutan NaOH 0,1 M yang digunakan untuk menitrasi larutan asam asetat (CH 3COOH), hitunglah konsentrasi larutan CH3COOH dalam satuan Molar (M) dan Normal (N) 26 PERCOBAAN IX GARAM TERHIDROLISIS Penentuan jenis garam yang mengalami hidrolisis I. TUJUAN PERCOBAAN Menentukan jenis garam yang mengalami hidrolisis II. DASAR TEORI Hidrolisis Garam adalah proses larutnya sebagian atau seluruh garam yang bereaksi dengan air. Garam sendiri adalah hasil pencampuran larutan asam dan larutan basa. Namun demikian, garam dapat bersifat asam, basa, dan netral. Sifat garam tersebut tergantung pada jenis komponen atau kekuatan asam dan basa yang menyusunnya. Garam yang tersusun dari asam kuat dan basa kuat tidak terhidrolisis sehingga bersifat netral PH = 7. Garam yang tersusun dari asam kuat dan basa lemah akan terhidrolisis sebagian sehingga bersifat asam PH < 7. Garam yang tersusun dari asam lemah dan basa kuat juga akan terhidrolisis sebagian yang membuat sifat garam tersebut basa PH > 7. Garam yang terbentuk dari asam lemah dan basa lemah akan terhidrolisis sempurna sehingga sifat garam tersebut netral PH = 7. III. ALAT DAN BAHAN No. 1 2 Alat Pipet tetes Plak tetes Bahan 1.Kertas lakmus merah 2. Kertas lakmus biru 3. NaCl 4. Na2CO3 IV. PROSEDUR KERJA 1. Tempatkan 1 mL larutan NaCl, Na2CO3 masing-masing kedalam 2 cekungan/lubang plak tetes 2. Beri label nama setiap jenis larutan 27 3. Letakkan kertas lakmus merah dan lakmus biru pada setiap jenis larutan. 4. Amati dan catat perubahan warna dari kertas lakmus. V. DATA PENGAMATAN Nama larutan Warna kertas lakmus merah Warna kertas lakmus biru Sifat NaCl Na2CO3 CH3COONa NH4Cl VI. DISKUSI 1. Dari data perubahan warna kertas lakmus merah dan lakmus biru setelah dimasukkan ke dalam larutan uji, larutan mana yang termasuk garam terhidrolisis dan garam bukan terhidrolisis. 2. Apakah garam KCl termasuk garam terhidrolisis atau tidak, jelaskan 28 PERCOBAAN X SIFAT LARUTAN PENYANGGA I. TUJUAN PERCOBAAN Mengukur PH larutan penyangga asam dan basa dengan penambahan sedikit asam, sedikit basa, dan pengenceran dengan air II. DASAR TEORI Larutan penyangga, larutan dapar, atau buffer adalah larutan yang digunakan untuk mempertahankan nilai pH tertentu agar tidak banyak berubah selama reaksi kimia berlangsung. Sifat yang khas dari larutan penyangga ini adalah pH-nya hanya berubah sedikit dengan pemberian sedikit asam kuat atau basa kuat. Larutan penyangga tersusun dari asam lemah dengan basa konjugatnya atau oleh basa lemah dengan asam konjugatnya. Reaksi di antara kedua komponen penyusun ini disebut sebagai reaksi asam-basa konjugasi. Adanya larutan penyangga ini dapat kita lihat dalam kehidupan sehari-hari seperti pada obat-obatan, fotografi, industri kulit dan zat warna. Selain aplikasi tersebut, terdapat fungsi penerapan konsep larutan penyangga ini dalam tubuh manusia seperti pada cairan tubuh. Cairan tubuh ini bisa dalam cairan intrasel maupun cairan ekstrasel. Dimana sistem penyangga utama dalam cairan intraselnya seperti H2PO4- dan HPO42- yang dapat bereaksi dengan suatu asam dan basa. Adapun sistem penyangga tersebut, dapat menjaga pH darah yang hampir konstan yaitu sekitar 7,4. Selain itu penerapan larutan penyangga ini dapat kita temui dalam kehidupan sehari-hari seperti pada obat tetes mata. Pada obat tetes mata mempunyai pH yang sama dengan cairan tubuh kita, agar tidak menimbulkan efek samping. 29 III. ALAT DAN BAHAN Alat 1. Gelas kimia 2. Gelas ukur 3. Tabung reaksi 4. Pipet tetes Bahan 1. CH3COOH 0,1 M 2. CH3COONa 0,1 M 3. NaOH 0,1 M 4. HCl 0,1 M 5. Indikator universal IV. PROSEDUR KERJA 1. Masukkan 10 mL larutan CH3COOH 0,1 M dan ukur pHnya menggunakan indikator universal kemudian tambahkan 10 mL larutan CH3COONa 0,1 M. Ukur juga pH CH3COONa sebelum dicampurkan. 2. Aduk campuran, kemudian diamkan sebentar dan diukur kembali pHnya dengan indikator universal. 3. Masukkan campuran di atas sebanyak masing-masing 5 mL ke dalam 3 tabung reaksi (A, B dan C). Kemudian tambahkan masing-masing 1 mL air suling. 4. Amati dan ukur kembali pH larutan dan catat hasilnya. 5. Lakukan langkah berikut: (a) tambahkan 1 tetes larutan HCl 0,1 M ke dalam tabung reaksi B, dan (b) tambahkan 1 tetes larutan NaOH 0,1 M ke dalam tabung reaksi C 6. Kocok pelan-pelan tabung reaksi A, B dan C, kemudian ukur kembali pHnya dengan indikator universal dan catat hasilnya. V. DATA PENGAMATAN Larutan pH awal pH setelah penambahan 1 mL 1 tetes NaOH 1 tetes HCl Air 0,1 M 0,1 M CH3COOH CH3COONa CH3COOH + CH3COONa VI. DISKUSI 1. Apakah campuran CH3COOH + CH3COONa berubah pHnya setelah penambahan (a) air, (b) 1 tetes NaOH 0,1 M dan (c) 1 tetes HCl 0,1 M?. Mengapa demikian? 30 2. Bagaimana cara kerja larutan penyangga dalam mempertahankan pH dengan penambahan sedikit asam atau basa? 31 PERCOBAAN XI SIFAT KOLIGATIF LARUTAN KENAIKAN TITIK DIDIH DAN PENURUNAN TITIK BEKU I. TUJUAN PERCOBAAN Mengetahui kenaikan titik didih dan penurunan titik beku beberapa larutan. II. DASAR TEORI Sifat koligatif larutan didefinisikan sebagai sifat fisik larutan yang hanya ditentukan oleh jumlah partikel dalam larutan dan tidak tergantung pada jenis partikelnya. Adanya zat pelarut didalam pelarut menyebabkan perubahan sifat fisik pelarut dan larutan tersebut. Sifat fisik yang mengalami perubahan misalnya, penurunan tekanan uap, penurunan titik beku, kenaikan titik didih, dan tekanan osmosis. Keempat sifat tersebut merupakan bagian dari sifat koligatif larutan. Titik didih suatu zat cair adalah suhu pada saat tekanan uap zat cair tersebut sama dengan tekana atmosfer di sekitarnya. Pada saat zat cair mencapai titk didih, tekanan zat cair cukup tinggi untuk menyebabkan penguapan pada setiap titik di dalam zat cair itu. Proses mendidih suatu zat cair dapat diamati dengan timbulnya gelembung-gelembung udara yang terbentuk secara terus-menerus pada berbagai bagian dalam zat cair itu. Dengan adanya zat-zat terlarut dalam suatu zat cair, misalnya larutan garam, maka titik didih zat cair itu akan naik. Kenaikan titik didih ini sebanding dengan konsentrasi zat terlarut. Bila konsentrasi zat terlarut semakin kecil, makan kenaikan titik didih juga semakin kecil, dan sebaliknya. Jadi, dengan adanya zat terlarut dalam air, maka titik didih air menjadi lebih besar dari 100ºC pada tekanan 1 atmosfer Peningkatan titik didih sebanding dengan konsentrasi fraksi molnya. Untuk larutan encer, perbandingannya dinyatakan dalam molalitas. Peningkatan titik didih dirumuskan: ∆TB = m . KB 32 Keterangan : ∆ Tb = besar penurunan titik didih KB = konstanta kenaikan titik didih m = molalitas dari zat terlarut Titik didih suatu larutan dapat lebih tinggi maupun lebih rendah dari pada titik didih pelarut, bergantung pada kemudahan zat terlarut itu menguap, dibandingkan dengan pelarutnya. Jika zat terlarut itu tak atsiri (tidak mudah menguap) misalnya gula, larutan air mendidih pada temperatur yang lebih tinggi dari pada titik didih air, jika zat terlarut itu mudah menguap misalnya alkohol, larutan air mendidih pada temperatur di bawah titik didih air. Titik beku suatu larutan adalah temperatur pada saat tekanan uapnya sama dengan tekanan uap pelarut. Karena tekanan uap lebih rendah daripada pelarutnya, larutan belum membeku pada temperatur 0ºC. Oleh karena itu, temperatur harus diturunkan agar larutan dapat membeku. Jika temperatur terus diturunkan, suatu saat pelarut akan membeku ( berubah menjadi pelarut padat ). Penurunan tekanan uap pada pelarut padat lebih cepat daripada zat cair. Akibatnya, pada temperatur dibawah titik beku pelarut terjadi kesetimbangan tekanan uap larutan dengan tekanan uap pelarut padat. Pada saat seperti itu pelarut akan membeku, sedangkan zat terlarutnya masih dalam fase cair. Hal itu menyebabkan larutan menjadi makin pekat sehingga titik bekunya makin rendah. Dengan kata lain, larutan tidak memiliki titik beku yang tetap. Hal itu menyebabkan pengertian titik beku larutan harus didefinisikan. Definisi dari titik beku larutan adalah temperatur pada saat membeku. Selisih antara titik beku pelarut dan titik beku larutan disebut penurunan titik beku (∆Tf = freezing point depression) Titik beku larutan merupakan titik beku pelarut murni dikurangi dengan penurunan titik bekunya. Pengukuran penurunan titik beku, seperti halnya peningkatan titik didih, dapat digunakan untuk menentukan massa molar zat yang tidak diketahui. Pada larutan encer, nilai fraksi mol zat terlarut sangat kecil dan jumlah pelarut sangat besar. Maka molalitas zat terlarut dapat diabaikan sehingga persamaan penurunan titik beku dirumuskan: 33 ∆Tf = m . K f Keterangan : ΔTf = penurunan titik beku m = molalitas dari zat terlarut Kf = konstanta penurunan titik beku besarnya tergantung pada jenis larutan. III. ALAT DAN BAHAN No 1 2 3 4 5 6 Alat Gelas Kimia Termometer Pembakar bunsen Spatula Spritus Es batu Bahan 1. Air 2. Gula 3. Garam dapur (NaCl) IV. PROSEDUR KERJA KENAIKAN TITIK DIDIH 1. Masukkan masing-masing 100 mL air suling ke dalam 3 buah gelas kimia. 2. Tambahkan 5 gram gula pada gelas kimia pertama dan 5 gram NaCl pada gelas kimia kedua. 3. Panaskan ketiga gelas kimia tersebut dan catat suhu pelarut (air suling) dan larutan (larutan NaCl dan larutan gula) setiap 5 menit sampai mendidih. V.A. DATA PENGAMATAN Waktu (menit) Suhu Air suling (oC) Suhu Larutan NaCl (oC) Suhu Larutan gula (oC) 0 5 10 15 20 25 30 34 PENURUNAN TITIK BEKU Percobaan 1. 9. Masukkan 100 mL es batu yang telah dihancurkan kedalam 3 gelas kimia yang diberi label A, B dan C. 10. Ukur suhu es batu yang ada di gelas kimia A 11. Tambahkan 1 gram gula pada gelas kimia B sambil diaduk, kemudian diukur suhunya 12. Tambahkan 5 gram gula pada gelas kimia C sambil diaduk, kemudian diukur suhunya Percobaan 2. 13. Masukkan 100 mL es batu yang telah dihancurkan kedalam 3 gelas kimia yang diberi label A, B dan C. 14. Ukur suhu es batu yang ada di gelas kimia A 15. Tambahkan 1 gram garam dapur (NaCl) pada gelas kimia B sambil diaduk, kemudian diukur suhunya. 16. Tambahkan 5 gram garam dapur (NaCl) pada gelas kimia C sambil diaduk, kemudian diukur suhunya V.B. DATA PENGAMATAN Waktu (menit) Suhu Es batu (oC) Suhu Es batu +Gula (oC) 1 gram 5 gram Suhu Es batu + NaCl (oC) 1 gram 5 gram 0 1 2 3 4 5 35 VI. DISKUSI 4. Bagaimana perbandingan titik didih tiap larutan dengan titik didh pelarut murni (air)? 2. Dengan menggunakan data percobaan kenaikan titik didih, hitunglah kenaikan titik didih larutan dan bandingkan hasilnya dengan kenaikan titih didih larutan secara teoritis. 3. Dengan menggunakan data percobaan penurunan titik beku, hitunglah penurunan titik beku larutan dan bandingkan hasilnya dengan penurunan titik beku larutan secara teoritis. 36 PERCOBAAN XII ELEKTROLISIS LARUTAN I. TUJUAN PERCOBAAN Menyelidiki reaksi-reaksi yang terjadi di anode dan katoda pada sel elektrolisis Menentukan rasio volume gas H2 dan O2 yang dihasilkan pada elektroda pada elektrolisis larutan NaOH Mengidentifikasi hasil reaksi (sifat asam-basa) di anode dan katode pada elektrolisis larutan NaOH dan NaCl II. DASAR TEORI Pada sel elektrolisis terjadi reaksi redoks , yaitu reaksi reduksi dan oksidasi yang berjalan dalam satu waktu . pada sel elektrolisis terdiri dua elektroda yaitu kutub katoda ( kutub negatif ) terjadi reaksi reduksi. Dan kutub anoda ( kutub positif ) terjadi reaksi oksidasi. Electrolysis adalah dekomposisi suatu senyawa dengan arus listrik. Reaksi oksidasi reduksi pada sel elektrolisis dapat ditunjukan adanya peristiwa perbedaan zat yang dihasilkan pada kedua elektrode. Dengan menggunakan indicator tertentu dapat diamati sifat - sifat zat hasil elektrolisis baik disekitar katoda dan anode. III. ALAT DAN BAHAN No 1 2 3 4 Alat Gelas Kimia Peralatan elektrolisis Batang pengaduk Sumber arus Bahan 1. 2. 3. 4. Air suling Larutan NaOH 1 M Larutan NaCl 1 M Indikator PP IV. PROSEDUR KERJA Percobaan 1: ELEKTROLISIS LARUTAN NaOH 1. Tempatkan 100 mL larutan NaOH kedalam beaker gelas, kemudian tambahkan 5 tetes indikator PP. 2. Tuangkan larutan tersebut pada peralatan elektrolisis 37 5. Dengan menggunakan syringe, isi kedua elektroda dengan larutan NaOH dan jepit selang menggunakan penjepit jika masing-masing elektrode sudah penuh dengan larutan NaOH.(penjepit berfungsi untuk mempertahankan agar larutan NaOH tidak keluar dari masing-masing elektrode) 3. Hubungkan masing-masing elektrode dengan sumber arus DC 9 Volt. 4. Amati reaksi elektrolisis yang terjadi dan cata volume gas yang dihasilkan pada anode dan katode. 9. Amati pula perubahan warna larutan yang terjadi di anode dan katode V.A. DATA PENGAMATAN Elektrolisis larutan NaOH Yang diamati Hasil pengamatan Sebelum proses elektrolisis Setelah proses elektrolisis Anode Katode Anode Katode Volume gas Warna larutan Percobaan 2: ELEKTROLISIS LARUTAN NaCl 1. Tempatkan 100 mL larutan NaCl kedalam beaker gelas, kemudian tambahkan 5 tetes indikator PP. 2. Tuangkan larutan tersebut pada peralatan elektrolisis 6. Dengan menggunakan syringe, isi kedua elektroda dengan larutan NaCl dan jepit selang menggunakan penjepit jika masing-masing elektrode sudah penuh dengan larutan NaCl.(penjepit berfungsi untuk mempertahankan agar larutan NaCl tidak keluar dari masing-masing elektrode) 3. Hubungkan masing-masing elektrode dengan sumber arus DC 9 Volt. 4. Amati reaksi elektrolisis yang terjadi dan catat volume gas yang dihasilkan pada anode dan katode. 10. Amati pula perubahan warna larutan yang terjadi di anode dan katode 38 V. B. DATA PENGAMATAN Elektrolisis larutan NaCl Yang diamati Hasil pengamatan Sebelum proses elektrolisis Setelah proses elektrolisis Anode Katode Anode Katode Volume gas Warna larutan VI. DISKUSI 1. Tuliskan reaksi di anode dan di katode pada elektrolisis larutan NaOH. 2. Amati rasio volume gas yang terbentuk di anoda dan di katoda. Bandingkan dengan hasil teoritisnya, apakah sesuai dan mengapa demikian? 3. Mengapa terjadi perbedaan warna larutan pada anode dan katode? 4. Tuliskan reaksi yang terjadi di anode dan katode pada elektrolisis larutan NaCl 5. Mengapa terjadi perbedaan warna larutan pada anode dan katode? 39 Lampiran 2. Lembar Kerja Siswa Praktikum Kimia Sederhana SMA Hasil Pelatihan.