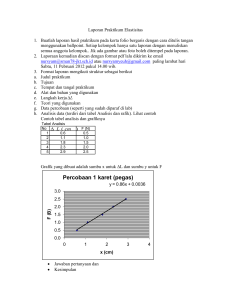
laporan praktikum mikrobiologi akuakultur kelompok iv mayor ilmu
advertisement

LAPORAN PRAKTIKUM MIKROBIOLOGI AKUAKULTUR KELOMPOK IV STEFANNO. M. A. RIJOLY C151140401 MAYOR ILMU AKUAKULTUR SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR 2014 KATA PENGANTAR Puji syukur penulis ucapkan kepada Allah Yang Maha Kuasa, karena atas kasih sayang dan penyertaanNya penulis mampu untuk menyelesaikan laporan praktikum Mikrobiologi akuakultur. Laporan ini disusun sebagai syarat dari praktikum mata kuliah mikrobiologi dalam program studi Akuakultur, Sekolah Pasca Sarjana, Institut Pertanian Bogor. Penulis menyadari bahwa penulisan laporan praktikum ini jauh dari sempurna dan tentu masih banyak kekurangan dan kesalahan yang tidak disadari penulis. Oleh karena itu kritik dan saran kearah perbaikan akan penulis terima dengan tangan terbuka. Pada kesempatan ini penulis mengucapkan terima kasih kepada para dosen mata kuliah Mikrobiologi Akuakultur yaitu Dr. Ir. Widanarni M.Si, Dr. Dinamella Wahjuningrum S.Si, M.Si dan Dr. Munti Yuhana S.Pi, M.Si yang sudah memberi pengarahan sebagai bekal awal menjalankan praktikum. Terima kasih juga penulis sampaikan kepada Pak Rahman S.Pi M.Si dan Pak Ranta yang telah menyediakan waktu dan tenaga demi kelancaran praktikum. Terima kasih bagi para asisten praktikum yang telah mendampingi penulis dalam menggali ilmu dan pengalaman praktek. Terima kasih terakhir bagi rekan-rekan mahasiswa magister akuakultur 2014, menjadi rekan seperjuangan dalam berikhtiar mencari ilmu yang bermanfaat. Penulis berharap semoga laporan hasil praktikum ini dapat bermanfaat bagi pengembangan praktikum mikrobiologi akuakultur. Bogor, 5 Januari 2015 Stefanno M. A. Rijoly RIWAYAT HIDUP Penulis dilahirkan di Ambon, 4 November 1988. Anak ketiga dari enam bersaudara. Penulis mengawali pendidikan formal di SD YPPK Gembala Baik, Papua pada tahun 1994. Pendidikan dasar berlanjut di SDN 2 Poka, Ambon hingga tahun 2000. Pendidikan menengah pertama ditempuh di SMP Hang Tuah Halong pada tahun 2000 dan berlanjut ke SMPN 4 Ambon dan lulus tahun 2003, pendidikan menengah atas ditempuh di SMAN 1 Ambon. Lulus sekolah menegah atas pada tahun 2006 penulis melanjutkan jenjang pendidikan ke strata 1 dengan mengambil program studi Biologi, di Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Pattimura Ambon. Selama menempuh pendidikan strata 1 penulis aktif dalam organisasi mahasiswa seperti GMNI, KPA Patra 28. Penulis juga pernah magang di Lembaga Ilmu Pengetahuan Indonesia Ambon. Lulus dari Universitas Pattimura pada tahun 2012 penulis bekerja sebagai laboran pada Laboratorium Biologi Dasar FMIPA Universitas Pattimura. Pada bulan oktober 2013 penulis mengambil program beasiswa pramagister dari DIKTI. Sampai saat ini penulis aktif sebagai mahasiswa pasca sarjana di Departemen Manajemen Budidaya Perikanan Program Studi Akuakultur Institut Pertanian Bogor. DAFTAR ISI Halaman KATA PENGANTAR ...................................................................................... ii RIWAYAT HIDUP .......................................................................................... iii DAFTAR ISI ..................................................................................................... iv BAB I Pengenalan Alat, Penyiapan Medium, Sterilisasi Bahan dan Peralatan ......................................................................................... 1 BAB II Isolasi Bakteri dari Lingkungan Akuakultur ................................. 14 BAB III Pewarnaan Gram Bakteri ............................................................... 25 BAB IV Karakterisasi Sifat Fisiologi dan Biokimia Bakteri ...................... 36 BAB V Isolasi dan Karakteristik Fungi untuk Akuakultur ......................... 48 BAB VI Penghitungan Bakteri dengan Metode Hitungan Cawan ............... 59 BAB VII Pengaruh Suhu dan Salinitas Terhadap Viabilitas Bakteri ............ 72 BAB VIII Pengaruh Bahan Antimikroba Terhadap Viabilitas Bakteri........... 81 BAB IX Pemberian Penanda Resisten Antibiotik Pada Bakteri Akuakultur ..................................................................................... 91 BAB X Seleksi Bakteri Probiotik untuk Akuakultur .................................. 99 BAB XI Deteksi Virus dengan Teknik PCR .............................................. 111 Laporan Praktikum ke- 1 m.k. Mikrobiologi Akuakultur Hari/Tanggal : Senin, 29 September 2014 Kelompok : IV Asisten : 1. Rahman, S.Pi., M.Si 2. Asisten Mikro 2013 PENGENALAN ALAT, PENYIAPAN MEDIUM, STERILISASI BAHAN DAN PERALATAN Oleh: Stefanno M.A. Rijoly C151140401 ILMU AKUAKULTUR SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR 2014 I. PENDAHULUAN 1.1 Latar Belakang Mikrobiologi adalah sebuah telaah mengenai organisme hidup yang berukuran mikroskopis. Dunia mikroorganisme terdiri atas 5 kelompok organisme; bakteri, protozoa, virus, serta algae dan cendawan mikroskopis. Dalam bidang ini kita mempelajari banyak segi mengenai jasad-jasad renik ini; di mana adanya, ciri-cirinya, kekerabatan antara sesamanya seperti juga dengan kelompok organisme lainnya, pengendaliannya, dan peranannya dalam kesehatan serta kesejahteraan kita (Pelczar dan Chan, 2010). Kegiatan praktikum yang meliputi penyiapan medium, sterilisasi bahan dan peralatan sangat penting untuk diperhatikan praktikan. Dengan memperhatikan kegiatan praktikum tersebut akan menentukan keberhasilan dalam suatu kegiatan praktikum. Karena keberhasilan dalam kegiatan praktikum menjadi indikator bahwa persiapan awal cukup baik. Pembiakan mikroorganisme dalam laboratorium memerlukan medium yang berisi zat hara serta lingkungan pertumbuhan yang sesuai dengan lingkungan asalnya. Umumnya, medium biakan berisi air, sumber energi, zat hara sebagai sumber karbon, nitrogen, sulfur, fosfat, oksigen, hidrogen serta unsur-unsur lain. Medium berdasarkan konsistensinya dibagi menjadi 3 macam, yaitu medium padat, medium setengah padat dan medium cair. Medium padat diperoleh dengan cara menambahkan agar yang berfungsi sebagai pemadat. Medium padat biasanya digunakan untuk mengamati morfologi koloni dan untuk mengisolasi biakan murni. Medium setengah padat dibuat dengan bahan yang sama dengan media padat, akan tetapi mengandung komposisi agar yang berbeda. Medium setengah padat digunakan untuk melihat pergerakan mikroba dan kemampuan fermentasi. Medium cair adalah medium yang berbentuk cair. Medium cair dapat digunakan untuk tujuan pembiakan mikroba dalam jumlah besar (Waluyo, 2008). Sebelum mengunakan peralatan yang telah disiapkan, terlebih dahulu disterilkan agar tidak terkontaminasi oleh mikroorganisme lain dan mematikan mikroorganisme yang tidak diinginkan. Dalam penggunaan alat-alat yang telah disterilkan sangat penting untuk menjaga mikroorganisme yang ingin ditumbuhkan, supaya dapat tumbuh sesuai dengan keinginan. 1.2 Tujuan Tujuan praktikum ini yang pertama adalah untuk mengetahui alat-alat apa saja yang terdapat di laboratorium mikrobiologi, cara penggunaan yang benar serta fungsi dan spesifikasi masing-masing alat tersebut. Tujuan kedua yaitu mengetahui prosedur penyiapan media dan sterilisasi alat dan bahan. II. METODOLOGI 2.1 Waktu dan Tempat Praktikum ini dilaksanakan pada hari Senin, 29 September 2014 pukul 08.00-10.00 WIB, bertempat di Laboratorium Kesehatan Ikan, Depertemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. 2.2 Alat dan Bahan Alat yang digunakan dalam praktikum ini adalah mikroskop, autoklaf, inkubator, waterbath, shaker, sentrifuge, gelas ukur, erlenmeyer, jarum ose, cawan petri, pipet ukur, batang penyebar, bunsen, gelas beaker, biological safety cabinet (BSC), mikropipet, tabung reaksi, buret dan pipet tetes, ependof, vortex, rak alat. Bahan yang digunakan yaitu kertas bekas dan beberapa macam media bakteri dan fungi seperti PBS, TSA, SWC, PDA, MEA dan GYA. 2.3 Prosedur Kerja 2.3.1 Sterilisasi Cawan Petri dan Pipet Ambil kertas bekas yang telah disediakan, setelah itu ambil cawan petri. Kemudian letakan cawan petri diatas kertas yang telah disediakan tadi, perlahanlahan kertas itu di lipat dari semua sisi. Usahakan lipatan kertas ditata rapi, agar bakteri dari luar tidak mudah masuk. Setelah sudah selesai, cawan petri tersebut disimpan kedalam autoklaf. Untuk sterilisasi pipet, tidak jauh berbeda dengan sterilisasi cawan petri. Pertama yang dilakukan yaitu ambil kertas bekas yang telah disediakan, setelah itu ambil pipet tersebut. Kemudian ujung kertas dilipat berbentuk segitiga, setelah itu kertasnya diputar-putar pada batang pipet tersebut. Usahakan memutar kertas tersebut dengan rapi dan rapat. Tujuannya agar tidak terkontaminasi dengan bakteri yang ada di luar. Setelah selesai pipet tersebut disimpan kedalam autoklaf. 2.3.3 Pembuatan Media Media yang digunakan umumnya adalah media agar yang sudah tersedia sebagai dalam bentuk bubuk, media tersebut diambil beberapa gram masukan kedalam erlenmeyer kemudian tambahkan akuades lalu dipanaskan sekitar suhu 70°C kemudian dipindahkan dalam autoklaf dan disterilisasi menurut prosedur penggunaan autoklaf. III. HASIL DAN PEMBAHASAN 3.1 Hasil Alat-alat yang terdapat di Laboratorium Kesehatan Ikan dan yang akan digunakan dalam praktikum mikrobiologi meliputi mikroskop, autoklaf, inkubator, waterbath, shaker, sentrifuge, gelas ukur, erlenmeyer, jarum ose, cawan petri, pipet ukur, batang penyebar/drigalski, lampu bunsen, gelas beaker, biological safety cabinet (BSC), mikropipet, tabung reaksi, erlenmeyer, pipet tetes, ependof dan vorteks. Alat Autoclave Foto Alat Alat Inkubator Untuk mensterilkan alat dan bahandengan uap kering Heater cooker) (rice Foto Alat Digunakan untuk fermentasi dan menumbuhkan media pada pengujian secara mikrobiologi Timbangan santorius Menjaga agar media tetap cair dan dapat digunakan setiap saat Menimbang bahan yang akan digunakan dalam praktikum dengan tingkat ketelitian yang tinggi Timbangan digital Kaca objek sebagai tempat untuk meletakan objek yang akan di amati di bawah mikroskop Menimbang bahan yang akan digunakan dalam praktikum dengan tingkat ketelitian yang tinggi Gelas Erlenmeyer Bunsen Untuk menampung bahan atau cairan. Sterilisasi dengan api (panas) larutan, Mikropipet Mikrotube (Ependof) Untuk mengambil bahan atau media ukuran di bawah 1ml Untuk menghomogenkan sampel seperti DNA, darah dan isolat bakteri larutan dengan Cawan petri Rak tabung reaksi merupakan alat yang digunakan untuk membiakan (kultivasi) mikroorganisme. Medium dapat dituang pada cawan bagian bawah dan cawan bagian atasnya sebagai penutupnya Tempat penyimpanan tabung reaksi agar posisi tabung tetap tegak. Oven Jarum inokulasi Untuk Sterilisasi panas kering memindahkan mikroba dari sediaan ke dalam media. Ada dua jenis ose, yang pertama ose bulat yang dapat dipakai untuk menggoreskan mikroba pada media miring dan tegak (cawan petri), yang kedua ose lurus yang dapat dipakai untuk Pipet volum Untuk mengambil bahan atau media ukuran tertentu Bahan Alkohol 95% larutan dengan Foto Bahan Sebagai bahan Sterilisasi kimia Bahan TCBS agar antibiotik. Foto Bahan Media selektif untuk menumbuhkan bakteri Vibrio Aquades 3.2 Pembahasan 3.2.1 Sterilisasi Cawan Petri dan Pipet Sterilisasi adalah suatu proses untuk membunuh semua jasad renik yang ada, jika ditumbuhkan di alam suatu medium tidak ada jasad renik yang dapat berkembang biak. Sterilisasi harus dapat membunuh renik yang paling tahan panas yaitu spora bakteri (Fardiaz, 1992). Pada prinsipnya sterilisasi dapat dilakukan dengan 3 cara yaitu secara mekanik, fisik dan kimiawi. 1. Sterilisasi secara fisik (pemanasan, penggunaan sinar gelombang pendek yang dapat dilakukan selama senyawa kimia yang akan disterilkan tidak akan berubah atau terurai akibat temperatur atau tekanan tinggi). Dengan udara panas, dipergunakan alat “bejana/ruang panas” (oven dengan temperatur 170˚– 180˚C dan waktu yang digunakan adalah 2 jam yang umumnya untuk peralatan gelas). 2. Sterilisasi secara kimia (misalnya dengan penggunaan disinfektan, larutan alkohol, larutan formalin). 3. Sterilisasi secara mekanik, digunakan untuk beberapa bahan yang akibat pemanasan tinggi atau tekanan tinggi akan mengalami perubahan, misalnya adalah dengan saringan/filter. Sistem kerja filter, seperti pada saringan lain adalah melakukan seleksi terhadap partikel-partikel yang lewat (dalam hal ini adalah mikroba) (Suriawiria, 2005). Banyak metode yang dapat digunakan dalam upaya mensterilisasi alat maupun bahan. Metode yang digunakan bergantung pada sifat dan karakteristik alat dan bahan yang akan disterilisasi dan jenis mikroorganisme yang ingin dimusnahkan. Prosedur sterilisasi yang paling sering digunakan dalam laboratorium mikrobiologi adalah sterilisasi panas lembab dengan menggunakan autoclaf. Berikut merupakan gambar contoh membungkus cawan petri sebelum dimasukkan kedalam autoclave alat yang disiapkan untuk sterilisasi dalam autoclaf dan yang akan diinkubasi. Gambar 1. Proses Pembungkusan Caan Petri Selain proses sterilisasi dengan Autoclave, ada juga sterilisasi dengan inkubator. Inkubasi terkait erat dengan pengetahuan tentang kondisi lingkungan bakteri yang diinokulasi dapat tumbuh secara optimum. Bila memeriksa suatu spesimen untuk mencari suatu spesies bakteri tertentu seperti spesies bakteri tifoid, maka pengetahuan tentang ciri-ciri bakteri dan kondisi lingkungan sangat penting. Sebagai contoh bakteri tifoid adalah heterotrofik, aerobik dan mesofilik. Makan kondisi inkubator juga harus menyediakan kondisi sesuai kebutuhan atau sesuai dengan kondisi di alam (Pelczar dan Chan, 2010). 3.2.2 Pembuatan Media Media adalah suatu substrat dimana mikroorganisme dapat tumbuh yang disesuaikan dengan lingkungan hidupnya.Media berfungsi untuk menumbuhkan mikroba, isolasi, memperbanyak jumlah, menguji sifat-sifat fisiologi dan perhitungan jumlah mikroba, dimana dalam proses pembuatannya harus disterilisasi dan menerapkan metode aseptis untuk menghindari kontaminasi pada media (Pelczar dan Chan, 2010). Media berdasarkan fungsinya, yaitu: Media diperkaya (enriched medium) adalah medium yang ditambah zat-zat tertentu (serum, darah, ekstrak tumbuhan dan lain-lain), digunakan untuk menumbuhkan mikroba heterotrof. Media selektif (selective medium) adalah media yang ditambah zat kimia tertentu yang bersifat selektif untuk mencegah pertumbuhan mikroba lain sehingga dapat mengisolasi mikroba tertentu, misalnya media yang mengandung kristal violet pada kadar tertentu, dapat mencegah pertumbuhan bakteri gram positif tanpa mempengaruhi bakteri gram negatif. Contohnya: Endo Agar, EMB (Eosin Metilena Biru) Agar, SSA (Salmonella Shygella Agar), VRB (Violet Red Bile Agar). Media diferensial (deferential medium) adalah media yang ditambahkan zat kimia tertentu yang menyebabkan mikroba membentuk pertumbuham atau mengadakan perubahan tertentu hingga dapat membedakan tipenya. Contohnya: TSIA (Triple Sugar Iron Agar) (Waluyo, 2008). Gambar 2 media petri SWC, TCBS dan PBS, dan media data dalam tabung reaksi (agar miring) Media memiliki karakteristik berbeda-beda baik warna, pH, viskositas, titik cair, titik beku, kandungan nutrisi, salinitas maupun permeabilitas. Sebagai contoh media SWC berwarna hijau tua merupakan media yang cocok jika digunakan untuk menumbuhkan bakteri yang berasal dari laut atau tahan dengan salinitas tinggi. Respon warna bakteri yang tumbuh pada media juga beragam. Bakteri yang sama jika ditumbuhkan pada media yang berbeda dapat memunculkan warna koloni yang berbeda (Prescott dan Harley, 2002). Media yang dicetak dalam cawan petri memiliki keunggulan area permukaan media luas, mudah digores, dapat ditumbuhi beberapa macam bakteri sekaligus, bisa digunakan untuk metode tuang dan mudah menghitung koloni. Namun media cawan tidak memiliki ketebalan media yang cukup. Media dalam tabung reaksi memiliki keunggulan yaitu ketebalan media besar sehingga cocok untuk menumbuhkan bakteri yang biasa hidup pada kolom media. Media dalam tabung cocok untuk metode tusuk. Media tabung agar miring biasanya digunakan untuk metode gores dengan bahan yang digunakan dalam jumlah sedikit (Atlas, 2010). IV. KESIMPULAN DAN SARAN 4.1 Kesimpulan Media yang digunakan untuk menumbuhkan suatu bakteri harus dibuat secara aseptik agar bakteri yang diinginkan dapat tumbuh dengan baik tanpa ada gangguan dari kontaminan, sehingga diperoleh bakteri yang murni. Agar hal itu tercapai maka alat dan bahan yang akan digunakan dalam proses pembuatan media harus disterilkan terlebih dahulu dengan prosedur yang benar sesuai dengan metode yang digunakan, dalam hal ini metode yang digunakan adalah metode panas basah menggunakan autoclave. 4.2 Saran Masing-masing prosedur penggunaan alat dan bahan perlu dijelaskan lebih mendalam, khususnya pada penggunaan alat yang sensitif kerusakan atau memiliki potensi bahaya dalam penggunaannya. DAFTAR PUSTAKA Atlas, Ronald. M. 2010. Handbook of Microbiological Media. Fourth Edition. CRC Press. New York Fardiaz, S. 1992. Mikrobiologi Pangan 1. PT Gramedia Pustaka Utama. Jakarta. Pelczar, M.J dan E.C.S. Chan. 2010. Dasar-Dasar Mikrobiologi (terjemahan), R.S. Hadioetomo, T. Imas, S. S. Tjitrosomp dan S. L. Angka. Jakarta (ID): UI Press. Prescott, L.M dan J. P. Harley. 2002. Laboratory Exercises in Microbiolgy. Fifth Editon. McGraw-Hill Company. USA Suriawira. 2005. Pengantar Mikrobiologi Umum. Angkasa; Bandung. Waluyo, Lud. 2008. Teknik dan Metode Dasar dalam Mikrobiologi. UMM Press. Malang. Laporan Praktikum ke-2 m.k. Mikrobiologi Akuakultur Hari/Tanggal : Senin, 06 Oktober 2014 Kelompok : IV Asisten : 1. Rahman S.Pi., M.Si 2. Asisten Mikro 2013 ISOLASI BAKTERI DARI LINGKUNGAN AKUAKULTUR Oleh: Stefanno. M. A. Rijoly C151140401 ILMU AKUAKULTUR SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR 2014 I. PENDAHULUAN 1.1 Latar Belakang Mikroorganisme ada dimana-mana. Mereka dapat ditemukan di tanah, udara, air, makanan, limbah, bahkan di permukaan tubuh. Singkatnya, setiap area dari lingkungan kitapenuh dengan mikroba. Ilmu mikrobiologi memisahkan populasi yang beraneka ragam tersebut menjadi spesies induvidu yang dapat dipelajari (Cappucino, 1983). Mikroorganisme atau mikroba adalah organisme mikroskopik yang sebagian besar berupa satu sel yang terlalu kecil untuk dapat dilihat menggunakan mata telanjang. Mikroba berukuran sekitar seperseribu milimeter (1 µm) atau bahkan kurang, walaupun ada juga yang lebih besar dari 5 µm. Karenanya, mikroba hanya bisa dilihat dengan menggunakan alat bantu berupa mikroskop (Waluyo, 2004). Pertumbuhan mikroorganisme di alam dapat diketahui dengan pengambilan mikroorganisme tersebut di alam yang kemudian ditumbuhkan di dalam suatu medium buatan yang disebut dengan isolasi. Dalam mengisolasi mikroorganisme baik mikroorganisme tanah, air, dan udara harus memperhatikan faktor-faktor yang dapat mempengaruhi proses isolasi tersebut (Sari, 2009). Isolasi merupakan cara untuk memisahkan atau memindahkan mikrobatertentu dari lingkungannya, sehingga diperoleh kultur murni atau biakan murni. Kultur murni ialah kultur yang sel-sel mikrobanya berasal dari pembelahan darisatu sel tunggal (Pelczar dan Chan, 2010) Berbagai macam mikroorganisme dapat ditemukan di alam dalam populasi yang heterogen. Isolasi adalah mengambil mikroorganisme yang terdapat di alam dan menumbuhkannya dalam suatu medium buatan. Prinsip dari isolasi mikroba adalah memisahkan satu jenis mikroba dengan mikroba lainnya yang berasal dari campuran bermacam-macam mikroba. Hal ini dapat dilakukan dengan menumbuhkannya dalam media padat sel-sel mikroba akan membentuk suatu koloni sel yang tetap pada tempatnya. Jika sel-sel tersebut tertangkap oleh media padat pada beberapa tempat yang terpisah,maka setiap sel atau kumpulan sel yang hidup akan berkembang menjadi suatu koloni yang terpisah, sehingga memudahkan pemisahan selanjutnya. Bila digunakan media cair, sel-sel mikroba sulit dipisahkan secara individu karena terlalu kecil dan tidak tetap tinggal di tempatnya. Akan tetapi bila sel-sel itu dipisahkan dengan cara pengenceran, kemudian ditumbuhkan dalam media padat dan dibiarkan membentuk koloni, maka sel-sel tersebut selanjutnya dapat diisolasi dalam tabung-tabung reaksi atau cawan petri-cawan petri yang terpisah (Sutedjo, 1996). Di dalam mengisolasi mikroorganisme digunakan berbagai cara, antara laindengan cara goresan (streak plate), cara taburan/tuang (pour plate), cara sebar (spread plate), cara pengenceran (dilution method), serta micromanipulator (the micromanipulator method) (Lim, 1998). 1.3 Tujuan Praktikum ini bertujuan untuk mempelajari cara mengisolasi bakteri dari lingkungan akuatik dengan menggunakan metode penggoresan kuadran serta mengamati ciri-ciri koloni bakteri tumbuh dari berbagai media. II. METODOLOGI 2.1 Waktu dan Tempat Praktikum ini dilaksanakan pada hari Senin, 6 Oktober 2014 bertempat di Laboratorium Kesehatan Ikan, Depertemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor, pukul 08.00 - 10.00 WIB. 2.2 Alat dan Bahan Pada praktikum kali ini alat yang digunakan adalah lup inokulasi, cawan petri, batang penyebar, bunsen, kertas label, korek api, tisu dan incubator. Sedangkan bahan yang digunakan adalah alkohol absolut 95%, alkohol 70%, koloni bakteri pada media TSA, EMBA, TCBS dan WSC. 2.3 Prosedur Kerja Sebelum melakukan praktikum, meja tempat praktikum disterilisasi dengan alkohol 70% dan kemudian dibersihkan dengan tissue. Media tempat bakteri hasil isolasi meliputi EMBA, TSA, TCBS dan SWC disiapkan diatas meja. Masing-masing media dibagi menjadi 4 area dengan kode 0, I, II, dan III (Gambar 1). Bunsen dinyalakan dan tangan disterilisasi dengan alkohol 70%. Gambar 1. Pembagian Kuadran dengan metode kuadran Jarum inokulan dicelupkan pada alkohol absolute 95% kemudian dibakar di bunsen sampai merah lalu didinginkan sesaat. Prosedur sterilisasi dilakukan dekat dengan bunsen untuk meminimalisir kontaminasi dari bakteri. Setelah dingin jarum inokulasi kemudian dimasukkan pada tabung reaksi yang berisi biakan bakteri murni lalu digoreskan pada media uji SWC. Penggoresan dilakukan mulai dari kuadran 0 hingga kuadran I dan dilakukan dengan perlahan tanpa merusak permukaan media. Setelah keempat area terdapat goresan bakteri, jarum inokulasi dimasukkan kembali pada alkohol 95%. Prosedur isolasi ini berlaku sama untuk ketiga media lainnya (media TSA, TCBS maupun EMBA). Setelah selesai menggores bakteri pada media, kemudian keempat media lalu dimasukan ke dalam kantong plastik transparan setelah itu dimasukan kedalam inkubator untuk diinkubasikan selama ± 24 jam. Setelah 24 jam kemudian dilakukan pengamatan terhadap koloni bakteri yang tumbuh. III. HASIL DAN PEMBAHASAN 3.1 Hasil Hasil pengamatan isolat bakteri dari lingkungan akuakultur yang telah diisolasi menggunakan media agar EMBA, TSA, TCBS, dan SWC disajikan pada tabel berikut. Tabel 1 Hasil pengamatan isolat bakteri dan fungi yang berhasil diisolasi dari lingkungan akuakultur Kultur Koloni Bentuk Elevasi Tepian Tumbuh Ya/Tidak - - Tidak Sirkular Raised Entire Ya Orange Sirkular Raised Entire Ya Orange Sirkular Raised Entire Ya Isolat Medium A EMBA - - B TSA Kuning C TCBS D SWC Warna Gambar Berdasarkan tabel 1 di atas, dapat dilihat bahwa pada media EMBA tidak ada koloni bakteri yang tumbuh. Pada media TSA tumbuh koloni bakteri dengan ciri-ciri berbentuk sirkular, tepian entire dan elevasi raised dan berwarna kuning. Sedangkan untuk media TCBS dan SWC tumbuh koloni dengan ciri-ciri berbentuk sirkular, tepian entire, elevasi raised dan berwarna orange. 3.2 Pembahasan Kultur murni adalah kultur yang sel-sel mikrobanya berasal dari pembelahan satu sel tunggal. Biakan murni diperlukan karena semua metode mikrobiologis yang digunakan untuk menelaah dan mengidentifikasi mikroba, termasuk penelaahan ciri-ciri kultur, morfologis, maupun serologis memerlukan suatu populasi yang terdiri dari satu macam mikroba saja (Waluyo dalam Iman, 2010). Karakteristik koloni bakteri hasil inokulasi merupakan salah satu bagian dalam identifikasi bakteri. Beberapa bentuk koloni spesifik koloni bakteri pada media agar datar yaitu (Sutedjo, 1996): 1. Ukuran • Titik • Kecil • Sedang • Besar 2. Warna koloni Bakteri yang hidup hampir tidak berwarna dan tidak kontras dengan air, di mana sel-sel bakteri tersebut disuspensikan. Oleh karena itu pengamatan tanpa pewarnaan menjadi lebih sukar dan tidak dapat digunakan untuk melihat bagian-bagian sel dengan teliti 3. Bentuk koloni • Bundar • Tidak beraturan • Rhizoid (tersebar seperti akar) 4. Bentuk bagian tepi koloni (margin ) • Rata (entire) • Tidak rata, bergelombang secara beraturan (lobate ) • Bergelombang (undulate ) • Bergerigi (serrate ) • Seperti filamen (filamentous) Media EMBA (Eosin Methylene Blue Agar) adalah medium selektif dan diferensial digunakan untuk mengisolasi coliform fecal. Eosin Y dan metilen blue adalah pewarna indikator pH yang bergabung untuk membentuk endapan ungu gelap pada pH rendah (asam), mereka juga berfungsi untuk menghambat pertumbuhan organisme yang paling Gram positif. Sukrosa dan laktosa berfungsi sebagai sumber karbohidrat dapat difermentasi yang mendorong pertumbuhan coliform. Fermentor yang kuat dari laktosa atau sukrosa akan menghasilkan jumlah asam yang cukup untuk membentuk kompleks warna ungu tua. Pertumbuhan organisme ini akan muncul berwarna ungu tua sampai hitam. Escherichia coli, suatu fermentor yang kuat, sering menghasilkan warna koloni hijau metalik. Fermentor lambat atau lemah akan menghasilkan koloni merah muda mukoid atau berlendir. Biasanya koloni berwarna atau tidak berwarna menunjukkan bahwa organisme fermentor laktosa atau sukrosa terserbut bukan merupakan coliform fecal (Lal and Cheeptham, 2007). Hasil praktikum menunjukkan bahwa tidak ada koloni bakteri yang tumbuh, hal ini menunjukkan bahwa dari isolat bakteri yang digunakan tidak mengandung bakteri E. coli. Trypticase Soy Agar (TSA) merupakan media agar yang digunakan untuk kegiatan pengisolasian dan pembudidayaan berbagai macam mikroorganisme yang bersifat aerobik. Medium ini digunakan untuk berbagai tujuan yang mencakup pemeliharaan stok budidaya, isolasi berbagai macam spesies mikroorganisme, serta sebagai dasar untuk media termasuk darah (Becton, Dickinson and Company 2007). Komposisi dari TSA ini antara lain Approximate Formula* Per Liter Purified Water, Pancreatic Digest of Casein, Papaic Digest of Soybean, Sodium Chloride, Agar. Media TSA merupakan media umum untuk pertumbuhan bakteri sehingga pada saat digores dan diinkubasikan tumbuh koloni bakteri. TCBS (Thiosulphate Citrate Bile Salt Sucrose) adalah media yang solid selektif untuk isolasi dan budidaya Vibrio. Media ini hanya digunakan untuk mendiagnosa bakteri secara in vitro saja. Prinsip kerjanya yaitu bakteri gram positif akan dihambat oleh oxbile, natrium tiosulfat dan sitrat besi akan mendeteksi produksi H2S dan bromythol biru dan timol biru adalah sebagai indikator pH (QUEBACT Laboratories, 2012). Formula untuk pembuatan 1 liter TCBS adalah Yeast Extract 5 g, Casein Peptone 5 g, Meat Peptone 5 g, Sodium Citrate 5 g, Sodium Thiosulfate 10 g, Oxbile 5 g, Sodium Cholate 3 g, Sucrose 20 g, Sodium Chloride 3 g, Ferric Citrate 1 g, Bromthymol Blue 0.04 g, Thymol Blue 0.04 g, dan Agar 14 g. Media TCBS merupakan media selektif untuk bakteri Vibrio. Menurut Arfah (2011) salah satu koloni Vibrio yang tumbuh pada media TCBS adalah V. cholera di mana memiliki ciri-ciri sebagai berikut, berukuran besar, permukaan halus, agak datar, bagian tengah buram dan bagian pinggir terang, berwarna kuning (sukrosa positif). Hasil yang didapatkan pada praktikum kali ini memiliki kesamaan ciri pada pernyataan dari Arfah (2011) yaitu berwarna kuning. Kemungkinan, bakteri yang tumbuh pada media TCBS tersebut adalah jenis Vibrio. SWC (Sea Water omplete) adalah media yang berbentuk padat yang dapat digunakan untuk menumbuhkan semua mikroba air laut dipermukaan sehingga membentuk koloni yang dapat dilihat, dihitung dan diisolasi. SWC biasanya digunakan dalam menumbuhkan bakteri yang bersifat luminescent atau bakteri yang mengeluarkan cahaya berpendar. Komposisi dari SWC meliputi 500 ml air, 12 g garam laut, 2,5 g pepton, 1,5 g yeast extract, 1,5 ml gliserin dan 7,5 g agar (Anonim, 2008). Hasil praktikum menunjukan bakteri yang tumbuh memiliki ciri-ciri berbentuk sirkular, tepian entire, elevasi raised dan berwarna orange yang sesuai dengan ciri-ciri bakteri Vibrio (Arfah, 2011). IV. KESIMPULAN DAN SARAN 4.1 Kesimpulan Praktikum isolasi bakteri dan fungi dari lingkungan akuatik telah berhasil dilakukan dengan metode cawan gores kuadran. Setiap media mempunyai fungsi masing-masing dalam menumbuhkan biakan murni. Masing-masing bakteri memiliki kebutuhan nutrien, fisika, kimia media yang berbeda-beda. Isolasi bakteri dapat dilakukan dengan menggunakan metode cawan gores. 4.2 Saran Wadah yang digunakan untuk medium sebaiknya diperbanyak jumlahnya dan lebih beragam sehingga praktikan dapat lebih mahir dalam pemindahan biakan mikroba secara aseptik. Sehingga praktikan akan lebih terampil dandapat memperoleh hasil yang lebih baik. Pada praktikum selanjutnya diharapkan selain dapat melakukan pengkulturan mikroba juga ada pengamatan melalui mikroskop, agar praktikan lebih mengetahui bagaimana bentuk mikroba secara langsung. DAFTAR PUSTAKA Anonim. 2008. Making Seawater Complete. cibt.bio.cornell.edu/programs/archive/0610ccc/media.pdf [30 Desember 2014] Arfah, Nurlina. 2011. Pengujian Vibrio cholera pada produk perikanan (SNI01.2332.4-2006). Becton, Dickinson and Company. 2007. Trypticase™ Soy Agar (Soybean-Casein Digest Agar). http://www.bd.com/ds/productCenter/221283.asp [30 Desember 2014] Cappuccino, J.G and N.Sherman. 1983. Microbiology: a Laboratory Manual. Adison-Wesley Publishing Company: California Lal, A., and Cheeptham, N., (2007) Eosin-Methylene Blue Agar Plates Protocol. American Society for Microbiology. Lim, D. 1998. Microbiology. WCB McGraw-Hill. Missouri. United States of America Madigan, Micahel. T, Martinko, John. M, Bender, Kelly. S, Buckley, Daniel. H, Stahl, David. A. 2009. Brock Biology of Microorganisms. Fourteenth Edition. Pearson Education: United States of America Pelczar, M.J dan E.C.S. Chan. 2010. Dasar-Dasar Mikrobiologi (terjemahan), R.S. Hadioetomo, T. Imas, S. S. Tjitrosomp dan S. L. Angka. Jakarta (ID): UI Press. QUEBACT. 2012. http://www.quebact.com/index.php/en/support/technicaldata/236-1022 [30 Desember 2014] Sari, Noorkomala. 2009. Teknik Isolasi Mikroorganisme. Laboratorium Mikrobiologi Program Studi Biologi FMIPA ITS Surabaya Sutedjo, M. 1996. Mikrobiologi Tanah. Rineka Cipta : Jakarta Waluyo, L. 2004. Mikrobiologi Umum. Penerbit Universitas Muhamadiyah Malang Laporan Praktikum ke-3 m.k. Mikrobiologi Akuakultur Hari/Tanggal : Senin, 13 Oktober 2014 Kelompok : IV Asisten : 1. Rahman, S.Pi., M.Si 2. Asisten Mikro 2013 PEWARNAAN GRAM BAKTERI Oleh: Stefanno. M. A. Rijoly C151140401 ILMU AKUAKULTUR SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR 2014 I. PENDAHULUAN 1.1 Latar Belakang Mikroorganisme dapat dilihat dengan mikroskop biasa, tanpa diwarnai. Pengamatan yang demikian (tanpa pewarnaan) lebih sulit dan tidak dapat dipakai untuk melihat bagian-bagian sel secara seksama. Mikroorganisme yang tidak diwarnai tampak transparan bila diamati dengan mikroskop cahaya biasa. Kontras antara sel dan latar belakangnya dapat diperjelas dengan cara mewarnai sel – sel mikroba tersebut dengan zat-zat warna (Waluyo, 2008). Macam dan fungsi pewarnaan menurut Pelczar dan Chan (2010), dibedakan menjadi 3 macam yaitu: 1. Pewarnaan Sederhana Pemberian warna pada bakteri atau jazad-jazad renik lain dengan menggunakan larutan tunggal suatu pewarna pada lapisan tipis atau desain, yang sudah difiksasi dinamakan pewarnaan sederhana. 2. Pewarnaan Diferensial Prosedur pewarnaan yang menampilkan perbedaan diantara sel-sel mikroba atau bagian-bagian sel mikroba disebut teknik pewarnaan diferensial.Dengan teknik ini biasanya digunakan lebih dari itu larutan zat pewarna atau reagen pewarna. 3. Pewarnaan Gram Pewarnaan gram merupakan salah satu teknik pewarnaan diferensial yang paling baik dan paling luas digunakan untuk bakteri. Dalam proses ini olesan bakteri yang terfiksasi dikenai larutan-larutan berturut yaitu kristal ungu, larutan yodium, alkohol, dan safranin atau beberapa warna petanding lain yang sesuai. Bakteri yang diwarnai dengan metode ini dibagi menjadi dua kelompok yaitu bakteri gram positif dan gram negatif (Pelczar dan Chan, 2010). Pewarnaan gram merupakan salah satu metode pewarnaan ganda yang digunakan sebagai dasar pengamatan dan awal dari identifikasi bakteri. Pewarnaan bertujuan untuk memperjelas sel bakteri dengan menempelkan zat warna ke permukaan sel bakteri. Pada zat warna basah bagian yang berperan menempelkan warna disebut klorofor bermuatan positif. Sedangkan zat warna asam yang berperan memiliki muatan negatif. Pewarnaan gram bertujuan untuk mengidentifikasikan bakteri baik mengenai bentuknya maupun sifat-sifat morfologinya. Dengan kata lain untuk memperlihatkan bagian-bagian sel mikroba (Dwidjoseputro, 1998). 1.4 Tujuan Praktikum ini bertujuan untuk mengetahui sifat gram, bentuk sel, dan penataan sel pada bakteri, untuk mengenal dan mempelajari prosedur pewarnaan Gram serta untuk memahami pentingnya setiap langkah dalam prosedur tersebut. II. METODOLOGI 2.1 Waktu dan Tempat Praktikum ini dilaksanakan pada hari Senin, 13 Oktober 2014, bertempat di Laboratorium Kesehatan Ikan, Depertemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor dari pukul 08.00-10.00 WIB. 2.2 Alat dan Bahan Peralatan yang digunakan dalam praktikum ini adalah mikroskop, kaca preparat, gelas objek, ependof, jarum ose, bunsen, vorteks, dan botol semprot. Sedangkan bahan yang digunakan adalah satu set pewarna gram berisi larutan safranin, larutan kaliaum iodium, larutan kristal violet, biakan bakteri, alkohol 70%, akuades, kertas tisu dan minyak imersi. 2.3 Prosedur Kerja Alat-alat seperti meja, kaca objek, serta tangan harus disterilisasi dengan alkohol 70%. Setelah steril, kaca objek disiapkan serta memberi label (A dan B) tetesi kaca objek dengan larutan akuades sebanyak 1 tetes. Biakan bakteri dengan kode B, S, dan V yang sudah disediakan dalam ependof divorteks agar homogen. Kemudian jarum ose dipanaskan dan langsung didinginkan sebentar agar saat pengambilan kultur cair, bakteri yang diambil tidak mati karena panas dari jarum ose tersebut. Biakan bakteri murni diambil dan diratakan diatas kaca obyek dengan menggunakan jarum ose. Setelah itu gelas objek difiksasi dengan menggunakan pembakar Bunsen dengan cara diletakan pada jarak 10 cm dari pusat api kemudian digoyang-goyangkan hingga kultur cair yang ada di atas kaca objek menguap dan hanya meninggalkan plak (preparasi). Setelah itu larutan kristal violet diteteskan sebanyak 2-3 tetes pada olesan bakteri tersebut dan didiamkan selama 1 menit. Kemudian olesan preparat dibilas dengan akuades lalu dikering-anginkan hingga kering. Kemudian larutan kalium iodida diteteskan sebanyak 1 tetes olesan preparat tadi dan didiamkan selama 1 menit. Setelah satu menit kaca objek dibilas dengan akuades dan dikering-anginkan lagi hingga kering. Setelah kering, olesan preparat ditetesi 2-3 tetes alkohol 95% dan didiamkan selama 30 detik kemudian dibilas lagi dengan akuades dan dikeringanginkan hingga kering lagi. Setelah kering, olesan preparat tersebut ditetesi 2-3 tetes larutan safranin dan didiamkan selama 30 detik kemudian preparat olesan kembali dibilas dengan akuades dan dianginkan hingga kering. Pada tahap yang terakhir, preparat olesan diberi minyak emersi lalu diamati dengan mikroskop. III. HASIL DAN PEMBAHASAN 3.1 Hasil Hasil pengamatan pada percobaan pewarnaan Gram bakteri adalah diketahui reaksi Gram bakteri, bentuk, dan penataan dari sel bakteri pada isolat B, S, dan V (Tabel 1). Tabel 1 Hasil pengamatan pewarnaan Gram bakteri Ulangan 1 2 3 4 5 Isolat B S V B S V B S V B S V B S V Gram + + + + + + + - Bentuk Basil Coccus Basil Basil Coccus Basil Basil Coccus Comma Basil Coccus Comma Basil Coccus Coccus Penataan Diplo Staphylo Staphylo Mono Staphylo Mono Mono Staphylo Mono Mono Staphylo Mono Mono Staphylo Mono Berdasarkan tabel 1 diatas pada ulangan 1 isolat B tergolong bakteri gram negatif dengan bentuk basil dan penataannya termasuk golongan diplo, isolat S merupakan bakteri gram negatif dengan bentuk coccus dan penataannya staphylo sedangkan isolat V termasuk bakteri gram negatif, berbentuk basil dengan penataan staphylo. Pada ulangan 2 isolat B dan V termasuk bakteri gram negatif dengan bentuk basil dan penataannya mono, sedangkan isolat S berupa bakteri gram positif dengan bentuk coccus dan penataannya staphylo. Ulangan 3 dan 4 memiliki hasil yang sama yaitu pada isolat B dan S termasuk bakteri gram positif dengan bentuk dan penataan masing-masing basil dan coccus serta mono dan staphylo, sedangkan isolat V merupakan bakteri gram negatif dengan bentuk comma dan penataannya mono. Pada ulangan 5 isolat B tergolong bakteri gram positif dengan bentuk basil dan penataannya termasuk golongan mono, isolat S merupakan bakteri gram positif dengan bentuk coccus dan penataannya staphylo sedangkan isolat V termasuk bakteri gram negatif, berbentuk coccus dengan penataan mono. 3.2 Pembahasan Dalam pewarnaan gram ada 2 kemungkinan yang akan terjadi yaitu menjadi warna ungu yang menunjukkan gram positif dan warna merah yang menunjukkan gram negatif. Warna ungu yang terdapat digram positif didapat karena pada saat bakteri ditetesi dengan etanol dinding selnya mengkerut. Sehingga saat diberi safranin (pewarnaan sekunder) bakteri tetap dapat mempertahankan warna primernya karena pengaruh ketebalan dinding, oleh karena itu disebut gram positif. Sedangkan gram negatif didapat karena pada saat bakteri ditetesi dengan etanol dinding selnya tidak dapat mengkerut dengan kuat karena strukturnya yang tipis., sehingga saat diberi safranin (pewarnaan sekunder) bakteri tidak dapat mempertahankan warna primernya, sehingga warna ungu pudar menjadi merah muda, oleh karena itu disebut gram negatif. Perbedaan antara bakteri gram positif dan bakteri gam negatif terletak pada struktur dinding sel dan kandungan asam ribonukleatnya. Hasil yang diperoleh dari setiap kelompok mengenai pewarnaan gram bakteri berbeda-beda. Ada yang jenis bakterinya gram (+) dan ada yang jenis bakterinya gram (-). Gram (+) berwarna ungu karena bakteri tersebut mengikat komplek zat warna kristal ungu, gram (-) berwarna merah karena mengikat zat warna sekunder. Jika sedian kemudian di cuci dengan air, lalu dengan alkohol maka dua kemungkinan dapat terjadi. Pertama zat warna tambahan terhapus, sehingga yang nampak ialah zat warna yang asli (ungu). Dalam hal ini sedian (bakteri) kita sebut gram positif. Kedua zat warna tambahan (merah) bertahan hingga zat warna asli tidak tampak, dalam hal ini sedian (bakteri) kita katakan gram negatif (Dwidjosaputro, 2005). Menurut Pelczar dan Chan (2010) bentuk-bentuk dasar bakteri terdiri atas bentuk bulat (coccus), batang (basil), dan spiral (spirilia). Penataan bakteri jenis coccus terdiri dari monococcus (sel bakteri kokus tunggal), diplococcus (dua sel bakteri berdempetan kokus berdempetan), tetracoccus (empat berbentuk segi empat), sarkina (delapan sel bakteri kokus sel bakteri kokus berdempetan membentuk kubus), streptococcus (lebih dari empat sel bakteri kokus berdempetan membentuk rantai), dan staphylococcus (lebih dari empat sel bakteri kokus berdempetan seperti buah anggur). Penataan bakteri jenis basil terdiri dari monobasil (sel bakteri basil tunggal), diplobasil (dua sel bakteri basil berdempetan, dan streptobasil (beberapa sel bakteri basil berdempetan membentuk rantai). Sedangkan penataan bakteri jenis spirilia diantaranya spiral (bentuk sel bergelombang), spiroseta (bentuk sel seperti sekrup), dan vibrio/comma (bentuk sel seperti tanda baca koma). Hasil pengamatan kelompok kami (Ulangan 4) pada isolat B (gambar 1) dapat kita lihat bahwa bakteri berbentuk batang, berwarna merah muda yang berarti bakteri tersebut termasuk Gram positif dengan pola penataannya tunggal. Gambar 1. Isolat B hasil pewarnaan kelompok 4 Menurut Austin (1999) dalam Puspitasari (2003) selama penambahan alkohol dinding sel akan terhidrasi dan pori-pori mengecil sehingga permeabilitas dinding sel berkurang. Akibatnya kompleks kristal violet-yodium tidak terekstrak keluar dan tetap berwarna ungu. Berdasarkan ciri-ciri diatas dugaan sementara bakteri yang terdapat pada preparat olesan adalah Bacillus sp. Hal ini sesuai dengan Wahyuni (2011) bahwa bentuk sel Bacillus sp batang. Diameter koloni 2,5-5 μm. koloni muncul di atas permukaan media NA. warna koloni merah kecoklatan. Termasuk ke dalam bakteri gram positif. Bersifat motil, sitrat negatif, glukosa positif, dapat tumbuh pada media yang diberi NaCL 5%, tidak dapat tumbuh pada suhu 50˚C. dapat tumbuh dalam keadaan aerobik dan anaerobik. Sedangkan pada kode isolat S (Gambar 2.) yang merupakan bakteri berbentuk coccus, berwarna ungu yang berarti bakteri tersebut termasuk Gram positif dengan pola penataannya berkoloni. Dari ciri-ciri di atas dugaan sementara bakteri pada preparat olesan tersebut adalah bakteri Staphylococcus sp. Hal ini sesuai dengan Wahyuni (2011) Bentuk sel bulat. Dimeter koloni 0,5-1,5 μm. koloni muncul di atas permukaan media NA. koloni berwarna putih. Permukaan koloni mengkilat. Termasuk ke dalam bakteri gram positif. Kebutuhan terhadap oksigen termasuk aerob. Termasuk pada bakteri yang tidak mampu bergerak. Katalase, oksidase dan produksi H2S bersifat positif. Gambar 2. Isolat S hasil pewarnaan kelompok 4 Sedangkan pada kode isolat V (Gambar 3) yang merupakan bakteri berbentuk comma, berwarna merah muda yang berarti bakteri tersebut termasuk Gram negatif dengan pola penataannya mono. Dari ciri-ciri di atas dugaan sementara bakteri pada preparat olesan tersebut adalah bakteri Caulobacter sp. Dengan ciri-ciri Bentuk sel serupa batang, lurus atau bengkok. Diameter koloni 0,4-0,6 x 1-2 μm. koloni muncul di atas permukaan media NA. warna koloni krem. Bentuk koloni circular dan convex. Termasuk ke dalam bakteri gram negatif. Sel-sel mempunyai flagel, kebutuhan terhadap oksigen termasuk aerob. Suhu optimumnya adalah 10-35˚C. habitat pada air tawar dan air laut. Gambar 3. Isolat V hasil pewarnaan kelompok 4 IV. KESIMPULAN DAN SARAN 4.1 Kesimpulan Bakteri dapat digolongkan menjadi dua sifat yaitu sebagai bakteri gram positif dan bakteri gram negatif. Bakteri gram positif ditandai dengan terbentuknya pigmen ungu seperti pada pengamatan pada isolat berkode B dan S sedangkan bakteri gram negatif ditandai dengan terbentuknya warna merah muda seperti pada pengamatan isolat berkode V. Bakteri yang teramati memiliki keanekaragaman bentuk yang berupa batangan (basil) dan bulat (coccus) dan comma. 4.2 Saran Agar dalam pelaksanaan praktikum khususnya pada saat pengamatan menggunakan mikroskop, praktikan senantiasa didampingi guna memudahkan proses pengamatan objek. Hasil yang berbeda dari kelima ulangan menunjukkan adanya keselahan teknik prosedur, untuk itu asisten harus bisa menerangkan dan mendemonstrasikan langkah-langkah yang baik dalam pewarnaan Gram sehingga akan diperoleh hasil yang maksimal. DAFTAR PUSTAKA Dwidjosaputro.2005. Dasar-Dasar Mikrobiologi. Jakarta : Djambatan. Dwidjoseputro, Ratna S., 1998. Mikrobiologi Dasar Dalam Praktek. Jakarta, P.T Gramedia Pustaka. Pelczar, M.J dan E.C.S. Chan. 2010. Dasar-Dasar Mikrobiologi (terjemahan), R.S. Hadioetomo, T. Imas, S. S. Tjitrosomp dan S. L. Angka. Jakarta (ID): UI Press. Puspitasari, FB. 2003. Identifikasi dan Uji Postulat Koch Cendawan Penyebab Penyakit pada Gurami. [Skripsi]. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor. Wahyuni, Ika. 2011. Jenis-jenis Bakteri Yang Berasosiasi Pada Proses Dekomposisi Serasah Daun Avicennia marina (forsk) Vierh Setelah Aplikasi Fungi Aspergillus sp., Curvullaria sp., Penicillium sp. Pada Beberapa Tingkat Salinitas di Desa Sicanang Belawan. [Skripsi] USU. Medan Laporan Praktikum ke-4 m.k. Mikrobiologi Akuakultur Hari/Tanggal : Senin, 20 Oktober 2014 Kelompok : IV Asisten : 1. Rahman, S.Pi., M.Si 2. Asisten Mikro 2013 KARAKTERISASI, SIFAT FISIOLOGI DAN BIOKIMIA BAKTERI Oleh: Stefanno. M. A. Rijoly C151140401 ILMU AKUAKULTUR SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR 2014 I. PENDAHULUAN 1.1 Latar Belakang Makhluk hidup yang sangat kecil yang tidak bisa dilihat oleh mata telanjang disebut mikroorganisme (Dwijoseputro 2003). Masing-masing mikroorganisme itu dibagi dalam filum, kelas, ordo, famili, genus, dan spesies. Pembagian mikroorganisme tersebut menyebabkan diperlukannya suatu cara pengelompokan atau pengklasifikasian. Penetapkan suatu sistem klasifikasi mikroba yang mencerminkan dengan semua persamaan dan perbedaannya dinamakan taksonomi. Kegiatan di dalam penyusunan taksonomi mikroorganisme berupa pengklasifikasian, penamaan, dan pengidentifikasi yang disebut dengan sistematika mikroba. Sistem klasifikasi mikroba baik jamur, bakteri, ataupun virus didasarkan pada hierarki taksonomi atau penamaan kelompok atau kategori yang menempatkan spesies pada satu ujung dunia dan di ujung dunia lainnya dalam urutan spesies - genus – famili - ordo - kelas - filum atau divisi - dunia. Mikroorganisme sebagaimana bentuk-bentuk kehidupan yang lain, diberi nama menurut nomenklatur sistem biner (Volk 1988). Klasifikasi bakteri menurut Bergey’s Manual of Determinative Bacteriology pada umumnya diterima secara internasional. Manual ini direvisi secara berkala untuk memanfaatkan pengetahuan baru melalui penelitian dengan mikroorganisme dan melalui teknik-teknik baru untuk menganilisis data yang diperoleh. Bergey’s Manual edisi kedelapan yang sekarang ini, membagi semua bakteri menjadi 19 bagian (kelompok), dan masing-masing dicirikan oleh sifatsifat morfologi atau metabolik yang nyata. Tekanan diberikan pada pengelompokan bakteri yang memiliki ciri-ciri umum dan mudah dikenali. Tidak ada usaha untuk mengatur penempatan mikroorganisme yang mencerminkan skema suatu perkembangan evolusi, sebagaimana dilakukan pada edisi-edisi sebelumnya. Hal ini dikarenakan masih banyak pengetahuan mengenai mikroorganisme yang belum lengkap diketahui (Karser 2004). Karakterisasi morfologi bertujuan untuk mengamati baik morfologi koloni maupun morfologi sel bakteri pada isolat bakteri yang telah lolos seleksi. Ketika ditumbuhkan dalam media yang bervariasi, mikroorganisme akan menunjukkan penampakan makroskopis yang berbeda-beda pada pertumbuhannya. Perbedaan ini disebut dengan karakterisktik kultur, yang digunakan sebagai dasar untuk memisahkan mikroorganisme dalam kelompok taksonomik (Capuccino 1992). Pengujian secara fisiologis juga dapat dilakukan untuk mengelompokkan taksonomi mikroorganisme termasuk taksonomi bakteri. Pengujian fisiologis terdiri dari uji motilitas, uji katalase, uji oksidase, uji gelatin, dan uji fermentatif/oksidatif. Selain kelima uji tersebut, dapat juga dilakukan uji yang lain yaitu dengan menggunakan uji hidrolisis pati, uji indol, uji methyl red, uji sitrat, dan uji hidrolisis urea (Hadioetomo 1993). 1.5 Tujuan Percobaan bertujuan mengidentifikasi sifat biokimia dan fisiologis suatu bakteri berdasarkan uji oksidase, uji katalase, uji oksidatif/fermentatif, uji motilitas, dan uji gelatin, kemudian dapat menduga jenis bakteri dengan skema penggolongan bakteri oleh Cowan (1974). II. METODOLOGI 2.1 Waktu dan Tempat Praktikum ini dilaksanakan pada hari Senin, 20 Oktober 2014 pukul 08.00- 10.00 WIB, bertempat di Laboratorium Kesehatan Ikan, Depertemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. 2.2 Alat dan Bahan Peralatan yang digunakan dalam praktikum ini adalah tabung reaksi, jarum ose, gobjek glass, rak tabung reaksi, kertas cakram, inkubator, kulkas, bunsen. Sedangkan bahan yang digunakan adalah koloni bakteri agar miring, gelatin, media mengandung glukosa, media SIM (Sulfida Indol Motility), parafin, H2O2 3%, P-aminodimethylaniline-oxalat 1%, 2.3 Prosedur Kerja 2.3.1 Uji Oksidatif dan Fermentatif Koloni bakteri diambil dengan jarum ose secara aseptik, inokulasikan vertical pada 1 set (dua buah tabung) O/F medium. Salah satu tabung diberi parafin 1 ml, kemudian diinkubasi selama 24 jam. Pemberian paraffin dimaksudkan untuk menahan oksigen yang masuk pada tabung yang berisi O/F medium. Reaksi oksidatif terjadi jika tabung yang tidak diberi paraffin berubah menjadi kuning. Sedangkan reaksi fermentative terjadi jika tabung yang diberi paraffin berubah warna menjadi kuning atau kedua tabung berubah warna menjadi kuning. 2.3.2 Uji Motilitas Koloni bakteri diambil dengan aseptik menggunakan jarum inokulum, kemudian inokulasikan secara vertikal pada media SIM (Sulfida Indol Motility) dan di inkubasi selama 24 jam. Motilitas bakteri ditunjukan dengan adanya pertumbuhan pada permukaan medium dan tidak ada bekas pada tusukan, Bakteri non motil tumbuh sepanjang tusukan. 2.3.3 Uji gelatin Isolat bakteri pada agar miring diambil dengan menggunakan jarum ose kemudian diinokulasi secara vertikan pada tabung reaksi yang berisi media yang menggandung gelatin. Tabung reaksi diinkubasi pada suhu ruang selama 24 jam. Kemudian masukan dalam kulkas dengan suhu 4˚C. Tes positif jika gelatin terhidrolisis dan tetap akan berbentuk cair. Sedangkan tes menjadi negatif jika gelatin tidak terhidrolisis sehingga saat dimasukan kedalam kulkas gelatin membeku. 2.3.4 Uji Oksidase Dua buah kertas cakram steril diletakkan di atas kaca preparat dengan salah satu kertas cakram steril digunakan sebagai kontrol. Reagen p-aminodimetil anilina oksalat 1% diteteskan pada kedua kertas cakram. Koloni bakteri diambil dengan menggunakan pipet tetes secara aseptis, kemudian diteteskan pada salah satu kertas cakram. Hasil positif ditunjukkan dengan adanya perubahan warna yang dapat diamati dengan cara membandingkannya menggunakan larutan kontrol. 2.3.5 Uji Katalase Dengan menggunakan jarum ose, koloni bakteri secara aseptik diambil dan diletakan pada gelas objek yang bersih. Kemudian diteteskan hydrogen peroksida (H2O2) pada koloni bakteri tersebut. Adanya gelembung-gelembung udara menunjukan tes tersebut positif. III. HASIL DAN PEMBAHASAN 3.1 Hasil Hasil pengamatan pada percobaan karakterisasi sifat biokimia dan fisiologi bakteri adalah diketahui sifat Oksidatif/Fermentatif, Katalase, Oksidase, Motilitas, Gelatin, Gram dan Bentuk bakteri pada isolat A, B, C, D, dan E (Tabel 1). Tabel 1 Hasil pengamatan uji sifat Oksidatif/Fermentatif, Katalase, Oksidase, Motilitas, Gelatin, Gram dan Bentuk bakteri Uji Sifat O/F Katalase Oksidase Motilitas Gelatin Gram Bentuk Genus Bakteri A B F F + + + + + + + Basil Coccus Listeria Staphylococcus, Pediococcus Isolat C F + Coccus Streptococcus, Pediococcus, Gamella D E F F + + Basil Basil Cardiobakterium, Pseudomonas, Eikenella Streptobacillus Berdasarkan tabel 1 diatas dapat kita lihat bahwa isolat D setelah dilakukan ujioksidasi/fermentasi mengalami fermentasi, uji katalse bersifat negatif, oksidase positif, bukan merupakan bakteri motil, tidak memiliki gelatin berupa bakteri Gram negatif dan bentuknya basil. Setelah dicocokan dengan tabel Cowan ciriciri isolat D merupakan bakteri Gram negatif dari genus Cardiobacterium dan Eikenella. 3.2 Pembahasan Metabolisme adalah semua reaksi kimiawi yang dilakukan oleh sel untuk menghasilkan energi yang digunakan untuk sintesis komponen-komponen sel dan untuk kegiatan-kegiatan selular, seperti pergerakan. Reaksi kimiawi yang membebaskan energi melalui perombakan nutrient disebut reaksi disimilasi atau penguraian; jadi merupakan kegiatan katabolik sel. Sedangkan reaksi kimiawi yang menggunakan energi untuk sintesis dan fungsi-fungsi sel lainnya disebut reaksi asimilasi atau anabolik. Jadi, reaksi disimilasi menghasilkan energi, dan reaksi asimilasi menggunakan energi. Bila sel merombak ikatan-ikatan kimiawi tertentu selama metabolisme, energi yang dilepaskan menjadi tersedia untuk melangsungkan kerja biologis. Selama masa hidup sel, kerja ini bersifat ekstensif dan beragam. Mikroorganisme heterotrofik nonfotosintesik memperoleh energinya dari oksidasi (pengusiran electron atau atom hydrogen) senyawa-senyawa anorganik (Pelczar dan Chan, 2010). Ciri fisiologi ataupun biokimia merupakan kriteria yang amat penting di dalam identifikasi spesimen bakteri yang tak dikenal karena secara morfologis biakan atau pun sel bakteri yang berbeda dapat tampak serupa, tanpa hasil pengamatan fisiologis yang memadai mengenai organik yang diperiksa maka penentuan spesiesnya tidak mungkin dilakukan. Karakteristik dan klasifikasi sebagian mikroba seperti bakteri berdasarkan pada reaksi enzimatik ataupun biokimia. Mikroba dapat tumbuh pada beberapa tipe media memproduksi tipe metabolit tentunya yang dideteksi dengan interaksi mikroba dengan reagen test yang mana menghasilkan perubahan warna reagen (Murray et al, 1996) Uji fisiologi biasanya identik dengan uji biokimia. Uji-uji biokimia yang dilakukan dalam praktikum ini antara lain uji O/F, uji katalase, uji oksidase, hidrolisis gelatin, dan uji motilitas. Pengujian OF dilakukan untuk mengidentifikasi isolat bakteri termasuk dalam kategori bakteri aerob atau bakteri anaerob. Perubahan warna yang terjadi pada media OF akan menentukan kategori bakteri tersebut. Perubahan warna media menjadi kuning pada tabung yang tidak diberi parafin tetapi tidak berubah pada tabung yang diberi parafin, menunjukan metabolisme oxidatif dari glukosa. Perubahan warna media menjadi kuning terjadi pada kedua tabung, menunjukan metabolisme fermentatif (Nicklin et al 1999). Hasil pengujian menunjukkan perubahan warna pada media glukosa yang tadinya berwarna hijau menjadi kuning pada tabung yang ditambahkan paraffin (gambar 1), sedangkan pada tabung yang tidak ditambahkan paraffin tetap berwarna hijau menunjukkan bahwa bakteri uji bersifat fermentatif. Sifat fermentatif menunjukkan bahwa bakteri hidup dalam suasana anaerob saja. Jika pada tabung yang tidak ditambahkan paraffin membentuk warna kuning, sedangkan pada tabung yang ditambahkan paraffin tetap berwarna hijau menunjukkan bahwa bakteri uji bersifat oksidatif. Sifat oksidatif menunjukkan bahwa bakteri hidup dalam suasana aerob saja. Jika tabung baik yang ditambahkan maupun yang tidak ditambahkan paraffin membentuk warna kuning menunjukkan bahwa bakteri uji memiliki sifat oksidatif/fermentatif. Sifat O/F ini menunjukkan bahwa bakteri dapat hidup baik dalam suasana aerob maupun anaerob. Hasil percobaan menunjukkan bahwa isolat D bersifat fermentatif yang bisa hidup dalam suasana anaerob saja. Gambar 1. Hasil Pengujian Oksidasi Fermentasi Uji katalase digunakan untuk mengetahui aktivitas katalase pada bakteri yang diuji. Kebanyakan bakteri memproduksi enzim katalase yang dapat memecah H2O2 menjadi H2O dan O2. Enzim katalase penting untuk pertumbuhan aerobik karena H2O2 yang dibentuk dengan pertolongan berbagai enzim pernafasan bersifat racun terhadap sel mikroba. Beberapa bakteri yang termasuk katalase negatif adalah Streptococcus, Leuconostoc, Lactobacillus, dan Clostridium. Kebanyakan bakteri aerobik dan anaerobik fakultatif akan memproduksi hidrogen peroksida yang bersifat toksik terhadap bakteri yang masih hidup. Untuk menjaga kelangsungan hidupnya, sejumlah bakteri mampu menghasilkan enzim katalase yang memecah H2O2 menjadi air dan oksigen sehingga sifat toksiknya hilang (Pelczar dan Chan, 2010). Matinya bakteri-bakteri anerobik obligat bila ada oksigen disebabkan karena tidak adanya pembentukan enzim katalase sehingga H2O2 meracuni bakteri itu sendiri. Ada tidaknya pembentukan enzim katalase dapat membantu pembedaan kelompok-kelompok bakteri tertentu. Pada uji katalase, kebanyakan bakteri aerob dan anaerob menggunakan oksigen H2O2 yang sesungguhnya bersifat racun bagi sistem-sistem enzim sendiri. Namun, mereka tetap dapat hidup dengan adanya racun tersebut karena akan meghasilkan enzim katalase (Hadieotomo, 1993). Uji katalase yang dilakukan pada percobaan menujukan hasil negatif yang ditandai dengan tidak terbentuknya gelembung. Enzim oksidase memegang peranan penting dalam transport elektron selama respirasi aerobik. Sitokrom oksidase mengkatalisis oksidasi dan reduksi sitokrom oleh molekul oksigen. Enzim oksidase dihasilkan oleh bakteri aerob, fakultatif anaerob, dan mikroaerofilik. Mikroorganisme ini menggunakan oksigen, sebagai akseptor elektron terakhir selama penguraian karbohidrat untuk menghsilkan energi. Kemampuan bakteri memproduksi sitokrom oksidase dapat diketahui dari reaksi yang ditimbulkan setelah pemberian reagen oksidase pada koloni bakteri. Enzim ini merupakan bagian dari kompleks enzim yang berperan dalam proses fosforilasi oksidatif. Reagen yang digunakan dalam praktikum ini adalah P-aminodimethylaniline-oxalat 1%. Reagen akan mendonorkan elektron terhadap enzim ini sehingga akan teroksidasi membentuk senyawa yang berwarna (Volk, 1988). Dari hasil praktikum didapat bahwa koloni bakteri setelah ditetesi reagen berubah warna menjadi pink hal ini menunjukan bahwa bakteri mengandung enzim oksidase. Gambar 2. Hasil Uji Oksidase dan Katalase Menurut Volk (1988) kemampuan suatu organisme untuk bergerak sendiri disebut motilitas. Hampir semua sel bakteri spiral dan sebagian dari sel bakteri basil bersifat motil, sedangkan bakteri yang berbentuk kokus bersifat immotil. Motilitas sebagian besar jenis bakteri motil pada suhu relatif rendah 15-25˚C dan mungkin tidak motil pada suhu 37˚C. Reaksi positif pada uji motilitas ditandai adanya pergerakan atau pertumbuhan bakteri tidak hanya pada bekas tusukan inoklasi tetapi menyebar. Dari praktikum didapatkan uji negatif karena bakteri yang diinokuasi tidak tumbuh menyebar. Enzim-enzim yang menguraikan golongan potein disebut protenase / protease, kedua nama ini dianggap sinonim. Contoh pada hidrolisis gelatin dimana protein diperoleh dari hidrolisis kalogen, yaitu zat pada jaringan penghubung dan tendon dari hewan. Gelatin akan terurai oleh mikrobia yang mensintesis enzim proteolisis. Larutan gelatin bersifat cair pada suhu ruang atau suhu kamar dan padat apabila berada di dalam refrigerator. Dan apabila gelatin sudah dihidrolisis oleh mikroba, maka akan tetap bersifat cair (Hadioetomo, 1993). Gelatin diperoleh dengan mendidihkan bahan hewani yang mengandung kolagen, namun gelatin bukanlah protein yang sama tipenya dengan kolagen. Ternyata bobot molekul gelatin hanyalah sepertiga kolagen. Agaknya dalam pembentukan gelatin, molekul tropokolagen terurai dan tiap helai membuat ikatan-ikatan hidrogen dalam air, menghasilkan pembentukan gel yang khas (Fessenden dan Fessenden, 1995). Hasil yang diperoleh pada percobaan setelah dilakukan inklubasi selama 24 jam dan pendinginan selama 10 menit didalam freezer diperoleh bakteri dalam keadaan keras atau membeku yang artinya isolat D negatif gelatin. Berdasarkan hasil-hasil yang telah dillakukan dengan uji fermentasi, uji oksidase, produksi katalase, uji motilase dan uji oksidase bakteri yang terkadung didalam kultur adalah Cardiobacterium dan Eikenella. Cardiobacterium dan Eikenella merupakan bakteri non patogen bagi organise akuatik seperti pada ikan mas koki, maanfish, black ghost, dan cupang terutama terdapat pada bagian insang dan juga ginjal (Insani, 2002), akan tetapi bakteri ini bersifat patogen pada manusia. Cardiobacterium biasanya menyerang rongga mulut dan saluran urogenital manusia yang menyebabkan native valve endocarditis yang didapatkan dari lingkungan (Chong et al, 1985). Eikenella merupakan bakteri patogen pada manusia yang terdapat pada plak gigi. Bakteri ini menyebabkan submandibular dan sublingual abses serta abses dari bagian anterior leher (Haffaje dan Socransky, 1994). IV. KESIMPULAN DAN SARAN 4.1 Kesimpulan Berdasarkan percobaan yang telah dilakukan dapat disimpulkan bahwa bakteri D memiliki genus Cardiobacterium, dan Eikenella yang bersifat Gram negatif, berbentuk batang, memiliki enzim oksidase, tidak memiliki enzim katalase, fermentatif, nonmotil, dan tidak memiliki enzim gelatinase. 4.2 Saran Untuk praktikum selanjutnya sebaiknya digunakan bakteri dengan jenis yang lain, misalnya bakteri bentuk kokus atau dapat juga menggunakan bakteri yang merupakan parasit pada ikan. DAFTAR PUSTAKA Capuccino JG, Sherman N. 1992. Microbiology a Labolatory Mannual. Amerika: The Benjamin. Chong, Yunsop., Kim, Tai Sook., Lee, Y. Samuel., Shim, Won Heum., Choo, Bum Koo. Cardiobacterium Hominis Endocarditis – A Case Report. Yonsei Medical Journal, Vol. 26, No. 1, 1985. Dwijoseputro. 2003. Dasar-Dasar Mikrobiologi. Jakarta: Djambatan. Fessenden dan Fessenden, 1995, Kimia Organik, Cetakan ketiga, Jilid II, Penerbit Erlangga, Jakarta, 454 Hadioetomo RS. 1993. Mikrobiologi Dasar dalam Praktek: Teknik dan Prosedur Dasar Laboratorium. Jakarta: PT Gramedia Pustaka. Haffajee AD, Socransky SS. 1994. Microbial Etiological Agents Of Destructive Periodontal Diseases. Periodontol 2000 1994;5:78-111. Insani, Dwi Surya. 2002. Inventarisasi Bakteri pada Ikan Hias Mas Koki (Carassius auratus), Maanvis (Pterophyllum scalare), Black Ghost (Apteronotus albifrons) dan Cupang (Betta splendens) di Jakarta Timur. [Skripsi]. Institut Pertanian Bogor Karser G. 2994. Microbiology Laboratory Manual. New York: Cotons Ville Campus. Murray, A.E., Hollibaugh, J.T. and Orrego, C. (1996) Phylogenetic compositions of bacterioplankton from two California estuaries compared by Denaturing Gradient Gel Electrophoresis of 16S rDNA fragments. Appl Environ Microbiol 62, 2676–2680. Nicklin, J, Graeme-Cook, T Paget, and Killington. 1999. Microbiology. BIOS Scientific Publisher Limited. New York. Sulia, S. B. and S. Shantharam. 1998. General Microbiology. Science Publ. Inc. USA Volk S. 1988. Mikrobiologi Dasar. Jakarta: Erlangga. Laporan Praktikum ke-5 m.k. Mikrobiologi Akuakultur Hari/Tanggal : Senin, 27 Oktober 2014 Kelompok : IV Asisten : 1. Rahman, S.Pi., M.Si 2. Asisten Mikro 2013 ISOLASI FUNGI DAN KARAKTERISTIK CENDAWAN (KHAMIR DAN KAPANG) Oleh: Stefanno. M. A. Rijoly C151140401 ILMU AKUAKULTUR SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR 2014 I. PENDAHULUAN 1.1 Latar Belakang Fungi adalah suatu kelompok jasad hidup yang menyerupai tumbuhan karena mempunyai dinding sel, tidak bergerak, berkembang biak dengan spora, tetapi tidak mempunyai klorofil. Fungi tidak mempunyai akar, batang, daun dan sistem pembuluh seperti pada tumbuhan tingkat tinggi. Umumnya fungi berbentuk benang, bersel banyak, dan semua bagian jamur tersebut memiliki potensi untuk tumbuh. Setiap lembar benang disebut hifa, dan kumpulan hifa dinamakan miselium. Diameter hifa berkisar antara 0,5 –100 mikron atau lebih (Rukmana 1997). Khamir (yeast) merupakan sel tunggal (uniseluler) yang membentuk tunas dan pseudohifa (Webster dan Weber, 2007). Hifanya panjang, dapat bersepta atau tidak bersepta dan tumbuh di miselium. Yeast memiliki ciri khusus bereproduksi secara aseksual dengan cara pelepasan sel tunas dari sel induk. Beberapa khamir dapat bereproduksi secara seksual dengan membentuk aski atau basidia dan dikelompokkan ke dalam Ascomycota dan Basidiomycota. Dinding sel yeast adalah struktur yang kompleks dan dinamis dan berfungsi dalam menanggapi perubahan lingkungan yang berbeda selama siklus hidupnya (Hoog et al., 2007). Sel khamir biasanya berbentuk telur, beberapa memanjang atau bentuk bola. Khamir tidak dilengkapi flagelum atau organ penggerak lainnya. Khamir mempunyai ukuran yang bervariasi dengan panjang 1-5 µm sampai 20-50 µm, dan lebar 1-10 µm. Sel khamir mempunyai bentuk yang bermacam-macam seperti bulat, oval, silinder, ogival yaitu bulat. Bentuk-bentuk dari sel khamir tersebut dapat membantu dalam indentifikasi dari khamir. Ada beberapa khamir dalam keadaan tertentu dapat mengalami dimorfisme yaitu fase khamir, bentuk sel tunggal dan filamen, bentuk benang (Pelczar dan Chan, 2010). Kapang (mold) adalah fungi multiseluler yang mempunyai filamen, dan pertumbuhannya pada substrat mudah dilihat karena penampakannya yang berserabut seperti kapas. Pertumbuhannya mula-mula berwarna putih, tetapi jika spora telah timbul akan terbentuk berbagai warna tergantung dari jenis kapang (Ali 2005). Kapang terdiri dari suatu thallus yang tersusun dari filamen yang bercabang yang disebut hifa. Kumpulan dari hifa membentuk suatu jalinan yang disebut miselium. Setiap hifa memiliki lebar 5-10 µm (Pelczar dan Chan 2010). Menurut Fardiaz (1992), dan Waluyo (2004), kapang dapat dibedakan menjadi 2 kelompok berdasarkan struktur hifa, yaitu hifa tidak bersekat atau nonseptat dan hifa bersekat atau septat. Septat akan membagi hifa menjadi bagianbagian, dimana setiap bagian tersebut memiliki inti (nukleus) satu atau lebih. Kapang yang tidak memiliki septat maka inti sel tersebar di sepanjang hifa. Dinding penyekat pada kapang disebut dengan septum yang tidak tertutup rapat sehingga sitoplasma masih dapat bebas bergerak dari satu ruang ke ruang lainnya. Kapang yang bersekat antara lain kelas Ascomycetes, Basidiomycetes dan Deuteromycetes. Sedangkan kapang yang tidak bersekat yaitu kelas Phycomycetes (Zygomycetes dan Oomycetes). Secara alamiah kapang berkembang biak dengan berbagai cara, baik aseksual dengan pembelahan, penguncupan, atau pembentukan spora. Dapat pula secara seksual dengan peleburan nukleus dari kedua induknya. Pada pembelahan, suatu sel membelah diri untuk membentuk dua sel anak yang serupa. Pada penguncupan suatu sel anak tumbuh dari penonjolan kecil pada sel inangnya (Waluyo 2004). Berbagai dampak cendawan parasit terhadap ikan tentunya menjadi ancaman bagi kegiatan budidaya. Sehingga diperlukan adanya isolasi dan identifikasi cendawan yang berada dalam lingkungan pemeliharaan ikan bahkan cendawan yang terdapat dalam tubuh ikan yang dipelihara. Hal tersebut perlu dilakukan agar jika terdapat cendawan yang bersifat parasit, pelaku budidaya dapat mengambil langkah tepat, yaitu dilakukan treatment, pengobatan, bahkan pemusnahan, sehingga kegiatan budidaya yang dilakukan tidak terlalu mengalami kerugian. 1.6 Tujuan Praktikum ini bertujuan memahami metode isolasi cendawan dan mengetahui morfologinya beserta karakteristik biokimia terhadap beberapa macam gula. II. METODOLOGI 2.1 Waktu dan Tempat Praktikum ini dilaksanakan pada hari Senin, 27 Oktober 2014 dan Senin, 3 November 2014 pukul 08.00-10.00 WIB, bertempat di Laboratorium Kesehatan Ikan, Depertemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. 2.2 Alat dan Bahan Peralatan yang digunakan dalam praktikum ini adalah cawan petri, tabung ependof, mikroskop optik, jarum ose, pinset, objek dan cover glass, pipet mikro, tabung reaksi dan inkubator. Sedangkan bahan yang digunakan adalah koloni khamir, ikan terinfeksi kapang dan telur ikan terinfeksi kapang, media PDA, MEA, GYA, antibiotik, aquades, khamir, Methylin Blue, Melacid Green, tissue, glukosa galaktosa, sukrosa, rafinosa, trehalosa, laktosa dan maltosa. 2.3 Prosedur Kerja 2.3.1 Isolasi Kapang dan Khamir Koloni kapang diambil dari bagian tubuh ikan yang terinfeksi kapang dan dari telur ikan yang juga sudah terinfeksi. Kapang pada tubuh dan telur ikan masing-masing diambil dengan menggunakan gunting dan pinset kemudian dibilas dengan aquades dan diletakkan pada bagian tengah cawan petri yang berisi media GYA yang sudah diberi antibiotik. Pemberian antibiotik berfungsi untuk mencegah tumbuhnya bakteri. Kemudian cawan diinkubasi pada suhu ruang selama 24-48 jam. Tabung ependorf yang berisi suspensi khamir diambil dengan jarum ose kemudian digoreskan pada media PDA, MEA maupun GYA. Penggoresan dilakukan dengan cara zigzag dan kuadran. Kemudian cawan petri diinkubasi pada suhu ruang selama 24-48 jam. 2.3.2 Rekultur Kapang Kapang yang sebelumnya sudah ditumbuhkan pada cawan petri, diambil bagiannya sedikit dengan pinset dan gunting. Kemudian pindahkan kapang yang sudah diambil tadi ke dalam cawan petri baru yang mengandung media GYA dan antibiotik. Setelah itu inkubasi pada suhu ruang selama 24-48 jam. 2.3.3 Karakterisasi Kapang Pada Tubuh dan Telur Ikan Kapang pada tubuh dan telur ikan diambil dengan pinset kemudian diletakkan pada kaca preparat dan ditetesi air, tutup dengan cover glass. Setelah itu preparat kapang diamati dibawah mikroskop pada pembesaran 100-1000x, amati bentuk hifa, sporangium dan sprora dari kapang tersebut. 2.3.4 Pengamatan Morfologi Khamir Suspensi khamir pada tabung ependorf diambil dengan jarum ose dan diteteskan pada objek gelas. Objek gelas ditetesi Methylin Blue kemudian tutup dengan cover glass tanpa ada gelembung. Setelah itu preparat khamir diamati bentuk dan perubahan warnanya dibawah mikroskop optik pada perbesaran 100400X. Kemudian dihitung persentase sel khamir yang hidup dan mati. 2.3.3 Uji Biokimia Khamir Tabung reaksi disiapkan dengan diisi oleh beberapa macam larutan gula yaitu glukosa galaktosa, sukrosa, rafinosa, trehalosa, laktosa dan maltosa. Kemudian dimasukkan tabung dengan posisi terbalik pada dasar tabung reaksi dengan tidak ada gelembung yang terperangkap. Khamir dimasukkan sebanyak 100 µl kemudian tabung diinkubasi pada suhu ruang selama 24-48 jam untuk diamati perubahan warna larutan dan ada atau tidaknya gas CO2 yang terperangkap di tabung. III. HASIL DAN PEMBAHASAN 3.1 Hasil Hasil pengamatan cendawan dari lingkungan akuakultur yang telah diisolasi menggunakan media agar GYA, PDA dan MEA disajikan pada tabel berikut. Tabel 1 Hasil isolasi dan pengamatan morfologi fungi kapang dan khamir Jenis Fungi Kapang (Telur Ikan) Kapang (Organ Ikan) Kapang (Rekultur) Khamir (Isolasi) Gambar Koloni Gambar Morfologi Khamir (Morfologi) Tabel 2 Persentase jumlah sel khamir yang mati, sel khamir yang hidup, dan bentuk koloninya Kelompok 1 2 3 4 5 6 7 8 9 10 ∑ Sel Mati (%) 12,25 11,48 16,70 24,00 47,00 26,00 0,00 0,00 0,00 27,00 ∑ Sel Hidup (%) 87,75 88,52 83,30 76,00 53,00 74,00 100 100 100 73,00 Bentuk Koloni Elips Sirkular Sirkular Sirkular Sirkular Elips Sirkular Sirkular Sirkular Sirkular Berdasarkan tabel 2 diatas dapat kita lihat bahwa persentasi sel khamir hidup tertinggi terdapat pada kelompok 7, 8 dan 9 yaitu sebesar 100%, sedangkan persentase sel khamir hidup terendah ada pada kelompok 5 sebesar 53%. Persentase sel khamir mati tertinggi terdapat pada kelompok 5 yaitu sebesar 47% sedangkan terendah ada pada kelompok 7, 8, dan 9 yaitu 0%. Tabel 3 Hasil uji biokimia isolat khamir pada berbagai media gula Uji Gula Set 1 Gula O/F + O + F + F + F Set 2 Gula O/F + F + F + O + F + F - Set 3 Gula O/F + O + O + O + O + O Set 4 Gula O/F + F + F + O + F + F Glukosa Dekstrosa Sukrosa Rafinosa Trehalosa Laktosa Maltosa Keterangan: + : reaksi positif (media berubah warna menjadi kuning) - : reaksi negatif (tidak terjadi perubahan warna pada media/tetap ungu) O : Oksidatif/aerob F : Fermentatif/anaerob Set 5 Gula O/F + O + O + O + F + O Berdasarkan tabel 3 diatas dapat kita lihat bahwa pada uji glukosa, set 1, set 3 dan set 5 berupa Oksidatif +, sedangkan set 2 dan set 4 berupa Fermentatif +. Pada uji gula dekstrosa set 1, set 2 dan set 4 bersifat Fermentatif +, sedangkan set 3 dan set 5 bersifat Oksidatif +. Uji sukrosa hanya set 1 yang bersifat Fermentatif +, sedangkan set 2 sampai set 5 bersifat Oksidatif +. Uji rafinosa set 1 dan set 2 negatif, set 3 Oksidatif +, set 4 dan set 5 Fermentatif +. Uji trehalosa set 1 dan set 3 sampai set 5 negatif sedangkan set 2 Fermentatif +. Uji laktosa memiliki hasil yang sama dengan uji trehalosa yaitu set 2 Fermentatif + sedangkan yang lainnya negatif. Uji maltosa set 1 dan set 4 Fermentatif +, set 3 dan set 5 Oksidatif + sedangkan set 2 negatif. 3.2 Pembahasan Fungi adalah organisme tidak berklorofil dan mempunyai dinding sel yang kaku. Beberapa bersel satu yang lain multiselular dan menunjukkan sedikit perbedaan pada bagian-bagian strukturnya. Ukuran dan bentuknya berkisar dari khamir yang mikroskopis dan multiselular (kapang) sampai jamur multiselular yang amat besar sepeti jamur kelentos. Fungi memperbanyak diri melalui beberapa proses, baik seksual maupun aseksual (Pelczar dan Chan, 2010). Fungi merupakan organisme kemoheterotrof yang memerlukan senyawa organik untuk nutrisinya. Bila sumber nutrisi tersebut diperoleh dari bahan organik mati, mendekomposisi maka fungi sisa-sisa tersebut tumbuhan bersifat dan saprofit. hewan yang Fungi saprofit kompleks dan menguraikannya menjadi zat yang lebih sederhana. Dalam hal ini, fungi bersifat menguntungkan sebagai elemen daur ulang yang vital (Pratiwi, 2008). Secara umumnya fungi dibagi menjadi 2 yaitu: khamir (Yeast) dan kapang (Mold). Khamir adalah fungi dengan bentuk sel tunggal dengan pembelahan secara pertunasan. Khamir mempunyai sel yang lebih besar daripada kebanyakan bakteri, tetapi khamir yang paling kecil tidak sebesar bakteri yang terbesar. Khamir sangat beragam ukurannya, berkisar antara 1-5μm lebarnya dan panjangnya dari 5-30 μm atau lebih. Biasanya berbentuk telur, tetapi beberapa ada yang memanjang atau berbentuk bola. Setiap spesies mempunyai bentuk yang khas, namun sekalipun dalam biakan murni terdapat variasi yang luas dalam hal ukuran dan bentuk. Sel-sel individu, tergantung kepada umur dan lingkungannya. Khamir tidak dilengkapi flagellum atau organ-organ penggerak lainnya (Coyne, 1999) Kapang adalah fungi yang memiliki miselium dan spora (sel resisten, istirahat atau dorman). Miselium merupakan kumpulan beberapa filamen yang dinamakan hifa. Setiap hifa lebarnya 5-10 μm, dibandingkan dengan sel bakteri yang biasanya berdiameter 1 μm. Disepanjang setiap hifa terdapat sitoplasma bersama (Syamsuri 2004) Terdapat 3 jenis hifa yaitu aseptat atau sinosit yang tidak memiliki sekat atau septum. Hifa septat dengan sel-sel uninukleat. Sekat membagi hifa menjadi ruang-ruang berisi nukleus tunggal. Pada setiap septum berisi pori di tengahtengah yang memungkinkan perpindahan nukleus dan sitoplasma dari satu ruang ke ruang lain. Hifa septa dengan sel-sel multinukleat. Septum membagi hifa menjadi sel-sel dengan lebih dari satu nukleus dalam setiap ruang. Miselium dapat bersifat vegetatif/somatik atau reproduktif. Beberapa hifa dari miselium somatik menembus ke dalam media untuk mendapatkan nutrien. Miselium reproduktif bertanggung jawab untuk pembentukan spora dan biasanya tumbuh meluas ke udara dari media. Miselium suatu kapang dapat merupakan jaringan yang terjalin lepas atau dapat merupakan struktur padat yang terorganisasi, seperti pada jamur (Pelczar dan Chain, 2010). Fardiaz (1992) mengungkapkan bahwa khamir dapat dibedakan atas dua kelompok berdasarkan sifat metabolismenya yaitu bersifat fermentatif dan oksidatif. Jenis fermentatif dapat melakukan fermentasi alkohol yaitu memecah gula (glukosa) menjadi alkohol dan gas. Sedangkan oksidatif (respirasi) maka akan menghasilkan carbon dioksida dan air. Berdasarkan uji gula oleh Lodder (1970) S. cerevisae mempunyai reaksi positif pada glukosa, dekstrosa, galaktosa, sukrosa, maltosa, raffinosa, dan negatif pada gula trehalosa dan laktosa. Jika dibandingkan dengan set uji kelompok kami bisa disimpulkan bahwa khamir yang di uji merupakan S. cerevisiae. Gambar 1. Hasil uji Gula IV. KESIMPULAN DAN SARAN 4.1 Kesimpulan Dari hasil praktikum menunjukkan bahwa jenis khamir yang di uji tergolong Saccharomyces cerevisiae. Pada uji gula didapatkan hasil pada media glukosa, dextrosa, rafinosa, dan maltosa terjadi reaksi fermentatif positif (warna berubah dari ungu menjadi kuning dengan adanya gelembung udara) dan pada sukrosa terjadi Oksidatif positif, pada trehalosa dan laktosa terjadi reaksi negatif (warna tetap ungu). 4.2 Saran Untuk dapat lebih meningkatkan pemahaman tentang fungi sebaiknya jumlah fungi yang diujikan cukup banyak dan berbeda antar kelompok. Media uji biokimia gula harus dipastikan benar dalam pembuatannya, tidak terdapat gelembung gas. Dan pada saat penghitungan sel khamir, sebaiknya para praktikan diajarkan cara menghitung menggunakan haemocytometer selain dengan menggunakan handcounter, sehingga praktikan dapat membedakan mana metode yang lebih baik. DAFTAR PUSTAKA Ali, A. 2005. Mikrobiologi Dasar Jilid I. State University of Makassar Press. Makassar. Coyne, Mark S. 1999. Soil Microbiology: An Exploratory Approach. USA: Delmar Publish Fardiaz, S. 1992. Mikrobiologi Pangan 1. PT Gramedia Pustaka Utama. Jakarta. Hoog, J.L., Schwartz C., Noon A.T., O’toole E.T., Mastronarde D.N, McIntosh JR, Antony C. 2007. Organization Of Interphase Microtubules In Fission Yeast Analyzed By Electron Tomography. Dev Cell. 12(3): 349-61. Lodder. 1970. The Yeast: A Tacsonomi Study, North Holland Publising Company. Madigan MT, JM Martinko, DA Stahl & DP Clark. 2012. Brock Biology Of Microoganism. San Fransisco: Pearson Education. Pelczar, M.J dan E.C.S. Chan. 2010. Dasar-Dasar Mikrobiologi (terjemahan), R.S. Hadioetomo, T. Imas, S. S. Tjitrosomp dan S. L. Angka. Jakarta (ID): UI Press. Pratiwi, Sylvia T. 2008. Mikrobiologi Farmasi. Penerbit Erlangga: Jakarta Syamsuri, Istamar. 2004. Biologi. Erlangga. Jakarta Waluyo, L. 2004. Mikrobiologi Umum. UMM Press. Malang Webster, J. and R. Weber. 2007. Introduction to Fungi. Cambridge University Press. New York. Laporan Praktikum ke-6 m.k. Mikrobiologi Akuakultur Hari/Tanggal : Senin, 10 November 2014 Kelompok : IV Asisten : 1. Rahman, S.Pi., M.Si 2. Asisten Mikro 2013 PENGHITUNGAN BAKTERI DENGAN METODE HITUNGAN CAWAN Oleh: Stefanno. M. A. Rijoly C151140401 ILMU AKUAKULTUR SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR 2014 I. PENDAHULUAN 1.1 Latar Belakang Jumlah mikrobia pada suatu bahan dapat ditentukan dengan bermacam- macam cara, tergantung pada bahan dan jenis mikrobia yang ditentukan. Jenis populasi mikrobia dalam tanah, air, bahan makanan dan lain-lainnya berbeda-beda tergantung pada susunan bahan tersebut. Berbagai macam metode tersedia untuk perhitungan mikroorganisme. Pemilihan metode akan tergantung pada sejumlah faktor diantaranya yaitu jenis sampel, organisme spesifik yang dicari, karakteristik media tertentu, batas bawah dari perhitungan yang diperlukan, tujuan dari pemeriksaan dan waktu yang tersedia. Pengukuran kuantitatif populasi mikroba dalam suatu sampel dilakukan untuk mengetahui kualitas bahan atau tujuan lain berdasarkan jumlah mikroba yang ada dalam sampel tersebut. Ada berbagai cara untuk mengukur jumlah sel, antara lain dengan penghitungan mikroskopis langsung (direct microscopis count) dan penghitungan tidak langsung (indirect count) dengan hitungan cawan, baik dengan metode penyebaran maupun metode penuangan (Waluyo, 2008). Ada beberapa cara untuk mengukur atau menghitung mikrobia yaitu dengan perhitungan jumlah sel, perhitungan massa sel secara langsung, dan pendugaan massa sel secara tak langsung. Perhitungan jumlah sel dapat dilakukan dengan tiga metode yaitu dengan hitungan mikroskopik, MPN (Most Probable Number), dan hitungan cawan (Fardiaz, 1992). Bakteri dapat dihitung dengan menggunakan metode cawan petri (metode perhitungan secara tidak langsung) yang didasarkan pada anggapan bahwa setiap sel yang dapat hidup akan berkembang menjadi satu koloni yang merupakan suatu indeks bagi jumlah organisme yang dapat hidup yang terdapat pada sampel (Penn, 1991). Metode hitung cawan didasarkan pada anggapan bahwa setiap sel yang dapat hidup akan berkembang menjadi satu koloni. Jadi jumlah koloni yang muncul pada cawan merupakan suatu indeks bagi jumlah mikroorganisme yang dapat hidup yang terkandung di dalam sampel. Prinsip dalam metode cawan adalah adanya seri pengenceran sampel. Pengenceran bertujuan mikroorganisme yang diamati dapat dihitung (Robert dan Greenwod, 2003). agar Untuk mempermudah penghitungan jumlah koloni bakteri digunakan alat yang biasa disebut Colony Counter. Pada alat Colony Counter, penghitungan jumlah koloni bakteri dipermudah dengan adanya counter electronic. Dengan adanya counter tersebut peneliti tinggal menandai koloni bakteri yang dihitung dengan menggunakan pen yang terhubung dengan counter. Setiap koloni yang ditandai maka counter akan menghitung. Penghitungan suatu koloni dengan metode pour plate masih memungkinkan terjadinya kesalahan dikarenakan faktor human error akibat bentuk koloni yang relatif kecil dan banyaknya koloni yang akan dihitung (Waluyo, 2008). 1.7 Tujuan Tujuan dari praktikum ini adalah untuk mempelajari cara melakukan pengenceran serial dan menentukan jumlah bakteri dalam suatu sampel dengan metode hitungan cawan. II. METODOLOGI 2.1 Waktu dan Tempat Praktikum ini dilaksanakan pada hari Senin, 10 November 2014 pukul 08.00-10.00 WIB, bertempat di Laboratorium Kesehatan Ikan (LKI), Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. 2.2 Alat dan Bahan Alat yang digunakan dalam praktikum adalah vortex, bunsen, jarum ose, mikropipet, pipet volume, tabung reaksi, spidol, tissue, kertas label, cawan petri, dan batang penyebar. Bahan yang digunakan dalam praktikum adalah suspensi biakan Pseudoalteromonas sp. media SWC dalam cawan petri, larutan fisiologis (0, 85% NaCl) dan alkohol 70%. 2.3 Prosedur Kerja 2.3.1 Metode Cawan Sebar Tabung-tabung berisi garam fisiologis dan disusun berderet. Kemudian sampel suspensi bakteri di vortex agar homogen sampai merata. Selanjutnya dilakukan pengenceran serial sampel suspensi bakteri yaitu dengan mengambil secara aseptik. Stok bakteri yang sudah disiapkan pada pengenceran 10-4 kemudian 1 ml suspensi bakteri lalu dimasukkan ke tabung 9 ml pertama (10-5). Vortex agar homogen, lalu diambil lagi secara aseptik pipet 1 ml sampel dari tabung pengencer pertama dan masukkan ke dalam tabung pengencer kedua (106 ), dan seterusnya sampai tabung pengencer ketiga (10-7). Gambar 1. Prosedur praktikum perhitungan bakteri dengan metode hitungan cawan 2.3.2 Metode Cawan Tuang Siapkan 3 cawan petri steril dan 3 cawan petri berisi media SWC. Kemudian diberi kode sesuai dengan kode tabung pengencer yang akan dituang atau disebar. Selanjutnya diambil 0,1 ml sampel dari tabung pengencer 1, 2 dan 3, lalu masing-masing disebar pada media SWC dengan menggunakan batang penyebar. Selanjutnya digoyangkan secara perlahan-lahan untuk meratakan media dan dibiarkan agar dalam cawan-cawan petri menjadi padat. Setelah itu diletakkan dalam posisi terbalik untuk diinkubasi pada suhu kamar selama 24 jam. Selanjutnya jumlah koloni yang tumbuh dihitung (30-300) dan dikalikan dengan faktor pengencernya. 2.3.3 Prosedur Perhitungan Cawan Beberapa prinsip yang harus diperhatikan dalam metode hitung cawan yaitu 1 koloni yang tumbuh berasal dari 1 bakteri. Jumlah koloni yang tumbuh dapat digunakan dalam perhitungan yaitu yang berkisar antar 30-300 koloni. Jika terdapat 2 pengenceran bakteri yang menghasilkan koloni antar 30-300 maka yang digunakan sebagai hasil adalah pengenceran terkecil atau jumlah koloni yang paling sedikit ditemukan. Berikut adalah rumus metode hitung cawan. Ʃ 𝑘𝑒𝑝𝑎𝑑𝑎𝑡𝑎𝑛 𝑏𝑎𝑘𝑡𝑒𝑟𝑖 = Ʃ 𝑘𝑜𝑙𝑜𝑛𝑖 𝑥 1 𝑃𝑒𝑛𝑔𝑒𝑛𝑐𝑒𝑟𝑎𝑛 𝑥 1 𝑣𝑜𝑙𝑢𝑚𝑒 𝑦𝑎𝑛𝑔 𝑑𝑖𝑠𝑒𝑏𝑎𝑟 III. HASIL DAN PEMBAHASAN 3.1 Hasil Berdasarkan hasil pengamatan dan perhitungan pada semua cawan petri diperoleh hasil seperti pada tabel berikut: Tabel 1 Hasil pengamatan Total Plate Count (TPC) bakteri dengan metode hitungan cawan tuang dan sebar Total Plate Count (cfu/ml) 10-5 10-6 10-7 7 8 Tuang 35,8 x 10 33,6 x 10 18,4 x 109 1 1 Ub Sebar 58,6 x 109 8 Tuang 1,6 x 10 TBUD TBUD 2 NP5 Sebar TBUD 7,8 x 108 0 Tuang 3 Sta Sebar Tuang 16,2 x 109 4 1 Ub Sebar TBUD Tuang TBUD 2,34 x 1011 0 5 NP5 Sebar TBUD TBUD TBUD Tuang 6 Sta Sebar Tuang 25,8 x 107 43,2 x 109 7 1 Ub Sebar TBUD TBUD TBUD Tuang 0 0 8 NP5 Sebar 15 x 108 0 Tuang 9 Sta Sebar Tuang TBUD TBUD TBUD 10 Sta Sebar TBUD TBUD TBUD Keterangan: *Syarat statistik dalam TPC adalah terdapat 30-300 koloni yang tumbuh TBUD : Terlalu Banyak Untuk Dihitung ( 300 koloni bakteri), 0 : Jumlah koloni 30, (-) : Kontaminasi (bakteri tidak tumbuh) Kelompok 3.2 Isolat Metode Pembahasan Metode penghitungan yang digunakan adalah penghitungan tidak langsung dengan hitungan cawan. Metode ini ada dua jenis, yaitu cawan sebar dan cawan tuang. Sebelum bakteri ditanam pada media, harus dilakukan pengenceran dahulu terhadap suspensi bakteri sampelnya. Bakteri yang yang digunakan pada kelompok kami adalah isolat 1Ub (Pseudoalteromonas sp). Bakteri pada tabung pengencer terakhir jumlahnya akan lebih sedikit dari tabung pengencer sebelumnya (Gambar 1). Pengenceran dilakukan agar setelah inkubasi, koloni yang terbentuk pada cawan tersebut dalam jumlah yang dapat dihitung. Dimana jumlah terbaik adalah antara 30 sampai 300 sel mikrobia /ml, /gr, atau /cm permukaan (Fardiaz, 1992). Prinsip pengenceran adalah menurunkan jumlah sehingga semakin banyak jumlah pengenceran yang dilakukan, makin sedikit sedikit jumlah mikroba, dimana suatu saat didapat hanya satu mikrobia pada satu tabung (Waluyo, 2004). Gambar 2. Koloni Bakteri dengan Cawan Sebar Koloni bakteri adalah sekumpulan dari bakteri-bakteri yang sejenis yang mengelompok menjadi satu dan membentuk suatu koloni-koloni. Menurut Waluyo (2008), Hasil menghitung dengan cara hitungan cawan menggunakan suatu stanar yang disebut Standard Plate Count (SPC) sebagai berikut: 1. Jumlah koloni tiap cawan petri antara 30-300 koloni, jika memang tidak ada yang memenuhi syarat dipilih yang jumlahnya mendekati 300. 2. Tidak ada koloni yang menutup lebih besar dari setengah luas cawan petri, dikenal sebagai spreader. 3. Perbandingan jumlah bakteri dari hasil pengenceran yang berturut-turut antara pengenceran sebelumnya, jika sama atau lebih kecil dari 2 hasilnya dirata-rata tetapi jika lebih besar dari 2 yang dipakai jumlah mikrobia dari hasil pengenceran sebelumnya. 4. Beberapa koloni yang bergabung menjadi satu merupakan satu kumpulan koloni yang besar dimana jumlah koloninya diragukan dapat dihitung sebagai satu koloni 5. Satu deret rantai koloni yang terlihat sebagai suatu garis tebal dihitung sebagai satu koloni Perhitungan bakteri dengan metode Plate Count (hitungan cawan) didasarkan pada asumsi bahwa setiap sel mikroorganisme hidup dalam suspensi akan tumbuh menjadi satu koloni. Jumlah koloni yang muncul pada cawan merupakan suatu indeks jumlah mikroba yang hidup terkandung dalam sampel. Setelah diinkubasi, jumlah koloni masing-masing cawan diamati. Jumlah mikroba dalam sampel ditentukan dengan mengalikan jumlah koloni dengan faktor pengenceran pada cawan yang bersangkutan. Menhitung jumlah koloni mikroba hidup dengan mengalikan faktor pengenceran yang digunakan dikalikan 10 karena hanya 0,1 ml suspensi yang digunakan memperoleh CFU/ml (CFU = Coloni Forming Units). Metode ini merupakan cara paling sensitif untuk menentukan jumlah jasad renik, dengan alasan haya sel mikroba yang hidup yang dapat dihitung, beberapa jasad renik dapat dihitung sekaligus, dapat digunakan untuk isolasi dan identifikasi mikroba karena koloni yang terbentuk mungkin berasal dari mikroba yang mempunyai penampakan spesifik. Sementara kekurangannya adalah hasil hitungannya tidak menunjukkan jumlah sel yang sebenarnya, karena beberapa sel yang berdekatan mungkin membentuk satu koloni, medium dan kondisi inkubasi yang berbeda mungkin menghasilkan nilai yang berbeda, jasad renik yang ditumbuhkan harus dapat tumbuh pada medium padat dan membentuk koloni yang kompak dan jelas, tidak menyebar dan memerlukan persiapan dan waktu inkubasi yang relatif lama sehingga pertumbuhan koloni dapat dihitung (Waluyo, 2008). Berdasarkan hasil pengamatan, pada metode tuang hanya pada pengenceran 10-7 jumlah koloni bakteri yang tumbuh sebesar 16,2x109 pada pengenceran 10-5 dan 10-6 tidak tumbuh koloni bakteri. Pada metode cawan sebar pengenceran10-5 koloni tidak dapat dihitung (TBUD). Hal ini disebabkan oleh kesalahan dalam praktikum seperti pada proses pengenceran, kurang aseptik sehingga terjadi kontaminan, penyebaran yang tidak merata, dan adanya penumpukan sel sehingga sulit dihitung. Hal ini dikemukakkan oleh Fardiaz (1992), pada penanaman bakteri dibutuhkan kondisi aseptis atau steril, baik pada alat maupun proses, untuk menghindari kontaminasi, yaitu masuknya mikrobia yang tidak diinginkan. Gambar 3. Koloni Bakteri yang Tumbuh dengan Metode Cawan Tuang Metode pour plate digunakan ketika ingin menumbuhkan bakteri anaerob, karena media dituang setelah kultur sehingga menyebabkan kondisi anaerob pada cawan. Kelebihan dari metode ini adalah mudah dilakukan, koloni tersebar merata pada media dan kekurangannya yaitu butuh kehati-hatian dalam menuang ke media, kontaminasi sulit dibedakan dan koloni yang berbeda saling bertumpuk. Metode spread plate digunakan digunakan ketika ingin menumbuhkan bakteri aerob, karena media sudah ada terlebih dahulu pada cawan kemudian dituangi kultur sehingga menyebabkan kondisi aerob pada cawan. Kelebihan metode ini adalah koloni tersebar merata pada permukaan media, kontaminan mudah dibedakan, sedangkan kekurangannya adalah harus dilakukan dengan hati-hati dan hanya dapat menumbuhkan bakteri aerob (Fardiaz, 1992). Bakteri genus Pseudoalteromonas diketahui memiliki fragmen gen nonribosomal peptide synthetase (NRPS) yang diketahui mampu menghasilkan siderophore Alterobactin (Deng et al., 1995 dalam Pringgenies, 2010). Pseudoalteromonas sp. pertama kali terisolasi dari alga laut dilingkungan pesisir laut. Bakteri ini termasuk bakteri gram negatif yang dapat ditemukan di laut seluruh dunia, bergerak dengan alat satu flagellum di ujung / kutub yang membantu untuk bergerak bolak-balik antara solid permukaan laut dan perairan terbuka dalam mencari sumber makanan. Tipe sel bakteri biasanya satu atau berpasangan serta memperoleh energi melalui mekanisme kemoorganotrofik. Kemoorganotrofik membentuk biofilm-bakteri yang penting untuk bioremidiasi. Biofilm penting dalam pengendalian konsentrasi logam beracun dalam lingkungan laut karena dapat menyerap 20 – 40 % dari tumpahan logam timah (Totten dan Lary, 1990). Faktor yang mempengaruhi hasil penghitungan koloni pada metode hitungan cawan, hingga diperoleh hasil TNTC/TBUD atau koloni tidak muncul antara lain tingkat pengenceran terlalu tinggi sehingga menyebabkan koloni tidak muncul, tingkat pengenceran terlalu rendah sehingga koloni yang muncul terlalu banyak (> 300) sehingga tidak bisa dihitung, ketidaksesuaian media yang digunakan, adanya kontaminasi yang bisa disebabkan karena alat yang digunakan, lingkungan dan diri yang tidak aseptis kondisi pH dan suhu yang tidak sesuai (Fardiaz, 1992) IV. KESIMPULAN DAN SARAN 4.1 Kesimpulan Berdasarkan hasil praktikum kelompok bakteri isolat 1Ub tidak tumbuh pada pengenceran 10-5 dan 10-6, tapi tumbuh di pengenceran 10-7 pada metode cawan tuang dengan jumlah 16,2x109. Sedangkan pada metode sebar pada pengenceran 10-5 TBUD dan pada pegenceran 10-6 dan 10-7 tidak tumbuh. 4.2 Saran Perlu ketelitian serta kehati-hatian dalam praktikum agar bakteri dapat hidup dengan baik dan dapat dihitung koloni sesuai yang diharapkan. DAFTAR PUSTAKA Fardiaz, S. 1992. Mikrobiologi Pangan 1. PT Gramedia Pustaka Utama. Jakarta. Penn, C. W. (1991). Pathogenicity and molecular biology of Treponemes. Rev Med Microbiol 2, 68±75. Pringgenies, D. Karakterisasi Senyawa Bioaktif Bakteri Simbion Moluska dengan GC-MS. Jurnal Ilmu dan Teknologi Kelautan Tropis, Vol.2, No.2, Hal.3440, Desember 2010 Robert, D. and Greenwood, M. 2003. Practical Food Microbiology. Massachusetts: Blackwell Publishing Salosa Y. 2013. Uji Kadar Formalin, Kadar Garam dan Total Bakteri Ikan Asin Tenggiri Asal Kabupaten Sarmi Propinsi Riau. [Skripsi]. Teknologi Hasil Perikanan. IPB. Bogor. Totten, A. P. and Lory, S. (1990). Characterization of a type A¯ agellin gene from Pseudomonas aeruginosa PAK. J Bacteriol 172, 7188±7199. Waluyo, L. 2004. Mikrobiologi Umum. UMM Press. Malang Laporan Praktikum ke-7 m.k. Mikrobiologi Akuakultur Hari/Tanggal : Jumat, 21 November 2014 Kelompok : IV Asisten : 1. Rahman, S.Pi., M.Si 2. Asisten Mikro 2013 PENGARUH SUHU DAN SALINITAS TERHADAP VIABILITAS BAKTERI Oleh: Stefanno. M. A. Rijoly C151140401 ILMU AKUAKULTUR SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR 2014 I. PENDAHULUAN 1.1 Latar Belakang Mikrobiologi merupakan ilmu yang mempelajari organisme mikroskopis atau yang sering disebut mikroorganisme. Mikroorganisme merupakan organisme yang berukuran sangat renik, yaitu makhluk yang berukuran mikron atau lebih kecil lagi, sehingga dapat hidup di berbagai lingkungan (Madigan et al 2012). Bakteri bersifat ada yang menguntungkan dan ada juga yang merugikan. Bakteri biasa digunakan sebagai probiotik bagi ikan dan bakteri yang merugikan besia mengakibatkan penyakit. Penyakit ikan dalam kegiatan budidaya dapat mengakibatkan kerugian ekonomis, semua itu berhubungan dengan lingkungan tempat hidup ikan dikarenakan didalamnya terdapat berbagai jenis mikroorganisme serta polusi. Bakteri hanya dapat tumbuh baik pada kondisi fisika, kimia yang optimum. Bakteri tidak hanya amat bervariasi dalam persyaratan nutrisinya, tetapi juga mununjukkan respon yang berbeda-beda terhadap kondisi fisik di dalam lingkunganya. Untuk menghasilkan kultivasi berbagai tipe bakteri, dibutuhkan suatu kombinasi nutrien serta lingkungan fisik yang sesuai (Pelczar dan Chan 2010). Menurut Waluyo (2008), pengamatan bakteri dapat dilakukan secara individual, satu per satu, maupun secara kelompok dalam bentuk koloni. Bila bakteri yang ditumbuhkan di dalam medium yang tidak cair, maka akan terjadi suatu kelompok yang dinamakan koloni. Bentuk koloni berbeda-beda untuk setiap spesies, dan bentuk tersebut merupakan ciri khas bagi suatu spesies tertentu. Aktivitas mikroorganisme dipengaruhi oleh lingkungan. Perubahan yang terjadi di dalam lingkungan dapat mengakibatkan perubahan sifat morfologi dan fisiologi mikroorganisme. Beberapa golongan sangat tahan terhadap perubahan lingkungan, sehingga cepat dapat menyesuaikan diri dengan kondisi baru. Ada pula golongan mikroorganisme yang sama sekali peka terhadap perubahan lingkungan sehingga tidak dapat menyesuaikan diri. Faktor lingkungan penting artinya dalam usaha mengendalikan kegiatan mikroorganisme, baik untuk kepentingan proses ataupun pengendalian (Suriawiria 2008). Faktor-faktor lingkungan dapat dibedakan menjadi dua kelompok yaitu faktor abiotik yang meliputi faktor kimia dan fisika dan faktor biotik yang berhubungan dengan jasad hidup lain. Faktor abiotik yang bersifat kimia antara lain pH, oksigen, ammonia, dan lain-lain, sedangkan yang bersifat fisika adalah temperatur atau panas, tekanan osmosa, pengeringan, penyinaran, dan lain-lain (Widanarni 2011). Mikroorganisme dalam melakukan segala aktivitas hidupnya, tentu dipengaruhi oleh berbagai faktor, terutama faktor lingkungan dan unsur ekologi. Faktor-faktor lingkungan yang berpengaruh terhadap kelangsungan hidup mikroba dikelompokkan menjadi faktor abiotik dan biotik (Kusnadi 2003). Faktor abiotik dapat berupa unsur kimia dan fisika. Dari berbagai unsur kimia dan fisika yang ada, terdapat faktor yang sangat penting yaitu pengaruh suhu dan salinitas terhadap viabilitas bakteri. Mikroorganisme mampu beradaptasi secara optimum pada lingkungan fisiologis yang normal. Setiap perubahan ekstrim pada kondisi lingkungan akan mengakibatkan stress terhadap mikroorganisme. Lamanya perubahan tersebut akan menentukan apakah organisme tersebut mati, terhambat pertumbuhannya, atau memperpanjang fase lag dan penurunan kecepatan pertumbuhannya. Pengamatan pengaruh suhu dan salinitas terhadap viabilitas bakteri dilakukan untuk mengetahui pada kondisi suhu dan tekanan osmosa berapa yang cocok bagi kehidupan bakteri, terutama bakteri yang menguntungkan bagi kegiatan budidaya. 1.8 Tujuan Praktikum ini bertujuan untuk mengamati dan mempelajari pengaruh suhu dan salinitas terhadap viabilitas bakteri dan mengetahui kondisi suhu dan salinitas yang optimum untuk pertumbuhan bakteri. II. METODOLOGI 2.1 Waktu dan Tempat Praktikum ini dilaksanakan pada hari Jumat, 21 November 2014 pukul 16.00-18.00 WIB, bertempat di Laboratorium Kesehatan Ikan (LKI), Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. 2.2 Alat dan Bahan Peralatan yang digunakan dalam praktikum adalah cawan petri, jarum ose, bunsen, inkubator, oven, kulkas, dan ependorf. Sedangkan bahan-bahan yang digunakan adalah TSA, bakteri Aeromonas hidrophilla (Ah) dan Bacillus (NP5), NaCl dan alkohol 70%. 2.3 Prosedur Kerja Prosedur kerja pengaruh suhu yaitu koloni bakteri Aeromonas hidrophilla (Ah) dan Bacillus (NP5) disiapkan pada empat buah tabung ependof. Masingmasing tabung dikondisikan pada suhu yang berbeda selama 30 menit meliputi suhu 4°C di kulkas, 28°C di suhu ruang, 37°C di inkubator dan 70°C di oven. Setelah 30 menit masing-masing bakteri digores dengan jarum oce pada cawan petri yang sudah berisi media TSA. Petri diinkubasi pada suhu ruang selama 24 jam dan siap diamati. Prosedur kerja pengaruh salinitas yaitu disiapkan 4 buah cawan petri berisi media TSA dengan 4 macam kandungan NaCl yaitu 0%, 1,5%, 3% dan 5%. Masing-masing cawan petri digores dengan bakteri Aeromonas dan Bacillus yang ditumbuhkan pada suhu ruang dengan menggunakan jarum ose. Kemudian cawan petri diinkubasi selama 24 jam pada suhu ruang dan siap diamati. III. HASIL DAN PEMBAHASAN 3.1 Hasil Hasil pengamatan uji viabilitas bakteri dengan suhu dan salinitas akan disajikan pada tabel berikut. Tabel 1 Hasil pengamatan pengaruh suhu dan salinitas terhadap viabilitas bakteri Aeromonas hidrophila dan NP5 (Bacillus) Kelompok 1 2 3 4 5 6 7 8 9 10 Isolat bakteri Ah NP5 Ah NP5 Ah NP5 Ah NP5 Ah NP5 Ah NP5 Ah NP5 Ah NP5 Ah NP5 Ah NP5 4°C ++ +++ ++ ++ +++ +++ ++ ++ +++ +++ ++ ++ +++ ++ +++ +++ +++ ++ +++ +++ Suhu 28°C 37°C ++ ++ ++ ++ ++ +++ +++ +++ +++ ++ +++ ++ ++ +++ ++ +++ +++ ++ +++ ++ +++ ++ +++ ++ +++ ++ +++ ++ ++ ++ ++ ++ +++ +++ +++ ++ +++ ++ +++ ++ 70°C + ++ + + + + + + + + ++ + + 0% ++ ++ ++ +++ +++ +++ ++ ++ +++ +++ +++ +++ +++ +++ +++ +++ +++ +++ +++ +++ Salinitas 1,5% 3% ++ ++ ++ ++ ++ + ++ ++ +++ ++ +++ +++ +++ ++ +++ ++ +++ ++ +++ +++ ++ + ++ ++ ++ ++ ++ ++ +++ ++ +++ ++ +++ +++ ++ ++ +++ ++ +++ ++ 5% ++ + + + + ++ + + + + Keterangan: +++ : Bakteri tumbuh sangat baik, ++ : Bakteri tumbuh baik, + : Bakteri tumbuh sedikit, - : Bakteri tidak tumbuh 3.2 Pembahasan Berdasarkan data hasil praktikum kelompok 4 pada tabel 1 diatas dapat dinyatakan bahwa bakteri A. hydrophilla dan Bacillus sp tumbuh sangat baik pada suhu 37˚C dan mampu tumbuh baik setelah diberi perlakuan suhu 4˚C serta 28˚C. Bakteri Aeromonas tidak mampu hidup pada suhu terlalu panas yaitu 70˚C tetapi Bacillus sp mampu hidup pada suhu 70˚C walaupun jumlahnya kecil (gambar 1). Berdasarkan tabel 1 diatas dapat dinyatakan bahwa pertumbuhan bakteri Bacillus sp yang paling baik adalah pada kadar salinitas 1,5 ppt dan masih hidup pada kadar Salinitas yang mencapai 5 ppt. Bakteri Aeromonas hydrophylla tumbuh sangat baik pada kadar salinitas 1,5 ppt, dan tidak tumbuh pada salinitas mencapai 5 ppt (gambar 2). Suhu 4˚C Suhu 28˚C Suhu 37 oC Suhu 70 oC Gambar 1. Hasil Pengaruh Suhu Terhadap Viabilitas Bakteri. Salinitas 0% Salinitas 1,5% Salinitas 3% Salinitas 5% Gambar 2. Hasil Pengaruh Salinitas Terhadap Viabilitas Bakteri Semua proses pertumbuhan bergantung pada reaksi kimiawi dan karena laju reaksi-reaksi ini dipengaruhi susu, maka pola pertumbuhan bakteri juga sangat dipengaruhi suhu. Setiap spesies bakteri tumbuh pada suatu kisaran suhu tertentu. Atas dasar ini maka bakteri dapat diklasifikasikan sebagai: psikofil, yang tumbuh pada 0 sampai 30˚C; mesofil, yang tumbuh pada 25 sampai 40˚C; dan termofil, yang tumbuh pada suhu lebih dari 50˚C (Pelczar dan Chan, 2010). Suhu lingkungan dapat mempengaruhi laju pertumbuhan, proses metabolisme dan morfologi sel bakteri. Toleransi suhu untuk pertumbuhan mikrooganisme berkisar antara 20 – 40˚C (Madigan et al., 2012). Setiap spesies bakteri tumbuh pada suatu kisaran suhu tertentu (Pelczar and Chan, 2010) Aeromonas sp. Merupakan bakteri penyebab penyakit pada ikan tergolong bakteri mesofilik dan dapat tumbuh baik pada suhu berkisar antara 15 – 35˚C (Percival et al., 2004). Bakteri Aeromonas hydrophila termasuk dalam bakteri golongan mesofil dan bakteri Bacillus sp. termasuk dalam bakteri termofil. Kabata (1985) dalam Sari, et al. (2009) menyatakan bahwa Aeromonas hydrophila merupakan bakteri mesofilik dengan suhu optimum 20-30˚C. Berdasarkan hasil pengamatan, pada pengaruh suhu terhadap pertumbuhan, bakteri A. hydrophila tidak tumbuh pada suhu 70˚C namun tumbuh baik pada suhu kamar, 4˚C serta 28˚C serta tumbuh sangat baik pada suhu 37˚C. Pada pengaruh salinitas terhadap pertumbuhan, bakteri A. hydrophila tumbuh sangat baik pada salinitas 0 ppt dan tumbuh baik pada salinitas 1,5 ppt dan 3 ppt, dan tidak tumbuh pada salinitas 5 ppt. Hal ini menunjukan bahwa A. hydrophila merupakan bakteri yang bersifat psikrofilik yaitu tumbuh pada suhu kurang dari 15°C dan beberapa diantaranya bersifat mesofilik yaitu tumbuh pada suhu 25-37oC. A. hydrophila tidak mampu bertahan hidup atau tidak ada pertumbuhan pada media yang mempunyai konsentrasi garam 10%. Hal tersebut dikarenakan , antara media dan sel terjadi perbedaan tekanan osmosa yang tinggi sehingga reaksi yang terjadi adalah media hipertonik terhadap sel sehingga terjadi plasmolisis yang menyababkan sel tidak tumbuh pada media dengan konsentrasi kadar garam tinggi tersebut. Pernyataan ini sesuai dengan pendapat Fauzi (2001) bahwa Bakteri A. hydrophila hidup pada suhu antara 5 - 37oC dan tumbuh baik pada salinitas 1-3%. Berdasarkan hasil pengamatan, pada pengaruh suhu terhadap pertumbuhan, bakteri Bacillus sp. tumbuh sangat banyak pada suhu kamar dan suhu 37˚C, tumbuh banyak pada suhu 4˚C serta 28˚C dan tumbuh sedikit pada suhu 70˚C. Pada pengaruh salinitas terhadap pertumbuhan, Bacillus sp. tumbuh sangat baik pada salinitas 0 ppt, tumbuh baik pada salinitas 1.5 ppt, salinitas 3% dan salinitas 5 ppt. Hal ini menunjukan bahwa Bacillus sp. merupakan bakteri yang bersifat psikrofilik yaitu tumbuh pada suhu kurang dari 15˚C dan beberapa diantaranya bersifat mesofilik yaitu tumbuh pada suhu 25-37˚C. Pernyataan ini sesuai dengan pendapat Feliatra et al (2004) bahwa bakteri Bacillus sp. Tumbuh optimum pada suhu 30-37˚C dan tumbuh baik pada NaCl 1-3% serta pendapat Nguyen et al (2006) yang menyatakan bahwa bakteri Bacillus sp tidak mampu tumbuh pada media dengan salinitas diatas 5%. IV. KESIMPULAN DAN SARAN 4.1 Kesimpulan Suhu optimum tumbuh untuk Aeromonas hydrophilla dan Bacillus sp yaitu 37˚C. A. hydrophilla tidak akan tumbuh pada suhu 70˚C karena tergolong bakteri mesofil sedangkan Bacillus sp mampu tumbuh hingga suhu 70˚C karena termasuk bakteri golongan termofil. Salinitas optimum untuk pertumbuhan bakteri Aeromonas hydrophilla dan Bacillus sp yaitu pada salinitas 0 ppt. 4.2 Saran Sebaiknya pengaruh faktor lingkungan yang lainnya seperti pH, kelembaban, intensitas cahaya dll juga diuji untuk mendapatkan informasi yang lebih lengkap dan akurat mengenai sifat bakteri tersebut. DAFTAR PUSTAKA Fauzi, Azhari. 2001. Pengaruh Pemberian Lekamisol dan Saccharomyces cerevisiae dosis 60 ppm terhadap Gambaran darah Ikan Mas (Cyprinus carpio) yang diinfeksi bakteri Aeromonas hydrophilla. [Skripsi]. Program Studi Teknologi dan Manajemen Akuakultur. Departemen Budidaya Perairan. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor. Feliatra, Irwan Efendi, dan Adwar Suryadi. 2004. Isolasi dan Identifikasi Bakteri Probiotik dari Ikan Kerapu Macan (Ephinephalus fuscogatus) dalam Upaya Efisiensi Pakan Ikan. Jurnal Natur Indonesia 6(2): 75-80. Madigan MT, JM Martinko, DA Stahl & DP Clark. 2012. Brock Biology Of Microoganism. San fransisco : Pearson Education. Nguyen K. M. Tam, Nguyen Q. Uyen, Huynh A. Hong, Le H. Duc, Tran T. Hoa, Claudia R. Serra, Adriano O. Henriques, and Simon M. Cutting. 2006. The Intestinal Life Cycle of Bacillus subtilis and Close Relatives. J Bacteriol. 2006 April; 188(7): 2692–2700. Pelczar, M.J dan E.C.S. Chan. 2010. Dasar-Dasar Mikrobiologi (terjemahan), R.S. Hadioetomo, T. Imas, S. S. Tjitrosomp dan S. L. Angka. Jakarta (ID): UI Press. Percival S L, RM Chalmers, M Embrey, P R Hunter, J Sellwood, P Wyn-Jones., 2004. Bacteriologi, In the Microbiology of Waterborne Diseases. Elsevier Academic Press. Great Britain. 21 – 209 P. Sari, Nurlita Annisa, Ririn Nurul Fauziah, dan Ai Tety Nurbaety. 2009. Pengaruh suhu dan salinitas terhadap viabilitas bakteri Aeromonas hydrophila dan Bacillus sp. [Karya Ilmiah]. Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Suriawiria, Unus. 2008. Mikrobiologi Air dan Dasar-Dasar Pengolahan Buangan Secara Biologis. Bandung: PT. alumni. Waluyo, Lud. 2008. Mikrobiolgi Umum. Malang: UMM Press. Widanarni. 2011. Modul Praktikum Mikrobiologi Akuatik. Bogor: Institut Pertanian Bogor. Laporan Praktikum ke- 8 m.k. Mikrobiologi Akuakultur Hari/Tanggal : Senin, 24 November 2014 Kelompok : IV Asisten : 1. Rahman, S.Pi., M.Si 2. Asisten Mikro 2013 PENGARUH BAHAN ANTIMIKROBA TERHADAP VIABILITAS BAKTERI Oleh: Stefanno. M. A. Rijoly C151140401 ILMU AKUAKULTUR SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR 2014 I. PENDAHULUAN 1.1 Latar Belakang Mikrobiologi merupakan telaah mengenai organisme hidup yang berukuran mikroskopis yang dikenal dengan mikroorganisme. Percobaanpercobaan Koch membuktikan bahwa jasad renik tertentu menyebabkan timbulnya penyakit tertentu (Pelczar dan Chan, 2010). Antibiotik adalah senyawa kimia yang dihasilkan oleh mikroorganisme yang dapat membunuh atau menghambat perkembangan bakteri dan organisme lain. Antibiotik, yang pertama kali ditemukan oleh Paul Ehlrich pada 1910, sampai saat ini masih menjadi obat andalan dalam penanganan kasus-kasus penyakit infeksi. Mekanisme kerja utama antibiotik, yaitu sebagai antimetabolit, menghambat sintesis dinding sel, menghambat fungsi membran sel, menghambat sintesis protein, menghambat sintesis asam nukleat (Dalimunthe, 2009). Antimikroba adalah obat yang digunakan untuk memberantas infeksi mikroba pada manusia. Sedang antibiotika adalah senyawa kimia yang dihasilkan oleh mikroorganisme (khususnya dihasilkan oleh fungi) atau dihasilkan secara sintetik yang dapat membunuh atau menghambat perkembangan bakteri dan organisme lain. Antibiotika dapat ditemukan dalam berbagai sediaan, dan penggunaanya dapat melalui jalur topical, oral, maupun intravena (Utami, 2012). Masing-masing bahan antimikroba memiliki mekanisme yang berbeda dalam menghambat pertumbuhan bakteri. Efektifitas bahan antimikroba juga beragam bergantung pada jenis bahan, konsentrasi bahan dan jenis mikroba. Oleh karena itu pengujian mengenai bahan antimikroba mana yang efektif untuk menghambat pertumbuhan bakteri penting dilakukan sebelum penggunaan bahan tersebut. 1.9 Tujuan Praktikum ini bertujuan untuk mengetahui pengaruh berbagai bahan antimikroba terhadap viabilitas bakteri. II. METODOLOGI 2.1 Waktu dan Tempat Praktikum ini dilaksanakan pada hari Senin, 24 November 2014 bertempat di Laboratorium Kesehatan Ikan (LKI), Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor, pukul 08.00-10.00 WIB. 2.2 Alat dan Bahan Peralatan yang digunakan dalam praktikum ini adalah korek api, tabung ependof, mikropipet, mikrotipe, cawan petri, spidol, batang penyebar, inkubator, penggaris, bunsen, tissue dan pinset. Sedangkan bahan-bahan yang digunakan adalah koloni bakteri Aeromonas hidrophila dan Basillus sp., alkohol 90%, media TSA, kertas cakram, larutan fisiologis, alkohol 70%, rifampicin dan ekstrak Curcuma longa. 2.3 Prosedur Kerja Cawan petri yang sudah diberi media steril TSA sebanyak 2 buah disiapkan dan masing-masing petri dibagi menjadi 3 area dengan penanda spidol (Gambar 1). Salah satu media TSA ditetesi bakteri Aeromonas hidrophila sebanyak 100 µl dan media lainya ditetesi Basillus sp. sebanyak 100 µl. Bakteri yang sudah ditetesi kemudian disebar dengan batang penyebar pada permukaan media hingga merata. Bakar pinset sebentar di atas nyala api, ambil kertas saring dengan pinset satu persatu. Celupkan kertas saring I kedalam larutan fisiologis dan letakkan diatas permukaan media TSA yang telah disebari biakan bakteri. Celupkan kertas saring II ke dalam larutan antibiotic dan letakkan padacawan petri yang sama dengan jarak tertentu, lakuka hal yang sama untuk jenis antibakteri yang lain. Antimikroba yang digunakan kelompok 4 yaitu alkohol 70%, rifampicin dan ekstrak Curcuma longa. Bakar pinset sebentar di atas nyala api, kertas cakram steril direndam pada ketiga bahan antimikroba dan kemudian dikeringkan sesaat dan diletakkan di tengah area yang sudah dibentuk pada cawan petri dengan menggunakan pinset. Sebagai kontrol pada bagian tengah petri diberi kertas cakram yang direndam dalam PBS. Cawan diinkubasi pada suhu ruang selama 24 jam. Kemudian diamati apakah terdapat zona bening/zona hambat di sekitar kertas cakram dan diukur diameter zona beningnya. Rifampicin Ekstrak Curcuma longa PBS Alkohol 70% Gambar 1. Penempatan kertas saring yang sudah dicelupkan ke dalam bahan antimikroba pada medium dengan inokulan bakteri III. HASIL DAN PEMBAHASAN 3.1 Hasil Tabel 1 Zona bening pada sebaran bakteri Aeromonas hydrophila Diameter Zona Bening (cm) I II III IV 1 PBS 0,6 0 0 0,1 2 Alkohol 70% 0,7 0,7 * 0,2 3 Alkohol 50% * * * * 4 Alkohol 30% * * 0,7 * 5 Rifampicin 0,6 * * 0,6 6 Chlorampenicol * 1,5 * * 7 Streptomisin * * 0,7 * 8 Ekstrak Curcuma longa 30% 0,6 * * 0,2 9 Ekstrak Garcinia mangostana * 0 * * 10 Ekstrak Nigella sativa * * 0,8 * Keterangan : 0 = tidak terbentuk zona bening, (*) = tidak diuji pada ulongan tersebut. No Bahan V 0,6 * 0,6 * * 0,6 * * 0,6 * Berdasarkan data pada tabel 1 diatas, bahan antimikroba yang membentuk zona bening terbesar untuk menghambat pertumbuhan bakteri Aeromonas hydrophilla dimiliki oleh rifampicin yaitu sebesar 0,6 cm dan zona bening terkecil di hasilkan oleh PBS yaitu sebesar 0,1 cm. Tabel 2 Zona bening pada sebaran bakteri NP5 Bacillus sp. No 1 2 3 4 5 6 7 8 9 10 Diameter Zona Bening (cm) I II III IV V PBS 0,8 1,2 0,1 0,7 Alkohol 70% 1,6 * 0,1 * Alkohol 50% * * * * 0,7 Alkohol 30% * * 0,8 * * Rifampicin 1,8 * * 0,9 * Chlorampenicol * * * 0,7 Streptomisin * * 1,1 * * Ekstrak Curcuma longa 30% 0,8 * * 0,1 * Ekstrak Garcinia mangostana * 1,1 * * 1,0 Ekstrak Nigella sativa * * 1,1 * * Keterangan : 0 = tidak terbentuk zona bening, (*) = tidak diuji pada ulongan tersebut. Bahan Berdasarkan data pada tabel 2 diatas, bahan antimikroba yang membentuk zona bening terbesar untuk menghambat pertumbuhan bakteri Bacillus sp dimiliki oleh rifampicin yaitu sebesar 0,9 cm dan zona bening terkecil di hasilkan oleh PBS, alkohol 70% dan Ekstrak Curcuma longa yaitu sebesar 0,1 cm. Hasil pengamatan daya hambat antimikroba terhadap pertumbuhan A. hydrophilla dan Bacillus sp dapat dilihat pada Gambar 2. A merupakan area dengan kertas cakram mengandung alkohol 70%, R merupakan area dengan kertas cakram mengandung rifampicin dan C merupakan area dengan kertas cakram mengandung ekstrak Curcuma longa.. Gambar 2. Cawan petri yang ditumbuhi A. hidrophila dan Bacillus sp 3.2 Pembahasan Antibakteri adalah senyawa kimia alami yang dalam kadar rendah dapat menghambat pertumbuhan bakteri. Salah satu bahan antibakteri adalah antibiotik. Antimikroba dapat berupa senyawa kimia sintetik atau alami. Antimikroba sintetik dapat dihasilkan dengan membuat suatu senyawa yang sifatnya mirip dengan aslinya yang dibuat secara besar-besaran, sedangkan yang alami didapatkan langsung dari organisme yang menghasilkan senyawa tersebut dengan melakukan proses pengekstrakan (Setyaningsih et al, 2004). Antibiotik adalah suatu substansi (zat-zat) kimia yang diperoleh dari atau dibentuk oleh mikroorganisme, dan zat-zat itu dalam jumlah sedikit mempunyai daya penghambat kegiatan mikroorganisme lain. Antibiotik berbeda dalam susunan kimia dan cara kerjanya (Waluyo, 2010). Bakteri Aeromonas hydrophila umumnya hidup di air tawar yang mengandung bahan organik tinggi. Ciri utama bakteri A. hydrophilla adalah berbentuk batang, berdiameter 0,3 - 1,0 µm dan panjang 1,0 - 3,5 µm, bersifat Gram negatif, hidup pada temperatur optimal 22 - 28°C, gelatinase positif (Holt et al, 1994). Selain itu bakteri ini juga bersifat fakultatif aerobik (dapat hidup dengan atau tanpa oksigen) yang mengubah karbohidrat menjadi asam dan gas, tidak berspora, bersifat motil (bergerak aktif) karena memiliki flagel (Monotrichous flagella) yang keluar dari salah satu kutubnya, koloni bakteri ini pada media agar benvarna putih kekuningan, bentuk bulat cembung, oksidase sitokrom dan reaksi katalase positif. Bakteri ini senang hidup di lingkungan perairan bersuhu 15 30°C dan pH antara 5,5-9 (Ghufran dan Kordi, 2004). A. hydrophilla merupakan bakteri agen penyebab penyakit BHS (Bacterial Hemorrhagic Septicemia) atau MAS (Motil Aeromonad Septicemia) (Irianto, 2005). Bakteri NP5 merupakan bakteri genus Bacillus. Berdasarkan uji biokimia dan morfologi fisik serta sekuens gen 16S rRNA, telah diidentifikasi bakteri NP5 sebagai Bacillus amyloliquefaciens. Bacillus amyloliquefaciens merupakan bakteri gram positif yang berasal bakteri tanah dengan bentuk rod dan memiliki flagela. Sel sering tampak seperti rantai panjang tidak seperti kebanyakan kelompok Bacillus. Bakteri ini menghasilkan spora pada kondisi kurang menguntungkan. B. Amyloquefaciens adalah non-patogenic yang juga menunjukkan kemampuan antifungal yang mana dipengaruhi oleh ketersediaan nitrogen di lingkungan (Microbewiki, 2014). Ethanol pada konsentrasi 70% digunakan secara rutin sebagai desinfektan. Bakteri memiliki sensitifitas yang beragam terhadap ethanol namun konsentrasi 510% bakteriostatik (pertumbuhan berhenti) dan 15% lethar atau mematikan pada sebagian besar bakteri. Target utama ethanol adalah membran sel (Sissons et al., 1995). Kandungan utama rimpang kunyit (Curcuma longa) adalah minyak atsiri dan kurkuminoid. Kunyit mengandung minyak atsiri keton sesquiterpena yaitu turmeron dan artumeron. Senyawa-senyawa yang terkandung dalam kunyit memiliki aktifitas biologis sebagai anti bakteri, antioksidan dan anti hepatotoksik (Rukmana, 1994). Banyak spesies C. longa secara tradisional digunakan untuk pengobatan. Antijamur, antibakteri dan antiperadangan telah dilaporkan dapat diobati oleh spesies seperti C. longa, C. zedoaria, C. aromatik dan C. amada (Majumdar et al., 2000). Hal ini terbukti dari hasil penelitian bahwa Bacillus subtilis adalah organisme yang paling sensitif terhadap kurkuminoid dan minyak dari ekstrak C. longa. Wilson et al., (2005) melaporkan bahwa aktivitas antibakteri ekstrak etanol C. zedoaria (0,15mg/ml) dan C. malabarica (0,94 mg/ml) menunjukkan penghambatan lebih tinggi terhadap B. subtilis dan ekstrak etanol hanya efektif pada konsentrasi yang lebih tinggi dari 3,75 mg. Kedua spesies kunyit tersebut memberi MIC terhadap B. subtilis adalah 8,0 mm. Telah dilaporkan bahwa bakteri Gram positif lebih sensitif terhadap minyak nabati dan ekstraknya (Karaman et al, 2003). Naz et al., (2010) mempelajari bahwa antara bakteri Gram positif, B. cereus adalah organisme yang paling sensitif terhadap ekstrak C. longa dan ekstrak etanol yang memberi MIC 12,0 mm. Rifampicin merupakan antimikroba yang menghambat sintesis asam nukleat sel mikroba. Salah satu derivat rifampisin berikatan dengan enzim polimerase-RNA (pada subunit) sehingga menghambat sintesis RNA dan DNA oleh enzim tersebut. Pada golongan kuinolon dapat menghambat enzim DNA girase pada mikroba yang berfungsi mengatur kromosom yang sangat panjang menjadi bentuk spiral hingga bisa muat dalam sel mikroba yang kecil (Sambrook and Russell, 2001). Rifampisin merupakan antibiotik bakterisidal yang dapat mematikan kebanyakan gram positif dan beberapa jenis bakteri gram negatif. Antibiotik ini bekerja dengan menghambat sintesa RNA polimerase dari bakteri (Pelczar dan Chan 2010). Rifampisin adalah antibiotik bakterisida dengan spektrum aktifitas yang luas, rifampisin biasanya digunakan untuk mengobati infeksi mycobacterium termasuk tuberkulosis, dan juga memiliki peran dalam pengobatan methicillinresistant S. aureus dalam kombinasi dengan asam fusidic. Rifampisin kurang aktif terhadap bakteri gram negatif seperti E. coli, sedangkan spesies Pseudomonas secara intrinsik resisten terhadap rifampisin. Rifampisin menghambat DNAdependent RNA polimerase dalam sel bakteri karena diikat subunit β-nya (Esmaili et al, 2007). IV. KESIMPULAN DAN SARAN 4.1 Kesimpulan Rifampicin merupakan bahan antimikroba yang lebih baik untuk menghambat pertumbuhan bakteri Aeromonas hydrophilla maupun Bacillus sp karena memberikan zona bening yang lebih besar dibandingkan bahan antimkroba lainnya 4.2 Saran Praktikum kedepannya diharapkan menggunakan bakteri dari jenis lain dan menggunakan bahan antimikroba lain sehingga mahasiswa bisa lebih banyak mengenal jenis bakteri dan berbagai macam antibiotik yang berkaitan dengan budi daya perairan. DAFTAR PUSTAKA Dalimunthe, A. 2009. Interaksi pada Obat Antimikroba. Artikel. Departemen Farmakologi. Fakultas Farmasi. Universitas Sumatera Utara. 19 hal. Esmaeili, Farnaz., Mahdi, Hosseini-Nasr., Mazda, Rad-Malekshahi., Nasrin, Samadi., Fatemeh, Atyabi., Rassoul, Dinarvand. 2007. Preparation and antibacterial activity evaluation of rifampicin-loaded poly lactide-coglycolide nanoparticles. Nanomedicine: Nanotechnology, Biology, and Medicine 3 (2007) 161– 167 Ghufran H., Kordi K. 2004. Penanggulangan Hama dan Penyakit Ikan. Rineka Cipta. Jakarta, 190 hlm Holt, John G., Noel R. Krieg., Peter H.A.Sneath., James T. Staley., Stanley T. Williams. 1994. Bergey Manual of Determinative Bacteriology. Ninth Edition. The Williams and Wilkins Company, Baltimore USA Irianto, A. 2005. Patologi Ikan Teleostei. Gadjah Mada University Press. Yogyakarta Karaman, I., F. Sahin, M. Gulluce, H. Qgutcu, M. Sengul and A. Adiguzel. 2003. Antimicrobial activity of aqueous and methanol extracts of Juniperus oxycedrus L. J. Ethnopharmacol, 85: 231-235. Majumdar, A.M., D.G. Naik, C.N. Dandge and H.M. Puntambekar. 2000. Antiflammatory activity of Curcuma amada in albino rats. Indian journal of Pharmacology, 32: 375-377. Microbewiki. 2014. Bacillus amyloliquefaciens. https://microbewiki.kenyon.edu/ index.php/Bacillus_amyloliquefaciens Naz, Shagufta., Safia Jabeen., Saiqa Ilyas., Farkhanda Manzoor., Farah Aslam and Aamir Ali. 2010. Antibacterial Activity of Curcuma longa Varieties Against Different Strains of Bacteria. Pak. J. Bot., 42(1): 455-462, 2010. Pelczar, Michael J dan E.C.S. Chan. 2010. Dasar-dasar Mikrobiologi. Universitas Indonesia Press. Jakarta Rukmana, R. (1995). Kunyit. Yogyakarta : Kanisius. Setyaningsih, I., Desniar Panggabean., Widyah Lily., Titik Harsita. 2004. Pemisahan Ekstrak Intraseluler dari Mikroalga Nitzschia closterium dan Penentuan Konsentrasi Hambatan Minimumnya terhadap Mikroba Patogen. [Karya Ilmiah]. Institut Pertanian Bogor Sambrook J. and Russell D.W. 2001. Molecular Cloning. A Laboratory Manual. Edisi ke-3. Vol.2. New York: (US). Cold Spring Harbor Laboratory Press. Sissons C. H, Wong L., Cutress T. W., 1996. Inhibition By Ethanol of the Growth of Biofilm and Dispersed Microcosm Dental Plaques. Archs oral Biol. Vol 41. 27-34. Sunatmo, T.I. 2009. Mikrobiologi Esensial. Ardy Agency, Jakarta. Utami, E.R. 2012. Antibiotika, Resistensi, dan Rasionalitas Terapi. Saintis 1(1): 124-138. Waluyo, Lud. 2010. Teknik dan Metode Dalam Mikrobiologi. UMM Press. Malang Wilson, B., G. Abraham, S. Manjuv, M. Mathew, B. Vimala, S. Sundaresan and B. Nambisa. 2005. Antimicrobial activity of Curcuma zedoaria and Curcuma malabarica tubers. J.Ethnophamacol., 99: 147-151. Laporan Praktikum ke- 9 m.k. Mikrobiologi Akuakultur Hari/Tanggal : Senin, 01 Desember 2014 Kelompok : IV Asisten : 1. Rahman, S.Pi., M.Si 2. Asisten Mikro 2013 PEMBERIAN PENANDA RESISTEN ANTIBIOTIK PADA BAKTERI AKUAKULTUR Oleh: Stefanno. M. A. Rijoly C151140401 ILMU AKUAKULTUR SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR 2014 I. PENDAHULUAN 1.1 Latar Belakang Sifat resistansi terhadap antibiotik diperlukan oleh suatu mikroorganisme untuk mempertahankan kelangsungan hidupnya di alam. Sifat resistensi terhadap suatu jenis antibiotik dari suatu bakteri perlu diketahui sebelum ditetapkan jenis antibiotik yang akan digunakan sebagai penanda terhadap bakteri tersebut. Hal ini akan memudahkan untuk menyeleksi bakteri tersebut dari bakteri yang secara alami sensitif terhadap antibiotik yang digunakan (Ayuzar, 2008). Menurut Chythanya et al. (1999) beberapa organisme secara alami resisten terhadap beberapa antibiotik. Hal ini disebabkan oleh beberapa faktor antara lain: (1) organisme tidak mempunyai dinding sel sehingga akan resisten terhadap jenis antibiotik yang merusak pada dinding sel seperti kelompok penisilin; (2) organisme mungkin tidak permeabel terhadap beberapa antibiotik; (3) rnikroorganisme mempunyai kemampuan untuk menginaktifkan beberapa antibiotik; (4) mikroorganisme mempunyai sistem metabolisme yang dapat memblokir antibiotik tertentu sehingga resisten terhadap antibiotik tersebut; (5) mikroorganisme mempunyai kemampuan untuk memompa antibiotik tertentu keluar dari dinding sel sehingga resisten terhadap antibiotik tersebut. Uji penanda resisten antibiotik terdiri dari uji sensitifitas untuk mengetahui apakah bakteri tersebut resisten atau sensitif dengan antibiotik tertentu dan uji mutasi spontan untuk mengetahui jumlah bakteri yang telah bermutasi menjadi resisten antibiotik tertentu. 1.10 Tujuan Praktikum ini bertujuan untuk mengetahui apakah isolat bakteri yang digunakan resisten atau sensitif terhadap antibiotik dan mengetahui jumlah bakteri yang berhasil bermutasi. II. METODOLOGI 2.1 Waktu dan Tempat Praktikum ini dilaksanakan pada hari Senin, 01 Desember 2014 pukul 08.00-10.00 WIB, bertempat di Laboratorium Kesehatan Ikan, Depertemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. 2.2 Alat dan Bahan Alat-alat yang digunakan pada praktikum ini adalah cawan petri, batang penyebar, inkubator, bunsen, korek api, tabung eppendorf, pinset, mikropipet, dan tissue. Adapun bahan-bahan yang digunakan adalah isolat bakteri untuk uji sensitifitas, uji mutasi spontan dan kontrol, media SWC dalam cawan petri, media SWC bercampur antibiotik chlorampenicol dalam cawan petri, larutan fisiologis. 2.3 Prosedur Kerja 2.3.1 Uji Sensitifitas Antibiotik Alat-alat dan bahan yang diperlukan untuk praktikum disiapkan dan diletakkan di atas meja kerja laboratorium. Media SWC tanpa antibiotik sebagai kontrol dan Media SWC bercampur antibiotik chlorampenicol, keduanya kemudian digores dengan isolat bakteri Bacillus. Selanjutnya diinkubasi dalam inkubator selama 24 jam dan diamati apakah ada koloni yang tumbuh atau tidak. 2.3.2 Uji Mutasi Spontan Alat-alat dan bahan yang diperlukan untuk praktikum disiapkan dan diletakkan di atas meja kerja laboratorium. Isolat bakteri sebanyak 1 ml disentrifuge dan supernatannya dibuang, kemudian dipekatkan dengan 10 ml larutan fisiologis. Selanjutnya, suspensi bakteri disebar pada media SWC bercampur antibiotik chlorampenicol. Isolat bakteri diencerkan menjadi isolat bakteri dengan kepadatan 10-5, 10-6 dan 10-7 yang kemudian disebarkan dengan menggunakan batang penyebar pada media SWC bercampur chlorampenicol kemudia diinkubasi selama 24 jam dalam inkubator dan dihitung jumlah koloni. III. HASIL DAN PEMBAHASAN 3.1 Hasil Hasil pengamatan praktikum pembuatan penanda resisten antibiotik dapat dilihat pada tabel 1. Tabel 1 Hasil uji sensivitas dan jumlah kepadatan bakteri setelah uji mutasi spontan pada pengenceran yang berbeda Uji Sensivitas TPC Uji Mutasi Spontan (cfu/ml) Isolat K + Ab 100 + Ab 10-5 K 10-6 K 10-7 K 8 1 + TBUD 11,3 x 10 0 2 + TBUD 29,8 x 108 0 3 + 28,9 x 105 98,0 x 106 0 4 + 15,6 x 105 42,0 x 106 98,0 x 108 5 + 44,7 x 105 10,0 x 106 0 Keterangan : K = kontrol, Ab = antibiotik, TPC = Total Plate Count atau kepadatan bakteri (cfu/ml), (+) = resisten, (-) = sensitif, 0 = jumlah koloni 30, TBUD = Terlalu Banyak Untuk Dihitung ( 300 koloni bakteri). Kelompok Berdasarkan data pada tabel 1 diatas dapat kita lihat bahwa pada uji sensitivitas isolat bakteri Bacillus sp tumbuh pada kontrol sedangkan tidak tumbuh pada media yang diberikan antibiotik chlorampenicol. Pada uji mutasi spontan bakteri Bacillus sp yang tumbuh pada media dengan pengenceran 10-5 sebesar 15,6 x 105 CFU/ml, pengenceran 10-6 jumlah bakteri Bacillus sp yang tumbuh sebesar 42,0 x 106 CFU/ml, sedangkan pertumbuhan bakteri Bacillus sp tertinggi terdapat pada pengenceran 10-7 yaitu sebesar 98,0 x 108 CFU/ml. 3.2 Pembahasan Bacillus spp. digolongkan ke dalam kelas bakteri heterotrofik, yaitu protista bersifat uniseluler, termasuk dalam golongan mikroorganisme redusen atau yang lazim disebut sebagai dekomposer. Sebagian besar bakteri laut termasuk dalam kelompok bakteri bersifat heterotrofik dan saprofitik (Rheinheimer 1980). Marga Bacillus merupakan bakteri yang berbentuk batang dapat dijumpai di tanah dan air termasuk pada air laut. Beberapa jenis menghasil enzim ekstraseluler yang dapat menghidrolisis protein dan polisakarida kompleks. Bacillus spp membentuk endospora, merupakan gram positif, bergerak dengan adanya flagel peritrikus, dapat bersifat aerobik atau fakultatif anaerobik serta bersifat katalase positif (Pelczar dan Chan 2010). Jenis Bacillus spp. menunjukkan bentuk koloni yasng berbeda-beda pada medium agar cawan Nutrien Agar. Warna koloni pada umumnya putih sampai kekuningan atau putih suram, tepi koloni bermacam-macam namun pada umumnya tidak rata, permukaannya kasar dan tidak berlendir, bahkan ada yang cenderung kering berbubuk, koloni besar dan tidak mengkilat. Bentuk koloni dan ukurannya sangat bervariasi tergantung dari jenisnya. Selain itu setiap jenis juga menunjukkan kemampuan dan ketahanan yang berbeda-beda dalam menghadapi kondisi lingkungannya, misalnya ketahanan terhadap panas, asam, kadar garam, dan sebagainya (Hatmanti 2000). A B Gambar 1. (A) Isolat Bakteri tumbuh pada media kontrol (hanya SWC), (B) Isolat bakteri tidak tumbuh pada media SWC yang diberi antibiotik chloramphenicol Chloramphenicol adalah salah satu jenis antibiotika turunan amfenikol yang secara alami diproduksi oleh Streptomyces venezuelae (Hartman et al, 1994). Melalui pengembangan teknologi fermentasi, chloramphenicol dapat diisolasi, disemisintesis menjadi antibitoka turunannya, antara lain tiamfenikol dan turunan lain melalui berbagai reaksi kimia dan enzimatis (Susanti et al 2009). Mekanisme kerja chloramphenicol sebagai anti bakteri bersifat stereospesifik, karena hanya satu stereoisomer yang memiliki aktivitas anti bakteri, yaitu D(-) treo-isomer. Chloramphenicol bekerja pada spektrum luas, efektif baik terhadap Gram positif maupun Gram negatif. Mekanisme kerja chloramphenicol melalui penghambatan terhadap biosintesis protein pada siklus pemanjangan rantai asam amino, yaitu dengan menghambat pembentukan ikatan peptida. Antibiotika ini mampu mengikat subunit ribosom 50-S sel mikroba target secara terpulihkan, akibatnya terjadi hambatan pembentukan ikatan peptida dan biosintesis protein. Chloramphenicol umumnya bersifat bakteriostatik, namun pada konsentrasi tinggi dapat bersifat bakterisid terhadap bakteri-bakteri tertentu (Ganiswarna, 1995). Spektrum antibakteri chloramphenicol meliputi D. pneumoniae, Str. pyogenes, Str. viridans, Neisseria, Haemophilus, Bacillus spp, Listeria, Bartonella, Brucella, P. multocida, C. diphtheriae, Chlamydia, Mycoplasma, Rickettsia, Treponema dan kebanyakan mikroba anaerob. Senyawa ini juga efektif terhadap kebanyakan galur E. coli, K. pneumoniae, dan Pr. Mirabilis (Ganiswara, 1995). Berdasarkan pernyataan tersebut maka hasil pengujian kelompok kami baik karena pada media SWC yang diberikan antibiotik chloramphenicol isolat bakteri Bacillus spp tidak tumbuh karena sensitif terhadap chloramphenicol. IV. KESIMPULAN DAN SARAN 4.1 Kesimpulan Bakteri Bacillus sp merupakan bakteri yang sensitif terhadap antbiotik chloramphenicol karena tidak tumbuh pada media SWC yang diberi antibiotik chloramphenicol. Jumlah bakteri Bacillus sp yang mengalami mutasi tertinggi terdapat pada pengenceran 10-7 yaitu sebesar 98,0 x 108 CFU/ml. 4.2 Saran Pada praktikum selanjutnya perlu dilakukan uji toksisitas penggunaan chloramphenicol terhadap ikan atau udang yang akan diuji, dan apakah bakteri hasil mutasi uji pula pertumbuhan dan patogenisitasnya. DAFTAR PUSTAKA Ayuzar, Eva.2014. Mekanisme Penghambatan Bakteri Probiotik Terhadap Pertumbuhan Vibrio harveyi Pada Larva Udang Windu (Penaeus Monodon). [Tesis]. Institut Pertanian Bogor. Chytanya R, Nayak D.K, Venugopal M.N. 1999. Antibiotic resistence in aquaculture. News from around the world. Infofish International, 6:3032. Ganiswarna, V.H.S. 1995. Farmakologi dan Terapi. Edisi ke-4, Jakarta: Bagian Farmakologi Fakultas Kedokteran Universitas Indonesia, hal. 571, 657660. Hartman, C., Massart, D.L., McDowell, R.D. 1994. An analysis of the Washington Conference report on bioanalytical method validation. Journal of Pharmaceutical and Biomedical Analysis, Vol. 12, p. 13371343. Hatmanti, Arianti. 2000. Pengenalan Bacillus spp. Jurnal Oseana, Volume XXV, Nomor 1, 2000 : 31-41 Pelczar, Michael J dan E.C.S. Chan. 2010. Dasar-dasar Mikrobiologi. Universitas Indonesia Press. Jakarta Rheinheimer .1980. Aquatic Microbiology, A. Willey Inter Science Publication Chichester: 225 pp. Susanti, Meliana., Isnaeni., Sri Poedjiarti. 2009. Validasi Metode Bioautografi untuk Determinasi Kloramfenikol. Jurnal Kedokteran Indonesia, Vol. 1/No. 1/Januari/2009 Laporan Praktikum ke- 10 m.k. Mikrobiologi Akuakultur Hari/Tanggal : Senin, 08 November 2014 Kelompok : IV Asisten : 1. Rahman, S.Pi., M.Si 2. Asisten Mikro 2013 SELEKSI BAKTERI PROBIOTIK UNTUK AKUAKULTUR Oleh: Stefanno M. A. Rijoly C151140401 ILMU AKUAKULTUR SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR 2014 I. PENDAHULUAN 1.1 Latar Belakang Probiotik adalah mikrob hidup yang ditambahkan ke dalam pakan yang dapat memberi pengaruh mengmtungkan bagi hewan inang dengan cara memperbaiki keseimbangan mikrob ususnya. Pada hewan akuatik, selain saluran pencemaan, air di sekeliling organisme tersebut juga memegang peranan penting (Fuller 1992). Sehingga probiotik untuk hewan akuatik adalah agen mikrob hidup yang memberikan pengaruh menguntungkan pada inang dengan memodifikasi komunitas mikrob atau berasosiasi dengan inang, menjamin perbaikan dalam penggunaan pakan atau memperbaiki nilai nutrisinya, memperbaiki respon inang terhadap penyakit, atau memperbaiki kualitas lingkungan ambangnya (Verschuere et al. 2000). Penambahan probiotik pada pakan telah banyak diaplikasikan pada kegiatan akuakultur dan terbukti telah memberikan efek yang menguntungkan bagi ikan (Kesarcodi-Watson et al., 2008). Menurut Gomez-Gil et al. (2000), konsep probiotik sebagai biokontrol, yaitu pemanfaatan organisme yang antagonis dalam membatasi atau menyerangi hama pada budidaya. Dalam hal ini mikroorganisme probiotik tidak hanya sebagai musuh alami patogen, tetapi juga dengan mengurangi kerusakan yang disebabkan oleh patogen, umumnya dengan kompetisi, yang paling banyak dengan menghasilkan substansi yang menghambat pertumbuhan mikroorganisme yang paling berbahaya. Metode seleksi bakteri probiotik untuk kegiatan pemeliharaan larva hewan akuatik dapat mencakup beberapa tahap berikut: (1) pengumpulan informasi dasar yang didapat dari studi pustaka maupun di lapangan, meliputi infomasi tentang mikroba serta hubungan antara inang dengan lingkungannya; (2) penapisan mikroba, yaitu proses pemisahan mikroba dari campurannya berdasarkan kriteria tertentu seperti bakteri probiotik harus menguntungkan inangnya, mampu bertahan hidup dalam usus, dapat disiapkan sebagai produk sel hidup pada skala industri, dan dapat terjaga stabilitas serta sintasan untuk waktu yang lama pada penyimpanan maupun di lapangan; (3) pengujian isolat dalam menghambat mikroba patogen secara in vitro dan in vivo; (4) pengujian patogenitas isolat terhadap inang; (5) pengujian skala laboratorium termasuk melihat pengaruh kandidat probiotik secara in vivo terhadap variabel imunologi, dan uji tantang dengan patogen; (6) analisa ekonomi biaya-laba (Gomez-Gil et al. 2000),. 1.11 Tujuan Praktikum ini bertujuan untuk mengevaluasi bakteri potensial sebagai probiotik melalui uji aktivitas enzim amilase, lipase, protease dan uji kompetisi dengan bakteri patogen. II. METODOLOGI 2.1 Waktu dan Tempat Praktikum ini dilaksanakan pada hari Senin, 08 November 2014 pukul 08.00-10.00 WIB, bertempat di Laboratorium Kesehatan Ikan, Depertemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. 2.2 Alat dan Bahan Peralatan yang digunakan dalam praktikum ini adalah cawan petri, bunsen, jarum ose, mikropipet, mikrotip, tabung ependof, batang penyebar, erlenmeyer, tabung reaksi, inkubator, rak alat. Sedangkan bahan yang digunakan adalah koloni bakteri NP5 (Bacillus sp), 1-Ub (Pseudoalteromonas), SKTb (Vibrio alginoliticus), media agar TCBS, media agar SWC, alkohol 70% dan 95%, larutan KI, larutan CuSO4. 2.3 Prosedur Kerja 2.3.1 Uji Amilase Meja kerja dan tangan disterilisasi dengan alkohol 70%. Jarum ose dicelupkan pada alkohol 95% dan dipanaskan di bunsen. Tiga buah tabung ependorf steril yang berisi masing-masing isolat kultur (NP5, 1-Ub dan SKTb) disiapkan, kemudian isolat bakteri diambil menggunakan jarum ose setelah itu gores pada cawan petri berisi Media SWC steril ditambah pati yang sebelumnya sudah dibagi menjadi tiga daerah untuk masing-masing isolat. Cawan diberi label dan diinkubasi pada suhu ruang selama 24 jam. Setelah 24 jam, media digenangi dengan KI. Amati perubahan warna pada isolat uji. 2.3.2 Uji Lipase Meja kerja dan tangan disterilisasi dengan alkohol 70%. Jarum ose dicelupkan pada alkohol 95% dan dipanaskan di bunsen. Tiga buah tabung ependorf steril yang berisi masing-masing isolat kultur (NP5, 1-Ub dan SKTb) disiapkan, kemudian isolat bakteri diambil menggunakan jarum ose setelah itu gores pada cawan petri berisi Media SWC steril ditambah minyak zaitun yang sebelumnya sudah dibagi menjadi tiga daerah untuk masing-masing isolat. Cawan diberi label dan diinkubasi pada suhu ruang selama 24 jam. Setelah 24 jam, media digenangi dengan CuSO4. Biakan diamati apakah terdapat zona litik yaitu berwarna hijau toska/kebiruan. 2.3.3 Uji Protease Media SWC steril ditambah skim milk dan disiapkan pada cawan petri. Cawan petri diberi penanda untuk memisahkan cawan menjadi 3 area. Jarum ose dicelupkan pada alkohol 95% dan dipanaskan di bunsen. Setelah dingin dicelupkan pada biakan bakteri dan digores pada cawan petri sesuai area masingmasing bakteri. Cawan diberi label dan diinkubasi pada suhu ruang selama 24 jam. Setelah 24 jam, biakan diamati apakah terdapat zona litik yaitu berwarna bening. 2.3.4 Uji Kompetisi Tahap persiapan yaitu menyiapkan media miring sesuai bakteri uji yaitu Vibrio harvey dan Pseudoalteromonas. Media agar steril dibuat pada tabung reaksi dan dimiringkan hingga memadat. Bakteri Vibrio harvey dan Pseudoalteromonas masing-masing dikultur pada media tersebut dan diinkubasi pada suhu ruang selama 24 jam. Pengerjaan isolasi dan kultur dalam kondisi steril. Tahap rekultur dan kultur bersama yaitu biakan bakteri uji pada media miring diambil dengan jarum ose dan tumbuhkan pada media SWC cair di erlenmeyer lalu diinkubasi selama 24 jam. Vibrio harvey dikultur hingga mendapatkan biakan dengan kepadatan 103 sedangkan Pseudoalteromonas dikultur hingga mendapatkan kepadatan 106. Vibrio harvey 103 diambil 100 µl dan dikultur di media SWC cair pada erlenmeyer dan diinkubasi selama 24 jam. Vibrio harvey pada biakan 103 diambil lagi sebanyak 100 µl dan dicampurkan pada media SWC cair pada erlenmeyer yang akan dijadikan sebagai media kultur bersama. Pseudoalteromonas 106 diambil sebanyak 100 µl dan dicampurkan pada media kultur bersama. Media kultur bersama dihomogenkan dan diinkubasi selama 24 jam. Tahap perbandingan kepadatan yaitu biakan Vibrio harvey pada media SWC dengan kepadatan awal 103 hasil inkubasi dilakukan pengenceran hingga pengenceran 10-5, 10-6 dan 10-7 yang masing-masing ditebar sebanyak 50 µl pada cawan petri media TCBS. Media kultur bersama hasil inkubasi yang berisi Vibrio harvey dan Pseudoalteromonas diambil dan dilakukan pengenceran hingga 10-2 dan 10-3. Masing-masing pengenceran diambil 50 µl dan dikultur pada cawan petri berisi media TCBS dan diinkubasi selama 24 jam. Setelah 24 jam diamati kepadatan bakteri Vibrio harvey pada cawan TCBS baik pengenceran 10-5, 10-6 maupun 10-7. Begitu pula kepadatan bakteri kultur bersama diamati baik pada pengenceran 10-2 dan 10-3. Jika kesemua pengenceran hasil kepadatannya dapat dihitung maka digunakan kepadatan pada pengenceran terkecil. Jika kepadatan Vibrio harvey lebih besar dari pada kepadatan kultur bersama maka bakteri Pseudoalteromonas memiliki potensi sebagai probiotik. III. HASIL DAN PEMBAHASAN 3.1 Hasil Hasil pengamatan praktikum seleksi probiotik disajikan dalam tabel 1 di bawah ini. Tabel 1 Hasil uji seleksi dan TPC uji kompetisi dan kultur bersama bakteri NP5, SKT-b, dan 1-Ub pada pengenceran berbeda Uji Seleksi TPC Uji Kompetisi TPC Kultur Bakteri (CFU/ml) Bersama (CFU/ml) A L P 10-5 K 10-6 K 10-7 K 10-2 10-3 A + + 1 B + TBUD 2,4 x 109 0 0 0 C + + + A + 2 B + TBUD 1,5 x 109 0 C + + A 3 B 3,7 x 108 8,0 x 108 0 C + A + + 4 B + TBUD 6,0 x 108 0 0 0 C + + A + + 5 B + + TBUD 194 x 108 0 0 C + + Keterangan: Isolat A = NP5, Isolat B = SKT-b, Isolat C = 1-Ub, Uji Seleksi A = uji Amilase, L = uji Lipase, P = uji Protease, TPC = Total Plate Count atau kepadatan bakteri (cfu/ml), K = kontrol, (+) = tumbuh, (-) = tidak tumbuh, 0 = jumlah koloni 30, TBUD = Terlalu Banyak Untuk Dihitung (300 koloni bakteri). Kelp Isolat Berdasarkan tabel 1 diatas dapat kita lihat bahwa pada uji seleksi bakteri isolat A tumbuh pada media yang mengandung amilase dan protease, namun tidak tumbuh pada media yang mengandung lipase. Isolat B hanya tumbuh pada media yang mengandung protease dan tidak tumbuh pada media yang mengandung amilase dan lipase. Isolat C tumbuh pada media yang mengandung amilase serta lipase dan tidak tumbuh pada media yang mengandung protease (Gambar 1). Hasil penghitungan cawan pada uji kompetisi pada kontrol dengan pengenceran 10 -5 tidak dapat dihitung karena jumlah koloni yang terlalu banyak (Gambar 2). Pada perlakuan kontrol dengan pengenceran 10-6 jumlah koloni yang tumbuh yaitu sebesar 6,0 x 108, sedangkan pada pengenceran 10-7 jumlah koloni yang tumbuh sangat sedikit. Hasil perhitungan koloni bakteri yang tumbuh pada kultur bersama baik pada pengenceran 10-2 dan 10-3 isolat bakteri tumbuh namun dalam jumlah yang sedikit (Gambar 3). A B C Gambar 1. Hasil uji seleksi bakteri (A). Uji Amilum, (B). Uji Lemak, (C) Uji Protein B A C Gambar 2. Hasil Uji Kompetisi (A) Pengenceran 10-5, (B) Pengenceran 10-6, (C) Pengenceran 10-7 A B Gambar 3. Hasil Uji Kultur Bersama (A) Pengenceran 10-2, (B) Pengenceran 10-3 3.2 Pembahasan Probiotik adalah mikroorganisme hidup yang bila diberikan dalam jumlah yang cukup akan memberikan manfaat kesehatan pada inangnya (FAO, 2001). Keseimbangan yang baik dalam ekosistem mikrobiota usus bisa menguntungkan kesehatan tubuh dan dapat dipengaruhi oleh konsumsi probiotik setiap hari (Lisal, 2005). Probiotik dapat diperoleh melalui konsumsi produk olahan susu fermentasi. Mikroba probiotik dalam susu fermentasi terdiri dari genus Lactobacillus, Pediococcus, Bifidobacterium, Lactococcus, Enterococcus dan Saccharomyces. Bakteri probiotik yang digunakan dalam produk olahan pangan harus mempertimbangkan aspek keamanan. Genus Lactococcus dan Lactobacillus merupakan genus bakteri yang paling umum mendapatkan status GARS atau Generally recognized as safe sehingga aman dikonsumsi (Surono, 2004). Bakteri yang mempunyai aktivitas proteolitik mempunyai kemampuan untuk menghasilkan enzim protease yang disekresikan ke lingkungannya. Enzim proteolitik ekstraseluler ini selanjutnya bekerja menghidrolisis senyawa-senyawa bersifat protein menjadi oligopeptida, peptida rantai pendek dan asam amino. Diameter zone hambat yang terbentuk dapat menunjukan secara kualitatif tingginya kemampuan proteolitik enzim protease yang dihasilkan atau juga tingginya jumlah enzim yang diproduksi dan dilepas keluar. Keberadaan enzim protease ekstraseluler ini sangat penting bagi kehidupan bakteri karena menyediakan kebutuhan senyawa bernitrogen yang dapat diangkut ke dalam sel. Jenis-jenis bakteri yang mempunyai kemampuan mensekresikan enzim protease ini memiliki potensi yang besar untuk digunakan sebagai agensia pembersih bahan pencemar yang bersifat protein (Setyati dan Subagyo, 2012). Dari hasil praktikum dapat dilihat bahwa isolat A dan B yang memiliki kemampuan untuk menghasilkan enzim protease. Amilum lebih mudah dicerna daripada selulosa. Amilum dicerna oleh enzim amilase. Bakteri amilolitik yang diperoleh dari penelitian ini adalah bakteri yang menghasilkan enzim amilase ekstraseluler. Enzim ini dibutuhkan untuk merombak amilum yang terdapat dalam sisa pakan (Setyati dan Subagyo, 2012). Bakteri amilolitik adalah bakteri yang mampu mensekresikan enzim amilase yang berperan penting dalam proses pencernaan ikan, yaitu sebagai katalisator untuk hidrolisis nutrien pakan dalam saluran pencernaan ikan. Bakteri dapat menyesuaikan diri dengan lingkungan yang kaya molekul kompleks dengan cara mensekresikan enzim yang disebut exogeneous enzim (Putra, 2010). Kemampuan degradasi atau hidrolisis pati (amilum) ditunjukkan oleh isolat A dan C. Seleksi aktivitas hidrolitik terhadap lipid yang ditunjukan dengan terbentuknya endapan asam lemak menunjukan bahwa isolat bakteri mempunyai kemampuan menghasilkan enzim lipolitik (lipase). Enzim ini merombak lipid menjadi lipid rantai pendek dan asam lemak, yang selanjutnya akan digunakan untuk pertumbuhan bakteri. Katabolisme lipid diawali dengan pecahnya trigliserida oleh penambahan air sehingga terbentuk gliserol dan asam lemak dengan bantuan enzim-enzim lipase. Gliserol sebagai komponen lemak dapat dirubah menjadi intermediet lintasan glikolitik (dehidroksiaseton fosfat). Asamasam lemak dioksidasi melalui pengusiran berturu-turut fragmen berkarbon dua dalam bentuk asetil-KoA. Ada lebih banyak hasil energi per gram lemak dari pada per gram protein dan karbohidrat. Namun, relatif hanya beberapa spesies mikroba yang efektif dalam merombak lipid, baik yang sederhana atau yang rumit oleh karena terbatasnya daya larut lemak (Pelczar dan Chan, 2010). Dari hasil praktikum kelompok hanya Isolat C yang punya kemampuan untuk menghidrolisis lipid. Dalam meningkatkan nilai nutrisi pakan, probiotik mampu menghasilkan beberapa enzim exogenous untuk pencernaan pakan seperti amilase, protease, lipase dan selulase (Wang et al. 2008). Enzim exogenous tersebut akan membantu enzim endogenous di inang untuk menghidrolisi nutrien pakan seperti memecah atau mengurai rantai panjang karbohidrat, protein dan lemak penyusun pakan. Pemecahan molekul-molekul komplek ini menjadi molekul yang lebih sederhana akan mempermudah pencernaan dan penyerapan dalam saluran pencernaan. Banyak kendala dijumpai pula dalam penggunaan probiotik, termasuk kemampuan bertahan, kolonisasi dan kompetisi nutrien untuk masuk ke dalam suatu lingkungan ekosistem yang sudah mengandung beberapa ratus jenis bakteri lainnya. Lisal (2005) menambahkan, jika bahan yang mengandung probiotik tidak dikonsumsi secara kontinyu, maka bakteri yang ditambahkan itu dengan cepat akan mengalami wash-out (tidak lagi melekat dan dikeluarkan dari saluran pencernaan). Pendekatan lain yang dapat mengatasi keterbatasan pemakaian probiotik adalah dengan menggunakan prebiotik yaitu suatu unsur makanan yang tidak dapat dicerna dan mempunyai pengaruh menguntungkan bagi inangnya, yang secara selektif menstimulasi pertumbuhan dan/atau aktivitas metabolik dari satu atau sejumlah terbatas bakteri dalam kolon sehingga memperbaiki kesehatan induk semangnya. IV. KESIMPULAN DAN SARAN 4.1 Kesimpulan Dari hasil praktikum dapat dilihat bahwa isolat A dan B yang memiliki kemampuan untuk menghasilkan enzim protease. Kemampuan degradasi atau hidrolisis pati (amilum) ditunjukkan oleh isolat A dan C. Dari hasil praktikum kelompok hanya Isolat C yang punya kemampuan untuk menghidrolisis lipid. Pada kultur bersama mampu menekan pertumbuhan Vibrio sehingga jumlah koloninya sedikit sehingga dapat disimpulkan bahwa ketiga isolat uji berpotensi sebagai probiotik. 4.2 Saran Untuk meningkatkan pemahaman tentang evaluasi bakteri potensi probiotik sebaiknya uji tidak hanya pada aktivitas enzim dan kompetisi. Namun juga dilakukan evaluasi potensi peningkatan nutrien ataupun imunitas didukung pula uji patogenitas dan juga uji pada larva. DAFTAR PUSTAKA Food and Agriculture Organization of the United Nations (FAO). 2001. Health and nutritional properties of probiotics in food including powder milk with live lactic acid bacteria. http://www.who.int/foodsafety/publications/fs management/en/probiotics.pdf.[3 Januari 2015]. Fuller R. 1992. History and Development of Probiotics. Di dalam: Fuller R, editor. Probiotics the Scientific Basis. London: Chapman and Hall. hlm 18. Gomez-Gil B, Roque A, Tumbull JF. 2000. The use and selection of probiotic bacteria for use in the culture of larval aquatic organisms. Aquaculture, 191 :259-270. Kesarcodi-Watson A, H. Kaspar, J. Lategan, L. Gibson. 2008. Probiotics in aquaculture: The need, principles and mechanisms of action and screening processes. Aquaculture, 274: 1-14. Lisal J. 2005. Konsep probiotik dan prebiotik untuk modulasi mikrobita usus besar. Medikal Nusantara, 26: Oktober-Desember Pelczar, M.J dan E.C.S. Chan. 2010. Dasar-Dasar Mikrobiologi (terjemahan), R.S. Hadioetomo, T. Imas, S. S. Tjitrosomp dan S. L. Angka. Jakarta (ID): UI Press. Putra A. N., 2010. Kajian Probiotik, Prebiotik dan Simbiotik untuk Meningkatkan kinerja Pertumbuhan ikan Nila (Oreochromis niloticus). [Thesis]. Magister Akuakultur. IPB Setyati, Willis Ari dan Subgayo. 2012. Isolasi dan Seleksi Bakteri Penghasil Enzim Ekstraseluler (proteolitik, amilolitik, lipolitik dan selulolitik) yang Berasal dari Sedimen Kawasan Mangrove. Jurnal Ilmu Kelautan September 2012. Vol. 17 (3) 164-168 Surono, I. S. 2004. Probiotik Susu Fermentasi dan Kesehatan. PT. Tri Cipta Karya, Jakarta. Verschuere L., G. Rombaut, P. Sorgeloos, W. Verstraete. 2000. Probiotic bacteria as biological control agents in aquaculture. Microbiological and Molecular Biology Review, 64: 655-671. Wang Bo-Yan, Rong Li, Lin Junda. 2008. Probiotics in Aquaculture: Challenges and Outlook. Aquaculture, 281: 1-4. Laporan Praktikum ke- 11 m.k. Mikrobiologi Akuakultur Hari/Tanggal : Minggu, 14 Desember 2014 Kelompok : IV Asisten : 1. Rahman, S.Pi., M.Si 2. Asisten Mikro 2013 DETEKSI VIRUS DENGAN TEKNIK PCR Oleh: Stefanno. M. A. Rijoly C151140401 ILMU AKUAKULTUR SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR 2014 I. PENDAHULUAN 1.1 Latar Belakang Koi Herpes Virus (KHV) atau Virus Herpes pada ikan koi merupakan penyakit yang mudah menular pada berbagai jenis ikan termasuk koi dan keluarga karper. Kematian ikan yang disebabkan Virus Herpes bisa mencapai 20% sampai dengan 100%. Virus ini biasa menyebar pada musim panas saat suhu air cukup tinggi, antara suhu 18 - 27˚C. Kematian yang disebabkan Virus Herpes ini termasuk cepat hanya dalam waktu 24 -48 jam sejak ada gejala. Kematian ikan koi yang disebabkan oleh Virus Herpes termasuk sporadis, karena kematian dalam jumlah yang besar (Hendrick, 2000). KHV juga dikenal sebagai Cyprinid herpesvirus 3 (CyHV3) yang tergolong virus double-standed DNA dan termasuk dalam family Alloherpesviridae. KHV menyerang beragam usia dan sering mengakibatkan 80-100% kematian ketika temperatur air berkisar antara 16°C25°C (Haenen et al., 2004). Polymerase Chain Reaction (PCR) adalah suatu teknik sintesis dan amplifikasi DNA secara in vitro. Teknik ini pertama kali dikembangkan oleh Karry Mullis pada tahun 1985. Teknik PCR dapat digunakan untuk mengamplifikasi segmen DNA dalam jumlah jutaan kali hanya dalam beberapa jam (Handoyo dan Rudiretna, 2001). Proses PCR melibatkan beberapa tahap yaitu: pra-denaturasi DNA templat, denaturasi DNA templat, penempelan primer pada templat (annealing), pemanjangan primer (extension) dan pemantapan (post extension). Tahap denaturasi sampai dengan tahap pemanjangan primer merupakan tahapan berulang (siklus), di mana pada setiap siklus terjadi duplikasi jumlah DNA (Sulistyaningsih, 2007). 1.12 Tujuan Praktikum ini bertujuan mendeteksi secara molekular organisme uji apakah negatif atau positif terserang Koi herves Virus (KHV) dengan menggunakan teknik Polimerase Chain Reaction (PCR). II. METODOLOGI 2.1 Waktu dan Tempat Praktikum ini dilaksanakan pada hari Minggu, 14 Desember 2014 pukul 10.00-14.00 WIB, bertempat di Laboratorium Molekular Ikan dan Bioteknologi, Depertemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. 2.2 Alat dan Bahan Alat yang digunakan dalam praktikum ini adalah mortar, pipet mikro, tabung mikro, tipe, sentrifuse, thermoshaker, lemari es, rak tabung mikro. Sedangkan bahan yang digunakan adalah sampel insang ikan, aqudest, cell lysis solution, proteinase K, RNAse, protein precipitation solution, isopropanol, ETOH 70%, KAPA mix, foward, reserver, IEW. 2.3 Prosedur Kerja 2.3.1 Ekstraksi DNA Ekstraksi DNA merupakan tahap awal dalam teknik PCR. Tujuan dari tahap ini adalah mendapatkan DNA dari sel utuh. Ekstraksi DNA melalui tahap pelisisan sel dan pemisahan DNA dari materi sel lainnya. 2.3.1.1 Sel Lisis Sampel insang diambil 100 mg. Jumlah sampel terkadang juga bergantung pada kit yang digunakan. Sampel ditambahkan sedikit aquades dan digerus dengan mortar. Setelah halus, sampel dipindahkan di tabung mikro/ependof. Cell lysis solution 200 µl ditambahkan pada ependof dan divorteks. Kemudian ditambahkan 1,5 µl proteinase K dan divorteks ulang. Ependof diinkubasi pada thermoshake pada suhu 55°C selama 3 jam hingga sel lisis. 2.3.1.2 RNAase Treatment dan Protein Precipitation Ependof hasil inkubasi ditambahkan 1,5 µl RNAase dan divorteks sampai homogen. Kemudian diinkubasi pada thermoshaker pada suhu 37 °C selama 30 menit. Setelah diinkubasi ditambahkan dengan 50 µl protein precipitation solution. Ependof diinkubasi on ice selama 10-15 menit atau 5-10 menit pada suhu -20°C. Setelah diinkubasi kemudian disentrifugasi selama 10 menit pada kecepatan 13.000 rpm. Mikrotube baru diambil dan diisi dengan 300 µl isopropanol. Mikrotube yang berisi sampel hasil sentrifugasi diambil supernatan dengan pipet mikro yaitu lapisan bening bagian atas. Supernatan dicampur pada ependof berisi isopropanol dan divorteks sampai homogen. Ependof disentrifugasi selama 10 menit pada kecepatan 13.000 rpm. Hasil sentrifugasi yaitu pada dinding dasar mikrotube terdapat bercak putih yang merupakan DNA sampel. Supernatan dibuang hingga tersisa DNA sampel. Untuk memurnikan, DNA dicuci dengan ETOH 70% sebanyak 300 µl dan divorteks kemudian disentrifugasi dengan kecepatan 13.000 rpm selama 10 menit. Setelah disentrifugasi ETOH dibuang dan tabung dibalik untuk dikering-anginkan. 2.3.2 Ampifikasi DNA dengan PCR Disiapkan premix sampel uji, kontrol positif, dan kontrol negatif. Kemudisan didistribusikan 9 µl premix kedalam setiap tabung PCR yang jumlahnya sesuai dengan jumlah sampel. Lalu ditambahkan 1 µl DNA sampel dan divortex. Kemudian diatur alat thermal cycler dengan kondisi PCR sebagai berikut: Pre Denaturation 94oC selama 3 menit; denaturasi 94oC selama 30 detik, Annealing primer 57oC selama 30 detik sebanyak 35 siklus, Extention 72oC selama 30 menit; Final Extention 72oC 3 menit. Selanjutnya, suhu diturunkan dan diakhiri pada 4oC. 2.3.3 Visualisasi Elektroforesis Hasil PCR akan divisualisasikan pada gel agarose. Tahapan pembuatan gel agarose yaitu, dipersiapkan serbuk agarose dan dilarutkan dalam TBE (Tris Base, Boric Acid, EDTA) yang mengandung 0,01 g/mL ethidium bromida, kemudian dipanaskan dalam microwave selama 1,5 menit sampai larutan menjadi bening. Setelah hangat, larutan dituangkan ke dalam cetakan yang telah dilengkapi sisir (comb) sebagai cetakan sumur (well) elektroforesis. Setelah membeku, sisir dilepas secara perlahan, gel dimasukkan ke dalam bak elektroforesis yang telah berisi larutan buffer TBE. Lalu dicampur 5 µl sampel DNA produk PCR dengan dengan 0,5 µL loading dye lalu dimasukkan ke dalam sumur gel dengan menggunakan mikropipet. Marker DNA selanjutnya juga dimasukkan sebanyak 1- 2 µL. Bak elektroforesis kemudian ditutup dan dihidupkan power supply. Kemudian dimatikan power supply ketika sampel DNA sudah bermigrasi (ditandai dengan warna loading dye yang mencapai sekitar ¾ dari total panjang gel agarose) tau sesuai yang diinginkan. Langkah terakhir, hasil uji KHV dilihat dan dibandingkan dengan kedua kontrol dan standar ukuran DNA dibawah cahaya UV dan didokumentasikan III. HASIL DAN PEMBAHASAN 3.1 Hasil Berikut adalah hasil visualisasi eletroforesis dengan sinar UV. M A C - 300 kb 100 kb + Keterangan M : Marker (KAPPA® DNA Ladder) A : Sample A C : Sample C - : Sample ikan - KHV + : Plasmid Glikoprotein KHV Gambar 1. band yang ditunjukkan oleh hasil elektroforesis 3.2 Pembahasan Diagnosa penyakit menggunakan teknik PCR telah banyak dikembangkan pada akhir-akhir ini PCR merupakan suatu reaksi in vitro untuk menggandakan jumlah molekul DNA target tersebut dengan bantuan enzim dan oligonukleotida sebagai primer dalam suatu thermocycler. DNA murni virus dengan jumlah memadai dapat diperoleh dengan cara mengisolasi DNA dari inang kemudian mengamplifikasinya (Muladno, 2002) Banyak cara dan berbagai macam prosedur yang dapat dilakukan dalam upaya deteksi virus KHV, tergantung pada reagen dan kit yang digunakan baik pada tahap ekstraksi, purifikasi, amplifikasi, maupun elektrophoresis. Gomez et al., (2011) menggunakan Qiagen GmbH Dneasy Tissue extraction kit (Qiagen, Germany). Mesin PCR yang digunakan adalah real-time PCR assays 2.5 dengan primer KHV didesain pada wilayah 9/5 dan wilayah target yaitu 484 pasang basa. Proses PCR diawali dengan kegiatan isolasi DNA. Isolasi DNA merupakan tahap yang paling penting untuk mendapatkan DNA berkualitas tinggi yang merupakan satu kaidah dasar yang harus dipenuhi dalam studi molekuler. Pada dasarnya isolasi DNA genom total dari sel bakteri terdiri dari beberapa tahap yaitu: kultivasi sel dalam media yang sesuai, pemecahan dinding sel, ekstraksi DNA genom, dan purifikasi DNA (Kurnia, 2011). Tahap-tahap amplifikasi DNA dengan PCR dimulai dengan tahap denaturasi, annealing, ekstensi/elongasi dan kembali ke tahap awal dengan jumlah siklus yang sudah ditentukan (Sambrook dan Russell, 2001). Gel yang biasa digunakan antara lain agarosa. Dengan gel agarosa dapat dilakukan pemisahan sampel DNA dengan ukuran dari beberapa ratus hingga 20.000 pasang basa (pb). Molekul DNA bermuatan negatif sehingga di dalam medan listrik akan bermigrasi melalui matriks gel menuju kutub positif (anode). Makin besar ukuran molekulnya, makin rendah laju migrasinya. Berat molekul suatu fragmen DNA dapat diperkirakan dengan membandingkan laju migrasinya dengan laju migrasi fragmen-fragmen molekul DNA strandar (marker) yang telah diketahui ukurannya. Visualisasi DNA selanjutnya dilakukan di bawah paparan sinar ultraviolet setelah terlebih dulu gel direndam di dalam larutan etidium bromid (Wibowo, 2009). Deteksi DNA dalam gel agarosa dilakukan dengan citra UV. Sinar UV yang digunakan dengan panjang gelombang 300 nm. Metode staining dan visualisasi DNA menggunakan ethidium bromide atau SYBR gold (Sambrook dan Russell, 2001). Gambar 1 menunjukkan bahwa sampel A positif mengandung KHV sedangkan sampel C negatif mengandung KHV. DNA KHV yang teramplifikasi saat PCR menunjukkan fragmen dengan panjang 300 kb. Hal tersebut didasarkan pada band sampel A sejajar dengan marker yang memiliki panjang 300 kb. Sedangkan tebal band menunjukkan seberapa banyak DNA/RNA virus yang teramplifikasi saat PCR. Keberhasilan pengujian sampel dengan metode PCR dipengaruhi oleh beberapa hal, antra lain faktor kontaminasi silang, umur reagen atau enzim yang dipakai, jumlah enzim yang dipakai, ketelitian saat poses ekstraksi, serta kondisi larutan buffer dan larutan etidium bromida yang dipakai. Jika melihat hasil yang didapat, pengerjaan praktikum ini sudah tergolong baik karena tidak adanya kontaminan sehingga hasil yang didapat dapat maksimal (Haliman dan Adijaya, 2005). IV. KESIMPULAN DAN SARAN 4.1 Kesimpulan Hasil elektroforesis menunjukkan bahwa ikan uji A positif (+) mengandung Koi Herpes Virus dan ikan uji C negatif (-) mengandung Koi Herpes Virus. 4.2 Saran Dalam praktikum ekstraksi dan amplifikasi DNA selain menggunakan cara manual sebaiknya juga menggunakan KIT sehingga hasil PCR dapat dibandingkan antara kedua macam bahan tersebut. Selain itu dengan menggunakan KIT akan mempersingkat waktu praktikum. DAFTAR PUSTAKA Gomez D.K., Joh S.J., Jang H., Shin S.P., Choresca Jr. C.H., Han J.E., Kim J.H., Jun J.W., Park S.C. 2011. Detection of koi herpesvirus (KHV) from koi (Cyprinus carpio koi) broodstock in South Korea. Aquaculture.311: 42-47. Haenen O.L.M, Way K, Bergmann S.M, Ariel E. 2004. The emergence of koi herpesvirus and its significance to European aquaculture. Bulletin of the European Association of Fish Pathologists 24:293–307. Haliman, R.W. dan D. Adijaya. 2005. Udang Vanamei, Pembudidayaan dan Prospek Pasar Udang Putih yang Tahan Penyakit. Penebar Swadaya.Jakarta. 75 pp. Handoyo, D dan A. Rudiretna. 2001. Prinsip Umum dan Pelaksanaan Polymerase Chain Reaction (PCR). Unitas Vol 9(1): 17-19. Hendrick RP, Gilad O, Yun S, Spangenberg JV. 2000. A Herpes Virus Associated with Mass Mortality of Juvenile and Adult Koi, a Strain of Common Carp J. Aquatic Animal Health 12: 44-57. Kurnia, A. 2011. Dasar Teknologi DNA Rekombinan. Departemen Farmasi, Universitas Indonesia, Depok, Indonesia. Muladno. 2002. Seputar Teknologi Rekayasa Genetika. Bogor: Pustaka Wira Usaha Muda. Pratiwi, R. 2001. Mengenal Metode Elektroforesis. Oseana Vol XXVI (1): 25-31. Sambrook J. and Russell D.W. 2001. Molecular Cloning. A Laboratory Manual. Edisi ke-3. Vol.2. New York: (US). Cold Spring Harbor Laboratory Press. Sulistyaningsih, E. 2007. Polymerase Chain Reaction (PCR): Era Baru Diagnosis dan Manajemen Penyakit Infeksi. Biomedis Vol 1(1): 17-25. Wibowo, M. S. 2009. Elektroforesis. Sekolah Farmasi. Institut Teknologi Bandung.