transplantasi autologus bone marrow
advertisement

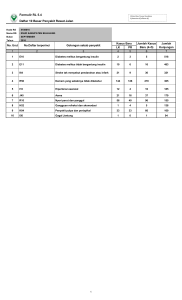
1180: Purwati dkk. KO-104 TRANSPLANTASI AUTOLOGUS BONE MARROW MESENCHYMAL STEM CELL DAN ALLOGENIC PANCREATIC STEM CELL UNTUK PERBAIKAN SEL BETA PANKREAS PADA EKSPERIMENTAL DIABETES MELITUS Purwati1,2,∗ , Fedik A.R.2 , Sony Wibisono1 , Anas P.2 , Eric H.2 , Helen S.2 , dan Deya K.2 1 Departemen Penyakit Dalam, Fakultas Kedokteran, Universitas Airlangga - RSUD Dr. Soetomo, Surabaya 2 Laboratorium Sel Punca, Institute of Tropical Disease, Universitas Airlangga, Surabaya ∗ e-Mail: [email protected] Disajikan 29-30 Nop 2012 ABSTRAK Background: Alternative therapies in Diabetes Mellitus (DM) management include the use of stem cells. Stem cells derived from the bone marrow and pancreatic cells from allogenic donors were used in this experimental animal model to restore glucose control. Methods: DM was induced in Wistar rats with 50 mg/kg alloxan. DM rats were divided into 4 treatment groups, group 1 was transplanted with autologous bone marrow derived mesenchymal stem cells (MSC) by intraperitoneally injection. group 2 was given allogenic pancreatic cells intraperitoneally, group 3 was given insulin subcutaneously, and group 4 served as control (no treated). The dosage was 200,000 cells/rat. Results: Post therapy results in group 1 revealed significant decrease of blood sugar levels, an increase in insulin levels, and increased C peptide levels. In group 2, there were more pronounced changes, improvements in glucose control compared to group 1. Those receiving only insulin the levels of blood sugar decreased but less so compared to those receiving MSC or pancreatic cells (p = 0.002). Conclusion: In a DM Wistar rat model the intraperitoneal administration of pancreatic cells resulted in better restoration of glucose control than intraperitoneally of bone marrow derived MSC, which in turn was better than only insulin. Kata Kunci: DM, stem cell, allogenic, autologous I. PENDAHULUAN DM ditemukan di seluruh dunia, terutama tipe 2 dan lebih sering terjadi di negara berkembang. Peningkatan prevalensi paling tinggi di Asia dan Afrika, sebagai akibat dari tren urbanisasi dan perubahan gaya hidup, termasuk adopsi diet ”gaya Barat”. Telah banyak intervensi medis dan perbaikan gaya hidup diupayakan sejauh ini untuk pencegahan dan penanganan diabetes, tapi prevalensinya tetap meningkat. Oleh karena itu, kami berupaya menyediakan suatu alternatif dalam pengobatan diabetes menggunakan stem cell. Stem cell yang digunakan adalah MSCs yang berasal dari sumsum tulang dan pancreatic stem cell dari donor allogenik. Autologus MSCs yang berasal dari sumsum tulang merupakan salah satu jenis stem cell yang digunakan untuk memperbaiki kerusakan sel pancreas pada DM, dan tidak didapatkan penolakan pasca dilakukan transplantasi. Sejauh ini, sumsum tulang dianggap sebagai sumber stem cell yang lebih disukai. MSCs merupakan derivat sumsum tulang mempunyai sifat multipotent. MSC akan tumbuh dan berdiferensiasi sesuai dengan lingkungannya. Secara in vivo, ketika MSCs dimasukkan ke dalam pankreas, maka MSC akan berdiferensiasi menjadi sel pankreas, yang mempunyai fungsi eksokrin dan endokrin yang sama. Dengan demikian maka transplantasi MSCs ini dapat memperbaiki kerusakan pankreas paada DM. Studi in vivo eksperimental komparatif ini, membandingkan transplantasi autologus MSCs, allogenik PSCs dan terapi pemberian insulin untuk perbaikan pankreas pada eksperimental DM dengan menggunakan rat. II. METODOLOGI Sampel Digunakan rat Wistar, dibagi menjadi 4 kelompok. Kelompok 1 mendapatkan transplantasi MSCs, kelompok 2 mendapatkan transplantasi sel pancreas/PSCs, kelompok 3 mendapatkan insulin dan kelompok 4 se- Prosiding InSINas 2012 1180: Purwati dkk. KO-105 TABEL 1: Kadar glukosa darah, C-peptide dan insulin sebelum dan setelah injeksi alloxan Kadar glukosa (mg/dl) Ains ∗ p Apep ∗∗ GDP p GD2JPP p Tikus sebelum 85.7±5.33 alloxan Tikus setelah 135.05±21.25 alloxan ∗ Kadar insulin (pg/L) ∗∗ Kadar C peptide (NG/l) 0.000 98.45±4.67 206.65±58.27 0.000 0.298±0.242 0.057±0.041 0.000 0.262±0.177 p 0.002 0.168±0.132 G AMBAR 1: Karakterisasi MSC dengan DAB immunostaining. Kiri: ekspresi CD44. Kanan: ekspresi CD 105. Pembesaran 40× bagai kontrol. Rat dibuat menjadi DM dengan injeksi alloxan dosis 50 mg/kg secara intraperitoneal, kemudian dipuasakan selama 8-10 jam, setelah 72 jam diukur kadar C peptide dan insulin diukur secara ELISA (Mercodia). Hasilnya dibandingkan antara pra-injeksi dan pasca-injeksi. Selain itu, diukur juga kadar gula darah menggunakan stik Accu-chek active (Roche) baik sebelum maupun sesudah injeksi alloxan. Diagnosis diabetes ditegakkan dengan mengukur glukosa darah, Cpeptide dan insulin. Kadar gula darah ditentukan dengan mengukur darah vena yang diambil dari vena ekor. Kadar glukosa diukur saat puasa dan 2 jam setelah makan. Kadar gula normal pada tikus adalah 60120 mg/dl. Pengukuran kadar C-peptide dan insulin dilakukan menggunakan metode ELISA. Tabel 1 menunjukkan bahwa pemberian alloxan efektif dalam perusakan sel pankreas pada rat sehingga menyebabkan penurunan kadar insulin dan C-peptide dan untuk meningkatkan kadar glukosa darah pada binatang ini. subsection*Isolasi dan kultur MSCs dari sumsum tulang Mesenchymal stem cells diisolasi dari sumsum tulang menggunakan aspirasi dan separasi pada Histopaque-1.077 (Sigma). Sel yang diambil dikultur pada Dulbecco’s Modified Eagles Medium (DMEM) yang mengandung glukosa 1.0 g/l. Karakterisasi MSCs dilakukan dengan menganalisa ekspresi CD44 + dan CD 105 + dengan menggunakan DAB immunostaining dan FACS (BD). Isolasi dan kultur sel pankreas Sel pankreas diisolasi dari organ pankreas yang diambil dari rat Wistar sehat (Demeterco et al., 2000). Sel pankreas dilakukan digest dengan menggunakan trypsin (Sigma) selama 40 menit pada suhu 37 ◦ C yang bertujuan untuk disosiasi jaringan. Selanjutnya ditambahkan 1,5 FBS (Gibco) untuk menghentikan proses digest. Kemudian disentrifugasi kecepatan 1600 rpm selama 10 menit, dan supernatannya dibuang. Pelet dikultur dalam medium RPMI dan Insulin transferin selenium medium (ITS). Setelah dikultur selama 21 hari, dikarakterisasi dengan memeriksa kadar insulin dan C-peptide yang disekresikan dan ekspresi nestin pada sel pankreas (Shapiro et al., 2000). C-peptide dan insulin diukur menggunakan metode ELISA, sedangkan imunofluoresensi nestin diperiksa menggunakan metode indirek (Rantam et al., 2009). MSCs dan sel pankreas yang sudah konfluen dipanen dan selanjutnya ditransplantasikan pada rat DM. Rat DM dibagi Prosiding InSINas 2012 KO-106 1180: Purwati dkk. G AMBAR 2: Kultur sel pankreas. Kiri: pertumbuhan sel pankreas pada hari ke-5. Kanan: pertumbuhan sel pankreas pada hari ke-12 menunjukkan lapisan sel yang konfluen. Mikroskop inverted, pembesaran 40× menjadi empat kelompok, tiap kelompok terdiri dari 6 binatang. Kelompok 1 diberikan 200.000 sel MSC, kelompok 2 diberikan 200.000 sel pankreas, kelompok 3 diberikan insulin subkutan 1 unit/kgBB, 3 kali sehari 15 menit sebelum makan, dan kelompok 4 yang tidak diobati bertindak sebagai kontrol. Sel diberikan secara intraperitonel. Evaluasi setelah tansplantasi dilakukan pengukuran kadar glukosa darah, C-peptide, dan insulin serta imunohistokimia untuk memeriksa ekspresi HE dan PDX1. III. HASIL DAN PEMBAHASAN Tiga bulan setelah injeksi alloxan, diukur kadar glukosa darah, C-peptide dan insulin serta pemeriksaan imunohistokimia. Hasil kadar glukosa darah, Cpeptide dan insulin tampak pada TABEL 1. Kadar glukosa darah (puasa dan 2 jam post-prandial) meningkat secara signifikan setelah injeksi alloxan. Kadar C-peptide dan insulin menurun secara signifikan setelah injeksi alloxan. G AMBAR 3: Kadar C peptide dan insulin diukur dengan elisa dari supernatan kultur sel pankreas, meningkatkan sesuai pasase dan mencapai puncak pada pasase 4 Karakterisasi MSCs dan sel pankreas Stem cell dikarakterisasi sebelum ditrasnplantasikan dengan tujuan untuk memastikan apakah sel yang ditransplantasikan sudah sesuai dengan sel yang dimaksud. Dalam studi ini karakterisasi fenotip MSC menggunakan immunostaining DAB untuk mengamati ekspresi CD 44+ dan CD105+. Hasil positif ditunjukkan dalam warna coklat seperti tampak pada G AMBAR 1. Setelah melalui tahapan isolasi dan kultur sel pankreas, didapatkan hasil yang diperoleh seperti ditunjukkan dalam G AMBAR 2: Karakterisasi sel pancreas dilakukan dengan mengukur kadar insulin dan C peptide dengan menggunakan elisa. Selain itu juga diperiksa ekspresi nestin dengan menggunakan imunofluoresens indirek. Pengukuran kadar insulin dan C peptide menunjukkan insulin disekresi oleh sel pankreas sejak pasase awal, meningkat pada setiap pasase dan mencapai kadar puncak pada pasase 4. C peptide juga disekresikan pada pasase 1, meningkat setiap pasase dan mencapai kadar puncak pada pasae 4. Transplantasi MSCs dan sel pankreas Hasil glukosa darah puasa dan 2 jam post prandial (PP) pasca-transplantasi menggunakan autologus MSCs dengan dosis 2×106/kgBB, sel pankreas (PSC) allogenik 2×106/kgB dibandingkan dengan insulin subkutan dan kontrol seperti tampak pada G AMBAR 5 dan G AMBAR 6. Kadar glukosa puasa dan 2 jam post-prandial secara signifikan menurun setelah transplantasi MSCs dan PSCs, juga setelah pemberian insulin tapi tidak pada kelompok kontrol. Pengukuran kadar insulin dan C-peptide setelah transplantasi autologus MSCs dan allogenik PSCs dibandingkan dengan pemberian insulin dan kontrol. Hasilnya ditunjukkan pada G AMBAR 7 dan G AMBAR 8. Kadar C peptide dan insulin secara signifikan Prosiding InSINas 2012 1180: Purwati dkk. KO-107 G AMBAR 4: Ekspresi nestin padea sel pankreas. Kiri, sel pankreas yang sudah matur. Kanan, ekspresi nestin ditunjukkan dengan fluoresensi hijau spesifik. Pembesaran 40× G AMBAR 5: Kadar glukosa puasa sebelum dan sesudah transplantasi autologus MSC , allogenik PSCs dibandingkan dengan insulin dan control G AMBAR 6: Kadar glukosa dua jam post-prandial sebelum dan sesudah transplantasi autologus MSCs, allogenik PSCs dibandingkan dengan insulin dan control meningkat setelah transplantasi MSCs dan PSC, juga setelah pemberian insulin tapi tidak pada kelompok kontrol. Pemeriksaan imunohistokimia pasca transplantasi autologus MSCs dan allogenik PSCs dibandingkan dengan pemberian insulin and kontrol didapatkan hasil seperti pada gambar di bawah ini. Marker yang digunakan untuk pemeriksaan imunohistokimia adalah PDX1 sebagai promoter insulin dan HE sebagai marker untuk melihat recovery atau repair dari sel beta pankreas. Ekspresi PDX1 pada pankreas rat yang normal adalah lebih dari 75%, setelah induksi dengan alloxan 50 mg/kg dan menjadi rat DM maka ekspresi PDX1 menurun di bawah 25%. Pasca dilakukan transplantasi dengan menggunakan autologus MSCs dan allogenik PSCs didapatkan peningkatan ekspresi PDX1 menjadi 25∼50%, demikian juga transplantasi allogenik PSCs, ekspresi PDX1 meningkat menjadi lebih dari 75%. Ekspresi PDX1 tidak meningkat pasca pemberian terapi insulin. Hasil pemeriksaan imunohistokimia ekspresi HE (Hematosilin Eosin) didapatkan hasil serupa dengan ekspresi PDX1, yaitu ekspresi HE pada pankreas tikus normal adalah lebih dari 75% dan menurun setelah injeksi alloxan. Peningkatan ekspresi HE didapatkan pasca transplantasi autologus MSCs (50∼75%) dan tranplantasi allogenik PSCs (lebih dari 75%), tapi HE tidak diekspresikan terlalu banyak pada tikus diabetik dengan pemberian insulin, hanya di bawah 25%. Diabetes melitus disebabkan oleh penurunan absolut produksi insulin, sehingga memerlukan suplementasi insulin eksogen, dalam hal ini secara fisiologis lebih dipilih untuk meregenerasi kapasitas fungsi pankreas untuk memproduksi insulin itu sendiri daripada pemberian insulin dari luar. Pada penelitian ini didapatkan hasil bahwa injeksi autologus MSCs derivat sumsum tulang dan allogenik PSCs dapat merekonstitusi produksi insulin pada model binatang DM. Sebelum digunakan, MSCs divalidasi terlebih dahulu untuk kadar Prosiding InSINas 2012 1180: Purwati dkk. KO-108 G AMBAR 7: Kadar C peptide sebelum dan sesudah transplantasi autologus MSCs, allogenik PSCs dibandingkan dengan insulin dan kontrol. kemurniannya dengan menggunakan ekspresi CD105 dan CD44. Hal ini mengindikasikan bahwa sel ini memang MSCs matur. Mesenchymal stem cell adalah prekursor jaringan non-hematopoietik (misal, otot, tulang, tendon, ligamen, jaringan adiposa, dan fibroblas) yang relatif mudah didapatkan dari sumsum tulang autologus. Sel ini bersifat multipotent serta menunjukkan imunogenisitas yang relatif rendah, dan mudah disimpan dalam suhu di bawah nol derajat. MSCs bersifat hipoimunogenik dan dapat menghindar dari eliminasi imun pejamu. MSCs akan tumbuh dan berdiferensiasi berdasarkan lingkungannya. In vivo, ketika diinjeksikan ke dalam pankreas, dapat diperkirakan bahwa MSCs akan berdiferensiasi menjadi sel pankreas yang mempunyai fungsi eksokrin dan endokrin. Dengan demikian maka transplantasi autologus MSCs derivate dari sumsum tulang dapat memperbaiki kerusakan sel pankreas melalui efek selnya sendiri maupun efek parakrin dari MSCs, sehingga bisa mengembalikan fungsi dari sel pancreas tersebut. Studi lain menyebutkan bahwa stem cell derivat sumsum tulang dapat berdiferensiasi menjadi sel yang dapat mensekresikan insulin in vitro (Baksh dan Tuan, 2007; Sotiropoulou et al., 2006). Pankreas adalah suatu organ yang mempunyai kemampuan terbatas untuk berproliferasi (Soria et al., 2001) walaupun demikian sel ini masih dapat berproliferasi dan berdiferensiasi secara in vitro menjadi sel islet (Demeterco et al., 2000; Kahn et al., 2005). Untuk mendapatkan hasil yang diinginkan sel pankreas dikultur dalam free serum medium yang mengandung ITS (insulin-transferrin selenium), terdiri dari nikotinamida dan faktor pertumbuhan keratinosit. Dalam beberapa hari sel tumbuh secara konfluen dengan formasi tridimensional yang memproduksi insulin dan glukagon. Sebelum diberikan, sel pankreas terlebih dahulu divalidasi untuk kadar kemurniannya menggunakan insulin, C peptide, dan nestin. Pemeriksaan insulin dan C peptide menggunakan ELISA ditemukan kadar insulin dan C peptida pada supernatan sel kultur, menunjukkan bahwa sel tersebut mensekresi insulin dan C peptide. Karakterisasi sel pankreas juga menggunakan ekspresi nestin melalui pemeriksaan imunofluoresens, menunjukkan ekspresi nestin positif. Ekspresi nestin positif menunjukkan suatu ciri spesifik sel punca pankreas, baik dalam fungsi eksokrin maupun endokrin. Pasca Transplantasi menggunakan autologus MSCs derivate sumsum tulang, allogenik PSCs dan terapi insulin sub cutan ditemukan adanya restorasi pengendalian glukosa, sekresi insulin, C peptide dan perbaikan sel beta pancreas paling bagus adalah pasca allogenik PSCs dibandingkan dengan autologus MSCs. Hal ini dikarenakan populasi sel pankreas yang digunakan mengandung sel progenitor yang berfungsi secara langsung secara endokrin dan eksokrin, sedangkan MSC adalah sel punca multipoten, yang membutuhkan waktu untuk berdiferensiasi menjadi sel pankreas. Sedamgkan pasca terapi insulin hanya didapatkan peningkatan kadar insulin tetapi tidak didapatkan perbaikan dari sel pankreas itu sendiri, dengan demikian maka stem cell dapat mengatasi permasalahan DM langsung dari akar penyebabnya yaitu dengan merepair sel pankreas itu sendiri. IV. KESIMPULAN Injeksi allogenik sel pankreas intraperitoneal memberikan respons lebih baik dibandingkan dengan autologus MSC intraperitoneal dalam merepair sel pankreas pada rat DM. G AMBAR 8: Kadar insulin sebelum dan sesudah transplantasi autologus MSCs, allogenik PSCs dibandingkan dengan insulin dan control UCAPAN TERIMA KASIH Peneliti berterima kasih kepada semua yang membantu penyelesaian studi ini, dr. Budiono M.S., drh. Budi S., Handoko dan ITD, Airlangga University. Prosiding InSINas 2012 1180: Purwati dkk. KO-109 G AMBAR 9: Ekspresi PDX1 dengan pemeriksaan imunohistokimia.A. Pankreas tikus normal. B. Pankreas tikus diabetik. C. Pankreas tikus diabetik setelah 1 bulan pemberian insulin. D. Pankreas tikus diabetik 1 bulan setelah transplantasi allogenik PSCs. E. Pankreas tikus diabetik 1 bulan setelah transplantasi autologus MSCs Penelitian ini didukung oleh Kementerian Riset dan Teknologi, Republik Indonesia, melalui insentif peneliti Program Research Grant (InSINas No. RT-2012-1180). DAFTAR PUSTAKA [1] Aggarwal S, Pittenger MF. 2005.Human mesenchymal stem cells modulate allogeneic immune cell responses. Blood, 105:1815-1822 [2] American Diabetes Association: Standards of medical care in diabetes.2008 (Position statement). Diabetes Care 2008;31 (Suppl.1):S12-54. [3] Baksh D. and Tuan R.S. 2007. Canonical and noncanonical Wnts differentially affect the development potential of primary isolate of human bone marrow mesenchymal stem cells. J. Cell physiol. 212: 817-826 [4] Bartholomew A., Sturgeon C., Siatskas M., Ferrer K., McIntosh K., Patil S., Hardy W., Devine S., Ucker D., Deans R., Moseley A., Hoffman R.. 2002. Mesenchymal stem cells suppress lymphocyte proliferation in vitro and prolong skin graft survival in vivo. Exp Hematol .30:42-48. [5] Brunner & Suddarth. (1997), Keperawatan Medikal Bedah, alih bahasa Hartono, A. [6] DeFronzo R.A., Ferrannini E., Keen H., Zimmet P. 2004. International Textbook of Diabetes Mellitus, 3rd ed. Chichester, UK: John Wiley and Sons. [7] Demeterco C., Beatttie G.M., Dib S.A., et al. 2000. A [8] [9] [10] [11] [12] Role for Activin A and Beta Cellulin in human fetal pancreatic cell differentiation and growth . J. Clin. Endocrinol Metab 85: 3892-3897 Diabetes Control and Complications Trial Research Group: The effect of intensive diabetes treatment on the development progression of long-term complications in insulin-dependent diabetes mellitus: the Diabetes Controland Complication Trial. N. Engl. J. Med. 1993;329:978-986. Dominici M, Le Blanc K, Mueller I, SlaperCortenbach I, Marini F, Krause D, Deans R, Keating A, Prockop D, Horwitz E. 2006. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy, 8:315-317. Leahy JL. Beta-cell Dysfunction in Type 2 Diabetes In: Kahn C.R., King G.L.,Moses A.C., Weir G.C., Jacobson A.M., Smith R.J. (Eds) Joslinfs Diabetes Mellitus. Lippincott Williams & Wilkin. Philadelphia. p. 449-462, 2005 Purnamasari D. Diagnosis dan klasifikasi diabetes melitus. Dalam: Sudoyo A., Setiyohadi B., Alwi I., Simadibrata M., Setiati S.. Buku Ajar Ilmu Penyakit Dalam Jilid 3. 5th ed. Jakarta: Interna Publishing. p. 1880-3. Rantam F.A., Ferdiansyah, Nasronudin, Purwati. 2009. Stem Cells and Exploration, Airlangga University Press Prosiding InSINas 2012 KO-110 1180: Purwati dkk. G AMBAR 10: Ekspresi HE dengan pemeriksaan imunohistokimia. A. Pankreas tikus normal. B. Pankreas tikus diabetik. C. Pankreas tikus diabetik setelah 1 bulan pemberian insulin. D. Pankreas tikus diabetik 1 bulan setelah transplantasi allogenik PSCs. E. Pankreas tikus diabetik 1 bulan setelah transplantasi autologus MSCs. [13] Shapiro A.M.J., Lakey J.R.T., Ryan E.A., et al. 2000. Islet Transplantation in seven patients with type 1 diabetes mellitus using a corticoid free immunosupressive regimen. N Eng J Med 343: 230-238 [14] Soria B., Skoudy A., Martin F. 2001. From Stem Cell TO Beta Cell: New Strategies in cell therapy of Diabetes Mellitus. Diabetologia 44:407-415 [15] Sotiropoulou P.A., Perez S.A., Salagianni M., Baxevanis C.N., Papamichail M. 2006. Characterization of the optimal culture conditions for clinical scale production of human mesenchymal stem cells. Stem Cells.24:462-471. [16] Wild S., Roglic G., Green A., Sicree R., King H. Global prevalence of diabetes: estimates for the year 2000 and projections for 2030. Diabetes Care 2004 May;27(5):1047-53. Prosiding InSINas 2012