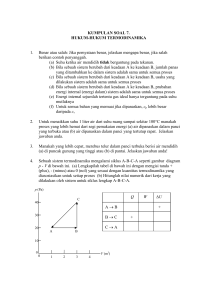
Kata Pengantar Daftar Isi
advertisement

Kata Pengantar Puja dan puji syukur kami panjatkan kehadirat Tuhan Yang Maha Esa, karena berkat dan rahmat-Nya, Makalah Fisika yang berjudul “TERMODINAMIKA” ini dapat diselesaikan. Makalah ini bertujuan untuk memberikan informasi tentang hukum-hukum termodinamika dan serba-serbinya, sehingga diharapkan nantinya pembaca dapat lebih memahami materi termodinamika dalam fisika. Tentunya karya tulis ini selesai berkat bantuan dari berbagai pihak yang telah memberikan kontribusi yang sangat berarti bagi penyusunan laporan ini, baik berupa moril maupun materiil. Untuk itu, kami ucapkan terima kasih yang mendalam kepada : 1. Semua pihak yang tidak dapat kami sebutkan satu persatu yang telah memberikan bantuan yang cukup besar dalam penyusunan makalah ini. Makalah ini sangat jauh dari sempurna dan masih banyak terdapat kesalahan-kesalahan dalam penyusunan makalah ini, maka dari itu, kami mohon maaf yang sebesar-besarnya. Selain itu, saran, usul dan kritik yang sifatnya membangun sangat kami harapkan demi penyempurnaan di masa yang akan datang. Akhir kata, semoga makalah ini dapat berguna dan bermanfaat bagi semua pihak. Daftar Isi riskailham11.wordpress.com Page 1 1. Kata pengantar……………………………………………………………...1 2. Daftar isi……………………………………………………………………2 3. BAB I Pendahuluan……………………………………………………….3 1.1 Latar belakang………………………………………….3 1.2 Tujuan…………………………………………………..3 4. BAB II Pembahasan……………………………………………………….4 2.1 Pengertian Termodinamika…………………………….4 a. System Termodinamika……………………………4 b. Pengertian Energi dalam…………………………...5 c. Formulasi Usaha, Kalor dan Energi Dalam………..5 d. Gas ideal …………………………………………6 e. Kapasitas Panas ……………………………………7 f. Entropi……………………………………............11 g. Pemuaian …………………………………………14 2.2 Proses Termodinamika………………………………15 a. Polytropic proses ………………………………..17 b. Proses isotermal ( suhu konstan ) ………………17 c. Isochoric proses ( volum konstan ) ………………20 d. Proses isobarik ( tekanan konstan ) ………………21 e. Proses adiabatik …………………………………24 f. Proses isentropik ………………………………...32 g. Isenthalpic proses …………………………….....34 h. Quasistatic proses ………………………………..35 2.3 Menentukan Usaha Luar Secara Grafik ……………..37 2.4 Hukum ke Nol Termodinamika………………………38 2.5 Hukum Pertama Termodinamika …………………….41 2.6 Hukum Kedua Termodinamika………………………44 2.7 Hukum Ketiga Termodinamika………………………47 2.8 Siklus Termodinamika ………………………………53 2.9 Tabel Persamaan Termodinamika …………………..60 5. BAB III Penutup …………………………………………………………74 3.1 Kesimpulan …………………………………………74 3.2 Daftar Pustaka ………………………………………75 3.3 Latihan soal ……………………………………..........76 BAB I riskailham11.wordpress.com Page 2 Pendahuluan 1.1 Latar Belakang Setiap kali kita mengendarai kendaraan bermotor, menghidupkan AC atau pendingin ruangan ataupun menggunakan peralatan elektronik lainnya, sebenarnya kita telah memanfaatkan penerapan termodinamika. Di dalam termodinamika, nantinya kita akan menemukan 3 hukum. Hukum ke nol termodinamika, kita mempelajari bagaimana karakteristik-karakteristik berbagai benda ketika kita mengubah suhunya. Hukum pertama termodinamika merupakan kelanjutan dari hukum kekekalan energi yang diperluas hingga meliputi pertukaran energi, baik melalui perpindahan panas maupun kerja mekanik serta memperkenalkan konsep energi dalam sebuah sistem. Hukum pertama termodinamika yang akan kita pelajari ini memegang peranan yang sangat penting dalam berbagai aspek kehidupan manusia sehari-hari. Dalam kehidupan sehari-hari, banyak peristiwa yang berlangsung secara alami pada satu arah tetapi tidak dapat berlangsung pada arah yang sebaliknya. Misalnya, panas selalu mengalir dari suhu tinngi ke suhu rendah, tak pernah sebaliknya. Mengapa demikian? Kita dapat mengubah seluruh energi mekanik menjadi panas dengan mudah, misalnya pada saat kita menginjak rem untuk menghentikan kendaraan. Untuk arah sebaliknya, yaitu mengubah panas menjadi energi mekanik, diperlukan peralatan yang cukup rumit. Misalnya, kita dapat melihat contohnya pada mesin mobil. Bahkan, para ahli sekalipun belum berhasil menciptakan mesin yang mampu mengubah seluruh panas menjadi energi mekanik. Mengapa? Jawaban kedua pertanyaan diatas berkaitan dengan arah proses dan merupakan salah satu pokok pembahasan hukum kedua termodinamika. Hukum ini menjelaskan prinsip dasar efisiensi mesin. Hukum ini juga mampu menjelaskan batas energi minimum yang diperlukan untuk menjalankan mesin pendingin. Jadi, hukum kedua termodinamika selalu berkaitan dengan persoalan praktis dalam kehidupan sehari-hari. 1.2 Tujuan Adapun tujuan atau indikator dari materi ini adalah: Dapat menganalisis keadaan gas karena perubahan suhu, tekanan dan volume. Dapat menggambarkan perubahan keadaan gas dalam diagram p – V, V – T, dan p – T. Dapat memformulasikan hukum I termodinamika dan penerapannya. Dapat memformulasikan hukum II termodinamika dan penerapannya. Dapat mengaplikasikan hukum I dan II termodinamika pada maslah fisika sehari-hari. Dapat membedakan serta merumuskan proses reversible dan irreversible. BAB II Pembahasan riskailham11.wordpress.com Page 3 2.1 Pengertian Termodinamika Ada beberapa pengertian dari Termodinamika: 1. Termodinamika adalah cabang ilmu fisika yang mempelajari pertukaran energi dalam bentuk kalor dan kerja, sistem pembatas (boundary) serta lingkungan. 2. Termodinamika adalah ilmu yang mempelajari hubungan antara panas, kerja mekanik serta aspek-aspek lain dari energi dan perpindahannya. 3. Termodinamika adalah suatu cabang ilmu fisika yang mempelajari hukum-hukum dasar yang dipatuhi oleh kalor dan usaha. Sistem Termodinamika Dalam fisika, dikenal 3 macam sistem sebagai berikut: 1. Sistem Terbuka; ada pertukaran massa dan energi sistem dengan lingkungannya. Contoh: lautan, tumbuh-tumbuhan. 2. Sistem Tertutup; ada pertukaran energi tetapi tidak terjadi pertukaran massa sistem dengan lingkungannya. Contoh: Green house ada pertukaran kalor tetapi tidak terjadi pertukaran kerja dengan lingkungan. 3. Sistem Terisolasi; tidak ada pertukaran massa dan energi sistem dengan lingkungan. Contoh: tabung gas yang terisolasi. Suatu sistem dapat berupa seperangkat mesin, refrigerant pada mesin pendingin, uap air dalam turbin, jaringan otot makhluk hidup dan sebagainya. Jika pada sistem itu dapat terjadi pertukaran energi dengan lingkungannya, misalnya melalui konduksi, maka sistem itu disebut sebagai sistem termodinamika. Sebagai contoh, perhatikan sebuah panci tertutup yang penuh berisi air. Ketika panci dipanaskan diatas kompor, energi diberikan ke dalam air melalui peristiwa konduksi. Ketika air mendidih, air mampu mengangkat tutup panci. Peristiwa ini dapat kita jumpai pada saat kita memanaskan air. Dalam peristiwa ini keadaan air berubah, karena pada saat mendidih, volume, suhu dan tekanan berubah. Proses semacam ini dikenal sebagai proses termodinamika. Dalam sistem termodinamika, kita perlu mendefinisikan sistem dengan jelas. Misalnya, pada proses pemanasan air diatas, yang dimaksud sistem adalah air, tetapi tidak termasuk panci, tutup dan kompor. Dalam proses termodinamika, kita perlu mengetahui besarnya panas Q yang ditambahkan ke sistem dan kerja W yang ditambahkan oleh sistem. Besaran Q dan W ini dapat bernilai positif, negative atau nol. Nilai Q posistif melambangkan aliran panas yang masuk ke dalam system, sedangkan Q negative melambangkan aliran panas yang keluar dari sistem. Nilai W positif melambangkan kerja yang dihasilkan oleh ekspansi gas, dan berkaitan dengan energi yang meningglkan sistem. Nilai W negative, seperti yang terjadi ketika gas mengalami kompresi, dimana kerja diberikan terhadap gas oleh lingkungannya, melambangkan kerja riskailham11.wordpress.com Page 4 yang dilakukan terhadap sistem. Kita akan menggunakan perjanjian tanda ini secara konsisten. Pengertian Energi Dalam Sebelum membahas lebih lanjut mengenai hukum pertama termodinamika kita harus memahami terlebih dahulu mengenai usaha, kalor dan energi serta energi dalam. Karena sebelumnya kita telah membahas mengenai usaha, kalor dan energi, maka yang perlu dibahas sekarang adalah mengenai energi dalam. Setiap benda memiliki energi yang tidak tampak dari luar. Energi ini disebut energi dalam. Energi dalam berhubungan dengan aspek mikroskopik zat. Kita ketahui bahwa setiap zat terdiri atas atom-atom atau molekul molekul yang bergerak terus-menerus. Dari gerakan ini, zat memiliki energy kinetik. Antara molekul-molekul zat juga terdapat gaya yang disebut gaya antarmolekul. Karena gaya antarmolekul ini, molekul-molekul memiliki energi potensial. Jumlah energi kinetik dan energi potensial yang berhubungan dengan atom-atom atau molekul-molekul zat disebut energi dalam. Untuk gas ideal, gaya antarmolekul dapat diabaikan, sehingga energi potensial molekul-molekul adalah nol. Dengan demikian, energi dalam hanyalah total energi kinetik dari seluruh molekul. Energi dalam adalah suatu sifat mikroskopik zat, sehingga tidak dapat diukur secara langsung. Yang dapat diukur secara tidak langsung adalah perubahan energi dalam (notasi ΔU), yaitu ketika sistem berubah dari keadaan awal (diberi indeks 1) ke keadaan akhir (diberi indeks 2). Perubahan energi dalam : ΔU = U2 – U1 Formulasi Usaha, Kalor dan Energi Dalam a. Formulasi Usaha Proses yang terjadi pada tekanan tetap disebut proses isobarik. Usaha W dapat dihitung dari persamaan: W=F.s dengan F adalah besar gaya dan s adalah besar perpindahan. Gaya F ditimbulkan oleh tekanan gas ρ yang bekerja pada bagian bawah pengisap, yang besarnya F=p.A, sehingga usaha W dapat ditulis: W=(p.A).s. Karena As sama dengan perubahan volum gas, ΔV=V2-V1, dengan V2 dan V1 adalah volum akhir dan awal. Maka usaha W dapat dinyatakan oleh persamaan: Usaha pada proses isobarik: W = p.ΔV = p(V2-V1) Rumus W = p.ΔV pada persamaan diatas hanya dapat digunakan untuk menghitung usaha gas pada tekanan tetap (proses isobarik). Jika tekanan gas berubah, usaha W harus dihitung dengan cara integral. Secara umum, usaha dihitung dengan persamaan integral berikut: Rumus umum usaha gas: W = ∫ p dV Usaha diferensial dW yang dilakukan gas selama perpindahan : dW = F.ds = ( pA )( ds ) = p ( A ds ) riskailham11.wordpress.com Page 5 = p dV b. Formulasi Kalor Kalor yang diserap atau diberikan oleh sistem gas dapat dihitung dari rumus kalor: Q = m.c.Δt atau Q = C.Δt Dengan c adalah kalor jenis dan C adalah kapasitas kalor gas. c. Formulasi Energi Dalam Telah kita ketahui bahwa untuk gas ideal, energy dalam gas sama dengan total energy kinetik dari seluruh molekul-molekul gas. Formulasi energy dalam adalah sebagai berikut: Gas monoatomik: U = 3/2 NkT = 3/2 nRT Gas diatomik: U = 5/2 NkT = 5/2 nRT Dengan n = jumlah molekul N = besar mol K = tetapan Boltzman (k = 1,38 x 1023 J/K) R = tetapan umum gas (R = 8,31 J/mol = 8310 J/kmol). Tentu saja perubahan energy dalam ΔU untuk system yang berubah dari suhu awal T1 ke suhu akhir T2 dapat dinyatakan sebagai berikut: Gas monoatomik: ΔU = 3/2 nRΔT = 3/2 nR(T2-T1) Gas diatomic: ΔU = 5/2 nRΔT = 5/2 nR(T2-T1) Dengan ΔU = U2 – U1. Persamaan diatas dengan jelas menunjukkan bahwa perubahan energi dalam sistem hanya bergantung pada suhu awal dan suhu akhir. Dengan kata lain, perubahan energi dalam ΔU hanya bergantung pada keadaan awal dan akhir sistem, dan tidak bergantung pada lintasan yang ditempuh sistem untuk mencapai keadaan itu. Karena itu, energi dalam termasuk fungsi keadaan. Gas Ideal Sebuah gas ideal adalah teori gas yang terdiri dari satu set bergerak-acak, non-berinteraksi titik partikel . Konsep gas ideal berguna karena mematuhi hukum gas ideal, yang disederhanakan, dan setuju untuk analisis dalam. Pada kondisi normal seperti suhu dan tekanan standar, paling nyata gas berperilaku kualitatif seperti gas ideal. Banyak gas seperti udara, nitrogen, oksigen, hidrogen, gas mulia, dan beberapa gas yang lebih berat seperti karbon dioksida dapat diperlakukan seperti gas ideal dalam toleransi yang wajar. Secara umum, gas berperilaku seperti gas ideal pada tinggi suhu dan rendah density (yaitu lebih rendah tekanan), sebagai pekerjaan yang dilakukan oleh gaya antarmolekul menjadi kurang signifikan dibandingkan dengan partikel ' energi kinetik, dan ukuran molekul menjadi kurang signifikan dibandingkan dengan ruang kosong di antara mereka. Model gas ideal cenderung gagal pada suhu rendah atau tekanan yang lebih tinggi, ketika pasukan antarmolekul dan ukuran molekul menjadi penting. Hal ini juga gagal untuk gas berat riskailham11.wordpress.com Page 6 kebanyakan, seperti banyak refrigeran , dan untuk gas dengan pasukan antarmolekul yang kuat, terutama uap air. Pada beberapa titik suhu rendah dan tekanan tinggi, gas nyata menjalani fase transisi, seperti ke sebuah cairan atau padat. Model gas ideal, bagaimanapun, tidak menggambarkan atau mengizinkan transisi fase. Ini harus dimodelkan dengan lebih kompleks persamaan umum. Model gas ideal telah dieksplorasi di kedua dinamika newton (seperti dalam " teori kinetik") dan dalam mekanika kuantum (sebagai " gas dalam kotak"). Model gas ideal juga telah digunakan untuk model perilaku elektron dalam logam (dalam model yang drude dan model elektron bebas), dan itu adalah salah satu model yang paling penting dalam mekanika statik. Jenis-jenis gas ideal Ada tiga kelas dasar gas ideal: klasik atau Maxwell-Boltzmann gas ideal, kuantum yang ideal Bose gas , terdiri dari boson , dan kuantum yang ideal Fermi gas , terdiri dari fermion . The gas ideal klasik dapat dipisahkan menjadi dua jenis: The gas ideal klasik termodinamika dan gas kuantum yang ideal Boltzmann. Keduanya pada dasarnya sama, kecuali bahwa gas termodinamika klasik yang ideal didasarkan pada klasik mekanika statistik , dan parameter termodinamika tertentu seperti entropi hanya ditentukan ke dalam aditif belum ditentukan konstan. Kuantum yang ideal Boltzmann gas mengatasi keterbatasan ini dengan mengambil limit dari kuantum Bose gas dan kuantum gas Fermi dalam batas suhu tinggi untuk menentukan konstanta ini aditif. Perilaku gas Boltzmann kuantum adalah sama seperti yang dilakukan oleh gas ideal klasik kecuali untuk spesifikasi konstanta ini. Hasil dari gas Boltzmann kuantum digunakan dalam sejumlah kasus termasuk persamaan Sackur-tetrode untuk entropi gas ideal dan ionisasi persamaan Saha untuk lemah terionisasi plasma . gas ideal klasik termodinamika Sifat termodinamika The gas ideal dapat dijelaskan oleh dua persamaan: The persamaan keadaan dari gas ideal klasik adalah hukum gas ideal Persamaan ini berasal dari Hukum Boyle: (Pada T konstan dan n); Hukum Charles: (Pada P konstan dan n), dan Hukum Avogadro: Dengan menggabungkan tiga hukum, itu akan menunjukkan bahwa riskailham11.wordpress.com (Pada T konstan dan P). yang Page 7 berarti bahwa . Dalam kondisi ideal, atau lebih tepatnya . The energi internal gas ideal diberikan oleh: dimana P adalah tekanan V adalah volume yang n adalah jumlah zat gas (dalam mol) R adalah konstanta gas (8,314 J · K -1 mol -1) T adalah temperatur absolut k adalah konstanta yang digunakan dalam Hukum Boyle b adalah proporsionalitas konstan; sama dengan V / T adalah proporsionalitas konstan; sama dengan V / n U adalah energi internal adalah berdimensi spesifik kapasitas panas pada volume konstan, ≈ 3/2 untuk gas monoatomik , 5/2 untuk diatomik gas dan 3 untuk molekul yang lebih kompleks. Jumlah gas di J · K -1 adalah dimana N adalah jumlah partikel gas adalah konstanta Boltzmann (1.381 × 10 -23 J · K -1). Distribusi probabilitas dari partikel dengan kecepatan atau energi yang diberikan oleh distribusi Boltzmann . Hukum gas ideal merupakan perpanjangan dari eksperimen menemukan hukum gas . Nyata cairan di low density dan tinggi suhu mendekati perilaku gas ideal klasik. Namun, di bawah suhu tinggi atau kepadatan , cairan nyata menyimpang kuat dari perilaku gas ideal, terutama karena mengembun dari gas menjadi cair atau padat. Penyimpangan ini dinyatakan sebagai faktor kompresibilitas . Model gas ideal tergantung pada asumsi sebagai berikut: riskailham11.wordpress.com Page 8 Molekul-molekul gas yang bisa dibedakan, kecil, bola keras Semua tumbukan elastis dan gerak semua gesekan (tanpa kehilangan energi dalam gerakan atau tabrakan) Hukum Newton berlaku Jarak rata-rata antara molekul jauh lebih besar dari ukuran molekul Molekul-molekul selalu bergerak dalam arah acak dengan distribusi kecepatan Tidak ada kekuatan menarik atau tolak antara molekul atau lingkungan Asumsi partikel berbentuk bola sangat diperlukan agar tidak ada mode rotasi diperbolehkan, tidak seperti dalam gas diatomik. Berikut tiga asumsi yang sangat terkait: molekul sulit, tabrakan yang elastis, dan tidak ada antar-molekul pasukan. Asumsi bahwa ruang antara partikel jauh lebih besar daripada partikel itu sendiri adalah sangat penting, dan menjelaskan mengapa pendekatan gas ideal gagal pada tekanan tinggi. Kapasitas Panas The kapasitas panas pada volume konstan nR = 1 J · K -1 gas apapun, termasuk gas ideal adalah: Ini adalah kapasitas panas berdimensi pada volume konstan, yang umumnya merupakan fungsi dari suhu karena gaya antarmolekul. Untuk suhu moderat, yang konstan untuk gas adalah monoatomic sedangkan untuk gas diatomik adalah . Hal ini terlihat bahwa pengukuran makroskopik pada kapasitas panas memberikan informasi tentang struktur mikroskopis dari molekul. Kapasitas panas pada tekanan konstan 1 · K -1 gas J ideal adalah: dimana adalah entalpi gas. Kadang-kadang, perbedaan dibuat antara gas ideal, di mana dan bisa bervariasi dengan tekanan dan temperatur, dan gas yang sempurna , yang hal ini tidak terjadi. Kapasitas kalor atau Harga air / Nilai air (H) Kapasitas kalor suatu zat ialah banyaknya kalor yang diserap/dilepaskan untuk menaikkan/menurunkan suhu 10 C riskailham11.wordpress.com Page 9 Jika kapasitas kalor/Nilai air = H maka untuk menaikkan/menurunkan suhu suatu zat sebesar t diperlukan kalor sebesar : Q = H . t Q dalam satuan k kal atau kal H dalam satuan k kal / 0C atau kal / 0C t dalam satuan 0C Kalor Jenis (c) Kalor jenis suatu zat ialah : banyaknya kalor yang diterima/dilepas untuk menaikkan/menurunkan suhu 1 satuan massa zat sebesar 10 C. Jika kalor jenis suatu zat = c, maka untuk menaikkan/menurunkan suatu zat bermassa m, sebesar t 0C, kalor yang diperlukan/dilepaskan sebesar : Q = m . c . t Q m c t dalam satuan k kal atau kal dalam satuan kg atau g dalam satuan k kal/kg 0C atau kal/g 0C dalam satuan 0C Dari persamaan di atas dapat ditarik suatu hubungan : H . t = m . c . t H=m.c Rambatan Kalor. Panas dapat dipindahkan dengan 3 macam cara, antara lain : a. Secara konduksi (Hantaran) b. Secara konveksi (Aliran) c. Secara Radiasi (Pancaran) a. KONDUKSI. Pada peristiwa konduksi, atom-atom zat yang memindahkan panas tidak berpindah tempat tetapi hanya bergetar saja sehingga menumbuk atom-atom disebelahnya, (Misalkan terdapat pada zat padat) Banyaknya panas per satuan waktu yang dihantarkan oleh sebuah batang yang panjangnya L, luas penampang A dan perbedaan suhu antara ujung-ujungnya t, adalah : H=k.A. k adalah koefisien konduksi panas dari bahan dan besarnya tergantung dari macam bahan. Bila k makin besar, benda adalah konduktor panas yang baik. Bila k makin kecil, benda adalah isolator panas. b. KONVEKSI. riskailham11.wordpress.com Page 10 Pada peristiwa ini partikel-partikel zat yang memindahkan panas ikut bergerak. Kalor yang merambat per satuan waktu adalah : H = h . A . t h = koefisien konveksi misalkan pada zat cair dan gas. c. RADIASI. Adalah pemindahan panas melalui radiasi energi gelombang elektromagnetik. Energi panas tersebut dipancarkan dengan kecepatan yang sama dengan gelombang-gelombang elektromagnetik lain di ruang hampa (3 x 108 m/det) Banyaknya panas yang dipancarkan per satuan waktu menurut Stefan Boltzman adalah : W=e..T4 = Intensitas radiasi yang dipancarkan per satuan luas, dinyatakan dalam : J/m2.det atau watt/m2 E = Emisivitas (Daya pancaran) permukaan watt –8 = Konstanta umum = 5,672 x 10 4 2 m (K) T = Suhu mutlak benda Besarnya harga e tergantung pada macam permukaan benda 0 e 1 - Permukaan hitam sempurna (black body) e=1 - Sebagai pemancar panas ideal. - Sebagai penyerap panas yang baik. - Sebagai pemantul panas yang jelek. e=0 - W Terdapat pada permukaan yang lebih halus. Sebagai pemancar panas yang jelek. Sebagai penyerap panas yang jelek. Sebagai pemantul yang baik. Entropi Entropi adalah properti dari sistem Thermodynamical. Sebuah sistem termodinamika adalah setiap benda fisik atau wilayah ruang yang dapat dijelaskan oleh jumlah termodinamika yang seperti temperatur , tekanan , Volume , dan kepadatan . kita bisa mendefinisikan fungsi negara S, yang disebut entropi, yang memenuhi Secara khusus, entropi adalah logaritma ukuran persamaan kepadatan : riskailham11.wordpress.com Page 11 di mana k B adalah konstanta Boltzmann , sama dengan 1.380 6 5 × 10 -23 JK -1. Penjumlahan adalah atas semua microstates kemungkinan sistem, dan P i adalah probabilitas bahwa sistem ini dalam i th microstate. Untuk sebagian besar tujuan praktis, ini dapat diambil sebagai definisi fundamental entropi karena semua formula lainnya untuk S dapat matematis berasal darinya, namun tidak sebaliknya. (Dalam beberapa situasi langka dan terpendam, generalisasi dari formula ini mungkin diperlukan untuk menjelaskan koherensi kuantum efek, tetapi dalam setiap situasi di mana gagasan klasik probabilitas masuk akal, persamaan di atas secara akurat menggambarkan entropi sistem.) Dalam apa yang disebut asumsi dasar termodinamika statistik atau fundamental postulat dalam mekanika statistik , pendudukan microstate pun diasumsikan sama kemungkinan (yaitu P i = 1 / Ω Ω mana adalah jumlah microstates), asumsi ini . biasanya dibenarkan untuk sistem terisolasi dalam kesetimbangan. Kemudian persamaan sebelumnya tereduksi menjadi: perubahan Entropy Ketika gas ideal mengalami perubahan, entropi yang juga bisa berubah. Untuk kasus-kasus di mana panas spesifik tidak berubah dan baik volume, tekanan atau temperatur juga konstan, perubahan entropi dapat dengan mudah dihitung. Ketika panas spesifik dan volume yang konstan, perubahan entropi diberikan oleh: . Ketika panas spesifik dan tekanan yang konstan, perubahan entropi diberikan oleh: . Ketika panas spesifik dan suhu yang konstan, perubahan entropi diberikan oleh: . Dalam persamaan adalah panas spesifik pada volume konstan, adalah panas spesifik pada tekanan konstan, adalah konstanta gas ideal , dan adalah jumlah mol gas. Gas Ideal kuantum Dalam persamaan Sackur-tetrode disebutkan di atas, pilihan terbaik dari konstanta entropi ditemukan sebanding dengan kuantum panjang gelombang termal dari sebuah partikel, dan titik di mana argumen logaritma menjadi nol kurang lebih sama dengan titik di mana jarak rata-rata antara partikel menjadi sama dengan panjang gelombang termal. Bahkan, kuantum teori itu sendiri riskailham11.wordpress.com Page 12 memprediksi hal yang sama. Setiap gas berperilaku sebagai gas ideal pada suhu cukup tinggi dan kepadatan cukup rendah, tetapi pada titik di mana persamaan Sackur-tetrode mulai rusak, gas akan mulai berperilaku sebagai gas kuantum, terdiri dari baik boson atau fermion . (Lihat gas dalam kotak artikel untuk derivasi dari gas kuantum yang ideal, termasuk gas Boltzmann yang ideal.) Gas cenderung berperilaku sebagai gas ideal pada rentang yang lebih luas dari tekanan saat suhu mencapai suhu Boyle . Gas Ideal Boltzmann Gas Boltzmann yang ideal menghasilkan hasil yang sama seperti gas termodinamika klasik, tetapi membuat identifikasi berikut untuk Φ konstan ditentukan: mana Λ adalah de Broglie panjang gelombang termal gas dan g adalah degenerasi negara. Gas Ideal Bose dan Fermi Ideal gas boson (misalnya gas foton ) akan diatur oleh Bose-Einstein statistik dan distribusi energi akan dalam bentuk distribusi Bose-Einstein . Ideal gas fermion akan diatur oleh Fermi-Dirac statistik dan distribusi energi akan berada dalam bentuk distribusi Fermi-Dirac . Pemuaian Pemuaian adalah bertambahnya ukuran suatu benda karena pengaruh perubahan suhu atau bertambahnya ukuran suatu benda karena menerima kalor. Pemuaian panjang Secara matematis persamaan yang digunakan untuk menentukan pertambahan panjang benda setelah dipanaskan pada suhu tertentu adalah riskailham11.wordpress.com Page 13 Pemuaian luas Untuk menentukan pertambahan luas dan volume akhir digunakan persamaan sebagai berikut : Pemuaian volume Persamaan yang digunakan untuk menentukan pertambahan volume dan volume akhir suatu benda tidak jauh beda pada perumusan sebelum. Hanya saja beda pada lambangnya saja. Perumusannya adalah 2.2 Proses Termodinamika riskailham11.wordpress.com Page 14 Sebuah proses termodinamika adalah pengembangan energik dari sistem termodinamika melanjutkan dari keadaan awal ke keadaan akhir. Jalan melalui ruang variabel termodinamika seringkali ditentukan dengan memegang variabel termodinamika tertentu konstan. Sebuah fungsi negara adalah variabel termodinamika yang hanya bergantung pada keadaan saat ini dari sistem, bukan jalan yang diambil untuk mencapai keadaan itu. Sebaliknya suatu fungsi proses tidak bergantung pada jalan. Ikhtisar Contoh dari serangkaian proses termodinamika yang membentuk siklus Stirling Sebuah proses termodinamika dapat divisualisasikan dengan grafis merencanakan perubahan sistem variabel negara . Dalam contoh ini, empat proses yang akan ditampilkan. Setiap proses memiliki awal yang terdefinisi dengan baik dan titik akhir dalam tekanan-volume ruang keadaan . Dalam contoh khusus ini, proses 1 dan 3 adalah isotermal , sedangkan proses 2 dan 4 isochoric . The diagram PV adalah visualisasi sangat berguna dari sebuah proses, karena area di bawah kurva dari sebuah proses adalah jumlah pekerjaan yang dilakukan oleh sistem selama proses tersebut. Dengan demikian kerja dianggap sebagai variabel proses , seperti nilai eksaknya tergantung pada jalan tertentu yang diambil antara titik awal dan akhir dari proses. Demikian pula, panas dapat ditransfer selama proses, dan juga merupakan variabel proses. Sebaliknya, tekanan dan volume (serta berbagai properti lainnya ) dianggap variabel negara karena nilai-nilai mereka hanya bergantung pada posisi titik awal dan akhir, bukan jalur khusus di antara mereka. Tekanan - Volume Para pasangan konjugasi tekanan-volume berkaitan dengan transfer energi mekanik atau dinamis sebagai hasil dari pekerjaan. Sebuah proses isobarik terjadi pada tekanan konstan. Sebuah contoh akan memiliki piston bergerak dalam silinder, sehingga tekanan dalam silinder selalu pada tekanan atmosfer, meskipun terisolasi dari atmosfer. Dengan kata lain, sistem ini secara dinamis terhubung, dengan batas bergerak, ke reservoir yang bertekanan konstan. riskailham11.wordpress.com Page 15 Sebuah proses isochoric adalah satu di mana volume tetap konstan, yang berarti bahwa pekerjaan yang dilakukan oleh sistem akan menjadi nol. Oleh karena itu, untuk sistem yang sederhana dari dua dimensi, setiap energi panas ditransfer ke sistem eksternal akan diserap sebagai energi internal. Sebuah proses isochoric juga dikenal sebagai proses isometrik atau proses isovolumetric. Sebuah contoh akan menempatkan kaleng tertutup dapat berisi udara hanya ke dalam api. Untuk pendekatan pertama, bisa tidak akan berkembang, dan perubahan hanya akan bahwa gas keuntungan energi internal, sebagaimana dibuktikan oleh peningkatan dalam suhu dan tekanan. Secara matematis, . Kita bisa mengatakan bahwa sistem secara dinamis terisolasi, dengan batas yang kaku, dari lingkungan. Suhu - entropi Para pasangan konjugasi temperatur-entropi berkaitan dengan transfer energi panas akibat pemanasan. Sebuah proses isotermal terjadi pada suhu konstan. Sebuah contoh akan memiliki sistem direndam dalam bak konstan suhu yang besar. Setiap pekerjaan yang dilakukan oleh energi sistem akan hilang ke kamar mandi, tapi suhunya akan tetap konstan. Dengan kata lain, sistem ini terhubung termal, dengan batas termal konduktif ke reservoir suhu konstan. Sebuah proses adiabatik adalah proses di mana ada tidak ada energi ditambahkan atau dikurangi dari sistem dengan pemanasan atau pendinginan. Untuk proses reversible, ini identik dengan proses isentropik. Kita bisa mengatakan bahwa sistem termal terisolasi dari lingkungannya dan bahwa batasnya adalah isolator termal. Jika sistem memiliki entropi yang belum mencapai nilai kesetimbangan maksimum, entropi akan meningkat meskipun sistem termal terisolasi. Dalam kondisi tertentu dua negara dari sistem dapat dianggap adiabatik accesisble . Sebuah proses isentropik terjadi pada konstan entropi . Untuk proses reversibel ini identik dengan proses adiabatik. Jika sistem memiliki entropi yang belum mencapai keseimbangan maksimum nilai, proses pendinginan mungkin diperlukan untuk mempertahankan bahwa nilai entropi. Polytropic proses Sebuah proses polytropic adalah proses termodinamika yang mematuhi hubungan: di mana P adalah tekanan, V adalah volume, n adalah setiap bilangan real ("index polytropic"), dan C adalah konstanta. Persamaan ini dapat digunakan untuk secara akurat menggambarkan proses riskailham11.wordpress.com Page 16 tertentu sistem , terutama kompresi atau ekspansi dari gas , tetapi dalam beberapa kasus, cairan dan padatan . Proses isotermal ( suhu konstan ) Sebuah proses isotermal adalah perubahan dari suatu sistem, di mana suhu tetap konstan: Δ T = 0. Hal ini biasanya terjadi ketika sistem berada dalam kontak dengan reservoir termal luar ( mandi panas ), dan perubahan terjadi perlahan-lahan cukup untuk memungkinkan sistem untuk terus menyesuaikan diri dengan suhu reservoir melalui panas pertukaran. Sebaliknya, suatu proses adiabatik adalah di mana sistem pertukaran panas dengan nya lingkungan (Q = 0). Dengan kata lain, dalam proses isotermal, nilai Δ T = 0 tapi Q ≠ 0, sedangkan dalam proses adiabatik, Δ T ≠ 0 tapi Q = 0. Detail untuk gas ideal Beberapa isoterm gas ideal pada diagram PV Untuk kasus khusus dari gas yang hukum Boyle berlaku, produk pV adalah konstan jika gas disimpan pada kondisi isotermal. Namun kasus-kasus di mana produk pv adalah istilah eksponensial ini tidak sesuai. Nilai dari konstan nRT, dimana n adalah jumlah mol gas hadir dan R adalah konstanta gas ideal . Dengan kata lain, hukum gas ideal pV = nRT berlaku. Ini berarti bahwa memegang. Keluarga kurva yang dihasilkan oleh persamaan ini ditunjukkan dalam grafik yang disajikan di bagian bawah kanan halaman. Setiap kurva disebut isoterm. Grafik tersebut disebut diagram indikator dan pertama kali digunakan oleh James Watt dan lain-lain untuk memantau efisiensi mesin. Suhu yang sesuai untuk setiap kurva pada gambar meningkat dari kiri bawah ke kanan atas. Perhitungan pekerjaan riskailham11.wordpress.com Page 17 Daerah biru merupakan "pekerjaan" untuk perubahan isotermal Dalam termodinamika, pekerjaan yang terlibat ketika perubahan gas dari negara A ke negara B hanya Untuk, isotermal reversibel proses, terpisahkan ini sama dengan daerah di bawah tekanan-volume yang relevan isoterm, dan ditandai dengan warna biru pada gambar (di bagian bawah kanan halaman) untuk gas ideal. Sekali lagi, p = nRT / V berlaku dan dengan T yang konstan (karena ini adalah proses isotermal), kita memiliki: Dengan konvensi, kerja didefinisikan sebagai sistem kerja yang tidak pada lingkungannya. Jika, misalnya, sistem mengembang oleh piston bergerak ke arah gaya yang diterapkan oleh tekanan internal gas, maka pekerjaan tersebut dihitung sebagai positif, dan sebagai pekerjaan ini dilakukan dengan menggunakan energi internal sistem, hasilnya adalah bahwa energi internal berkurang. Sebaliknya, jika lingkungan tidak bekerja pada sistem sehingga meningkatkan internal energi, pekerjaan dihitung sebagai negatif. Hal ini juga diperhatikan bahwa, untuk banyak sistem, jika suhu tetap konstan, energi internal sistem juga konstan, dan sebagainya . Dari Hukum Pertama Termodinamika , , Sehingga dapat dikatakan bahwa untuk proses isotermal yang sama. Ketika tidak ada panas mengalir ke atau keluar dari gas karena suhu konstan, maka tidak ada pekerjaan yang dilakukan. Dengan demikian, bekerja = 0 yang berarti tekanan eksternal adalah nol. Ini disebut ekspansi bebas . riskailham11.wordpress.com Page 18 Isochoric proses ( volum konstan ) Sebuah proses isochoric, juga disebut proses konstan-volume, proses isovolumetric, atau proses isometrik, adalah proses termodinamika yang selama itu jumlah dari sistem tertutup menjalani proses tersebut tetap konstan. Sebuah proses isochoric dicontohkan oleh pemanasan atau pendinginan isi wadah, disegel inelastis: Proses termodinamika adalah penambahan atau penghapusan panas, isolasi isi wadah menetapkan sistem tertutup, dan ketidakmampuan kontainer untuk merusak memaksakan kondisi konstan-volume. Formalisme Sebuah proses termodinamika isochoric ditandai dengan konstan Volume , yaitu, . Proses ini tidak ada tekanan -volume kerja , karena pekerjaan tersebut didefinisikan oleh , di mana P adalah tekanan. Konvensi Tanda adalah sedemikian rupa sehingga kerja yang positif dilakukan oleh sistem terhadap lingkungan. Untuk proses reversibel , pada hukum pertama termodinamika memberikan perubahan dalam sistem energi internal : Mengganti bekerja dengan perubahan volume memberikan Karena proses ini isochoric, , Persamaan sebelumnya sekarang memberikan Menggunakan definisi kapasitas panas spesifik pada volume konstan, , Mengintegrasikan kedua belah pihak menghasilkan riskailham11.wordpress.com Page 19 Dimana adalah kapasitas panas spesifik pada volume konstan, final suhu . Kami menyimpulkan dengan: adalah awal suhu dan adalah Isochoric Proses dalam diagram Volume Tekanan . Pada diagram ini, meningkatkan tekanan, tetapi volume tetap konstan. Pada diagram Volume tekanan , proses isochoric muncul sebagai garis vertikal lurus. Konjugat termodinamika, sebuah proses isobaric akan muncul sebagai suatu garis horisontal. Etimologi The isochor benda dan kata sifat isochoric berasal dari kata Yunani ἴσος (isos) yang berarti "sama", dan χώρος (Choros) yang berarti "ruang." Proses isobarik ( tekanan konstan ) Sebuah proses isobarik adalah proses termodinamika dimana tekanan tetap konstan. Istilah ini berasal dari bahasa Yunani isos, (sama), dan barus, (berat). Panas ditransfer ke sistem tidak bekerja tetapi juga mengubah energi internal sistem: riskailham11.wordpress.com Page 20 Daerah kuning merupakan kerja yang dilakukan Menurut hukum pertama termodinamika , di mana W adalah kerja yang dilakukan oleh sistem, U adalah energi internal, dan Q adalah panas. Tekanan-volume pekerjaan oleh sistem tertutup didefinisikan sebagai: di mana Δ berarti perubahan atas seluruh proses, sedangkan d menunjukkan sebuah diferensial. Karena tekanan konstan, ini berarti bahwa . pada proses isobarik P = C. maka besarnya usaha adalah W=∫ = P ( V2 – V1 ). Menerapkan hukum gas ideal , ini menjadi dengan asumsi bahwa jumlah gas tetap konstan, misalnya, tidak ada fase transisi selama reaksi kimia . Menurut teorema equipartition , perubahan energi internal berkaitan dengan suhu sistem dengan , dimana adalah panas spesifik pada volume konstan. Mengganti dua persamaan terakhir ke persamaan pertama menghasilkan: , dimana adalah panas spesifik pada tekanan konstan. kapasitas panas spesifik riskailham11.wordpress.com Page 21 Untuk menemukan kapasitas panas molar spesifik dari gas yang terlibat, persamaan berikut berlaku untuk setiap gas umum yang calorically sempurna. Properti adalah baik disebut indeks adiabatik atau rasio kapasitas panas . Beberapa sumber yang diterbitkan mungkin menggunakan k bukan . Molar panas spesifik isochoric: . Molar panas spesifik isobaric: . Nilai-nilai untuk adalah untuk gas diatomik seperti udara dan komponen utamanya , dan untuk gas monoatomik seperti gas mulia . Rumus untuk memanaskan spesifik akan mengurangi dalam kasus khusus: Monoatomik: dan Diatomik: dan Sebuah proses isobarik ditunjukkan pada diagram PV sebagai garis horizontal lurus, menghubungkan negara termostatik awal dan akhir. Jika proses bergerak ke arah kanan, maka itu adalah ekspansi. Jika proses bergerak ke arah kiri, maka itu adalah kompresi. Mendefinisikan entalpi Sebuah proses isochoric dijelaskan oleh persamaan . Ini akan mudah untuk memiliki persamaan yang sama untuk proses isobarik. Mengganti persamaan kedua ke dalam hasil pertama riskailham11.wordpress.com Page 22 Kuantitas U + p V adalah fungsi keadaan sehingga dapat diberikan nama. Hal ini disebut entalpi , dan dilambangkan dengan H. Oleh karena itu proses isobarik dapat lebih ringkas digambarkan sebagai . Entalpi dan kapasitas panas spesifik isobaric konstruksi matematika sangat berguna, karena ketika menganalisis proses dalam sebuah sistem terbuka , situasi kerja nol terjadi ketika cairan yang mengalir pada tekanan konstan. Dalam sebuah sistem terbuka, entalpi adalah jumlah yang berguna untuk menggunakan untuk melacak kandungan energi dari fluida. Proses adiabatik Sebuah proses adiabatik adalah setiap proses yang terjadi tanpa masukan atau output dari panas dalam suatu sistem (yaitu selama proses sistem ini termodinamika terisolasi-tidak ada perpindahan panas dengan lingkungan). Ini adalah kebalikan dari proses diabatic, di mana ada perpindahan panas. Sebuah konsep kunci dalam termodinamika , banyak yang cepat proses kimia dan fisika yang dijelaskan atau didekati dengan cara ini. Proses tersebut biasanya diikuti atau didahului oleh peristiwa yang melakukan melibatkan panas transfer (yaitu non-adiabatik). Contohnya termasuk transfer elektron . Proses adiabatik dapat terjadi jika wadah sistem memiliki dinding termal-terisolasi atau proses yang terjadi dalam waktu yang sangat singkat, sehingga tidak ada kesempatan untuk pertukaran panas yang signifikan. Meskipun istilah adiabatik dan isokalori seringkali dapat dipertukarkan, Proses adiabatik dapat dianggap sebagai bagian dari proses isokalori , subset pelengkap sisa proses isokalori menjadi proses di mana perpindahan panas bersih tidak menyimpang regional seperti dalam kasus ideal dengan media konduktivitas termal terbatas atau tidak ada kapasitas termal. Dalam proses ireversibel adiabatik, dQ = 0 tidak sama dengan TDS (TDS> 0) di mana Q adalah energi panas, T adalah temperatur, dan S adalah entropi. dQ = TDS = 0 berlaku untuk proses reversibel saja. Sebagai contoh, sebuah batas adiabatik adalah batas yang kedap perpindahan panas dan sistem dikatakan adiabatik (atau termal) diisolasi, sebuah dinding terisolasi mendekati suatu batas adiabatik. Contoh lain adalah temperatur nyala adiabatik , yang merupakan suhu yang akan dicapai oleh api dengan tidak adanya kehilangan panas ke lingkungan. Sebuah proses adiabatik yang reversibel juga disebut proses isentropik . Sebaliknya, proses adiabatik yang ireversibel dan ekstrak pekerjaan tidak ada dalam isenthalpic proses, seperti tarik kental, maju menuju perubahan non-negatif entropi. Satu berlawanan ekstrim-yang memungkinkan perpindahan panas dengan lingkungan, menyebabkan suhu tetap konstan-dikenal sebagai proses isotermal . Karena suhu termodinamika konjugat ke entropi , proses isotermal adalah konjugasi untuk proses adiabatik untuk transformasi reversibel. riskailham11.wordpress.com Page 23 Sebuah transformasi suatu sistem termodinamika dapat dianggap adiabatik ketika itu cukup cepat bahwa tidak ada panas yang signifikan ditransfer antara sistem dan luar. Pada ekstrim yang berlawanan, sebuah transformasi dari suatu sistem termodinamika dapat dianggap isotermal jika cukup lambat sehingga suhu sistem tetap konstan dengan pertukaran panas dengan luar. Istilah "adiabatik" secara harfiah berarti dilewati, berasal dari akar Yunani ἀ-("tidak"), διὰ("melalui"), dan βαῖνειν ("lulus"); etimologi ini sesuai di sini untuk ketiadaan perpindahan panas Adiabatik pemanasan dan pendinginan Perubahan adiabatik suhu terjadi karena perubahan tekanan dari gas sementara tidak menambah atau mengurangi setiap panas . Sebaliknya, ekspansi bebas adalah isotermal proses untuk gas ideal. Pemanasan adiabatik terjadi ketika tekanan gas yang meningkat dari pekerjaan yang dilakukan di atasnya oleh lingkungannya, misalnya piston . Mesin diesel mengandalkan pemanasan adiabatik saat langkah kompresi untuk meningkatkan suhu cukup untuk menyalakan bahan bakar. Pemanasan adiabatik juga terjadi di atmosfer bumi ketika massa udara turun, misalnya, dalam angin katabatic atau Foehn atau chinook angin mengalir menurun selama pegunungan. Ketika sebidang udara turun, tekanan pada peningkatan paket. Karena ini peningkatan tekanan, volume paket ini menurun dan suhu yang meningkat, sehingga meningkatkan energi internal. Pendinginan adiabatik terjadi ketika tekanan zat menurun karena tidak bekerja pada sekitarnya. Pendinginan adiabatik terjadi di atmosfer bumi dengan mengangkat orografis dan gelombang lee , dan ini dapat membentuk pileus atau awan lenticular jika udara didinginkan di bawah titik embun . Ketika tekanan diterapkan pada sebidang menurun udara, udara dalam paket diperbolehkan untuk memperluas, dengan meningkatnya volume, suhu turun dan energi internal berkurang. Pendinginan adiabatik tidak harus melibatkan cairan. Salah satu teknik yang digunakan untuk mencapai suhu yang sangat rendah (seperseribu bahkan sepersejuta derajat di atas nol mutlak) adalah demagnetisation adiabatik , di mana perubahan medan magnet pada bahan magnetik yang digunakan untuk menyediakan pendinginan adiabatik. Juga, isi dari alam semesta yang mengembang . (untuk urutan pertama) dapat digambarkan sebagai cairan pendingin adiabatik (Lihat - kematian Panas alam semesta ) Magma naik juga mengalami pendinginan adiabatik sebelum letusan, sangat signifikan dalam kasus magma yang naik dengan cepat dari kedalaman besar seperti kimberlites . [3] Perubahan suhu tersebut dapat diukur dengan menggunakan hukum gas ideal , atau persamaan hidrostatik untuk proses atmosfer. riskailham11.wordpress.com Page 24 Proses Tidak ada benar-benar adiabatik. Banyak proses yang dekat dengan adiabatik dan dapat dengan mudah didekati dengan menggunakan asumsi adiabatik, tapi selalu ada beberapa kehilangan panas, karena tidak ada isolator yang sempurna ada. Ideal gas (proses reversible) Untuk zat yang sederhana, selama proses adiabatik yang meningkat volume, energi internal dari substansi kerja harus menurunkan Persamaan matematika untuk gas ideal menjalani (yaitu, tidak ada generasi entropi) reversibel proses adiabatik adalah di mana P adalah tekanan, V adalah spesifik atau volume molar , dan menjadi panas spesifik untuk tekanan konstan, adalah indeks adiabatik , dan untuk gas diatomik). Untuk gas ideal monoatomik, menjadi panas khusus untuk volume konstan, adalah jumlah derajat kebebasan (3 untuk gas monoatomik, 5 , Dan untuk gas diatomik (seperti nitrogen dan oksigen , komponen utama dari udara ) . Perhatikan bahwa rumus di atas hanya berlaku untuk gas ideal klasik dan tidak Bose-Einstein atau gas Fermi . riskailham11.wordpress.com Page 25 Untuk proses adiabatik reversibel, juga benar bahwa di mana T adalah temperatur absolut. Hal ini juga dapat ditulis sebagai Penurunan rumus terus menerus untuk pemanasan dan pendinginan adiabatik Definisi proses adiabatik adalah bahwa perpindahan panas ke sistem adalah nol, Kemudian, menurut hukum pertama termodinamika , . dimana dU adalah perubahan energi internal sistem dan δW adalah kerja yang dilakukan oleh sistem. Setiap pekerjaan (δW) dilakukan harus dilakukan dengan mengorbankan U energi internal, karena tidak ada δQ panas sedang dipasok dari sekitarnya. Tekanan-volume pekerjaan δW dilakukan oleh sistem didefinisikan sebagai Namun, P tidak tetap konstan selama proses adiabatik melainkan berubah bersama dengan V. Hal ini diinginkan untuk mengetahui bagaimana nilai-nilai dan dP dV berhubungan satu sama lain sebagai hasil proses adiabatik. Untuk gas ideal energi internal diberikan oleh dimana adalah jumlah derajat kebebasan dibagi dua, R adalah konstanta gas universal dan n adalah jumlah mol dalam sistem (konstan). Persamaan Membedakan (3) dan penggunaan hukum gas ideal , , Hasil Persamaan (4) sering dinyatakan sebagai . karena Sekarang persamaan pengganti (2) dan (4) ke dalam persamaan (1) untuk mendapatkan riskailham11.wordpress.com Page 26 menyederhanakan: dan membagi kedua sisi dengan PV: Setelah mengintegrasikan sisi kiri dan kanan dari masing-masing, V ke dan dari untuk p dan mengubah sisi Exponentiate kedua belah pihak, dan menghilangkan tanda negatif untuk memperoleh Oleh karena itu, dan Penurunan rumus diskrit Perubahan energi internal dari suatu sistem, diukur dari negara ke negara 1 2, sama dengan riskailham11.wordpress.com Page 27 Pada saat yang sama, kerja yang dilakukan oleh tekanan-perubahan volume sebagai akibat dari proses ini, sama dengan Karena kita memerlukan proses untuk menjadi adiabatik, persamaan berikut harus benar Dengan derivasi sebelumnya, Mengatur ulang (4) memberikan Mensubstitusikan ini ke (2) memberikan Mengintegrasikan, Mengganti , Mengatur ulang, riskailham11.wordpress.com Page 28 Menggunakan hukum gas ideal dan dengan asumsi jumlah molar konstan (seperti yang sering terjadi dalam kasus-kasus praktis), Dengan rumus terus menerus, Atau, Mensubstitusikan ke dalam ekspresi sebelumnya untuk , Mengganti ungkapan ini dan (1) dalam (3) memberikan Menyederhanakan, Menyederhanakan, Menyederhanakan, riskailham11.wordpress.com Page 29 Dalam proses adiabatik tidak ada kalor yang masuk (diserap) ataupun keluar (dilepaskan) oleh sistem (Q = 0). Dengan demikian, usaha yang dilakukan gas sama dengan perubahan energi dalamnya (W = ∆U). Jika suatu sistem berisi gas yang mula-mula mempunyai tekanan dan volume masingmasing p1 dan V1 mengalami proses adiabatik sehingga tekanan dan volume gas berubah menjadi p2 dan V2, usaha yang dilakukan gas dapat dinyatakan sebagai Dimana γ adalah konstanta yang diperoleh perbandingan kapasitas kalor molar gas pada tekanan dan volume konstan dan mempunyai nilai yang lebih besar dari 1 (γ > 1). Proses isentropik Dalam termodinamika , proses proses atau isoentropic isentropik (ισον = "sama" (Yunani), εντροπία entropi = "gangguan" (Yunani)) adalah satu di mana untuk tujuan analisis teknik dan perhitungan, seseorang dapat berasumsi bahwa proses berlangsung dari inisiasi sampai selesai tanpa peningkatan atau penurunan entropi sistem, yaitu, entropi sistem tetap konstan. Hal ini dapat dibuktikan bahwa setiap reversibel proses adiabatik adalah proses isentropik. Penurunan hubungan isentropik Untuk sistem tertutup, perubahan total energi dari sebuah sistem adalah jumlah dari pekerjaan yang dilakukan dan panas yang ditambahkan, Pekerjaan reversibel dilakukan pada sistem dengan mengubah volume, dimana adalah tekanan dan oleh, riskailham11.wordpress.com adalah Volume . Perubahan entalpi ( ) Diberikan Page 30 Kemudian untuk proses yang bersifat reversibel dan adiabatik (yaitu tidak ada perpindahan panas terjadi), , Dan sebagainya . Semua proses adiabatik reversibel yang isentropik. Hal ini menyebabkan dua pengamatan penting, , Dan Selanjutnya, banyak dapat dihitung untuk proses isentropik dari gas ideal. Untuk setiap transformasi gas ideal, itu selalu benar bahwa , Dan . Menggunakan hasil umum yang berasal di atas untuk dan , Kemudian , Dan . Jadi untuk gas ideal, rasio kapasitas panas dapat ditulis sebagai, Untuk gas ideal adalah konstan. Oleh karena itu pada mengintegrasikan persamaan di atas, dengan asumsi gas yang sempurna, kita mendapatkan yaitu Menggunakan persamaan keadaan untuk gas ideal, juga, untuk konstan riskailham11.wordpress.com , (Per mol), Page 31 dan Jadi untuk proses isentropik dengan gas ideal, Tabel hubungan isentropik untuk gas ideal Berasal dari: Dimana: = Tekanan riskailham11.wordpress.com Page 32 = Volume = Rasio spesifik memanaskan = = Suhu = Massa = Gas konstan untuk gas tertentu = = Konstanta gas Universal = Berat molekul gas tertentu = Density = Panas spesifik pada tekanan konstan = Panas spesifik pada volume konstan Proses Isenthalpic Sebuah proses isenthalpic proses atau isoenthalpic adalah proses yang berlangsung tanpa perubahan entalpi , H, atau entalpi spesifik , h. Dalam proses tunak, steady-aliran, perubahan yang signifikan pada tekanan dan suhu dapat terjadi pada cairan dan belum proses akan isenthalpic jika tidak ada transfer panas ke atau dari lingkungan, tidak ada kerja yang dilakukan pada atau oleh lingkungan , dan tidak ada perubahan energi kinetik dari cairan. (Jika proses tunak, steady-aliran dianalisis dengan menggunakan kontrol volume segala sesuatu di luar kendali volume dianggap lingkungan. ) The Proses throttling adalah contoh yang baik dari proses isenthalpic. Pertimbangkan pencabutan katup lega atau katup pengaman pada bejana tekan. Entalpi spesifik dari cairan di dalam bejana tekan adalah sama dengan entalpi spesifik rumit karena lolos dari katup. [2] Dengan pengetahuan tentang entalpi spesifik dari cairan, dan tekanan luar bejana tekan, itu adalah mungkin untuk menentukan suhu dan kecepatan dari fluida melarikan diri. Dalam proses isenthalpic: Proses Isenthalpic pada gas ideal mengikuti isoterm sejak . Proses Quasistatic Dalam termodinamika , proses quasistatic adalah proses termodinamika yang terjadi jauh perlahan-lahan. Namun, sangat penting untuk dicatat bahwa tidak ada proses yang sebenarnya adalah quasistatic. Oleh karena itu dalam prakteknya, proses tersebut hanya dapat didekati dengan melakukan mereka amat sangat lambat. riskailham11.wordpress.com Page 33 quasistatic dan reversibilitas Sebuah proses quasistatic memastikan bahwa sistem akan pergi melalui urutan negara yang amat dekat dengan keseimbangan (sehingga sistem tetap dalam keseimbangan quasistatic ), dalam hal proses ini biasanya reversibel . Setiap proses reversibel adalah selalu satu quasistatic. Namun, beberapa proses quasistatic yang ireversibel, jika ada panas yang mengalir (dalam atau keluar dari sistem) atau jika entropi sedang dibuat dalam beberapa cara lain. Contoh dari proses quasistatic yang tidak reversibel adalah kompresi terhadap sistem dengan piston tunduk gesekan - Meskipun sistem selalu dalam kesetimbangan termal, gesekan memastikan generasi entropi disipatif, yang secara langsung bertentangan dengan definisi reversibel. Sebuah contoh penting dari sebuah proses yang bahkan tidak quasistatic adalah lambat pertukaran panas antara dua mayat di dua temperatur finitely berbeda, di mana nilai tukar panas dikendalikan oleh kurang adiabatik partisi antara dua badan (Sears dan Salinger, 1986) - di kasus ini, tidak peduli seberapa lambat proses berlangsung, negara-negara dari dua mayat yang pernah amat dekat dengan keseimbangan, karena kesetimbangan termal mensyaratkan bahwa dua mayat berada tepat pada suhu yang sama. Beberapa ambiguitas ada dalam literatur mengenai perbedaan antara proses quasistatic dan reversibel, karena ini kadang-kadang diambil sebagai sinonim ( Bernard H Lavenda , 1978). Alasannya justru karena teorema terbukti bahwa setiap proses reversibel juga merupakan salah satu quasistatic, meskipun kami juga telah menunjukkan bahwa Kebalikannya tidak benar. Hal ini praktis tidak berguna untuk membedakan antara kedua karena insinyur pun akan ingat untuk memasukkan gesekan ketika menghitung generasi entropi disipatif. Definisi di atas lebih dekat dengan pemahaman intuitif dari kata "quasi-" (hampir) "statis", namun tetap secara teknis berbeda dari proses reversibel . PV-Work di berbagai kuasi-statis proses 1. Konstan tekanan: proses isobaric , 2. Konstan volume: proses isochoric , 3. Suhu konstan: proses isotermal , riskailham11.wordpress.com Page 34 Hubungan dengan proses yang ideal Untuk nilai-nilai tertentu dari indeks polytropic, proses akan identik dengan proses umum lainnya. Beberapa contoh dampak dari berbagai nilai indeks diberikan dalam tabel. Variasi indeks polytropic Polytropic indeks Hubungan Efek - Meskipun tidak berlaku untuk sistem sehari-hari, eksponen negatif dapat berarti dalam beberapa kasus khusus yang tidak didominasi oleh interaksi termal, seperti dalam proses plasma tertentu dalam astrofisika. [1] (Konstan) (Konstan) - Setara dengan proses isobarik (konstan tekanan ) Setara dengan proses isotermal (konstan suhu ) Sebuah proses kuasi-adiabatik seperti dalam mesin pembakaran internal selama ekspansi, atau dalam refrigerasi kompresi uap selama kompresi - adalah indeks adiabatik , menghasilkan suatu proses adiabatik (tidak ada panas yang ditransfer) - Setara dengan proses isochoric (konstan Volume ) Ketika indeks n adalah antara dua nilai mantan (0, 1, gamma, atau tak terhingga), itu berarti bahwa kurva polytropic [ klarifikasi diperlukan ] akan dibatasi oleh kurva dari dua indeks yang sesuai. Perhatikan bahwa , Karena . Sebuah solusi untuk persamaan Lane-Emden menggunakan cairan polytropic dikenal sebagai polytrope . 2.3 Menentukan Usaha Luar Secara Grafik riskailham11.wordpress.com Page 35 Usaha luar yang dilakukan oleh gas pada tekanan tidak tetap dapat dinyatakan dalam diagram p – V, yang besarnya sebanding dengan luas daerah di bwah kurva. Proses kearah kanan V2 > V1, berarti W positif W = p ( V2 – V1 ) Proses kearah kiri V2 < V1, berarti W negative W = -p ( V2 – V1 ) Proses berbentuk siklus Proses 1 ke 2 > W 0 Proses 2 ke 3 > W positif Proses 3 ke 4 > W 0 Proses 4 ke 1 > W negative Wtotal = = ( p2 – p1 ) . ( V2 – V1 ) 2.4 Hukum Ke Nol termodinamika The zeroth hukum termodinamika adalah prinsip generalisasi dari kesetimbangan termal antara badan-badan, atau sistem termodinamika , kontak. Hukum zeroth menyatakan bahwa jika dua sistem berada dalam kesetimbangan termal dengan sistem ketiga, mereka juga dalam kesetimbangan termal dengan satu sama lain. Sistem dikatakan berada dalam kesetimbangan termal jika mereka mampu mentransfer panas antara satu sama lain (misalnya dengan konduksi atau radiasi) tetapi tidak melakukannya. Sistem juga dapat dikatakan berada dalam kesetimbangan termal jika mereka tidak dapat mentransfer panas ke satu sama lain, tetapi tidak akan melakukannya jika mampu. Hukum menyiratkan bahwa keseimbangan termal antara sistem adalah hubungan transitif , yang memberikan definisi parameter fisik yang empiris, yang disebut temperatur . Suhu adalah sama untuk semua sistem dalam kesetimbangan termal. Hukum memungkinkan pembangunan termometer untuk mengukur properti ini. Hukum zeroth sebagai hubungan kesetaraan Suatu sistem dikatakan berada dalam kesetimbangan termal ketika tidak mengalami perubahan bersih energi panas. Jika A, B, dan C yang berbeda sistem termodinamika , hukum zeroth dari termodinamika dapat dinyatakan sebagai: Jika A dan C masing-masing dalam kesetimbangan termal dengan B, A juga dalam kesetimbangan dengan C. riskailham11.wordpress.com Page 36 Pernyataan ini menegaskan bahwa kesetimbangan termal adalah hubungan Euclidean antara sistem termodinamika. Jika kita juga mengakui bahwa semua sistem termodinamika berada dalam kesetimbangan termal dengan diri mereka sendiri, maka kesetimbangan termal juga merupakan hubungan refleksif . Hubungan yang baik refleksif dan Euclidean adalah hubungan kesetaraan . Salah satu konsekuensi dari penalaran ini adalah bahwa kesetimbangan termal adalah hubungan transitif : Jika A berada dalam kesetimbangan termal dengan B dan B berada dalam kesetimbangan termal dengan C, maka A berada dalam kesetimbangan termal dengan C. Konsekuensi lain adalah bahwa hubungan kesetimbangan simetris : Jika A berada dalam kesetimbangan termal dengan B, maka B berada dalam kesetimbangan termal dengan A. Dengan demikian kita dapat mengatakan bahwa dua sistem berada dalam kesetimbangan termal dengan satu sama lain, atau bahwa mereka berada dalam kesetimbangan bersama. Secara implisit dengan asumsi kedua refleksivitas dan simetri, hukum zeroth Oleh karena itu sering dinyatakan sebagai : Jika dua sistem berada dalam kesetimbangan termal dengan sistem ketiga, maka mereka berada dalam kesetimbangan termal dengan satu sama lain. Sekali lagi, secara implisit dengan asumsi kedua refleksivitas dan simetri, hukum zeroth kadangkadang dinyatakan sebagai hubungan transitif: [4] Jika A berada dalam kesetimbangan termal dengan B dan jika B berada dalam kesetimbangan termal dengan C, maka A berada dalam kesetimbangan termal dengan C. Thermal keseimbangan antara banyak sistem Banyak sistem dikatakan dalam kesetimbangan jika, kecil pertukaran acak (karena gerak Brown atau emisi foton , misalnya) di antara mereka tidak menyebabkan perubahan bersih pada total energi dijumlahkan seluruh sistem. Contoh sederhana ini menggambarkan mengapa hukum zeroth diperlukan untuk melengkapi deskripsi ekuilibrium. Pertimbangkan sistem N di adiabatik terisolasi dari seluruh alam semesta, yaitu tidak ada pertukaran panas di luar kemungkinan dari sistem N, yang semuanya memiliki volume konstan dan komposisi, dan yang hanya dapat bertukar panas dengan satu sama lain. Hukum Pertama dan Kedua gabungan berhubungan fluktuasi energi total, ke-i, dan entropi fluktuasi dalam sistem th i, , Dengan suhu sistem sebagai berikut: . The adiabatic isolasi sistem dari alam semesta yang tersisa mensyaratkan bahwa jumlah total dari fluktuasi entropi hilang, atau: riskailham11.wordpress.com Page 37 Artinya, entropi hanya dapat dipertukarkan antara sistem N. Kendala ini dapat digunakan untuk mengatur ulang ekspresi untuk fluktuasi energi total dan mendapatkan: dimana adalah suhu setiap j sistem kita dapat memilih untuk keluar tunggal antara sistem N. Akhirnya, ekuilibrium memerlukan fluktuasi total energi menghilang, dalam hal: yang dapat dianggap sebagai lenyapnya produk dari suatu matriks antisimetrik fluktuasi entropi dan vektor . Agar solusi non-sepele untuk eksis, Artinya, determinan dari matriks yang dibentuk oleh harus menghilang untuk semua pilihan N. Namun, menurut teorema Jacobi , determinan dari N x N antisimetrik matriks selalu nol jika N aneh, meskipun untuk N bahkan kami menemukan bahwa semua entri harus lenyap, , Dalam rangka untuk mendapatkan penentu menghilang. Karenanya pada kesetimbangan. Ini hasil non-intuitif berarti bahwa ganjil sistem selalu dalam ekuilibrium terlepas dari suhu dan fluktuasi entropi, sementara kesetaraan suhu hanya diperlukan antara jumlah bahkan sistem untuk mencapai keseimbangan dengan adanya fluktuasi entropi. Hukum zeroth memecahkan paradoks ini aneh vs bahkan, karena dapat dengan mudah digunakan untuk mengurangi sistem ganjil ke nomor bahkan dengan mempertimbangkan tiga dari sistem N dan menghilangkan satu per penerapan prinsip, dan karenanya mengurangi masalah bahkan untuk N yang kemudian mengarah ke kondisi ekuilibrium yang sama yang kita harapkan dalam setiap kasus, yaitu, . Hasil yang sama berlaku untuk fluktuasi dalam jumlah yang ekstensif, seperti volume (menghasilkan kondisi tekanan yang sama), atau fluktuasi massa (yang mengarah ke kesetaraan kimia potensi). Oleh karena itu hukum zeroth memiliki implikasi bagi banyak lebih dari suhu saja. Secara umum, kita melihat bahwa hukum zeroth istirahat jenis tertentu asimetri hadir dalam Hukum Pertama dan Kedua. Hukum zeroth menetapkan keseimbangan termal sebagai hubungan kesetaraan. Sebuah hubungan kesetaraan pada set (seperti set sistem termal disetimbangkan) membagi set yang menjadi riskailham11.wordpress.com Page 38 koleksi himpunan bagian yang berbeda ("disjoint subset") di mana setiap anggota himpunan adalah anggota dari satu dan hanya satu bagian tersebut. Dalam kasus hukum ke nol, ini terdiri dari subset sistem yang berada dalam kesetimbangan bersama. Partisi ini memungkinkan setiap anggota subset untuk menjadi unik "ditandai" dengan label mengidentifikasi subset mana ia berasal. Meskipun label mungkin cukup sewenang-wenang, [5] suhu adalah seperti proses pelabelan yang menggunakan sistem bilangan real untuk penandaan. Hukum zeroth membenarkan penggunaan sistem termodinamika cocok sebagai termometer untuk memberikan seperti pelabelan, yang menghasilkan sejumlah kemungkinan skala temperatur empiris , dan membenarkan penggunaan hukum kedua termodinamika untuk memberikan mutlak, atau suhu termodinamika skala. Skala temperatur tersebut membawa kelangsungan tambahan dan memesan (misalnya, "panas" dan "dingin") properti dengan konsep temperatur. Dalam ruang parameter termodinamika, zona suhu konstan membentuk permukaan, yang menyediakan tatanan alam dari permukaan di dekatnya. Satu Oleh karena itu dapat membangun fungsi suhu global yang menyediakan pemesanan terus menerus negara. The dimensi dari permukaan suhu konstan adalah salah satu kurang dari jumlah parameter termodinamika, dengan demikian, untuk gas ideal digambarkan dengan tiga parameter termodinamika P, V dan n, itu adalah dua- dimensi permukaan. Misalnya, jika dua sistem gas yang ideal berada dalam kesetimbangan, maka P 1 V 1 / N 1 = P 2 V 2 / N 2 di mana P i adalah tekanan dalam sistem ke-i, V i adalah volume, dan N i adalah jumlah (dalam mol , atau hanya jumlah atom) gas. Permukaan PV / N = const mendefinisikan permukaan suhu termodinamika yang sama, dan satu dapat label T mendefinisikan sehingga PV / N = RT, di mana R adalah beberapa konstan. Sistem ini sekarang dapat digunakan sebagai termometer untuk mengkalibrasi sistem lain. Sistem tersebut dikenal sebagai "termometer gas ideal". 2.5 Hukum I Termodinamika a. Pernyataan Hukum I Termodinamika Hukum pertama termodinamika berhubungan dengan cara suatu sistem memperoleh energi dalam dari lingkungan atau kehilangan energi dalam ke lingkungan. Jika suatu sistem memperoleh energi Q dalam bentuk kalor dan pada saat yang sama kehilangan energi W dalam bentuk usaha, perubahan energi dalam karena kedua faktor ini dinyatakan oleh persamaan: ΔU = U2 – U1 = Q – W. Jadi, hukum pertama termodinamika adalah prinsip kekekalan energi yang diaplikasikan pada kalor, usaha, dan energi dalam. Hukum pertama termodinamika: Energi dalam suatu system berubah dari nilai awal U1 ke nilai akhir U2 sehubungan dengan kalor Q dan usaha W: ΔU = U2 – U1 = Q – W riskailham11.wordpress.com Page 39 (perubahan energi dalam (ΔU) sistem = kalor (Q) yang ditambahkan ke sistem dikurangi dengan kerja yang dilakukan oleh sistem) Q adalah usaha positif jika sistem memperoleh kalor dan negatif jika kehilangan kalor. Usaha W positif jika usaha dilakukan oleh sistem dan negatif jika usaha dilakukan pada sistem. Beberapa sumber lain menuliskan hukum pertama termodinamika sebagai berikut: ΔQ = ΔU + ΔW ΔQ = kalor yang masuk / keluar sistem ΔU = perubahan energi dalam ΔW = usaha luar. b. Hukum I pada Berbagai Proses Termodinamika Gas Proses Isotermal Pada proses isothermal, suhu awal gas T1 sama dengan suhu akhir gas T2 (atau T2 = T1). Dengan demikian, ΔU = 3/2 nRT = 0. Hukum pertama termodinamika memberikan: ΔU = Q – W; 0 = Q – W atau Q = W Pada proses isothermal: ΔU = 0 dan Q = W Proses Isokhorik Pada proses isokhorik, volum gas tetap (V1 = V2 atau ΔV = 0), sehingga usaha W = 0. Hukum pertama termodinamika memberikan: ΔU = Q – W; ΔU = Q – 0 atau ΔU = Q Pada proses isokhorik: W = 0 dan ΔU = Q Proses Adiabatik Pada proses adiabatik, Q = 0, sehingga hukum pertama memberikan: ΔU = Q – W; ΔU = 0 – W atau ΔU = -W Pada proses adiabatik: Q = 0 dan ΔU = -W Karena Q = 0 maka O = U + W U2 -U1 = - W Bila W negatif ( -W = sistem ditekan ) usaha dalam sistem ( U ) bertambah. Sedangkan hubungan antara suhu mutlak dan volume gas pada proses adibatik, dapat dinyatakan dengan persamaan : T.V-1 = konstan atau T .V1-1 = T .V -1 1 2 2 Usaha yang dilakukan pada proses adiabatik adalah : W = m . cv ( T1 - T2 ) atau W= P1 .V1 1 ( V2-1 - V1-1 ) Juga berlaku persamaan : P1.V1 = P2.V2 riskailham11.wordpress.com Page 40 Proses Isobarik Pada proses isobarik: Q = ΔU + p.ΔV Kapasitas Kalor Gas a. Pengertian Kapasitas Kalor Ada tiga besaran yang umum digunakan untuk menghitung kalor yang diterima atau dilepaskan oleh suatu gas: kalor jenis, kapasitas kalor dan kapasitas kalor molar. Ketiga besaran ini saling berhubungan, sehingga jika rumus salah satu rumus besaran diketahui, maka rumus kedua besaran lainnya dapat diperoleh. Kapasitas kalor suatu zat (C) adalah banyaknya kalor (Q) yang diperlukan untuk menaikkan suhu suatu zat sebesar 1 kelvin. C = Q/ΔT atau Q = C.ΔT Satuan SI untuk kapasitas kalor adalah J/K atau J.K-1. Kapasitas kalor gas pada tekanan tetap, Cp, didefinisikan sebagai kalor yang diperlukan untuk menaikkan suhu suatu zat 1 kelvin pada tekanan tetap. Kapasitas kalor pada tekanan tetap: Cp = Qp/ΔT atau Qp = Cp.ΔT Kapasitas kalor gas pada volum tetap, CV, didefinisikan sebagai kalor yang diperlukan untuk menaikkan suhu suatu zat 1 kelvin pada volum tetap. Kapasitas kalor pada volum tetap: CV = QV/ΔT atau QV = CV.ΔT Hubungan Cp dan Cv adalah sebagai berikut: Cp – Cv = nR Dengan n adalah banyak zat dalam mol dan R adalah tetapan umum gas. b. Nilai Kapasitas Kalor dan Tetapan Laplace Untuk gas monoatomik : Cv = 3/2 nR Cp = 5/2 nR Untuk gas diatomik : Cv = 5/2 nR Cp = 7/2 nR Tetapan Laplace (notasi γ) didefinisikan sebagai nilai perbandingan antara kapasitas kalor pada tekanan tetap dengan kapasitas kalor pada volum tetap: γ = Cp/Cv Perhatikan, Cp > Cv maka pastilah γ > 1. Untuk gas monoatomik: Cp = 5/2 nR dan Cv = 3/2 nR, sehingga: γ = 5/2 nR : 3/2 nR = 5/3 = 1,67 Untuk gas diatomik: Cp = 7/2 nR dan Cv = 5/2 nR, sehingga: γ = 7/2 nR : 5/2 nR = 7/5 = 1,4 c. Kapasitas Kalor Molar riskailham11.wordpress.com Page 41 Selain besaran kapasitas kalor yang digunakan di fisika, dalam kimia lebih sering digunakan besaran kapasitas kalor molar. Kapasitas kalor molar (notasi Cm) adalah kapasitas kalor per mol. Kapasitas kalor molar: Cm = C/n atau C = n.Cm Dengan demikian dapat kita tulis: Kalor pada tekanan tetap Qp = Cp . ΔT ; Qp = n . Cp,m . ΔT Kalor pada volum tetap Qv = Cv . ΔT ; Qv = n . Cv,m . ΔT 2.6 Hukum II Termodinamika Hukum kedua termodinamika mengatakan bahwa aliran kalor memiliki arah. Dengan kata lain, tidak semua proses di alam adalah reversible (arahnya dapat dibalik). Jika kita berbaring di atas tumpukan salju, kalor dari tubuh kita akan dapat mencairkan salju, tetapi kita tidak dapat mengambil energi dari salju untuk menghangatkan tubuh kita. Dengan demikian, aliran energi kalor memiliki arah, yaitu dari panas ke dingin. Satu aplikasi penting dari hukum kedua termodinamika adalah studi tentang mesin kalor (carnot), seperti misalnya mesin bensin pada mobil dan prinsip-prinsip yang membatasi efisiensinya. a. Mesin Carnot Mesin Carnot merupakan mesin panas yang didefinisikan sebagai mesin yang dapat mengubah energi panas menjadi energi mekanik. Selain mesin Carnot, terdapat mesin-mesin lain yang digolongkan ke dalam mesin panas, antara lain mesin uap, mesin diesel, dan mesin jet. Jika suatu gas yang mengalami siklus Carnot menerima kalor Q1 dari reservoir bersuhu tinggi, dan melepas kalor Q2 ke reservoir yang bersuhu rendah, usaha yang dilakukan oleh gas sesuai dengan hukum Termodinamika I sebagai berikut: Q = ΔU + W, untuk proses siklus ΔU = 0. Dengan demikian, Q = 0 + W atau W = Q1 – Q2 atau W = Q1 (1 - T2/T1 ) Siklus Carnot Siklus Carnot dibatasi oleh garis lengkung isotherm dan dua garis lengkung adiabatik. Hal ini memungkinkan seluruh panas yang diserap ( input panas ) diberikan pada satu suhu panas yang tinggi dan seluruh panas yang dibuang ( panas output ) dikeluarkan pada satu suhu rendah. p P1 AB=pemuaian/pengembang A an/ekspansi isotermis Q1 riskailham11.wordpress.com BC = pemuaian / ekspansi adiabatik CD = penampatan/kompresi isotermis Page 42 P2 P4 P3 B D Q2 C V1 V4 V2 V3 V Siklus Carnot bekerja dengan mengubah kalor panas (heat) dan membuangnya dalam bentuk kalor dingin (cold) Mesin Pemanas Mesin yang menggunakan siklus ini misalnya seperti mesin pemanas ruang dalam rumah seperti di negara-negara sub tropis pada musim dingin. Gambar: Skema siklus Carnot Disini kalor panas (QH) sebagai Q1, dan kalor dingin (QC) sebagai Q2. W = Q1 – Q2 Daya guna /efisiensi mesin kalor W x 100% Q1 Q1 Q2 x 100% Q1 =1 Q2 x 100% Q1 =1 T2 x 100% T1 atau Untuk mesin Carnot ideal efisiensinya selalu maksimum. Mesin Pendingin riskailham11.wordpress.com Page 43 Mesin pendingin seperti air conditioner (AC) maupun kulkas/refrigerator menggunakan proses yang berbeda dengan proses mesin pemanas yang menggunakan siklus Carnot. Mesin pendingin menyerap kalor dingin sebagai sumber dan membuangnya dalam bentuk kalor panas. Gambar mesin kulkas Gambar mesin AC Gambar: Skema mesin pendingin Di sini kalor panas (QH) sebagai Q1, dan kalor dingin (QC) sebagai Q2. Berlaku pula W = Q1 – Q2 Efisiensi mesin pendingin sebagai berikut. Daya guna /efisiensi mesin pendingin: W x 100% Q2 Q1 Q2 x 100% Q2 = Q1 Q2 1 x 100% riskailham11.wordpress.com atau Page 44 = T1 T2 1 x 100% Koefisien Performance mesin pendingin / koefisien daya guna sebagai berikut. 1 K= Q2 W Q2 K= Q1 Q2 K= Hukum kedua termodinamika dapat dinyatakan dengan dua formulasi sebagai berikut: 1. Formulasi Kelvin-Planck Tidak mungkin untuk membuat sebuah mesin kalor yang bekerja dalam suatu siklus yang semata-mata mengubah energy panas yang diperoleh dari suatu sumber pada suhu tertentu seluruhnya menjadi usaha mekanik. T ( 1 2 ) 100% T1 2. Formulasi Clausius Tidak mungkin membuat mesin yang bekerja dalam satu siklus, mengambil kalor dari suatu reservoir rendah dan memberikannya ke reservoir suhu tinggi tanpa dilakukan usaha dari luar. 2.7 Hukum Ketiga termodinamika Hukum ketiga termodinamika terkadang dinyatakan sebagai berikut: The entropi dari sempurna kristal di nol mutlak adalah persis sama dengan nol. Pada nol kelvin sistem harus dalam keadaan dengan kemungkinan minimal energi , dan pernyataan dari hukum ketiga berlaku jika kristal yang sempurna hanya memiliki satu keadaan energi minimum . Entropi berkaitan dengan jumlah microstates mungkin, dan dengan hanya satu microstate tersedia di nol kelvin, entropi adalah persis nol. riskailham11.wordpress.com Page 45 Sebuah bentuk yang lebih umum dari hukum ketiga berlaku untuk sistem seperti kacamata yang mungkin memiliki lebih dari satu keadaan energi minimum: Entropi dari suatu sistem mendekati nilai konstan karena suhu mendekati nol. Nilai konstan (tidak selalu nol) disebut entropi sisa dari sistem. Secara fisik, hukum menyiratkan bahwa tidak mungkin untuk prosedur apapun untuk membawa sistem ke nol mutlak suhu dalam jumlah terbatas langkah. Pernyataan Hukum Ketiga Termodinamika : • • • Suatu kristal sempurna pada temperatur nol mutlak mempunyai keteraturan sempurna → entropinya adalah nol. Entropi suatu zat yang dibandingkan dengan entropinya dalam suatu bentuk kristal sempurna pada nol mutlak, disebut Entropi Mutlak Makin tinggi temperatur zat, makin besar entropi mutlaknya Penjelasan Dalam istilah sederhana, menyatakan hukum ketiga bahwa entropi dari kristal sempurna mendekati nol sebagai suhu mendekati nol mutlak. Undang-undang ini memberikan titik acuan mutlak untuk penentuan entropi. Entropi ditentukan relatif terhadap titik ini adalah entropi mutlak. Secara matematis, entropi mutlak sistem apapun pada suhu nol adalah log alami dari jumlah B konstanta k tanah negara kali Boltzmann. Entropi dari suatu kisi kristal yang sempurna seperti yang didefinisikan oleh teorema Nernst ini adalah nol asalkan keadaan dasar adalah unik, karena ln (1) = 0. Sebuah contoh dari sistem yang tidak memiliki keadaan dasar yang unik adalah salah satu yang mengandung setengah-bulat berputar , yang waktu pembalikan simetri memberikan dua merosot keadaan dasar. Untuk sistem tersebut, entropi pada suhu nol setidaknya ln (2) k B (yang diabaikan pada skala makroskopis). Beberapa sistem kristal menunjukkan frustrasi geometris , di mana struktur kisi kristal mencegah munculnya keadaan dasar yang unik. Ground-state helium (kecuali di bawah tekanan) tetap cair. Selain itu, gelas dan solusi yang solid mempertahankan entropi besar di 0K, karena mereka adalah koleksi besar negara hampir merosot, di mana mereka menjadi terperangkap keluar dari keseimbangan. Contoh lain yang solid dengan banyak hampir-degenerate keadaan dasar, terperangkap keluar dari keseimbangan, adalah es Ih , yang memiliki "gangguan proton" . Untuk entropi nol mutlak untuk menjadi nol, momen magnetik dari kristal sempurna memerintahkan harus diri mereka sempurna memerintahkan, memang, dari perspektif entropis, ini riskailham11.wordpress.com Page 46 dapat dianggap sebagai bagian dari definisi "kristal sempurna". Hanya feromagnetik , antiferromagnetik , dan diamagnetik bahan dapat memenuhi kondisi ini. Bahan yang tetap paramagnetik pada 0K, sebaliknya, mungkin memiliki keadaan dasar banyak hampir-merosot (misalnya, dalam kaca spin ), atau dapat mempertahankan gangguan dinamis (a cairan berputar ). formulasi Matematika Pertimbangkan sebuah sistem tertutup dalam keseimbangan internal. Karena sistem berada dalam kesetimbangan tidak ada proses ireversibel sehingga produksi entropi adalah nol. Selama gradien suhu panas pasokan yang dihasilkan dalam materi, namun produksi entropi terkait dapat disimpan cukup rendah jika panas diberikan perlahan-lahan. Kenaikan entropi karena δ panas tambah Q kemudian diberikan oleh (1) Kenaikan suhu δ T karena δ panas Q ditentukan oleh kapasitas panas C (T, X) sesuai dengan (2) The X Parameter adalah notasi simbolis untuk semua parameter (seperti tekanan, medan magnet, cair / padat fraksi, dll) yang dijaga konstan selama pasokan panas. Misalnya jika volume konstan kita mendapatkan kapasitas panas pada volume konstan C V. Dalam kasus fase transisi dari cair ke padat, atau dari gas ke cair X parameter dapat menjadi sebagian kecil dari salah satu dari dua komponen. Menggabungkan hubungan (1) dan (2) memberikan (3) Integrasi persamaan. (3) dari suhu acuan T 0 ke suhu T sewenang-wenang memberikan entropi pada suhu T (4) Kita sekarang sampai pada formulasi matematis dari hukum ketiga. Ada tiga langkah: 1:. Dalam batas T 0 0 → integral di Persamaan (4) adalah terbatas. Sehingga kita dapat mengambil T 0 = 0 dan menulis riskailham11.wordpress.com Page 47 (5) 2. nilai S (0, X) adalah independen dari X. Dalam bentuk matematika (6) Jadi persamaan. (5) dapat lebih disederhanakan (7) Persamaan (6) juga dapat dirumuskan sebagai (8) Dengan kata: pada nol mutlak semua proses isotermal yang isentropik. Persamaan. (8) adalah formulasi matematis dari hukum ketiga. 3: sebagai salah satu bebas untuk memilih nol entropi akan lebih mudah untuk mengambil (9) sehingga persamaan. (7) tereduksi menjadi bentuk akhir (10) Makna fisik Persamaan. (9) adalah lebih dari sekedar pilihan yang nyaman dari nol entropi. Hal ini karena urutan yang sempurna nol kelvin seperti yang dijelaskan sebelumnya. Konsekuensi dari hukum ketiga riskailham11.wordpress.com Page 48 Gambar 1 Sisi Kiri: Absolute nol dapat dicapai dalam jumlah terbatas langkah-langkah jika S (0, X 1) ≠ S (0, X 2). Kanan: Sebuah jumlah tak terbatas langkah ini diperlukan karena S (0, X 1) = S (0, X 2). Hukum ketiga adalah setara dengan pernyataan bahwa "Tidak mungkin dengan prosedur apapun, tidak peduli seberapa ideal, untuk mengurangi suhu sistem apapun ke nol suhu dalam jumlah terbatas operasi terbatas". Alasan bahwa T = 0 tidak dapat dicapai sesuai dengan hukum ketiga dijelaskan sebagai berikut: Misalkan suhu suatu zat dapat dikurangi dalam proses isentropik dengan mengubah parameter X dari X 2 X 1. Salah satu bisa memikirkan multistage demagnitization nuklir setup dimana medan magnet dihidupkan dan dimatikan dengan cara yang terkontrol. [8] Jika akan ada perbedaan entropi pada nol mutlak T = 0 dapat dicapai dalam jumlah terbatas langkah. Namun, pada T = 0 tidak ada perbedaan entropi sehingga jumlah tak terbatas langkah akan diperlukan. Proses ini diilustrasikan dalam Gambar 1. panas spesifik Misalkan bahwa kapasitas panas dari sampel di wilayah LT dapat didekati dengan C (T, X) = C 0 T α, maka (11) Integral terbatas untuk T pada nol mutlak 0 → 0 jika α> 0. Jadi kapasitas panas dari semua zat harus pergi ke nol riskailham11.wordpress.com Page 49 (12) Panas spesifik molar pada volume konstan dari gas ideal monoatomik klasik, seperti helium pada suhu kamar, diberikan oleh C V = (3/2) R dengan R molar gas ideal konstan. Pergantian dalam Pers. (4) memberikan (13) Dalam batas T 0 0 → ini menyimpang ekspresi. Jelas kapasitas panas konstan tidak memenuhi persamaan. (12). Ini berarti bahwa gas dengan kapasitas panas yang konstan sepanjang jalan ke nol mutlak melanggar hukum ketiga termodinamika. Konflik diselesaikan sebagai berikut: Pada suhu tertentu sifat quantum dari materi mulai mendominasi perilaku. Partikel Fermi mengikuti Fermi-Dirac statistik Bose dan partikel mengikuti statistik Bose-Einstein . Dalam kedua kasus kapasitas panas pada suhu rendah tidak lagi suhu independen, bahkan untuk gas ideal. Untuk gas Fermi (14) dengan temperatur Fermi T F diberikan oleh (15) Berikut N adalah bilangan Avogadro, V m volume molar, dan M massa molar. Untuk gas Bose (16) dengan T B diberikan oleh (17) riskailham11.wordpress.com Page 50 Spesifik memanaskan diberikan oleh Persamaan (14) dan. (16) keduanya memenuhi persamaan. (12). Tekanan uap Cairan hanya dekat nol mutlak adalah ³ Dia dan ⁴ Dia. Panas mereka penguapan memiliki nilai membatasi diberikan oleh (18) dengan L 0 dan C konstanta p. Jika kita menganggap wadah, sebagian diisi dengan cairan dan sebagian gas, entropi dari campuran cairan-gas (19) di mana S l (T) adalah entropi cairan dan x adalah fraksi gas. Jelas perubahan entropi selama masa transisi cair-gas (x dari 0 ke 1) divergen dalam batas T → 0. Ini melanggar Persamaan. (8). Alam memecahkan paradoks ini sebagai berikut: pada suhu di bawah sekitar 50 mK tekanan uap yang sangat rendah sehingga kepadatan gas lebih rendah dari vakum terbaik di alam semesta. Dengan kata lain: di bawah 50 mK ada cukup gas di atas cairan. Laten panas mencair Kurva pencairan dari ³ Dia dan ⁴ Dia baik memperpanjang turun ke nol mutlak pada tekanan terbatas. Pada tekanan mencair cair dan padat berada dalam kesetimbangan. Hukum yang ketiga menuntut bahwa entropi dari padat dan cair yang sama pada T = 0. Akibatnya panas laten pencairan adalah nol dan kemiringan kurva leleh mengekstrapolasikan untuk nol sebagai hasil dari persamaan Clausius-Clapeyron . koefisien ekspansi termal Koefisien ekspansi termal didefinisikan sebagai (20) Dengan hubungan Maxwell riskailham11.wordpress.com Page 51 (21) dan persamaan (8) dengan X = p. terlihat bahwa (22) Jadi koefisien ekspansi termal dari semua bahan harus pergi ke nol nol kelvin. 2.8 Siklus Termodinamika Sebuah siklus termodinamika terdiri dari serangkaian proses termodinamika mentransfer panas dan kerja, sementara memvariasikan tekanan, temperatur, dan variabel negara lainnya, akhirnya mengembalikan sistem ke keadaan awal. Dalam proses melalui siklus ini, sistem dapat melakukan bekerja pada sekitarnya, sehingga bertindak sebagai mesin panas . Jumlah negara tergantung hanya pada keadaan termodinamika , dan variasi kumulatif sifat tersebut menambahkan hingga nol selama siklus. Proses kuantitas (jumlah atau path), seperti panas dan kerja adalah proses tergantung, dan panas kumulatif dan pekerjaan non-nol. The hukum pertama termodinamika menyatakan bahwa masukan panas yang bersih adalah sama dengan output kerja bersih atas setiap siklus. Sifat mengulangi dari jalur proses memungkinkan untuk terus beroperasi, membuat siklus konsep penting dalam termodinamika . Siklus termodinamika sering menggunakan proses quasistatic untuk model kerja dari perangkat yang sebenarnya. Panas dan bekerja Dua kelas utama siklus termodinamika adalah kekuatan siklus dan siklus pompa panas. Siklus Power siklus yang mengubah beberapa masukan panas menjadi kerja mekanik output, sedangkan siklus panas pompa mentransfer panas dari rendah ke suhu tinggi menggunakan masukan kerja mekanik. Siklus seluruhnya terdiri dari proses quasistatic dapat beroperasi sebagai kekuatan atau siklus pompa panas dengan mengendalikan arah proses. Pada diagram Volume tekanan atau diagram temperatur entropi , yang searah jarum jam dan berlawanan arah menunjukkan kekuasaan dan siklus pompa panas, masing-masing. Hubungan dengan bekerja riskailham11.wordpress.com Page 52 Contoh diagram PV dari siklus termodinamika. Karena variasi bersih properti negara selama siklus termodinamika adalah nol, membentuk loop tertutup pada diagram PV. Sebuah diagram PV sumbu Y menunjukkan tekanan (P) dan sumbu X menunjukkan volume (V). Daerah tertutup oleh loop adalah kerja (W) yang dilakukan oleh proses: Pekerjaan ini sama dengan keseimbangan panas (Q) ditransfer ke dalam sistem: Persamaan (2) membuat proses siklus mirip dengan proses isotermal : meskipun perubahan energi internal selama proses siklik, ketika proses siklik selesai energi sistem adalah sama dengan energi itu ketika proses dimulai. Jika proses siklus bergerak searah jarum jam di sekitar loop, maka W akan positif, dan itu merupakan mesin panas . Jika bergerak berlawanan, maka W akan negatif, dan itu merupakan pompa panas . Kekuatan siklus Diagram Panas mesin. Siklus kekuasaan Termodinamika merupakan dasar untuk pengoperasian mesin panas, yang memasok sebagian besar dunia tenaga listrik dan menjalankan sebagian besar kendaraan bermotor . riskailham11.wordpress.com Page 53 Siklus daya dapat dibagi sesuai dengan tipe mesin panas mereka berusaha untuk model. Yang paling umum bahwa model siklus mesin pembakaran internal adalah siklus Otto , yang model mesin bensin dan siklus Diesel , yang model mesin diesel . Siklus bahwa model mesin pembakaran eksternal meliputi siklus Brayton , yang model turbin gas , dan siklus Rankine , yang model turbin uap . Siklus termodinamika searah jarum jam ditunjukkan oleh panah menunjukkan bahwa siklus merupakan mesin panas. Siklus ini terdiri dari empat negara (titik ditunjukkan oleh salib) dan proses termodinamika empat (baris). Misalnya tekanan-volume kerja mekanik dilakukan dalam siklus mesin panas, terdiri dari 4 proses termodinamika, adalah: Jika tidak ada perubahan volume yang terjadi dalam proses 4 -> 1 dan 2 -> 3, persamaan (3) disederhanakan menjadi: siklus pompa panas riskailham11.wordpress.com Page 54 Siklus panas Termodinamika pompa adalah model untuk pompa panas dan lemari es . Perbedaan antara keduanya adalah bahwa pompa panas dimaksudkan untuk menjaga tempat yang hangat saat lemari es dirancang untuk mendinginkannya. Siklus refrigerasi yang paling umum adalah siklus kompresi uap , yang model sistem yang menggunakan refrigeran yang fase perubahan. The siklus refrigerasi absorpsi merupakan alternatif yang menyerap refrigeran dalam larutan cair daripada menguap itu. Gas siklus refrigerasi termasuk siklus Brayton terbalik dan siklus Hampson-Linde . Regenerasi dalam pendingin gas memungkinkan untuk pencairan gas . Pemodelan sistem nyata Contoh sistem nyata dimodelkan dengan proses ideal: PV dan TS diagram siklus Brayton dipetakan ke proses aktual dari mesin turbin gas Siklus termodinamika dapat digunakan untuk model perangkat nyata dan sistem, biasanya dengan membuat serangkaian asumsi. asumsi penyederhanaan sering diperlukan untuk mengurangi masalah ke bentuk yang lebih mudah dikelola. Sebagai contoh, seperti yang ditunjukkan pada gambar, perangkat seperti turbin gas atau mesin jet dapat dimodelkan sebagai siklus Brayton . Perangkat yang sebenarnya terdiri dari serangkaian tahap, masing-masing itu sendiri dimodelkan sebagai proses termodinamika ideal. Meskipun setiap tahap yang bekerja pada fluida kerja adalah perangkat nyata yang kompleks, mereka dapat dimodelkan sebagai proses ideal yang mendekati perilaku nyata mereka. Asumsi selanjutnya adalah bahwa gas buang akan diteruskan kembali melalui inlet dengan kerugian yang sesuai panas, sehingga menyelesaikan siklus ideal. Perbedaan antara siklus ideal dan performa sebenarnya dapat menjadi signifikan. [2] Sebagai contoh, gambar berikut menggambarkan perbedaan dalam output kerja diprediksi oleh ideal siklus Stirling dan kinerja aktual dari mesin Stirling: riskailham11.wordpress.com Page 55 Ideal Stirling siklus Realisasi kinerja Aktual dan ideal dilapis, menunjukkan perbedaan dalam output kerja Sebagai hasil kerja diwakili oleh interior siklus, ada perbedaan yang signifikan antara output kerja prediksi siklus ideal dan output kerja yang sebenarnya ditunjukkan oleh mesin nyata. Hal ini juga dapat diamati bahwa proses individu nyata menyimpang dari rekan-rekan ideal mereka, misalnya, ekspansi isochoric (proses 1-2) terjadi dengan beberapa perubahan volume aktual. siklus termodinamika terkenal Dalam prakteknya, sederhana siklus termodinamika ideal biasanya terbuat dari empat proses termodinamika . Setiap proses termodinamika dapat digunakan. Namun, ketika siklus ideal dimodelkan, seringkali proses di mana satu variabel negara dipertahankan konstan digunakan, seperti proses isotermal (suhu konstan), proses isobaric (tekanan konstan), proses isochoric (volume konstan), proses isentropik (entropi konstan) , atau proses isenthalpic (entalpi konstan). Seringkali proses adiabatik juga digunakan, di mana tidak ada panas yang dipertukarkan. Beberapa siklus termodinamika contoh dan proses konstituen mereka adalah sebagai berikut: Proses 2-3 Proses 4-1 Proses 1-2 Proses 3-4 Sepeda (Penambahan (Penolakan (Compression) (Ekspansi) Panas) Panas) Catatan Daya siklus normal dengan pembakaran eksternal - atau siklus pompa panas: Bell adiabatik Coleman isobarik adiabatik Carnot isentropik isotermal isentropik isotermal Ericsson isotermal isobarik isotermal riskailham11.wordpress.com isobarik isobarik Sebuah Brayton siklus terbalik kedua Ericsson siklus dari Page 56 1853 Rankine adiabatik isobarik adiabatik isobarik Scuderi adiabatik variabel tekanan dan volume adiabatik isochoric Stirling isotermal isochoric isotermal isochoric Stoddard adiabatik isobarik adiabatik isobarik Mesin uap Daya siklus normal dengan pembakaran internal : Brayton adiabatik isobarik adiabatik isobarik adiabatik isobarik adiabatik isochoric Disel Lenoir isobarik Minyak adiabatik mawar isochoric adiabatik isochoric adiabatik Mesin jet versi pembakaran eksternal siklus ini dikenal sebagai pertama siklus Ericsson dari 1.833 Pulse jet (Catatan: Proses 1-2 menyelesaikan keduanya penolakan panas dan kompresi) isochoric Bensin / mesin Siklus Ideal Sebuah ilustrasi dari sebuah mesin panas siklus yang ideal (panah searah jarum jam). Sebuah siklus yang ideal dibangun dari: riskailham11.wordpress.com Page 57 1. TOP dan BOTTOM dari loop: sepasang proses isobaric paralel 2. KIRI dan KANAN dari loop: sepasang proses paralel isochoric Carnot siklus The Siklus Carnot adalah siklus terdiri dari benar-benar proses reversibel dari isentropik kompresi dan ekspansi dan isotermal Selain panas dan penolakan. The Efisiensi termal dari siklus Carnot hanya bergantung pada suhu mutlak dari dua waduk di mana perpindahan panas berlangsung, dan untuk siklus daya: dimana adalah suhu terendah siklus dan koefisien kinerja untuk pompa panas adalah: tertinggi. Untuk siklus Carnot listrik dengan dan untuk kulkas koefisien kinerja adalah: Hukum kedua termodinamika membatasi efisiensi dan COP untuk semua perangkat siklik ke tingkat pada atau di bawah efisiensi Carnot. The Siklus Stirling dan siklus Ericsson adalah dua siklus reversibel lainnya yang menggunakan regenerasi untuk mendapatkan perpindahan panas isotermal. Stirling siklus Siklus Stirling adalah seperti siklus Otto, kecuali bahwa adiabats diganti dengan isoterm. Hal ini juga sama dengan siklus Ericsson dengan proses isobaric diganti untuk proses volume konstan. 1. TOP dan BOTTOM dari loop: sepasang kuasi-paralel proses isotermal 2. KIRI dan KANAN sisi loop: sepasang proses paralel isochoric Panas mengalir ke loop melalui isoterm atas dan isochore kiri, dan beberapa dari panas ini mengalir kembali keluar melalui isoterm bawah dan isochore yang tepat, tetapi sebagian besar aliran panas adalah melalui sepasang isoterm. Hal ini masuk akal karena semua pekerjaan yang dilakukan oleh siklus dilakukan oleh sepasang proses isotermal, yang dijelaskan oleh Q = W. Hal ini menunjukkan bahwa semua panas bersih masuk melalui isoterm atas. Bahkan, semua panas yang datang melalui riskailham11.wordpress.com Page 58 isochore kiri keluar melalui isochore yang tepat: karena isoterm atas adalah semua pada suhu yang lebih hangat yang sama dan isoterm bawah adalah semua pada temperatur dingin yang sama , Dan karena perubahan dalam energi untuk isochore suatu sebanding dengan perubahan suhu, maka semua panas yang masuk melalui isochore kiri dibatalkan tahu persis oleh panas akan keluar isochore yang tepat. 2.9 Tabel persamaan termodinamika jumlah pokok Umum Kuantitas (Nama umum / s) (Umum) Simbol / s N SI Unit Dimensi berdimensi berdimensi mol [N] T K [Θ] Panas Energi Q, q J [M] [L] 2 [T] -2 Laten Panas QL J [M] [L] 2 [T] -2 Jumlah molekul Jumlah mol n Suhu jumlah berasal Umum Kuantitas (Nama umum / s) (Umum) Mendefinisikan Persamaan Simbol / s SI Unit Dimensi J -1 [T] 2 [M] -1 [L] -2 S JK -1 [M] [L] 2 [T] -2 [Θ] -1 Negentropy J JK -1 [M] [L] 2 [T] -2 [Θ] -1 Energi internal U J Entalpi H J Partisi Fungsi Z berdimensi berdimensi Termodinamika beta β suhu, Inverse Entropi Energi bebas Gibbs G J [M] [L] 2 [T] -2 [M] [L] 2 [T] -2 [M] [L] 2 [T] -2 Kimia potensial (dari komponen i dalam campuran) riskailham11.wordpress.com μi J [M] [L] 2 [T] -2 (N i, S, V semua harus Page 59 konstan) Energi bebas Helmholtz Sebuah F, Landau potensial , Ω Landau Gratis Energy Potensi besar Massieu Potensi, Helmholtz gratis entropi [M] [L] 2 [T] J -2 [M] [L] 2 [T] J -2 [M] [L] 2 [T] ΦG J Φ JK -1 [M] [L] 2 [T] -2 [Θ] -1 -1 [M] [L] 2 [T] -2 [Θ] -1 Planck potensial, Ξ Gibbs bebas entropi JK -2 Thermal sifat materi Kuantitas (Umum) (nama umum simbol / / s) s Umum panas / kapasitas C termal Mendefinisikan persamaan SI unit Dimensi -1 [M] [L] 2 [T] -2 [Θ] -1 JK -1 [M] [L] 2 [T] -2 [Θ] -1 Kapasitas panas spesifik C mp (isobarik) J kg -1 K -1 [L] 2 [T] -2 [Θ] -1 Molar kapasitas C np panas spesifik (isobarik) [M] [L] 2 JK -1 mol -1 [T] -2 [Θ] -1 [N] -1 Kapasitas panas (isobarik) Cp Kapasitas panas CV (isochoric / volumetrik) Kapasitas panas spesifik C mV (isochoric) riskailham11.wordpress.com JK JK -1 [M] [L] 2 [T] -2 [Θ] -1 J kg -1 K -1 [L] 2 [T] -2 [Θ] -1 Page 60 Molar kapasitas C nV panas spesifik (isochoric) [M] [L] 2 JK -1 mol -1 [T] -2 [Θ] -1 [N] -1 Spesifik L panas laten J kg -1 Rasio isobarik terhadap kapasitas panas γ isochoric, panas rasio kapasitas indeks, adiabatik berdimensi berdimensi [L] 2 [T] -2 Thermal transfer (Umum) simbol / s Kuantitas (nama umum / s) Suhu gradien Mendefinisikan persamaan Tidak ada simbol standar K m -1 [Θ] [L] -1 Konduksi termal tingkat, termal saat ini, termal / P panas fluks , transfer daya termal Thermal intensitas SI unit Dimensi W = J s [M] [L] 2 -1 [T] -2 W m -2 [M] [T] -3 Saya Termal / panas kerapatan fluks (vektor analog q intensitas termal di atas) W m -2 [M] [T] -3 Persamaan Fase transisi Fisik Situasi Persamaan Adiabatik transisi riskailham11.wordpress.com Page 61 Isotermal transisi Untuk gas ideal p 1 = p 2, p = konstanta Isobarik transisi V 1 = V 2, V = konstan Isochoric transisi Adiabatik ekspansi Gratis ekspansi Proses Pekerjaan dilakukan oleh gas memperluas Kerja Bersih Selesai dalam Proses Cyclic Teori Kinetic Ideal gas persamaan Fisik Situasi Tata nama Ideal gas hukum Tekanan gas ideal Persamaan p = tekanan V = volume kontainer T = temperatur n = jumlah mol N = jumlah molekul k = konstanta Boltzmann m = massa satu molekul M m = massa molar riskailham11.wordpress.com Page 62 gas Ideal Kuant Isobarik Isochoric Persamaan Umum itas Δp=0 ΔV=0 Isoterm al ΔT=0 Adiabatik Beker ja W Panas Kapas (Seperti untuk gas nyata) itas C (Untuk (Untuk gas ideal gas ideal monoato monoatom mik) ik) Energ i intern al ΔU Ental pi ΔH Entro pi ΔS [1] Konst an Entropi , Di mana k B adalah konstanta Boltzmann , dan Ω menunjukkan volume macrostate di ruang fase atau probabilitas termodinamika dinyatakan disebut. , Untuk proses reversibel hanya riskailham11.wordpress.com Page 63 Statistik fisika Di bawah ini adalah hasil yang bermanfaat dari distribusi Maxwell-Boltzmann untuk gas ideal, dan implikasi dari jumlah Entropy. Distribusi ini berlaku untuk atom atau molekul merupakan gas yang ideal. Fisik Situasi Tata nama MaxwellBoltzmann distribusi Persamaan v = kecepatan atom / molekul, m = massa setiap molekul (semua molekul adalah identik dalam Non-relativistik kecepatan teori kinetik), γ (p) = Faktor Lorentz sebagai fungsi dari momentum (lihat di bawah) Relativistik kecepatan (Maxwell-Juttner Rasio termal distribusi) untuk beristirahat massa-energi setiap molekul: K 2 adalah Modifikasi fungsi Bessel jenis kedua. Entropi Logaritma dari kepadatan negara P i = probabilitas sistem di microstate i Ω = jumlah di mana: microstates Entropi perubahan Entropik riskailham11.wordpress.com Page 64 kekuatan Rata-rata energi kinetik per derajat kebebasan Equipartition teorema d f = derajat kebebasan Energi internal Kololari dari distribusi non-relativistik Maxwell-Boltzmann di bawah. Fisik Situasi Tata nama Persamaan Berarti kecepatan Root mean kecepatan persegi Modal kecepatan Berarti jalan bebas σ = penampang Efektif n = Volume kepadatan jumlah partikel sasaran ℓ = jalan bebas Rata-Rata proses Kuasi-statis dan reversibel Untuk kuasi-statis dan reversibel proses, hukum pertama termodinamika adalah: di mana δ Q adalah panas yang dipasok ke sistem dan δ W adalah kerja yang dilakukan oleh sistem. potensi Termodinamika Energi berikut ini disebut potensi termodinamika , Nama Simbol Rumus Natural variabel Energi internal riskailham11.wordpress.com Page 65 Energi bebas Helmholtz Entalpi Energi bebas Gibbs Landau Potensi (potensial Grand) , dan terkait hubungan termodinamika mendasar atau "persamaan master" [2] adalah: Potensi Diferensial Energi internal Entalpi Energi bebas Helmholtz Energi bebas Gibbs hubungan Maxwell Empat yang paling umum hubungan Maxwell adalah: Fisik Situasi Tata nama = internal energi Termodinamika potensi sebagai fungsi dari variabel alami mereka Persamaan = Entalpi = energi bebas Helmholtz = energi bebas Gibbs Hubungan mencakup berikut ini. riskailham11.wordpress.com Page 66 Persamaan diferensial lainnya adalah: Nama H U G GibbsHelmhol tz persama an Quantum properti Dibedakan Partikel di mana N adalah jumlah partikel, h adalah konstanta Planck , I adalah momen inersia , dan Z adalah fungsi partisi , dalam berbagai bentuk: Derajat kebebasan Partisi Fungsi Terjemahan Getaran Rotasi riskailham11.wordpress.com Page 67 di mana: σ = 1 ( molekul heteronuklir ) σ = 2 ( homonuclear ) Thermal sifat materi Koefisien Persamaan JouleThomson koefisien Kompresibilit as (suhu konstan) Koefisien ekspansi termal (tekanan konstan) Kapasitas panas (tekanan konstan) Kapasitas panas (volume konstan) Derivasi dari kapasitas panas (tekanan konstan) Sejak riskailham11.wordpress.com Page 68 Derivasi dari kapasitas panas (volume konstan) Sejak (Di mana δ W rev adalah kerja yang dilakukan oleh sistem), Thermal transfer Fisik Situasi Tata nama Net intensitas emisi / penyerapan Energi internal dari suatu zat Meyer persamaan riskailham11.wordpress.com Persamaan T = temperatur eksternal eksternal (di luar sistem) T = sistem internal yang suhu (dalam sistem) ε = emmisivity C V = isovolumetric kapasitas panas dari substansi Δ T = perubahan suhu zat C p = kapasitas panas isobarik C V = isovolumetric kapasitas panas Page 69 n = jumlah mol Seri Efektif termal konduktivitas λ i = konduktivitas termal zat i λ bersih konduktivitas termal = setara Paralel efisiensi termal Fisik Situasi Tata nama Termodinamika mesin Persamaan η = efisiensi W = kerja yang dilakukan oleh mesin Q H = energi panas Termodinamika Mesin: pada reservoir suhu tinggi Q C = energi panas pada reservoir suhu Carnot mesin efisiensi: yang lebih rendah T H = suhu suhu yang lebih tinggi. waduk T C = suhu suhu yang lebih rendah. waduk Pendinginan kinerja Pendinginan K = koefisien kinerja pendinginan Carnot pendingin kinerja v t riskailham11.wordpress.com Page 70 e Cabang fisika Divisi Eksperimental fisika Teoritis fisika Klasik mekanika o o o Energi dan gerak Inti Gelomba ng dan bidang Fisik ilmu dan Terapa matemati n ka Continuum mekanik Celestial mekanika Mekanika statistika Termodinamika Mekanika zat cair dan gas Biomekanika Mekanika kuantum Gravitasi Elektromagnetisme Quantum teori medan Kenisbian o o Newtonian mekanik Lagrangian mekanika Hamiltonian mekanik Relativitas khusus Relativitas umum Akustik Fisika perbintangan Atom, molekul, dan optik fisika Atom fisika Kimia fisika Komputasi fisika Publikasi materi fisika Tinggi fisika energi Matematika fisika Optik Fisika plasma riskailham11.wordpress.com Page 71 Biofisika o o Biologi , geologi , ekonomi Medis fisika Neurophysics Agrophysics Atmosfer fisika Econophysics Geofisika o Tanah fisika Diperoleh dari " http://en.wikipedia.org/w/index.php?title=Table_of_thermodynamic_equations&oldid=517291259 " BAB III Penutup 3.1 Kesimpulan Terdapat empat Hukum Dasar yang berlaku di dalam sistem termodinamika, yaitu: Hukum Awal (Zeroth Law) Termodinamika Hukum ini menyatakan bahwa dua sistem dalam keadaan setimbang dengan sistem ketiga, maka ketiganya dalam saling setimbang satu dengan lainnya. Hukum Pertama Termodinamika Hukum ini terkait dengan kekekalan energi. Hukum ini menyatakan perubahan energi dalam dari suatu sistem termodinamika tertutup sama dengan total dari jumlah energi kalor yang disuplai ke dalam sistem dan kerja yang dilakukan terhadap sistem. Hukum kedua Termodinamika Hukum kedua termodinamika terkait dengan entropi. Hukum ini menyatakan bahwa total entropi dari suatu sistem termodinamika terisolasi cenderung untuk meningkat seiring dengan meningkatnya waktu, mendekati nilai maksimumnya. riskailham11.wordpress.com Page 72 Hukum ketiga Termodinamika Hukum ketiga termodinamika terkait dengan temperatur nol absolut. Hukum ini menyatakan bahwa pada saat suatu sistem mencapai temperatur nol absolut, semua proses akan berhenti dan entropi sistem akan mendekati nilai minimum. Hukum ini juga menyatakan bahwa entropi benda berstruktur kristal sempurna pada temperatur nol absolut bernilai nol. 3.2 Daftar Pustaka HALLIDAY, RESNICK, WALKER. “ DASAR – DASAR FISIKA “ http://hyperphysics.phy-astr.gsu.edu/hbase/thermo/firlaw.html http://thermodynamicslaw.blogspot.com/2011/12/about-thermodynamics-2.html http://bowlesphysics.com/images/AP_Physics_B_-_Thermodynamics.ppt http://en.wikipedia.org/wiki/Thermodynamic_process http://www.transtutors.com/physics-homework-help/thermal-physics/thermodynamic-process.aspx http://www.britannica.com/EBchecked/topic/591572/thermodynamics/258543/Isothermal-andadiabatic-processes http://translate.googleusercontent.com/translate_c?depth=1&hl=id&langpair=en|id&rurl=translate.g oogle.co.id&u=http://en.wikipedia.org/wiki/Carnot%27s_theorem_%28thermodynamics%29&usg= ALkJrhhjGR0dbJfOPksDTa28M7Vb3TQ7TA http://en.wikipedia.org/wiki/Thermodynamics http://translate.googleusercontent.com/translate_c?depth=1&hl=id&langpair=en|id&rurl=translate.g oogle.co.id&u=http://en.wikipedia.org/wiki/Pressure&usg=ALkJrhhXCqhmEjd0Yfm_ej3yZy0v_S9nA http://www.fisikanet.lipi.go.id/utama.cgi?cetakartikel&1112756344 http://didot4com.wordpress.com/animasi-fisika/ http://subkioke.wordpress.com/download/download-animasi-flash/ http://blogfisikaku.wordpress.com/category/animasi-fisika/ http://translate.googleusercontent.com/translate_c?depth=6&hl=id&langpair=en|id&rurl=translate.g oogle.com&twu=1&u=http://en.wikipedia.org/wiki/Entropy&usg=ALkJrhiWhhcRmymmctC6nuX AZgzmds97XQ http://translate.googleusercontent.com/translate_c?depth=6&hl=id&langpair=en|id&rurl=translate.g oogle.com&twu=1&u=http://en.wikipedia.org/wiki/Free_entropy&usg=ALkJrhiD5ZCpKZSFYSij DSWQuVVlNMW3YQ http://translate.googleusercontent.com/translate_c?depth=6&hl=id&langpair=en|id&rurl=translate.g oogle.com&twu=1&u=http://en.wikipedia.org/wiki/Entropy_%28classical_thermodynamics%29&u sg=ALkJrhio3ebSUjZj1zB7FLgwzw48hN0ugA riskailham11.wordpress.com Page 73 Latihan Soal Soal No. 1 Suatu gas memiliki volume awal 2,0 m3 dipanaskan dengan kondisi isobaris hingga volume akhirnya menjadi 4,5 m3. Jika tekanan gas adalah 2 atm, tentukan usaha luar gas tersebut! (1 atm = 1,01 x 105 Pa) Pembahasan Data : V2 = 4,5 m3 V1 = 2,0 m3 P = 2 atm = 2,02 x 105 Pa Isobaris → Tekanan Tetap W = P (ΔV) W = P(V2 − V1) W = 2,02 x 105 (4,5 − 2,0) = 5,05 x 105 joule Soal No. 2 1,5 m3 gas helium yang bersuhu 27oC dipanaskan secara isobarik sampai 87oC. Jika tekanan gas helium 2 x 105 N/m2 , gas helium melakukan usaha luar sebesar…. A. 60 kJ B. 120 kJ C. 280 kJ D. 480 kJ E. 660 kJ (Sumber Soal : UMPTN 1995) Pembahasan Data : V1 = 1,5 m3 T1 = 27oC = 300 K riskailham11.wordpress.com Page 74 T2 = 87oC = 360 K P = 2 x 105 N/m2 W = PΔV Mencari V2 : V V 2/T2 = 1/T1 V V2 = ( 1/T1 ) x T2 = ( 1,5/300 ) x 360 = 1,8 m3 W = PΔV = 2 x 105(1,8 − 1,5) = 0,6 x 105 = 60 x 103 = 60 kJ Soal No. 3 2000 /693 mol gas helium pada suhu tetap 27oC mengalami perubahan volume dari 2,5 liter menjadi 5 liter. Jika R = 8,314 J/mol K dan ln 2 = 0,693 tentukan usaha yang dilakukan gas helium! Pembahasan Data : n = 2000/693 mol V2 = 5 L V1 = 2,5 L T = 27oC = 300 K Usaha yang dilakukan gas : W = nRT ln (V2 / V1) W = (2000/693 mol) ( 8,314 J/mol K)(300 K) ln ( 5 L / 2,5 L ) W = (2000/693) (8,314) (300) (0,693) = 4988,4 joule Soal No. 4 Mesin Carnot bekerja pada suhu tinggi 600 K, untuk menghasilkan kerja mekanik. Jika mesin menyerap kalor 600 J dengan suhu rendah 400 K, maka usaha yang dihasilkan adalah…. A. 120 J B. 124 J C. 135 J D. 148 J E. 200 J (Sumber Soal : UN Fisika 2009 P04 No. 18) Pembahasan η = ( 1 − Tr / Tt ) x 100 % Hilangkan saja 100% untuk memudahkan perhitungan : η = ( 1 − 400/600) = 1/3 η = ( W / Q1 ) 1 /3 = W/600 W = 200 J Soal No. 5 Diagram P−V dari gas helium yang mengalami proses termodinamika ditunjukkan seperti gambar berikut! riskailham11.wordpress.com Page 75 Usaha yang dilakukan gas helium pada proses ABC sebesar…. A. 660 kJ B. 400 kJ C. 280 kJ D. 120 kJ E. 60 kJ (Sumber Soal : UN Fisika 2010 P04 No. 17) Pembahasan WAC = WAB + WBC WAC = 0 + (2 x 105)(3,5 − 1,5) = 4 x 105 = 400 kJ Soal No. 6 Suatu mesin Carnot, jika reservoir panasnya bersuhu 400 K akan mempunyai efisiensi 40%. Jika reservoir panasnya bersuhu 640 K, efisiensinya…..% A. 50,0 B. 52,5 C. 57,0 D. 62,5 E. 64,0 (Sumber Soal : SPMB 2004) Pembahasan Data pertama: η = 40% = 4 / 10 Tt = 400 K Cari terlebih dahulu suhu rendahnya (Tr) hilangkan 100 % untuk mempermudah perhitungan: η = 1 − (Tr/Tt) 4 / 10 = 1 − (Tr/400) (Tr/400) = 6 / 10 Tr = 240 K Data kedua : Tt = 640 K Tr = 240 K (dari hasil perhitungan pertama) η = ( 1 − Tr/Tt) x 100% η = ( 1 − 240/640) x 100% η = ( 5 / 8 ) x 100% = 62,5% riskailham11.wordpress.com Page 76 Soal No. 7 Perhatikan gambar berikut ini! Jika kalor yang diserap reservoir suhu tinggi adalah 1200 joule, tentukan : a) Efisiensi mesin Carnot b) Usaha mesin Carnot c) Perbandingan kalor yang dibuang di suhu rendah dengan usaha yang dilakukan mesin Carnot d) Jenis proses ab, bc, cd dan da Pembahasan a) Efisiensi mesin Carnot Data : Tt = 227oC = 500 K Tr = 27oC = 300 K η = ( 1 − Tr/Tt) x 100% η = ( 1 − 300/500) x 100% = 40% b) Usaha mesin Carnot η = W/Q1 4 /10 = W/1200 W = 480 joule c) Perbandingan kalor yang dibuang di suhu rendah dengan usaha yang dilakukan mesin Carnot Q2 = Q1 − W = 1200 − 480 = 720 joule Q2 : W = 720 : 480 = 9 : 6 = 3 : 2 d) Jenis proses ab, bc, cd dan da ab → pemuaian isotermis (volume gas bertambah, suhu gas tetap) bc → pemuaian adiabatis (volume gas bertambah, suhu gas turun) cd → pemampatan isotermal (volume gas berkurang, suhu gas tetap) da → pemampatan adiabatis (volume gas berkurang, suhu gas naik) Soal No. 8 riskailham11.wordpress.com Page 77 Suatu gas ideal mengalami proses siklus seperti pada gambar P − V di atas. Kerja yang dihasilkan pada proses siklus ini adalah….kilojoule. A. 200 B. 400 C. 600 D. 800 E. 1000 Pembahasan W = Usaha (kerja) = Luas kurva siklus = Luas bidang abcda W = ab x bc W = 2 x (2 x 105) = 400 kilojoule riskailham11.wordpress.com Page 78





![2. Tinjauan Singkat Termodinamika [Compatibility Mode]](http://s1.studylibid.com/store/data/000368661_1-2ccd4e1981a961db647255fa08a2b63f-300x300.png)