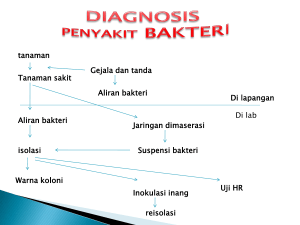
universitas negeri semarang
advertisement

UJI TOLERANSI TANAMAN TEMBAKAU (Nicotiana tabacum L.) TERHADAP CEKAMAN KADMIUM (Cd), TIMBAL (Pb), DAN TEMBAGA (Cu) PADA KULTUR CAIR skripsi disajikan sebagai salah satu syarat memperoleh gelar Sarjana Sains Program Studi Biologi oleh Siti Rosidah 4411409022 JURUSAN BIOLOGI FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS NEGERI SEMARANG 2014 i PERNYATAAN KEASLIAN SKRIPSI Saya menyatakan dengan sebenar-benarnya bahwa skripsi saya yang berjudul “Uji Toleransi Tanaman Tembakau (Nicotiana tabacum L.)terhadap Cekaman Kadmium (Cd), Timbal (Pb), dan Tembaga (Cu) pada Kultur Cair” disusun berdasarkan hasil penelitian saya dengan arahan dosen pembimbing. Sumber informasi atau kutipan yang berasal atau dikutip dari karya yang diterbitkan telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir skripsi ini. Skripsi ini belum pernah diajukan untuk memperoleh gelar dalam program sejenis di perguruan tinggi manapun. Semarang, Juli 2014 Siti Rosidah 4411409022 ii LEMBAR PENGESAHAN Skripsi dengan judul: “Uji Toleransi Tanaman Tembakau (Nicotiana tabacum L.) terhadap Cekaman Kadmium (Cd), Timbal (Pb), dan Tembaga (Cu) pada Kultur Cair” nama : Siti Rosidah NIM : 4411409022 Telah dipertahankan di hadapan sidang Panitia Ujian Skripsi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Negeri Semarang pada tanggal 23 Juli 2014. Panitia Ujian, Ketua Sekretaris Prof. Dr. Wiyanto, M.Si NIP. 196310121988031001 Andin Irsadi S.Pd, M.Si NIP. 197403102000031001 Mengetahui, Penguji Utama Dra. Lina Herlina, M.Si NIP. 19670207 199203 2 001 Anggota penguji I/ Pembimbing Utama Anggota penguji II/ Pembimbing Pendamping Dr. Yustinus Ulung A, M.Si NIP. 19640427 199003 1 003 Drs. Krispinus K Pukan, M.Si NIP. 19550731 198503 1 002 iii ABSTRAK Rosidah, S. 2014. Uji Toleransi Tanaman Tembakau (Nicotiana tabacum L.) terhadap Cekaman Kadmium (Cd), Timbal (Pb) dan Tembaga (Cu) pada Kultur Cair. Skripsi, Jurusan Biologi FMIPA Universitas Negeri Semarang. Dr. Yustinus U Anggraito, M.Si dan Drs. Krispinus Kedati Pukan, M.Si. Luasnya lahan bekas pertambangan dan polusi tanah yang tidak terkendali menyebabkan cekaman logam berat seperti kadmium (Cd), timbal (Pb) dan tembaga (Cu) terhadap tanaman.Beberapa penelitian transformasi genetik telah dilakukan untuk menemukan tanaman tahan cekaman logam dengan menggunakan tembakau (Nicotiana tabacum L.) sebagai tanaman model. Oleh karena itu diperlukan data pembanding pada tanaman kontrol pada cekaman logam berat kadmium (Cd), timbal (Pb) dan tembaga (Cu). Penelitian ini bertujuan untuk mengetahui ada tidaknya pengaruh cekaman logam berat terhadap tanaman tembakau dan bagaimana respon anatomis, morfologis antar perlakuan. Penelitian ini merupakan penelitian eksperimental rancangan acak lengkap dengan satu faktor; yaitu konsentrasi logam Cu (0 µM, 50 µM, 100 µM, 150 µM & 200 µM), Cd (0 µM, 50 µM, 100 µM, 200 µM & 300 µM)dan Pb (0 µM, 5 µM, 20 µM, 50 µM & 100 µM). Sampel yang digunakan adalah tembakau berumur 34 minggu yang berasal dari eksplan biji. Uji toleransi cekaman logam secara kuantitatif diukur berdasarkan tiga parameter yaitu pertambahan panjang akar, pertambahan jumlah akar & akumulasi logam dalam akar, sedangkan secara kualitatif berdasarkan anatomi akar,tekstur akar& warna daun. Data dianalisis dengan ANAVA satu jalan dan uji lanjut Beda Nyata Terkecil (BNT). Hasil penelitian menunjukkan bahwa cekaman logam Cu, Cd dan Pb berpengaruh signifikan pertambahan terhadap panjang akar, namun cekaman Cu dan Pb tidak berpengaruh signifikan terhadap jumlah akar. Hasil AAS menunjukkan pada cekaman logam Cu akumulasi terbesar ditemukan pada konsentrasi 200 µM, pada cekaman logam Cd ditemukan pada konsentrasi 200 µM dan pada cekaman Pb ditemukan pada konsentrasi 100 µM. Klorosis tidak ditemukan pada cekaman Cu, akam tetapi positif pada cekaman Cd dan Pb. Akumulasi logam ditemukan pada silinder pusat akar tembakau pada konsentrasi yang tinggi dan tidak ditemukan di kontrol. Berdasarkan hasil penelitian yang telah diperoleh, perlu dilakukan penelitian lanjutan untuk mengetahui pengaruh cekaman logam Cu,Cd dan Pb terhadap tanaman lainnya. Kata kunci: kadmium (Cd), kultur cair, Nicotiana tabacum L., tembaga (Cu), timbal (Pb), uji toleransi iv KATA PENGANTAR Dengan mengucapkan puji syukur kehadirat Allah SWT yang telah memberikan nikmat iman, nikmat Islam, serta rahmat, dan hidayah-NYA. Shalawat dan salam senantiasa tercurah limpahkan kepada Rasulullah SAW yang senantiasa memberikan inspirasinya sehingga penulis dapat menyelesaikan skripsi yang berjudul “Uji Toleransi Tanaman Tembakau (Nicotiana tabacum L.) terhadap Cekaman Kadmium (Cd), Timbal (Pb), dan Tembaga (Cu) pada Kultur Cair”. Penulis menyadari masih banyak kekurangan dalam menyusun skripsi ini.Syukur alhamdulillah dengan segala upaya, bantuan dan dorongan dari berbagai pihak, penulis dapat menyelesaikan skripsi ini dengan baik. Dalam kesempatan ini penulis menyampaikan terima kasih kepada: 1. Rektor Universitas Negeri Semarang yang telah memberikan motivasi kepada penulis dan mahasiswa lainnyasehingga dapat menyelesaikan studi. 2. Dekan FMIPA Universitas Negeri Semarang yang telah memberi izin penulis sehingga dapat menyelesaikan penulisan skripsi ini. 3. Ketua Jurusan Biologi yang membantu jalan penulis dalam menyusun skripsi. 4. Dr. Yustinus U Anggraito, M.Si, dosen pembimbing I atas bimbingan, pengarahan dan dorongannya selama ini. 5. Drs. Krispinus Kedati Pukan, M.Si dosen pembimbing II untuk dukungan, ilmu dan perhatiannya. 6. Dra. Lina Herlina, M.Si, dosen penguji untuk waktu dan kesabaran yang sangat berarti, tanpanya penulisan skripsi ini tidak menjadi lebih baik. 7. Mbak Tika, Mas Solikhin, dan segenap pengurus Laboratoium Biologi FMIPA UNNES atas bantuannya. 8. Bapak Ibu dosen dan seluruh staf pengajar Jurusan Biologi, untuk ilmu yang diberikan. 9. Mamak, Bapak, Mbak Umi, Mas Yono, Ifah dan Isa serta saudara-saudaraku tercinta untuk kasih sayang, kesabaran, doa dan dukungannya. v 10. Mbak Ambar dan Mbak Nida, terimakasih untuk kebaikan dan kesabarannya membantu penulis selama penelitian dan olah data. 11. Para sahabatku, Putri, Maya dan Janah, teman-teman Biologi murni 2009 dan kawan-kawan Botani (Betty, Ika, Umi semoga senantiasa sukses selalu), Botani 2010 (Dek Aisyah, Dek Durroh, Dek Elly dll), kos Lintang, dan saudarasaudaraku seperjuangan di kampus tercinta, terimakasih untuk semangat, kebersamaan, peringatan, dan tegurannya. 12. Keluarga besar UKM English Debating Society (EDS) Unnes atas segala doa dan dukungan. 13. Semua pihak yang turut membantu dalam penyelesaian skripsi ini yang tidak bisa penulis sebutkan satu persatu. Penulis menyadari akan adanya kekurangan dalam penulisan skripsi ini, maka segala kritik maupun saran yang bersifat membangun akan penulis terima dengan senang hati. Akhir kata penulis berharap semoga skripsi ini dapat berguna bagi semua pihak yang membutuhkan. Semarang, Juli 2014 Penulis vi DAFTAR ISI Halaman HALAMAN JUDUL................................................................................... i PERNYATAAN KEASLIAN SKRIPSI ..................................................... ii PENGESAHAN .......................................................................................... iii ABSTRAK ............................................................................................. iv KATA PENGANTAR ................................................................................ v DAFTAR ISI ............................................................................................. vii DAFTAR TABEL ....................................................................................... ix DAFTAR GAMBAR .................................................................................. xi DAFTAR LAMPIRAN ............................................................................... xii BAB I. PENDAHULUAN A. Latar Belakang ................................................................... 1 B. Rumusan Masalah ............................................................... 4 C. Penegasan Istilah ................................................................. 4 D. Tujuan Penelitian ................................................................ 5 E. Manfaat Penelitian .............................................................. 5 BAB II. TINJAUAN PUSTAKA DAN HIPOTESIS A. Tinjauan Pustaka ................................................................ 6 1. Logam berat ................................................................. 6 2. Tembaga ....................................................................... 6 3. Kadmium ...................................................................... 8 4. Timbal .......................................................................... 9 5. Fitoremediasi ................................................................ 10 6. Tembakau sebagai model tanaman transformasi ......... 12 7. Kultur cair .................................................................... 13 8. Media MS ..................................................................... 14 9. Pengamatan mikroskopik jaringan tumbuhan pada cekaman logam............................................................. 15 B. Kerangka Berpikir .............................................................. 16 C. Hipotesis............................................................................. 16 BAB III. METODE PENELITIAN A. Lokasi dan Waktu Penelitian ............................................. 17 B. Populasi dan Sampel .......................................................... 17 C. Variabel Penelitian ........................................................... 17 D. Rancangan Penelitian ......................................................... 18 E. Prosedur Penelitian............................................................. 18 F. Analisis Data ...................................................................... 21 vii BAB IV. HASIL PENELITIAN DAN PEMBAHASAN A. Hasil .................................................................................. B. Pembahasan ........................................................................ 1. Pengaruh Cekaman Cu, Cd, dan Pb terhadap Pertumbuhan Akar ....................................................... 2. Akumulasi Cu, Cd, dan Pb dalam Semaian Tembakau (Nicotiana tabacum L) dan Anatomi Akar .................. 3. Pengaruh Cekaman Cu, Cd, dan Pb terhadap Warna Daun Tembakau ........................................................... BAB V. SIMPULAN DAN SARAN A. Simpulan ............................................................................ B. Saran .................................................................................. DAFTAR PUSTAKA ................................................................................ LAMPIRAN viii 25 38 38 43 48 52 53 54 DAFTAR TABEL Tabel Halaman 1 Daftar tanaman hiperakumulator terestrial ……………………………... 2 2 Daftar penelitian cekaman Cu menggunakan sampel tembakau (Nicotiana tabacum L.) dan tanaman satu famili dengan tembakau…….. 7 3 Daftar penelitian cekaman Cd dengan menggunakan tembakau (Nicotiana tabacumL.)…………………………………………………... 9 4 Daftar penelitian cekaman Pb menggunakan sampel tembakau (Nicotiana tabacum L.)…………………………………………………... 10 5 6 7 Daftar komponen penyusun media hara MS……………………………... 14 Daftar perlakuan cekaman logam pada tembakau……………………….. 17 Rekap pengambilan data untuk uji toleransi tembaga…………………… 21 8 9 10 11 12 Rekap pengambilan data untuk uji toleransi kadmium…………………... Rekap pengambilan data untuk uji toleransi timbal……………………… Rumus Anava satu jalan menurut Sudjana (2005)……………………….. Rerata panjang akar tembakau yang dicekam oleh logam Cu…………… Hasil uji anava satu jalan pengaruh konsentrasi cekaman Cu terhadap pertambahan panjang akar tanaman tembakau ………………………….. 21 22 22 25 25 13 Hasil uji BNT pengaruh berbagai konsentrasi cekaman Cu terhadap pertambahan panjang akar tembakau…………………………………….. 26 14 Rerata pertambahan jumlah akar tanaman tembakau yang dicekam oleh logam Cu…………………………………………………………………. 26 15 Hasil uji anava pengaruh konsentrasi cekaman Cu terhadap pertambahan jumlah akar tanaman tembakau............................................. 27 16 Akumulasi logam Cu pada akar tanaman tembakau dengan metode AAS (Atomic Absorbance Spectroscopy)……………………………………… 27 17 Hasil pengamatan kualitatif pada daun dan akar semaian tembakau pada cekaman Cu………………………………………………………………. 27 18 Rerata panjang akar tembakau yang dicekam oleh logam Cd………………………………………………………………………… 29 19 Hasil uji anava pengaruh konsentrasi cekaman Cd terhadap panjang akar tanaman tembakau …………………………………………………. 29 ix 20 Hasil uji BNT pengaruh berbagai konsentrasi cekaman Cd terhadap pertambahan panjang akar tembakau ……………………………………. 30 21 Rerata pertambahan jumlah akar tanaman tembakau yang dicekam oleh logam Cd…………………………………………………………………. 30 22 Hasil uji anava pengaruh konsentrasi cekaman Cd terhadap pertambahan jumlah akar semaian tanaman tembakau ………………….. 31 23 Akumulasi logam Cd pada akar tanaman tembakau dengan metode AAS (Atomic Absorbance Spectroscopy)……………………………………… 31 24 Hasil pengamatan kualitatif pada daun dan akar semaian tembakau pada cekaman Cd………………………………………………………………. 31 25 Rerata pertambahan panjang akar tembakau yang dicekam oleh logam Pb………………………………………………………………………… 33 26 Hasil uji anava satu jalan pengaruh konsentrasi cekaman Cu terhadap pertambahan panjang akar tanaman tembakau………………………....... 33 27 Hasil uji BNT pengaruh berbagai konsentrasi cekaman Pb terhadap pertambahan jumlah akar tembakau………………………..……………. 34 28 Rerata pertambahan jumlah akar tanaman tembakau yang dicekam oleh logam Pb…………………………………………………………………. 34 29 Hasil uji anava pengaruh konsentrasi cekaman Pb terhadap pertambahan jumlah akar tembakau……………………………………... 35 30 Hasil uji BNT pengaruh berbagai konsentrasi cekaman Pb terhadap pertambahan jumlah akar tembakau……………………………………... 35 31 Akumulasi logam Pb pada akar tanaman tembakau dengan metode AAS (Atomic Absorbance Spectophotometry)…………………………………. 36 32 Hasil pengamatan kualitatif pada daun dan akar semaian pada cekaman Pb………………………………………………………………………… 36 x DAFTAR GAMBAR Gambar Halaman 1 Model uji toleransi dalam media cair……….................................................... 13 2 Kerangka berpikir uji toleransi Nicotiana tabacum L. pada kultur cair…….... 16 3 Model pot plastik penyisip planlet…………………………………………..... 20 4 Perbandingan morfologi akar semaian Nicotiana tabacum L. pada cekaman Cu…………………………………………………………………………….. 28 5 Perbandingan warna daun semaianNicotiana tabacum L. pada cekaman Cu.. 6 Anatomi membujur akar (perbesaran 40x) Nicotiana tabacum L. pada cekaman Cu dengan pewarna methylen blue ……………………..………….. 28 7 Perbandingan morfologi akar semaianNicotiana tabacum L. pada cekaman Cd……………………………………………………………………………... 32 8 Perbandingan warna daun semaianNicotiana tabacum L. pada cekaman Cd.. 9 Anatomi membujur akar (perbesaran 40x) Nicotiana tabacum L. pada cekaman Cd dengan pewarna hematoxylin……………………..……………. 33 28 32 10 Perbandingan morfologi akar semaianNicotiana tabacum L. pada cekaman Pb……………………………………………………………………………... 36 11 Perbandingan warna daun Nicotiana tabacum L. pada cekaman Pb………... 38 12 Perbandingan anatomi akar semaianNicotiana tabacum L. pada cekaman Pb……………………………………………………………………………... 38 xi DAFTAR LAMPIRAN Lampiran Halaman 1. Pengambilan dan analisis data …………………………………….. 62 2. Langkah kerja penelitian……………………………………........... 74 xii BAB I PENDAHULUAN A. Latar Belakang Masalah Luasnya lahan bekas pertambangan terbuka yang tidak dapat diberdayakan secara maksimal merupakan masalah serius yang harus segera ditangani. Penggalian tanah pertambangan menggunakan alat berat menyebabkan bagian tanah permukaan (top soil) dan tanah bagian tengah (sub soil) tergeser sedangkan bagian induk yang tidak subur muncul ke permukaan (Murjanto 2011). Hal ini menyebabkan lahan bekas pertambangan terbuka tidak dapat dimanfaatkan sebagai lahan pertanian produktif. Di sisi lain diperkirakan setiap tahun antara 50 ribu-100 ribu hektar lahan pertanian subur di Indonesia dialihfungsikan menjadi area komersial seperti perumahan, pabrik, lokasi usaha, dan perkantoran (Shaleh 13 Juli 2013, www.suaramerdeka.com). Dengan demikian revitalisasi lahan bekas tambang perlu dilakukan karena semakin terbatasnya lahan produktif pertanian. Lapisan tanah induk (horizon D atau C) memiliki kandungan mineral logam yang lebih banyak dan tekstur yang lebih kasar (Sunarminto 2011). Pengerukan tambang telah memindahkan lapisan tersebut ke permukaan sehingga tanah menjadi tidak subur. Penyebab lain yaitu limbah tambang yang tidak ditangani dengan baik. Beberapa studi membuktikan bahwa ditemukan residu logam pada daerah tambang, seperti ditemukannya logam Cu, Pb, Zn, As, Cd, dan Hg pada endapan sungai yang berada pada lahan bekas tambang emas Gunung Pani (Sabtanto & Suhandi 2005). Herman (2005) menyebutkan bahwa proses pembuangan limbah cair atau tailing pertambangan logam mengandung unsur pencemar As, Hg, Pb, dan Cd mengakibatkan pencemaran lingkungan. Konsentrasi logam yang tinggi menyebabkan petumbuhan tanaman terhambat dan menjadikan lahan tidak produktif (Shakoor et al.2013). Berbagai upaya penanggulangan pencemaran logam telah dilakukan dan salah satunya ialah bioremediasi. Beberapa jenis bioremediasi antara lain menggunakan media tanaman (fitoremediasi) maupun dengan media organisme 1 2 lain seperti fungi. Kelkar dan Bhalerao (2013) menyatakan bahwa mikoriza mampu menurunkan efek toksik arsenik pada spesies mikoriza Trigonella foenum-graceum. Daerah pertambangan yang sebagian besar berada di luar pulau Jawa memiliki karakter tanah kering umumnya berupa podsolik merah kuning yang memiliki kemampuan menahan air rendah (Sembiring 2007). Dengan demikian, penggunaan mikoriza yang menuntut kelembaban tinggi sulit diaplikasikan. Oleh karena itu fitoremediasi menggunakan tanaman merupakan metode yang lebih tepat digunakan pada tanah kering. Hal ini disebabkan karena tanaman memiliki ketahanan yang lebih tinggi terhadap faktor lingkungan dibandingkan dengan fungi, terlebih lagi teknologi transformasi genetik telah mampu menciptakan tanaman tahan cekaman logam dan faktor ekologi lainnya. Beberapa tanaman secara alami memiliki kemampuan mengkelat logam karena mampu tumbuh dengan optimal dalam kondisi tercekam logam sehingga disebut juga sebagai tanaman akumulator. Beberapa contoh tanaman tersebut dapat dilihat pada tabel sebagai berikut. Tabel 1. Daftar tanaman hiperakumulator terestrial (www.wikipedia.org) No 1 2 3 4 5 Species Haumaniustrum robertii Larrea tridentate Agrostis castellana Avena strigosa Crotalaria juncea Logam Cu Cu Pb Cd Cd Habitus Semak Semak kayu Rerumputan Rerumputan Semak Tanaman-tanaman tersebut mampu bertahan dalam cekaman logam berat, akan tetapi tidak semua tumbuhan memilki kemampuan sebagai bioakumulator. Oleh karena itu teknologi transformasi genetik dikembangkan untuk menciptakan tanaman tahan cekaman logam dengan cara menyisipkan gen dari tanaman toleran logam. Penelitian transformasi genetik saat ini telah mengarah ke tujuan menciptakan tanaman tahan cekaman logam yang menggunakan tanaman model sebagai sampel. Tanaman model yang digunakan adalah tanaman yang memiliki respon yang cepat terhadap manipulasi kondisi internal maupun eksternal. Menurut Ganapathi et al. (2004) tanaman tembakau (Nicotiana tabacum) adalah 3 tanaman kedua setelah tanaman Arabidopsis yang paling banyak digunakan sebagai tanaman model dalam teknologi rekayasa genetika, kultur jaringan, dan penelitian molekuler. Beberapa penelitian transformasi genetik telah menggunakan tembakau sebagai model seperti dalam Li et al. (2010), Anggraito et al. (2012), dan Zhang et al. (2013). Hal ini menunjukkan bahwa tembakau sangat berpotensi digunakan sebagai model penelitian transformasi genetik yang bertujuan untuk menghasilkan tanaman tahan cekaman logam. Narusaka et al. (2012) menyebutkan tahapan-tahapan pada penelitian transformasi genetik yang diperantarai oleh Agrobacterium (Agrobacterium mediated) menggunakan sampel tembakau antara lain yaitu mempersiapkan tanaman target (4-5 minggu), konstruksi vektor pada Agrobacterium dan inokulasi transformasi (3 hari), inkubasi tanaman target hasil transformasi (1 bulan), seleksi putatif tanaman hasil transformasi (10-14 hari), dan uji toleransi atau uji perbandingan. Dengan demikian diperlukan waktu penelitian yang lama dikarenakan perlunya uji pendahuluan untuk mengetahui respon tanaman secara alami sampel terhadap perlakuan. Oleh karena itu dibutuhkan data mengenai respon tanaman model non transformasi (wild type) terhadap cekaman logam tertentu. Informasi ini digunakan sebagai acuan untuk uji toleransi penelitian transformasi genetik dengan tujuan menciptakan tanaman tahan cekaman logam, sehingga waktu penelitian dapat dipersingkat dan efisien. Organ tanaman yang diamati adalah akar, karena akar berperan dalam pengambilan dan transportasi air dan mineral dari tanah (Hock & Wolf 2005), akar dapat mengakumulasi lebih banyak logam yang diserap tanaman dibandingkan dengan organ tumbuhan lainnya. Selain itu letak akar yang langsung bersentuhan dengan tanah atau media tanam menyebabkan akar memiliki sensitivitas yang lebih besar terhadap faktor abiotik dalam media dibandingkan daun maupun batang. Dengan demikian organ pertama yang merespon cekaman logam adalah akar oleh karena itu akar adalah organ yang tepat untuk digunakan mengamati respon cekaman logam terhadap tanaman. Pada penelitian ini teknik yang digunakan ialah metode uji toleransi pada kultur cair. Metode ini banyak digunakan pada penelitian transformasi genetik 4 seperti kacang hijau (Butare et al. 2011), jelai (Mikkelsen et al. 2012) dan jarak pagar (Tistama et al. 2012). Media cair banyak digunakan karena zat terlarut mudah diserap oleh tanaman, selain itu mobilitas logam pada media cair lebih tinggi dibanding dengan media padat. Akar hasil inkubasi kultur cair ini kemudian diwarnai dan diamati secara mikroskopik. Berdasarkan latar belakang di atas dapat disimpulkan bahwa perlu dilakukan penelitian untuk mengetahui respon tembakau terhadap cekaman logam dengan konsentrasi tertentu. Informasi ini sangat penting untuk penentuan konsentrasi logam pada uji toleransi penelitian transformasi genetik yang menggunakan tanaman tembakau sebagai sampel dan mengetahui, efek logam pada konsentrasi tertentu terhadap morfologi dan anatomi akar tembakau. B. RUMUSAN MASALAH Berdasarkan latar belakang tersebut dirumuskan masalah sebagai berikut. 1. Apakah cekaman berbagai konsentrasi logam Cd, Pb dan Cu berpengaruh terhadap pertumbuhan akar tembakau? 2. Bagaimana tingkat kerusakan anatomi akar tembakau, akumulasi logam dan warna daun tanaman pada konsentrasi Cd, Pb dan Cu yang berbeda? 3. Pada konsentrasi berapakah tembakau mampu mentolerir cekaman Cd, Pb dan Cu? C. PENEGASAN ISTILAH Dalam penelitian ini ada beberapa batasan istilah yang digunakan untuk menghindari salah pengertian sehingga perlu diberikan penegasan. 1. Uji Toleransi Uji Toleransi adalah uji yang dilakukan untuk mengetahui respon suatu organisme terhadap cekaman zat tertentu dan menganalisis keberhasilan suatu perlakuan dalam penelitian tertentu. Uji toleransi pada penelitian ini dilakukan sebagaimana uji toleransi yang dilakukan oleh Tistama et al. (2011). 5 2. Kultur cair Kultur cair adalah metode pemeliharaan tanaman yang menggunakan media cair berisi hara yang dibutuhkan oleh tanaman (Yusnita 2003). Pada penelitian ini kultur cair mengggunakan media hara setengah MS cair ditambah dengan logam Cu, Pb, dan Cu dengan konsentrasi yang sudah ditentukan. 3. Tembakau Tembakau adalah tanaman herba yang digunakan sebagai bahan dasar rokok. Tanaman tembakau cocok ditanam pada daerah dengan curah hujan ratarata 2000 mm/tahun, suhu optimal antara 21-32 ºC, dan pH antara 5-6 (Anonim 2013). Pada penelitian ini tembakau yang digunakan sebagai sampel adalah tembakau berumur 3-4 minggu. D. TUJUAN PENELITIAN Tujuan dari penelitian ini adalah sebagai berikut. 1. Mengetahui ada tidaknya pengaruh cekaman berbagai konsentrasi logam Cd, Pb, dan Cu terhadap pertumbuhan akar tembakau. 2. Menganalisis tingkat kerusakan anatomi akar tembakau, akumulasi logam dan warna daun pada konsentrasi Cd, Pb, dan Cu yang berbeda. 3. Mengetahui konsentrasi Pb, Cu, dan Cd yang mampu ditolerir oleh tembakau. E. MANFAAT PENELITIAN Penelitian ini memberikan beberapa informasi yang dapat dimanfaatkan oleh peneliti pada bidang terkait. Informasi tersebut antara lain sebagai berikut. 1. Informasi mengenai tingkat kerusakan akar tembakau pada kadar cekaman logam Cd, Pb dan Cu yang berbeda. Informasi dapat digunakan sebagai data acuan penelitian transgenetik dengan tujuan menciptakan tanaman tahan cekaman logam. 2. Informasi mengenai konsentrasi logam dan metode kultur cair yang dapat dijadikan acuan bagi penelitian sejenis. BAB II TINJAUAN PUSTAKA DAN HIPOTESIS A. Tinjauan Pustaka 1. Logam Berat Kontaminasi logam berat menjadi isu yang penting karena banyaknya kasus pencemaran logam berat yang merugikan kesehatan. Logam berat kationik yang umumnya bersifat toksik yaitu merkuri, kadmium, timbal, nikel, tembaga, seng, kromium dan mangan, sedangkan logam berat anionik yang umum adalah arsenik, molibdenum, selenium, dan boron (NRCS 2000). Logam-logam ini bersifat toksik baik pada hewan maupun tumbuhan. Akan tetapi tumbuhan secara umum memilki beberapa mekanisme penyerapan, transportasi dan respon terhadap cekaman logam berat (Manara 2012; Garg & Singla2011; Cheng 2003; Taiz & Zeiger 2010) Kontaminasi logam berat baik pada kadar rendah maupun tinggi pada makhluk hidup bersifat toksik. Pencemaran logam berat pada lingkungan seperti tanah dapat menyebabkan efek toksik dalam rantai makanan. Pada tumbuhan pencemaran logam menyebabkan terganggunya metabolisme seperti menurunnya jumlah klorofil dan rusaknya struktur sel tumbuhan (Reichman 2002). Pada hewan dan manusia kontaminasi logam berat menyebabkan beberapa penyakit seperti kanker, disfungsi ginjal, gangguan reproduksi, dan gangguan tulang (UNEP 2008). Dalam upaya penanggulangan pencemaran logam berat pada lahan bekas pertambangan, fitoremediasi dan transformasi genetik berpotensi besar dalam upaya pendayagunaan kembali lahan bekas tambang. 2. Tembaga Tembaga adalah elemen pertama dari grup 1B dalam sistem periodik unsur dan memiliki empat fase oksidatif yaitu: Cu (0), Cu (I), Cu (II), dan Cu (III) (Reichman 2002). Seperti halnya dengan perak dan emas, tembaga diklasifikasikan sebagai logam mulia dan dapat ditemukan langsung dalam bentuk 6 7 unsur. Tembaga memiliki sifat kimia dan fisika yang unik sehingga tembaga menjadi salah satu logam terpenting. Pada pertambangan logam mulia seperti emas terdapat residu Cu yang dihasilkan dan mencemari lingkungan (Manggara et al. 2007). Di dalam tanah, tembaga hadir secara alami pada beberapa jenis mineral seperti cuprite (Cu2O), malachite (CuCO3·Cu(OH)2), azurite (2CuCO3·Cu(OH)2), chalcopyrite (CuFeS2), chalcocite (Cu2S), dan bornite (Cu5FeS4). Kelarutan logam Cu dalam air sangat dipengaruhi oleh pH, menurut Reddy et al. (1995) Cu larut optimal pada pH 5.15.6. Semakin rendah pH suatu media maka semakin besar kelarutan Cu. Kontaminasi Cu pada tumbuhan menyebabkan beberapa gejala merugikan antara lain klorosis daun (Marschner 2012), bahkan dengan konsentrasi yang lebih tinggi dapat menyebabkan nekrosis daun. Akan tetapi Zhangyuan et al. (2012) menyebutkan bahwa respon cekaman Cu lebih dominan pada daerah akar (root part) dari pada daerah batang dan daun (shoot). Gangguan lain seperti rusaknya jaringan dinding sel, terhambatnya pertumbuhan dan bahkan polimerasi lignin (Fry et al. 2002; Mahmood et al. 2007; Quiroga et al. 2000). Secara fisiologis Cu menghambat penyerapan elemen esensial yang diperlukan tanaman seperti kalsium dan magnesium (Alaoui-Sossé et al. 2003), selain itu menurut Jiang et al. (2001) kontaminasi Cu juga mempengaruhi pembelah sel antara lain menyebabkan mitosis-c, terbentuknya jembatan anaphase dan penempelan kromosom. Dengan demikian Cu dapat menyebabkan mutasi pada sel tumbuhan. Berikut ini adalah tabel mengenai penelitian tentang Cu. Tabel 2. Daftar penelitian cekaman Cu menggunakan sampel tembakau (Nicotiana tabacum L.) dan tanaman satu famili dengan tembakau Nama Tanaman Konsentrasi Waktu pH dan jenis sampel pemaparan media Gori et al N. tabacum 50, 100, 150, 20 hari 5.8 (MS padat) (1998 ) 200 μM Joshi & Capsicum 0.5, 1.0, 2.0, 35 Hari 5.8 (MS padat) Kothari anuum 3.0, 5.0 μM (2007) Singh et N. tabacum 0.32, 3.2, 9.6,96 14 Hari - (Hoagland al (2011) μM cair) 8 3. Kadmium Kadmium adalah logam berat yang tidak dibutuhkan oleh tanaman. Kadmium bersifat toksik bagi tumbuhan maupun manusia. Kehadiran kadmium meskipun dalam jumlah yang sedikit terbukti mampu menghambat penyerapan unsur esensial yang dibutuhkan tanaman seperti Ca oleh akar (Kurtyka et al. 2008). Logam Cd juga trebukti mengganggu ekspansi sel sehingga mengganggu pertumbuhan (Poschenrieder et al. 1989). Larutan media yang mengandung kadmium menyebabkan berbagai gangguan fisiologis pada tanaman seperti membuka menutupnya stomata, transpirasi, dan fotosintesis, sedangkan dalam media tanah kadmium bersifat toksik pada kadar minimal 1.8-2.5 mg/kg tanah (UNEP 2008). Penyerapan Cd terjadi oleh beberapa mekanisme pengikatan Cd dengan protein pengikat logam (Liu et al. 2010). Berdasarkan penelitian Zou et al. (2012) kehadiran Cd dalam sel tumbuhan menyebabkan terganggunya pembelahan sel dan aberasi kromosom termasuk mitosis-c, patahnya kromosom, jembatan anafase, dan menempelnya kromosom. Kadmium secara alami terdapat dalam mantel dan kerak bumi dengan jumlah yang sangat sedikit yaitu sebanyak 0,4 mg/kg tanah (O’Neill 1994). Kehadiran kadmium dalam tanah juga dipengaruhi oleh penggunaan pupuk fosfat, hal ini karena pupuk fosfat mengandung 5-100 mg Cd/kg sehingga konsentrasi kadmium akan semakin bertambah seiring dengan banyaknya pupuk fosfat yang digunakan (O’Neill 1994). Pertambangan terbuka seperti emas (Herman et al. 2006) dan batu bara menghasilkan residu kadmium yang dapat mencemari lingkungan. Ditambah lagi akibat proses tailing tambang yang tidak sempurna banyak kadmium yang mengendap dalam tanah dan menyebabkan susahnya revegetasi (Sabtanto & Suhandi 2005). Dengan demikian lahan bekas galian tambang beresiko tinggi tercemar kadmium. Kelarutan kadmium sangat dipengaruhi pH. Semakin basa pH media, semkain rendah tingkat kelarutan Cd. Kadmium cenderung memiliki kelarutan dan mobilitas tinggi pada kisaran yang lebih tinggi dibanding dengan Cu dan Fe (John & Laventhal 1995). Sandrint dan Maier (2012) menyebutkan bahwa toksisitas kadmium pada pH > 4 lebih tinggi dibanding dengan pH < 4, hal ini 9 karena pada pH yang lebih rendah kadmium harus berkompetisi dengan hidrogen untuk berikatan dengan sel permukaan. Dalam rujukan lain seperti Levine (2013) disebutkan bahwa kadmium adalah logam yang memiliki titik disasosiasi pada pH 7, naiknya pH secara signifikan di atas 7 menurunkan kelarutan kadmium. Dalam penelitian ini, pH media pelarut kadmium diatur pada kisaran 5,8 seperti dalam Kim et al. (2011). Berikut ini adalah tabel mengenai penelitian tentang Cd dengan sampel tembakau. Tabel 3. Daftar penelitian cekaman Cd (Nicotiana tabacum L.) Nama Tanaman Konsentrasi sampel Kim et al. N. tabacum 0, 100 dan (2011) 200 μM Cd Yoshihara N. tabacum 20μM dan et al (2006) 100μM Shukla et al N. tabacum 50, (2012) 100, 200, 300 μM Pomponi et N. tabacum 30 μ M al (2006) menggunakan sampel tembakau Waktu pemaparan 21 Hari pH dan jenis media 5.8 (1/2 MS cair) 14 hari - (1/2 MS cair) 10 hari - (1/2 MS padat) 9 hari - (1/2 MS cair) 4. Timbal Timbal secara alami hadir pada konsentrasi yang sangat rendah dalam tanah, bebatuan maupun debu, jumlah total timbal pada kerak bumi diperkirakan 3,1x1014 ton (Anonim 2013). Akan tetapi, jumlah yang sedikit ini tetap berefek toksik apabila diserap oleh makhluk hidup. Pada lahan bekas tambang timbal ditemukan dalam konsentrasi yang besar, hal ini menyebabkan cekaman Pb yang merugikan tanaman. Pada daerah padat penduduk pencemaran limbah disebabkan oleh emisi bahan bakar motor, bekas cat timbal, dan limbah dari ekstraksi logam (Anonim 2013). Menurut Herman et al. (2006) akumulasi Pb banyak ditemukan pada lahan bekas tambang emas. Limbah tambang emas umumnya mengandung berbagai beraneka mineral di antaranya adalah sulfida. Sulfida mempunyai sifat aktif secara kimiawi, dan apabila bersentuhan dengan udara akan mengalami oksidasi sehingga membentuk garam bersifat asam dan aliran asam mengandung sejumlah logam beracun seperti As, Hg, Pb dan Cd. 10 Seperti halnya dengan kadmium, mobilitas timbal dalam tanah sangat dipengaruhi pH, pH yang rendah meningkatkan mobilitas dan penyerapan timbal oleh makhluk hidup (Anonim 2013). Kelarutan timbal sangat dipengaruhi oleh pH media. Reddy et al. (1995) menyebutkan bahwa Pb memiliki respon fluktuatif terhadap pH, kehadiran Pb pada pH 5.5-5.7 lebih besar dibanding dengan pada pH 5.1-5.4 akan tetapi pada pH < 3 konsentrasi Pb bertambah. Akumulasi timbal dalam akar paling banyak ditemukan pada dinding sel dan cekaman timbal menyebabkan menurunnya produktivitas tanaman (Sharma & Dubey 2005). Penimbunan Pb menyebabkan penurunan pertumbuhan akar, hilangnya dominansi apikal (Kopittke et al. 2007; Ghelich et al. 2013), sedangkan Petrescu et al. (2011) menyebutkan bahwa banyaknya kandungan timbal dalam media tanam berbanding lurus dengan lambatnya pertumbuhan tanaman Lycopersicum esculentum L. Pada tataran sitologi, kehadiran Pb menyebabkan aberasi kromosom yang dapat menimbulkan mutasi hal ini dibuktikan dalam penelitian Kumar & Tripathi (2008) yang mengobservasi sel Lathyrus sativus yang dicekam oleh Pb. Berikut ini adalah tabel mengenai penelitian tentang Pb dengan sampel tembakau. Tabel 4. Daftar penelitian cekaman Pb menggunakan (Nicotiana tabacum L.) Nama Tanaman konsentrasi Waktu sampel pemaparan Piano et N. 0, 2, 20 dan 200 10 hari al. (2008) tabacum mg dm-3 Alkhatib N. 10, 15, 50, dan 6 hari et al tabacum 100 uM (2011a) Alkhatib N. 5, 10, 25, 50, 7 hari et al tabacum 100, 300 dan (2011b) 500 μM sampel tembakau pH dan jenis media - (-/Cair) - (Hoagland cair) - (Hoagland cair) 5. Fitoremediasi Akumulasi logam pada media tanam dapat diserap dan ditranslokasi oleh tumbuhan. Absorbsi logam tersebut dapat dilakukan dengan beberapa mekanisme seperti tranportasi simplas, apoplas ataupun translokasi dengan transporter spesifik (Redjala et al. 2009; Krystofova et al. 2012; Nazar et al. 2012). Di dalam 11 Cobbet (2000) dijelaskan bahwa tanaman memiliki berbagai macam respon pada pencemaran logam berat, respon tersebut antara lain immobilisasi, pengkelatan dan kompartementalisasi ion logam, dan respon yang lebih umum seperti etilen dan stres protein. Immobilisasi adalah respon tanaman dengan menahan logam agar tidak ditransport ke lokasi lain sedangkan pengkelatan ialah pengikatan ion logam oleh zat pengkelat yaitu metallothionein (MT) dan phytochelatin (PC) (Sriprang & Murooka 2007). Adapun kompartemenlisasi ion oleh sel tumbuhan dilakukan oleh vakuola dengan mencegah ion logam bergerak bebas dalam sitosol. Sriprang & Murooka (2007) juga menyebutkan bahwa pengikatan logam oleh PC di dalam sel mengkibatkan menurunnya berat molekul komplek logamPC, komplek tersebut kemudian ditransport ke dalam vakuola oleh antiport logam atau transporter PC. Kemampuan tersebut yang kemudian dimanfaatkan dalam fitoremediasi. Hidayati (2005) menyebutkan bahwa fitoremediasi adalah pencucian polutan yang dimediasi oleh tumbuhan, termasuk pohon, rerumputan, dan tumbuhan air. Beberapa penelitian telah membuktikan bahwa beberapa tanaman berpotensi sebagai bioremediator alami seperti Psidium guajava (Pery et al. 2010), Haemanthus dan Mitracarpus scaber (Ayodele & Kiyawa 2010) dan Tympanotonus fuscatus (Otitoloju & Don-Pedro 2002). Karakteristik tumbuhan hiperakumulator menurut Hidayati (2005) adalah: (i) tahan terhadap unsur logam dalam konsentrasi tinggi pada jaringan akar dan tajuk; (ii) tingkat laju penyerapan unsur dari tanah yang tinggi dibanding tanaman lain; (iii) memiliki kemampuan mentranslokasi dan mengakumulasi unsur logam dari akar ke tajuk dengan laju yang tinggi. Di dalam tanaman bioakumulator terdapat pengkelat alami yaitu fitokelatin ataupun metallotheonin. Fitokelatin ialah golongan peptida disintesis oleh sel tumbuhan yang mampu mendetoksifikasi logam. Kandungan glutathion dalam peptida tersebut mampu mengkelat logam berat seperti Cd, Zn, Cu, dan Pb dan memiliki struktur umum berupa (γ-Glu-Cys)n-Gly dimana n = 2-11 (Anaspec 2008). Sedangkan metallotheonin adalah protein kaya sistein yang juga mampu 12 mengkelat logam. Cobbet (2000) menyebutkan bahwa kedua peptida tersebut bekerja secara independen dalam detoksifikasi logam. Penelitian lain seperti Blaylock et al. (1997) membuktikan bahwa beberapa zat pengkelat sintetis seperti EDTA (ethylene diamine tetra acetic acid), EGTA (ethylene glycol tetra acetic acid), dan asam sitrat mampu mengurangi akumulasi logam berat dalam akar. Akan tetapi penggunaan metode ini kurang efisien sehingga saat ini upaya telah berkembang ke arah rekayasa genetika. Beberapa penelitian transformasi genetik yang telah dilakukan dengan tujuan fitoremediasi yaitu Grispen et al. (2009) yang mentransformasi tembakau dengan gen AtMb2 dari Arabidopsis dan ATPase HM4 yang bertujuan untuk detoksifikasi kadmium, sedangkan penelitian lainnya yaitu Anggraito et al. (2012) yang menyisipkan gen MaMT2 pada tembakau dengan tujuan tahan cekaman Al. Dengan demikian transformasi genetik secara tidak langsung telah berperan besar dalam upaya fitoremediasi. 6. Tembakau sebagai Tanaman Model Transformasi Tanaman tembakau merupakan jenis tanaman komersial yang digunakan sebagai bahan baku utama rokok. Akan tetapi, dalam perkembangannya tembakau telah digunakan sebagai tanaman model kedua setelah tanaman Arabidopsis. Dari tahun 1396 penelitian bioteknologi tanaman dalam periode 1980-1990, 123 di antaranya menggunakan tembakau sebagai model penelitian (Ganapathi et al. 2004). Data ini menunjukkan bahwa tembakau sangat berpotensi digunakan sebagai tanaman sampel transfomasi genetik dengan tujuan menciptakan tanaman toleran cekaman logam. Secara morfologi tanaman tembakau merupakan tanaman semi tahunan berumur pendek. Pada umur 3 bulan daun tembakau sudah siap dipanen. Tinggi maksimal tanaman mencapai 2 meter dengan panjang daun maksimal 45 cm dan lebar 20 cm. Ukuran daun sesuai dengan ukuran batang tanaman, semakin besar batang semakin besar daun. Daun berbentuk bulat lanset dan daun bertelinga atau auriculatus (Anonim 2013). Berbagai penelitian telah menggunakan tembakau sebagai tanaman model transformasi genetik antara lain Luo et al. (2006), 13 Anggraito et al. (2012), Maheshwari & Kovalchuk (2012) dan Zhang et al. (2013). Tanaman tembakau banyak digunakan karena masa perkecambahannya yang singkat namun responsif terhadap faktor lingkungannya. 7. Kultur Cair Kultur cair merupakan metode penanaman yang menggunakan cairan sebagai komponen utamanya. Metode ini telah dikembangkan dengan berbagai tujuan seperti pengoptimalan lahan yang terbatas dan juga sebagai media tanam dengan kandungan zat tertentu. Dalam penelitian kultur jaringan, kultur cair banyak digunakan dalam uji tantang terhadap logam maupun zat tertentu yang hanya mungkin digunakan dalam bentuk cair. Hal ini dibuktikan oleh beberapa penelitian yang telah memanfaatkan metode kultur cair seperti dalam Longcamp et al. (2013), Tistama et al. (2012). Pada penelitian ini digunakan model kultur cair Hede et al. (2001) yang telah dimodifikasi (Gambar 1). Gambar 1. Model uji toleransi dalam media cair Gambar di atas menggambarkan model uji toleransi dengan media cair. Planlet tembakau di tempatkan dalam pot plastik yang di bagian bawah disangga sterofoam. Komplek pot dan planlet kemudian diapungkan dalam bak berisi 1 liter media cair. pH larutan disesuaikan dengan jenis logam kemudian aerator dipasang. 14 8. Media MS (Murashige dan Skoog) Pada teknologi kultur jaringan terdapat berbagai jenis media antara lain Knudson C (1946), Heller (1953), Nitsch dan Nitsch (1956), Gamborg dkk. B5 (1976), Linsmaier dan Skoog (LS) (1965), Murashige dan Skoog (1962) serta woody plant medium (Lloyd dan Mc Cown 1980). Akan tetapi medium MS mengandung unsur dan persenyawaan yang lebih lengkap dibanding dengan medium lain. Menurut Yusnita (2003) komponen media kultur yang lengkap sehingga memenuhi kriteria tersebut sehingga media MS menjadi salah satu media yang paling banyak digunakan dalam kultur jaringan. Media MS murni tanpa tambahan zat pengatur tumbuh disebut dengan MS0, media ini biasanya digunakan sebagai media perkecambahan atau media kontrol. Berikut adalah kandungan dalam media MS. Tabel 5. Daftar komponen penyusun media hara MS No Jenis Senyawa 1 Garam organik Komponen Hara makro : NH4NO3, KNO3, CaCl2.2H2O, MgSO4.7H2O, dan KH2PO4 Hara mikro: MnSO4.4H2O, ZnSO4.4H2O, H3BO3, KI, Na2MoO4.2H2O5, CuSO4.5H2O, dan CoCl2.6H2O Thiamin (B1), asam nikotinat, piridoksin (B6), myo-inositol 2 Vitamin 3 Sumber karbohidrat Asam amino Sukrosa Bahan pengatur pH Bahan pemadat (Alternatif) Zat pengatur tumbuh (Alternatif) Persenyawaan organik kompleks (Alternatif) NaOH/KOH atau HCl 4 5 6 7 8 L-glutamin, L-asparagin, Larginin, L-sistein, glisisn dan adenin Agar Auksin, sitokinin dan giberelin Arang aktif Fungsi Memenuhi kebutuhan mineral yang diperlukan tanaman Menstimulasi dan katalisis pertumbuhan tanaman Sumber energi Menyediakan sumber nitrogen lebih baik dibandingkan dengan nitrogen anorganik Mengatur pH media pada kisaran 5.8-6 Memadatkan media Mengontrol pertumbuhan dan diferensiasi sel Mencegah terjadinya browning 15 9. Pengamatan Mikroskopik Jaringan Tumbuhan pada Cekaman Logam Cekaman logam pada tanaman telah diaplikasikan pada banyak penelitian dan salah satu metode pengujiannya yaitu pengamatan jaringan dengan bantuan mikroskop. Tujuan metode ini adalah mengetahui lokasi penyebaran logam dalam jaringan tanaman dan menganalisis efek cekaman pada sitologi sel tanaman. Untuk mencapai tujuan tersebut jaringan diwarnai agar terlihat jelas dan kontras pada saat diamati. Jenis pewarna jaringan sangat ditentukan oleh jenis logam yang digunakan dan tujuan pengamatan. Oleh karena itu setiap logam hanya dapat diwarnai oleh pewarna tertentu seperti dalam Hede et al. (2001) mewarnai tanaman pada cekaman logam Al dengan pewarna hematoxilyn. Pada penelitian dengan cekaman logam lain seperti Cu, Arduini et al. (1995) yang menggunakan methylen blue pada pewarnaan penampang akar bibit Pinus pinaster dengan tujuan mengamati lokasi penyebaran Cu. Namun Jiang et al. (2001) menggunakan pewarna Carbol fuchsin pada akar Zea mays pada uji cekaman Cu karena bertujuan mengamati morfologi kromosom, sedangkan Lequeux et al. (2010) menggunakan propidium iodide pada bibit Arabidopsis thaliana. Pada cekaman logam Pb pewarna yang digunakan pada jaringan tumbuhan adalah Crytal violet pada Vigna unguiculata (Kopittke et al. 2007) dan asam rhodizonik dikombinasi dengan dithizon (Baranowska-Morek & Wierzbicka 2004). Pada cekaman Cd beberapa studi menggunakan pewarna yang berbeda antara lain yaitu Evans blue (Suzuki 2005), hematoxylin (Ratheesh et al.2010), toluidine blue (Schutzendubel et al. 2010). 16 B. Kerangka berpikir Penelitian transformasi genetik dimanfaatkan untuk menciptakan tanaman tahan cekaman logam Penelitian transformasi genetik memiliki banyak tahapan sehingga memerlukan banyak waktu. Penelitian transformasi genetik menggunakan tembakau sebagai sampel. Perlu dilakukan penelitian untuk menyediakan informasi mengenai respon tembakau secara wild type Uji toleransi dengan media cair dengan beberapa jenis logam Pengukuran panjang dan jumlah akar Pembuatan preparat akar semipermanen dan pengamatan mikroskopik Mendapatkan informasi mengenai konsentrasi logam yang mampu ditolerir oleh tembakau Gambar 2. Kerangka berpikir uji toleransi Nicotiana tabacum L. pada kultur cair C. HIPOTESIS Berdasarkan tinjauan pustaka di atas maka hipotesis yang dapat dirumuskan yaitu: 1. Terdapat pengaruh cekaman berbagai konsentrasi Cd, Pb, dan Cu terhadap pertumbuhan akar tembakau (Nicotiana tabacum L.). 2. Terdapat perbedaan tingkat kerusakan anatomi akar, akumulasi logam dan warna daun tembakau pada konsentrasi Cd, Pb, dan Cu yang berbeda (Nicotiana tabacum L.). 3. Tembakau memiliki toleransi terhadap cekaman logam pada konsentrasi yang lebih kecil dari konsentrasi terbesar masing-masing logam. BAB III METODE PENELITIAN A. Lokasi dan Waktu Penelitian Penelitian dilakukan di laboratorium Kultur Jaringan Tumbuhan Jurusan Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam. Pengambilan data dilaksanakan pada bulan Januari 2014- April 2014. B. Populasi dan Sampel Populasi biji tembakau (Nicotiana tabacum) diambil dari Desa Tuksari Kabupaten Temanggung Jawa Tengah sedangkan sampel dalam penelitian ini adalah planlet tembakau yang dikecambahkan secara in vitro berumur 3-4 minggu dan memiliki jumlah daun 5-6. C. Variabel Penelitian a. Variabel bebas Variabel bebas yang digunakan pada penelitian ini adalah sebagai berikut. Tabel 6. Daftar perlakuan cekaman logam pada tembakau Logam Cd (CdCl)2 0 µM 50 µM Pb 0 µM 5 µM Pb(NO3)2 Cu 0 µM 50 µM (CuSO4) Konsentrasi Waktu 100 µM 200 µM 300 µM 14 hari 20 µM 50 µM 100 µM 14 hari pH 5.8 5.5-5.7 100 µM 150 µM 200 µM 14 hari 5.1-5.6 b. Variabel Terikat Pertumbuhan planlet tanaman tembakau pada saat uji toleransi dengan dengan parameter: 1. Pertambahan panjang akar, pengukuran dilakukan secara berkala pada hari pemaparan ke 1, 5, 10, dan 14 pada akar terpanjang tiap sampel. 2. Pertambahan jumlah akar, perhitungan dilakukan secara berkala pada hari pemaparan ke 1, 5, 10, dan 14. 17 18 c. Variabel Kendali Variabel kendali yang digunakan dalam penelitian ini antara lain ialah: a. Suhu ruang tanam dan ruang inkubasi 20-26 0C. b. Cahaya disuplai oleh 1 lampu TL 40 Watt. D. Rancangan Penelitian Penelitian didesain dengan Rancangan Acak Lengkap (RAL). Setiap perlakuan dilakukan dengan 5 ulangan. Jumlah ulangan menurut (Zulkarnaen 2009) ditentukan menggunakan rumus perlakuan x (ulangan-1) ≥ 15. Berikut merupakan rancangan penelitian yang akan digunakan. No Logam 1 Cu 2 Cd 3 Pb Total sampel ∑ Perlakuan 5 5 5 Ulangan 5 5 5 ∑ Sampel 25 25 25 75 E. Prosedur Penelitian 1. Persiapan sampel a. Persiapan media Media yang digunakan adalah media MS (Murashige and Skoog, 1962). Pembuatan media dimulai dengan memasukan larutan stok masingmasing 10 ml (CaCl2.2H2O, MgSO4.7H2O, KH2PO4, NH4NO3, KNO3, hara mikro, vitamin, myo-inositol, FeEDTA,) ke dalam beker gelas 1 liter, kemudian disuplemen dengan sukrosa 30 gram dan diaduk sampai homogen. Selanjutnya setelah homogen larutan ditambah aquades sampai 1 liter dan kadar pH diatur agar mencapai pH 5.8-6, jika pH masih asam larutan perlu ditambahkan beberapa tetes NaOH dan jika terlalu basa larutan ditambah dengan HCl. Kemudian media dipanaskan dan ditambah bubuk agar sebanyak 7,5 g dan diaduk hingga homogen. Media kemudian dimasukkan ke dalam botol jam ukuran besar dan ditutup dengan tutup tahan panas, 1 liter media dapat digunakan untuk 24 botol besar. Proses dilanjutkan dengan sterilisasi media dalam autoclav selama 20 menit pada suhu 121º C. Media yang telah disterilisasi kemudian disimpan 19 dalam ruang penyimpanan selama tiga hari untuk mengetahui terjadi tidaknya kontaminasi. b. Persiapan eksplan Di dalam LAF yang sudah dibersihkan dengan alkohol 70 % dan disinari oleh sinar UV selama 1 jam, eksplan berupa biji N. tabacum disterilisasi permukaan dengan cara direndam dalam ethanol 70% selama 5 menit, lalu direndam dalam 20% larutan Bayclin (5.25% NaClO) selama 5 menit. Eksplan selanjutnya dibilas dengan air steril sebanyak dua kali, kemudian dikeringanginkan di atas kertas tissue steril. Sebanyak 3 eksplan dikecambahkan pada botol jam ukuran 150 ml berisi media MS0 diinkubasi dalam ruang gelap selama 2 hari kemudian diinkubasi dengan pencahayaan TL 40 watt dan suhu 26 selama 3-4 minggu. 2. Uji toleransi a. Persiapan media dan perangkat Pada uji toleransi terdapat 2 kali pembuatan media yaitu media untuk aklimatisasi berupa ½ MS0 dan media untuk uji cekaman berupa ½ MS0 ditambah logam (Tistama et al. 2012). Alat-alat berupa beker gelas 1 liter dan pengaduk disiapkan terlebih dahulu. Larutan stok digunakan sesuai pembuatan media ½ MS0 dimulai dengan memasukan masing-masing 5 ml larutan stok (CaCl2.2H2O, MgSO4.7H2O, KH2PO4, NH4NO3, KNO3, hara mikro, vitamin, myo-inositol, FeEDTA,) ke dalam beker gelas ukuran 1 liter dan diaduk sampai homogen. Selanjutnya setelah homogen larutan ditambah aquades sampai 1 liter dan kadar pH diatur pada kisaran 5.8-6 untuk media aklimatisasi dan disesuaikan menurut jenis logam untuk media uji cekaman, jika pH masih asam larutan perlu ditambahkan beberapa tetes NaOH namun jika terlalu basa larutan ditambah dengan HCl. Alat yang digunakan dalam uji tantang logam ini adalah bak plastik berukuran 20 x 30 cm untuk menampung media, pot bibit plastik sebagai wadah planlet, sterofoam untuk menyangga pot, dan aerator. Masing-masing wadah diisi dengan 1 liter media setengah MS yang sesuai perlakuan. Pot bibit 20 plastik di isi disangga dengan sterofoam agar planlet tidak tenggelam (Gambar 2). Penggaris dipersiapkan untuk mengukur kedalaman media perhari. Tempat penyisipan planlet. Gambar 3. Model pot plastik penyisip planlet b. Aklimatisasi planlet Planlet yang sudah berumur 3-4 minggu dengan jumlah daun 5-6 dikeluarkan dari botol kultur dan dicuci dengan air mengalir dan disisipkan pada pot plasik yang sudah dipersiapkan. Planlet ini kemudian diinkubasi pada media ½ MS0 cair tanpa logam selama 3 hari sebelum dipindahkan ke media setengah MS yang mengandung logam. c. Uji cekaman Planlet tembakau dari tahapan aklimatisasi dipindahkan ke media ½ MS yang mengandung logam setelah inkubasi selama 3 hari, hal ini bertujuan untuk memastikan plantet dapat beradaptasi pada media cair setelah sebelumnya ditumbuhkan pada media padat. Alkohol 70% disemprotkan di sekitar bak untuk menghindari kontaminasi. Planlet tembakau diletakkan di dalam bak media dan aerator dipasang ke dalam bak media. Aerator berfungsi mencegah logam dalam media mengendap dan menghomogenkan larutan media. Pemaparan dilakukan selama 14 hari dan media diperbaharui setiap 3 hari. d. Pengamatan histologis Pada pembuatan preparat histologis semipermanen uji toleransi cekaman logam digunakan pewarna yang berbeda yaitu hematoxylin (Ratheesh et al.2010) untuk cekaman Cd, methylen blue untuk cekaman Cu (Arduini et al. 1995) dan crystal violet untuk Pb (Kopittke et al. 2007). Proses dimulai dengan memilih akar terpanjang dari setiap sampel dan dicuci dengan 21 aquades. Untuk metode whole mount, ujung akar dipotong sepanjang 5 mm kemudian direndam dalam larutan pewarna selama 10 menit, potongan kemudian diletakkan pada gelas benda dan ditutup dengan kaca penutup. Setelah proses penutupan, kaca penutup ditekan dengan hati-hati. Kemudian preparat diamati di bawah mikroskop dan difoto. F. ANALISIS DATA 1. Analisis kuantitatif Data berupa pertumbuhan plantlet pengambilan data dihitung pada akhir penelitian. Dengan parameter sebagai berikut. 1. Pemanjangan akar, pengukuran dilakukan secara berkala pada hari pemaparan ke 1, 5, 10, dan 14 pada akar terpanjang tiap sampel. 2. Pertambahan jumlah akar, perhitungan dilakukan secara berkala pada hari pemaparan ke 1, 5, 10, dan 14. Tabel 7. Rekap pengambilan data untuk uji toleransi tembaga. Perlakuan Ulangan Jumlah (Konsentrasi) 1 2 3 4 5 Cu0 Cu1 Cu2 Cu3 Cu4 Keterangan Cu0 = N. tabacum tanpa kandungan Cu. Cu1 = N. tabacum dengan konsentrasi Cu 50 μM. Cu2 = N. tabacum dengan konsentrasi Cu 100 μM. Cu3 = N. tabacum dengan konsentrasi Cu 150 μM. Cu4 = N. tabacum dengan konsentrasi Cu 200 μM Rata-rata Tabel 8. Rekap pengambilan data untuk uji toleransi kadmium. Perlakuan Ulangan (Konsentrasi) 1 2 3 4 Cd0 Cd1 Cd2 Cd3 Cd4 Jumlah 5 Rata-rata 22 Keterangan Cd0 = N. tabacum pH 7 tanpa kandungan Cd. Cd1 = N. tabacum dengan konsentrasi Cd 50 μM. Cd2 = N. tabacum dengan konsentrasi Cd 100 μM. Cd3= N. tabacum dengan konsentrasi Cd 200 μM. Cd4= N. tabacum dengan konsentrasi Cd 300 μM. Tabel 9. Rekap pengambilan data untuk uji toleransi timbal. Perlakuan (Konsentrasi) Ulangan 1 2 3 4 Jumlah Ratarata 5 Pb0 Pb1 Pb2 Pb3 Pb4 Keterangan Pb0 = N. tabacum pH 7 tanpa kandungan Pb. Pb1 = N. tabacum dengan konsentrasi Pb 5 μM. Pb2 = N. tabacum dengan konsentrasi Pb 20 μM. Pb3 = N. tabacum dengan konsentrasi Pb 50 μM. Pb4 = N. tabacum dengan konsentrasi Pb 100 μM. Data dianalisis menggunakan uji Analisis Varians (ANAVA) satu jalan untuk melihat pengaruh tiap kelompok perlakuan. Jika hasil uji Anava signifikan, maka akan dilakukan uji BNT. Tabel 10. Rumus Anava satu jalan menurut Sudjana (2005) Sumber Variasi Perlakuan Derajat Kebebasan (dB) T-1 Jumlah Kuadrat (JK) JKP Kuadrat Tengah (KT) KTP Galat Total T(t-1) (r)(t)-1 JKT JKT KTG Keterangan dB KT t(1-1/2α) JK F r : derajat kebebasan : kuadrat tengah : perlakuan atau treatment : jumlah kuadrat : nilai frekuensi : replikasi atau ulangan F hitung KTP KTG F Tabel 5% 23 Selanjutnya untuk dapat menolak atau menerima hipotesis, maka F hitung yang telah diketahui harus dibandingkan dengan F tabel, sehingga kesimpulan yang dapat diambil adalah: 1) Bila Fh > Ft Signifikan Ho ditolak, Ha diterima. 2) Bila Fh < Ft Tidak Signifikan Ho diterima, Ha ditolak Apabila perhitungan dengan uji ANAVA memiliki perbedaan signifikan maka perhitungan dilanjutkan uji BNT 95% dengan rumus: BNT α= t(1-1/2 α) 2𝐾𝑇𝐺 𝑟 Selanjutnya, selisih rata-rata pada setiap perlakuan dibandingkan dengan nilai BNT 5%. Apabila nilai selisih rata-rata tersebut lebih besar dari nilai BNT 5%, maka dapat disimpulkan bahwa kedua perlakuan yang diuji berbeda secara signifikan. 3. Analisis kualitatif Analisis kualitatif pada penelitian ini dilakukan dengan melakukan pengamatan terhadap dua parameter yaitu: 1. Anatomi akar Pengamatan dilakukan setelah inkubasi pada media kultur cair mengandung kadmium, timbal dan tembaga, pengamatan dilakukan pada hari ke-14 pemaparan. Proses pembuatan preparat didahului dengan pewarnaan akar dan dilanjutkan dengan pengamatan dengan mikroskop. Adapun pengamatan akar akan berfokus pada tingkat kerusakan seperti rusaknya sel akar dan lokasi penimbunan logam pada akar. Analisis ini dilakukan dengan membandingkan struktur anatomi akar tembakau yang dicekam oleh logam pada berbagai konsentrasi dengan struktur anatomi akar tembakau pada media kontrol. Akar kemudian diwarnai dengan pewarna Hematoxilyn untuk Cd (Ratheesh et al. 2010), methylen blue untuk cekaman Cu (Arduini et al. 1995) dan crystal violet untuk Pb (Kopittke et al. 2007) dan diamati di bawah 24 mikroskop. Dengan mengamati struktur anatomi akar dapat diketahui distribusi penimbunan logam dalam akar seperti yang dilakukan dalam Tistama et al. (2011). 2. Warna daun Pengamatan warna daun dilakukan seperti halnya pada pengamatan kualitatif yakni pada pemaparan pada hari ke-14. Pengamatan ini bertujuan untuk mengetahui efek cekaman logam terhadap daun. Analisis yang dilakukan yaitu membandingkan warna daun pada tiap perlakuan dengan warna daun pada media kontrol. Analisis warna daun dilakukan dengan menggunakan chlorophyll meter untuk membandingkan tingkat klorosis daun. Daun seedling pada konsentrasi kontrol diharapkan memiliki morfologi daun yang lebih baik dibanding dengan tanaman yang berapa pada media yang mengandung logam. BAB IV HASIL PENELITIAN DAN PEMBAHASAN A. Hasil Penelitian 1. Uji Toleransi Logam Cu Hasil penelitian uji toleransi tanaman tembakau (Nicotiana tabacum L.) terhadap cekaman tembaga (Cu) pada parameter pengamatan pertambahan panjang, pertambahan jumlah akar, akumulasi logam, hasil uji anava satu jalan, dan uji BNT disajikan pada Tabel 11-17. Tabel 11. Rerata panjang akar tembakau yang dicekam oleh logam Cu Konsentrasi Cu (µM) 0 50 100 150 200 Jumlah total Rata-rata total Pertambahan panjang akar (ulangan) 1 2 3 4 5 6 7 10 4 20 8 5 7 9 6 6 5 7 5 6 0 0 2 5 7 3 0 1 4 4 Jumlah Rata-rata 47 35 29 14 12 137 9.4 7.0 5.8 2.8 2.4 5.48 Data pada Tabel 11 menunjukkan bahwa pertambahan panjang akar cenderung semakin kecil seiring bertambahnya konsentrasi Cu dalam larutan media. Oleh karena itu untuk mengetahui ada tidaknya pengaruh Cu terhadap pertambahan panjang akar data diuji dengan anava satu jalan (Tabel 12). Tabel 12. Hasil uji anava satu jalan pengaruh konsentrasi cekaman Cu terhadap pertambahan panjang akar tanaman tembakau Sumber Jumlah Keragaman Kuadrat Perlakuan 172.24 Galat 224.00 Umum 396.24 Derajat bebas 4 20 24 Kuadrat Tengah 43.06 11.20 F Hitung 3.844* F tabel 5% 2.87 * berbedasignifikan pada taraf 5% Tabel 12 menyajikan data yang menunjukkan bahwa konsentrasi Cu berpengaruh signifikan terhadap pertambahan panjang akar tanaman tembakau 25 26 pada p<0.05. Selanjutnya dilakukan uji BNT untuk mengetahui konsentrasi manakah yang berbeda nyata dengan kontrol, hasil uji BNT disajikan pada Tabel 13. Tabel 13. Hasil uji BNT pengaruh berbagai konsentrasi cekaman Cu terhadap pertambahan panjang akar tembakau Konsentrasi Cu ( µM) 0 50 100 150 200 Rerata panjang akar 9.4a 7.0a 5.8a 2.8b 2.4b *Angka yang dibuktikan oleh huruf yang berbeda pada kolom yang sama berarti berbeda signifikan dengan kontrol pada uji BNT α=0,05 Data uji BNT menunjukkan bahwa rerata pertambahan panjang akar pada konsentrasi 150 µM dan konsentrasi 200 µM Cu berbeda signifikan pada taraf 5 % dengan konsentrasi 0 µM. Di sisi lain pertambahan panjang akar pada konsentrasi 50 µM Cu dan 100 µM Cu tidak berbeda nyata dengan konsentrasi 0 µM (Tabel 13). Tabel 14. Rerata pertambahan jumlah akar tanaman tembakau yang dicekam oleh logam Cu Konsentrasi Cu (µM) 0 50 100 150 200 Jumlah total Rataan total Pertambahan jumlah akar (ulangan) 1 2 3 4 5 1 3 9 8 4 3 4 5 4 7 8 0 4 6 4 1 4 6 0 7 2 1 2 3 2 Jumlah Rata-rata 25 23 22 18 10 98 5.0 4.6 4.4 3.6 2.0 3.92 Rekapitulasi rerata pertambahan jumlah akar pada Tabel 14 menunjukkan bahwa tidak adanya konsistensi pengaruh konsentrasi Cu terhadap penurunan jumlah akar. Oleh karena itu analisis anava satu jalan dilakukan untuk mengetahui ada tidaknya pengaruh Cu terhadap pertambahan jumlah akar (Tabel 15). 27 Tabel 15. Hasil uji anava pengaruh konsentrasi cekaman Cu terhadap pertambahan jumlah akar tanaman tembakau Sumber Keragaman Perlakuan Galat Umum tn Jumlah Kuadrat 28.240 129.600 157.840 Derajat bebas 4 20 24 Kuadrat Tengah 7.060 6.480 F tabel F Hitung 5% tn 1.090 2.87 tidak berbeda signifikan Uji anava satu jalan menunjukkan bahwa konsentrasi Cu tidak berpengaruh signifikan terhadap pertambahan jumlah akar tanaman tembakau pada level p<0.05 (Tabel 15). Tabel 16. Akumulasi logam Cu pada akar tanaman tembakau dengan metode AAS (Atomic Absorbance Spectrophotometry). Konsentrasi Cu (µM) Kadar Cu (µg/g) 0 tdk terdeteksi 50 tdk terdeteksi 100 0.206209 150 0.344913 200 3.453577 Tabel 16 menyajikan data akumulasi Cu pada akar tembakau. Akumulasi Cu positif ditemukan pada konsentrasi 100 µM, 150 µM, dan 200 µM Cu. Pada konsentrasi 0 µM dan 50 µM tidak ditemukan akumulasi Cu. Data tersebut memperlihatkan hubungan linear antara konsentrasi Cu dengan kadar Cu dalam akar, semakin tinggi konsentrasi Cu semakin besar kandungan Cu yang dideteksi di dalam akar. Tabel 17. Hasil pengamatan kualitatif pada daun dan akar semaian tembakau pada cekaman Cu Parameter 0 +++ ++ 50 +++ ++ Konsentrasi (µM) 100 150 +++ +++ ++ ++ Warna Daun Tekstur akar Keterangan: Warna daun : hijau (+++) dan hijau kekuningan (++) Tekstur akar: keras (+++) dan keras cenderung lunak (++) 200 +++ ++ Tabel 17 menunjukkan bahwa tidak ada perbedaan warna daun dan tekstur akar yang signifikan pada kontrol dan perlakuan.Oleh karena itu dapat 28 disimpulkan bahwa cekaman Cu pada penelitian ini tidak menyebabkan klorosis. Gambar 4. Perbandingan morfologi akar semaian Nicotiana tabacum L. pada cekaman Cu dengan konsentrasi a) 0 µM (Bar = 8 mm), b) 50 µM (Bar = 5 mm), c) 100 µM (Bar = 8 mm), d) 150 µM (Bar = 7 mm), dan e) 200 µM (Bar = 4 mm). Gambar 5. Perbandingan warna daun semaian Nicotiana tabacum L. pada cekaman Cu dengan konsentrasi a) 0 µM, b) 50 µM, c) 100 µM, d) 150 µM, dan e) 200 µM. Bar = 10 mm. Keterangan : Index warna daun: 1 (20,1 mg/l), 2 (25,8 mg/l), 3 (31,8 mg/l), 4 (36,2 mg/l), 5 (40,3 mg/l) dan 6 (44,8 mg/l). Satuan mg/l menunjunkan jumlah nitrogen yang dibutuhkan S S S S S Gambar 6. Anatomi membujur akar (perbesaran 40x) Nicotiana tabacum L. pada cekaman Cu dengan pewarna methylen blue. a) 0 µM, b) 50 µM, c) 100 µM, d) 150 µM, dan e) 200 µM. 29 Gambar 6 menunjukkan adanya deposit Cu (Cu, panah) pada silinder pusat (S, panah) pada zona elongasi akar semaian Nicotiana tabacum L. setelah 14 hari perlakuan dengan kosentrasi Cu; 100 µM, 150 µM, dan 200 µM. Logam Cu terdeteksi dengan pewarnaan menggunakan methylen blue, pada konsentrasi 150 µM dan 200 µM terdapat timbunan berkas berwarna terang di antara sel-sel meristematik. 2. Uji Toleransi Logam Cd Hasil penelitian uji toleransi tanaman tembakau terhadap cekaman kadmium (Cd) pada parameter pengamatan pertambahan panjang, pertambahan jumlah akar, akumulasi logam, dan hasil uji anava satu jalan dan uji BNT disajikan pada Tabel 18-24. Tabel 18. Rerata panjang akar tembakau yang dicekam oleh logam Cd Konsentrasi Cd (µM) Pertambahan panjang akar (ulangan) 1 2 3 4 5 17 7 6 9 6 5 3 4 4 6 5 4 3 4 4 4 4 4 2 3 0 2 9 6 1 Jumlah Rata-rata 0 45 50 22 100 20 200 17 300 18 Jumlah total 122 Rata-rata total Tabel 18 menyajikan data yang menunjukkan bahwa 9.0 4.4 4.0 3.4 3.6 4.88 pertambahan panjang akar cenderung semakin menurun seiring bertambahnya konsentrasi Cd dalam larutan media. Selanjutnya untuk mengetahui ada tidaknya pengaruh Cd maka data diuji dengan analisis anava satu jalan (Tabel 19). Tabel 19. Hasil uji anava pengaruh konsentrasi cekaman Cd terhadap panjang akar tanaman tembakau Sumber Keragaman Perlakuan Galat Umum Jumlah Kuadrat 109.04 153.60 262.64 * berbeda signifikan pada taraf 5% Derajat bebas 4 20 24 Kuadrat Tengah 27.26 7.68 F F tabel Hitung 5% 3.55* 2.87 30 Hasil anava satu jalan pada Tabel 19 menunjukkan bahwa konsentrasi Cd berpengaruh signifikan terhadap panjang akar tanaman tembakau pada level p<0.05. Dengan demikian untuk mengetahui konsentrasi manakah yang berbeda nyata dengan kontrol perlu dilakukan uji BNT yang hasilnya disajikan pada Tabel 20. Tabel 20. Hasil uji BNT pengaruh berbagai konsentrasi cekaman Cd terhadap pertambahan panjang akar tembakau Konsentrasi Cd Rerata panjang (µM) akar 0 9.0a 50 4.4b 100 4.0b 200 3.4b 300 3.6b Angka yang dibuktikan oleh huruf yang berbeda pada kolom yang sama berarti berbeda signifikan dengan kontrol pada uji BNT α=0,05 Hasil uji BNT menunjukkan bahwa rerata panjang akar pada semua konsentrasi Cd yaitu; 50 µM Cd, 100 µM Cd, 200 µM Cd, dan 300 µM berbeda nyata pada taraf 5% dengan konsentrasi 0 µM (Tabel 20). Tabel 21. Rerata pertambahan jumlah akar tanaman tembakau yang dicekam oleh logam Cd Pertambahan jumlah Konsentrasi akar (ulangan) Jumlah Rata-rata Cd (µM) 1 2 3 4 5 0 16 7 5 9 5 42 8.4 50 5 5 3 6 4 23 4.6 100 7 12 4 8 8 39 7.8 200 7 13 10 8 3 41 8.2 300 8 2 3 8 8 29 5.8 Jumlah total 174 Rata-rata total 6.79 Data pada Tabel 21 menyajikan rekapitulasi rerata pertambahan akar pada cekaman. Data selanjutnya diuji dengan analisis anava satu jalan untuk mengetahui ada tidaknya pengaruh Cd terhadap pertambahan jumlah akar (Tabel 22). 31 Tabel 22. Hasil uji anava pengaruh konsentrasi cekaman Cd terhadap pertambahan jumlah akar semaian tanaman tembakau. Sumber Keragaman Perlakuan Galat Umum Jumlah Kuadrat 56.160 212.800 268.960 Derajat bebas 4 20 24 Kuadrat Tengah 14.040 10.640 F Hitung 1.320tn F tabel 5% 2.87 tn tidak signifikan pada taraf 5% Hasil uji anava satu jalan menunjukkan bahwa konsentrasi Cd tidak berpengaruh signifikan terhadap pertambahan jumlah akar tanaman tembakau pada p<0.05 (Tabel 22). Tabel 23. Akumulasi logam Cd pada akar tanaman tembakau dengan metode AAS (Atomic Absorbance Spectroscopy). Konsentrasi Cd (µM) Kadar Cd (µg/g) 0 50 100 200 300 Tidak terdeteksi Tidak terdeteksi 0.72164 18.860594 8.310196 Tabel 23 menunjukkan bahwa logam Cd ditemukan di setiap sampel pada konsentrasi 50, 100, 200 dan 300 µM. Adapun kandungan kadmium terbesar ditemukan pada konsentrasi 200 µM Cd dan terendah pada konsentrasi 0 µM. Tabel 24. Hasil pengamatan kualitatif pada daun dan akar semaian tembakau pada cekaman Cd Parameter 0 +++ +++ 50 ++ ++ Konsentrasi (µM) 100 200 ++ ++ ++ + Warna daun Tekstur akar Keterangan: Warna daun: hijau (+++) dan hijau kekuningan (++) Tekstur akar : keras (+++) dan keras cenderung lunak (++) 300 ++ + Tabel 24 menunjukkan bahwa terdapat perbedaan warna daun dan tekstur akar yang signifikan pada kontrol dan perlakuan.Klorosis pada daun 32 mulai terlihat pada konsentrasi 50µM dan tidak terlihat pada kontrol. Semakin tinggi konsentrasi Cd, tekstur akar semakin lunak. Gambar 7. Perbandingan morfologi akar semaian Nicotiana tabacum L. pada cekaman Cd dengan konsentrasi a) 0 µM, b) 50 µM, c) 100 µM, d) 200 µM, dan e) 200 µM. Bar: 10 mm. a Gambar 8. b c d e Perbandingan warna daun semaian Nicotiana tabacum L. pada cekaman Cd dengan konsentrasi a) 0 µM, b) 50 µM, c) 100 µM, d) 200 µM, dan e) 200 µM Keterangan : Index warna daun 1 (20,1 mg/l), 2 (25,8 mg/l), 3 (31,8 mg/l), 4 (36,2 mg/l), 5 (40,3 mg/l) dan 6 (44,8 mg/l). Satuan mg/l menunjukkan jumlah nitrogen yang dibutuhkan e a b Gambar 9. Anatomi membujur akar (perbesaran 4x10) Nicotiana tabacum L. pada cekaman Cd dengan pewarna hematoxylin. a) 0 µM, b) 50 µM, c) 100 µM, d) 200 µM, dan e) 300 µM. d 33 Gambar 9 menunjukkan adanya deposit Cd (tanda panah) pada silinder pusat (C) pada zona elongasi akar semaian Nicotiana tabacum L. setelah 14 hari pemaparan logam Cd dengan konsentrasi;50µM, 100 µM, 200 µM, dan 300 µM. Pada konsentrasi 200 µM dan 300 µM terdapat timbunan debris sel akar yang mati di sekitar akar. 3. Uji Toleransi Logam Pb Hasil penelitian uji toleransi tanaman tembakau (Nicotiana tabacum L) terhadap cekaman timbal (Pb) pada parameter pertambahan panjang akar, pertambahan jumlah akar, akumulasi logam dan uji anava satu jalan dan BNT Tabel 25-31. Tabel 25. Rerata pertambahan panjang akar tembakau yang dicekam oleh logam Pb. Konsentrasi Pertambahan panjang Akar Pb (µM) 1 2 (Ulangan) 3 4 5 0 10 11 15 8 14 5 8 17 9 9 8 20 16 3 0 3 2 50 1 6 4 2 4 100 3 5 2 2 3 Jumlah total Rata-rata total Jumlah Rataan 58 51 24 17 15 165 11.6 10.2 4.8 3.4 3.0 6.6 Tabel 25 menunjukkan adanya pengaruh konsentrasi Pb terhadap pertambahan panjang akar. Pertambahan panjang menurun seiring bertambahnya konsentrasi Pb dalam larutan media. Data selanjutnya diuji dengan analisis anava satu jalan untuk mengetahui ada tidaknya pengaruh Pb terhadap pertambahan panjang akar (Tabel 26). Tabel 26. Hasil uji anava satu jalan pengaruh konsentrasi cekaman Cu terhadap pertambahan panjang akar tanaman tembakau. Sumber Keragaman Perlakuan Galat Umum Jumlah Kuadrat 322 276 598 Derajat bebas 4 20 24 **berbeda sangat signifikan pada taraf 1% Kuadrat F Tengah Hitung 80.5 5.833** 13.8 F tabel 1% 4.43 34 Hasil uji anava satu jalan menunjukkan bahwa konsentrasi Pb berpengaruh sangat signifikan terhadap pertambahan panjang akar tanaman tembakau pada level p<0.01 (Tabel 26). Dengan demikian untuk mengetahui konsentrasi manakah yang berbeda nyata dengan kontrol perlu dilakukann uji BNT yang disajikan pada Tabel 27. Tabel 27. Hasil uji BNT pengaruh berbagai konsentrasi cekaman Pb terhadap pertambahan jumlah akar tembakau Konsentrasi Pb (µM) 0 5 20 50 100 Rerata panjang akar 11.6 a 10.2 a 4.8b 3.4b 3.0b Angka yang dibuktikan oleh huruf yang berbeda pada kolom yang sama berarti berbeda signifikan dengan kontrol pada uji BNT α=0,05 Hasil uji BNT pada Tabel 27 yaitu hasil uji lanjut BNT menunjukkan bahwa rerata panjang akar pada konsentrasi Pb yaitu; 20 µM Pb, 50 µM Pb, dan 100 µM Pb berbeda nyata dengan konsentrasi 0 µM pada taraf 5%. Pada konsentrasi 5 µM Pb tidak berbeda nyata dengan kontrol. Tabel 28. Rerata pertambahan jumlah akar tanaman tembakau yang dicekam oleh logam Pb Konsentrasi (µM) Pertambahan jumlah akar (Ulangan) 1 2 3 4 5 8 7 10 7 5 7 3 5 3 6 5 2 3 1 4 3 1 6 4 4 1 2 3 1 3 Jumlah Rata-rata 0 37 7.4 5 24 4.8 20 15 3.0 50 18 3.6 100 10 2.0 Jumlah total 104 Rata-rata total 4.16 Tabel 28 menunjukkan bahwa konsentrasi Pb secara signifikan menyebabkan menurunnya pertambahan jumlah akar. Selanjutnya untuk mengetahui ada tidaknya pengaruh Pb maka data diuji dengan analisis anava satu jalan (Tabel 29). 35 Tabel 29. Hasil uji anava pengaruh konsentrasi cekaman Pb terhadap pertambahan jumlah akar tembakau Sumber Keragaman Jumlah Derajat Kuadrat F F tabel Kuadrat bebas Tengah Hitung 1% Perlakuan 86.160 4 21.540 8.098** 4.43 Galat 53.200 20 2.660 Umum 139.360 24 ** berbeda sangat signifikan pada taraf 1% Tabel 29 menyajikan hasil anava satu jalan yang menunjukkan bahwa konsentrasi Pb berpengaruh sangat signifikan terhadap pertambahan jumlah akar tanaman tembakau pada level p<0.01. Dengan demikian untuk mengetahui konsentrasi manakah yang berbeda nyata dengan kontrol perlu dilakukannya uji BNT yang disajikan pada Tabel 30. Tabel 30. Hasil uji BNT pengaruh berbagai konsentrasi cekaman Pb terhadap pertambahan jumlah akar tembakau Konsentrasi Pb (µM) 0 5 20 50 100 Rerata jumlah akar 7.4 a 4.8b 3.0 bc 3.6 bc 2.0c Angka yang dibuktikan oleh huruf yang berbeda pada kolom yang sama berarti berbeda signifikan dengan kontrol pada uji BNT α=0,05 Hasil uji lanjut BNT pada Tabel 30 menunjukkan bahwa rerata pertambahan jumlah akar pada semua konsentrasi Pb yaitu; 5 µM Pb, 20 µM Pb, 50 µM Pb, dan 100 µM Pb berbeda nyata dengan konsentrasi 0 µM pada taraf 5%. 36 Tabel 31. Akumulasi logam Pb pada akar tanaman tembakau dengan metode AAS (Atomic Absorbance Spectophotometry). Konsentrasi Pb (µM) 0 5 20 50 100 Kadar Pb (µg/g) Tidak terdeteksi Tidak terdeteksi Tidak terdeteksi Tidak terdeteksi 0.02392 Tabel 31 menunjukan bahwa akumulasi timbal hanya pada kosentrasi 100 µM (0.02392 µg/g). Pada konsentrasi lain tidak ditemukan adanya deposit timbal dalam sampel. Tabel 32. Hasil pengamatan kualitatif pada daun dan akar semaian pada cekaman Pb. Konsentrasi (µM) Parameter 0 5 20 50 100 Warna daun +++ +++ +++ +++ ++ Tekstur akar +++ +++ +++ ++ ++ Keterangan: Warna daun: hijau (+++) dan hijau kekuningan (++) Tekstur akar : keras (+++) dan keras cenderung lunak (++) Tabel 32 menunjukkan bahwa terdapat perbedaan warna daun dan tekstur akar pada kontrol dan perlakuan. Klorosis pada daun terlihat pada konsentrasi 100µM dan tidak terlihat pada kontrol. Semakin tinggi konsentrasi Pb maka tekstur akar semakin lunak. Gambar 10. Perbandingan morfologi akar semaian Nicotiana tabacum L. pada cekaman Pb dengan konsentrasi a) 0 µM, b) 5 µM, c) 20 µM, d) 50 µM, dan e) 100 µM. Bar: 10 mm. 37 Gambar 11. Perbandingan warna daun Nicotiana tabacum L. pada cekaman Pb dengan konsentrasi a) 0 µM, b) 5 µM, c) 20 µM, d) 50 µM, dan e) 100 µM. Keterangan : Index warna daun 1 (20,1 mg/l), 2 (25,8 mg/l), 3 (31,8 mg/l), 4 (36,2 mg/l), 5 (40,3 mg/l) dan 6 (44,8 mg/l). Satuan mg/l menunjukkan jumlah nitrogen yang dibutuhkan S, Pb S S,Pb S,Pb S a b c d e Gambar 12. Perbandingan anatomi akar semaian Nicotiana tabacum L. pada cekaman Pb dengan konsentrasi a) 0 µM, b) 5 µM, c) 20 µM, d) 50 µM, dan e) 100 µM Gambar 12 menunjukkan adanya deposit Pb (Pb, panah) pada silinder pusat (S,panah) pada zona elongasi akar semaianNicotiana tabacum L. yang dicekam pada konsentrasi 20, 50, dan 100 µM. Akumulasi Pb ditunjukkan adanya penimbunan pewarna crystal violet sepanjang daerah pengangkut akar. 38 B. Pembahasan 1. Pengaruh Cekaman Cu, Cd dan Pb terhadap Pertumbuhan Akar Pada penelitian ini parameter pertambahan panjang dan jumlah akar masing-masing cekaman logam menunjukkan respon yang berbeda. Cekaman Cu dan Cd menghambat pertambahan panjang akar (Tabel 12 & 19), namun tidak berpengaruh pada pertambahan jumlah akar (Tabel 15 & 22). Sedangkan cekaman Pb menghambat pertambahan jumlah dan panjang akar (Tabel 26 & 28). Pada dasarnya hasil penelitian menunjukkan bahwa kehadiran logam berat dalam media tanam mampu menghambat pertumbuhan akar. Pada cekaman Cu pertambahan panjang akar terhambat sedangkan pertambahan jumlah akar tidak terhambat dan tidak ada hambatan signifikan pada bagian daun dan batang (aerial part) seperti klorosis dan sebagainya. Hal ini menunjukkan bahwa Cu sebenarnya tidak mempunyai tingkat toksisitas yang tinggi terhadap tanaman karena Cu adalah salah satu mikronutrien yang dibutuhkan oleh tumbuhan. Namun, meskipun Cu merupakan bagian dari komponen mikronutrien bukan berarti kehadiran Cu tidak menghambat pertumbuhan. Kehadiran Cu pada konsentrasi yang tinggi menyebabkan gangguan antara lain yaitu peningkatan permeabilitas plasmalema (Arduini et al. 1995) sehingga meningkatkan akumulasi Cu dalam sel. Peningkatan absorbsi Cu menyebabkan mengendurnya ikatan penyusun membran sel seperti fosfolipid, protein, oligosakarida dan glikolipid.Pernyataan tersebut didukung oleh Fry et al. (2002) yang menyebutkan bahwa Cu menyebabkan rusaknya dinding sel sehingga menyebabkan membran sel rusak. Semakin banyak kerusakan membran sel maka semakin rendah kemampuan sel untuk menyeleksi mineral yang akan diserap. Konsentrasi Cu yang tinggi menyebabkan kompetisi antar mineral, dengan banyaknya Cu yang diakumulasi oleh sel akar maka penyerapan elemen esensial seperti Ca, Fe dan Mg yang diperlukan tanaman semakin terhambat. Pada akhirnya metabolisme sel akar terganggu sehingga pertambahan panjang akar terhambat. Pertambahan panjang akar pada konsentrasi 150 dan 200 µM berbeda nyata dengan kontrol pada taraf 5% sedangkan konsentrasi 50 dan 100 µM 39 tidak berbeda nyata. Hal ini terjadi karena semakin tinggi konsentrasi Cu dalam media semakin banyak Cu diserap oleh akar, akan tetapi respon tanaman dipengaruhi pula oleh adanya mekanisme pertahanan terhadap cekaman logam. Dengan kata lain konsentrasi 50 dan 100 µM mampu ditoleransi oleh tembakau. Pada konsentrasi yang lebih tinggi, penyerapan Cu lebih besar sehingga efek toksik lebih terlihat. Akibat cekaman Cu, mineral penting seperti Ca, K, P, dan Mn konsentrasinya menurun (Lequex et al. 2010). Gangguan penyerapan mineral akibat cekaman Cu terjadi pada Zea mays (Jiang et al. 2001), dijelaskan pula bahwa cekaman Cu menyebabkan beberapa hambatan pada pembelahan sel seperti patahnya kromosom, terjadinya mitosis-c, dan terbentuknya jembatan anafase. Abnormalitas tersebut disebabkan karena calmodulin (CaM) tidak mampu mengaktifkan enzim Ca-ATPase sehingga mempengaruhi integritas nukleolus. Berkurangnya Ca disebabkan oleh menurunnya selektivitas membran sel yang kemudian mempengaruhi konsentrasi Ca dalam sel, ion Cu pada konsentrasi tinggi cenderung menggantikan Ca pada situs pertukaran ion (Jiang et al. 2001). Intervensi tersebut kemudian mempengaruhi metabolisme sel sehingga menghambat pertambahan panjang akar. Pada parameter pertambahan jumlah akar Nicotiana tabacum L. cekaman Cu tidak berpengaruh signifikan (Tabel 15). Tidak bertambahnya jumlah akar dimungkinkan karena peran Cu sebagai mikronutrien yang dibutuhkan tanaman dan rendahnya respon inisiasi akar baru dibanding dengan respon elongasi akar terhadap cekaman Cu (Arduini et al. 1995). Dalam penelitian ini dijelaskan bahwa inisiasi akar baru dan akar lateral semaian Pinus pinaster tidak dipengaruhi oleh cekaman Cu. Fenomena serupa ditemukan oleh Mahmood et al. (2007) yang menyatakan bahwa konsentrasi Cu tidak berpengaruh terhadap jumlah akar. Terbentuknya akar baru dan akar lateral pada tembakauumumnya berada pada zona diferensiasi dibandingkan dengan zona elongasi yang berdekatan dengan tudung akar sehingga tidak sepenuhnya terganggu oleh cekaman logam. Meskipun demikian Lequex et al. (2010) menemukan bahwa konsentrasi Cu menyebabkan terganggunya 40 regulasi hormon pengatur tumbuh yakni menyebabkan produksi sitokinin yang berlebihan pada tudung akar sehingga mengganggu aktivitas mitotik dalam akar yang menyebabkan pembentukan akar baru dan pemanjangan akar terhambat. Hasil serupa terdapat pada cekaman Cd yaitu pertambahan panjang akar berbeda signifikan (Tabel 19) akan tetapi pertambahan jumlah akar tidak berbeda signifikan (Tabel 22). Mineral Cd tidak memiliki fungsi biologis sehingga bersifat toksik bagi makhluk hidup meskipun pada konsentrasi yang rendah. Pada penelitian ini, semakin besar konsentrasi Cd dalam media semakin sedikit pertambahan panjang akar. Terhambatnya pertumbuhan akar ini disebabkan oleh absorbsi Cd pada daerah akar. Pada uji BNT pertambahan panjang akar, hasil pemaparan Cd berbeda nyata dengan kontrol pada taraf 5%. Pada sampel kontrol terjadi pertambahan panjang akar maksimum karena sel-sel akar tidak mengalami keracunan. Pada tanaman, Cd2+ diserap oleh akar melalui jalur simplas atau apoplas. Secara fisiologis, cekaman Cd mempengaruhi keseimbangan kadar makronutrien dan mikronutrien dalam tumbuhan karena Cd mampu diikat oleh transporter mineral mikronutrien seperti ZIP (Zinc transporter) yang menyebabkan penyerapan mineral menjadi berkurang. Secara in vitro Goncalves et al (2009) membuktikan bahwa kehadiran Cd dalam media mampu mempengaruhi keseimbangan kadar makronutrien dan mikronutrien. Hal ini terjadi karena konsentrasi ion Cd yang melimpah pada media menyebabkan adanya kompetisi antar ion baik secara eksternal maupun internal. Pada level sitologis kehadiran Cd menyebabkan beberapa abnormalitas seperti patahnya kromosom, terbentuknya jembatan anafase dan lainnya (Zou et al. 2012). Gangguan sitologis tersebut pada akhirnya mempengaruhi pembelahan dan elongasi sel. Akan tetapi gangguan ini sangat tergantung dengan tinggi rendahnya konsentrasi Cd dan respon akar terhadap cekaman tersebut.Ion Cd yang diserap sel akar dibawa oleh pengikat logam divalen atau melalui kanal ion bahkan diikat oleh fitokelatin (Shen et al. 2012). Sebagai bentuk pertahanan, ion Cd disimpan dalam vakuola oleh transporter pengikat- 41 ATP (Cobbet 2000). Penggunaan transporter bermuatan ATP menyebabkan tumbuhan kekurangan energi aktif, sehingga dibutuhkan waktu yang lebih lama untuk melakukan pembelahan sel. Alasan tersebut pula yang menjelaskan mengapa cekaman Cd mempengaruhi pertambahan panjang dan jumlah akar. Pada parameter jumlah akar, Cd tidak menyebabkan terhambatnya pertambahan jumlah akar. Hal ini dimungkinkan karena umumnya pemaparan logam berat seperti Cd, Cu, Fe dan Zn mampu meningkatkan kadar etilen dalam sel sebagai bentuk pertahanan (Manara 2012). Dengan demikian munculnya akar baru tidak terganggu secara signifikan. Selain itu mekanisme pertahanan tanaman tehadap Cd menjadi salah satu faktor tidak terhambatnya mengapa pertambahan jumlah akar. Secara alami tembakau mampu memproduksi peptida kelator logam seperti fitokelatin dan methalotheionin (Krystofova et al. 2012) meskipun dengan jumlah yang terbatas. Peptida tersebut digunakan oleh tanaman sebagai mekanisme pertahanan sehingga tidak semua aktivitas fisiologis terganggu. Uji toleransi yang terakhir yaitu cekaman Pb. Pada uji ini, baik parameter panjang akar (Tabel 26) dan jumlah akar ( Tabel 28) menunjukkan perbedaan yang signifikan antar perlakuan sehingga dapat disimpulkan bahwa cekaman Pb menghambat pertumbuhan akar. Secara umum, Pb yang dikategorikan sebagai logam berat tidak memiliki fungsi biologis bagi tumbuhan. Dengan demikian tumbuhan tidak memiliki enzim, transporter atau mekanisme tertentu untuk memanfaatkan Pb. Oleh karena itu Pb diserap dengan menggunakan transporter mineral lain sehingga memblokir penyerapan mineral penting yang pada akhirnya mempengaruhi pertumbuhan akar. Penyerapan ion penting yang dibutuhkan tanaman seperti Ca2+ terhambat. Penghambatan ini berhubungan erat dengan perebutan transporter antara Ca2+ dan Pb2+.Berkurangnya Ca2+ dalam akar menyebabkan terganggunya metabolisme sel sehingga menghambat pembelahan sel akar dan pemanjangan sel. Pada studi-studi sebelumnya Pb berperan dalam penurunan pertumbuhan akar dan tunas yang disebabkan oleh penurunan pembelahan sel, 42 fotosintesis, dan sintesis protein (Sharma &Dubey 2005). Pada konsentrasi yang tinggi, kehadiran Pb menyebabkan munculnya akar lateral terhambat karena hilangnya dominansi apikal (Kopittke et al. 2007). Pernyataan ini menjelaskan mengapa Pb menghambat pertambahan jumlah akar Nicotiana tabacum L. Uji BNT menunjukkan pertambahan panjang akar pada konsentrasi 0µM dan konsentrasi 5µM tidak berbeda nyata sedangkan konsentrasi lainnya berbeda nyata pada taraf 5% dengan kontrol (Tabel 30). Hal ini dimungkinkan karena rendahnya konsentrasi Pb dalam media.Konsentrasi yang rendah menyebabkan penyerapan Pb yang tidak signifikan. Penyebab lain yaitu tumbuhan mampu mempertahankan diri dari cekaman Pb. Mekanisme pertahanan terhadap cekaman Pb ditunjukkan oleh Gelliche et al. (2012) bahwa Medicago sativa mampu beradaptasi dengan memproduksi lapisan lilin untuk menghindari hilangnya kadar air akibat cekaman Pb. Mekanisme pertahanan lainnya seperti produksi enzim untuk meminimalisir efek toksik Pb dikemukakan oleh Cheng (2003). Di sisi lain, perbedaan yang signifikan ditunjukkan oleh akar pada konsentrasi terbesar yaitu 100 µM. Hasil serupa dikemukakan oleh Al Khatib et al. (2011) yang menyatakan bahwa efek toksik terhadap pertumbuhan akar terlihat secara makro pada konsentrasi >100 µM. Efek toksik tersebut tidak hanya ditemukan pada daerah akar tetapi pada daerah batang dan daun. Gejala yang ditemukan umumnya adalah klorosis. Ketiga kontrol Cu, Cd, dan Pb pada media tanpa logam menunjukkan hasil yang tidak seragam. Hal ini mungkin terjadi karena faktor endogen seperti sintesis hormone masing-masing unit sampel yang berbeda. Perubahan kondisi eksogen seperti suhu, cahaya merupakan faktor yang mungkin mempengaruhi respon sampel. Meskipun demikian, data menunjukkan kecenderungan yang sama yakni kontrol mempunyai pertambahan panjang dan jumlah akar yang paling besar. Pada dasarnya akar sebagai bagian tumbuhan yang bertugas menyerap mineral memiliki beberapa mekanisme pertahanan. Salah satu respon awal tanaman dalam mempertahankan kondisi homeostatis pada saat cekaman 43 logam ialah deposit logam dalam jaringan akar. Pada tingkat morfologis, akar memiliki lapisan luar akar dan tudung akar yang berfungsi mencegah masuknya mineral atau ion yang tidak dibutuhkan ke dalam jaringan. Sedangkan pada tingkat seluler, tumbuhan mempunyai beberapa mekanisme perlindungan terhadap cekaman logam berat antara lain: 1) Aktivasi antioksidan, baik secara enzimatik (katalase, peroksidase, superoksida dismutase) dan non-enzimatik (tokoferol, karotenoid, polyfenol) (Cheng 2003); 2.) Meningkatkan produksi senyawa organik seperti malat dan sitrat sebagai respon cekaman air oleh logam berat Buchanan et al 2000); 3.) Terjadi perubahan fisio-kemikal pada dinding sel dan membran plasma (Manara 2012); 4. Berubahnya proses fisiologis seperti level fitohormon (Manara 2012); 5). Sintesis peptide pengikat logam dan beberapa protein seperti gluthatione (GSH), fitokelatin dan protein identik metalothionein (Garg & Singla2011). Hal ini menjelaskan bahwa pada dasarnya respon tumbuhan tidaklah seragam sehingga beberapa aktivitas fisiologis terganggu, namun tumbuhan masih mampu bertahan hidup. Meskipun demikian, aktif tidaknya mekanisme pertahanan sangat bergantung pada spesies tumbuhan dan banyaknya konsentrasi logam dalam media tanam (Cobbet 2000). 2. Akumulasi Cu, Cd dan Pb dalam semaian tembakau (Nicotiana tabacum L.) dan anatomi akar Mineral yang terdapat pada media baik yang esensial maupun non esensial akan diserap tanaman dan ditranslokasi dari bagian akar (root) menuju bagian tajuk (shoot). Mekanisme inilah yang kemudian menjadi awal mula efek toksik cekaman logam. Beberapa penelitian sebelumnya telah menemukan bahwa terdapat tiga tahapan mekanisme translokasi logam dalam tumbuhan. Mekanisme pertama adalah translokasi secara apoplas melalui ruang antar sel dan dinding sel luar membran plasma. Kedua yaitu translokasi simplas yang melalui protoplas yang terhubung terus menerus antar sitoplasma tanpa melibatkan organel sel (Redjala et al. 2009). Mekanisme yang ketiga melibatkan transporter khusus dalam sel termasuk di dalamnya 44 mekanisme pompa ion dan berbagai tipe transporter yang berbeda. Selain ketiga mekanisme tersebut, logam berat ditranslokasi melalui aliran transpirasi via xilem (air, kompleks pengkelat dan logam berat) menuju bagian tajuk (Krystofova et al. 2012). Pada penelitian ini uji AAS pada semua cekaman logam menunjukkan bahwa semakin besar konsentrasi logam maka semakin besar akumulasi logam ditemukan dalam akar kecuali pada cekaman Cd dimana akumulasi Cd pada konsentrasi 200 µM lebih besar dibanding dengan konsentrasi 300 µM. Hasil AAS menunjukkan bahwa akumulasi Cu positif ditemukan pada konsentrasi 100 µM, 150 µM dan 200 µM (Tabel 16) dan semakin tinggi konsentrasi logam semakin besar akumulasi Cu. Akumulasi terbesar ditemukan pada konsentrasi 200 µM dan tidak ditemukan akumulasi Cu pada kontrol. Cu merupakan merupakan mikronutrien yang dibutuhkan tumbuhan memiliki transporter khusus sehingga mudah diserap oleh tanaman. Menurut Buchanan et al. (2000) batas kandungan Cu yang dibutuhkan tanaman yaitu 6 µg/g berat kering tanaman. Pada penelitian ini ditemukan bahwa kandungan Cu terbesar yang ditemukan yaitu 3.4 µg/g. Dengan demikian akumulasi Cu berada di bawah ambang batas, hal ini berarti secara umum cekaman Cu pada penelitian ini masih mampu ditolerir oleh tembakau. Penyerapan logam dipengaruhi oleh faktor konsentrasi, hal ini sejalan dengan Szôllôsi et al. (2011) yang mengemukakan hasil AAS pada Brassica juncea menunjukkan bahwa semakin tinggi konsentrasi semakin besar akumulasi logam. Akan tetapi pada konsentrasi 50 µM tidak ditemukan akumulasi Cu, secara ilmiah seharusnya Cu ditemukan dalam akar karena Cu merupakan elemen yang dibutuhkan tumbuhan. Hal ini dimungkinkan karena rendahnya kandungan dalam akar sehingga tidak terdeteksi oleh AAS ataupun terjadi gangguan penyerapan logam. Pada pengamatan anatomis dan uji AAS, akumulasi Cd positif ditemukan pada konsentrasi 100 µM, 200 µM dan 300 µM (Tabel 23). Cd ditranspor secara simplas atau apoplas sehingga akumulasi dalam jaringan akar cukup signifikan (Nazar et al. 2012). Uji AAS menunjukkan bahwa 45 akumulasi terbesar Cd justru ditemukan pada konsentrasi 200 µM, akan tetapi baik konsentrasi 200 µM dan 300 µM menunjukkan gejala klorosis yang sama (Gambar 9). Adanya perbedaan hasil AAS menunjukkan bahwa besarnya konsentrasi bukanlah faktor mutlak penyerapan logam oleh akar. Perbedaan akumulasi dimungkinkan oleh beberapa faktor antara lain; kelarutan ion dan transportasi zat cair dalam sel. Kelarutan ion dipengaruhi oleh oleh beberapa hal seperti pH, temperatur, cahaya dan interaksi antar ion (Taiz & Zeiger 2010). Selain kelarutan, pengangkutan ion merupakan faktor penting yang menentukan translokasi dan pengangkutan ion. Selain itu konsentrasi ion, potensi kimia, potensi elektrik dan tekanan hydrostatik merupakan faktor lain pengangkutan ion (Taiz & Zeiger 2010). Dengan kata lain, perbedaan akumulasi dimungkinkan karena berubahnya salah satu faktor tersebut pada masa pemaparan. Cd larut dalam media pada pH < 7.Pada Kim et al. (2011) pH larutan berkisar 5.8, penelitian tersebut pula yang menjadi dasar penentuan pH pada penelitian ini. Akan tetapi semakin rendah pH pelarut penyerapan Cd semakin meningkat. Faktor lingkungan seperti pH dan temperatur pada percobaan ini telah diseragamkan, sehingga kemungkinan besar perbedaan penyerapan dipengaruhi oleh faktor internal seperti transportasi dan interaksi antar ion. Pada penelitian ini, hasil AAS menunjukkan bahwa akumulasi Pb hanya ditemukan pada konsentrasi terbesar yaitu 100 µM (Tabel 31). Hal ini sejalan dengan hasil pengamatan warna daun dimana hanya pada konsentrasi 100 µM ditemukan gejala klorosis. Hasil AAS ini dimungkinkan karena akumulasi yang sangat rendah di dalam akar sehingga tidak terdeteksi saat analisis. Penyebab lain yaitu adanya respon pertahanan pada saat tanaman dicekam oleh logam. Secara umum tumbuhan memiliki beberapa mekanisme pertahankan cekaman logam berat sebagai bentuk dari pertahanan tumbuhan antara lain (Cobbet 2000): 1) pengkelatan logam berat yang dilakukan dengan produksi peptida pengkelat logam seperti fitokelatin dan metalotheionin; 2) immobilisasi, dan 3) kompartementalisasi ion logam dalam vakuola. 46 Mekanisme tersebut memungkinkan tanaman untuk mempertahankan diri dari cekaman Pb. Pb yang sudah terlarut pada media cair dengan media siap absorbsi di serap dan di transport di jaringan pengangkut (xylem dan floem) secara apoplast (Sharma & Dubey 2005). Akan tetapi, penyerapan ion dipengaruhi oleh beberapa faktor yaitu kelarutan ion dan trasnportasi ion. Kelarutan ion dipengaruhi oleh oleh beberapa hal seperti pH, temperatur, cahaya dan interaksi antar ion (Taiz & Zeiger 2010). Selain kelarutan, pengangkutan ion merupakan faktor penting yang menentukan translokasi dan pengangkutan ion. Faktor lain seperti konsentrasi ion, potensi kimia, potensi elektrik dan tekanan hydrostatik merupakan faktor penentu pengangkutan ion (Taiz & Zeiger 2010). Oleh karena itu penyerapan Pb tidak hanya dipengaruhi oleh besarnya konsentrasi Pb. Secara umum pada uji AAS jumlah logam yang terdeteksi jauh lebih kecil dibandingkan dengan konsentrasi logam yang dilarutkan dalam media. Hal ini merujuk kepada dua indikasi yaitu penyerapan ion tidak optmal dan terjadinya proses detoksifikasi ion logam. Indikasi yang pertama yaitu optimal tidaknya penyerapan ion dipengaruhi dengan oleh banyak faktor seperti kelarutan ion, transportasi zat cair dalam sel dan lain-lain. Indikasi yang kedua yaitu adanya kemungkinan eksklusi ion logam melalui transpor aktif. Mekanisme ini merupakan bentuk adaptasi tumbuhan terhadap cekaman abiotik seperti cekaman salinitas (Taiz & Zeiger 2010). Ion-ion yang bersifat toksik terhadap enzim sitosol disimpan dalam vakuola, sehingga kalsium dalam sel berperan untuk meningkatkan selektivitas membrane terdapat ion toksik. Hal inilah yang diasumsikan menjadi penyebab rendahnya akumulasi logam dalam akar. Pada pengamatan anatomi, deposit Cu ditemukan pada daerah silinder pusat. Akumulasi yang ditemukan pada akar merupakan gejala utama toksisitas Cu pada akar yaitu penimbunan Cu pada floem. Selain itu gejala lignifikasi pada silinder pusat juga merupakan gejala keracunan utama Cu pada konsentrasi yang lebih tinggi. Pada penelitian ini, akumulasi methylen 47 bluepada silinder pusat disasumsikan sebagai gejala lignifikasi (Gambar 5). Polimerasi lignin dikatalisis oleh enzim peroksidase dan lakase yaitu glikoprotein yang mengandung Cu. Pada kondisi cekaman Cu, kedua enzim tersebut secara optimal mengkatalisis polimerasi lignin dalam jaringan (Quiroga et al. 2000). Lignifikasi akibat cekaman Cu telah ditemukan pada Nicotiana tabacum var Turkish oleh Lequex et al. (2010) dan juga ditemukan oleh Arduini et al. (1995) pada tanaman pinus. Terlepas dari ada tidaknya lignifikasi jaringan pengangkut, translokasi Cu melalui apoplas pada dinding sel menyebabkan penimbunan Cu. Akumulasi utama ditemukan pada jaringan pengangkut disebabkan oleh sifat xylem dan floem yang mampu menyerap ion bebas atau kompleks ion-transporter. Pada logam lain, deposit Cd nampak pada daerah silinder pusat. Mineral anorganik berasosiasi dengan pergerakan mineral organik dan ditransportasi oleh aliran transpirasi xylem atau oleh floem (Nazar et al. 2012). Pada preparat kontrol, silinder pusat nampak tidak terwarnai sehingga disimpulkan tidak ditemukan deposit Cd pada jaringan akar. Beberapa penelitian seperti Sriprang & Murooka (2007) menyebutkan bahwa ion Cd2+ dan komplek PC-Cd2+ ditranslokasi melalui xylem menuju batang dan daun. Proses translokasi ini dilakukan secara simplastik maupun apoplastik. Dengan demikian akumulasi Cd ditemukan pada jaringan pengangkut akar. Hasil serupa juga ditemukan oleh Ratheesh et al. (2010) yang menyatakan bahwa translokasi Cd ditemukan pada daerah stele dan jaringan pengangkut. Pada hasil pengamatan juga ditemukan beberapa gejala cekaman Cd seperti rusaknya jaringan pada akar. Rusaknya jaringan terlihat dari banyaknya debris disekitar akar, selain itu sel terlihat jelas dan kosong menunjukkan bahwa integritas sel telah rusak. Rusaknya sel diakibatkan cekaman Cd yang mengganggu metabolisme sel penyerapan hara essensial (Kurtyka et al. 2008). Kehadiran Cd juga secara signifikan mampu mengakibatkan terganggunya pembelahan sel dan aberasi kromosom, termasuk mitosis-c, patahnya kromosom dan kerusakan lainnya (Zou et al. 2012). Kajian tersebut membuktikan bahwa integritas sel terganggu oleh Cd. 48 Dengan demikian secara anatomis cekaman Cd tidak mampu ditoleran oleh akar tembakau. Berbeda dengan hasil AAS, hasil pengamatan anatomi menunjukan akumulasi Pb pada jaringan akar pada konsentrasi 20, 50 dan 100 µM. Hasil ini disimpulkan dari analisis kontras warna, jaringan pengangkut dan silinder pusat akar pada konsentrasi 100 µM berwarna kontras dengan sel pada daerah lain. Sedangkan akar pada konsentrasi lainnya tidak menunjukkan adanya kontras pewarna.Pb di translokasi pada tanaman oleh beberapa mekanism seperti simplas dan apoplas, maupun translokasi ion bebas. Analisis deposit Pb pada jaringan tumbuhan telah dilakukan pada beberapa studi sebelumnya dan membuktikan bahwa Pb ditemukan pada berbagai bagian seperti dinding sel, vakuola, retikulum dan organel lainnya (Kopittke et al. 2007; Ghelich et al. 2013). Deposit Pb pada jaringan pengangkut akar juga ditemukan oleh Ghelich et al. (2013) yang mengemukakan bahwa terjadi pembengkakan sel pada akar. Belum dapat dipastikan apakah dalam penelitian ini terjadi pembengkakan. Untuk mendapatkan gambaran yang lebih jelas pada penelitian terkait selanjutnya disarankan untuk menggunakan mikroskop elektron. 3. Pengaruh cekaman Cu, Cd dan Pb terhadap warna daun tembakau dan morfologi akar Pada cekaman Cu, tidak ditemukan perbedaan warna daun yang signifikan antar perlakuan (Gambar 4). Tidak adanya perbedaan warna daun dimungkinkan karena beberapa faktor antara lain; Cu berperan sebagai nutrien mikro karena Cu dibutuhkan sebagai komponen seperti plastosianin yang digunakan untuk beberapa aktivitas enzimatik dalam tumbuhan. Oleh karena itu Cu mempunyai transporter yang spesifik sehingga tidak perlu berkompetisi dengan mineral pembentuk klorofil. Selain itu, daya translokasi Cu dari akar ke batang relatif rendah (Manara 2012), sehingga efek cekaman Cu tidak sampai pada bagian batang dan daun. Hal ini sejalan dengan Goryet al. (1998) yang menggunakan Nicotiana tabacum sp sebagai sampel. Di dalam Taiz & 49 Zeiger (2010) dijelaskan bahwa Cu merupakan komponen plastosianin yang berperan dalam transpor elektron selama terjadinya reaksi terang. Dengan demikian cekaman Cu tidak menyebabkan klorosis, akan tetapi pada konsentrasi yang besar dan waktu pemaparan yang lama Cu mampu menyebabkan klorosis (Marshner 2012). Pada penelitian Lu et al. (2012) disebutkan sampel tanaman yang dipapar oleh polusi udara menyebutkan bahwa Cu tidak diakumulasi di akar tetapi diakumulasi pada bagian tajuk. Hal ini bisa jadi disebabkan karena periode pemaparan yang lama dan terus menerus meskipun pada penelitian ini efek toksik Cu tidak terlihat secara makro pada daun, tetapi Cu dapat diakumulasi oleh daun. Sedangkan pada cekaman Cd, gejala klorosis nampak pada semua perlakuan Cd dan tidak ditemukan pada kontrol, akan tetapi gejala yang paling parah terdapat pada konsentrasi 200 µM dan 300 µM (Gambar 7). Klorosis terjadi karena beberapa faktor antara lain: terganggunya proses sintesis klorofil dan berkurangnya salah satu mineral pembentuk klorofil seperti Fe, Mg dan N yang disebabkan oleh munculnya mineral lain (Wann 1930). Menurut Manara (2012) kehadiran Cd meningkatkan kadar etilen dalam tanaman yang kemudian memicu sintesis auksin. Banyaknya kadar auksin memicu sintesis enzim klorofilase yang mampu mendegradasi klorofil. Dengan demikian kehadiran Cd menghambat proses sintesis klorofil, selain itu intervensi Cd menyebabkan berkurangnya mineral yang digunakan untuk sintesis klorofil. Karena Cd tidak memiliki fungsi biologis, maka Cd tidak memiliki transporter yang spesifik. Di lain pihak beberapa transporter mineral penting Fe2+ dan Zn2+ seperti IRT1 memiliki sensitivitas yang rendah sehingga dapat pula mengikat mineral lain seperti Cd2+ dan Mn2+ (Manara 2012). Tipe transporter yang lain seperti ZIP mampu mentranslokasi Mn, Zn, Fe, dan Cd (Nazar et al. 2012) dengan demikian terjadilah kompetisi antar ion untuk berikatan dengan transporter. Pada konsentrasi yang tinggi, Cd2+memiliki kesempatan berikatan dengan transporter lebih besar daripada Fe2+ sehingga kadarnya menurun.Berkurangnya Fe2+ secara langsung menyebabkan produksi klorofil terhambat sehingga menyebabkan klorosis. 50 Pada cekaman Pb, gejala klorosis hanya ditunjukan oleh sampel pada konsentrasi 100 µM (Gambar 10), hal ini sejalan dengan hasil AAS dimana hanya pada konsentrasi 100 µM ditemukan akumulasi Pb. Logam Pb diserap langsung secara apoplas oleh jaringan tumbuhan. Akan tetapi Pb mempunyai daya translokasi akar ke batang dan daun yang rendah sehingga akumulasi Pb berkurang pada tiap bagian tumbuhan dimulai dari akar, daun tua, batang dan daun muda (Piano et al. 2008). Meskipun demikian tinggi rendahnya konsentrasi Pb mempengaruhi metabolisme pada batang dan daun. Mekanisme terjadinya klorosis oleh Pb secara umum disebabkan oleh kompetisi antara Pb dan mineral yang dibutuhkan untuk produksi klorofil seperti Fe, Mg, dan N sehingga menyebabkan klorosis (Wann 1930). Akan tetapi secara spesifik kehadiran Pb menurut Sharma & Dubey (2005) menghambat produksi klorofil secara langsung dalam kloroplas. Penghambatan dimulai dengan berubahnya komposisi lipid di membran tilakoid yang kemudian menyebabkan penurunan produksi klorofil, plastoquinon, karotenoid dan aktivitas NADP+ oksidoreduktase. Penurunan ini pada akhirnya mengurangi transport elektron dalam kloroplas dan menyebabkan terganggunya siklus Calvin. Dengan demikian intervensi Pb dalam metabolisme tersebut dapat menghambat produksi klorofil. Meskipun demikian, terlihat tidaknya gejala klorosis terkait erat dengan tinggi rendahnya konsentrasi, semakin tinggi konsentrasi maka semakin besar kemungkinan terjadinya klorosis. Parameter morfologi akar pada semua perlakuan logam baik Cu, Cd dan Pb menunjukan bahwa semakin tinggi konsentrasi semakin lunak habitus akar. Tekstur akar menjadi lunak disebabkan oleh matinya sel-sel akar ataupun rambut akar. Hal ini disebabkan rusaknya dinding sel akar yang dicekam oleh logam. Pada cekaman Cu, mekanisme melonggarnya dinding sel dijelaskan dalam Fry et al. (2004). Logam Cu2+ yang bereaksi dengan polimer dinding sel mendapat donor elektron dari askorbat dan superoksida sehingga berubah muatan menjadi Cu+ yang kemudian mengalami reaksi fenton yang menghasilkan radikal hidroksil. Dengan hadirnya radikal hidroksil proses 51 enzimatik terganggu sehingga ikatan dinding sel mengendur. Rusaknya dinding sel menyebabkan inflitrasi Cu melalui plasmalema pada sel meningkat dan menyebabkan gangguan metabolisme sel yang pada akhirnya menimbulkan kematian. Kerusakan dinding sel dan kematian sel ditemukan pada cekaman Cd dan Pb yang mempengaruhi tekstur akar (Zou et al. 2012; Kumar & Tripathi 2008; Kopittke et al. 2007). BAB V SIMPULAN DAN SARAN A. Simpulan Berdasarkan hasil dari uraian pembahasan, dapat ditarik kesimpulan sebagai berikut: 1. Konsentrasi logam Cu, Cd dan Pb dalam media cair setengah MS berpengaruh signifikan terhadap pertambahan panjang akar, namun pada parameter pertambahan jumlah akar logam Cu dan Cd tidak berpengaruh signifikan. Konsentrasi Cu yang paling optimal dalam menghambat pertumbuhan akar adalah 200 µM, sedangkan konsentrasi Cd yang paling menghambat pertumbuhan akar yaitu 300 µM dan pada cekaman Pb konsentrasi yang secara maksimal menghambat konsentrasi 100 µM. 2. Terdapat perbedaan tingkat parameter kerusakan anatomi akar, akumulasi logam dan warna daun pada setiap konsentrasi dan jenis logam dalam media. Ketiga parameter tersebut tidak tergantung satu sama lain, yang berarti meskipun dicekam oleh logam dan konsentrasi yang sama tiap parameter dapat menunjukan hasil yang berbeda. Pada cekaman logam Cu besarnya akumulasi logam dalam akar ekuivalen dengan besarnya konsentrasi Cu dalam media. Pada cekaman logam Cd akumulasi logam dalam akar tidak ekuivalen dengan besarnya konsentrasi Cd dalam media. Pada cekaman logam Pb besarnya akumulasi logam dalam akar ekuivalen dengan besarnya konsentrasi 3. Berdasarkan analisis kuantitatif, tembakau mampu mentoleransi cekaman logam Cu pada level ≤ 100 µM, Cd pada konsentrasi < 50 µM dan Pb pada konsentrasi ≤ 5 µM. Berdasarkan analisis kualitatif tembakau mampu mentoleransi cekaman pada konsentrasi logam Cu pada level ≤ 50 µM, Cd pada konsentrasi < 50 µM dan Pb pada konsentrasi ≤ 20 µM. 52 53 B. Saran Berdasarkan hasil penelitian yang diperoleh dapat dirumuskan saran sebagai berikut: 1. Untuk penelitian sejenis perlu dilakukan analisis AAS baik pada bagian akar (root) maupun bagian batang daun (shoot) untuk mengetahui secara detail pola translokasi logam. 2. Pada penelitian serupa sebaiknya dilakukan uji lanjut yaitu re-growth analysis untuk mengetahui responsif tidaknya tembakau terhadap pemulihan pertumbuhan akar pada media nutritif non logam. 3. Perlu dilakukan penelitian lanjut guna mengetahui respon tembakau (Nicotiana tabacum L.) secara molekuler dan mikroanatomis terhadap cekaman logam berat Cu, Cd dan Pb DAFTAR PUSTAKA Anaspec Inc. 2008. Phytochelatin Peptide. Fremont: Anaspec Inc [Anonim]. 2013. Fact Sheet-Nicotiana tabacum L. Di dalam www. flora. sa. gov. au/efsa/lucid/Solanaceae/Nicotiana%20species/key/Australian%20Nicotia na%0sspecies/Media/Html/Nicotiana_tabacum.htm [7 Maret 2013] [Anonim].2013. List of hyperaccumulator plants. Di dalam http ://en. wikipedia. org/w/index. php?oldid=402229528 [ 9 September 2013] [Anonim]. 2013. Source, level and movememnts of lead in the environment. Di dalam http://www4.hmc.edu:8001/Chemistry/Pb/resources/pb%20sources.pdf [7 juni 2013] [Anonim]. 2013. Tembakau. Di dalam http :// dishutbunnak. Majalengkakab .go.id/index.php?option=com_content&view=article&id=23:tembakau&ca tid=13:potensi-perkebunan&Itemid=13 [7 november 2013] Alaoui-Sossé B, Genet P, Vinit-Dunand F, Toussaint ML, Epron D, Badot PM. 2004. Effect of copper on growth in cucumber plants (Cucumis sativus) and its relationships with carbohydrate accumulation and changes in ion contents. Plant Sci 166 :1213–1218. Alkhatib R, Creamer R, Lartey RT, Ghoshroy S. 2011. Effect of lead (Pb) on the systemic movement of RNA viruses in tobacco (Nicotiana tabacum var. Turkish). Plant Cell Rep 30:1427–1434 (a). Alkhatib R, Maruthavanan J, Ghoshroy S, Steiner R, Sterling T, Creamer. 2011. Physiological and ultrastructural effects of lead on tobacco. Biol Plantarum 56 : 711-716 (b). Anggraito YU, Suharsono, Pardal SJ, Sopandie D. 2012. Transformasi genetik Nicotiana benthamiana L dan kedelai dengan gen MaMt2 penyandi metallothionein Tipe II dari Melastoma malabathricum L. Forum Pascasarjana 35:179-188. Arduini I, Godbold DL, Onnis A. 1995. Influence of copper on root growth and morphology of Pinus pinea L. and Pinus pinaster Ait. Seedlings. Tree Physiol 15: 411-415. Ayodele JT, Kiyawa SA. 2010. Haemanthus and Mitracarpus scaber as bioaccumulators of heavy metals. J Int Env App & Sci, 5: 878-882. 55 Baranowska-Morek A, Wierzbicka M. 2004. Localization of lead in root tip of Dianthus carthusianorum. Acta Biol Cracoviensia Ser Botanica 46: 45-56. Blaylock MJ, Salt D, Dushenkov S, Zakharova O, Gussman C, Kapulnik Y, Ensley B, Raskin A. 1997. Enhanced accumulation of Pb in indian mustard by soil-applied chelating agents. Environ Sc Technol 31: 860-865. Buchanan BB, Gruissem W, Jones RL. 2000. Biochemistry & Molecular Biology of Plants. Maryland: American Society of Plant Physiologists Butare L, Rao I, Lepoivre P, Polania J, Cajiao C, Cuasquer J, Beebe S. 2011. New genetic sources of resistance in the genus Phaseolus to individual and combined aluminium toxicity and progressive soil drying stresses. Euphytica 181:385-404. Cheng S. 2003. Effects of heavy metals on plants and resistance mechanisms. Environ Sci & Pollut Res 10: 256 - 264 Cobbet CS. 2000. Phytochelatins and their roles in heavy metal detoxification. Plant Physiol, 123: 825–832. Fry SC, Miller JC, Dumville JC. 2002. A proposed role for copper ions in cell wall loosening. Plant Soil 247: 57–67. Ganapathi TR, Suprasanna P, Rao PS, Bapat VA. 2004. Tobacco (Nicotiana tabacum L)- A model system for tissue culture interventions and genetic engineering. Ind J Biotech 3: 171-184. Garg N, Singla P. 2011. Arsenic toxicity in crop plants: physiological effects and tolerance mechanisms. Environ Chem Lett 9: 303–321. Ghelich S 1, Zarinkamar, Fatemeh. 2013. Histological and ultrastructure changes in Medicago sativa in response to lead stress. Phyto J 2: 20-29 Gonçalves JF, Antes FG, Maldaner J, Pereira LB, Tabaldi LA, Rauber R, Rossato LV, Bisognin DA, Dressler VL, de Moraes Flores EM, Nicoloso FT. 2009. Cadmium and mineral nutrient accumulation in potato plantlets grown under cadmium stress in two different experimental culture conditions [Abstrak]. Di akses berkala pada http://www.sciencedirect.com/science/article/pii/S0981942809001053 Gori P, Schiff S, Santandrea G, Bennici A. 1998. Response of in vitro cultures of Nicotiana tabacum L. to copper stress and selection of plants from Cutolerant callus. Plant Cell Tiss Organ Cult 53: 161–169. 56 Grispen VMJ, Hakvoort HWJ, Bliek T, Verkleij JAC, Schat H. 2009. Combined expression of the Arabidopsis metallothionein MT2b and the heavy metal transporting ATPase (HMA4) enhances cadmium tolerance and the root to shoot translocation of cadmium and zinc in tobacco. Di dalam: Bouter LM, editor. Exploring Cadmium Phytoextraction with Brassica napus and Nicotiana tabacum: Breeding and Selection versus Genetic Engineering. Universiteit Amsterdam. Hlm 78-96. Hede AR, Skovmand B, Lopez-Cesatia J. 2001. Acid soils and aluminum toxicity. App Physiol Wheat Breeding Chapter 15: 172-182. Herman DZ. 2006. Tinjauan terhadap tailing mengandung unsur pencemar arsen (As), merkuri (Hg), timbal (Pb), dan kadmium (Cd) dari sisa pengolahan bijih logam. J Geologi Indo 1: 31-36. Hidayati N. 2005. Fitoremediasi dan potensi tumbuhan hiperakumulator [ulasan]. Hayati 12: 35-40. Hock B, Wolf NM. 2005. Characteristic of plant life: hazard from pollutant. Di dalam: Hock B, Elstner EF, editor. Plant Toxicology (fourth edition). New York: Marcel Dekker. Järup L. 2003. Hazards of heavy metal contamination. Brit Med Bull 68: 167-182. Jiang W, Liu D, Liu X. 2001. Effects of copper on root growth, cell division and nucleolus of Zea mays. Biol Plant 44:105-109. John DA, Leventhal JS. 1995. Bioavailability of metals. Di dalam http://pubs.usgs.gov/of/1995/ofr-95-0831/CHAP2.pdf diakses pada 17 September 2013 Joshi A, Kothari SL. High copper levels in the medium improves shoot bud differentiation and elongation from the cultured cotyledons Capsicum annuum L. Plant Cell Tiss Organ Cult 88:127–133. Kelkar TS, Bhalerao SA.2013. Beneficiary effect of arbuscular mycorrhiza to Trigonella Foenum-Graceum in contaminated soil by heavy metal. Res J Recent Sci 2:29-32. Kim YN, Kim JS, Seo SG, Lee Y, Baek SW, Kim IS, Yoon HS, Kim KR, Kim SH, Kim KH. 2011. Cadmium resistance in tobacco plants expressing the MuSI gene. Plant Biotechnol Rep 5:323–329. Kopittke P, Asher CJ, Kopittke RA, Menzies NW. 2007. Toxic effects of Pb2+ on growth of cowpea (Vigna unguiculata). Envir Poll 150: 280-287. 57 Krystofova O, Zitka O, Krizkova S, Hynek D, Shestivska V, Adam V, Hubalek V, Mackova M, Macek T, Zehnalek J. 2012. Accumulation of cadmium by transgenic tobacco tlants (Nicotiana tabacum L.) carrying yeast metallothionein gene revealed by electrochemistry. Int. J. Electrochem. Sci. 7: 886-907 Kumar G, Tripathi R. 2008. Lead-induced cytotoxicity and mutagenicity in grass pea. Turk J Biol 32: 73-78. Kurtyka R, Małkowski E, Kita A, Karcz W. 2008. Effect of calcium and cadmium on growth and accumulation of cadmium, calcium, potassium and sodium in maize seedlings. Polish of Environ Study 17:51-56. Lequeux H, Hermans C, Lutts S, Verbruggen N. 2010. Response to copper excess in Arabidopsis thaliana: Impact on the root system architecture, hormone distribution, lignin accumulation and mineral profile. Plant Physiol Biochem 48: 673-682. Levine M. 2013. Effect of pH on Heavy Metal Concentration [artikel]. Dalam http://www.nist.gov/data/PDFfiles/jpcrd444.pdf diakses pada 26 September 2013 Li L, Cheng H, Peng J, Cheng S. 2010. Construction of a plant expression vector of chalcone synthase gene of Ginkgo biloba L. and its genetic transformation into tobacco. Chin Agric 4:456-462. Liu X P, Peng K J, Wang A G, Lian C L, Shen Z G. 2010. Cadmium accumulation and distribution in populations of Phytolacca americana L. and the role of transpiration. Chemosphere, 78: 1136–1141. Lu Z, Zhi Y, Wang Z, Hua Y, Hong G, Camada E, Yao Y. Absorption and accumulation of heavy metal pollutants in roadside soil-plant systems –a caase study for western inner Mongolia. Di dalam: Luo Y. Novel Approaches and Their Applications in Risk Assessment. Shanghai: Intech China. Longchamp M, Angeli N, Castrec-Rouelle M. 2013. Selenium uptake in Zea mays supplied with selenate or selenite under hydroponic conditions. Plant Soil 362:107-117. Luo Y, Wei Q, Huang M, Xu Y, Chen F. 2006. Isolation of a genomic DNA for Jatropha curcas ribosome inactivating protein and its tobacco transformation. J Shanghai Univ 10(5): 461-464. Maheshwari P, Kovalchuk I. 2011. Combination of ammonium nitrate, cerium chloride and potassium chloride salts improves Agrobacterium 58 tumefaciens-mediated transformation of Nicotiana tabacum. Plant Biotech Rep [terhubung berkala]. http://springerlink.com diakses pada 25 April 2013 Mahmood T, Islam KR, Muhammad S. 2007. Toxic effects of heavy metal on early growth and tolerance of cereal crops. Pak J Bot 39: 451-462 Manara A. 2012. Plants responses in heavy metal toxicity. Di dalam: Furini A, editor. Plants and heavy metals. SpringerBriefs in Biometals: 27-53 Manggara PP, Denni W, Sabtanto JS, Asep A. 2007. Penyelidikan potensi bahan pada tailing PT. Freeport Indonesia di Kabupaten Mimika. Prosiding Pemaparan Hasil Kegiatan Lapangan dan Non Lapangan Tahun 2007. Pusat Sumber Daya Geologi. hlm 1-9. Marschner H. 2012. Mineral Nutrition of Higher Plants (Third edition). Academic Press: London Mikkelsen MD, Pedas P, Schiller M, Vincze E, Mills RF, Borg S, Møller A, Schjoerring JK, Williams LE, Baekgaard L, Holm PB, Palmgren MG. 2012. Barley HvHMA1 is a heavy metal pump involved in mobilizing organellar Zn and Cu and plays a role in metal loading into grains. Plos one 7: 1-13. Murjanto D. 2011. Karakterisasi dan perkembangan tanah pada lahan reklamasi bekas tambang batu bara PT Kaltim Prima Coal [tesis] Bogor: Program Pascasarjana, Institut Pertanian Bogor. Narusaka Y, Narusaka M, Yamasaki S, Iwabuchi M. 2012. Methods to transfer foreign genes to plants. Di dalam Çiftçi YO, editor. Transgenic Plants Advances and Limitations. Shanghai: Intech. hlm 173-188. Nazar R, Iqbal N, Masood A, Khan MIR, Syeed S, Khan NA. 2012. Cadmium toxicity in plants and role of mineral nutrients in its alleviation. American J Plant Sciences 3: 1476-1489. [NRSC] Natural Resources Conservation Service. 2000. Heavy Metal Soil Contamination. Urban Technical Note 3: 1-7 O’Neill P. 1994. Environmental Chemistry. Plymouth: Chapman & Hall. Perry CT, Divan AM Jr, Rodriguez MTR, Atz VL. 2010. Psidium guajava as a bioaccumulator of nickel around an oil refinery, southern Brazil. Ecotoxic Environ Safety 73 : 647–654. Petrescu I, Petolescu C, Coradini C, Lazar A, Banu C, Velicevici G. 2011. Studies concerning the lead effect in vitro and in vivo on the plants 59 development of Lycopersicum esculentum L. J Hortic Forest Biotech 15:147-150. Piano LD, Abet M, Sorrentino C, Barbato L, Sicignano M, Cozzolino E, Cuciniello A. 2008. Uptake and distribution of lead in tobacco (Nicotiana tabacum L.). J Applied Bot Food Qual 82:21-25. Pomponi M, Censi V, Girolamo VD, De Paolis A, Di Toppi LS, Aromolo R, Costantino P, Cardarelli M. 2006. Overexpression of Arabidopsis phytochelatin synthase in tobacco plants enhances Cd2+ tolerance and accumulation but not translocation to the shoot. Planta 223: 180–190. Poschenrieder C, Gunse B, Barcelo J. 1989. Influence of cadmium on water relations, stomatal resistance, and abscisic acid content in expanding bean leaves. Plant Physiol 90: 1365-1371. Quiroga M, Guerrero C, Botella MA, Barcelo´ A, Amaya I, Medina M, Alonso FJ, Forchetti SM, Tigier H, Valpuesta V. 2000. A Tomato Peroxidase Involved in the synthesis of lignin and suberin. Plant Physiol 122: 1119– 1127. Ratheesh CP, Abdussalam A, Nabeesa S, Puthur JT. 2010. Distribution of bioaccumulated Cd and Cr in two Vigna species and the associated histological variations. J Stress Physiol Biochem 6: 4-12. Reddy KJ, Wang L, Gloss SP. 1995. Solubility and mobility of copper and zinc and lead in acidic environment. Plant Soil 171: 53-58. Redjala T, Sterckeman T, Morel JL. 2009. Influence of plant cadmium content on root cadmium uptake [prosiding]. Dipresentasikan pada “Proceedings of the International Plant” Nutrition Colloquium XVI University of California Reichman SM. 2002. The response of plants to metal toxicity: a review focusing on copper, manganese and zinc. Melbourne: Australian Minerals & Energy Environment Foundation. Schutzendubel A, Schwanz P, Teichmann T, Gross K, Langenfeld-Heyser R, Godbold DL, Polle A. 2001. Cadmium-induced changes in antioxidative systems, hydrogen peroxide content, and dfferentiation in scots pine roots. Plant Physiol 127: 887–898. Szôllôsi R, Kálmán E, Medvegy1 A, Petô1 A, Varga SI. 2011. Studies on oxidative stress caused by Cu and Zn excess in germinating seeds of Indian mustard (Brassica juncea L.) Acta Biol Szeg 55:175-178. 60 Sembiring S. 2008. Sifat kimia dan fisik tanah pada areal bekas tambang bauksit di pulau Bintan, Riau. Info Hutan 5: 123-134. Sabtanto JS, Suhandi. 2005. Pendataan sebaran unsur merkuri pada wilayah pertambangan gunung pani dan sekitarnya Kabupaten Pohuwato, Provinsi Gorontalo. Hasil Kegiatan Subdit Konservasi TA. Sandrint TR, Maier RM. 2012. Effect of pH on cadmium toxicity, speciation, and accumulation during naphthalene biodegradation [abstrak]. Di dalam http://www.ncbi.nlm.nih.gov/pubmed/12371483 di akses pada 26 September 2013. Shakoor MB, Ali S, Farid M, Farooq MA, Tauqeer HM, Iftikhar U, Hannan F, Bharwana SA. 2013. Heavy metal pollution, a global problem and its remediation by chemically enhanced phytoremediation: A Review. J Bio & Env Sci 3:12-20. Shaleh H. 2013. Alih fungsi lahan makin mengkhawatirkan [terhubung berkala] di dalam_www.suaramerdeka.com/v1/index.php/read/news/2013/06/13/1606 92/Alih-Fungsi-Lahan-Makin-Mengkhawatirkan diakses pada [13 Juli 2013]. Sharma P, Dubey RS. 2005. Lead toxicity in plants. Braz J Plat Physiol 17:35-52. Shen GM, Du QZ, Wang JX. 2012. Involvement of plasma membrane Ca2+/H+ antiporter in Cd2+ tolerance. Rice Sci 19: 161−165 Shukla D, Kesari R, Mishra S, Dwivedi S, Tripathi RD, Nath P, Trivedi PK. 2012. Expression of phytochelatin synthase from aquatic macrophyte Ceratophyllum demersum L. enhances cadmium and arsenic accumulation in tobacco. Plant Cell Rep 31:1687–1699. Singh S, Korripally P, Vancheeswaran R, Eapen S. 2011. Transgenic Nicotiana tabacum plants expressing a fungal copper transporter gene show enhanced acquisition of copper. Plant Cell Rep 30:1929–1938. Sriprang R, Murooka Y. 2007. Accumulation and detoxification of metals by plants and microbes. Di dalam: Singh SN, Tripathi RD. Environmental Bioremediation Technologies. Springer: 1-28 Sudjana. 2005. Metoda Statistika. Bandung: Tarsito. Sunarminto BH. 2011. Genesis, karakteristik tanah dan kualitas lahan: peranannya dalam menumbuhkan tanaman [pidato pengukuhan guru besar]. Yogyakarta: Universitas Gadjah Mada. 61 Suzuki N. 2005. Alleviation by calcium of cadmium-induced root growth inhibition in Arabidopsis seedlings. Plant Biotech 22: 19–25. Tistama R, Widyastuti U, Sopandie D, Yokota A, Akashi K, Suharsono. 2012. Physiological and biochemical responses to aluminium stress in the root of a biodiesel plant Jatropha curcas L. Hayati 19:37-38. [UNEP] United Nations Environment Program. 2008. Draft final review of scientific information on cadmium. Chemical Branch Ver Nov 2008:1-184. Wann FB. 1930. Chlorosis Yellowing of Plants: Cause and Control. Utah: UAES Circulars Yau PY, Loh CF, Azmil IAR. 1991. Copper toxicity of clove Syzygium aromaticum (L.) Merr. and Perry seedlings. MARDI Res J 19: 49-53. Yoshihara T, Hodoshima H, Miyano Y, Shoji K, Shimada H, Goto F. 2006. Cadmium inducible Fe deficiency responses observed from macro and molecular views in tobacco plants. Plant Cell Rep 25: 365–373 Yusnita. 2003. Kultur Jaringan: Cara Memperbanyak Tanaman secara Efisien. Jakarta: Agromedia Pustaka. Zhang J, Zhang X, Duan Y, Han Y. 2013. Construction of a phosphate transporter gene expression vector and its usage for tobacco transformation. Russ J Plant Physiol 60:290-294. Zou J, Yue J, Jiang W, Liu D. 2012. Effects of cadmium stress on root tip cells and some physiological indexes in Allium cepa var Agrogarium L. Acta Biol Crac 54:129-141. Zulkarnain. 2009. Kultur Jaringan Tanaman. Jakarta: Bumi Aksara. 62 LAMPIRAN I PengambilandanAnalisis Data A. RekapPengambilan Data Konsentrasi (µM) Logam Cu Cd Pb 0 50 100 150 200 0 50 100 200 300 0 5 20 50 100 Konsentrasi (µM) Logam Cu Cd Pb 0 50 100 150 200 0 50 100 200 300 0 5 20 50 100 Pertambahanpanjangakar (ulangan) 1 2 3 4 5 6 7 10 4 20 8 5 7 9 6 6 5 7 5 6 0 0 2 5 7 3 0 1 4 4 17 7 6 9 6 5 3 4 4 6 5 4 3 4 4 4 4 4 2 3 0 2 9 6 1 10 11 15 8 14 8 17 9 9 8 16 3 0 3 2 1 6 4 2 4 3 5 2 2 3 Jumlah Rata-rata (mm) 47 35 29 14 12 45 22 20 17 18 58 51 24 17 15 9.4 7 5.8 2.8 2.4 9 4.4 4 3.4 3.6 11.6 10.2 4.8 3.4 3 Pertambahanjumlahakar (ulangan) 1 2 3 4 1 3 9 8 3 4 5 4 8 0 4 6 1 4 6 0 2 1 2 3 16 7 5 9 5 5 3 6 7 12 4 8 7 13 10 8 8 2 3 8 8 7 10 7 7 3 5 3 5 2 3 1 3 1 6 4 1 2 3 1 Jumlah Rata-rata 25 23 22 18 10 42 23 39 41 29 37 24 15 18 10 5 4.6 4.4 3.6 2 8.4 4.6 7.8 8.2 5.8 7.4 4.8 3 3.6 2 62 5 4 7 4 7 2 5 4 8 3 8 5 6 4 4 3 63 B. Hasilanalisisanavasatujalandanuji BNT 1. HasilAnavasatujalandanuji BNT padacekaman pertambahanpanjangakar Cu parameter PanjangAkar Sum of Squares Df Mean Square Between Groups 172.240 4 43.060 Within Groups 224.000 20 11.200 Total 396.240 24 F Sig. 3.845 .018 Multiple Comparisons PanjangAkarLSD (I) (J) Konsentr Konsentr Mean asiCu asiCu Difference (I-J) Std. Error 0 µM 95% Confidence Interval Sig. Lower Bound Upper Bound 50 µM 2.400 2.117 .270 -2.02 6.82 100 µM 3.600 2.117 .104 -.82 8.02 150 µM 6.600 * 2.117 .005 2.18 11.02 200 µM 7.000 * 2.117 .004 2.58 11.42 0 µM 100 µM -2.400 1.200 2.117 2.117 .270 .577 -6.82 -3.22 2.02 5.62 150 µM 4.200 2.117 .061 -.22 8.62 200 µM 100 µM 0 µM * 4.600 -3.600 2.117 2.117 .042 .104 .18 -8.02 9.02 .82 50 µM -1.200 2.117 .577 -5.62 3.22 150 µM 3.000 2.117 .172 -1.42 7.42 200 µM 3.400 2.117 .124 -1.02 7.82 * 2.117 .005 -11.02 -2.18 50 µM -4.200 2.117 .061 -8.62 .22 100 µM -3.000 2.117 .172 -7.42 1.42 200 µM 200 µM 0 µM .400 -7.000* 2.117 2.117 .852 .004 -4.02 -11.42 4.82 -2.58 50 µM -4.600* 2.117 .042 -9.02 -.18 100 µM -3.400 2.117 .124 -7.82 1.02 150 µM -.400 2.117 .852 -4.82 4.02 50 µM 150 µM 0 µM -6.600 64 Multiple Comparisons PanjangAkarLSD (I) (J) Konsentr Konsentr Mean asiCu asiCu Difference (I-J) Std. Error 0 µM 95% Confidence Interval Sig. Lower Bound Upper Bound 50 µM 2.400 2.117 .270 -2.02 6.82 100 µM 3.600 2.117 .104 -.82 8.02 150 µM 6.600 * 2.117 .005 2.18 11.02 200 µM 7.000 * 2.117 .004 2.58 11.42 0 µM -2.400 2.117 .270 -6.82 2.02 100 µM 1.200 2.117 .577 -3.22 5.62 150 µM 4.200 2.117 .061 -.22 8.62 200 µM * 2.117 .042 .18 9.02 -3.600 2.117 .104 -8.02 .82 50 µM 150 µM -1.200 3.000 2.117 2.117 .577 .172 -5.62 -1.42 3.22 7.42 200 µM 3.400 2.117 .124 -1.02 7.82 * 2.117 .005 -11.02 -2.18 50 µM 100 µM -4.200 -3.000 2.117 2.117 .061 .172 -8.62 -7.42 .22 1.42 200 µM .400 2.117 .852 -4.02 4.82 -7.000 * 2.117 .004 -11.42 -2.58 -4.600 * 2.117 .042 -9.02 -.18 -3.400 2.117 .124 -7.82 1.02 150 µM -.400 2.117 .852 *. The mean difference is significant at the 0.05 level. -4.82 4.02 Cu parameter 50 µM 100 µM 0 µM 150 µM 0 µM 200 µM 0 µM 50 µM 100 µM 4.600 -6.600 2. HasilAnavasatujalandanuji BNT padacekaman pertambahanjumlahakar ANOVA Jumlahakar Sum of Squares Df Mean Square F Between Groups Within Groups Total 28.240 4 7.060 129.600 157.840 20 24 6.480 1.090 Sig. .388 65 Multiple Comparisons Jumlahakar LSD (I) (J) Konsentr Konsentr Mean asiCu asiCu Difference (I-J) Std. Error 0 µM 50 µM 95% Confidence Interval Sig. Lower Bound Upper Bound 50 µM .400 1.610 .806 -2.96 3.76 100 µM .600 1.610 .713 -2.76 3.96 150 µM 1.400 1.610 .395 -1.96 4.76 200 µM 3.000 1.610 .077 -.36 6.36 0 µM 100 µM -.400 .200 1.610 1.610 .806 .902 -3.76 -3.16 2.96 3.56 150 µM 1.000 1.610 .542 -2.36 4.36 200 µM 2.600 1.610 .122 -.76 5.96 -.600 1.610 .713 -3.96 2.76 50 µM -.200 1.610 .902 -3.56 3.16 150 µM .800 1.610 .625 -2.56 4.16 200 µM 2.400 1.610 .152 -.96 5.76 -1.400 -1.000 1.610 1.610 .395 .542 -4.76 -4.36 1.96 2.36 100 µM -.800 1.610 .625 -4.16 2.56 200 µM 1.600 1.610 .332 -1.76 4.96 -3.000 1.610 .077 -6.36 .36 50 µM -2.600 1.610 .122 -5.96 .76 100 µM -2.400 1.610 .152 -5.76 .96 150 µM -1.600 1.610 .332 -4.96 1.76 100 µM 0 µM 150 µM 0 µM 50 µM 200 µM 0 µM 3. HasilAnavasatujalandanuji BNT padacekaman Cd parameter pertambahanpanjangakar ANOVA PanjangAkar Sum of Squares Between Groups Within Groups Total 118.160 182.400 300.560 Df Mean Square 4 20 24 29.540 9.120 F 3.239 Sig. .033 66 Multiple Comparisons PanjangAkar LSD (I) (J) Mean Konsentras Konsentras Difference (IiCd iCd J) Std. Error 0 µM Cd 95% Confidence Interval Sig. Lower Bound Upper Bound 50 µM 4.600 * 1.910 .026 .62 8.58 100 µM 5.000* 1.910 .016 1.02 8.98 200 µM 5.600* 1.910 .008 1.62 9.58 .005 .026 .836 .606 .472 .016 .836 .757 .606 .008 .606 .757 .836 .005 .472 .606 .836 2.02 -8.58 -3.58 -2.98 -2.58 -8.98 -4.38 -3.38 -2.98 -9.58 -4.98 -4.58 -3.58 -9.98 -5.38 -4.98 -4.38 9.98 -.62 4.38 4.98 5.38 -1.02 3.58 4.58 4.98 -1.62 2.98 3.38 4.38 -2.02 2.58 2.98 3.58 * 300 µM 6.000 1.910 * 50 µM Cd 0 µM -4.600 1.910 100 µM .400 1.910 200 µM 1.000 1.910 300 µM 1.400 1.910 * 100 µM 0 µM -5.000 1.910 Cd 50 µM -.400 1.910 200 µM .600 1.910 300 µM 1.000 1.910 * 200 µM 0 µM -5.600 1.910 Cd 50 µM -1.000 1.910 100 µM -.600 1.910 300 µM .400 1.910 * 300 µM 0 µM -6.000 1.910 Cd 50 µM -1.400 1.910 100 µM -1.000 1.910 200 µM -.400 1.910 *. The mean difference is significant at the 0.05 level. 67 4. HasilAnavasatujalandanuji BNT padacekaman Cd parameter pertambahanjumlahakar ANOVA JumlahAkar Sum of Squares Between Groups Within Groups Total Df Mean Square 56.160 4 14.040 212.800 268.960 20 24 10.640 F Sig. 1.320 .297 Multiple Comparisons JumlahAkarLSD (I) (J) Konsentrasi Konsentrasi Mean Cd Cd Difference (I-J) Std. Error 0 µM Cd 50 µM Cd 95% Confidence Interval Sig. Lower Bound Upper Bound 50 µM 3.800 2.063 .080 -.50 8.10 100 µM .600 2.063 .774 -3.70 4.90 200 µM .200 2.063 .924 -4.10 4.50 300 µM 2.600 2.063 .222 -1.70 6.90 0 µM 100 µM -3.800 -3.200 2.063 2.063 .080 .137 -8.10 -7.50 .50 1.10 200 µM -3.600 2.063 .096 -7.90 .70 300 µM -1.200 2.063 .567 -5.50 3.10 -.600 2.063 .774 -4.90 3.70 50 µM 3.200 2.063 .137 -1.10 7.50 200 µM -.400 2.063 .848 -4.70 3.90 300 µM 2.000 2.063 .344 -2.30 6.30 -.200 3.600 2.063 2.063 .924 .096 -4.50 -.70 4.10 7.90 100 µM .400 2.063 .848 -3.90 4.70 300 µM 2.400 2.063 .258 -1.90 6.70 -2.600 2.063 .222 -6.90 1.70 50 µM 1.200 2.063 .567 -3.10 5.50 100 µM -2.000 2.063 .344 -6.30 2.30 200 µM -2.400 2.063 .258 -6.70 1.90 100 µM Cd 0 µM 200 µM Cd 0 µM 50 µM 300 µM Cd 0 µM 68 5. HasilAnavasatujalandanuji BNT padacekamanPb parameter pertambahanpanjangakar ANOVA PanjangAkar Sum of Squares Between Groups Within Groups Total Df Mean Square 322.000 4 80.500 276.000 598.000 20 24 13.800 F Sig. 5.833 .003 Multiple Comparisons PanjangAkarLSD (I) (J) Konsentr Konsentr Mean asiPb asiPb Difference (I-J) Std. Error 0 µM 5µM 20 µM 50 µM 5µM 95% Confidence Interval Sig. Lower Bound Upper Bound 1.400 2.349 .558 -3.50 6.30 20 µM 6.800 * 2.349 .009 1.90 11.70 50 µM 8.200* 2.349 .002 3.30 13.10 100 µM 0 µM * 8.600 -1.400 2.349 2.349 .002 .558 3.70 -6.30 13.50 3.50 20 µM 5.400* 2.349 .032 .50 10.30 50 µM * 2.349 .009 1.90 11.70 100 µM 0 µM * 7.200 -6.800* 2.349 2.349 .006 .009 2.30 -11.70 12.10 -1.90 5µM -5.400* 2.349 .032 -10.30 -.50 50 µM 1.400 2.349 .558 -3.50 6.30 100 µM 1.800 2.349 .453 -3.10 6.70 -8.200 * 2.349 .002 -13.10 -3.30 -6.800 * 2.349 .009 -11.70 -1.90 -1.400 2.349 .558 -6.30 3.50 .400 -8.600* 2.349 2.349 .867 .002 -4.50 -13.50 5.30 -3.70 5µM -7.200* 2.349 .006 -12.10 -2.30 20 µM -1.800 2.349 .453 -6.70 3.10 50 µM -.400 2.349 .867 -5.30 4.50 0 µM 5µM 20 µM 100 µM 100 µM 0 µM 6.800 69 Multiple Comparisons PanjangAkarLSD (I) (J) Konsentr Konsentr Mean asiPb asiPb Difference (I-J) Std. Error 0 µM 5µM 95% Confidence Interval Sig. Lower Bound Upper Bound 1.400 2.349 .558 -3.50 6.30 6.800 * 2.349 .009 1.90 11.70 8.200 * 2.349 .002 3.30 13.10 100 µM 8.600 * 2.349 .002 3.70 13.50 0 µM -1.400 2.349 .558 -6.30 3.50 5.400 * 2.349 .032 .50 10.30 6.800 * 2.349 .009 1.90 11.70 7.200 * 2.349 .006 2.30 12.10 * 2.349 .009 -11.70 -1.90 * -5.400 1.400 2.349 2.349 .032 .558 -10.30 -3.50 -.50 6.30 1.800 2.349 .453 -3.10 6.70 * 2.349 .002 -13.10 -3.30 * -6.800 -1.400 2.349 2.349 .009 .558 -11.70 -6.30 -1.90 3.50 .400 2.349 .867 -4.50 5.30 -8.600 * 2.349 .002 -13.50 -3.70 -7.200 * 2.349 .006 -12.10 -2.30 -1.800 2.349 .453 -6.70 3.10 50 µM -.400 2.349 .867 *. The mean difference is significant at the 0.05 level. -5.30 4.50 20 µM 50 µM 5µM 20 µM 50 µM 100 µM 20 µM 0 µM 5µM 50 µM 100 µM 50 µM 0 µM 5µM 20 µM -6.800 -8.200 100 µM 100 µM 0 µM 5µM 20 µM 6. HasilAnavasatujalandanuji BNT padacekamanPb parameter pertambahanjumlahakar ANOVA JumlahAkar Sum of Squares Between Groups Within Groups Total Df Mean Square 86.160 4 21.540 53.200 139.360 20 24 2.660 F 8.098 Sig. .000 70 Multiple Comparisons JumlahAkar LSD (I) (J) Mean Konsentras Konsentras Difference (IiPb iPb J) Std. Error 0 µ M Pb 5 µM 20 µM 50 µM 95% Confidence Interval Sig. Lower Bound Upper Bound 2.600* 1.032 .020 .45 4.75 * 1.032 .000 2.25 6.55 * 1.032 .001 1.65 5.95 .000 .020 .096 .258 .013 .000 .096 .567 .344 .001 .258 .567 .137 .000 .013 .344 .137 3.25 -4.75 -.35 -.95 .65 -6.55 -3.95 -2.75 -1.15 -5.95 -3.35 -1.55 -.55 -7.55 -4.95 -3.15 -3.75 7.55 -.45 3.95 3.35 4.95 -2.25 .35 1.55 3.15 -1.65 .95 2.75 3.75 -3.25 -.65 1.15 .55 4.400 3.800 * 100 µM 5.400 1.032 * 5 µ M Pb 0 µM -2.600 1.032 20 µM 1.800 1.032 50 µM 1.200 1.032 * 100 µM 2.800 1.032 * 20 µ M Pb 0 µM -4.400 1.032 5 µM -1.800 1.032 50 µM -.600 1.032 100 µM 1.000 1.032 * 50 µ M Pb 0 µM -3.800 1.032 5 µM -1.200 1.032 20 µM .600 1.032 100 µM 1.600 1.032 * 100 µ M 0 µM -5.400 1.032 * Pb 5 µM -2.800 1.032 20 µM -1.000 1.032 50 µM -1.600 1.032 *. The mean difference is significant at the 0.05 level. 7. Rekap pengambilan data pertambahan panjang dan jumlah akar pada cekaman Cu, Cd, dan Pb Tabel 1. Pertambahan panjang akar cekaman Cu Konsent rasi 0 µm 50 µm 100 µm 150 µm 200 µm 1 46 42 50 60 36 1 49 43 53 62 36 1 50 48 55 63 39 1 52 50 56 56* 39 2 32 51 23 70 54 2 35 53 25 70 56 2 37 56 28 73 57 2 39 56 28 64* 52* Ulangan (mm) 3 3 3 15 20 23 20 20 25 48 51 55 53 54 54 59 59 60 3 25 27 55 55 60 2 19 14 12 15 10 Jumlah akar 3 3 15 18 11 12 15 15 11 13 13 13 3 19 12 15 14 13 4 26 38 38 34 50 4 28 42 40 36 51 4 29 43 43 39 54 4 30 47 43 39 54 4 25 14 13 10 12 4 26 14 18 10 13 5 36 43 52 42 36 5 39 43 55 44 39 5 45 44 57 49 40 5 56 49 58 49 40 *Patah Tabel 2. Pertambahan jumlah akar cekaman Cu Konsentrasi 0 µm 50 µm 100 µm 150 µm 200 µm 1 14 15 9 10 13 1 14 16 11 10 13 1 14 16 16 10 15 1 15 18 17 11 15 2 16 10 12 11 9 2 16 10 12 13 9 2 16 12 12 13 10 3 10 7 11 8 11 4 18 10 12 10 10 4 21 11 12 10 10 5 16 14 8 11 16 5 16 15 10 16 16 5 17 20 11 17 17 5 20 21 12 18 18 64 Tabel 3. Pertambahan panjang akar cekaman Cd Konsentrasi 0 µm 50 µm 100 µm 200 µm 300 µm *patah 1 50 51 50 35 56 1 55 53 52 36 57 1 60 55 53 37 50 1 67 56 55 39 53* 2 40 52 40 34 57 2 41 52 41 35 57 2 43 53 41 37 57 2 47 55 44 38 59 Ulangan (mm) 3 3 3 3 35 37 38 41 34 35 37 38 46 46 47 49 25 26 27 29 35 39 40 44 4 46 47 47 25 44 4 49 48 48 26 40 4 51 49 49 27 47 4 55 51 51 27 50 5 21 76 47 59 66 5 22 76 50 59 66 5 25 78 50 60 64 5 27 82 51 62 67 Tabel 4. Pertambahan jumlah akar cekaman Cd Konsentrasi 0 µm 50 µm 100 µm 200 µm 300 µm 1 15 14 9 18 19 1 19 14 10 19 19 1 23 16 12 20 22 1 31 19 16 25 27 2 10 13 13 13 13 2 12 15 14 14 11 2 14 16 20 21 13 2 17 18 25 26 15 3 19 12 17 13 18 Jumlah akar 3 3 21 22 13 13 18 20 18 20 19 20 3 24 15 21 23 21 4 15 17 16 11 14 4 17 17 17 11 19 4 20 20 21 11 20 4 24 23 24 19 22 5 10 10 10 11 12 5 12 13 12 12 13 5 12 14 14 13 13 5 15 14 18 14 20 65 Tabel 5. Pertambahan panjang akar cekaman Pb Konsentrasi 0 µm 5 µm 20 µm 50µm 100 µm *patah 1 53 59 25 41 43 1 62 60 25 41 44 1 62 62 41 42 44 1 63 67 41 42 46 2 21 50 61 11 36 2 24 44 62 12 39 2 26 49 63 14 40 2 32 67 64 17 41 Ulangan (mm) 3 3 3 3 61 65 76 76 49 49 50 58 60 56 58 59* 44 46 46 48 56 56 57 58 2 17 22 17 10 20 2 19 23 18 11 21 3 16 12 21 13 19 4 51 31 32 41 68 4 54 31 31 41 59 4 42 34 34 42 35 4 59 40 35 43 70 5 26 50 56 49 31 5 30 56 56 49 31 5 38 57 57 50 34 5 40 58 58 53 34 Jumlah akar 3 3 18 22 13 16 22 23 15 17 19 20 4 10 13 14 10 16 4 14 13 14 12 16 4 16 14 15 14 16 4 17 16 15 14 17 5 14 16 15 8 14 5 17 18 17 10 14 5 19 20 17 12 16 5 19 22 19 12 17 Tabel 6. Pertambahan jumlah akar cekaman Pb Konsentrasi 0 µm 5 µm 20 µm 50µm 100 µm 1 19 18 10 12 15 1 22 20 13 14 16 1 25 23 14 15 16 1 27 25 15 15 16 2 12 20 16 10 19 2 13 21 17 10 19 3 26 17 24 19 22 Lampiran II LANGKAH KERJA PENELITIAN A. Persiapan sampel Dokumentasi Deskripsi kegiatan Di dalam LAF, disiapkan media MS padat, Bunsen, alat tanam steril, petridisk, aquades steril, kertas tissu, dan sterilan seperti alkohol 70 % dan kloroks. LAF kemudian dipapar sinar UV selama 45 menit. Langkah selanjutnya yaitu sterilisasi biji dengan alkohol 70 %, larutan kloroks dan aquades steril. Biji yang sudah steril kemudian ditanam dalam media MS dengn menggunakan alat steril. Biji yang sudah ditanam pada media MS, diinkubasi pada ruang gelap selama 2 hari untuk mempercepat proses perkecambahan. Setelah 2 hari, sampel dipindah ke ruang terang dan diinkubasi selama 2-3 minggu. 74 75 57 B. Pemaparan logam Dokumentasi Deskripsi kegiatan Setelah 3-4 minggu, semaian tembakau dipindah ke media setengah MS cair tanpa logam untuk adaptasi pada media baru. Setelah 3 hari, semaian semaian tersebut akan dipindah pada media yang mengandung logam berat. Sampel dipindah ke media yang mengandung logam dan dipapar selama 14 hari. Masingmasing wadah mengandung konsentrasi logam yang berbedadan setiap wadah dilengkapi 1 aerator. Untuk penghindari transpirasi berlebihan, wadah ditutup plastik. Pengambilan data kuantitatif dan kualitatif. Data kuantitatif diambil pada periode tertentu selama masa pemaparan yakni pada hari k1,5, 10, dan 14. Sedangkan data kualitatif berupa foto diambil pada hari ke-14 Pembuatan preparat dengan metode wholemount, ujung akar dipotong sepanjang 5 mm kemudian direndam dalam larutan pewarna selama 10 menit, kemudian preparat diamati dan difoto.