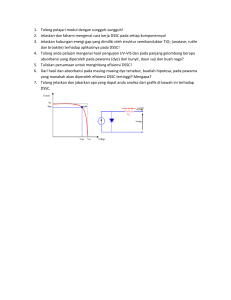
DSSC - Repository - ITS - Institut Teknologi Sepuluh Nopember
advertisement

Skripsi Studi Komputasi Sifat Elektronik Senyawa Turunan Carbazole sebagai Sensitiser pada Dye-Sensitized Solar Cell (DSSC) ANNISA TRIA APRILIANI NRP.1413 100 004 Dosen Pembimbing Dr. Yuly Kusumawati, M. Si. JURUSAN KIMIA FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT TEKNOLOGI SEPULUH NOPEMBER SURABAYA 2017 Script Computational Study of Electronic Properties of Carbazole Derivatives Compounds as Sensitizer on Dye-Sensitized Solar Cells (DSSC) ANNISA TRIA APRILIANI NRP.1413 100 004 Advisor Lecturer Dr. Yuly Kusumawati, M. Si. CHEMISTRY DEPARTMENT FACULTY OF MATHEMATICS AND NATURAL SCIENCES INSTITUT TEKNOLOGI SEPULUH NOPEMBER SURABAYA 2017 ii Studi Komputasi Sifat Elektronik Senyawa Turunan Carbazole sebagai Sensitiser pada Dye-Sensitized Solar Cell (DSSC) SKRIPSI Disusun sebagai syarat untuk menyelesaikan mata kuliah Tugas Akhir Program Studi S-1 Di Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Teknologi Sepuluh Nopember Surabaya ANNISA TRIA APRILIANI NRP. 1413 100 004 Dosen Pembimbing Dr. Yuly Kusumawati, M. Si. JURUSAN KIMIA FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT TEKNOLOGI SEPULUH NOPEMBER SURABAYA 2017 iii HALAMAN PENGESAHAN Studi Komputasi Sifat Elektronik Senyawa Turunan Carbazole sebagai Sensitiser pada Dye-Sensitized Solar Cells (DSSC) SKRIPSI Annisa Tria Apriliani NRP. 1413 100 004 Surabaya, 27 Januari 2017 Menyetujui, Dosen Pembimbing Dr. Yuly Kusumawati, M. Si NIP. 19810128 200812 2 003 Mengetahui, Ketua Jurusan Kimia Prof. Dr. Didik Prasetyoko, S.Si., M.Sc. NIP. 19710616 199703 1 002 iv Karya ini ku persembahkan untuk Ibu, Bapak, Mas Kukuh dan Mas Wahyu yang aku sayangi Teman dan shabat terdekatku Dan seluruh keluarga ANORTHITE v Studi Komputasi Sifat Elektronik Senyawa Turunan Carbazole sebagai Sensitiser pada Dye-Sensitized Solar Cells (DSSC) Nama NRP Jurusan Dosen Pembimbing : Annisa Tria Apriliani : 1413100004 : Kimia : Dr. Yuly Kusumawati, M. Si ABSTRAK Studi komputasi pengaruh penambahan gugus pendorong elektron –OCH3, -NHCH3, -OC5H11 dan –NH(C5H11) terhadap sifat elektronik senyawa golongan carbazole telah diteliti menggunakan metode DFT dan TDDFT pada tingkat teori CAMB3LYP dan basis set 6-31G*. Struktur teroptimasi dari molekul didapatkan dari metode DFT dan sifat elektronik diteliti menggunakan TDDFT titik tunggal. Sifat elektronik yang diperhitungkan adalah tingkat energi HOMO-LUMO, profil rapatan orbital HOMO-LUMO, spektrum UV-Vis, kuantitas transfer muatan dan jarak pemisahan muatan molekul pada keadaan dasar dan keadaan tereksitasi. Hasil menunjukkan bahwa penambahan gugus pendorong elektron yang memiliki rantai panjang, -NH(C5H11) atau CT_NC5 menunjukkan hasil yang paling baik. Diperoleh bahwa kontribusi transisi HOMO ke LUMO pada CT_NC5 adalah 77%, kuantitas transfer muatan (qCT) 1,004 dan ELUMO= -1,810 eV. Kata Kunci: Sifat elektronik, DFT, TDDFT, carbazole, Dyesensitized solar cells (DSSC). vi Computational Study of Electronic Properties of Carbazole Derivatives Compounds as Sensitizer on Dye-Sensitized Solar Cells (DSSC) Name NRP Department Advisor : Annisa Tria Apriliani : 1413100004 : Chemistry : Dr. Yuly Kusumawati, M. Si. ABSTRACT The effect of the addition electron donating moiety – OCH3, -NHCH3, -OC5H11 and –NH(C5H11) to the electronic properties of carbazole dye, CT2 have been studied using DFT and TDDFT methode at CAM-B3LYP level theory and 6-31G* basis set. The optimized structure were obtained from DFT calculation, whilst electronic properties were obtained using single point TDDFT calculation. The calculated electronic properties were HOMO-LUMO energy level, UV-Vis absorption spectrum, charge transfer quantity and chare transfer distance at ground state and excitation state. The result reveal that addition of long alkyl electron donating moiety –NH(C5H11) or CT_NC5, give the best result. Contribution HOMO-to-LUMO transition in CT_NC5 molecule of 77%, the quantify charge transfer (qCT) of 1,004 and LUMO energy (ELUMO = of -1,810 eV). Overall, CT_NC5 gave the best result. Keywords: Electronic properties, DFT, TDDFT, carbazolebased-dyes, Dye-sensitized solar cells (DSSC) vii KATA PENGANTAR Alhamdulillahirobbil’alamin. Puji syukur penulis panjatkan kepada Allah SWT yang telah melimpahkan rahmat dan karuniaNya sehingga naskah Tugas Akhir berjudul “Studi Komputasi Sifat Elektronik Senyawa Turunan Carbazole sebagai Sensitiser pada Dye-Sensitized Solar Cell (DSSC)” dapat diselesaikan dengan baik. Tulisan ini tidak akan terwujud dengan baik tanpa bantuan dan dukungan dari semua pihak. Untuk itu penulis sangat berterima kasih kepada : 1. Ibu Dr. Yuly Kusumawati, M. Si. selaku dosen pembimbing yang telah memberikan pengarahan dan bimbingan selama proses penyusunan naskah Tugas Akhir ini. 2. Prof. Dr. Didik Prasetyoko, M.Sc., selaku Ketua Jurusan Kimia atas fasilitas yang telah diberikan hingga naskah Kolokium ini dapat terselesaikan. 3. Ibu Dra. Afifah Rosyidah, selaku dosen wali saya yang telah memberikan semangat dan masukan selama ini. 4. Kedua orang tua dan kedua kakak saya yang selalu memberikan semangat, dukungan dan doa untuk saya. 5. Sahabat-sahabatku yang selalu memberikan dukungan moril untuk saya. Semua pihak yang telah membantu yang tidak mungkin saya sebutkan satu persatu. Semoga tugas akhir ini memberikan manfaat bagi penulis dan pembaca. Surabaya, 6 Januari 2017 Penulis viii DAFTAR ISI HALAMAN JUDUL .............................................................. ii HALAMAN PENGESAHAN................................................ iv ABSTRAK ............................................................................. vi KATA PENGANTAR ......................................................... viii DAFTAR ISI.......................................................................... ix DAFTAR GAMBAR ............................................................ xii DAFTAR TABEL................................................................ xiv DAFTAR SINGKATAN PENTING .................................... xv BAB I PENDAHULUAN ....................................................... 1 1.1. Latar Belakang ........................................................ 1 1.2. Pemasalahan............................................................ 4 1.3. Batasan Masalah ..................................................... 5 1.4. Tujuan Penelitian .................................................... 5 BAB II TINJAUAN PUSTAKA ............................................ 7 2.1. Energi Surya................................................................. 7 2.2. Dye-sensitized Solar Cell (DSSC) ............................... 8 2.2.1. TCO (Transparent Conductive Oxide) ...................... 9 2.2.2. Zat Warna Pemeka .................................................. 10 2.2.3. Semikonduktor ........................................................ 12 2.2.4. Elektrolit ................................................................. 17 2.2.5. Elektroda Pembanding ............................................ 19 2.3. Prinsip Kerja DSSC ................................................... 20 ix 2.4. Kimia Kuantum .......................................................... 22 2.5. Density Functional Theory (DFT) ............................. 24 2.6. Basis Set ..................................................................... 26 2.7. TDDFT (Time Dependent Density Functional Theory)27 BAB III METODE PENELITIAN ....................................... 31 3.1 Perlatan yang Digunakan ............................................ 31 3.1.1. Perangkat keras ....................................................... 31 3.1.2. Perangkat lunak ....................................................... 31 3.2. Metode Perhitungan .............................................. 31 3.2.1. Pembuatan Model Awal .......................................... 32 3.2.2. Optimasi Geometri .................................................. 33 3.2.3. Perhitungan TDDFT ............................................... 33 3.2.4. Perhitungan Energi Transfer Muatan ...................... 34 BAB IV HASIL DAN PEMBAHASAN .............................. 35 4.1. Optimasi Geometri ..................................................... 35 4.2. Penentuan Metode Teori Perhitungan ........................ 35 4.3. Penyelidikan Sifat Elektronik dalam Zat Warna CB1 dan CT2 ................................................................................... 37 4.4. Pengaruh Penambahan Gugus Pendorong Elektron terhadap Sifat Elektronik Zat Warna CT2 ........................ 44 4.5. Pengaruh Perpanjangan Rantai Karbon pada Pendorong Elektron terhadap Sifat Elektronik Zat Warna .................. 51 BAB V KESIMPULAN DAN SARAN................................ 61 5.1. Kesimpulan ................................................................ 61 x 5.2. Saran .......................................................................... 61 DAFTAR PUSTAKA ........................................................... 63 LAMPIRAN.......................................................................... 79 Biodata Penulis......................................................................83 xi DAFTAR GAMBAR Gambar 2 1 Sistem D-π-A dalam struktur zat warna organik. Gugus donor (biru), π-konjugasi (merah) dan gugus penerima (hijau) .................................................................................... 11 Gambar 2 2 Skema diagram energi insulator, semikonduktor dan konduktor .............................................................................. 13 Gambar 2 3 Diagram energi beberapa semikonduktor ......... 15 Gambar 2 4 Skema kerja DSSC ............................................ 21 Gambar 3 1 Skema penelitian ............................................... 32 Gambar 4 1 Spektra UV-Vis senyawa CB1 dan CT2 dengan basis set B3LYP dan CAM-B3LYP...................................... 36 Gambar 4 2 Struktur teroptimasi CB1 (atas) CT2 (kiri) ....... 38 Gambar 4 3 Spektra absorpsi UV-Vis CB1 dan CT2 ........... 38 Gambar 4 4 HOMO-2 (atas); HOMO (baris 2); gambaran DCT (baris 3) dan LUMO (bawah)................................................ 41 Gambar 4 5 Diagram energi HOMO-LUMO CB1 dan CT2 42 Gambar 4 6 Struktur teroptimasi CT_Metoksi (atas) dan CT_NC5 (bawah) .................................................................. 45 Gambar 4 7 Spektra absorpsi UV-Vis zat warna CT_Metoksi dan CT_NC1 ................................................................................ 45 Gambar 4 8 (Atas) HOMO, (tengah) penggambaran DCT (bawah) LUMO dari senyawa CT_Metoksi (kiri) dan CT_NC1 (kanan) .................................................................................. 48 Gambar 4 9 Diagram energi CT_Metoksi dan CT_NC1 ...... 49 Gambar 4 10 Struktur teroptimasi CT_Pentoksi (atas) dan CT_NC5 (bawah) .................................................................. 52 Gambar 4 11 Spektra absorpsi UV-Vis zat warna CT_Pentoksi dan CT_NC5 ......................................................................... 53 Gambar 4 12 Spectra perbandingan CT_Metoksi-CT_Pentoksi (atas) dan CT_NC1-CT_NC5 (bawah) ................................. 55 xii Gambar 4 13 (Atas) HOMO, (tengah) penggambaran DCT (bawah) LUMO dari senyawa CT_Pentoksi (kiri) dan CT_NC5 (kanan) .................................................................................. 57 Gambar 4 14 Diagram energi CT_Pentoksi dan CT_NC5.... 58 xiii DAFTAR TABEL Tabel 4 1 Perbandingan nilai λ spektra UV-Vis berdasar eksperimen dan perhitungan komputasi dengan fungsi B3LYP dan CAM-B3LYP ................................................................. 36 Tabel 4 2 Spektra TD-DFT terhitung dari CB1 dan CT2 dengan kekuatan osilator, f>0,1......................................................... 39 Tabel 4 3 Nilai DCT dan qCT zat warna CB1 dan CT2 .......... 40 Tabel 4 4 Spektra TD-DFT terhitung untuk CT_Metoksi dan CT_NC1 dengan kekuatan osilator, f>0,1 ............................ 46 Tabel 4 5 Nilai DCT dan qCT zat warna CT_Metoksi dan CT_NC1 .............................................................................................. 47 Tabel 4 6 Spektra TD-DFT terhitung untuk CT_Pentoksi dan CT_NC5 dengan kekuatan osilator, f>0,1 ............................ 54 Tabel 4 7 Nilai DCT dan qCT senyawa CT_Pentoksi dan CT_NC5 .............................................................................................. 56 xiv DAFTAR SINGKATAN PENTING ALDA Adiabatic Local Density Approximation B3LYP Fungsi Hybrid 3 Parameter CAM-B3LYP Fungsi Hybrid 3 Parameter yang melibatkan Gaya Coulomb dalam fungsi korelasi CB Conduction band (pita konduksi) DCT Charge Transfer Distance DFT Density Functional Theory DSSC Dye-Sensitized Solar Cell Ev Electron volt FTO Flouride dopped Tin Oxide HOMO Highest Occupied Molecular Orbital ITO Indium Tin Oxide KEN Kebijakan Energi Nasional LUMO Lowest Unoccupied Molecular Orbital PV Photovoltaic STO-3G Slater Type Orbital 3G (3fungsi Gaussian) TCO Transparent Conductive Oxide xv TDDFT Time Dependent – Density Functional Theory QCT Quantify of Charge Transfer xvi BAB I PENDAHULUAN 1.1. Latar Belakang Energi adalah besaran yang kekal, yang artinya energi tidak dapat diciptakan ataupun dimusnahkan tetapi enrgi dapat diubah dari bentuk satu ke bentuk yang lain. Salah satunya adalah energi panas menjadi energi listrik. Selain itu, energi merupakan salah satu kebutuhan mendasar dalam kehidupan manusia. Kebutuhan energi primer dunia diperkirakan akan meningkat cukup tinggi seiring dengan pertumbuhan populasi dan perkembangan ekonomi dunia (Internationak Energy Agency, 2013). Konsumsi energi terbesar terjadi pada sektor industri dengan kebutuhan pada tahun 2013 sebesar 38% dari jumlah kebutuhan energi total dan diproyeksikan akan terus meningkat hingga tahun 2050 dengan laju pertumbuhan 4,4% per tahun berdasarkan skenario Kebijakan Energi Nasional (KEN) (DEN, 2014). Beberapa sumber energi yang utama digunakan sekarang adalah bahan bakar fosil, minyak bumi dan gas alam. Ketiga sumber tersebut termasuk dalam sumber energi tak dapat diperbaharui. Keadaan pola energi yang terus meningkat menyebabkan sumber energi hanya cukup untuk beberapa puluh tahun kedepan (Shafiee & Topal, 2009). Kelemahan lain yang dimiliki oleh bahan bakar fosil adalah dampak negatifnya terhadap lingkungan. Hasil pembakaran mereka melepaskan gas CO2 ke atmosfer sehingga menyebabkan efek rumah kaca dan menimbulkan perubahan iklim serta global warming (Steinberg, 1999). 1 Salah satu sumber energi terbaharui yang berpotensi untuk menjadi solusi permasalahan diatas adalah energi surya karena energi surya memiliki tiga kriteria menjadi sumber energi yaitu ketahanan, bersih dan rendah resiko. Tiga kriteria tersebut penting untuk mempertahankan sistem energi untuk waktu yang lama (Jacobson & Delucchi, 2011). Teknologi surya mempunyai peran penting dan telah menjadi pesaing bahan bakar fosil yang menjanjikan sebagai sumber energi. Tipe teknologi pembangkit listrik pada energi surya adalah photovoltaic (PV). Tipe ini diaplikasikan dalam suatu semikonduktor yang disebut dengan sel surya. Peningkatan dalam bidang sel surya bertujuan untuk meningkatkan efisiensi dan meminimalisir biaya produksi. Salah satu teknologi yang muncul dari sel surya adalah penggunaan zat warna untuk menangkap cahaya matahari yang disebut dengan Dye-sensitized solar cells (DSSC). Salah satu komponen penting dalam DSSC adalah zat warna sensitiser, yang memiliki peran dalam menyerap sinar matahari. Sejauh ini, zat warna pemeka berbasis Ruthenium tercatat sebagai zat warna pada DSSC yang memiliki efisiensi lebih dari 11% (Grätzel, 2004; Nazeeruddin, dkk., 2001). Akan tetapi, zat warna berbasis Ruthenium sangat mahal karena ketersediaanya di alam yang terbatas. Oleh karena itu zat warna bebas logam seperti zat warna organik dan zat warna alami menjadi alternatif untuk aplikasi pada DSSC (Goncalves, dkk., 2008). Berbagai desain dan konfigurasi molekul zat warna dikembangkan untuk mendapatkan koefisien konversi energi yang tinggi pada DSSC. Dari berbagai macam desain tersebut, konfigurasi donor-π-acceptor (D-π-A) dari molekul zat warna menunjukkan efisiensi konversi yang menjanjikan. Sejauh ini, 2 gugus pendorong elektron seperti triphenylamine, carbazole, indoline dan lain-lain telah digunakan dalam konfigurasi D-πA untuk mendesain sensitizer yang efisien (Kanaparthi, dkk., 2012; Mishra, dkk., 2009). Senyawa carbazole dan turunannya memiliki karakteristik sifat emisi dan absorsi yang kuat, kemampuan holetransporting yang baik, dan memiliki band gap yang luas sehingga banyak digunakan dalam material optik (Tang, dkk., 2010; Li, dkk., 2011). Turunan carbazole juga telah digunakan sebagai donor elektron dalam beberapa zat warna sensitiser untuk DSSC dengan efisiensi konversi energi yang optimal yaitu 9,20% (Liu, dkk., 2013). Srinivas dkk. juga telah melakukan penelitian tentang penggunaan senyawa turunan carbazole untuk zat warna sensitizer pada DSSC yaitu senyawa CB1 dan CT2. CB1 adalah penamaan untuk senyawa dimana gugus pendorong berupa carbazole dengan sistem jembatan π terdapat gugus benzen, sementara CT2 adalah senyawa dengan gugus pendorong carbazole dan sistem jembatan π terdapat gugus thiopen. Senyawa CB1 memiliki efisiensi 0,695% dan senyawa CT2 memiliki efisiensi 0,819%. Berdasarkan eksperimen yang mereka lakukan belum menunjukkan hasil yang maksimal dikarenakan terjadi kerusakan konjugasi (break conjugation) (Srinivas, dkk., 2011). Dalam rangka menyerap sinar matahari sebanyak mungkin, diperlukan spektrum absorpsi yang lebar. Biasanya perpanjangan sistem konjugasi π merupakan strategi yang umum dilakukan untuk mengatasi permasalahan ini. Akan tetapi sistem konjugasi π yang besar mendorong sifat photovoltaic yang lemah dikarenakan agregasi zat warna, dan juga masalah rekombinasi elektron. Pada DSSC dengan 3 elektrolit berbasis kobalt, untuk mengurangi agregasi zat warna dan rekombinasi elektron, rantai alkoksi atau alkil ditambahkan ke dalam sistem aromatik. Berbagai penelitian telah dilakukan dengan penerapan alkoksi yang besar dan cincin aromatik kedalam sistem donor dan peningkatan efisiensi telah diamati (Shi, dkk., 2012; Su, dkk., 2011; Iqbal, dkk., 2013). Selain itu juga, gugus pendorong juga berpengaruh terhadap spektra absorpsi suatu senyawa. Gugus pendonor tidak hanya dapat mempengaruhi spektra absorpsi tetapi juga mengatur tingkat energi dari zat pemeka. Dan perubahan kecil pada geometri struktur pendonor dapat menghasilkan sifat fotofisika, elektrokimia dan sifat lain yang menarik (Wan, dkk., 2012). Oleh karena itu, pada penelitian ini dilakukan modifikasi desain dari senyawa berbasis carbazole. Modifikasi dilakukan dengan menambahkan gugus alkil pada daerah π-linker dan gugus pendonor elektron seperti gugus alkoksi dan amina pada pendorong carbazole. Pengaruh modifikasi desain senyawa terhadap sifat elektroniknya dilihat berdasarkan hasil perhitungan energi HOMO-LUMO dan spektra UV-Vis yang dilakukan dengan metode DFT (Desnsity Functional Theory) dan TD-DFT (Time Dependent- Desnsity Functional Theory). 1.2. Pemasalahan Senyawa CB1 dan CT2 menurut literatur (Srinivas, dkk., 2011) sebagai zat warna sensitiser pada DSSC masih belum menunjukkan hasil yang optimal dilihat dari efisiensi zat warna dalam sel surya. Modifikasi struktur senyawa diharapkan dapat menjadikan sifat elektroniknya menjadi lebih baik. 4 1.3. Batasan Masalah Modifikasi dilakukan pada senyawa CB1 dan CT2 yang berdasarkan literatur (Srinivas, dkk., 2011). Modifikasi dilakukan dengan menambahkan gugus alkil pada πlinker dan penambahan gugus alkoksi serta amina pada pendorong carbazole. Perhitungan dilakukan dengan metode DFT (Desnsity Functional Theory) dan TD-DFT (Time Dependent- Desnsity Functional Theory). Sifat elektronik yang diperhitungkan adalah tingkat energi HOMO-LUMO, spektrum UV-Vis, profil rapatan orbital HOMO-LUMO, perhitungan kuantitas transfer muatan dan perhitungan jarak pemisahan muatan molekul pada keadaan dasar dan keadaan tereksitasi. 1.4. Tujuan Penelitian Pada penelitian ini bertujuan untuk melakukan modifikasi struktur molekul CT2 serta mengetahui pengaruh modifikasi tersebut terhadap sifat elektronik senyawa. 5 “Halaman Ini Sengaja Dikosongkan” 6 BAB II TINJAUAN PUSTAKA 2.1. Energi Surya Energi surya dapat digunakan secara langsung tanpa perlu diubah ke bentuk lainnya salah satunya pada proses pengeringan tradisional. Hal ini merupakan penggunaan energi yang sederhana dan mudah. Dengan meningkatnya kebutuhan energi dalam berbagai sektor, energi surya menjadi lebih bermanfaat dengan mengubahnya menjadi listrik. Teknologi surya memiliki peran penting dalam menjadi pesaing yang menjanjikan untuk bahan bakar fosil sebagai sumber energi. Perintis teknologi yang mengubah energi surya menjadi lebih berguna pertama kali muncul pada tahun 1860. Pada saat itu mereka mengembangkan teknologi untuk menangkap panas matahari. Panas ini kemudian digunakan untuk menghasilkan uap air (panas) untuk menjalankan mesin dan pompa irigasi. Jenis lain dari teknologi penghasiol listrik dari energi surya adalah photovoltaic (PV). Pengaruh photovoltaic ditemukan oleh Alexandte Edmond Becquerel pada tahun 1839. Efek photovoltaic ini diproduksi dalam semikonduktor yang dapat menyerap cahaya pada daerah spektrum radiasi cahaya matahari. Penyerapan cahaya ini menghasilkan eksitasi muatan, yang kemudian terpisah, mendorong aliran elektron, menghasilkan beda potensial dan akhirnya menghasilkan arus listrik. Sejak fabrikasi sel surya silika pertama pada tahun 1954 di laboratorium Bell, United States, hingga kini banyak teknologi photovoltaic yang telah dikembangkan. Sel surya berbasis kristal silika merupakan teknologi yang memimpin di pasar sel surya. Teknologi baru 7 untuk mencari material alternatif yang lebih rendah energi sehingga dapat menggantikan sel surya berbasis silika juga dikembangkan (Devabhaktuni, dkk., 2013; Timilsina, dkk., 2012). 2.2. Dye-sensitized Solar Cell (DSSC) Dye Sentitized Solar Cell (DSSC) “klasik” pertama kali ditemukan oleh Michael Gratzel dan Brian O’Regan pada tahun 1991 di École Polytechnique Fédérale de Lausanne, Swiss (O'Regan & Grätzel, 1991). DSSC merupakan terobosan pertama dalam teknologi sel surya sejak sel surya silikon. Perbedaan antara DSSC dan sel surya konvesional adalah DSSC merupakan sel surya fotoelektrokimia menggunakan elektrolit sebagai medium transport muatan (Smestad & Grätzel, 1998). DSSC merupakan piranti photovoltaic yang mengubah energi surya menjadi listrik. Agar proses proses konversi itu terjadi, DSSC membutuhkan zat warna yang berperan sebagai sensitizer untuk menyerap cahaya matahari, material semikonduktor yang menampung elektron hasil eksitasi zat warna dan mentransfernya ke penghubung bagian depan. Kemudian muatan harus mencapai elektroda pembanding dan zat warna yang teroksidasi diregenerasi oleh pasangan redoks yang terlarut dalam larutan elektrolit. DSSC terdiri dari lima komponen, yaitu : (1) Transparent conductive oxide (TCO), (2) semikonduktor, (3) dye sentitizer, (4) elektrolit dan (5) elektroda pembanding. 8 2.2.1. TCO (Transparent Conductive Oxide) TCO yang terlapis kaca berfungsi sebagai substrat untuk meletakkan fotoanoda dan elektroda pembanding. Untuk pengaplikasiannya, TCO harus transparan (transmitan > 80%) dan konduktif (resistan <10-3 Ω cm). Dua jenis TCO yang paling sering digunakan dalam DSSC adalah ITO (indium tin oxide) yang tersusun dari 90 wt% In2O3; 10 wt% SnO2 dan FTO (flourin doped tin oxide) (Magne, 2012). Sima dkk telah mempelajari pengaruh jenis TCO yang digunakan dalam DSSC dan hasilnya menunjukkan bahwa sel yang menggunakan FTO sebagai substrat memiliki efisensi 9,6% dimana jauh lebih tinggi daripada ITO yang hanya mencapai 2,24%. Kinerja yang luar biasa dari FTO ini dikarenakan resistivitas FTO yang lebih kecil daripada ITO (8,5 Ω/sq vs 18 Ω/sq). Selain itu, resistivitas FTO lebih stabil terhadap termal. Resistivitasnya tidak berubah setelah perlakuan pemanasan pada 450°C, sementara resistivitas ITO meningkat hingga 52 Ω/sq dengan perlakuan yang sama (Sima, dkk., 2010). Sayangnya, FTO merupakan material yang rapuh. Kerapuhan material tersebut membatasi penggunaannya (Jena, dkk., 2012). DSSC yang fleksibel penting dalam aplikasinya untuk mebuat sel mudah ditanamkan dalam bangunan ataupun peralatan elektronik seperti komputer atau telepon genggam. Selain itu, DSSC yang fleksibel juga penting dalam permasalahan fabrikasi, untuk mewujudkan produksi skala besar (Weerasinghe, dkk., 2013). Material lain seperti logam, karbon, plastik atau polimer yang lain telah diteliti untuk diterapkan dalam rangka membuat DSSC yang fleksibel. 9 2.2.2. Zat Warna Pemeka Untuk mendapatkan performa yang baik, zat warna sensitiser harus memenuhi beberapa persyaratan. (1) Idealnya, mampu menyerap semua cahaya matahari mulai dari panjang gelombang dekat-IR hingga mencapai 920 nm, (2) secara struktur harus memiliki gugus fungsi yang mampu mengikat zat warna ke permukaan semikonduktor, yang secara umum gugus karboksilat atau fosfonat, (3) harus memiliki energi Lowest Unoccupied Molecular Orbital (LUMO) dibawah pita konduksi dari semikonduktor untuk menjamin terjadinya injeksi elektron, (4) posisi energi Highest Occupied Molecular Orbital (HOMO) harus berada dibawah potensial redoks dari elektrolit, (5) memiliki stabilitas yang baik. Jika zat warna masih memiliki performa yang baik setelah 108 putaran, hal tersebut sama dengan 20 tahun stabil untuk menyerap cahaya matahari (Hagfeldt, dkk., 2010; Jena, dkk., 2012). Zat warna untuk DSSC dapat dibagi menjadi 2 jenis, yaitu senyawa kompleks logam seperti rhutenium, osmium, besi atau kompleks berbasis seng dan yang kedua senyawa organik diantaranya indolin, kumarin dan carbazole. Barubaru ini, Mathew dkk telah berhasil menyiapkan sel dengan efisiensi sebesar 13% menggunakan zat warna kompleks seng-porpirin (Mathew, dkk., 2014). Hingga saat ini, hampir semua zat warna ditandai dengan struktur donor-π-akseptor (D-π-A) (Hagfeldt, dkk., 2010; Manoharan & Anandan, 2014). Diantara mereka, gugus pendonor tidak hanya dapat mempengaruhi spektra absorpsi tetapi juga mengatur tingkat energi dari sensitiser. Dan perubahan kecil pada geometri struktur pendonor dapat menghasilkan sifat fotofisika, elektrokimia dan sifat lain yang 10 menarik (Wan, dkk., 2012). Oleh karena itu, penelitian dari gugus pendonor dari sistem D-π-A sangat penting untuk menyeimbangkan photovoltage, gaya dorong atau driving forces dan respon spektral. Gambar 2 1 Sistem D-π-A dalam struktur zat warna organik. Gugus donor (biru), π-konjugasi (merah) dan gugus penerima (hijau) Sumber: Srinivas dkk, 2011 Hingga saat ini, banyak penelitian tentang investigasi pengaruh unit pendonor yang berbeda terhadap sifat zat warna. Tamilvan dkk. meneliti pengaruh pendonor yang berbeda (metoksi atau heksiloksi tersubstitusi trifenilamin dan difluorenephenylamine) pada sifat zat warna, dan mereka menemukan bahwa sifat optik, elektrokimia dan sifat photovoltaic dari zat warna dapat terpengaruh oleh efek sterik gugus pendonor elektron (Tamilvan, dkk., 2012). Hal yang sama juga dilakukan oleh Tian dkk., dimana mereka meneliti pengaruh unit pendonor (10-phenyl-10H-phenothiazine, 10phenyl-10H-phenoxazine dan triphenylamine) pada performa DSSC. Mereka menemukan bahwa variasi struktur dari 11 pendonor elektron mempunyai pengaruh tidak hanya pada charge combination, tetapi juga pada tepi pita konduksi (Guo, dkk., 2013). 2.2.3. Semikonduktor Semikonduktor oksida berperan penting dalam DSSC. Dia menerima elektron dari zat warna yang tereksitasi yang menempel pada permukaan dan berperan sebagai material pentransport elektron yang memastikan transfer elektron menuju bagian depan dari sel surya. Untuk memahami kenapa celah pita semionduktor yang lebar digunakan pada fotoanoda DSSC, salah satunya harus digambarkan sifat elektronik dari material (Kusumawati, 2015). Berdasarkan konduktivitas listriknya, material solid state dibagi menjadi 3 kategori yaitu insulator, semikonduktor dan konduktor. Sifat konduktivitas mereka dapat dijelaskan dengan menjabarkan sifat elektronik solid state. Pertama, dilihat dari skala atomik. Setiap atom memiliki orbital atom yang dipenuhi dengan elektron dan lainnya kosong. Orbital yang terisi elektron memiliki energi yang lebih rendah jika dibandingkan dengan yang kosong. Orbital terisi yang memiliki energi tertinggi disebut HOMO (Highest Occupied Molecular Orbital) dan yang lain memiliki energi kosong terendah disebut LUMO (Lowest Unoccupied Molecular Orbital). Dalam kasus material padat ada atom dengan jumlah yang banyak. Sebagai konsekuensinya, kulit terluar, suk-kulit dan gabungan orbital, menyediakan lebih banyak dari tingkat energi yang tersedia, kemudian akhirnya membentuk pita energi yang kontinu. Sehingga HOMO pada suatu atom menjadi pita valensi pada padatan dimana LUMO menjadi pita konduksi. Pada beberapa padatan, ada jarak antara pita 12 konduksi dan pita valensi yang disebut dengan jarak pita (band gap). Itu juga disebut pita terlarang dimana tidak ada kemungkinan untuk mencari elektron. Informasi mengenai tingkat energi pada material solid state dapat ditampilkan pada diagram energi (Kusumawati, 2015). Gambar 2.2 menunjukkan diagram energi dari insulator, semikonduktor dan konduktor. Jarak pita pada insulator merupakan yang terbesar, diatas 6 eV pada suhu ruang. Hal ini mengindikasikan bahwa energi diatas nilai tersebut harus ditransfer oleh elektron tereksitasi dari pita valensi menuju pita konduksi. Kebalikannya, material konduktor tidak memiliki jarak pita dan pita konduksinya sebagian terisi. Semikonduktor memiliki sifat elektronik intermediet diantara insulator dan konduktor. Semikonduktor yang paling sering digunakan adalah gerranium yang memiliki energi jarak pita 0,72 eV dan silika yang memiliki energi jarak pita 1,1 eV (Sharma, 1996). Energi jarak pita untuk semikonduktor oksida umumnya sedikit lebih besar, contohnya TiO2 yaitu 3,2-3,4 eV; ZnO = 3,2 eV dan SnO2 = 3,8 eV (Gong, dkk., 2012). Gambar 2 2 Skema diagram energi insulator, semikonduktor dan konduktor 13 Karena sifat elektroniknya yang unik, semikonduktor banyak digunakan dalam perangkat elektronik. Konduktivitasnya dapat dikontrol dengan menerapkam energi tertentu yang sesuai dengan energi jarak pitanya. Dalam hal perangkat sel surya photovoltaic, energi cahaya matahari merupakan sumber untuk menghasilkan energi listrik. Ada banyak macam perangkat sel surya yang berbeda. Perkembangan DSSC dimotivasi dengan mengganti sel surya silika dengan solar sel yang lebih murah. TiO2 anatase telah dipilih sebagai jantung dari DSSC karena harganya yang murah, ketersediaannya, stabilitas kimia dan kemampuan absorpsinya. Titanium dioksida semikonduktor dengan celah pita yang lebar dengan berbagai keuntungan sifat kimia, struktur, sifat optik, dan sifat elektronik (Facci & Huguenin, 2010; Fenoglio, dkk., 2009; Khare, dkk., 2011; Kozeij, dkk., 2009; Liao, dkk., 2012; Nussbaumer, dkk., 2003). Aplikasi utama dari TiO2 antara lain pigmen (Liao, dkk., 2012), pelapis (Parkin & Palgrave, 2005), sensor gas (Karunagaran, dkk., 2007), baterai (Wang, dkk., 2009), fotokatalisi (Fujishima, dkk., 2008; Linsebigler, dkk., 1995) dan bidang energi misalnya produksi hidrogen (Ni, dkk., 2007) dan sel surya (Burschka, dkk., 2013; Kim, dkk., 2012; Liu & Kelly, 2014). Perbedaan struktur polimorf dari TiO2 (anatase, brookit dan rutile) menyebabkan adanya perbedaan sifat. Berdasarkan ketiga polimorf TiO2, anatase merupakan fase yang banyak digunakan daam literatur DSSC karena konduktivitasnya yang baik (Hagfeldt, dkk., 2010; Reyes-Coronado, dkk., 2008). Selain itu, permukaan anatase (101) memiliki energi 14 permukaan yang paling rendah yang akan membantu adsorpsi zat warna (Fisher, dkk., 2000). Terdapat beberapa data pada DSSC yang menggunakan fasa rutile. DSSC berbasis fasa rutile telah menarik beberapa perhatian karena potensi biaya produksinya yang murah dan keunggulan karakteristik persebaran cahaya yang dapat berguna untuk penyerapan cahaya matahari (Bisquert & Vikhrenko, 2004; Magne, dkk., 2011; Thomas & Syres, 2012). Selain TiO2, ada semikonduktor lain yang memiliki potensi untuk digunakan karena sifat elektroniknya mirip dengan TiO2. Gambar 2.3 menunjukkan diagram energi dari semikonduktor alternatif bersama tingakt energi dari beberapa pasangan redoks (Gong, dkk., 2012). ZnO merupakan semikonduktor yang paling banyak diteliti setelah TiO2. Gambar 2 3 Diagram energi beberapa semikonduktor Sumber: Gong dkk, 2012 ZnO dapat digunakan sebagai material alternatif untuk menggantikan TiO2 dalam DSSC. ZnO wurtzite merupakan 15 struktur kristal paling stabil dari ZnO. Dibandingkan TiO2, ZnO memiliki mobilitas elektron dan koefisien difusi yang lebih tinggi. Hal ini berpotensi menguntungkan untuk aplikasi DSSC karena dapat menimbulkan transfer muatan dan mengurangi rekombinasi muatan yang cepat (Quintana, dkk., 2009). Terdapat banyak faktor yang telah dilaporkan tentang batasan aplikasi ZnO dalam DSSC dan berperan dalam efisiensi yang lebih rendah dari DSSC berbasis ZnO dibandingkan dengan TiO2. Faktor ini adalah injeksi elektron yang lambat, regenerasi zat warna yang rendah (Quintana, dkk., 2007) dan ketidakstabilitasan ZnO dalam zat warna asam (Zhang, dkk., 2009). Perbedaan kinetika injeksi antara ZnO dan TiO2 dijelaskan dengan perbedaan dalam pita konduksi dari struktur dan mekanisme injeksi elektron dari ZnO yang terlewat melalui keadaan intermediet (Zhang, dkk., 2009). Zat warna yang biasanya digunakan dalam DSSC akan terikat pada permukaan TiO2 melalui ikatan dengan gugus karboksil dari zat warna. Ikatan ini sulit terbentuk pada ZnO, karena tidak stabil pada kondisi larutan asam dari zat warna. Selain itu kondisi ini dapat menyebabkan aglomerasi Zn2+ dengan zat warna. Perhatian utama dari ZnO adalah kristalisasi dan pertumbuhan anisotropiknya yang relatif mudah. Selain itu preparasi struktur ZnO dengan berbagai bentuk juga cukup mudah. Nanostruktur 1 dimensi dari Z nO yang disemut nanowire, penting dalam DSSC karena dapat mengurang laju rekombinasi (Zhang, dkk., 2009). Nanowire ZnO bercabang 16 juga menarik dikarenakan kemampuannya untuk menyerap zat warna pemeka yang lebih banyak (Omar & Abdullah, 2014). Material lain yang menarik adalah partikel heksagonalbatang ZnO yang berdiameter 35 nm. Struktur ini digunakan untuk preparasi lapisan berpori dengan sintering yang memfasilitasi transport muatan elektron. Selain itu, hal tersebut menghadirkan pori yang lebih besar yang menyediakan ruang yang baik untuk sensitasi zat warna dan penetrasi elektrolit dan menghasilkan efisiensi konversi yang lebih baik dibandingkan bentuk yang lain (Hosni, 2014). 2.2.4. Elektrolit Elektrolit terdiri dari pasangan redoks dan aditif yang terlarut dalam pelarut organik. Komponen paling penting dari elektrolit adalah pasangan redoks. Peran pasangan redoks adalah untuk meregenerasi zat warna yang terokdidasi dengan menyediakan sebuah elektron. I3-/I- adalah pasangan redoks paling popular yang digunakan dalam DSSC sejak hasil rintisan oleh O’Regan dan Gratzel pada tahun 1991 (O'Regan & Grätzel, 1991). Keuntungan utamanya terdapat pada kinetika reduksi yang lambat dari I3- dan reaksi parasit rekombinasi yang lambat (Gong, dkk., 2012). Bahkan, I3-/Ihampir memenuhi kebutuhan utama dari komponen elektrolit yaitu: potensial redoks harus dibawah tingkat HOMO dari zat warna, regenerasi secara efisien zat warna, konduktivitas tinggi (~10-3 S.cm-1), mudah menembus kedalam pori fotoanoda, kontak yang baik antara fotoanoda dan elektroda pembanding. Bahkan, dia tidak menyebabkan desorpsi zat warna dari fotoanoda, tidak merusak segel sel dan memiliki stabilitas kimia dan termal yang baik (Boschloo & Hagfeldt, 2009; Jena, dkk., 2012). 17 Perkembangan pada penelitian DSSC menunjukkan bahwa pasangan redoks I3-/I- bukan merupakan elektrolit terbaik untuk DSSC karena dia bersifat korosif terhadap logam termasuk Ag, Au dan Cu, yang membuat pemilihan material untuk modul DSSC sangat terbatas. I3-/I- juga memiliki 2 kekurangan yang lain: pertama, dia menyerap cahaya pada daerah panjang gelombang 350-450 nm dan kedua, nilai potensial reduksinya cukup rendah dan membatasi tegangan rangkaian terbuka pada DSSC (Fan, dkk., 2013; Feldt, dkk., 2011; Hamann, 2012; Klahr & Hamann, 2009). Pasangan redoks kobalt (II)/(III) merupakan salah satu kandidat utama untuk menggantikan I3-/I-. Mereka memiliki sifat yang menjanjikan seperti absorbansi pada daerah 350450 nm yang lebih sedikit dibandingkan dengan I3-/I-, sifat rendah korosif, dengan mengubah ligan atau dengan menambahkan substituen tertentu ke ligan dapat disesuaikan dengan potensial ground state zat warna, dalam hal regenerasi zat warna dengan kehilangan over-potential yang minimal (Feldt, dkk., 2011; Hamann, 2012; Yum, dkk., 2012). Akan tetapi, kompleks kobalt (II)/(III) memiliki struktur yang bulki yang menghalangi transport masa melalui fotoelektroda dan memiliki kinetika rekombinasi yang cukup cepat dengan elektron dari pita konduksi TiO2 (Hamann, 2012). Beberapa usaha telah dilakukan untuk mengatasi batasan DSSC berbasis kobalt. Pemanfaatan fotoelektroda tipis dan lebih berpori dibutuhkan untuk memfasilitasi transport masa dari spesi redoks kobalt (Feldt, dkk., 2010; Hamann, 2012; Pazoki, dkk., 2014). Beberapa peneliti 18 menutupi permukaan TiO2 menggunakan alumina untuk mempasifkannya. Alumina dapat menghambat rekombinasi elektron dengan berperan sebagai penghalang antara elektron konduktif dan mediator redoks (Pascoe, dkk., 2013). Menggunakan zat warna yang memiliki rantai alkil yang panjang atau gugus alkoksi yang bulki dapat menghalangi rekombinasi pada semikonduktor dan antarmuka elektrolit (Bai, dkk., 2011; Feldt, dkk., 2010; Feldt, dkk., 2011). Penambahan aditif pada performa sel berbasis kobalt telah diteliti. Dilaporkan bahwa meningkatkan Li+ mendorong meningkatnya masa hidup elektron dikarenakan reduksi dari laju transfer muatan sebagai akibat dari menurunnya konsentrasi Co3+ lokal. Penambahan 4-tert-butilpiridin dengan kehadiran Li+ memfasilitasi transfer muatan dari Co2+ menuju kation zat warna dan kemudian miningkatkan arus pendek (JSC) (Feldt, dkk., 2010). 2.2.5. Elektroda Pembanding Pada DSSC, elektroda pembanding mempercepat reaksi reduksi spesi kumparan teroksidasi. Seperti telah disebutkan dalam seksi TCO sebelumnya, khususnya FTO, secara sederhana digunakan sebagai elektroda pembanding setelah diaktivasi dengan endapan dari suatu katalis. Katalis yang paling sering digunakan adalah platinum (Pt) (Jena, dkk., 2012). Pt disimpan dalam substrat dengan annealing termal suatu garam, elektrodeposisi atau deposisi uap. Untuk membatasi biaya, sejumlah kecil Pt disimpan, biasanya sekitar 5 µg.cm-2 (Hagfeldt, dkk., 2010). 19 Banyak material yang telah diteliti untuk menggantikan Pt seperti material karbon (grafit (Roy-Mayhew, dkk., 2010) atau nano-tube karbon (Hashmi, dkk., 2014)), polimer penghantar (seperti poli(3,4-etilendioksitiopen)(PEDOT)) atau kobalt sulfida yang memiliki sifat katalitik yang baik. Bahkan dika performa mereka tidak sebaik Pt, tetapi penggunaan mereka lebih ekonomis (Hagfeldt, dkk., 2010). 2.3. Prinsip Kerja DSSC Pada DSSC terjadi proses absorpsi cahaya matahari oleh zat warna. Zat warna yang menyerap cahaya matahari tersebut kemudian mengalami eksitasi elektron. Lalu elektron yang tereksitasi diinjeksi menuju semikonduktor TiO2. Prinsip kerja diawali dengan proses eksitasi elektron di dalam zat warna akibat absorpsi foton dari cahaya matahari [Persamaan 2.1]. Penyerapan cahaya matahari oleh zat warna memberikan energi untuk mempromosikan elektron ke enrgi yang lebih tinggi. Setelah penyerapan foton dari energi yang akurat, elektron dari HOMO zat warna tereksitasi menuju LUMO. S + hv S* [2.1] Elektron dari keadaan tereksitasi kemudian terinjeksi menuju pita konduksi TiO2 sehingga zat warna teroksidasi [Persamaan 2.2]. Untuk dapat dengan mudah terjadi transfer dari zat warna menuju semikonduktor dibutuhkan transisi yang efektif. Untuk melakukan transisi ini dibutuhkan posisi LUMO atau orbital lain yang merupakan destinasi elektron yang tereksitasi (misalnya LUMO+1) harus dekat dengan gugus pengikat (anchoring group) (Le Bahers, dkk., 2011). 20 S* S+ + e- TiO2 [2.2] Gambar 2 4 Skema kerja DSSC Sumber: (Grätzel, 2003) Zat warna yang teroksidasi kemudian direduksi hingga kembali ke keadaan semulan (ground state) oleh elektron dari elektrolit I3-/I- [Persamaan 2.3]. Regenerasi dari sensitiser oleh I- mencegah penangkapan kembali elektron oleh zat warna yang teroksidasi (Gratzel, 2005). S+ + 3I- 2S +I3- [2.3] 21 Untuk mendapatkan listrik, elektron harus menempuh perjalanan didalam semokonduktor. Semikonduktor mengandung nanopartikel, yang berarti elektron harus melewati banyak partikel sebelum mereka mencapai kontak depan TCO. TCO atau lapisan oksida tersebut secara elektrik terhubung dengan rangkaian luar. Elektron akhirnya melakukan perjalanan kembali melalui rangkaian luar hingga mencapai elektroda pembanding. Ion tri-iodida melayanglayang didalam elektrolit hingga mereka mencapai katoda untuk menggantikan elektron yang hilang dari elektroda pembanding. Ion tri-iodida kemudian mengalami regenerasi dengan direduksi kembali oleh elektroda pembanding sehingga terbentuk iodida (I-) [Persamaan 2.4] (Al-Alwani, dkk., 2016) I3- + 2e 3 I- [2.4] 2.4. Kimia Kuantum Mekanika kuantum (Quantum Mechanics) merupakan deskripsi matematis yang tepat untuk sifat elektron dalam kimia. Dalam teori, mekanika kuantum dapat memprediksi berbagai sifat dari atom ataupun molekul (Young, 2001). Kimia kuantum telah membuka kemungkinan untuk menghitung energi molekul ata sifat lain seperti sifat magnetik, optik dan termal dari suatu sistem. Persamaan Schrödinger dapat dipertimbangkan sebagai jantung dari kimia kuantum dikarenakan solusinya yang secara teori dapat menjawab banyak pertanyaan tentang sifat molekul melalui persamaan berikut (Schrödinger, 1926): ĤΨ = EΨ 22 [2.5] Ĥ (operator Hamiltonian) merupakan operator diferensial yang menggambarkan total energi dari molekul. Untuk suatu sistem yang mengandung M inti atom dan N elektron, dinyatakan dengan persamaan berikut: [2.6] Simbol pada persamaan 2.6 menggambarkan; 1) energi kinetik elektron; 2) energi kinetik inti; 3) interaksi elektrostatik antara inti atom dan elektron; dan 4) potensial tolakan dikarenakan interaksi elektron-elektron dan inti-inti. A dan B adalah indeks dari inti M; dimana i dan j untuk elektron N. merupakan operator Laplacian, biasanya dalam koordinat Cartesian: [2.7] E merupakan energi dari sistem, Ψ merupakan fungsi gelombang yang ada dalam sistem. Karena massa inti atom lebih besar dibandingkan dengan elektron, inti atom bergerak lebih lambat dibandingkan dengan elektron. Sehingga, persamaan 2.c dapat disederhanakan dengan mengasumsikan bahwa energi kinetik dan potensial dari inti atom adalah 0 dikarenakan tolakan inti-inti adalah konstan. Perkiraan ini pertama kali diusulkan oleh Born-Oppenheimer yang mendapatkan Hamiltonian elektronik berikut (Born & Oppenheimer, 1927): 23 [2.8] Persamaan Schrodinger dan perkiraan Born-Oppenheimer merupakan dua konsep dasar dalam kimia kuantum. Sayangnya, hingga saat ini, persamaan ini tetap dapat dipecahkan secara analitik hanya pada beberapa kasus dengan jumlah elektron yang terbatas. Fakta ini telah mendorong banyak peneliti untuk mengembangkan metode numerik baru dalam rangka untuk menghitung struktur elektronik suatu sistem yang berbeda ukuran. Tiga jenis utama pendekatan komputasi yang paling sering digunakan untuk perhitungan adalah: 1. Metode ab-initio: memecahkan persamaan Schrödinger menggunakan pendekatan matematis. Metode ini berdasarkan pada mekanika kuantum dan beberapa parameter umum seperti kecepatan cahaya, massa inti dan elektron serta konstanta Planck. 2. Metode semi-empirik: menggunakan parameter yang berasal dari data eksperimen untuk memecahkan persamaan Schrödinger 3. Teori fungsi kerapatan (DFT): sama seperti metodeab-initio, DFT menggunakan perkiraan matematis. Namun, DFT diperoleh dari distribusi elektron (sistem fungsi densitas elektron) 2.5. Density Functional Theory (DFT) Teori fungsi kerapatan (DFT) merupakan metode komputasi untuk perhitungan struktur keadaan dasar elektronik yang menentukan sifat suatu sistem sebagai fungsi 24 densitas elektron. Itulah perbedaan utama dibandingkan dengan teori sebelumnya, yang mana menggambarkan suatu sistem atau molekul dengan banyak fungsi gelombang elektron Ψ (r1, r2, ..., rN). Hohenberg, Kohn dan Sham yang telah mengembangkan teori deskripsi keadaan dasar dari interaksi tidak homogen elektron gas, telah memberikan konsep dasar dari DFT (Hohenberg & Kohn, 1964; Kohn & Sham, 1965). Hohenberg dan Kohn mendalilkan teorema pertama mereka yang menghubungkan potensial (v(r)), densitas partikel ρ(r) dan keadaan dasar fungsi gelombang (Ψ0) melalui pemetaan 1-1: ρ(r) v (r) Ψ0 [2.9] Dengan kata lain, teorema ini menyebutkan bahwa dalam rangka untuk menyelidiki sifat molekul, kita harus mengetahui densitas elektron deadaan dasar. Untuk mencarinya maka digunakan teorema HK-2 yang menyatakan bahwa densitas elektron keadaan dasar merupakan salah satu yang berhubungan dengan energi minimum, yang mana telah diketahui sebagai prinsip variasi dalam matematis (Baerends & Gritsenko, 1997; Koch & Holthausen, 2000). Teorema HK-1 ditujukan untuk sistem yang mengandung hanya satu elektron. Persamaan ini tidak mencantumkan interaksi partikel antara dua atom atau lebih. Untuk mengatasi kesulitan ini,Kohn dan Sham memperkenalkan konsep orbital Kohn-Sham. Orbital ini mengandung satu fungsi elektron yang tidak saling berinteraksi satu sama lain. Peningkatan kemudian difokuskan 25 untuk mencari fungsi korelasi pertukaran yang bergantung pada sistem yang diamati. Salah satu fungsi korelasi tersebut adalah fungsi hibrida. Fungsi hibrida adalah fungsi yang mengandung termasuk bagian dari pertukaran Hartree-Fock ( . Perkembangan metode ini diinisiasi oleh Axel Becke pada tahun 1993 (Becke, 1993). Bagian dari fungsi hibrida Becke, banyak fungsi hibrida lain telah dikembangkan seperti B3LYP (Becke, 3 parameter, Lee-Yang-Parr) (Becke, 1993; Lee, dkk., 1988), LYP (Lee, dkk., 1988) dan VWN (Vosko-WilkNusair) (Vosko, dkk., 1980). Diantara semua itu, B3LYP yang paling sering digunakan. 2.6. Basis Set Basis set merupakan suatu fungsi yang digunakan untuk menggambarkan bentuk orbital dalam suatu atom. Basis set standaruntuk perhitungan struktur elektronik menggunakan kombinasi linear dari fungsi gaussian untuk membentuk orbital. Basis set memberikan fungsi dasar untuk setiap atom dalam suatu molekul untuk memperkirakan orbitalnya. Beberapa jenis basis set berbeda dalam keakurasiannya. a. Minimal basis set: minimal basis set mengandung jumlah minimum fungsi dasar yang dibutuhkan oleh setiap atom. Contohnya adalah basis set STO-3G (STO = Slater type orbital, 3G = 3 fungsi Gaussian) yang memperkirakan orbital Slater dengan fungsi Gaussian. b. Split valence basis set: memiliki 2 (atau lebih) fungsi dasar untuk setiap valensi orbital. Contoh basis set 326 21G. Maksud dari notasi 3-21G adalag angka 3 berarti inti orbital 1s adalah kombinasi linear dari 3 fungsi Gaussian. Angka selanjutnya yaitu 2 dan 1 sebelum huruf G berarti kulit valensi orbital 2s dan 2p terpecah menjadi 2 bagian: bagian dalam kombinasi linear dari 2 fungsi Gaussian dan bagian luar terdiri dari 1 fungsi Gaussian. c. Basis set terpolarisasi (polarized basis set): pada basis set ini fungsi momentum angular ditambahkan kedalam fungsi yang menggambarkan orbital atom. Misalnya, basis set terpolarisasi menambahkan fungsi d kedalam atom karbon dan beberapa menambahkan fungsi p kedalam atom hidrogen. Contoh untuk basis set terpolarisasi adalah basis set 6-31G(d) atau 631G* dan 6-31G(d,p) atau 6-31G**. Notasi * atau ** digunakan untuk menunjukkan bahwa fungsi momentum angular ditambahkan. d. Fungsi terdifusi (diffused function): basis set dengan penambahan fungsi difusi merupakan versi besar dari split valence basis set jenis s dan jenis p. Orbital difusi menempati ruang yang lebih luas. Basis set dengan fungsi difusi penting untuk sistem dimana elektron jauh dari intinya. Modifikasi basis set ini dilambangkan dngan penambambahan “+”. Contoh basis set difusi adalah basis set 6-311+G (d,p) . 2.7. TDDFT (Time Dependent Density Functional Theory) Beberapa metode yang telah dikembangkan untuk menghitung sifat eksitasi elektron dibagi menjadi metode berdasar fungsi gelombang dan metode berdasar densitas elektron. Metode yang paling sering digunakan dikarenakan 27 penerapannya ke molekul besar adalah CIS (Configuration Interaction Singles), TDHF (Time Dependent Hartree-Fock) dan TDDFT. CIS dan TDHF merupakan metode berdasar fungsi gelombang sementara TDDFT merupakan metode berdasar densitas elektron (Dreuw & Head-Gordon, 2005). TDDFT dikenalkan pertama kali oleh Runge dan Gross (Runge & Gross, 1984). Mereka memformulasikan Teorema I yang berbunyi: “potensi partikel tunggal mengarah ke diberikannya densitas representasi v secara unik ditentukan sehingga pemetaan yang sesuai dapat kembali” (Runge & Gross, 1984) Dengan kata lain, teorema ini merupakan bentuk dari teorema HK-1 yang bergantung waktu (persamaan 2.9). karena potensial dan fungsi gelombang adalah fungsi densitas, persamaan 2.9 dapat dituliskan kembali dengan: [2.10] Penambahan fungsi C(t) diperlukan untuk sistem yang bergantung waktu. Skema yang sama yang telah digunakan untuk mendapatkan DFT juga diaplikasikan untuk mendapatkan TDDFT. Perbedaannya adalah semua persamaan dalam DFT menjadi bergantung waktu pada TDDFT. Sehingga tahap selanjutnya adalah menentukan densitas sebenarnya yang diselesaikan dengan variasi prinsip dalam DFT. Sayangnya, prosedur yang sama tidak dapat diaplikasikan dalam TDDFT. 28 Tidak mungkin untuk menggunakan variasi prinsip untuk menentukan energi total dari sistem dalam TDDFT. Hal ini dibutuhkan untuk menentukan kuantitas analog terhadap energi (A) (Dreuw & Head-Gordon, 2005; Marques & Gross, 2004; Runge & Gross, 1984): [2.11] Sehingga, densitas elektron sebenarnya dapat diperoleh dengan menyelesaikan: [2.12] Selanjutnya perlu ditentukan solusi dari permasalahan untuk sistem yang mengandung lebih dari satu atom. Formalisme Kohn-Sham menunjukkan bahwa dalam rangka menyelesaikan sistem banyak-badan (many-body systems) perlu ditentukan fungsi korelasi perbahan. Dalam DFFT, fungsi korelasi perubahan bergantung waktu (vxc) dapat diperoleh melalui persamaan: [2.13] Namun, solusi untuk permasalahan TDDFT tidak sederhana seperti DFT, karena melibatkan densitas yang berkembang terhadap waktu, ρ(r,t). Disini perlu menentukan parameter lain yang disebut xc-kernel yang terkait dengan vxc melalui persamaan: [2.14] 29 Terakhir, untuk menyelesaikan permasalahan TDDFT diperlukan untuk membuat perkiraan xc-kernel. Perkiraan paling sederhana yang telah diformulasikan adalah Adiabatic Local Density Approximation (ALDA) (Gross & Maitra, 2012): [2.15] Dimana, merupakan energi korelasi perubahan per elektron dari densitas gas elektron homogen. Kunci akurasi dari TDDFT terdapat pada penemuan xckernel yang dapat mendekati sistem yang diamati (Casida, 2009; Dreuw & Head-Gordon, 2005; Marques & Gross, 2004). 30 BAB III METODE PENELITIAN 3.1 Perlatan yang Digunakan 3.1.1. Perangkat keras Penelitian ini memerlukan seperangkat komputer untuk menyelesaiakn pehitungan. Untuk keperluan tersebut, spesifikasi komputer yang digunakan adalah Cluster komputer total 32 core. Terdiri dari 4 komputer, masing-masing 8 core dan memory 32 GB. 3.1.2. Perangkat lunak Perhitungan akan dilakukan menngunakan software Gaussian 09. Sebelum perhitungan, penggambaran molekul awal dilakukan menggunakan software ChemSketch (2 dimensi) dan Avogadro (3 dimensi). Persiapan input file dilakukan menggunakan software metapad. Kemudian hasil perhitungan TD-DFT divisualisasikan menggunakan software Gabedit dan Gaussum untuk mengetahui transisi elektronik. Avogadro juga digunakan untuk memvisualisasikan profil rapatan HOMO dan LUMO. 3.2. Metode Perhitungan Secara garis besar perhitungan dilakukan sesuai skema yang dicantumkan pada Gambar 3.1. 31 Gambar 3 1 Skema penelitian 3.2.1. Pembuatan Model Awal Untuk melakukan penelitian ini dibutuhkan struktur 3 dimensi dari senyawa target serta konfigurasi yang tepat. Langkah pertama, senyawa target dimodelkan secara 2 dimensi menggunakan program ChemSketch dan disimpan 32 sebagai format MDL Molfile. Lalu struktur 2 dimensi tersebut dibuat struktur 3 dimensi dengan menggunakan program Avogadro untuk kemudian diketahui titik koordinatnya untuk digunakan sebagai file input dalam penelitian ini. File input dibuat dengan format g09 dengan menggunakan program metapad. Pada file ini berisi perintah operasi yang akan dijalankan menggunakan program Gaussian 09. Perintah operasi bergantung pada jenis operasi yang akan dilakukan. Contoh file input dicantumkan pada lampiran. 3.2.2. Optimasi Geometri Setelah dibuat file input, langkah selanjutnya yakni dilakukan optimasi geometri terhadap senyawa target. Optimasi geometri ini dilakukan untuk memastikan bahwa senyawa target yang akan dihitung/ ditentukan sifat tertentu dalam keadaan energi terendah. Optimasi geometri dilakukan dengan metode Teori Fungsional Kerapatan atau DFT (Density Functional Theory) (Hay & Wadt, 1985). Pada saat optimasi struktur molekul, digunakan basis set 3-12G dan kemudian ditingkatkan sampai 6-31G* (Ditchfield, dkk., 1971). 3.2.3. Perhitungan TDDFT Time Dependent DFT (TDDFT) dilakukan untuk penyelidikan sifat elektronik dari senyawa zat warna yang digunakan dan untuk mensimulasikan spektra absorpsi UVVis (Runge & Gross, 1984). Perhitungan dilakukan menggunakan teori B3LYP (Lee, dkk., 1988) dan juga CAMB3LYP (Yanai, dkk., 2004). Langkah yang dilakukan untuk 33 perhitungan sama dengan optimasi geometri, hanya dibedakan oleh kode perintah yang dituliskan pada file input untuk perhitungan. Kemudian hasil perhitungan divisualisasikan dan diselidiki transisi elektroniknya. 3.2.4. Perhitungan Energi Transfer Muatan Perhitungan muatan dilakukan untuk menghitung jarak transfer muatan (DCT) dan besar transfer muatan (qCT) (Le Bahers, dkk., 2009) dengan suatu kode perintah. Langkah yang dilakukan dengan menggunakan koordinat senyawa yang telah teroptimasi, dilakukan perhitungan terhadap keadaan dasar (ground state) dan keadaan tereksitasi (excited state). Dari perhitungan secara komputasi, didapatkan hasil berupa muatan pada keadaan dasar dan tereksitasi. Hasil tersebut kemudian dilakukan perhitungan lebih lanjut dengan menggunakan Microsoft Excel untuk mendapatkan nilai DCT dan qCT. 34 BAB IV HASIL DAN PEMBAHASAN 4.1. Optimasi Geometri Prosedur penelitian dengan metode komputasi yang harus dilakukan pertama kali adalah optimasi geometri. Pada tahap ini, ditentukan struktur molekul paling stabil yang akan diselidiki sifatnya. Suatu molekul dikatakan stabil apabila memiliki energi paling rendah. Demikian pula pada penelitian ini. Molekul yang ingin diamati dilakukan optimasi geometrinya terlebih dahulu, setelah itu dilakukan perhitungan pada titik tunggal (disebut perhitungan single point energy). Pada beberapa kasus, diperlukan perhitungan secara bertahap dari basis set rendah untuk memperoleh hasil perhitungan yang baik. 4.2. Penentuan Metode Teori Perhitungan Seperti yang telah disebutkan pada metodelogi penelitian, perhitungan dilakukan dengan menggunakan 2 teori, yakni B3LYP serta CAM-B3LYP. Hal ini diterapkan dikarenakan senyawa yang diobservasi memiliki struktur yang panjang sehingga membutuhkan fungsi koreksi yang lebih akurat. Hasil perhitungan dengan kedua teori tersebut kemudian dibandingkan untuk dipilih salah satu yang terbaik. 35 Tabel 4 1 Perbandingan nilai λ spektra UV-Vis berdasar eksperimen dan perhitungan komputasi dengan fungsi B3LYP dan CAM-B3LYP Senyawa CB1 CT2 Eksperimen (Srinivas, dkk, 2011) 375 409 λ (nm) Perhitungan Komputasi CAMB3LYP B3LYP 524 352 540 379 Gambar 4 1 Spektra UV-Vis senyawa CB1 dan CT2 dengan basis set B3LYP dan CAM-B3LYP Perbandingan penggunaan teori B3LYP dan CAMB3LYP ditampilkan pada Gambar 4.1 dan Tabel 4.1. Pada teori CAM-B3LYP memasukkan peran gaya Coulomb dalam fungsi korelasi. Fungsi korelasi yang tidak memperhatikan 36 peran gaya Coulomb biasanya menjadi tidak akurat pada jarak yang besar, sehingga tidak sesuai untuk proses pemodelan pada molekul yang besar (Jungsuttiwong, Tarsang, Sudyoadsuk, Promarak, Khongpracha, & Namuangruk, 2013; Kumar, et al., 2014). Berdasarkan nilai λ absorpsi yang ditampilkan pada Tabel 4.1, spektra UV-Vis yang dihitung menggunakan metode CAM-B3LYP menunjukkan pergeseran yang lebih kecil dengan hasil eksperimen dibandingkan dengan B3LYP. Berdasarkan hasil ini, perhitungan dilakukan menggunakan teori CAM-B3LYP untuk senyawa yang lain. 4.3. Penyelidikan Sifat Elektronik dalam Zat Warna CB1 dan CT2 Perhitungan dilakukan menggunakan Program Gaussian 09 dengan metode CAM-B3LYP (Yanai, dkk., 2004). Sebelum dilakukan perhitungan, terlebih dahulu dilakukan optimasi geometri untuk semua zat warnamenggunakan basis set 6-31G* (Ditchfield, dkk., 1971). Hasil optimasi ditampilkan pada Gambar 4.2. Perhitungan TDDFT titik tunggal (Runge & Gross, 1984) dilakukan terhadap struktur teroptimasi untuk menyelidiki lebih dalam sifat elektronik dan keadaan tereksitasi yang berkontribusi dalam spektra UV-Vis. 37 Gambar 4 2 Struktur teroptimasi CB1 (atas) CT2 (kiri) Hasil spektra absorpsi UV-Vis ditampilakan pada Gambar 4.3 dan transisi elektronik serta kekuatan osilator ditampilkan pada Tabel 4.2. Gambar 4 3 Spektra absorpsi UV-Vis CB1 dan CT2 38 Tabel 4 2 Spektra TD-DFT terhitung dari CB1 dan CT2 dengan kekuatan osilator, f>0,1 Panjang gelombang, λ (nm) Kekuatan osilator, f 352,56 1,5804 296,73 0,1619 259,909 0,1556 250,86 0.1478 379,39 1,3452 261,54 0,1356 250,81 0,1472 Kontribusi utama CB1 HOMO LUMO HOMO-2 LUMO HOMO-2 LUMO HOMO LUMO HOMO LUMO+1 HOMO LUMO+1 HOMO LUMO HOMO-1 LUMO+2 HOMO LUMO+6 CT2 HOMO LUMO HOMO-2 LUMO HOMO LUMO+1 HOMO-6 LUMO HOMO-1 LUMO+2 HOMO LUMO+6 Prosentase kontribusi utama 54% 33% 54% 24% 11% 60% 18% 75% 14% 52% 40% 40% 29% 76% 13% Hasil spektra absorpsi UV-Vis menunjukkan bahwa CT2 mengalami pergeseran merah sebesar 27 nm, dibandingkan dengan CB1. Berdasarkan data pada Tabel 4.2 untuk kedua zat warna, transisi elektronik dikontribusi utamanya oleh transisi HOMO LUMO dan HOMO-2 LUMO. Ditambah lagi, berdasarkan visualisasi orbital molekul pada Gambar 4.4, pemisahan muatan antara orbital HOMO-2 dan LUMO tidak sebagus antara HOMO dan 39 LUMO. Berdasarkan informasi pada Tabel 4.2 kontribusi dari transisi HOMO LUMO meningkat dari CB1 (54%) ke CT2 (52%). Hal ini sesuai dengan hasil yang diperoleh Srinivas dan kawan-kawan pada penelitiannya. Hasil yang dilaporkan menunjukkan kontribusi utama pada transisi elektronik didominasi oleh transisi HOMO LUMO dengan nilai 0.552 untuk CB1 dan 0.546 untuk CT2 (Srinivas, dkk., 2011). Sehingga kita menyimpulkan bahwa pemisahan muatan CB1 lebih baik dari CT2. Untuk menghitung muatan yang ditransfer (qCT) dan jarak pemisahan muatan (DCT) dilakukan perhitungan menggunakan model transfer muatan yang telah digambarkan oleh Jacquemin dan kawan-kawan (Jacquemin, dkk., 2012). Hasil perhitungan ditampilkan pada Tabel 4.3. Informasi yang didapatkan dari tabel tersebut adalah CB1 memiliki qCT yang lebih besar dibandingkan dengan CT2. Akan tetapi, CB1 memiliki DCT yang lebih kecil dibandingkan dengan CT2. Ilustrasi jarak pemisahan muatan CB1 dan CT2 ditampilkan pada Gambar 4.4. Berdasarkan nilai DCT dan qCT, pemisahan pada CB1 dan CT2 terlihat sama-sama cukup baik. Karena CB1 memiliki qCT yang lebih besar maka dapat disimpulkan bahwa CB1 memiliki pemisahan yang lebih baik dari CT2. Tabel 4 3 Nilai DCT dan qCT zat warna CB1 dan CT2 Senyawa CB1 CT2 40 DCT (Å) 3.967 5,419 qCT (e) 0,441 0,402 CB1 CT2 EHOMO-2= -7,695 eV EHOMO-2= -7,540 eV EHOMO= -6,796 eV EHOMO= -6,786 eV ELUMO= -1,804 Ev ELUMO= -1,902 eV Gambar 4 4 HOMO-2 (atas); HOMO (baris 2); gambaran DCT (baris 3) dan LUMO (bawah) 41 Profil rapatan HOMO dan LUMO ditampilkan pada Gambar 4.4. Berdasarkan profil rapatan elektron menunjukkan HOMO utamanya terletak pada gugus carbazole sementara LUMO terletak utamanya pada gugus cyanoacrylic. Dari gambar tersebut tampak bahwa pada kedua zat warna, posisi LUMO mendekati sisi pengikat TiO2, yaitu gugus COOH. Hal ini baik untuk mempermudah injeksi elektron dari LUMO menuju pita konduksi semikonduktor TiO2. Gambar 4 5 Diagram energi HOMO-LUMO CB1 dan CT2 Perhitungan tingkat energi orbital molekul untuk kedua senyawa yang terlibat dalam transisi elektronik utama bersama dengan tingkat energi pita konduksi dan pita valensi dari semikonduktor TiO2 dan juga posisi energi elektrolit I3-/Iditampilkan dalam Gambar 4.5. Tingkat energi dari 42 semikonduktor TiO2 diambil dari referensi (Chung, dkk., 2012). Gambar tersebut memberikan informasi bahwa posisi energi LUMO dari kedua senyawa memenuhi kriteria untuk injeksi muatan yang efisien ke pita konduksi TiO2. Hal tersebut membutuhkan posisi LUMO diatas pita konsuksi dari semikonduktor. Sementara untuk regenerasi zat warna, posisi HOMO harus berada dibawah potensial redoks dari elektrolit. Dengan posisi ini menjamin gaya dorong yang cukup untuk aliran elektron. Posisi LUMO dari CB1 terletak diatas CT2 sehingga CB1 memiliki gaya dorong untuk injeksi elektron menuju semikonduktor yang sedikit lebih besar dibandingkan dengan CT2. Hasil ini juga sejalan dengan perhitungan yang dilakukan oleh Srinivas dan kawan-kawan (2011) (Srinivas, dkk., 2011). Berdasarkan analisis tersebut menunjukkan bahwa CB1 dan CT2 menunjukkan hasil yang sama baiknya, sehingga kedua zat warna tersebut sama-sama berpotensi diaplikasikan menjadi zat warna dalam DSSC. Namun berdasarkan hasil eksperimen dari penelitian Srinivas dkk, CT2 memiliki koefisien konversi 0,819% yang mana nilainya lebih besar dibandingkan dengan koefisiensi konversi CB1 yakni 0,695%. Dalam Srinivas dan kawan-kawan menyimpulkan efisiensi sel DSSC ini meningkat dengan pergantian benzen dengan tiopen pada π-spacer (Srinivas, dkk., 2011). Dengan alasan tersebut, pada penelitian kali ini dilakukan modifikasi struktur terhadap senyawa CT2. 43 4.4. Pengaruh Penambahan Gugus Pendorong Elektron terhadap Sifat Elektronik Zat Warna CT2 Molekul zat warna organik dengan struktur D- π-A menunjukkan efisiensi konversi yang menjanjikan dalam perkembangan DSSC dewasa ini (Hagfeldt, dkk., 2010; Manoharan & Anandan, 2014). Diantaranya, gugus pendonor tidak hanya mempengaruhi spektra absorpsi UV-Vis tetapi juga mengatur tingkat energi dari zat warna. Dan perubahan kecil pada geometri struktur pendonor dapat menghasilkan sifat fotofisika, elektrokimia dan sifat lain yang menarik (Wan, dkk., 2012). Dan mungkin dengan menambahkan substituen pendorong elektron yang kuat dapat memfasilitasi transfer muatan intramolekular antara donor dan akseptor dan mendorong pada peningkatan absorpsi (Hagberg, dkk., 2009; Im, dkk., 2010). Contoh gugus pendorong elektron yang kuat diantaranya alkoksi (-OR) dan amina (-NHR). Penambahan gugus yang pertama dengan menambahkan –OCH3 dan –NH(CH3) masing-masing pada posisi C3 dan C6 gugus carbazole. Senyawa dengan penambahan –OCH3 kemudian disebut dengan CT_Metoksi sementara dengan penambahan –NH(CH3) disebut dengan CT_NC1. Sama seperti bagian sebelumnya, sebelum dilakukan perhitungan dilakukan optimasi geometri terlebih dahulu terhadap kedua zat waran tersebut dengan menggunakan basis set 6-31G*. Struktur teroptimasi ditampilkan pada Gambar 4.6. Perhitungan TDDFT titik tunggal juga dilakukan terhadap struktur teroptimasi untuk menyelidiki lebih dalam sifat elektronik dari zat warna. 44 Gambar 4 6 Struktur teroptimasi CT_Metoksi (atas) dan CT_NC5 (bawah) Spektra absorpsi UV-Vis ditampilkan pada Gambar 4.7 dan karakter dari tansisi elektronik dalam spektra UV-Vis ditampilkan pada Tabel 4.4. Gambar 4 7 Spektra absorpsi UV-Vis zat warna CT_Metoksi dan CT_NC1 45 Tabel 4 4 Spektra TD-DFT terhitung untuk CT_Metoksi dan CT_NC1 dengan kekuatan osilator, f>0,1 Panjang gelombang, λ (nm) Kekuatan osilator, f 397,75 1,2162 333,01 0,3507 282,44 0,1766 259,81 0,1922 424,96 0,9339 345,61 0,6899 298,05 275,18 0,154 0,1518 Kontribusi utama CT_Metoksi HOMO LUMO HOMO-2 LUMO HOMO-2 LUMO HOMO LUMO HOMO LUMO+1 HOMO LUMO HOMO-1 LUMO+2 CT_NC1 HOMO LUMO HOMO-2 LUMO HOMO-2 LUMO HOMO LUMO HOMO LUMO+1 HOMO-1 LUMO+2 HOMO LUMO+3 Prosentase kontribusi utama 64% 25% 67% 22% 69% 12% 80% 77% 14% 76% 14% 73% 60% 23% Spektra absorpsi UV-Vis menunjukkan bahwa dengan penambahan –O(CH3) dan –NH(CH3) pada molekul CT2 menggeser spektrum UV-Vis ke pergeseran merah. Penambahan CT_NC1 menunjukkan pergeseran yang lebih jauh dibandingkan dengan CT_Metoksi. Dengan penambahan gugus tersebut tampak pula memberikan spektrum yang lebih luas. Sementara berdasarkan karakter transisi elektronik menunjukkan bahwa untuk kedua zat warna kontribusi utama didominasi oleh transisi HOMO LUMO. Pada CT_NC1 46 menunjukkan prosentase kontribusi HOMO LUMO yang lebih besar (77%) dibandingkan dengan CT_Metoksi (64%). Dengan begitu dapat disimpulkan bahwa pemisahan muatan pada CT_NC1 lebih baik dibandingkan dengan CT_Metoksi. Tabel 4 5 Nilai DCT dan qCT zat warna CT_Metoksi dan CT_NC1 Senyawa CT_Metoksi CT_NC1 DCT (Å) 3,9583 1,786 qCT (e) 0,723 0,969 Hasil perhitungan DCT dan qCT ditampilkan pada Tabel 4.5 yang menunjukkan CT_NC1 memiliki nilai qCT yang lebih besar dibandingkan CT_Metoksi. Hasil ini mengkonfirmasi bahwa penambahan gugus –NH(CH3) menunjukkan peningkatan qCT yang lebih besar dibandingkan dengan ketika ditambahkan –OCH3. Akan tetapi, peningkatan nilai qCT tidak didukung dengan peningkatan DCT. Baik CT_Metoksi maupun CT_NC1 menunjukkan penurunan DCT dibandingkan dengan CT2. Penggambaran jarak transfer muatan ditampilkan pada Gambar 4.8. Berdasarkan analisis ini maka dapat disimpulkan bahwa CT_Metoksi memiliki pemisahan yang lebih baik dari CT_NC1. Hal ini disebabkan jarak transfer muatan pada CT_NC1 terlalu kecil sehingga dikhawatirkan akan terjadi rekombinasi elektron pada sistem. Orbital molekul HOMO dan LUMO dari zat warna CT_Metoksi dan CT_NC1 ditunjukkan pada Gambar 4.8. Letak HOMO dari kedua zat warna sama-sama terpusat pada gugus carbazole dan begitu pula dengan LUMO yang terpusat pada gugus cyanoacrylic. LUMO dari kedua zat warna terlihat 47 mendekati sisi pengikat antara zat warna dengan semikonduktor yang mengindikasikan bahwa elektron akan berpindah dengan mudah dari LUMO menuju pita konduksi TiO2. CT_Metoksi CT_NC1 EHOMO= -6,310 eV EHOMO= -5,870 eV ELUMO= -1,889 Ev ELUMO= -1,819 eV Gambar 4 8 (Atas) HOMO, (tengah) penggambaran DCT (bawah) LUMO dari senyawa CT_Metoksi (kiri) dan CT_NC1 (kanan) 48 Gambar 4 9 Diagram energi CT_Metoksi dan CT_NC1 Hasil perhitungan tingkat energi orbital molekul ditampilkan pada Gambar 4.9. Dari gambar tersebut memberikan informasi bahwa posisi energi LUMO baik CT_Metoksi maupun CT_NC1 berada diatas pita konduksi TiO2 yang menunjukkan bahwa kedua zatwarna memenuhi kriteria injeksi muatan yang efisien menuju pita konduksi TiO2. Energi HOMO keduanya juga terletak dibawah energi potensial reduksi dari elektrolit I- dengan begitu menjamin terjadinya regenerasi zat warna. Tingkat energi LUMO dari CT_NC1 terletak sedikit diatas energi LUMO CT_Metoksi sehingga memberikan gaya dorong yang lebih tinggi untuk injeksi elektron menuju permukaan oksida. 49 Berdasarkan analisis tersebut dapat disimpulkan secara keseluruhan bahwa dengan penambahan gugus pendorong elektron berupa alkoksi (-OR) dan amina (-NHR) dapat meningkatkan sifat elektronik dari zat warna. Hal ini dilihat berdasarkan 3 parameter. Pertama, dari hasil spektra absorpsi UV-Vis menunjukkan peningkatan panjang gelombang akibat adanya penambahan alkoksi dan amina terhadap zat warna CT2. Prosentase kontribusi transisi elektronik juga meningkat. Kedua, berdasarkan jumlah muatan yang ditransfer qCT meningkat dengan adanya penambahan alkosi dan amina pada CT2. Dan yang ketiga, berdasarkan tingkat energi LUMO CT_Metoksi dan CT_NC1 memiliki energi yang lebih positif dibandingkan dengan CT2 yang mengindikasikan bahwa pada CT_Metoksi dan CT_NC1 memiliki gaya dorong yang lebih besar untuk melakukan injeksi muatan dari HOMO ke pita konduksi TiO2. Hal ini sesuai dengan penelitian yang dilakukan oleh Han dan kawan-kawan (2011). Mereka melaporkan bahwa penambahan gugus sustituen alkoksi pada fenil meningkatkan kemampuan donor elektron pada spacer, yang mana menguntungkan untuk penyerapan cahaya, seperti meningkatkan koefisien kepunahan molar dan spektra absorpsi yang lebih luas (Han, dkk., 2011). Dari ketiga parameter tersebut, CT_NC1 menunjukkan hasil yang lebih baik dibandingkan dengan CT_Metoksi. Hal ini diduga bahwa gugus amina memiliki pengaruh donor elektron yang lebih kuat terhadap carbazole sehingga berpengaruh pula terhadap transfer muatan yang lebih baik dibandingkan dengan CT_Metoksi. 50 4.5. Pengaruh Perpanjangan Rantai Karbon pada Pendorong Elektron terhadap Sifat Elektronik Zat Warna Salah satu komponen penyusun DSSC adalah elektrolit. I3 /I adalah pasangan redoks paling popular yang digunakan dalam DSSC sejak hasil rintisan oleh O’Regan dan Gratzel pada tahun 1991 (O'Regan & Grätzel, 1991). Perkembangan pada penelitian DSSC menunjukkan bahwa pasangan redoks I3-/I- bukan merupakan elektrolit terbaik untuk DSSC. Hal ini dikarenakan I3-/I- bersifat korosif terhadap logam yang membuat pemilihan material untuk modul DSSC sangat terbatas. Selain itu, I3-/I- juga menyerap cahaya pada daerah panjang gelombang 350-450 nm dan nilai potensial reduksinya cukup rendah dan membatasi tegangan rangkaian terbuka pada DSSC (Fan, dkk., 2013; Feldt, dkk., 2011; Hamann, 2012; Klahr & Hamann, 2009). Pasangan redoks kobalt (II)/(III) merupakan salah satu kandidat utama untuk menggantikan I3-/I-. Namun, kompleks kobalt (II/III) memiliki struktur yang bulki yang menghalangi transport masa melalui fotoelektroda dan memiliki kinetika rekombinasi yang cukup cepat dengan elektron dari pita konduksi TiO2 (Hamann, 2012). Oleh karena itu dengan menggunakan zat warna yang memiliki rantai alkil yang panjang atau gugus alkoksi yang bulki dapat menghalangi rekombinasi pada semikonduktor dan antarmuka elektrolit (Bai, dkk., 2011; Feldt, dkk., 2010; Feldt, dkk., 2011). - - Oleh karena itu terhadap struktur sebelumnya dilakukan perpanjangan rantai karbon pada gugus pendorong (-OC5H11 dan –NH(C5H11)). Sebelum dilakukan perhitungan, dilakukan 51 optimasi geometri terlebih dahulu menggunakan basis set 631G*. Struktur teroptimasi ditampilkan pada Gambar 4.10. Gambar 4 10 Struktur teroptimasi CT_Pentoksi (atas) dan CT_NC5 (bawah) Hasil perhitungan TDDFT titik tunggal berupa spektra absorpsi UV-Vis ditampilkan pada Gambar 4.11 dan karakter transisi elektronik ditampilkan pada Tabel 4.6. Berdasarkan hasil spektra absorpsi UV-Vis menunjukkan bahwa CT_NC5 mengalami pergeseran merah sebesar 28 nm dibandingkan dengan CT_Pentoksi. Karakter 52 transisi elektronik yang ditampilkan pada Tabel 4.6 memberikan informasi bahwa kontribusi transisi elektronik yang dominan adalah transisi dari HOMO LUMO. Berdasarkan prosentase kontribusi HOMO LUMO CT_NC5 lebih tinggi dari CT_Pentoksi (77% untuk CT_NC5 dan 66% untuk CT_Pentoksi). Hasil ini sejalan dengan pemaparan pada sub bab sebelumnya dimana –NHR memberikan pengaruh pendorong elektron yang lebih kuat dibandingkan dengan –OR. Hasil ini juga menunjukkan bahwa perpanjangan rantai karbon pada gugus pendorong tidak mengubah karakteristik dari transisi elektronik zat warna. Gambar 4 11 Spektra absorpsi UV-Vis zat warna CT_Pentoksi dan CT_NC5 53 Tabel 4 6 Spektra TD-DFT terhitung untuk CT_Pentoksi dan CT_NC5 dengan kekuatan osilator, f>0,1 Panjang gelomba ng, λ (nm) Kekuatan osilator, f 400,34 1,2156 334,45 0,3836 283,90 0,1815 260,23 0,2194 428,08 0,9302 346,64 0,7231 299,36 275,70 0,1576 0,1735 Kontribusi utama CT_Pentoksi HOMO LUMO HOMO-2 LUMO HOMO-2 LUMO HOMO LUMO HOMO LUMO+1 HOMO LUMO HOMO-1 LUMO+2 CT_NC5 HOMO LUMO HOMO-2 LUMO HOMO-2 LUMO HOMO LUMO HOMO LUMO+1 HOMO-1 LUMO+2 HOMO LUMO+3 Prosentase kontribusi utama 66% 24% 68% 21% 69% 12% 78% 77% 13% 77% 14% 73% 63% 20% Perbandingan spektra absorpsi UV-Vis antara CT_Metoksi dengan CT_Pentoksi dan CT_NC1 dan CT_NC5 ditampilkan pada Gambar 4.12. Dapat dilihat dari gambar tersebut bahwa antara CT_Metoksi dan CT_Pentoksi tidak menunjukkan pergeseran panjang gelombang yang signifikan, begitu pula dengan CT_NC1 dengan CT_NC5.Dari spektra 54 absorpsi UV-Vis terlihat sedikit peningkatan intensitas dengan adanya perpanjangan rantai karbon pada gugus pendorong. Gambar 4 12 Spectra perbandingan CT_Metoksi-CT_Pentoksi (atas) dan CT_NC1-CT_NC5 (bawah) 55 Hasil perhitungan DCT dan qCT yang ditampilkan pada Tabel 4.7 menunjukkan hasil yang sesesuai dengan yang diuraikan pada sub bab sebelumnya dimana CT_NC5 memiliki nilai qCT yang lebih besar dibandingkan dengan CT_Pentoksi. Hasil ini menunjukkan nilai qCT antara CT_Metoksi dan CT_Pentoksi tidak berbeda jauh tetapi mengalami peningkatan yakni 0,723 menjadi 0,783. Begitu pula dengan CT_NC1 dan CT_NC5 mengalami peningkatan dari 0,969 menjadi 1,004. Hal ini diduga dikarenakan perpanjangan rantai karbon yang terdapat pada gugus pendorong. Perpanjangan rantai karbon juga mengakibatkan peningkatan pada jarak transfer muatan untuk kedua zat warna tersebut. Pada CT_Pentoksi DCT meningkat dari 3,9583 menjadi 6,313, sementara pada CT_NC5 meningkat dari 1,786 menjadi 4,396. Dengan demikian, dengan semakin panjangnya rantai karbon pada gugu pendorong maka mendorong pemisahan muatan yang lebih baik. Penggambaran jarak transfer muatan ditampilkan pada Gambar 4.13. Tabel 4 7 Nilai DCT dan qCT senyawa CT_Pentoksi dan CT_NC5 Senyawa CT_Pentoksi CT_NC5 DCT (Å) 6,313 4,396 qCT (e) 0,783 1,004 Lokasi orbital HOMO dan LUMO zat warna CT_Pentoksi dan CT_NC5 tidak berbeda dari CT_Metoksi dan CT_NC1. Orbital HOMO utamanya terletak pada gugus carbazole sementara LUMO mendekati sisi pengikat karboksilat dengan permukaan semikonduktor TiO2 yang 56 mengindikasikan bahwa elektron akan berpindah dengan mudah dari LUMO ke pita konduksi TiO2. CT_Pentoksi EHOMO= -6,259 eV ELUMO= -1,875 eV CT_NC5 EHOMO= -5,831 eV ELUMO= -1,810 eV Gambar 4 13 (Atas) HOMO, (tengah) penggambaran DCT (bawah) LUMO dari senyawa CT_Pentoksi (kiri) dan CT_NC5 (kanan) 57 Gambar 4 14 Diagram energi CT_Pentoksi dan CT_NC5 Gambar 4.14 menunjukkan tingkat energi HOMO dan LUMO zat warna CT_Pentoksi dan CT_NC5 bersama dengan energi pita konduksi TiO2 serta energi potensial reduksi elektrolit I3-/I-. Energi LUMO CT_Pentoksi dan CT_NC5 terletak diatas pita konduksi TiO2 dan energi HOMO keduanya terletak dibawah potensial redoks dari elektrolit I3/I-. Posisi ini menjamin gaya dorong yang cukup untuk mengalirnya elektron dalam sistem DSSC. Jika dilihat lebih detail, energi LUMO CT_NC5 lebih positif dibandingkan dengan CT_Pentoksi yang mana menunjukkan CT_NC5 memiliki gaya dorong yang lebih besar untuk injeksi muatan dari LUMO ke pita konduksi TiO2. Perbandingan antara CT_Metoksi dengan CT_Pentoksi dan CT_NC1 dengan CT_NC5 juga dilakukan untuk melihat 58 pengaruh perpanjangan rantai karbon yang terikat pada gugus pendorong terhadap tingakt energi HOMO dan LUMO. Hasil perbandingan menunjukkan bahwa semakin panjang rantai karbon menyebabkan nilai energi HOMO dan LUMO semakin positif. Hal ini berlaku baik untuk CT_MetoksiCT_Pentoksi dan CT_NC1-CT_NC5. Berdasarkan analisis diatas dapat disimpulkan bahwa perpanjangan rantai karbon pada gugus pendorong dapat meningkatkan sifat elektronik dari zat warna. Hal ini ditunjukkan berdasarkan 3 parameter. Pertama, berdasarkan spektra absorpsi UV-Vis terjadi pergeseran merah dan peningkatan kontribusi prosentase kontribusi transisi elektronik dari HOMO ke LUMO. Kedua, nilai qCT dan DCT meningkat seiring dengan bertambah panjangnya rantai karbon pada gugus pendorong. Dan yang terakhir, energi LUMO pada CT_Pentoksi dan CT_NC5 menunjukkan nilai yang lebih positif dibandingkan dengan CT_Metoksi dan CT_NC1 yang mengindikasikan gaya dorong yang lebih besar untuk injeksi muatan dari LUMO ke pita konduksi TiO2. Ditambah lagi, struktur molekul yang besar akibat perpanjangan rantai karbon baik untuk aplikasi DSSC dengan elektrolit berbasis kobalt. Kesimpulan ini juga didukung dengan hasil penelitian yang dilaporkan oleh Yu dan kawan-kawan (2011). Pada penelitian yang mereka lakukan, perpanjangan rantai dilakukan pada gugus alkoksi yang tersubstitusi pada zat warna trifenilamin. Hasil yang diperoleh menunjukkan dengan semakin panjang rantai alkil pada substituen didapatkan efisiensi yang meningkat pula. Berdasarkan 59 spektra absorpsi UV-Vis juga terlihat bahwa spektra semakin luas dengan rantai alkil yang lebih panjang. Mereka mengasumsikan bahwa alasan semakin luasnya spektra absorpsi UV-Vis seiring dengan semakin panjang rantai karbon, karena rantai karbon mungkin berperan sebagai material absorber yang lebih baik untuk cahaya yang datang (Yu, dkk., 2011). 60 BAB V KESIMPULAN DAN SARAN 5.1. Kesimpulan Berdasarkan penelitian yang dilakukan, modifikasi terhadap senyawa CT2 dengan menambahkan gugus alkoksi(OCH3) dan amina (-NH(CH3)) secara umum menunjukkan hasil yang baik. Hasil yang lebih baik juga didapatkan dengan melakukan perpanjangan rantai karbon. Berdasarkan spektra absorpsi UV-Vis semua variasi modifikasi menunjukkan pergeseran merah. Kontribusi transisi elektronik untuk semua molekul didominasi oleh orbital HOMO LUMO dan menunjukkan peningkatan dengan penambahan gugus alkoksi dan amina. Kontribusi HOMO LUMO pada CT2 = 52%, CT_Metoksi = 64%, CT_NC1 = 77%, CT_Pentoksi = 66% dan CT_NC5 = 77%. Rapatan LUMO pada semua molekul menunjukkan posisi yang dekat dengan gugus ikat TiO2 (anchoring site). Pemisahan muatan juga menunjukkan hasil yang baik dengan nilai qCT yang meningkat. Pada CT2 = 0,402; CT_Metoksi = 0,723; CT_Pentoksi = 0,783; CN_NC1 = 0,969 dan CT_NC5 = 1,004. Dan berdasarkan energi LUMO dengan penambahan gugus tersebut didapatkan energi yang lebih besar. Energi LUMO pada CT2 = -1,902 eV; CT_Metoksi = -1,889 eV; CT_Pentoksi = -1,875 eV; CT_NC1 = -1,819 eV dan CT_NC5 = -1,810 eV. Secara keseluruhan CT_NC5 menunjukkan hasil yang paling baik. 5.2. Saran 1. Bagi peneliti dalam bidang komputasi, dapat dilakukan penelitian sifat elektronik untuk guus pendorong yang lain, 61 atau dengan memperpanjang ikatan π pada senyawa golongan carbazole ini. Dapat juga dilakukan simulasi terikatnya zat warna pada permukaan semikonduktor TiO2. 2. Bagi peneliti dalam bidang kimia organik, dapat dilakukan sintesis terhadap senyawa yang telah kami teliti secara komputasi untuk diaplikasikan dalam DSSC sehingga dapat diketahui hasil secara percobaan. 62 DAFTAR PUSTAKA Al-Alwani, M. A., Mohamad, A. B., Ludin, N. A., Kadhum, A. A., & Sopian, K. (2016). Dye-sensitized solar cells: development, structure, operationprinciples, electron kinetics, characterisation, synthesis materials and natural photosensitiser. Renew. Sustain. Energy Rev. , 183-213. Baerends, E. J., & Gritsenko, O. V. (1997). A Quantum Chemical View of Density Functional Theory. J. Phys. Chem. A 101 , 5383-5403. Bai, Y., Zhang, J., Zhou, D., Wang, Y., Zhang, M., & Wang, P. (2011). Engineering organic sensitizers for iodine-free dyesensitized solar cells: red-shifted current response concomitant with attenuated charge recombination. J. Am. Chem. Soc. 133 , 11442-11445. Becke, A. D. (1993). A new mixing of Hartree–Fock and local density‐functional theories. J. Chem. Phys. 98 , 1372-1377. Becke, A. D. (1993a). Density‐functional thermochemistry. III. The role of exact exchange. J. Chem. Phys. 98 , 5648– 5652. Bisquert, J., & Vikhrenko, V. S. (2004). Interpretation of the time constants measured by kinetic techniques in nanostructured semiconductor electrodes and dye-sensitized solarcells. J. Phys. Chem. B. 108 , 2313-2322. Born, M., & Oppenheimer, R. (1927). Zur quantentheorie der molekeln. Ann. Phys. 389 , 457-484. 63 Boschloo, G., & Hagfeldt, A. (2009). Characteristics of the iodide/triiodide redox mediator in dye-sensitized solar cells. Acc. Chem. Res. 42 , 1819-1826. Burschka, J., Pellet, N., Moon, S. J., Humphry-Baker, R., Gao, P., Nazeeruddin, M. K., et al. (2013). Sequential deposition as a route to high-performance perovskitesensitized solar cells. Nature 499 , 316-319. Casida, M. E. (2009). Time-dependent density-functional theory for molecules and molecular solids. J. Mol. Struct. THEOCHEM, Time-dependent density-functional theory for molecules and molecular solids 914 , 3–18. Chen, X., & Mao, S. S. (2007). Titanium dioxide nanomaterials: synthesis, properties, modification, and applications. Che. Rev. 107 , 2891-2959. Chung, I., Lee, B., He, J., Chang, R. P., & Kanatzidis, M. G. (2012). All-solid-state dye-sensitized solar cells with high efficiency. Natture Letter , 486-489. Devabhaktuni, V., Alam, M., Shekara Sreenadh Reddy Depuru, S., II, G., Nims, R. C., & Near, C. (2013). Solar Energy: Trends and enabling technologies. Renew. Sustain. Energy Rev 19 , 555-564. Dewan Energi Nasional (DEN). (2014). Outlook Energi Indonesia 2014. Ditchfield, R., Hehre, W. J., & Pople, J. A. (1971). SelfConsistent Molecular Orbital Methods. 9. Extended Gaussian- 64 type basis for molecular-orbital studies of organic molecules. J. Chem. Phys. 54 , 724. Dreuw, A., & Head-Gordon, M. (2005). Single-Reference ab Initio Methods for the Calculation of Excited States of Large Molecules. Chem. Rev. 105 , 4009–4037. Facci, T., & Huguenin, F. (2010). Spectroelectrochemical properties and lithium ion storage in self-assembled nanocomposites from TiO2. Langmuir 26 , 4489-4496. Fan, J., Hao, Y., Cabot, A., Johansson, E. M., Boschloo, G., & Hagfeldt, A. (2013). Cobalt(II/III) redox electrolyte in ZnO nanowire-based dye-sensitized solar cells. ACS Appl. Mater. Interfaces 5 , 1902-1906. Feldt, S. M., Gibson, E. A., Gabrielsson, E., Sun, L., Boschloo, G., & Hagfeldt, A. (2010). Design of organic dyes and cobalt polypyridine redox mediators for high-efficiency sye-sensitized solar cells. J. Am. Chem. Soc. 132 , 1671416724. Feldt, S. M., Wang, G., Boschloo, G., & Hagfeldt, A. (2011). Effects of driving forces for recombination and regeneration on the phitivoltaic performance of dye-sensitized solar cells using cobalt polypyridin redox couples. J. Phys. Chem. C 115 , 21500-21507. Fenoglio, I., Greco, G., Livraghi, S., & Fubini, B. (2009). Non-UV-induced radical reaction at the surface of TiO2 nanoparticles that may trigger toxic responses. Chem. - Eur. J. 15 , 4614-4621. 65 Fisher, A. C., Peter, L. M., Ponomarev, E. A., Walker, A. B., & Wijayantha, K. G. (2000). Intensity dependence of the back reaction and transport of electrons in sye-sensitized nanocrystalline TiO2 solar cells. J. Phys. Chem. B 104 , 949958. Fitri, A., Benjelloun, A. T., Benzakour, M., Mcharfi, M., Hamidi, M., & Bouachrine, M. (2014). Theoritical design of thiazole-based organic dyes with dofferent electron donors for dye-sensitized solar cells. Spectrochim. Acta , 232-238. Fujishima, A., Zhang, X., & Tryk, D. A. (2008). TiO2 photocatalysis and related surface phenomena. Surf. Sci. Rep. 63 , 515-582. Goncalves, L. M., Bermudez, V., Ribeiro, H. A., & Mendes, A. M. (2008). Dye-sensitized solar cells: A safe bet for the future. Energy Environ. Sci. 1 , 655-667. Gong, J., Liang, J., & Sumathy, K. (2012). Review on dyesensitized solar cells (DSSCs): Fundamental concepts and novel materials. Renew. Sustain. Energy Rev. 16 , 5848-5860. Grätzel, M. (2004). Conversion of sunlight to electric powerby nanocrystalline dye-sensitized solar cells. Journal of Photochemistry and Photobiology , 3-14. Grätzel, M. (2003). Review: Dye-sensitized solar cells. Journal of Photochemistry and Photobiology C: Photochemistry , 145–153. Gratzel, M. (2005). Solar energy conversion by dye-sensitized photovoltaic cells. Inorg. Chem. , 6841-6851. 66 Gross, E. K., & Maitra, N. P. (2012). Introduction to TDDFT in Rubio, A. Fundamentals of Time-Dependent Density Functional Theory. Berlin: Springer-Verlag. Gross, E. K., Ullrich, C. A., & Gossman, U. J. (1995). Density functional theory of time-dependent systems, in: Gross, E. K. U., Dreizler, R. M. (Eds.), density functional theory, NATO ASI Series. Springer US. Guo, F., He, J., Qu, S., Li, J., Zhang, Q., Wu, W., et al. (2013). Structure-property relationship of different electron donors: new organic sensitizers based on bithiazole moiety for high efficiency dye-sensitized solar cells. RSC Adv. 3 , 1590015908. Hagfeldt, A., Boschloo, G., Sun, L., Kloo, L., & Petterson, H. (2010). Dye-sensitized solar cells. Chem. Rev. 110 , 65956663. Hamann, T. W. (2012). The end of iodide? Cobalt complex redox shuttles in DSSC. Dalton Trans. 41 , 3111. Han, H., Liang, M., Tang, K., Cheng, X., Zong, X., Sun, Z., et al. (2011). Molecular design of triarylamine dyes incorporating phenylene spacer and the influence of alkoxy substituent on the performance of dye-sensitized solar cells. J. Photochem. and Photobio. A: Chemistry 225 , 8-16. Hashmi, S. G., Moehl, T., Halme, J., Ma, Y., Saukkonen, T., Yella, A., et al. (2014). A durable metal free SWCNT/PET polymer foil based counter electrode for flexible dye sensitized solar cells. J. Mater. Chem. A. 67 Hay, P. J., & Wadt, W. R. (1985). Ab initio effective core potentials for molecular calculation. Potentials for the transition metal atom Sx to Hg. J. Chem. Phys. 82 , 270-283. Hohenberg, P., & Kohn, W. (1964). Inhomogeneous electron gas. Phys. Rev. 136 , B864-B871. Hosni, M. (2014). Optimisation du procédé polyol pour la synthése de nanoparticules d'Oxyde de zinc: Mise à l'échelle du procédé et applications photovoltaïques. Doctoral thesis Universite Paris 13 - Sorbonne paris cité-institut galelée and Universite de tunis el manar-Faculté des sciences de tunis. Chapter IV , 181-234. International Energy Agency (IEA). (2013). World Energy Outlook 2013. Iqbal, Z., Wu, W. Q., Kuang, D. B., Wang, L., Meier, H., & Cao, D. (2013). Phenothiazine-based dyes with bilateral extension of π-conjugation for efficient dye-sensitized solar cells. Dyes Pigm. , 722-731. Jacobson, M. Z., & Delucchi, M. A. (2011). Providing all golbal energy with wind, water and solar power, Part I: Technologies, energy resources, quantities and areas of infrastructures, and materials. Energy Policy 39 , 1154-1169. Jacquemin, D., Le Bahers, T., Adamo, C., & Ciofini, I. (2012). What is the "best" atomic charge model to describe through-space charge-transfer excitation? Phys. Chem. Chem. Phys. , 5383-5388. 68 Jena, A., Mohanty, S. P., Kumar, P., Naduvath, J., Gondane, V., Lekha, P., et al. (2012). Dye sensitized solar cells: A review. Trans. Indian Ceram. Soc. 71 , 1-16. Jungsuttiwong, S., Tarsang, R., Sudyoadsuk, T., Promarak, V., Khongpracha, P., & Namuangruk, S. (2013). Theoritical study on novel double donor-based dyes used in high efficient dye-sensitized solar cellss: The application of TDDFT study to the elctron injection process. Org. Electron. 14 , 711-722. Kanaparthi, R. K., Kandhahdi, J., & Giribabu, L. (2012). Metal-free organic dyes for dye-sensitized solar cells: recent advances. Tetahedron , 8383-8393. Karunagaran, B., Uthirakumar, P., Chung, S. J., Velumani, S., & Suh, E. K. (2007). TiO2 thin film gas sensor for monitoring ammonia. Mater. Charact., XIV International Materials Research Congress: Symposium 7 XIV International Materials Research Congress 58 , 680-684. Khare, P., Sonane, M., Pandey, R., Ali, S., Gupta, K. C., & Satish, A. (2011). Adverse effects of TiO2 and ZnO nanoparticles in soil Nematode, Caenorhabditis elegans. J. Biomed. Nanotechnol. 7 , 116-117. Kim, H. S., Lee, C. R., Im, J. H., Lee, K. B., Moehl, T., Marchioro, A., et al. (2012). Lead iodide perovskite sensitized all-solid-state submicron thin film mesoscopic solar cell with efficiency exceeding 9%. Sci. Rep. , 2. Kiymaz, D., Sezgin, M., Sefer, E., Zafer, C., & Koyuncu, S. (2016). Carbazole based D-A-p-A chromophores for dyesensitized solar cells: Effect of the side alkyl chain length on 69 device performance. International Journal of Hydrogen energy (In Press) , 1-7. Klahr, B. M., & Hamann, T. W. (2009). Performance enhancement and limitations of cobalt bipyridyl redox shuttles in dye-sensitized solar cells. J. Phys. Chem. C 113 , 1404014045. Koch, W., & Holthausen, M. C. (2000). chemist’s guide to density functional theory. Wiley-VCH. Kohn, W., & Sham, L. J. (1965). Self-consistent equations including wxchange and correlation effects . Phys. Rev. 140 , A1133-A1138. Koumara, N., Wang, Z. S., Mori, S., Miyashita, M., Suzuki, E., & Hara, K. (2006). Alkyl-functionalized organic dyes for efficient molecular photovoltaics. J. Am. Chem. Soc , 128. Kozeij, D., Fischer, F., Kränzlin, N., Caseri, W. R., & Niederberger, M. (2009). Nanoaqueous TiO2 nanoparticle synthesis: a versatile basis for the fabrication of selfsupporting, tranparent, and UV-absorbing composite films. ACS Appl. Mater. Interfaces 1 , 1097-1104. Kumar, G. S., Srinivas, K., Shanigaram, B., Bharath, D., Singh, S. P., Bhanuprakash, K., et al. (2014). Metal-free organic dyes containing thiadiazole unit for dye-sensitized solar cells: a combined experimental and theoritical study. RSC Adv. 4 , 13172-13181. Kusumawati, Y. (2015). Oxide and composite electron transport layers for efficient dye-sensitized. France. 70 Lancelle-Beltran, E., Prené, P., Boscher, C., Belleville, P., Buvat, P., Lambert, S., et al. (2008). Solid-state organic/inorganic hybrid solar cells based on poly(octylthiophene) and dye-sensitized nanobrookite and nanoanatase TiO2 electrodes. Eur. J. Inor. Chem , 903-910. Le Bahers, T., Labat, F., Pauporté, T., Lainé, P. P., & Ciofini, I. (2011). Theoritical procedure for optimizing dye-sensitized solar cells: from electronic structure to photovoltaic efficiency. J. Am. Chem. Soc. 133 , 8005-8013. Le Bahers, T., Pauporté, T., Scalmani, G., Adamo, C., & Ciofini, I. (2009). A TD-DFT investigation of ground and excited state properties in indoline dyes used for dyesensitized solar cells. Phys. Chem. Chem. Phys. 11 , 11276– 11284. Lee, C., Yang, W., & Parr, R. G. (1988). Development of the Colle-Salvetti correlation-energy formula into a functional of the electron density. functional of the electron density. Phys. Rev. B 37 , 785–789. Li, P. P., Chen, Y., Zhu, J., Feng, M., Zhuang, X., & Lin, Y. (2011). Charm-bracelet-type poly(N-vinylcarbazole) functionalized with reduced graphene oxide for broadband optical limiting. Chem. Eur. J. 17 , 780-785. Liang, Y., Peng, B., Liang, J., Tao, Z., & Chen, J. (2010). Triphenylamine-based dyes bearing functionalized 3,4propylenedioxythiophene linkers with enhanced performance for dye-sensitized solar cells. Org. Lett. 12 , 1204-1207. 71 Liao, Y., Que, W., Jia, Q., He, Y., Zhang, J., & Zhong, P. (2012). Controllable synthesis of brookite/anatase/rutile TiO2 nanocomposites and single-crystalline rutile nanorods array. J. Mater. Chem. 22 , 7937-7944. Linsebigler, A. L., Lu, G., & Yates, J. T. (1995). Photocatalysis on TiO2 surfaces: principles, mechanisms, and selected results. Chem. Rev. 95 , 735-758. Liu, D., & Kelly, T. L. (2014). Perovskite solar cell with a planar heterojunction structure prepared using rootemperature solution processing techniques. Nat. Photonics 8 , 133-138. Liu, J., Yang, X. D., Islsm, A., Numata, Y., Zhang, S. F., & Salim, N. T. (2013). Effiicient metal-free sensitizers bearing circle chain embracing phi-spacer for dye-sensitized solar cells. J. Mater. Chem. A 1 , 10889-10897. Magne, C. (2012). Optimisation de Couches D'oxyde Nanostructurees pour Applications Aux Cellules Solaires A Colorant. Doctoral Thesis Universite Pierre et Marie Currie , 21. Magne, C., Cassaigon, S., Lancel, G., & Pauporté, T. (2011). Brookite TiO2 nanoparticle films for dye-sensitized solar cells. Chem. Phys. Chem. 12 , 2461-2467. Manoharan, S., & Anandan, S. (2014). Cyanovinyl substituted benzimidazole based (D–π–A) organic dyes for fabrication of dye sensitized solar cells. Dyes Pigments 105 , 223-231. 72 Marques, M. A., & Gross, E. K. (2004). Time-Dependent Density Functional Theory. Annu. Rev. Phys. Chem. 55 , 427– 455. Mathew, S., Yella, A., Gao, P., Humphry-Baker, R., Curchod, B. F., Ashari-Astani, N., et al. (2014). Dye-senstized solar cells with 13% efficiency achieved through the molecular engineering of porphyrin sensitizers. Nat. Chem. , 242-247. Mishra, A., Fischer, M., & Bauerle, P. (2009). Metal-free organic dyes for dye-sensitized solar cells: From structure– property relationships to design rules. Angew. Chem. Int. Ed. , 2474-2499. Murakami, T. N., Koumura, N., Kimura, M., & Mori, S. (2014). Structural effect of donor in organic dye on recombination in dye-sensitized solar cells with cobalt complex electrolyte. Langmuir 30 , 2274-2279. Nazeeruddin, M. K., Péchy, P., Renouard, T., Zakeeruddin, S. M., Humphry-Baker, R., Comte, P., et al. (2001). Engineering of efficient panchromatic sensitizer for nanocrystalline TiO2based solar cells. J. Am. Chem. Soc , 1613-1624. Nazeeruddin, M. K., Zakeeruddin, S. M., Humphry, B. R., Jirousek, M., Liska, P., & Vlachopoulus, N. (1999). Acid-base equilibria of (2,2'-bipyridyl-4,4'-dicarboxylic acid)ruthenium(II) complexes and the effect of protonation on charge transfer sensitization of nanocrystalline titania. Inorg. Chem. , 6298-6305. Ni, M., Leung, M. K., Leung, D. Y., & Sumathy, K. (2007). A review and recent developments in photocatalytic water73 splitting using for hydrogen production. Renew. Sustain. Energy Rev. 11 , 401-425. Nussbaumer, R. J., Caseri, W. R., Smith, P., & Tervoort, T. (2003). Polymer-TiO2 nanocomposites: a route towards visually transparent broadband UV filters and high refractive index materials. Macromol. Mater. Eng. 288 , 44-49. Omar, A., & Abdullah, H. (2014). Eelctron transport analysis in zinc oxide-based dye-sensitized solar cells: a review. Renew. Sustain. Energy Rev. 31 , 149-157. O'Regan, B., & Grätzel, M. (1991). A low-cost, highefficiency solar cell based on dye-sensitized collodial TiO2 films. Natyre 353 , 737-740. Parkin, I. P., & Palgrave, R. G. (2005). Self-cleaning coatings. J. Mater. Chem. 15 , 1689-1695. Pascoe, A. R., Bourgeois, L., Duffy, N. W., Xiang, W., & Cheng, Y. B. (2013). Surface state recombination and apssivation in nanocrystalline TiO2 dye-sensitized solar cells. J. Phys. Chem. C 117 , 25118-25126. Pazoki, M., Taghavinia, N., Hagfeldt, A., & Boschloo, G. (2014). Mesoporoues TiO2 microbead electrodes for cobaltmediator-based dye-sensitized solar cells. J. Phys. Chem. C 118 , 16472-16478. Quintana, M., Edvinsson, T., Hagfeldt, A., & Boschloo, G. (2007). Comparison of dye-sensotozed ZnO and TiO2 solar cells: studies of charge transport and carrier lifetime. J. Phys. Chem. C 111 , 1035-1041. 74 Reyes-Coronado, D., Rodriguez-Gattamo, G., EspinosaPesqueira, M. E., Cab, C., Coss, R. d., & Oskam, G. (2008). Phase-pure TiO2 nanoparticles: anatase, brookite and rutile. Nanotechnology 19 , 145605. Roy-Mayhew, J. D., Bozym, D. J., Punckt, C., & Aksay, I. A. (2010). Functionalized graphene as a catalytic counter electrode in dye-sensitized solar cells. ACS Nano 4 , 62036211. Runge, E., & Gross, E. K. (1984). Density-Functional Theory for Time-Dependent Systems. Phys. Rev. Lett. 52 , 997–1000. Schrödinger, E. (1926). An undulatory theory of the mechanism of atoms and moleculs. Phys. Rev. 28 , 10491070. Shafiee, S., & Topal, E. (2009). When will fossil fuel reserves be diminished? Energy Policy 37 , 181-189. Sharma, A. K. (1996). Semiconductor Electronics. New Age International , 6-7. Shi, J., Chai, Z., Zhong, C., Wu, W., Hua, J., & Dong, Y. (2012). New efficient dyes containing tert-butyl in donor for dye-sensitized solar cells. Dyes Pigm, , 244-251. Sima, C., Grigoriu, C., & Antohe, S. (2010). Comparison of the dye-sensitized solar cells performances based on transparent conductive ITO and FTO. Thin Solid Films, Special Section: Romanian Conference on Anvanced Materials 2009 , 595-597. 75 Smestad, G. P., & Grätzel, M. (1998). Demonstrating electron transfer and nanotechnology: A natural dye-sensitized nanocrystalline energy converter. J. Chem. Educ. 75 , 752756. Srinivas, K., Kumar, C. R., Reddy, M. A., Bhanuprakash, K., Rao, V. J., & Giribabu, L. (2011). D-π-A organic dyes with carbazole as donor for dye-sensitized solar cells. Syn. Metals , 96-105. Steinberg, M. (1999). Fossil fuel decarbonization technology for mitigatingglobal warming. Int. J. Hydrog.Energy 24 , 771777. Su, C. Y., Yu, Q. Y., Liao, J. Y., Zhou, S. M., Shen, Y., & Liu, J. M. (2011). Effect of hydrocarbon chain length of disubstitued triphenylamine based organic dyes on dyesensitized solar cells. J. Phys. Chem. C , 22002-22008. Tamilvan, V., Cho, N., Kim, C., Ko, J., & Hyun, M. H. (2012). Influences of the electron donor groups on the properties of thiophene-(N-aryl)pyrrole-thiophene-based organic sensitizers. Synth. Met. 162 , 2155-2162. Tang, J., Hua, J. L., Wu, W. J., Li, J., Jin, Z. G., & Long, Y. T. (2010). New starburst sensitizer with carbazole antennas for efficient and stable dye-sensitized solar cells. Energy Environ. Sci. 3 , 1736-11745. Thomas, A. G., & Syres, K. L. (2012). Adsorption of organic molecules on rutile TiO2 and anatase TiO2 single crystal surface. CheM. Soc. Rev. 41 , 4207-4217. 76 Timilsina, G. R., Kurdgelashvili, L., & Narbel, P. A. (2012). Solar Energy: Markets, economics and policies. Renew. Sustain. Energy Rev. 16 , 449-465. Vosko, S. H., Wilk, L., & Nusair, M. (1980). Accurate spindependent electron liquid correlation energies for local spin density calculations: a critical analysis. Can. J. Phys. 58, , 1200–1211. Wan, Z., Jia, C., Zhang, J., Duan, Y., Lin, Y., & Shi, Y. (2012). Triphenylamine-based starburst dyes with carbazole and phenothiazine antennas for dye-sensitized solar cells. J. Power Sources 199 , 426-431. Wang, D., Choi, D., Li, J., Yang, Z., Nie, Z., Kou, R., et al. (2009). Self-assembled TiO2-Graphene hybrid nanostructures for enhanced Li-ion insertion. ACS Nano 3 , 907-914. Weerasinghe, H. C., Huang, F., & Cheng, Y. B. (2013). Fabrication of flexible dye sensitized solar cells on plastic substrates. Nano Energy , 174-189. Wei, S., Lu, X., Shi, X., Deng, Z., Shao, Y., Zhao, L., et al. (2014). Theoretical Insight into Organic Dyes Incorporating Triphenylamine-Based Donors and Binary π-Conjugated Bridges for Dye-Sensitized Solar Cells. Int. J. Photoenergy , 1-9. Yanai, T., Tew, D. P., & Handy, N. C. (2004). A new hybrid exchange-correlation functional using the Coulombattenuating methode (CAM-B3LYP). Chem. Phys. Lett. 393 , 51-57. 77 Yella, A., Lee, H. W., Tsao, H. N., Yi, C., Chandiran, A. K., Nazeeruddin, M. K., et al. (2011). Porphyrin-sensitized solar cells with Co (II/III)-based redox electrolyteexceed 12 percent efficiency. Science 334 , 629-634. Young, D. C. (2001). Computational Chemistry: A Practical Guide for Applying Techniques to Real-World Problems. New York: John Wiley & Sons, Inc. Yu, Q. Y., Liao, J. Y., Zhou, S. M., Shen, Y., Liu, J. M., & Kuang, D. B. (2011). Effect of hydrocarbon chainlength of disubtituted triphenyl-amine-based organic dyes on dyesensitized solar cells. J. Phys. Chem. C , 115. Yum, J. H., Baranoff, E., Kessler, F., Moehl, T., Ahmad, S., Bessho, T., et al. (2012). A cobalt complex redox shuttle for dye-sensitized solar cells with high open-circuit potentials. Nat. Commun. 3 , 631. Zhang, Q., Dandeneau, C. S., Zhou, X., & Cao, G. (2009). ZnO nanostructures for dye-sensitized solar cells. Adv. Mater. 21 , 4087-4108. 78 LAMPIRAN A. Penjelasan Input File Gaussian Contoh untuk zat molekul CB1 %nproc=4 #P GFINPUT IOP(6/7=3) CAM-B3LYP/6-31G* opt test Kode untuk perhitungan optimasi geometri CB1_1 Judul 0 1 0 = total muatan; 1=multiplisitas C -5.33748 -2.45676 -0.56660 Koordinat C -5.71334 -1.15928 -0.21677 molekul C -6.34527 -3.40249 -0.75282 C -7.08191 -0.79963 -0.07814 ..... Keterangan: #P GFINPUT IOP(6/7=3) : Kode untuk membuat output yang dapat divisualisasikan dengan beberapa software CAM-B3LYP : Tingkat teori yang digunakan dalam perhitungan molekul 6-31G* : Basis set yang digunakan dalam perhitungan molekul Opt test : Kode instruksi untuk perhitungan optimasi 79 B. Prosedur Perhitungan Transfer Muatan Prosedur untuk perhitungan transfer muatan dari keadaan dasar menuju keadaan tereksitasi diadaptasi dari prosedur yang telah diimplementasikan oleh Jacquemin dan kawan-kawan (Jacquemin, dkk., 2012). Prosedur ini menggunakan model muatan atom sebagian (Partiallu Atomic Charge/ PAC) untuk memperkirakan lokasi densitas elektron. Tahap pertama, harus ditetapkan posisi atom molekul yang memiliki transisi elektron (koordinat kartesian molekul). Lalu dilakukan perhitungan perbedaan energi keadaan dasar dan PAC tereksitasi (δqi). δqi = qiES - qiGS Hasil perhitungan tersebut kemudian dibedakan menjadi 2 kategori yaitu berdasarkan peningkatan/penurunan PAC. qi+= δqi, jika δqi >0 0, jika δqi <0 Dan qi-= δqi, jika δqi <0 0, jika δqi >0 Jumlah transfer muatan (qct) menjadi: qCT = 80 = Dua koorsinat sebagai posisi awal dan akhir transfer muatan didefinisikan dengan: r+= (x+, y+, z+) = r-= (x-, y-, z-) = Pemisahan muatan kemudian didefinisikan sebagai jarak dari kedua titik ini: DCT = |r+ - r-| 81 “Halaman ini sengaja dikosongkan” 82 Biodata Penulis Penulis bernama Annisa Tria Apriliani yang dilahirkan di Mojokerto pada tanggal 22 April 1996. Penulis merupakan anak ketiga dari tiga bersaudara. Penulis pernah menempuh pendidikan di SDN Pohkecik I, SMPN 1 Puri, dan SMAN 1 Puri. Penulis melanjutkan pendidikan tinggi di Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam (MIPA) Institut Teknologi Sepuluh Nopember (ITS) melalui jalur SNMPTN pada tahun 2013 dan terdaftar sebagai mahasiswaKimia ITS dengan NRP 1413100004. Penulis pernah melakukan kerja praktik di PT Petrokimia Gresik. Selama menempuh pendidikan di ITS, penulis aktif berorganisasi. Penulis pernah menjabat sebagai staff Departemen Chemistry Week Himpunan Mahasiswa Kimia (HIMKA) ITS periode 2014/2015 dan sekretaris Big Event Chemistry Week Himpunan Mahasiswa Kimia (HIMKA) periode 2015/2016. Penulis menyelesaikan pendidikannya di Jurusan Kimia FMIPA ITS dengan mengambil tugas akhir yang berjudul “Studi Komputasi Sifat Elektronik Senyawa Turunan Carbazole sebagai Sensitiser pada Dye-Sensitized Solar Cell (DSSC)” yang dibimbing oleh Dr. Yuly Kusumawati, M. Si. Penulis dapat diajak berdiskusi mengenai tugas akhir maupun topik lainnya dan dapat dihubungi melalui email [email protected]. 83