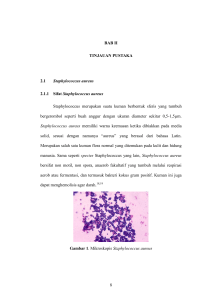
ekstrak daun kaktus pakis giwang
advertisement

Tesis EKSTRAK DAUN KAKTUS PAKIS GIWANG (EUHPHORBIA MILII) MENGHAMBAT PERTUMBUHAN BAKTERI METHICILLIN-RESISTANT STAPHYLOCOCCUS AUREUS SECARA IN VITRO I MADE AGUS SUNADI PUTRA NIM 0990761030 PROGRAM MAGISTER PROGRAM STUDI ILMU BIOMEDIK PROGRAM PASCASARJANA UNIVERSITAS UDAYANA DENPASAR 2012 Tesis EKSTRAK DAUN KAKTUS PAKIS GIWANG (EUHPHORBIA MILII) MENGHAMBAT PERTUMBUHAN BAKTERI METHICILLIN-RESISTANT STAPHYLOCOCCUS AUREUS SECARA IN VITRO Tesis ini untuk Memperoleh Gelar Magister dalam Program Studi Ilmu Biomedik pada Program Pascasarjana Universitas Udayana I MADE AGUS SUNADI PUTRA NIM 0990761030 PROGRAM MAGISTER PROGRAM STUDI ILMU BIOMEDIK PROGRAM PASCASARJANA UNIVERSITAS UDAYANA DENPASAR 2012 Lembar Pengesahan TESIS INI TELAH DISETUJUI TANGGAL 8 Pebruari 2012 Pembimbing I, Pembimbing II, dr. Komang Januartha Putra Pinatih, M.Kes NIP 1967012219601101 Dr.dr. I Putu Gede Adiatmika,M.Kes NIP 196603091998021003 Mengetahui Ketua Program Studi Ilmu Biomedik Program Pascasarjana Universitas Udayana Prof.Dr.dr. Wimpie Pangkahila,Sp.And.,FAACS NIP. 194612131971071001 Direktur Program Pascasarjana Universitas Udayana Prof.Dr.dr.A.A.Raka udewi,SpS(K) NIP 195902151985102001 Tesis Ini Telah Diuji pada Tanggal 8 Pebruari 2012 Panitia Penguji Tesis Berdasarkan SK. Rektor Universitas Udayana No. 0144/UN14.4/HK/2012 Tanggal 16 Januari 2012 Ketua: dr. Komang Januartha Putra Pinatih, M.Kes Anggota: 1. 2. 3. 4. Dr.dr. I Putu Gede Adiatmika,M.Kes Prof.Dr.dr.J Alex Pangkahila,M.Sc.,Sp.And Dr.dr. I Wayan Putu Sutirta Yasa,M.Si Dr.dr. I Dewa Made Sukrama,M.Si.Sp.MK(K) SURAT PERNYATAAN BEBAS PLAGIAT Saya yang bertanda tangan di bawah ini : Nama : I Made Agus Sunadi Putra NIM : 0990761030 Program Studi : S2 Ilmu Biomedik Program Pascasarjana Universitas Udayana Judul Tesis : Ekstrak Daun Kaktus Pakis Giwang (Euphorbia milii) Menghambat Pertumbuhan Bakteri Methicillin-resistant Staphylococcus aureus secara In Vitro Dengan ini menyatakan bahwa karya ilmiah Tesis ini bebas plagiat. Apabila di kemudian hari terbukti plagiat dalam karya ilmiah ini, maka saya bersedia menerima sanksi sesuai peraturan Mendiknas RI No. 17 Tahun 2010 dan Peraturan Perundang-undangan yang berlaku. Denpasar, 20 Pebruari 2012 Yang membuat pernyataan (I Made Agus Sunadi Putra) NIM : 0990761030 UCAPAN TERIMAKASIH Pertama – tama perkenankanlah penulis memanjatkan puji syukur ke hadapan Ida Sang Hyang Widhi Wasa, Tuhan Yang Maha Kuasa, karena atas karunia-Nyalah, tesis yang berjudul ”Ekstrak Daun Kaktus Pakis Giwang (Euhphorbia milii) Menghambat Pertumbuhan Bakteri Methicillin-resistant Staphylococcus Aureus secara in vitro” dapat diselesaikan. Pada kesempatan ini pula penulis mengucapkan terima kasih yang sebesar – besarnya kepada dr. Komang Januartha Putra Pinatih, M.Kes, selaku pembimbing I yang dengan penuh perhatian telah memberikan dorongan, semangat, bimbingan, dan saran selama penulis mengikuti program magister, khususnya dalam penyelesaian tesis ini. Terimakasih sebesar – besarnya pula penulis sampaikan kepada Dr.dr. I Putu Gede Adiatmika,M.Kes selaku pembimbing II yang dengan penuh perhatian dan kesabaran telah memberikan bimbingan dan saran kepada penulis. Penulis juga mengucapkan terima kasih yang sebesar – besarnya kepada Prof. Dr. Dr. I Made Bakta,Sp.PD (KHOM), selaku Rektor Universitas Udayana atas kesempatan dan fasilitas yang diberikan kepada penulis untuk mengikuti pendidikan Program Magister di Universitas Udayana. Ucapan terimakasih penulis sampaiakan juga kepada Prof. Dr. Dr.A.A Raka Sudewi, Sp.S(K), selaku Direktur Program Pascasarjana Universitas Udayana dan Ketua Program Biomedis Prof. Dr.dr. Wimpie Pangkahila,SpAnd,FAACS. , atas kesempatan yang diberikan kepada penulis mengikuti program magister di Universitas Udayana. Tidak lupa pula penulis ucapkan terima kasih kepada Drs. I Gede Made Saskara Edi,M.Psi.,Apt selaku Direktur Akademi Farmasi Saraswati Denpasar atas ijin dan fasilitas yang diberikan kepada penulis untuk mengikuti program magister. Ucapan terima kasih penulis sampaikan pula kepada para penguji tesis, dr Komang Januarta ; Dr.dr. I Putu Gede Adiatmika; Dr.dr. I Dewa Made Sukrama, M.Si.,SpMK(K) dan Dr.dr. I Wayan Putu Sutirta Yasa,M.Si; Prof.Dr.dr.J.Alex Pangkahila,Sp.And.,FAACS yang telah memberikan masukan, saran, sanggahan dan koreksi sehingga tesis ini dapat terwujud. Penulis juga mengucapkan terima kasih yang tulus disertai penghargaan kepada seluruh guru – guru serta dosen – dosen yang telah membimbing penulis, mulai dari tingkat dasar sampai perguruan tinggi. Juga penulis ucapkan terima kasih kepada Ibu Ni Wayan Sudiarni dan Bapak I Nyoman Sunatra yang telah mengasuh dan membesarkan penulis, memberikan dasar – dasar berpikir logik dan suasana demokratis sehingga tercipta suasana yang baik untuk berkembangnya kreativitas. Akhirnya penulis sampaikan kepada istri tercinta Ni Wayan Suliastri,SE serta putra – putri terkasih Ni Luh Putu Diastri Putri Sunadi dan I Kadek Prabu Putra Sunadi yang dengan penuh pengorbanan telah memberikan penulis kesempatan untuk lebih berkonsentrasi menyelesaikan tesis ini. Semoga Ida Sang Hyang Widhi Wasa, Tuhan Yang Maha Esa, selalu melimpahkan rahmat-Nya kepada semua pihak yang telah membantu pelaksanaan dan penyelesaian tesis ini, yang tidak dapat penulis sebutkan satu persatu secara lengkap, serta kepada penulis sekeluarga. Denpasar, Pebruari 2012 Ttd Penulis ABSTRAK EKSTRAK DAUN KAKTUS PAKIS GIWANG (EUHPHORBIA MILII) MENGHAMBAT PERTUMBUHAN BAKTERI METHICILLIN-RESISTANT STAPHYLOCOCCUS AUREUS SECARA IN VITRO Meningkatnya pemakaian antibiotika menyebabkan meningkatnya resistensi bakteri terhadap antibiotika. Ada beberapa macam keadaan dimana mikroorganisme resisten terhadap antibiotik, antara lain methicillin-resistant Staphylococcus aureus (MRSA). Untuk mengatasi masalah resistensi salah satunya dengan memakai bahan tanaman seperti daun kaktus pakis giwang (Euphorbia milii). Penelitian ini menggunakan metode eksperimental murni. Untuk mengetahui pengaruh daun kaktus pakis giwang terhadap pertumbuhan MRSA dilakukan dengan cara membuat ekstrak daun dengan pelarut etanol 70%. Dibuat konsentrasi ekstrak 25%, 50%, 75% dan 100% untuk uji daya hambat menggunakan cakram terhadap pertumbuhan MRSA dengan metode difusi dengan media agar. Dengan uji statistik didapatkan ada pengaruh secara bermakna ekstrak daun kaktus pakis giwang terhadap pertumbuhan MRSA. Terjadinya efek hambatan tersebut diduga disebabkan karena daun kaktus pakis giwang mengandung zat anti bakteri yaitu senyawa saponin. Uji perbandingan berdasarkan konsentrasi antara kelima kelompok perlakuan didapatkan rerata diameter daya zona hambat MRSA kelompok kontrol 0,0000+0,0000; kelompok ekstrak Euphorbia milii 25% 14,2500+0,5000; kelompok ekstrak Euphorbia milii 50% 18,0000+0,8165; kelompok ekstrak Euphorbia milii 75% 20,0000+0,0000 dan kelompok ekstrak Euphorbia milii 100% 22,0000+0,8165. Dapat disimpulkan peningkatan konsentrasi ekstrak Euphorbia milii dalam etanol 70% berpengaruh terhadap diameter zona hambat MRSA yang dihasilkan dari percobaan secara in vitro. Kata kunci : Euphorbia milii, Staphylococcus aureus Ekstrak etanol 70%, Methicillin-resistant ABSTRACT EUHPHORBIA MILI EXTRACT HAMPERING THE GROWTH OF METHICILLIN-RESISTANT STAPHYLOCOCCUS AUREUS IN VITRO Increased use of antibiotics leading to increased bacterial resistant. There are several kinds of circumstances in which the microorganisms resistant to antibiotics, including methicillin-resistant Staphylococcus aureus (MRSA). To overcome the resistance problem by using one plant materials such as fern leaf earrings cactus (Euphorbia milii). This study uses a purely experimental methods. To determine the influence of cactus fern leaf earrings on the growth of MRSA is done by making the leaf extract with 70% ethanol solvent. Created extract concentration of 25%, 50%, 75% and 100% power to test the growth inhibitory against MRSA using disc agar diffusion method. With the statistical tests found no significant effect of cactus fern leaf extract on the growth of MRSA earrings. The occurrence of these barriers effect caused by cactus fern leaf earrings contain anti-bacterial substances are compounds saponins. Comparison test based on the concentration between the five treatment groups obtained a mean diameter of the zone of inhibition of MRSA control group 0.0000+0.0000; group 25% extract of Euphorbia milii 14.2500+0.5000; group 50% extract of Euphorbia milii 18.0000+0 , 8165; group 75% extract of Euphorbia milii 20.0000+0.0000 and the 100% extract of Euphorbia milii 22.0000+0.8165. It can be concluded increasing concentrations of ethanol extract of Euphorbia milii in the 70% inhibitory effect on MRSA zone diameters resulting from in vitro experiments. Key words : Euphorbia milii, 70% ethanol extract, Methicillin-resistant Staphylococcus aureus DAFTAR ISI halaman SAMPUL DALAM............................................................................................ i PERSYARATAN GELAR ................................................................................ ii LEMBAR PENGESAHAN ............................................................................... iii PENETAPAN PANITIA PENGUJI ................................................................... iv SURAT PERNYATAAN ................................................................................... v UCAPAN TERIMA KASIH .............................................................................. vi ABSTRAK ....................................................................................................... viii ABSTRACT ..................................................................................................... ix DAFTAR ISI ..................................................................................................... x DAFTAR TABEL ............................................................................................. xii DAFTAR GAMBAR ........................................................................................ xiii DAFTAR ARTI LAMBANG, SINGKATAN DAN ISTILAH .......................... xiv DAFTAR LAMPIRAN ..................................................................................... xv BAB I PENDAHULUAN ................................................................................. 1.1 Latar Belakang ..................................................................................... 1.2 Rumusan Masalah ................................................................................ 1.3 Tujuan Penelitian ................................................................................. 1.3.1 Tujuan umum .......................................................................... 1.3.2 Tujuan khusus .......................................................................... 1.4 Manfaat Penelitian ................................................................................ 1.4.1 Manfaat teoritis......................................................................... 1.4.2 Manfaat praktis ......................................................................... 1 1 4 5 5 5 5 5 6 BAB II KAJIAN PUSTAKA ............................................................................ 2.1 Kaktus Pakis Giwang (Euphorbia milii) ................................................ 2.1.1 Sejarah dan asal – usul Euphorbia milii ..................................... 2.1.2 Morfologi Euphorbia milii ........................................................ 2.2 Staphylococcus aureus ......................................................................... 2.3 Methicillin-resisten Staphylococcus aureus .......................................... 2.4 Furunkle (Bisul) ................................................................................... 2.5 Anti Bakteri .......................................................................................... 2.6 Ekstraksi ............................................................................................... 2.7 Maserasi ................................................................................................ 7 7 7 8 13 15 17 18 20 21 BAB III KERANGKA PIKIR , KONSEP, DAN HIPOTESIS............................ 3.1 Kerangka Pikir ...................................................................................... 3.2 Kerangka Konsep .................................................................................. 3.3 Konsep Penelitian ................................................................................. 3.3 Hipotesis ............................................................................................... 22 22 23 24 25 BAB IV METODE PENELITIAN .................................................................... 4.1 Rancangan Penelitian ........................................................................... 4.2 Tempat dan Waktu Penelitian ................................................................ 4.3 Sumber Data Populasi dan Sampel ........................................................ 4.3.1 Populasi .................................................................................... 4.3.2 Sampel ...................................................................................... 4.4 Variabel Penelitian ............................................................................... 4.5 Definisi Operasional ............................................................................. 4.6 Alat dan Bahan ..................................................................................... 4.7 Alur Penelitian ..................................................................................... 4.8 Prosedur Penelitian............................................................................... 4.8.1 Tahap persiapan ........................................................................ 4.8.2 Tahap pengujian ....................................................................... 4.8.3 Penilaian kemampuan ekstrak daun kaktus pakis giwang (Euphorbia milii) terhadap pertumbuhan kultur MRSA ............. 4.9 Tahap Pengolahan Data ........................................................................ 4.9.1 Analisis deskriptip ....................................................................... 4.9.2 Uji normalitas dan homogenitas ................................................... 4.9.3 Uji Efek perlakuan ....................................................................... 4.9.4 Analisis kualitatif......................................................................... 26 26 27 27 27 27 28 29 30 32 33 33 35 BAB V HASIL PENELITIAN .......................................................................... 5.1 Hasil Penelitian .................................................................................... 5.2 Uji Deskriptif ....................................................................................... 5.3 Uji Normalitas dan Homogenitas Data ................................................ 5.4 Analisis Efek Perlakuan ....................................................................... 5.5 Analisis Kualitas .................................................................................. 48 48 49 50 51 52 BAB VI PEMBAHASAN HASIL PENELITIAN .............................................. 6.1 Subyek Penelitian ................................................................................. 6.2 Distribusi Data Hasil Penelitian ............................................................ 6.3 Pengaruh Ekstrak Daun Kaktus Pakis Giwang (Euphorbia milii) terhadap Diameter Xona Hambat MRSA ............................................. 54 54 54 44 44 44 45 45 47 56 BAB VII SIMPULAN DAN SARAN ............................................................... 61 7.1 Simpulan .............................................................................................. 61 7.2 Saran ................................................................................................... 61 DAFTAR PUSTAKA ....................................................................................... 62 LAMPIRAN ...................................................................................................... 68 DAFTAR TABEL halaman Tabel 4.1 Daftar Alat Penelitian ......................................................................... 30 Tabel 4.2 Daftar Bahan Penelitian ...................................................................... 31 Tabel 5.1 Zona Hambat MRSA .......................................................................... 49 Tabel 5.2 Rerata dan Simpangan Baku ............................................................... 49 Tabel 5.3 Hasil Uji Normalitas Data Masing – masing Kelompok ..................... 50 Tabel 5.4 Perbedaan Antara Dua Kelompok Perlakuan ...................................... 51 Tabel 5.5 Kualitas Daya Hambat ........................................................................ 53 DAFTAR GAMBAR halaman Gambar 2.1 Euphorbia milii............................................................................... 8 Gambar 2.2 Staphylococcus aureus .................................................................... 13 Gambar 2.3 Furunkle ......................................................................................... 17 Gambar 3.1 Kerangka Konsep ........................................................................... 24 Gambar 4.1 Rancangan Penelitian ..................................................................... 26 Gambar 4.2 Alur Penelitian ................................................................................ 32 Gambar 4.3 Alur Pengujian Koloni ................................................................... 36 Gambar 4.4 Uji Kekeruhan MRSA dibandingkan dengan 0,5 McFarland ........... 41 Gambar 4.5 Menimbang Agar Mueller Hinton ................................................... 42 Gambar 4.6 Pemanasan dan pelarutan agar dalam 100ml aquadest ..................... 42 Gambar 4.7 Proses sterilisasi dalam autoclave.................................................... 42 Gambar 4.8 Penuangan larutan agar dalam cawan petri ...................................... 43 Gambar 4.9 Proses inkubasi pada suhu 37oC selama 24 Jam .............................. 43 Gambar 5.1 Hasil pengukuran zona hambat ....................................................... 48 Gambar 5.2 Grafik diameter zona hambat MRSA .............................................. 52 DAFTAR ARTI LAMBANG, SINGKATAN DAN ISTILAH atm : atmosfer BPOM : Badan Pemeriksa Obat dan Makanan cm : centimeter DIC : Disseminated intravascular coagulation kg : kilogram KHM : Konsentrasi Hambat Minimum MIC : Minimum Inhibition Concentration mm : milimeter MRAB : Methicillin-resitant Acinobacter baumanii MRSA : Methicillin-resistant Staphylococcus aureus n : jumlah sampel NA : nutrient agar NB : nutrient broth p : signifikansi pH : derajat keasaman VRE : Vancomycin-resistant Enterococci α : tingkat kemaknaan DAFTAR LAMPIRAN Rerata dan Simpangan Baku .............................................................................. 68 Uji Normalitas Data ........................................................................................... 68 Uji Homogenitas ................................................................................................ 69 Kruskal-Wallis Test............................................................................................ 71 Mann-Whitney Test ............................................................................................ 72 Chi-Square test ................................................................................................. 78 Keterangan Kelaikan Etik ................................................................................. 80 BAB I PENDAHULUAN 1.1.Latar Belakang Infeksi merupakan kasus yang paling banyak dijumpai di komunitas maupun rumah sakit dimana angka kesakitan dan kematiannya masih tinggi. Tingginya kasus infeksi menyebabkan pemakaian antibiotikaa semakin meningkat. Antibiotikaa merupakan obat untuk membunuh bakteri penyebab infeksi, tetapi di lain pihak pemberian antibiotikaa membuat bakteri resisten. Resistensi antibiotika bisa menyebabkan pengobatan menjadi sangat mahal dan bahaya lainnya yang lebih berbahaya adalah bisa mengancam jiwa. Resistensi antibiotika sampai beberapa tahun kedepan mungkin tetap akan menjadi salah satu permasalahan kesehatan bangsa, yang mana bahaya dari resistensi antibiotikaa ini mungkin akan semakin berbahaya sebahaya penyakit menular lainnya bila tidak ditangani dengan tepat. Salah satu penyakit infeksi kulit yang sering dijumpai adalah furuncle atau umum disebut bisul. Meningkatnya pemakaian antibiotikaa menyebabkan meningkatnya resistensi bakteri terhadap antibiotikaa (Mahon dkk, 2007). Resistensi timbul bila suatu antibiotikaa kehilangan kemampuannya untuk secara efektif mengendalikan atau membasmi pertumbuhan bakteri, dengan kata lain bakteri mengalami “resistensi” dan terus berkembangbiak meskipun telah diberikan antibiotikaa dalam jumlah yang cukup untuk pengobatan. Dalam kurun waktu ±50 tahun ini telah terjadi peningkatan kejadian infeksi yang disebabkan oleh mikoorganisme yang resisten terhadap berbagai agen antimikroba atau antibiotika. Suatu mikroorganisme dianggap multi resisten jika banyak diantara antibiotika yang biasa digunakan tidak dapat membunuh mikroorganisme tersebut. Mikroorganisme dengan resistensi multi-obat akan banyak menyebabkan banyak masalah dalam lingkungan perawatan kesehatan dan bahkan dalam masyarakat (Alangaden, 1997; EPIC, 2006). Beberapa faktor dapat menyebabkan terjadinya peningkatan ini, diantaranya adalah salah pemilihan dan penggunaan dari agen antibiotika sehingga muncul adanya mikroorganisme yang resisten. Hal ini akan menyebabkan peningkatan morbiditas dan mortalitas, serta peningkatan biaya perawatan (Alangaden, 1997). Ada beberapa macam keadaan dimana mikroorganisme resisten terhadap antibiotika, salah satunya dan paling banyak mendapat perhatian adalah Methicillinresistant Staphylococcus aureus atau MRSA (EPIC, 2006). MRSA adalah Staphylococcus aureus yang resisten terhadap antibiotika β-laktam, termasuk penicillinase-resistant penicillins (methicillin, oxacillin, nafcillin) dan cephalosporin (Dellit dkk, 2004). MRSA merupakan penyebab utama infeksi di rumah sakit dan telah meluas dengan cepat di banyak bagian dunia. Makin lama makin sulit untuk melawan MRSA dan cara terbaik untuk mencegah penularannya masih banyak diperdebatkan. Di samping menjadi masalah di rumah – rumah sakit di dunia, MRSA juga makin banyak ditemukan kembali dari pasien di fasilitas perawatan jangka panjang seperti wisma para usia lanjut, dan bahkan dari orangorang di masyarakat atau di tempat-tempat olah raga (EPIC, 2006). Untuk mengatasi masalah resistensi perlu dicari cara untuk mengatasi masalah infeksi dan resistensi tersebut. Salah satu cara mengatasi infeksi yang dilakukan masyarakat adalah dengan menggunakan tanaman. Pemanfaatan tanaman obat atau bahan obat alam pada umumnya sebenarnya bukanlah merupakan hal yang baru. Obat-obat dapat ditemukan dari berbagai sumber bahan alam atau diciptakan secara sintesis dalam laboratorium. Sepanjang sejarah, bahan yang berasal dari tanaman merupakan suatu gudang dari obat-obatan baru yang potensial. Hanya sebagian kecil dari jenis tanaman yang diidentifikasi dan telah diselidiki untuk bahan obat. Sumbangan-sumbangan besar tertentu dalam terapi obat modern yang menakjubkan dapat disebabkan oleh penelitian yang berhasil dari obat-obat tradisional yang berasal dari tumbuh-tumbuhan (Ansel, 1989). Di Indonesia ada lebih dari 30.000 jenis tumbuhan dan lebih dari 1000 jenis tumbuhan obat yang dimanfaatkan dalam industri obat tradisional, di mana ada beberapa simplisia atau bahan alam yang banyak dipakai (lebih dari 10 ton per tahun) oleh industri obat tradisional untuk memproduksi obat tradisional/obat bahan alam (Badan POM, 2005). Obat adalah sediaan atau paduan-paduan yang siap digunakan untuk mempengaruhi atau menyelidiki secara fisiologi atau keadaan patologi dalam rangka penetapan diagnosa, pencegahan, penyembuhan, pemulihan, peningkatan kesehatan dan kontrasepsi (Departemen Kesehatan,1992). Salah satu tanaman yang mempunyai khasiat obat adalah Euphorbia milii (Kaktus pakis giwang). Secara farmakologi Euphorbia milii mengandung beberapa gugus senyawa kimia yang dapat dimanfaatkan sebagai obat. Batang tanaman Euphorbia milii mengandung glikosida sianopora, glikosida antrakuinon, euphorbone, taraxerone, taraxenon, epifriedelanol, sterol, progesterone, karbohidrat, asam sitrat dan asam malat. Daunnya mengandung, peroksidase, saponin, kalsium oksalat, subtasi peptic, dan amilum. Sementara itu getahnya mengandung euphorbol, euphol dan cyeloartenol (Lingga, 2006). Daun banyak gunakan sebagai obat bisul (furuncle) , radang kulit bernanah (piodermi), tersiram air panas, luka bakar (Wikipedia, 2011). Dalam hal ini dilakukan penelitian untuk melihat khasiat Euphorbia milii sebagai penghambat pertumbuhan MRSA. Berdasarkan hal tersebut perlu dilakukan pengujian lebih lanjut mengenai kemampuan ekstrak daun Euphorbia milii atau kaktus pakis giwang untuk menghambat pertumbuhan MRSA. Dalam hal ini akan digunakan sampel Staphylococcus aureus yang resisten terhadap methicillin (MRSA / Methicillinresistant Staphylococcus aureus). 1.2 Rumusan Masalah Berdasarkan latar belakang masalah yang telah dipaparkan , maka penelitian dirumuskan sebagai berikut : 1. Apakah ekstrak daun kaktus pakis giwang (Euphorbia milii) dapat menghambat pertumbuhan MRSA secara in vitro? 2. Apakah ada perbedaan daya hambat antara ekstrak daun kaktus pakis giwang (Euphorbia milii) konsentrasi 25%, 50%, 75%, dan100% terhadap MRSA secara in vitro? 1.3 Tujuan Penelitian 1.3.1 Tujuan umum Penelitian ini bertujuan untuk mengetahui efek ekstrak daun kaktus pakis giwang (Euphorbia milii) dalam menghambat pertumbuhan MRSA secara in vitro. 1.3.2 Tujuan khusus 1. Untuk mengetahui apakah ekstrak daun kaktus pakis giwang (Euphorbia milii) dapat menghambat pertumbahan MRSA secara in vitro. 2. Untuk mengetahui apakah ada perbedaan daya hambat antara ekstrak daun kaktus pakis giwang (Euphorbia milii) konsentrasi 25%, 50%, 75%, dan100% terhadap MRSA secara in vitro. 1.4 Manfaat Penelitian 1.4.1 Manfaat teoritis Sebagai informasi mengenai efek dari ekstrak daun kaktus pakis giwang (Euphorbia milii) untuk menghambat pertumbuhan bakteri khususnya MRSA. 1.4.2 Manfaat praktis Penelitian ini diharapkan dapat bermanfaat bagi ilmuwan terkait sebagai referensi tambahan untuk membuat obat antibakterial alami dari tanaman kaktus pakis giwang, khususnya dalam membasmi bakteri MRSA. Informasi dari penelitian ini juga diharapkan dapat menambah pengetahuan masyarakat tentang pemanfaatan tanaman liar sebagai obat. BAB II KAJIAN PUSTAKA 2.1 Kaktus Pakis Giwang (Euphorbia milii) 2.1.1 Sejarah dan asal-usul Euphorbia milii Euphorbia diperkirakan berasal dari Madagaskar, sebuah kepulauan di Afrika yang beriklim tropis. Penemu tanaman ini dan yang mempopulerkannya menjadi tanaman hias bernama Euphorbus, seorang dokter dari Mauritania, Afrika Utara, yang telah berjasa pada rajanya (Purwanto,2006). Karena untuk menghormati jasanya, tanaman ini di beri nama ilmiah Euphorbia milii. Dari afrika, tanaman ini masuk dan menyebar di daratan asia melalui Cina. Dibandingkan dengan negara-negara di Asia lainnya, Thailand adalah negara yang paling serius mengembangkan tanaman ini. Penyebaran tanaman ini tidak lepas dari jasa pedagang pada zaman kerajaan Sukhothai. Etnis Cina di Thailand meletakkan euphorbia di depan rumah untuk menghalau roh jahat. Mereka menancapkan dupa serta mengikat tali merah di bagian pot. Tanaman tersebut dipercaya membawa keberuntungan, kesuksesan dan kemakmuran. Semakin besar dan banyak bunga, semakin beruntung dan sukses pula pemiliknya (Soedijono dan hartono, 2007). Melalui campur tangan para petani bunga yang terampil muncullah berbagai jenis euphrbia hibrida yang tampil memikat (Kusumayani dan Andoko, 2004). Sebagaimana halnya tanaman lain, euphorbia juga diberi nama latin untuk mempermudah komunikasi. Sistem tata nama berdasarkan Binomial Nomenclature yang dipelopori oleh Carolus Lineaeus pada tahun 1750-an yang terdiri atas dua kata, yaitu genus dan spesies. Sistem klasifikasi euphorbia menurut Lawrence (1959) adalah sebagai berikut : Divisi : Spermatophyta (Menghasilkan biji) Sub Divisi : Angiospermae Kelas : Dicotyledoneae Ordo : Archichlamydeae Famili : Euphorbiaceae Genus : Euphorbia Spesies : Euphorbia milii Euphorbia griffthii, dll Nama Lokal menurut Dalimartha tahun 2003: Kaktus pakis giwang (lndonesia); Tie hai tang (China), Mahkota duri (Jawa tengah) 2.1.2 Morfologi Euphorbia milii Gambar 2.1 Euphorbia milii Secara morfologi, tanaman Euphorbia milii dibagi atas beberapa bagian yaitu akar, batang, daun, bunga, buah dan biji. 1. Akar Akar euphorbia, sebagaimana semua tanaman dikotil, adalah akar tunggang. Akan tetapi, tanaman yang diperbanyak dengan stek memiliki perakaran serabut. Akar tersebut tumbuh langsung dari pangkal batang. Akar yang sehat berwarna putih kecoklatcoklatan, sedangkan akar yang sudah tua berwarna coklat (Purwanto, 2006). 2. Batang Batang euphorbia ada dua macam, yaitu bulat dan bersudut. Batang ini tumbuh tegak menjulang ke atas, tetapi beberapa spesies ada yang melengkung. Sebagaimana tanaman kaktus, euphorbia tidak berkayu. Akan tetapi, dengan semakin bertambahnya umur tanaman batang akan mengeras. Batang ini ditumbuhi duri, ada yang berduri tunggal, ganda, dan duri yang berkelompok (Purwanto, 2006). 3. Daun Bentuk daun euphorbia bervariasi, meskipun tidak terlalu banyak, ada yang berbentuk bulat telur dan lonjong. Masing-masing daun mempunyai ketebalan berbeda-beda. Hampir semua daun tidak bertangkai tetapi duduk pada batang. Tepi daun tidak bergerigi. Ujung daun juga bervariasi, ada yang runcing, tumpul dan ujung terbelah. Susunan daun euphorbia berselang-seling atau saling berhadapan dan duduk pada ruas batang tanaman. (Purwanto, 2006). Pilih tanaman berdaun sehat, besar, tebal, permukaan halus, segar, dan mulus. Tulang daun menonojol, terutama tulang pada bagian tengah keras. Warna bervariasi mulai dari hijau muda hingga tua. Secara umum, daun euphorbia tunggal berbentuk pipih, bergelombang atau melengkung. Munculnya euphorbia impor semakin banyak dengan variasi tanaman yang beragam, termasuk ciri dari daunnya, beberapa variasi bentuk daun sebagai berikut : a) Bentuk daun ada empat macam, yaitu simetri yang ditandai dengan ujung daun lancip, oval dengan ujung daun lancip mengecil, lurus dengan ujung daun agak membulat dan bentuk hati dengan ujung daun terbelah menjadi dua bulatan. b) Pangkal daun ada tiga macam, yaitu pangkal melebar, lanset dan lancip mengecil (Hapsari dan Budiana, 2007). 4. Bunga Bunga euphorbia muncul membentuk dompolan-dompolan, setiap dompol terdiri atas 432 kuntum. Ada empat bagian utama bunga, yaitu mahkota bunga semu, benang sari, putik dan bakal buah. Mahkota bunga yang berwarna-warni yang kita kenal sebagai bunga sebetulnya adalah brachtea (seludang) bunga yang sudah mengalami modifikasi sehingga menyerupai mahkota. Oleh karena itu, sering kali bunga euphorbia disebut bermahkota semu (Purwanto, 2006). Umumnya tanaman ini memiliki bunga sejati yang sempurna dengan organ seksual jantan dan betina yang lengkap. Namun, ada juga yang memilki bunga yang tidak sempurna yang tidak memiliki organ seksual dan bersifat steril, sehingga tidak dapat digunakan untuk perbanyakan generatif. Beberapa kultivar memiliki bunga yang keseluruhannya merupakan bunga yang tidak sempurna. Ada pula tanaman yang sebagian bunganya merupakan bunga sempurna dan beberapa kondisi tumbuh bunga yang tidak sempurna. 5. Buah Tanaman ini termasuk mudah berbuah. Buah muncul karena adanya pembuahan atau bersatunya benang sari dan putik. Penyerbukan dapat terjadi secara alami dengan bantuan serangga atau manusia. Buah muncul setelah 3-6 hari dari penyerbukan (Hapsari dan Budiana, 2007). Buah berbentuk seperti kapsul dan tersusun membentuk dompolan yang terdiri atas 3-4 buah. Buah ini terletak di ujung tangkai bunga. Buah muda berwarna hijau dan apabila sudah tua buah akan berwarna coklat. Buah tua harus segera dipetik, sebelum pecah dengan sendirinya. Pemetikan buah dilakukan pada pagi hari, karena pada siang hari biji yang sudah kering akan terpelanting bila terkena sinar matahari (Purwanto, 2006). 6. Biji Biji euphorbia terdapat di dalam buah. Biji yang berwarna coklat tua ini berbentuk bulat, dengan diameter antara 0,3-0,5 cm. Biji akan terbentuk setelah 3-6 hari sejak penyerbukan dan dapat segera disemaikan setelah dipetik (Purwanto, 2006). Penyakit yang dapat diobati: Pendarahan haid, bisul, radang kulit, luka bakar, kena air panas, hepatistis. 1. Bunga: Funcional uterine bleeding (Pendarahan menstruasi fungsional). 2. Batang: Hepatitis. 3. Daun: Bisul, radang kulit bernanah (Piodermi), tersiram air panas, luka bakar. Cara Pemakaian: 1. Functional Uterine Bleeding: lima belas bunga segar, tambahkan daging, rebus sebagai sup. 2. Bisul dan radang kulit bernanah Daun segar dilumatkan, tambahkan gula merah secukupnya kemudian tempelkan pada tempat yang sakit. 3. Hepatistis 9 – 15 gram batang segar direbus. Minum airnya. Daun, batang dan bunga mengandung saponin dan tannin. Bunganya juga mengandung flavonoid. Terasa pahit, astringen, netral, sedikit beracun (toxic). Untuk memastikan bahwa tanaman yang akan diteliti merupakan tanaman kaktus pakis giwang (Euphorbia milii), perlu dilakukan determinasi dengan cara mencocokkan tanaman dengan kunci determinasi yang terdapat dapam literatur. Adapun kunci determinasi menurut Puspita tahun2009 untuk Euphorbia milii adalah: 1.b. Tumbuh-tumbuhan dengan bunga sejati setidak-tidaknya dengan benangbenang sari dan/atau putik. Tumbuh-tumbuhan berbunga 2 2.b. Tidak terdapat alat pembelit. Tumbuh-tumbuhan dapat juga memanjat atau membelit (dengan batang, sumbu daun, atau tangkai daunnya) 3 3.b. Daun-daunnya tidak berbentuk jarum dan tidak dalam berkas 4 4.b. Bukan bangsa rumput-rumputan. Daun dan bunganya lain 6 6.a. Tidak berdaun atau tidak dengan daun yang nyata (golongan 3) 34 34.b. Cabang-cabang atau bagian batang bersegi atau bulat 37 37.a. Batangnya tebal dan berdaging (succulent). Tumbuhan bergetah (tusuk atau kerat). Batangnya beralur persegi atau bulat. Apabila sesuai dengan kunci tersebut di atas maka dapat dipastikan bahwa tanaman yang diuji adalah Euphorbia milii. 2.2 Staphylococcus aureus Staphylococcus merupakan bakteri gram positif berbentuk bulat biasanya tersusun dalam bentuk menggerombol yang tidak teratur seperti anggur yang memungkinkan dirinya dapat terbagi dalam beberapa bentuk (Brown dkk.,2005). Staphylococcus bertambah dengan cepat pada beberapa tipe media dengan aktif melakukan metabolisme, melakukan fermentasi karbohidrat dan menghasilkan bermacam-macam pigmen dari warna putih hingga kuning gelap. Staphylococcus cepat menjadi resisten terhadap beberapa antimikroba (Jawetz dkk, 2005). Gambar 2.2 Staphylococcus aureus Source: http://en.wikipedia.org Klasifikasi Staphylococcus aureus (Salle, 1961): Kingdom : Protozoa Divisio : Schyzomycetes Class : Schyzomycetes Ordo : Eubacterialos Family : Micrococcaceae Genus : Staphylococcus Species : Staphylococcus aureus Staphylococcus tumbuh dengan baik pada berbagai media bakteriologi di bawah suasana aerobik atau mikroaerofilik. Tumbuh dengan cepat pada temperatur 20 - 35ºC. Koloni pada media padat berbentuk bulat, lambat dan mengkilat (Jawetz dkk, 2005). Staphylococcus aureus dapat menimbulkan infeksi pada setiap jaringan atau alat tubuh manusia dan menyebabkan timbulnya penyakit dengan tanda-tanda yang khas, yaitu peradangan, nekrosis dan pembentukan abses. Staphylococcus aureus dapat menyebabkan penyakit bisul, postula, pemfigus neonatorum, hordeolum, mastitis, pneumonia, karbunkel, infeksi luka dan luka bakar, osteomielitis akut, abses perinefrik, keracunan makanan, dan enteritis (Gibson, 1996). Staphylococcus aureus mempunyai 4 karakteristik khusus, yaitu faktor virulensi yang menyebabkan penyakit berat pada normal hast, faktor differensiasi yang menyebabkan penyakit yang berbeda pada sisi atau tempat berbeda, faktor persisten bakteri pada lingkungan dan manusia yang membawa gejala karier, dan faktor resistensi terhadap berbagai antibiotika yang sebelumnya masih efektif. Staphylococcus aureus menghasilkan katalase yang mengubah hidrogen peroksida menjadi air dan oksigen (Spicer, 2000 ; Jawetz dkk, 2005). Genom staphylococcus terdiri dari kromosom melingkar (± 2800 bp), dengan prophages, plasmid, dan transposons (Holden et al., 2004). Gen-gen yang akan menentukan virulensi dan resistensi terhadap antibiotika ditemukan pada kromosom ini. Lima puluh persen berat dinding sel staphylococcus terdiri dari peptidoglikan. Peptidoglikan ini berisi subunit-subunit polisakarida dari N-acetylglucosamine dan N-acetylmuramic acid. Rantai peptidoglikan ini akan terikat pada N-acetylmuramic acid melalui jembatan pentaglisin spesifik untuk Staphylococcus aureus. Peptidoglikan bekerja seperti endotoksin, yaitu merangsang pelepasan sitokin oleh makrofag, aktivasi komplemen, dan agregasi platelet. Perbedaan struktur peptidoglikan dari strain staphylococcus memberikan kontribusi pada variasi kemampuannya untuk menimbulkan disseminated intravascular coagulation (DIC) (Lowy, 1998). 2.3 Methicillin-resistant Staphylococcus Aureus (MRSA) Lebih dari 80% strain Staphylococcus aureus menghasilkan penicilinase, dan penicillinase-stable betalactam seperti methicillin, cloxacillin, dan fluoxacillin yang telah digunakan sebagai terapi utama dari infeksi Staphylococcus aureus selama lebih dari 35 tahun. Strain yang resisten terhadap kelompok penicillin dan beta-lactam ini muncul tidak lama setelah penggunaan agen ini untuk pengobatan (Duckworth dkk., 1998). Methicillin merupakan penicillinase-resistant semisynthetic penicillin, pertama kali diperkenalkan pada tahun 1959 (Kowalski dkk., 2005). Methicillin digunakan untuk mengatasi infeksi yang disebabkan oleh Staphylococcus aureus resisten terhadap penicillin. Namun, di Inggris pada tahun 1961 telah dilaporkan adanya isolat Staphylococcus aureus yang resisten terhadap methicillin (Brown dkk., 2005). Kemudian infeksi MRSA secara cepat menyebar di seluruh negara-negara Eropa, Jepang, Australia, Amerika Serikat, dan seluruh dunia selama berpuluh-puluh tahun serta menjadi infeksi yang multidrug-resistant (Enright dkk., 2002; Samathkumar, 2007). Antara tahun 1996-1999 dilaporkan bahwa 23 rumah sakit di Kanada terdapat 6% dari seluruh isolat Staphylococcus aureus yang resisten terhadap methicillin, dengan rerata 4,14 kasus MRSA per 1000 pasien yang dirawat dari 35% pasien dengan infeksi. Sebagian besar isolat diperoleh dari MRSA yang berasal dari ruang perawatan akut (72,6%), 7,2% diperoleh dari bangsal perawatan, 4,6% diperoleh dari komunitas masyarakat, dan sisanya (15,6%) tidak diketahui asalnya (BC Center for Disease Control, 2001). Selama tahun 2006 di Laboratorium Patologi Klinik RSUP (Rumah Sakit Umum Pusat) Dr. Sardjito Yogyakarta diperoleh 3729 isolat kuman, yaitu 1128 dari spesimen darah, 825 dari spesimen urin, 957 dari spesimen sputum, dan 819 spesimen pus. Proporsi beberapa jenis kuman Gram positif ternyata cukup signifikan. Spesies yang menonjol adalah Staphylococcus epidermidis, Staphylococcus aureus, dan Staphylococcus viridians (Wijisaksono, 2007). 2.4 Furunkle (Bisul) Furunkle atau Bisul (bahasa Latin: abscessus) adalah sekumpulan nanah (neutrofil mati) yang telah terakumulasi di rongga di jaringan setelah terinfeksi sesuatu (umumnya karena bakteri atau parasit) atau barang asing (seperti luka tembakan/tikaman). Bisul adalah reaksi ketahanan dari jaringan untuk menghindari menyebar nya barang asing di tubuh. Bisul merupakan peradangan yang terjadi pada daerah folikel rambut kulit dan sekitarnya. Penyebab bisul yang paling sering dialami adalah bakteri Staphylococcus aureus, karena itu bisul dapat juga diartikan sebagai infeksi lokal pada kulit dalam. Awalnya hanya folikel rambut yang terinfeksi, tetapi karena adanya gesekan, iritasi, dan kurang bersihnya perawatan tubuh, infeksi tersebut dapat menyebar ke jaringan sekitarnya, dan terjadilah bisul (Wikipedia, 2011). Gambar 2.3 Furuncle Source: http://www.graphicshunt.com Penyebab awalnya dapat juga karena rambut yang tumbuh ke dalam, luka, ataupun dikarenakan masuknya benda asing ke dalam kulit. Bisul biasanya berawal dari benjolan merah dan lunak di daerah kulit, yang lama kelamaan akan menjadi lebih keras. Kemudian di tengah benjolan tersebut akan terbentuk puncak berwarna putih yang akan memecah atau harus dikeluarkan oleh dokter (melalui prosedur bedah minor). Cairan yang keluar ini disebut nanah, berisi sel darah putih (yang dikirim tubuh untuk melawan bakteri yang menginfeksi daerah kulit tersebut ), bakteri dan protein (Common,2011). 2.5 Antibakteri Istilah – istilah yang berhubungan dengan antimikroba adalah bakteriostatik dan bakteriosidal. Bakteriostatik adalah sifat antibakteri yang memiliki kemampuan mengahambat perkembangbiakan bakteri, sedangkan bakterisidal adalah antimikroba yang memiliki sifat mematikan bakteri. Kerja bakterisidal berbeda deari bakteriostatik dalam hal tidak dapat dipulihkan lagi. (Jawet dkk, 2005). Zat aktif yang terkandung dalam berbagai jenis ekstrak tumbuhan diketahui dapat menghambat beberapa mikroorganisme patogen maupun perusak makanan. Zat aktif tersebut dapat berasal dari bagian tumbuhan seperti biji, buah, rimpang, batang, daun, dan umbi. Kemampuan senyawa antimikroba untuk menghambat aktivitas pertumbuhan mikroba dapat dipengaruhi oleh beberapa faktor seperti temperatur, pH (keasaman), ketersediaan oksigen, dan interaksi/sinergi antara beberapa faktor tersebut (Ardiansyah, 2007). Menurut McKane dan Kandel tahun 1996, uji resistensi bakteri oleh zat antimikroba dapat dilakukan dengan beberapa metoda, yaitu: 1. Metoda Difusi Agar Metoda difusi agar ini dicetuskan oleh Kirby-Bauer sehingga dapat pula disebut sebagai metoda Kirby-Bauer yang menjadikan diameter daya hambat yang terbentuk sebagai tolak ukur resisten atau tidaknya suatu mikroorganisme terhadap zat antimikroba. Metoda ini dilakukan pada medium padat yang diinokulasikan mikroorganisme atau patogen ke dalamnya dan meletakkan cakram kertas yang telah mengandung zat antimikroba pada medium tersebut. Diameter zona hambat yang terbentuk di sekitar cakram kertas diukur setelah mikroorganisme diinkubasikan selama 24 jam. Pada medium yang tidak terdapat zona hambat menunjukkan bahwa bekteri tersebut bersifat resisten. 2. Minimum Inhibitory Concentration (MIC) Test Metoda ini merupakan metoda yang akurat untuk mengetahui sensitivitas mikroorganisme terhadap pengaruh zat antimkroba. MIC adalah jumlah bahan antimikroba terkecil yang dapat menghambat pertumbuhan mikroorganisme. Metoda MIC dapat disebut pula Broth Dilution Method. Pada konsentrasi zat antimikroba yang paling efektif dapat diketahui dari tidak adanya pertumbuhan mikroorganisme pada medium setelah diinkubasikan. 3. Metoda Otomatis Metoda otomatis merupakan suatu metoda yang dapat dengan cepat menentukan sensitivitas bakteri terhadap zat antimikroba. Pada metode ini, digunakan alat khusus untuk dapat mengetahui pertumbuhan mikroorganisme yang dilihat dari kekeruhannya pada medium cair. Jika zat antimikroba yang diujikan tidak efektif maka mikroorganisme akan tetap melakukan perbanyakan diri pada medium tersebut. 4. Metoda Antibiogram Pada metode ini dilakukan pemilihan zat antimikroba untuk menghambat suatu mikroorganisme. Berbagai zat antimikroba diujikan pada suatu mikroorganisme, sehingga didapatkan salah satu bahan yang paling efektif dalam menghambat mikroorganisme tersebut. Antibiogram ini dapat meramalkan seberapa besar sensitivitas mikroorganisme terhadap suatu zat antimikroba. Zat antimikroba yang efektif dapat dijadikan sebagai pilihan bahan yang tepat untuk menghambat pertumbuhan mikroorganisme sasaran. 2.6 Ekstraksi Ekstraksi adalah suatu proses pemisahan dari bahan padat maupun cair dengan bantuan pelarut. Pelarut yang digunakan harus dapat mengekstrak substansi yang diinginkan tanpa melarutkan material lainnya (Mahmud, 2010). Tujuan ekstraksi adalah untuk menarik semua komponen kimia yang terdapat dalam simplisia. Ekstraksi ini didasarkan pada perpindahan massa komponen zat padat ke dalam pelarut dimana perpindahan mulai terjadi pada lapisan antar muka, kemudian berdifusi masuk ke dalam pelarut (Dinda,2008). 2.7 Maserasi Maserasi istilah aslinya adalah macerare (bahasal latin, artinya merendam), merupakan sediaan cair yang dibuat dengan cara direndam menggunakan pelarut bukan air (non polar) atau setengah air, misalnya etanol encer, selama periode waktu tertentu sesuai dengan aturan dalam buku resmi kefarmasian (Departemen Kesehatan RI, 1995). Teorinya, ketika simplisia yang akan di maserasi direndam dalam pelarut yang dipilih, maka ketika direndam, cairan penyari akan menembus dinding sel dan masuk ke dalam sel yang penuh dengan zat aktif dan karena ada pertemuan antara zat aktif dan penyari itu terjadi proses pelarutan (zat aktifnya larut dalam penyari) sehingga penyari yang masuk ke dalam sel tersebut akhirnya akan mengandung zat aktif, katakan 100%, sementara penyari yang berada di luar sel belum terisi zat aktif (nol%) akibat adanya perbedaan konsentrasi zat aktif di dalam dan di luar sel ini akan muncul gaya difusi, larutan yang terpekat akan didesak menuju keluar berusaha mencapai keseimbangan konsentrasi antara zat aktif di dalam dan di luar sel. Proses keseimbangan ini akan berhenti, setelah terjadi keseimbangan konsentrasi. Dalam kondisi ini, proses ekstraksi dinyatakan selesai, maka zat aktif di dalam dan di luar sel akan memiliki konsentrasi yang sama, yaitu masing-masing 50% (Mahmud, 2010). BAB III KERANGKA PIKIR, KONSEP DAN HIPOTESIS 3.1 Kerangka Pikir Penyakit infeksi merupakan masalah kesehatan utama baik di masyarakat maupun di rumah sakit. Selain itu penyakit infeksi merupakan penyebab kesakitan dan kematian di negara berkembang. Pemilihan antibiotika sebagai terapi infeksi memiliki peran penting dalam mencapai kesembuhan kepada pasien. Selain itu, timbul permasalahan lain yaitu terdapat penyakit infeksi dengan bakteri penyebab yang telah resisten terhadap berbagai antibiotika. Hilangnya efektifitas antibiotika ini sudah dilaporkan semenjak ditemukannya penicillin pada tahun 1940, dimulai dengan Staphylococcus aureus. Sekarang, masalah ini menjadi perhatian kembali karena mulai meningkatknya resistensi bakteri terhadap berbagai macam antibiotika. Salah satu masalah yang muncul akhir-akhir ini adalah MRSA (Methicillin resistant Staphylococcus aureus). MRSA adalah strain bakteri Staphylococcus aureus yang resisten terhadap methicillin dan antibiotika golongan beta laktam lainnya seperti penicillin dimana antibiotika golongan ini merupakan antibiotika yang sering digunakan. Staphylococcus aureus maupun MRSA pada umumnya menyerang kulit, dan masyarakat umum mengenalnya dengan nama bisul (Furunkle). Furunkle (bisul) merupakan peradangan yang terjadi pada daerah folikel rambut kulit dan sekitarnya. Penyebab bisul yang paling sering dialami adalah bakteri Staphylococcus aureus, karena itu bisul dapat juga diartikan sebagai infeksi lokal pada kulit dalam. Awalnya hanya folikel rambut yang terinfeksi, tetapi karena adanya gesekan, iritasi, dan kurang bersihnya perawatan tubuh, infeksi tersebut dapat menyebar ke jaringan sekitarnya, dan terjadilah bisul. Masyarakat Indonesia telah memiliki cara pengobatan tradisional untuk penyakit bisul sejak jaman dulu, seperti menggunakan cocor bebek, lobak, lidah buaya, daun kamboja, kaktus pakis giwang, dan lain – lain. Untuk memastikan pengaruh pemakaian tanaman khususnya kaktus pakis giwang (Euphorbia milii), dilakukan penelitian secara in vitro. 3.2 Kerangka Konsep MRSA merupakan penyebab utama infeksi di rumah sakit dan telah meluas dengan cepat di banyak bagian dunia. Makin lama makin sulit untuk melawan MRSA dan cara terbaik untuk mencegah penularannya masih banyak diperdebatkan. Di samping menjadi masalah di rumah sakit di dunia, MRSA juga makin banyak ditemukan kembali dari pasien di fasilitas perawatan jangka panjang seperti wisma para usia lanjut, dan bahkan dari orang-orang di masyarakat atau di tempat-tempat olahraga (EPIC, 2006). Ekstrak etanol daun kaktus pakis giwang merupakan salah satu bahan yang diyakini berpotensi sebagai salah satu obat untuk mengatasi infeksi yang disebabkan oleh bakteri Staphylococcus aureus termasuk MRSA karena mengandung berbagai macam alkaloid seperti saponin (Herawati,2004). Oleh karena itu perlu dilakukan pengujian secara in vitro untuk mengetahui efek ekstrak daun kaktus pakis giwang dalam berbagai konsentrasi (25%, 50%, 75%, 100%) terhadap pertumbuhan bakteri MRSA. 3.3 Konsep Penelitian Ekstrak Daun Kaktus Pakis Giwang (Euphorbia Milii) 25%, 50%, 75%, 100% Faktor Internal : Faktor Eksternal : - Waktu pengeraman MRSA - Media pengeraman MRSA - Suhu pengeraman MRSA - Cara penghitungan koloni MRSA - Sterilisasi alat dan bahan Pertumbuhan MRSA terhambat (Terdapat zona hambat) Gambar 3.1 Kerangka Konsep 3.3 Hipotesis 1. Ekstrak daun kaktus pakis giwang (Euphorbia milii) mempunyai efek menghambat pertumbuhan MRSA secara in vitro. 2. Ada perbedaan daya hambat antara ekstrak daun kaktus pakis giwang (Euphorbia milii) konsentrasi 25%, 50%, 75% dan 100% terhadap pertumbuhan MRSA secara in vitro. BAB IV METODE PENELITIAN 4.1.Rancangan Penelitian Rancangan penelitian ini bersifat eksperimental murni (true experiment), memakai kelompok kontrol dengan menggunakan rancangan post test only control group design (Marczyk dkk,2005). Bagan rancangan penelitian sebagai berikut: K P1 S RA P2 P3 P4 O0 O1 O2 O3 O4 Gambar 4.1 Rancangan Penelitian Keterangan : S = Sampel penelitian, MRSA diambil dari satu serotype RA = Random alokasi untuk meletakkan difusi disk (perlakuan) pada plate K = Kontrol negatif dengan etanol 70% P1 = Perlakuan dengan ekstrak kaktus pakis giwang 25% P2 = Perlakuan dengan ekstrak kaktus pakis giwang 50% P3 = Perlakuan dengan ekstrak kaktus pakis giwang 75% P4 = Perlakuan dengan ekstrak kaktus pakis giwang 100% O0 = Nilai observasi pada kelompok K O1 = Nilai observasi pada kelompok P1 26 O2 = Nilai observasi pada kelompok P2 O3 = Nilai observasi pada kelompok P3 O4 = Nilai observasi pada kelompok P4 4.2 Tempat dan Waktu Penelitian Tempat penelitian dilakukan di Laboratorium Mikrobiologi Universitas Udayana Denpasar. Waktu penelitian akan dimulai dari bulan Desember 2011 – Januari 2012. 4.3 Sumber Data Populasi dan Sampel 4.3.1. Populasi Dalam uji aktivitas antibakteri dengan metode difusi agar digunakan inokulum bakteri Methicillin-resistant Staphylococcus aureus (MRSA) yang diambil dari sampel di Rumah Sakit Umum Pusat Sanglah. Penentuan besar sampel ditetapkan sesuai dengan penetapan baku uji bakteri yaitu menggunakan 108CFU/ml bakteri. 4.3.2. Sampel Populasi dalam penelitian ini adalah daun kaktus pakis giwang segar yang didapat di seputaran Kota Denpasar. Daun kemudian dikeringkan dan dibuat serbuk. Serbuk tersebut dimaserasi dengan etanol 70% selama 48 jam dan dilanjutkan dengan tahap destilasi menggunakan rotary evaporator. Selanjutnya dibuat konsentrasi ekstrak 25%, 50%, 75% dan 100% untuk pengujian. Untuk mendapatkan data yang valid dilakukan pengulangan sesuai dengan rumus Federer (1977): (n-1)(t-1) ≥ 15 .......................................................................................... (1) n = banyaknya pengulangan t = perlakuan, dalam hal ini ada 5 perlakuan (K, P1, P2, P3, P4) (n-1) (5-1) = 15 (n-1) (4) = 15 n-1 = 15/4 n-1 = 3,75 ≈ 4 Jadi banyaknya pengulangan yang dilakukan pada penelitian ini adalah sebanyak 4 kali. Sehingga jumlah sampel keseluruhan adalah 20 sampel. 4.4 Variabel Penelitian Dalam penelitian menggunakan 3 variabel yaitu : 1. Variabel Bebas: Daun kaktus pakis giwang yang dibuat dari simplisia daun yang dimaserasi, kemudian dibuat berbagai konsentrasi (25%,50%, 75%, 100%) dengan pelarut etanol 70%. 2. Variabel Tergantung : Terjadinya area terang sekitar cakram dengan menggunakan jangka sorong, yang menunjukkan adanya hambatan bakteri sebelum dan sesudah perlakuan. 3. Variabel Kendali : a. Suhu pada saat pengeraman MRSA dengan satuan derajat celcius (oC). b. Waktu pengeraman MRSA dengan satuan Jam c. Media pengeraman MRSA d. Jumlah koloni MRSA 4.5 Definisi Operasional 1. Methicillin-resistant Staphylococcus aureus (MRSA) adalah Staphylococcus aureus yang resisten terhadap antibiotika β-laktam, termasuk penicillinaseresistant penicillins (methicillin, oxacillin, nafcillin) dan cephalosporin. 2. Jumlah koloni MRSA adalah jumlah MRSA yang sesuai dengan 108CFU/ml diperoleh dari membuat kekeruhan bakteri setara dengan 0,5 McFarland. 3. Ekstrak kasar etanol adalah ekstrak daun kaktus pakis giwang yang diperoleh dari hasil maserasi dan destilasi simplisia daun Euphorbia milii dengan menggunakan pelarut etanol 70%. 4. Daya hambat adalah kemampuan ekstrak daun kaktus pakis giwang konsentrasi 25%, 50%, 75% dan 100% dalam menghambat pertumbuhan bakteri MRSA yang dilihat dari diameter zona hambatnya. 5. Diameter zona hambat adalah nilai rata-rata diameter zona bening yang terbentuk pada medium Nutrient Agar, diukur dengan menggunakan jangka sorong dengan satuan millimeter (mm). 6. Suhu adalah satuan besaran yang menyatakan derajat panas yang diperlukan untuk pertumbuhan optimal MRSA yang diukur menggunakan thermometer dengan skala derajat celcius. 7. Waktu adalah besaran yang menunjukkan lamanya peristiwa mulai dari masuknya media pertumbuhan MRSA ke incubator selama proses inkubasi sampai dikeluarkannya media dengan satua jam. 8. Media pengeraman adalah tempat untuk menumbuhkan bakteri MRSA aureus yaitu media Nutrien Broth. 9. Jumlah koloni adalah jumlah kelompok bakteri sejenis yang diamati dan dihitung pada media pertumbuhan. 4.6 Alat dan Bahan Peralatan yang digunakan dalam penelitian adalah alat – alat untuk keperluan sterilisasi, ekstraksi bahan, pengukuran bakteri uji dan pengujian aktivitas zat antibakteri seperti yang tercantum pada tabel di bawah ini. Tabel 4.1 Daftar Alat Penelitian No 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 Nama Alat Beker glas Gelas ukur Waterbath shaker incubator Pinset Lemari inkubator Autoklaf Penggaris Tabung reaksi Labu erlenmeyer Spidol permanen Pipet Cawan petri Blender Micropipet Timbangan analitik Box transfer Kawat ose Api spiritus Vortex mixer Hot plate Digital camera Colony counter Rotary evaporator Gunting Gelas arloji Lemari es pH meter Spesifikasi 100 ml 10ml, 50ml, 250ml Milimeter 13 x 150 mm 50, 250, 500, dan 1000ml Diameter 9 cm Sony Jumlah 2 buah 1 buah 1 buah 4 buah 1 buah 1 buah 1 buah 26 buah 4 buah 1 buah 3 buah 30 buah 1 buah 1 buah 1 buah 1 buah 1 buah 1 buah 1 buah 1 buah 1 buah 1 buah 1 buah 1 buah 2 buah 1 buah 1 buah Adapun bahan – bahan yang digunakan dalam penelitian adalah seperti yang tercantum pada tabel di bawah ini. Tabel4.2 Daftar Bahan Penelitian No 1 Nama Bahan Medium Blood Agar (Base) Jumlah 40g/1 liter No Nama Bahan Jumlah 2 Medium Mueller Hinton Agar 34g/1 liter 3 Biakan MRSA 1 tabung 4 Daun kaktus pakis giwang (Euphorbia milii) 100 gram 5 Etanol 70% 2 liter 6 Aquadest 5 liter 7 Kertas saring Whatman No.1 8 Cakram kertas 9 Kapas 1 bungkus 10 Benang kasur 1 gulung 11 Korek api 12 Plastik tahan panas 13 Kertas label 1 pak 14 NaCl 0,85% 1 liter 15 Aluminium foil 1 gulung 20 Kain kassa 1 bungkus 4 lembar Secukupnya 1 buah 1 bungkus 4.7 Alur Penelitian Alur penelitian dapat dilihat seperti pada gambar di bawah ini. MRSA Blood Agar (Base) Pembuatan kekeruhan sebanding 108CFU/ml 1. Uji Pengecatan Gram 2. Uji Katalase 3. Uji Koagulase 4. Uji bacitracin 5. Uji Cefoxitin Mueller Hinton Random difusi disk Etanol Ekstrak Ekstrak Ekstrak Ekstrak 95% Euphorbia milii Euphorbia milii Euphorbia milii Euphorbia milii Diameter zona hambat MRSA Tabulasi data Analisis data Gambar 4.2 Alur Penelitian 4.8 Prosedur Penelitian Langkah penelitian ini dibagi menjadi tiga tahap, yaitu tahap persiapan, tahap pengujian, dan tahap pengolahan data. 4.8.1 Tahap persiapan a. Sterilisasi Alat dan Bahan Dilakukan pengumpulan alat-alat yang akan digunakan kemudian dilakukan pembuatan media NA (Nutrient Agar) dan NB (Nutrient Broth). Setelah itu, semua alat dan bahan tersebut disterilisasi di dalam autoklaf selama 15 menit dengan mengatur tekanan sebesar 1,5 kg/cm2 (1 atm) dan suhu sebesar 121oC yang sebelumnya telah dibungkus dengan plastik tahan panas. Alat-alat yang tidak tahan panas disterilisasi dengan cara disemprotkan etanol 95%. b. Ekstraksi Daun Kaktus Pakis Giwang (Euphorbia milii) Daun kaktus pakis giwang (Euphorbia milii) dicuci dengan air bersih lalu dikeringanginkan (tidak terkena sinar matahari langsung) selama satu minggu sampai daun kering. Daun yang telah kering dihaluskan hingga berbentuk serbuk dengan menggunakan blender dan dikumpulkan hingga sebanyak 20 gram. Serbuk daun tersebut dicampurkan dengan pelarut etanol 70% sebanyak 250 ml dan disimpan pada labu erlenmeyer. Labu tersebut ditutup dan dikocok setiap 30 menit sekali selama 6 jam lalu larutan tersebut dibiarkan (dimaserasi) selama 48 jam. Setelah itu, larutan disaring dengan menggunakan kertas saring Whatman No.1. Kemudian, hasil saringan tersebut diuapkan pelarutnya dengan menggunakan rotary evaporator hingga didapatkan ekstrak kasar etanol. Serbuk daun yang masih terlihat hijau setelah penyaringan dilarutkan kembali dengan etanol 70% sebanyak 200 ml dan dimaserasi kembali selama 48 jam. Larutan tersebut disaring dengan kertas saring whatman dan diekstraksi pula dengan rotary evaporator. Ekstrak yang diperoleh kemudian dikumpulkan dan dihitung berat totalnya. Ekstrak diasumsikan telah berkonsentrasi 100% dan siap diencerkan menjadi berbagai konsentrasi dengan menggunakan pelarut etanol 70%. Selanjutnya, ekstrak disimpan dalam botol gelap atau botol bening yang ditutup alumunium foil pada suhu 5oC untuk mencegah terjadinya perubahan kimiawi (Ogbulie dkk, 2007). c. Pembuatan konsentrasi ekstrak daun kaktus pakis giwang Ekstrak kental daun kaktus pakis giwang dibuat konsentrasi 25%, 50%, 75% dan 100% dengan menggunakan etanol 70%. Untuk membuat konsentrasi suatu larutan dengan jumlah gram zat dalam 100ml etanol. 1. Konsentrasi 25% = 25gram ekstrak daun kaktus pakis giwang dalam labu ukur 100ml ditambahkan etanol 70% sampai batas tanda. 2. Konsentrasi 50% = 50gram ekstrak daun kaktus pakis giwang dalam labu ukur 100ml ditambahkan etanol 70% sampai batas tanda. 3. Konsentrasi 75% = 75gram ekstrak daun kaktus pakis giwang dalam labu ukur 100ml ditambahkan etanol 70% sampai batas tanda. 4. Konsentrasi 100% = 100gram ekstrak daun kaktus pakis giwang dalam labu ukur 100ml ditambahkan etanol 70% sampai batas tanda. 4.8.2 Tahap pengujian A. Pembuatan Blood Agar 1. Menimbang Blood Agar (base) 4g, kemudian dilarutkan dalam 100ml aquadest dengan pemanasan, kemudian dimasukkan ke dalam autoclave pada 121atm selama 15 menit. 2. Ditaruh di Waterbath hingga suhu ± 50oC, kemudian ditambahkan 5% darah kambing dan diaduk hingga homogen. 3. Dituangkan ke dalam cawan peteri dengan diameter 10cm 4. Diinkubasi pada suhu 37oC selama 24 jam untuk mengetahui sterilitas media. 5. Apabila menunjukkan media dalam keadaan steril, bisa langsung digunakan sebagai media penanaman MRSA. 6. Media yang telah ditanami MRSA diinkubasi pada suhu 37oC selama 24 Jam B. Pengujian Koloni Tahap pengujian dapat dilihat pada bagan berikut. Pengecatan gram Positif cocci Uji Katalase + - + Uji Koagulase Uji bacitrasin Streptococcaceae - + Staphylococcus auresus Uji Cefoxitin - + Non MRSA MRSA Gambar 4.3 Alur Pengujian Koloni (Connie dkk, 2011) Koloni yang tumbuh dan dicurigai sebagai staphylococcus dipastikan dengan melakukan pewarnaan Gram untuk mengetahui sifat Gram dan morfologi secara mikroskopis dan uji katalase untuk membedakannya dengan streptococcus. Koloni staphylococcus yang didapatkan kemudian diidentifikasi dengan uji koagulasi (Tirnata,2008). Untuk memastikan lagi bahwa koloni yang tumbuh adalah Staphylococcus aureus, dilanjutkan dengan uji bacitrasin (Connie dkk, 2011). Kemudian dilakukan uji lanjutan untuk memastikan bakteri tersebut MRSA dengan uji menggunakan cefoxitin. Hasil menunjukkan MRSA ditunjukkan dengan tidak adanya zona hambat di sekitar cakram cefoxitin. B.1 Pengecatan Gram a. Buat preparat ulas (smear) yang telah difiksasi dari MRSA b. Teteskan Kristal violet sebagai pewarna utama, tunggu lebih kurang satu menit c. Cuci dengan aquades mengalir d. Teteskan lugol , kemudian tunggu selama 1 menit e. Cuci dengan aquades mengalir f. Teteskan alkohol 96% sebagai larutan pemucat, diamkan 30detik, kemudian cuci dengan aquades mengalir g. Teteskan safranin, tunggu selama 1 sampai 2menit, kemudian cuci dengan aquades mengalir h. Keringkan preparat kemudian diamati secara mikroskopis berbentuk coccus atau bulat, susunan seperti anggur dan bersifat gram positif (ungu). Hal ini untuk meyakinkan bakteri tumbuh adalah Staphylococcus aureus B.2. Uji Katalase Uji katalase digunakan untuk mengetahui aktivitas katalase pada bakteri yang diuji. Kebanyakan bakteri memproduksi enzim katalase yang dapat memecah H2O2 menjadi H2O dan O2. Enzim katalasi diduga penting untuk untuk pertumbuhan aerobic karena H2O2 yang dibentuk dengan pertolongan berbagai enzim pernafasan bersifat racun terhadap sel mikroba. Uji dilakukan dengan langkah – langkah: a. Mengambil kultur sampel dengan ose secara aseptis dari agar miring b. Biakan digoreskan pada petri disk agar sel rata dan tidak bertumpuk c. Kultur mikroba ditetesi 1-2 tetes H2O2 3% , agar aktivitas katalase pada mikroba dapat diketahui d. Petri disk ditutup kembali agar tidak ada kontaminasi dan memaksimalkan mikroba untuk merombak H2O2 e. Amati ada tidaknya gelembung – gelembung kecil. Jika terdapat gelembung maka dalam petri disk tersebut merupakan bakteri katalase positif, sebaliknya jika tidak ada gelembung termasuk bakteri katalase negatif. Staphylococcus aureus termasuk bakteri katalase positif B.3. Uji Koagulase Uji koagulasi dilakukan dengan menanam koloni ke dalam tabung yang telah berisi plasma darah kelinci, campur hingga rata dan inkubasikan selama 4 hingga 24 jam. Hasil koagulase positif Staphylococcus aureus ditunjukkan dengan terbentuknya gumpalan, sedangkan disebut staphylococcus koagulase negatif (CNS) bila setelah 24 jam tidak terjadi penggumpalan (Koneman et al., 1992; Fox, 2000; Cappucino and Sherman, 2005). B.4. Uji Bacitracin Uji bacitracin dilakukan dengan cara menanam bakteri pada media agar darah, kemudian pada media tersebut tempatkan bacitracin disk. Biakkan pada incubator pada suhu 36-37oC selama 24 jam. Amati zona hambat di sekitar bacitracin disk. Bakteri Staphylococcus resisten atau tidak menunjukkan zona hambat pada uji bacitracin (Baker dkk, 1986). B.5. Uji Cefoxitine a. Sediakan media perbenihan Agar Mueller Hinton b. Buat suspensi bakteri yang akan diuji dalam akuades steril dengan tingkat kekeruhan yang sesuai dengan standar McFarland 0,5, setara dengan jumlah bakteri 108 CFU (Colony Forming Unit) pada tiap satu milimeter suspensi bakteri c. Tanamkan suspensi bakteri tersebut pada media perbenihan yang disediakan dengan mengapuskannya menggunakan kapas lidi steril. d. Biarkan seluruh biakan mengering selama lima menit e. Letakkan cakram Cefoxitine 30μg pada permukaan media f. Tekan dengan perlahan cakram metilsilin tersebut dengan menggunakan kapas lidi steril untuk memastikan cakram melekat pada permukaan agar. Jangan menekan cakram sampai terbenam ke dalam agar. g. Inkubasikan pada suhu 37˚C selama 24 jam h. Amati zona hambat di sekitar cakram. Dinyatakan resisten bila diameter zona hambat ≤ 14 mm, intermediet bila zona hambat 1517 mm, dan sensitif bila zona hambat ≥ 18 mm. C. Pembuatan kekeruhan MRSA sebanding dengan 108CFU/ml 1. Membuat larutan NaCl 0,9% 2. Masukkan koloni MRSA yang telah dijuji biokimia tadi ke dalam tabung yang berisi NaCl 0,9% 3. Setarakan kekeruhan larutan NaCl 0,9% + MRSA dengan 0,5McFarland Gambar 4.4 Uji kekeruhan MRSA dibandingkan dengan 0,5 McFarland D. Pembuatan Media Mueller Hinton 1. Menimbang Mueller Hinton agar 3,4g, kemudian larutkan dalam 100ml aquadest dengan pemanasan dan diaduk secara konstan dan disterilkan dalam autoclave pada 121atm selama 15 menit. 2. Didinginkan dengan cara ditaruh di waterbath hingga suhu + 50oC, 3. Dituangkan ke dalam cawan petri dengan diameter 10cm 4. Diinkubasi pada suhu 37oC selama 24 jam untuk mengetahui sterilitas media 5. Apabila menunjukkan media dalam keadaan steril, bisa langsung digunakan sebagai media uji terhadap MRSA 6. Media yang telah ditanami MRSA diinkubasi pada suhu 37oC selama 24 jam Gambar 4.5 Menimbang Agar Mueller Hinton Gambar 4.6 Pemanasan dan pelarutan agar dalam 100ml aquadest Gambar 4.7 Proses sterilisasi dalam autoclave Gambar 4.8 Penuangan larutan agar dalam cawan petri Gambar 4.9 Proses inkubasi pada suhu 37oC selama 24 jam E. Pengujian Ekstrak Daun Kaktus Pakis Giwang terhadap MRSA 1. Dengan menggunakan lidi kapas steril, MRSA dioleskan merata pada media agar Mueller Hinton pada petri. Buat media Mueller Hinton sebanyak 4 buah. 2. Rendam paper disk pada aquadest, ekstrak daun kaktus pakis giwang dengan konsentrasi 25%, 50%, 75% dan 100%. Buat masing – masing sebanyak 4 paper disk. 3. Tanam masing – masing paper disk tersebut ke dalam petri yang telah ditanami MRSA 4. Media uji tersebut kemudian dieramkan dalam incubator selama 24 jam pada suhu 37oC. 4.8.3 Penilaian kemampuan ekstrak daun kaktus pakis giwang (Euphorbia milii) terhadap pertumbuhan kultur MRSA Untuk menilai kemampuan hambat ekstrak daun kaktus pakis giwang (Euphorbia milii) terhadap pertumbuhan MRSA dilakukan dengan cara mengukur zona bening yang terlihat disekitar difusi disk (Wasitaninggrum, 2009). 4.9 Tahap Pengolahan Data Untuk menganalisis data hasil penelitian ini dipakai: 4.9.1 Analisis deskriptif Analisis data ini digunakan untuk memberikan gambaran tentang mean dan standar deviasi yang didapatkan dari hasil penelitian. 4.9.2 Uji normalitas dan homogenitas a. Uji Normalitas Distribusi data diameter zona hambat dari masing – masing kelompok percobaan diuji dengan Shapiro Wilks dengan tingkat kemaknaan 5%. Hipotesis yang diuji adalah: Ho : Sampel berasal dari populasi berdistribusi normal (p>0,05) Ha : Sampel berasal dari populasi berdistribusi tidak normal (p<0,05) b. Uji Homogenitas Varian data diameter zona hambat antar kelompok percobaan diuji homogenitasnya dengan tingkat kemaknaan α=5%. Dengan hipotesis statistik: Ho : variansi tiap kelompok sama/homogen (p>0,05) Ha : variansi tiap kelompok tidak homogen (p<0,05) 4.9.3 Uji efek perlakuan a. Perbedaan rerata diameter zona hambat antar kelompok perlakuan diuji dengan uji non parametrik yaitu uji Kruskal-Wallis dengan tingkat kemaknaan α=5% dengan hipotesis statistik: Ho : Sampel berasal dari populasi yang sama (p>0,05) Ha : Sampel berasal dari populasi yang berbeda (p<0,05) b. Dilanjutkan dengan analisis perbedaan antar perlakuan dengan metode uji non parametrik Mann Whitney, pada tingkat kemaknaan α=5% dengan hipotesis statistik sebagai berikut: 1) Untuk K-P1 : Ho : tidak ada perbedaan antara kontrol dengan konsentrasi 25% H1 : ada perbedaan antara kontrol dengan konsentrasi 25% 2) Untuk K-P2 : Ho : tidak ada perbedaan antara kontrol dengan konsentrasi 50% H1 : ada perbedaan antara kontrol dengan konsentrasi 50% 3) Untuk K-P3 : Ho : tidak ada perbedaan antara kontrol dengan konsentrasi 75% H1 : ada perbedaan antara kontrol dengan konsentrasi 75% 4) Untuk K-P4 : Ho : tidak ada perbedaan antara kontrol dengan kons.100% H1 : ada perbedaan antara kontrol dengan kons.i 100% 5) Untuk Pl-P2 : Ho : tidak ada perbedaan antara kons. 25% dengan kons.50% H1 : ada perbedaan antara kons. 25% dengan kons.50% 6) Untuk Pl-P3 : Ho : tidak ada perbedaan antara kons. 25% dengan kons.75% H1 : ada perbedaan antara kons. 25% dengan kons.75% 7) Untuk Pl-P4 : Ho : tidak ada perbedaan antara kons. 25% dengan kons.100% H1 : ada perbedaan antara kons. 25% dengan kons.100% 8) Untuk P2-P3 : Ho : tidak ada perbedaan antara kons. 50% dengan kons.75% H1 : ada perbedaan antara kons. 50% dengan kons.75% 9) Untuk P2-P4 : Ho : tidak ada perbedaan antara kons. 50% dengan kons.100% H1 : ada perbedaan antara kons. 50% dengan kons.100% 10) Untuk P3-P4 : Ho : tidak ada perbedaan antara kons. 75% dengan kons.100% H1 : ada perbedaan antara kons. 75% dengan kons.100% 4.9.4 Analisis kualitatif Dalam analisis kualitatif ini dilakukan dengan cara mengelompokkan zona hambat ke dalam empat kelompok yaitu sangat kuat, kuat, sedang dan lemah. Analisis hubungan antara konsentrasi ekstrak daun kaktus pakis giwang (Euphorbia milii) dengan kualitas daya hambat menggunakan tabulasi silang dengan tingkat signifikan hubungan diuji dengan uji Chi Square. BAB V HASIL PENELITIAN Dalam penelitian ini digunakan sebanyak empat plate dengan inkubasi koloni Methicillin-resisten Staphylococcus aureus (MRSA) sesuai dengan 108CFU/ml dibuat kekeruhan yang setera dengan 0,5 Mac Farland. MRSA pada masing – masing plate terbagi menjadi 5 (lima) kelompok, yaitu kelompok K (kontrol), P1 (Ethanol 70%), P2 (Ekstrak Euphorbia milii 25%), P3 (Ekstrak Euphorbia milii 50%), P4 (Ekstrak Euphorbia milii 75%), P5 (Ekstrak Euphorbia milii 100%). Pembahasan hasil penelitian ini meliputi uji normalitas, homogenitas data, dan uji efek perlakuan. 5.1 Hasil Penelitian Hasil uji ekstrak ethanol 70% daun kaktus pakis giwang (Euphorbia milii) terhadap Methicillin-resistant Staphylococcus aureus (MRSA) ditunjukkan pada gambar 5.1. Ekstrak 50% Ekstrak 100% Ekstrak 75% Ekstrak 25% Kontrol Negatif (Ethanol 70%) Gambar 5.1 Hasil pengukuran zona hambat Dalam penelitian ini zona hambat yang diukur dengan jangka sorong diperlihatkan pada tabel 5.1 48 Tabel 5.1 Zona Hambat MRSA Diameter zona hambat (mm) Konsentrasi Ekstrak (dalam ethanol 70%) 0% 25% 50% 75% 100% 0 14 18 20 22 0 15 19 20 23 0 14 18 20 22 0 14 17 20 21 5.2 Uji Deskriptif Data yang diperoleh dicari rerata dan simpangan baku dengan uji deskriptif diperoleh hasil seperti pada tabel 5.2. Tabel 5.2 Rerata dan Simpangan Baku Konsentrasi n Rerata Simpangan Baku 0% 4 0,0000 0,0000 25% 4 14,2500 0,5000 50% 4 18,0000 0,8165 75% 4 20,0000 0,0000 100% 4 22,0000 0,8165 Tabel 5.2 menunjukkan rerata diameter zona hambat MRSA kelompok kontrol 0,0000+0,0000; kelompok ekstrak Euphorbia milii 25% 14,2500+0,5000; kelompok ekstrak Euphorbia milii 50% 18,0000+0,8165; kelompok ekstrak Euphorbia milii 75% 20,0000+0,0000 dan kelompok ekstrak Euphorbia milii 100% 22,0000+0,8165. 5.3 Uji Normalitas dan Homogenitas Data Data diameter zona hambat MRSA sesudah perlakuan pada masing – masing kelompok diuji normalitasnya dengan menggunakan uji Shapiro-Wilk, dengan nilai α=0,05. Hasilnya menunjukkan data berdistribusi normal (p>0,05) untuk ekstrak dengan konsentrasi 50% dan 100%, sedangkan untuk ekstrak dengan konsentrasi 25% menunjukkan data berdistribusi tidak normal (p<0,005) dan homogen yang ditampilkan pada Tabel 5.3.Untuk kelompok kontrol dan kelompok konsentrasi 75% diabaikan karena diameter zona hambat MRSA hasil penelitian konstan. Tabel 5.3 Hasil Uji Normalitas Data Masing – masing Kelompok Kelompok Perlakuan n p Ekstrak Euphorbia milli 25% 4 0,001 Ekstrak Euphorbia milli 50% 4 0,683 Ekstrak Euphorbia milli 100% 4 0,683 Dari hasil uji normalitas data tersebut, dilanjutkan dengan uji efek perlakuan untuk mengetahui perbedaan rerata diameter zona hambat antar kelompok perlakuan. Karena data berdistribusi tidak normal maka uji perlakuan yang dipakai adalah uji Kruskal-Wallis. Sedangkan untuk uji homogenitas berdasarkan rerata (based on mean) didapatkan p=0,919>0,05. Ini berarti data penelitian homogen. 5.4 Analisis Efek Perlakuan Analisis efek perlakuan diuji berdasarkan rerata diameter zona hambat MRSA antar kelompok sesudah diberikan perlakuandengan nilai α=0,05. Nilai p yang didapat dari uji Kruskal-Wallis adalah 0,001 < 0,005, oleh karena itu hipotesis Ho ditolak, bahwa terdapat perbedaan dari kelompok perlakuan. Untuk mengetahui sampel mana yang berbeda dilanjutkan dengan uji Mann Whitney. Dari hasil uji Mann Whitney didapatkan data sesuai dengan tabel 5.4. Tabel 5.4 Perbedaan Antara Dua Kelompok Perlakuan Konsentrasi (%) n 0 25 4 Rerata Diameter Zona Hambat 2,50 6,50 P 0,011 0 50 0 75 0 100 25 50 25 75 25 100 50 75 50 100 75 100 4 4 4 4 4 4 4 4 4 2,50 6,50 2,50 6,50 2,50 6,50 2,50 6,50 2,50 6,50 2,50 6,50 2,50 6,50 2,50 6,50 2,50 6,50 0,013 0,008 0,013 0,017 0,011 0,017 0,013 0,019 0,013 Dari tabel 5.4 di atas dapat dilihat ekstrak dengan konsentrasi yang lebih tinggi mempunyai nilai mean lebih besar dibandingkan ekstrak dengan konsentrasi lebih rendah (6,50 > 2,50). Nilai p untuk semua perbandingan konsentrasi lebih kecil dari 0,05. Jadi hipotesis Ho ditolak, perbedaan konsentrasi mempengaruhi diameter zona hambat MRSA. Pada gambar grafik di bawah ini terlihat pemberian ekstrak daun Euphorbia milii mempengaruhi diameter zona hambat MRSA. Semakin besar konsentrasi yang diberikan, semakin besar zona hambat yang terjadi. Gambar 5.2 Grafik diameter zona hambat MRSA 5.5 Analisis Kualitas Analisis kualitas daya hambat diuji dengan Chi-Square dengan nilai α=0,05. Kekuatan daya hambat bakteri dikategorikan menurut Davis dan Stout (1971) menjadi: sangat kuat (>20mm), kuat (10-20mm), sedang (5-10mm) dan lemah (<5mm). Hasil analisis kemaknaan dengan uji Chi-Square terdapat pada table 5.5 Tabel 5.5 Kualitas Daya Hambat Kualitas Kelompok Subyek Kontrol Ekstrak 25% Ekstrak 50% Ekstrak 75% Ekstrak 100% Lemah Sedang Kuat 4 0 0 0 0 0 0 0 0 0 0 4 4 0 0 Sangat Kuat 0 0 0 4 4 X2 p 40,000 0,000 Tabel 5.5 menunjukkan bahwa pemberian ekstrak daun kaktus pakis giwang (Euphorbia milii) dengan berbagai konsentrasi mempengaruhi kualitas zona hambat MRSA. Ini ditunjukkan dengan nilai p<0,05. BAB VI PEMBAHASAN HASIL PENELITIAN 6.1 Subyek Penelitian Untuk mengetahui efek pemberian ekstrak daun kaktus pakis giwang (Euphorbia milii) terhadap daya hambat Methicillin-resistant Staphylococcus aureus (MRSA) secara in vitro maka dilakukan penelitian pada plate inkubasi di Laboratorium Mikrobiologi Universitas Udayana. Obyek yang digunakan dalam penelitian ini sebanyak 4 (empat) plate sebagai sampel, yang tergagi dalam 5 (lima) kelompok, yaitu kelompok kontrol (Ethanol 70%), Ekstrak Euphorbia milii 25%, Ekstrak Euphorbia milii 50%, Ekstrak Euphorbia milii 75% dan Ekstrak Euphorbia milii 100%. 6.2 Distribusi Data Hasil Penelitian Uji perbandingan berdasarkan konsentrasi antara kelima kelompok perlakuan didapatkan rerata diameter daya zona hambat MRSA kelompok kontrol 0,0000+0,0000; kelompok ekstrak Euphorbia milii 25% 14,2500+0,5000; kelompok ekstrak Euphorbia milii 50% 18,0000+0,8165; kelompok ekstrak Euphorbia milii 75% 20,0000+0,0000 dan kelompok ekstrak Euphorbia milii 100% 22,0000+0,8165. Untuk uji distribusi digunakan uji Saphiro-wilk dengan nilai signifikansi 0,05. Berdasarkan hasil uji tersebut kelompok kontrol dan konsentrasi 75% diabaikan karena diameter zona hambat MRSA hasil penelitian konstan. Untuk ekstrak dengan konsentrasi 25% menunjukkan hasil uji dengan nilai signifikansi 0,001; konsentrasi 50% menunjukkan hasil uji dengan nilai signifikansi 0,683 serta konsentrasi 100% juga menunjukkan hasil uji dengan nilai signifikansi 0,683. Dengan demikian ada satu sampel yaitu pada konsentrasi 54 25% menunjukkan populasinya berdistribusi tidak normal, sehingga untuk mengetahui perbedaan rerata diameter zona hambat antar kelompok perlakuan dipakaiuji non parametrik yaitu uji Kruskal-Wallis dengan nilai α=0,05. Uji perbandingan antara kelima kelompok dengan uji Kruskal-Wallis menunjukkan bahwa terdapat perbedaan bermakna diameter zona hambat pertumbuhan MRSA dengan perlakuan kontrol, konsentrasi ekstrak 25%, konsentrasi ekstrak 50%, konsentrasi ekstrak 75% dan konsentrasi ekstrak 100% (p<0,05). Untuk mengetahui sampel mana yang berbeda dilanjutkan dengan uji MannWhitney, dengan membandingkan sampel satu dengan sampel yang lain, pada nilai α=0,05. Hasil menunjukkan terdapat perbedaan bermakna antara kelompok kontrol dengan kelompok konsentrasi 25% (p<0.05), kelompok kontrol dengan kelompok konsentrasi 50% (p<0,05), kelompok kontrol dengan kelompok konsentrasi 75% (p<0,05), kelompok kontrol dengan kelompok konsentrasi 100% (p<0,05), kelompok konsentrasi 25% dengan kelompok konsentrasi 50% (p<0,05), kelompok konsentrasi 25% dengan kelompok konsentrasi 75% (p<0,05), kelompok konsentrasi 25% dengan kelompok konsentrasi 100% (p<0,05), kelompok konsentrasi 50% dengan kelompok konsentrasi 75% (p<0,05), kelompok konsentrasi 50% dengan kelompok konsentrasi 100% (p<0,05) dan kelompok konsentrasi 75% dengan kelompok konsentrasi 100% (p<0,05). Hasil juga menunjukkan semakin besarnya konsentrasi dari 25% sampai dengan 100%, semakin besar pula daya hambat terhadap MRSA seperti ditunjukkan oleh grafik pada gambar 5.1. Pada uji Chi-square juga menunjukkan bahwa ada hubungan antara konsentrasi dengan kualitas diameter zona hambat MRSA. Dengan demikian peningkatan konsentrasi ekstrak Euphorbia milii dalam etanol 70% berpengaruh terhadap diameter zona hambat MRSA yang dihasilkan dari percobaan secara in vitro. 6.3 Pengaruh Ekstrak Daun Kaktus Pakis Giwang (Euphorbia milii) Terhadap Diameter Zona Hambat MRSA MRSA merupakan penyebab utama infeksi di rumah sakit dan telah meluas dengan cepat di banyak bagian dunia. Makin lama makin sulit untuk melawan MRSA dan cara terbaik untuk mencegah penularannya masih banyak diperdebatkan. Di samping menjadi masalah di rumah rumah sakit di dunia, MRSA juga makin banyak ditemukan kembali dari pasien di fasilitas perawatan jangka panjang seperti wisma para usia lanjut, dan bahkan dari orang-orang di masyarakat atau di tempat-tempat olahraga. MRSA adalah S. aureus yang resisten terhadap antibiotika β-laktam, termasuk penicillinase-resistant penicillins (methicillin, oxacillin, nafcillin) dan cephalosporin (Dellit dkk., 2004; EPIC, 2006). Masalah MRSA di rumah sakit di samping penyebab lain, bisa juga disebabkan karena pasien yang masuk telah terjangkit MRSA sebelumnya, kemungkinan terinfeksi pada perawatan sebelumnya dari rumah sakit yang lain. Jika tidak diketahui bahwa pasien tersebut membawa koloni atau terinfeski MRSA, dan jika tidak diambil tindakan pencegahan infeksi yang tepat pada saat dia masuk rumah sakit, maka pasien tersebut cukup berpotensi menularkan organisme kepada pasien lain dan staf di dalam rumah sakit (Awang, 2006). Euphorbia milii merupakan salah satu spesies dari 2000 spesies lain dari genus Euphorbia. Spesies yang asli diberi nama Euphorbia milii varietas splendens/E.splendens. Varietas ini tumbuh sedikit menjalar (scrambing), memiliki seludang bunga (cyathia) berwarna merah berukuran 1 cm dan berbunga sejati berwarna kuning, dapat tumbuh mencapai 60-240 cm. Di Indonesia, Euphorbia milii ini dikenal dengan nama Pakis giwang (Wikipedia1,2011). Berdasarkan hasil penelitian diperoleh bahwa terjadi peningkatan bermakna diameter zona hambat Methicillin-resistant Staphylococcus aureus pada kelompok kontrol dengan kelompok perlakuan yang diberi ekstrak daun kaktus pakis giwang (Euphorbia milii). Terjadinya efek hambatan tersebut kemungkinan disebabkan karena daun kaktus pakis giwang mengandung zat anti bakteri yaitu senyawa saponin. Pada penelitian terdahulu oleh Herawati terhadap Artemia salina Leach, menunjukkan bahwa getah dari tanaman Euphorbia milii Des Moulins ternyata mengandung senyawa terpenoid dan saponin yang mempunyai efek toksik(Herawati,2004). Pada penelitian Septiningsih tahun 2005 juga menyebutkan saponin yang terkandung dalam ekstrak papaya dalam etanol 70% mampu mempercepat penyembuhan luka. Senyawa saponin dapat bekerja sebagai antimikroba (Robinson, 2005). Senyawa saponin akan merusak membran sitoplasma dan membunuh sel (Assani,1994). Saponin juga dinyatakan menghambat pertumbuhan bakteri Staphylococcus aureus. Saponin mempunyai efek menghambat pertumbuhan bakteri gram positif tetapi tidak dapat menghambat pertumbuhan bakteri gram negatif dan jamur (Soetan, dkk,2006). Mekanisme kerja antibakteri ada lima diantaranya, menghambat metabolism sel mikroba, menghambat sintesis dinding sel mikroba, mengganggu permeabilitas membrane sel mikroba, menghambat sintesis protein sel mikroba dan menghambat sintesis atau merusak asam nukleat sel mikroba (Ganiswara, 1995). Pada perusakan membrane sel, ion H+ dari senyawa fenol dan turunannya akan menyerang gugus polar (gugus fosfat) sehingga molekul fosfolipid akan terurai menjadi gliserol, asam karboksilat, dan asam fosfat. Hal ini mengakibatkan fosfolipid tidak mampu mempertahankan bentuk membran sel, akibatnya membran sel akan bocor dan bakteri akan mengalami hambatan pertumbuhan bahkan kematian (Noviana,2004). Saponin adalah sejenis sabun yang berasal dari tanaman yang dapat memperlihatkan sifat antibakteri. Saponin dapat membentuk larutan koloidal dalam air. Bila dikocok akan membuih. Kemampuan menurunkan tegangan permukaan ini disebabkan molekul saponin terdiri dari hidroforb dan hirofil. Saponin dibagi menjadi 2 golongan yaitu saponin sterol dan saponin triterpen. Saponin sterol bila terhidrolisis akan membentuk senyawa sterol dan saponin triterpen bila terhidrolisis akan membentuk senyawa terpen (Sirait, 2007). Hal ini juga dilaporkan pada penelitian Noor dan kawan – kawan (2006) bahwa senyawa saponin yang terdapat pada ekstrak daun tanjung (Mimusops elengi) mempunyai aktivitas antibakteri. Saponin bekerja sebagai antibakteri dengan mengganggu stabilitas membrane sel bakteri seihingga menyebabkan sel bakteri lisis (Wang dkk, 2000). Jadi mekanisme kerja saponin termasuk dalam kelompok antibakteri yang mengganggu permeabilitas membrane sel mikroba, yang mengakibatkan kerusakan membrane sel dan menyebabkan keluarnya berbaggai komponen penting dari dalam sel mikroba yaitu protein, asam nukleat, nukleotida dan lain – lain (Ganiswara, 1995). Menurut Robinson (1991) dinyatakan bahwa senyawa glikosida seperti saponin dan glikosida jantung tidak larut dalam pelarut non polar. Senyawa ini paling cocok diekstraksi dari tumbuhan dengan memakai etanol atau methanol panas 70% sampai 75%. Pada penelitian ini ekstraksi dilakukan dengan menggunakan etanol 70%, diharapkan yang terlarut adalah senyawa saponin. Untuk membuktikan lebih lanjut perlu dilakukan identifikasi senyawa saponin, serperti menggunakan kromatografi. Beberapa penelitian dengan menggunakan Euphorbia milii juga banyak dilakukan seperti penggunaan getah pada pengobatan tumor yang dilakukan oleh Degaldo dkk tahun 2003. Juga penelitian yang dilakukan oleh Bakry dkk tahun 2011 mengenai pengaruh getah Euphorbia milii terhadap pertumbuhan larva Schistosoma mansoni pada host. Berdasarkan hasil penelitian perbedaan konsentrasi mempengaruhi diameter zona hambat yang dihasilkan. Pada konsentrasi yang lebih besar memperlihatkan daya hambat terhadap pertumbuhan bakteri MRSA semakin besar pula. Ini diperlihatkan oleh diameter zona yang dihasilkan. Diameter yang dimaksud merupakan nilai rata – rata diameter zona bening yang terbentuk pada media, diukur dengan menggunakan jangka sorong dengan satuan millimeter. BAB VII SIMPULAN DAN SARAN 7.1 Simpulan Berdasarkan hasil penelitian pemberian ekstrak daun kaktus pakis giwang pada bakteri MRSA didapatkan simpulan sebagai berikut: 1. Ekstrak daun kaktus pakis giwang (Euphorbia milii) mempunyai efek menghambat pertumbuhan Methicillin-resistant Staphylococcus aureus secara in vitro. 2. Pada pemberian ekstrak daun kaktus pakis giwang (Euphorbia milii) konsentrasi 25%, 50%, 75% dan 100% didapatkan semakin besar konsentrasi semakin besar diameter zona hambat secara in vitro. 7.2 Saran Sebagai saran dalam penelitian ini adalah: 1. Perlu melakukan penelitian lebih lanjut untuk mencari konsentrasi hambat minimum (KHM) dari ekstrak daun pakis giwang terhadap MRSA. 2. Perlu melakukan penelitian lebih lanjut untuk memastikan kandungan kimia yang terdapat dalam ekstrak etanol 70% Euphorbia milii 3. Perlu dilakukan penelitian lebih lanjut mengenai pelarut yang memberikan konsentrasi maksimal dari zat antibakteri yang terdapat dalam tanaman Euphorbia milii 4. Untuk penerapan penggunaan ekstrak daun Euphorbia milii sebagai perlu dilakukan penelitian menentukan dosis optimal penggunaan pada pengobatan terhadap infeksi MRSA 61 DAFTAR PUSTAKA Alangaden, G.J. 1997. Overview of Antimicrobial Resistance National Foundation for Infectious Diseases. Available from: http://www.nfid.org/publications/id_archive/antimicrobial.html. [cited 2011 October 27] Anonim1. 2011. Kaktus Pakis Giwang. Available at: http://ramuherbal.wordpress.com/2011/04/20/kaktus-pakis-giwang/ . [cited 2011 Juli 15] Anonim2, 2011. Penyebab dan Cara Mengobati Bisul. Available at: http://sehatzblog.blogspot.com/2011/05/penyebab-cara-mengobati-bisul.html [cited 2011 Juli 15] Ansel, Howard C. 1989. Pengantar Bentuk Sediaan Farmasi. Jakarta : UI Press. Ardiansyah. 2007. Senyawa Antimikroba Tumbuhan. Bagian Kedua. Available from: http://kompas.com [cited 2010 September 30] Ariyoso. 2009. Uji Kruskal-Wallis. Available from: http://ariyoso.wordpress.com/2009/11/07/uji-kruskal-wallis/ [cited 2012 January 5] Awang, N. 2006. Essential Practices in Infection Control. Ansell Cares. Edisi 2 . Prakarsa Badan Penasehat Pengendalian Infeksi. Malaysia. Available from:http://150.101.90.21/mam_asset/.pdf?col=/client_db/ANSL&id=01ffa7c0646b 3fb20000010e7d4643cc&type=pdf [cited 2012 January 30] Badan Pom RI.2005. Standarisasi Ekstrak Tumbuhan Obat Indonesia Salah Satu Tahapan Penting Dalam Pengembangan Obat Asli Indonesia. InfoPOM, volume 6, No.4 Edisi Juli 2005, hal. 1-5 Baker,J.S., Hackett, M.F., Simard, D.J., 1986. Variations in Bacitracin Susceptibility Observed in Staphylococcus and Micrococcus Spesies; Journal of Clinical Microbiology, May 1986, p.963-964 Bakry, Fayes., Mohamed, Raga. 2011. Inpact of Euphorbia milii Latex on Infectivity of Schistosoma mansoni Larvar Stages to Their Host. Journal of Evolutionory Biology Research Vol.3(7), pp.101-107, November 2011. Available fromt: http://www.academicjournals.org/jebr [cited 2012 January 28] BC Centre for Disease Control. 2001. British Columbia Guidelines for Control of Antibiotic Resistant Organisms (AROs) [Methicillin-resistant Staphylococcus aureus (MRSA) and Vancomycin-resistant Enterococci (VRE)]. 62 Beishir, L. 1991. Microbiology in Practice: A Self-Instructional Laboratory Course. 5th ed. HarperCollins Publishers Inc. New York. USA. Brown, D.F.J., Edwards, D.I., Hawkey, P.M., Morrison, D., Ridgway, G.L., Towner, K.J., Wren, M.W.D. 2005. Guidelines for the laboratory diagnosis and susceptibility testing of methicillin-resistant Staphylococcus aureus (MRSA). J Antimicrob Chemother, 56:1000–1018. Cappucino, J. G. and N. Sherman. 2005. Microbiology: A Laboratory Manual. 7th ed. Pearson Education Inc. USA. Common,Wikimedia.2011, Berkas:Abszess.jpg. Available http://id.wikipedia.org/wiki/Berkas:Abszess.jpg [cited 2011 Juli 15] from: Connie,R., Donald,C., Manuselis,G. 2011. Textbook of Diagnostic Microbioloby, Fourth Edition., W.B Saunders Company Dalimartha,S. 2003. Atlas Tumbuhan Obat Indonesia Jilid 3. Trubus Agriwidia, hal. 36 – 38 Delgado,IF., De-Carvalho, De-Olivera. Kuriyama,S., Oliveira, Souza., Paumgartten. 2003. Absence of Tumor Promoting Activity of Euphorbia milii Latex on The Mouse Back Skin. Toxicology Letters 145 (2003) 175-180. Available from : http://www.sciencedirect.com [cited 2012 January 28] Dellit, T., Duchin, J., Hofmann, J., Olson, E.G. 2004. Interim Guidelines for Evaluation & Management of Community Associated Methicillin-resistant Staphylococcus aureus Skin and Soft Tissue Infection in Outpatient Settings. Departemen Kesehatan RI, 1992. Pemanfaatan Tanaman Obat. Jakarta Departemen Kesehatan RI, 1995. Farmakope Indonesia edisi IV, Direktorat Jenderal Pengawasan Obat dan Makanan. Digunawan,2010.Maseras. Available from: http://obtrando.files.wordpress.com /2010/11/ekstraksi-tanaman-dengan-maserasi_perkolasi_soxhlet.pdf [cited 2011 Juli 22] Dinda, 2008. Ekstraksi. Available from: 2008/11/ekstraksi.html [cited 2011 Juli 22] http://medicafarma.blogspot.com/ Duckworth, G., Cookson, B., Humphreys, H., Heathcock, R. 1998. Revised Methicillinresistant Staphylococcus aureus Infection Control Guideline for Hospitals, Report of a combined working party of the British Society for Antimicrobial Chemotherapy, the Hospital Infection Society and the Infection Control Nurses Association. Brit Soc Antimicrob Chemother. Dwiatmojo,Bagus. 2011. Deteksi Strain Methicillin-Resistant Staphylococcus aureus (MRSA) Pada Unit Ambulans RSUP Dr. Hasan Sadikin Bandung . hal. 48 – 49. Enright, M.C., Robinson, D.A., Randle, G., Feil, E.J., Grundmann, H., Spratt, B.G. 2002. The evolutionary history of methicillin-resistant Staphylococcus aureus (MRSA). PNAS 99(11):7687–7692. EPIC. 2006. Apakah organisme multi-resistan itu dan bagaimana timbulnya? in Essential Practices in Infection Control. Ansell Cares, 2:1-6. Fox, M. T. 2000. Identification of Gram-Positive Bacteria: Normal Flora Staphylococci. Ganiswara,S.G. 1995. Farmakologi dan Terapi. Gaya Baru. Jakarta Gibson, J.M. (1996). Mikrobiologi dan Patologi Modern Untuk Perawat. Diterjemahkan dari buku Modern Microbiology and Patology for Nurses oleh I.K.G. Soma Prasada. Penerbit Buku Kedokteran EGC, Jakarta. Hamdiyati,Y., Kusnadi, Rahadian. 2008. Aktivitas Antibakteri Ekstrak Daun Patikan Kebo (Euphorbia hirta) terhadap Pertumbuhan Bakteri Staphylococcus epidermidis. Jurnal Pengajaran MIPA Vol. 12 No 2 Desembar 2008 Hapsari, B. dan Budiana, N.S. 2007. Euphorbia milii. Penebar Swadaya. Jakarta. Haryana,A. 2011. Obat Herbal dan Obat Tradisional Bisul. Available fromt: http://www.tanaman-obat.com/jual-obat-herbal/259-obat-herbal-dan-obattradisional-bisul [cited 2011 Juli 25] Herawati, R., D., 2004, Uji Toksisitas Getah Euphorbia milii Des Moulins Terhadap Artemia salina Leach. Skripsi Mahasiswa Fakultas Farmasi Universitas Muhammadiyah Surakarta, Surakarta. Holden, M.T.G., Feil, E.J., Lindsay, J.A., Peacock, S.J., Day, N.J.P., Enright, M.C. 2004. Complete genomes of two clinical Staphylococcus aureus strains: Evidence for the rapid evolution of virulence and drug resistance. PNAS, 101(26):9786-9791. Jawetz, M., Adelberg’s. 2005 Mikrobiologi Kedokteran. edisi 23. Alih Bahasa: Huriwati Hartanto dkk. Jakarta, Penerbit Buku Kedokteran ECG. Johnson, T. R. and C. L. Case. 1995. Laboratory Experiments in Microbiology. 4th ed. The Benjamin/Cummings Publishing Company, Inc. California. USA. Katno. Pramono. 2008.Tingkat Manfaat dan Keamanan Tanaman Obat dan Obat Tradisional. Balai Penelitian Tanaman Obat Tawangmangu. Fakultas Farmasi UGM Khoeriah, 2010. Ringkasan Uji Statistik dengan SPSS. Available from: http://khoeriah.blog.com/2010/03/14/ringkasan-spss/ [cited 2011 January 5] Koneman, E. W., Allen, W., M. Janda, P. C. , Shreckenberger and Winn, Jr. 1992. Color Atlas and Textbook of Diagnostic Microbiology. 4th ed. J. B. Lippincott Company. Philadelphia, Pennsylvania. USA. Kowalski, T.J., Berbari, E.F., Osmon D.R. 2005. Epidemiology, Treatment, and Prevention of Community-Acquired Methicillin-resistant Staphylococcus aureus Infections. Mayo Clin Proc, 80(9):1201-1208. Kusumayani,L. Andoko,A. 2004. Membuat Euphorbia Tampil Indah dan Menawan Lauhari,N. 2010. Tanaman Obat Kaktus Pakis Giwang. Available http://informasidantips.com/search/obat+menghentikan+mens/ [cited Agustus 24] from: 2011 Lawrence, G. H. M. 1959. Taxonomy of Vascular Plant. New York : The Macmillan Co. Lia, 2011. Laporan Farmakognosi (repaired). Available http://www.scribd.com/doc/56609221/15/b-Deskripsi [cited 2011 Juli 22] from: Lingga,L. 2006. Sukses Menanam & Merawat Euphorbia milii, Jakarta, Hal. 14-16 Lowy, F.D. 1998. Staphylococcus Aureus Infections. NEJM, 339(8):520-532. Mahmud, R. 2010. Prinsip Ekstraksi Maserasi. Available from: http://kumpulilmu.blogspot.com/ 2010/04/prinsip-ekstraksi-maserasi.html [cited 2011 Juli 22] Marczyk,G.R., DeMatteo,D.,dan Festinger,D.2005,Essentials of Research Design and Methodology, Hoboken, NJ: John Wiley & Sons, New Jersey. Moran, G. 2011. Deadly Skin Infection. Available from: http://www.cbsnews.com /2300 204_162-10007550.html [cited 2011 December 13] Noor,S., Poeloengan, M., Yulianti, T. 2006. Analisis Senyawa Kimia Sekunder dan Uji Daya Antibakteri Ekstrak Daun Tanjung (Mimusops elengi L) terhadap Salmonela typhi dan Shigella boydii. Balai Penelitian Veteriner Fakultas Farmasi ISTN Jakarta. Noviana,L.2004. Identifikasi Senyawa Flavonoid Hasil Isolasi dari Propolis Lebah Madu (Apis Mellifera) dan Uji Aktivitasnya Sebagai Antibakteri (Staphylococcus aureus. Skripsi Mahasiswa Jurusan Kimia Universitas Brawijaya Malang. Ogbulie et al. 2007. Antibacterial Activities and Toxicological Potentials of Crude ethanolic Extracts of Euphorbia hirta. African Journal of Biotechnology. 6, (13), 1544-1548 Pocock SJ.2008. Clinical Trials A Practical Approach. England : John Wiley & Sons Ltd. The Atrium, South Gate, Chichester, West Sussex. Purwanto, A. W. 2006. Euphorbia Tampil Prima dan Semarak Berbunga. Kanisius. Yogyakarta. Puspita, 2009. Euphorbia milii . Available from: http://www.puspitaklaten.co.cc/2009/07/kegunaan-khasiat.html [cited 2011 Juli 21] Sampathkumar, P. 2007. Methicillin-Resistant Staphylococcus aureus: The Latest Health Scare. Mayo Clin Proc, 82(12):1463-1467. Septiningsih, E. 2008 . Efek Penyembuhan Luka Bakar Ekstrak Etanol 70% Daun Pepaya (Carica papaya L.) dalam Sediaan Gel pada Kulit Punggung Kelinci new zealand, UMM Surakarta, Solo Soedijono, B. dan Rudi H. 2007. Agar Euphorbia Tampil Menawan. Penebar Swadaya. Jakarta. Sirait, Midian. 2007. Penuntun Fitokimia dalam Farmasi. ITB. Bandung Soetan, K., Oyekunle, M., Aiyelaaagbe, O., Fafunso, M. 2006. Evaluation of the Antimicrobial Activity of Saponins Extract of Sorghum Bicolor L. Moench. Departement of Biochemistry, University of Ibadan, Ibadan. Supranto, J.2000. Teknik Sampling untuk Survei dan Eksperimen. Penerbit PT Rineka Cipta Jakarta The Center for Food Security & Public Health. 2011. Methicillin Resistant Staphylococcus aureus (MRSA). Available from: http://www.cfsph.iastate.edu/Factsheets/pdfs/mrsa.pdf. [cited 2011 November 17] Tirnata. L.P. 2008. Identifikasi Staphylococcus aureus Penyebab Mastitis dengan Uji Fermentasi Mannitol dan Deteksi Produksi Asetoin pada Sapi Perah di Wilayah Kerja Koperasi Usaha Tani Ternak Suka Makmur Grati Pasuruan. Fakultas Kedokterah Hewan Universitas Airlangga Surabaya. Volk, Wesley A dan Wheeler, Margareth F. 1989. Mikrobiologi Dasar. Erlangga. Jakarta. Wang, Y., McAllister, T. A., Yanke, L. J., & Cheeke, P. R. 2000. Effect of steroidal saponin from Yucca schidigera extract on ruminal microbes. Journal of Applied Microbiology, 88, 887–896. Available from: http://onlinelibrary.wiley.com [cited 2012 January 28]. Wasitaninggrum, IDA. 2009. Uji Resistensi Bakteri Staphylococcus aureus dan Escherichia coli dari Isolat Susu Sapi Segar terhadap Beberapa Antibiotika. Fakultas Farmasi Universitas Muhammadiah Surakarta. Wijisaksono, D.P. 2007. Terapi optional “baru” untuk infeksi gram (+): peran vancomycin. Dalam: M. Sja’bani, S. Nurdjanah, K. Widayati, M.R. Ikhsan, A. Widiatmoko (eds.) Naskah lengkap Pertemuan Ilmiah Tahunan IX Ilmu Penyakit Dalam FK UGM. Hal. 13-24. Yogyakarta. PGTKI Press002E Wikipedia. 2011. Bisul . Available from: http://id.wikipedia.org/wiki/Bisul Agustus 4] Wikipedia1,2011. Euphorbia milii. Available wiki/Euphorbia_milii [cited 2011 Desember 20] from: [cited 2011 http://id.wikipedia.org/ LAMPIRAN Rerata dan Simpangan Baku Diameter Konsent rasi Mean 0% N Std. Deviation .0000 4 .00000 25% 14.2500 4 .50000 50% 18.0000 4 .81650 75% 20.0000 4 .00000 100% 22.0000 4 .81650 Total 14.8500 20 8.07384 Uji Normalitas Data Case Processing Summary Cases Valid Missing Total Konsent rasi Diameter N Percent N Percent N Percent 0% 4 100.0% 0 .0% 4 100.0% 25% 4 100.0% 0 .0% 4 100.0% 50% 4 100.0% 0 .0% 4 100.0% 75% 4 100.0% 0 .0% 4 100.0% 100% 4 100.0% 0 .0% 4 100.0% b,c Tests of Normality Kolmogorov-Smirnov a Shapiro-Wilk Konsent rasi Diameter Statistic df Sig. Statistic df Sig. 25% .441 4 . .630 4 .001 50% .250 4 . .945 4 .683 100% .250 4 . .945 4 .683 a. Lilliefors Significance Correction b. Diameter is constant when Konsentrasi = 0%. It has been omitted. c. Diameter is constant when Konsentrasi = 75%. It has been omitted. 68 Uji Homogenitas a,b Test of Homogeneity of Variance Levene Statistic Diameter df1 df2 Sig. Based on Mean .086 2 9 .919 Based on Median .273 2 9 .767 .273 2 8.854 .767 .104 2 9 .903 Based on Median and with adjusted df Based on trimmed mean a. Diameter is constant when Konsentrasi = 0%. It has been omitted. b. Diameter is constant when Konsentrasi = 75%. It has been omitted. Multiple Comparisons Diameter LSD (I) (J) 95% Confidence Interval Konsent Konsent Mean Difference rasi rasi (I-J) 0% 25% -14.25000 50% -18.00000 75% -20.00000 100% -22.00000 25% 50% 75% Std. Error Sig. Lower Bound Upper Bound * .39791 .000 -15.0981 -13.4019 * .39791 .000 -18.8481 -17.1519 * .39791 .000 -20.8481 -19.1519 * .39791 .000 -22.8481 -21.1519 * .39791 .000 13.4019 15.0981 * .39791 .000 -4.5981 -2.9019 * .39791 .000 -6.5981 -4.9019 * .39791 .000 -8.5981 -6.9019 * .39791 .000 17.1519 18.8481 * .39791 .000 2.9019 4.5981 * .39791 .000 -2.8481 -1.1519 * .39791 .000 -4.8481 -3.1519 * .39791 .000 19.1519 20.8481 * .39791 .000 4.9019 6.5981 0% 14.25000 50% -3.75000 75% -5.75000 100% -7.75000 0% 18.00000 25% 3.75000 75% -2.00000 100% -4.00000 0% 20.00000 25% 5.75000 100% * .39791 .000 1.1519 2.8481 * .39791 .000 -2.8481 -1.1519 * .39791 .000 21.1519 22.8481 * .39791 .000 6.9019 8.5981 * .39791 .000 3.1519 4.8481 * .39791 .000 1.1519 2.8481 50% 2.00000 100% -2.00000 0% 22.00000 25% 7.75000 50% 4.00000 75% 2.00000 *. The mean difference is significant at the 0.05 level. Kruskal-Wallis Test Ranks Konsent rasi Diameter N Mean Rank 0% 4 2.50 25% 4 6.50 50% 4 10.50 75% 4 14.50 100% 4 Total 20 18.50 a,b Test Statistics Diameter Chi-Square 18.650 df 4 Asymp. Sig. .001 a. Kruskal Wallis Test b. Grouping Konsentrasi Variable: Mann-Whitney Test (0-25) Ranks Konsen trasi Diameter N Mean Rank Sum of Ranks 0% 4 2.50 10.00 25% 4 6.50 26.00 Total 8 b Test Statistics Diameter Mann-Whitney U .000 Wilcoxon W 10.000 Z -2.530 Asymp. Sig. (2-tailed) Exact Sig. [2*(1-tailed Sig.)] a. Not corrected for ties. b. Grouping Variable: Konsentrasi .011 a .029 Mann-Whitney Test (0-50) Ranks Konsen trasi Diameter N Mean Rank Sum of Ranks 0% 4 2.50 10.00 50% 4 6.50 26.00 Total 8 b Test Statistics Diameter Mann-Whitney U .000 Wilcoxon W 10.000 Z -2.477 Asymp. Sig. (2-tailed) .013 a Exact Sig. [2*(1-tailed Sig.)] .029 a. Not corrected for ties. b. Grouping Variable: Konsentrasi Mann-Whitney Test (0-75) Ranks Konsen trasi Diameter N Mean Rank Sum of Ranks 0% 4 2.50 10.00 75% 4 6.50 26.00 Total 8 b Test Statistics Diameter Mann-Whitney U .000 Wilcoxon W 10.000 Z -2.646 Asymp. Sig. (2-tailed) .008 a Exact Sig. [2*(1-tailed Sig.)] .029 a. Not corrected for ties. b. Grouping Variable: Konsentrasi Mann-Whitney Test (0-100) Ranks Konsent rasi Diameter N Mean Rank Sum of Ranks 0% 4 2.50 10.00 100% 4 6.50 26.00 Total 8 b Test Statistics Diameter Mann-Whitney U .000 Wilcoxon W 10.000 Z -2.477 Asymp. Sig. (2-tailed) Exact Sig. [2*(1-tailed Sig.)] a. Not corrected for ties. b. Grouping Variable: Konsentrasi .013 a .029 Mann-Whitney Test (25-50) Ranks Konsen trasi Diameter N Mean Rank Sum of Ranks 25% 4 2.50 10.00 50% 4 6.50 26.00 Total 8 b Test Statistics Diameter Mann-Whitney U .000 Wilcoxon W 10.000 Z -2.381 Asymp. Sig. (2-tailed) Exact Sig. [2*(1-tailed Sig.)] .017 a .029 a. Not corrected for ties. b. Grouping Variable: Konsentrasi Mann-Whitney Test (25-75) Ranks Konsen trasi Diameter N Mean Rank Sum of Ranks 25% 4 2.50 10.00 75% 4 6.50 26.00 Total 8 b Test Statistics Diameter Mann-Whitney U .000 Wilcoxon W 10.000 Z -2.530 Asymp. Sig. (2-tailed) Exact Sig. [2*(1-tailed Sig.)] .011 a .029 a. Not corrected for ties. b. Grouping Variable: Konsentrasi Mann-Whitney Test (25-100) Ranks Konsent rasi Diameter N Mean Rank Sum of Ranks 25% 4 2.50 10.00 100% 4 6.50 26.00 Total 8 b Test Statistics Diameter Mann-Whitney U .000 Wilcoxon W 10.000 Z -2.381 Asymp. Sig. (2-tailed) Exact Sig. [2*(1-tailed Sig.)] a. Not corrected for ties. b. Grouping Variable: Konsentrasi .017 a .029 Mann-Whitney Test (50-75) Ranks Konsen trasi Diameter N Mean Rank Sum of Ranks 50% 4 2.50 10.00 75% 4 6.50 26.00 Total 8 b Test Statistics Diameter Mann-Whitney U .000 Wilcoxon W 10.000 Z -2.477 Asymp. Sig. (2-tailed) Exact Sig. [2*(1-tailed Sig.)] a. Not corrected for ties. b. Grouping Variable: Konsentrasi .013 a .029 Mann-Whitney Test (50-100) Ranks Konsent rasi Diameter N Mean Rank Sum of Ranks 50% 4 2.50 10.00 100% 4 6.50 26.00 Total 8 b Test Statistics Diameter Mann-Whitney U .000 Wilcoxon W 10.000 Z -2.337 Asymp. Sig. (2-tailed) Exact Sig. [2*(1-tailed Sig.)] .019 a .029 a. Not corrected for ties. b. Grouping Variable: Konsentrasi Mann-Whitney Test (75-100) Ranks Konsent rasi Diameter N Mean Rank Sum of Ranks 75% 4 2.50 10.00 100% 4 6.50 26.00 Total 8 b Test Statistics Diameter Mann-Whitney U .000 Wilcoxon W 10.000 Z -2.477 Asymp. Sig. (2-tailed) .013 a Exact Sig. [2*(1-tailed Sig.)] .029 a. Not corrected for ties. b. Grouping Variable: Konsentrasi Chi Square Test Crosstab Count Kualitas Lemah Konsentrasi Total Kuat Sangat Kuat Total 0% 4 0 0 4 25% 0 4 0 4 50% 0 4 0 4 75% 0 4 0 4 100% 0 0 4 4 4 12 4 20 Chi-Square Tests Asymp. Sig. (2Value df sided) a 8 .000 Likelihood Ratio 38.011 8 .000 Linear-by-Linear Association 14.250 1 .000 Pearson Chi-Square N of Valid Cases 40.000 20 a. 15 cells (100,0%) have expected count less than 5. The minimum expected count is ,80.