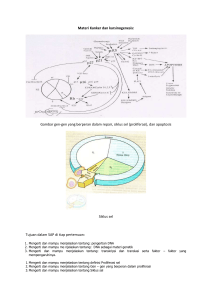
POLIMORFISME GEN insl3 DAN lgr8, KADAR HORMON
advertisement

DISERTASI POLIMORFISME GEN insl3 DAN lgr8, KADAR HORMON INSL3 DAN ESTRADIOL SEBAGAI FAKTOR RISIKO KRIPTORKISMUS PADA ANAK I WAYAN BIKIN SURYAWAN PROGRAM PASCASARJANA UNIVERSITAS UDAYANA DENPASAR 2011 DISERTASI POLIMORFISME GEN insl3 DAN lgr8, KADAR HORMON INSL3 DAN ESTRADIOL SEBAGAI FAKTOR RISIKO KRIPTORKISMUS PADA ANAK I WAYAN BIKIN SURYAWAN NIM 0790271001 PROGRAM DOKTOR PROGRAM STUDI ILMU KEDOKTERAN PROGRAM PASCASARJANA UNIVERSITAS UDAYANA DENPASAR 2011 Halaman Prasyarat Gelar DOKTOR POLIMORFISME GEN insl3 DAN lgr8, KADAR HORMON INSL3 DAN ESTRADIOL SEBAGAI FAKTOR RISIKO KRIPTORKISMUS PADA ANAK Disertasi untuk Memperoleh Gelar Doktor pada Program Doktor, Program Studi Ilmu Kedokteran, Program Pascasarjana Universitas Udayana I WAYAN BIKIN SURYAWAN NIM 0790271001 PROGRAM DOKTOR PROGRAM STUDI ILMU KEDOKTERAN PROGRAM PASCASARJANA UNIVERSITAS UDAYANA DENPASAR 2011 ii Halaman Persetujuan Promotor dan Kopromotor Lembar Pengesahan DISERTASI INI TELAH DISETUJUI TANGGAL 28 Juni 2011 Promotor, Prof.dr.Soetjiningsih, Sp.A(K), IBCLC NIP. 19450124 197106 2 001 Kopromotor I, Kopromotor II, Prof.Dr.dr.Ketut Suastika,Sp.PD-KEMD Prof.Dr.dr.Joserizal Latief Batubara,Sp.A(K) NIP. 19550329 198012 1 001 NIP. 19520121 197703 1 001 Mengetahui Ketua Program Studi Ilmu Kedokteran Direktur Program Pascasarjana Program Pascasarjana Universitas Udayana, Universitas Udayana, Dr.dr.I Wayan Putu Sutirta Yasa, M.Si Prof.Dr.dr.A.A.Raka Sudewi, Sp.S (K) NIP. 19570513 198601 1 001 NIP. 19590215 198510 2 001 iii Halaman Penetapan Panitia Penguji Disertasi Disertasi Ini Telah Diuji dan Dinilai pada Ujian Tertutup Tanggal 16 Juni 2011 Panitia Penguji Disertasi Berdasarkan SK Rektor Universitas Udayana No : 1055 / UN14.4 /HK/2011, Tanggal: 7 Juni 2011 Panitia Penguji Disertasi Tahap I (Ujian Tertutup) Program Doktor (S3) Ilmu Kedokteran Program Pascasarjana Universitas Udayana adalah: Ketua : Prof. Dr.dr.N. Adiputra, M.OH Anggota : 1. 2. Prof. dr. Soetjiningsih, Sp.A(K), IBCLC Prof. Dr. dr. Ketut Suastika, Sp.PD-KEMD 3. Prof. Dr. dr. Joserizal Latief Batubara, Sp.A(K) 4. Prof. Dr. dr. I Gde Raka Widiana, Sp.PD-KGH 5. Prof. Dr. Ir. I Gede Putu Wirawan, M.Sc 6. Prof. Dr. dr. A. A. Gede Sudewa Djelantik, Sp.PK(K) 7. Prof. drh. I Nyoman Mantik Astawa, Ph.D iv UCAPAN TERIMA KASIH Pertama-tama perkenankanlah penulis memanjatkan Puji Syukur ke hadapan Ida sang Hyang Widhi Wasa/Tuhan Yang Maha Esa, karena atas asung wara nugraha-Nya/kurnia-Nya, disertasi ini dapat diselesaikan. Pada kesempatan ini perkenankanlah penulis mengucapkan terima kasih yang sebesarbesarnya kepada Yth: (1) Prof. dr. Soetjiningsih, Sp.A(K), IBCLC selaku promotor yang dengan penuh perhatian telah memberikan dorongan, semangat, bimbingan, dan saran selama penulis mengikuti program doktor, khususnya dalam penyelesaian disertasi ini. Terima kasih sebesar-besarnya pula penulis sampaikan kepada yth Prof. Dr. dr. Ketut Suastika, Sp.PD-KEMD selaku kopromotor 1 dan kepada yth Prof. Dr. dr. Joserizal Latief Batubara, Sp.A(K) selaku kopromotor 2, yang penuh perhatian dan kesabaran telah memberikan bimbingan dan saran kepada penulis. (2) Rektor Universitas Udayana Prof. Dr. dr. I Made Bakta, Sp.PD-KHOM atas kesempatan dan fasilitas yang diberikan kepada penulis untuk mengikuti dan menyelesaikan pendidikan program doktor di Universitas Udayana. (3) Direktur Program Pascasarjana Universitas Udayana Prof.Dr.dr.A.A.Raka Sudewi, Sp.S(K); Asisten Direktur I Program Pascasarjana Universitas Udayana Prof. Dr. Made Budiarsa, MA; Asisten Direktur II Program Pascasarjana Universitas Udayana Prof. Dr. Ir. Budi Surusa, MS; dan stap PPS UNUD atas kesempatan yang diberikan untuk kuliah di tingkat pendidikan terakhir. (4) Ketua dan Sekretaris Program Doktor Program Studi Ilmu Kedokteran Dr.dr. I Wayan Putu Sutirta Yasa, M.Si dan Dr. dr. Dewa Made Sukrama, Sp.MK, M.Si atas pemberian semua fasilitas pendidikan sejak awal proses kuliah. (5) Direktur RSUD Wangaya Prof.Dr.dr. I Gede Raka Widiana, Sp.PD-KGH, Kepala SMF Anak RSUD wangaya dr. Putu Paramita Rahayu, Sp.A, dan kepada bagian Anak IKA FK UNUD dr. BNP Arhana, Sp.A(K) atas ijin yang diberikan untuk mengikuti pendidikan Doktor. (6) Para penguji disertasi, yaitu: Prof.Dr.dr.N.Adiputra, M.OH, Prof.Dr.dr. I Gede Raka Widiana, Sp.PD-KGH, Prof.Dr.Ir.I Gede Putu Wirawan, M.Sc, Prof.Dr.dr.A.A.Gede v Sudewa Djelantik, Sp.PK(K), Prof.drh. I Nyoman Mantik Astawa, Ph.D, atas masukan, saran, sanggahan, dan koreksi yang telah diberikan. (7) Kepada Dr.dr. Iswari Setianingsih, Sp.A dan dr Nanis Sacharin,Sp.A yang telah membimbing kami selama belajar genetika di Lembaga Biomolekuler Eijkman Jakarta. (8) Seluruh dosen pengajar Program Doktor, Program Studi Ilmu Kedokteran, Program Pascasarjana, Universitas Udayana, staff tata usaha dan seluruh teman –teman mahasiswa S3 Kedokteran khususnya angkatan 2007/2008. (9) Kepada teman-teman dokter spesialis anak di RSUD Wangaya, RSUP Sanglah dan IDAI Cabang Bali yang telah memberikan dorongan dan dukungan kepada penulis. Kepada perawat zal Kaswari RSUD Wangaya, petugas Laboratorium Prodia Denpasar, Laboratorium Biomolekuler FK UNUD, YAYASAN GENNEKA Eijkman Institute for Molekuler Biology di Jakarta, Laboratorium Kedokteran Hewan F.KH UNUD yang telah membantu penelitian ini. Terima kasih kepada pasien yang dipakai sebagai kasus dan kontrol dengan suka rela pada penelitian ini. (10) kepada seluruh guru-guru yang telah membimbing penulis, mulai dari sekolah dasar sampai perguruan tinggi dan semua pihak yang tidak dapat disebutkan satu persatu. (11) Penulis juga mengucapkan terima kasih kepada ayah dan ibu yang telah mengasuh dan membesarkan penulis, memberikan dasar dasar berpikir logik dan suasana demokratis sehingga tercipta suasana yang baik untuk berkembangnya kreativitas. Akhirnya penulis sampaikan terima kasih kepada istri tercinta Ni Made Muliasih, SE, serta anak-anak: Putu Siska Suryaningsih dan Kadek Adi Suryamulyawan tersayang, yang dengan penuh pengorbanan telah memberikan kepada penulis kesempatan untuk lebih berkonsentrasi menyelesaikan disertasi ini. Semoga Ida sang Hyang Widhi Wasa/ Tuhan Yang Maha Esa selalu melimpahkan rahmat-Nya kepada semua pihak yang telah membantu pelaksanaan penyelesaian disertasi ini, serta kepada penulis sekeluarga. Denpasar, Juni 2011 I Wayan Bikin Suryawan vi POLIMORFISME GEN insl3 DAN lgr8, KADAR HORMON INSL3 DAN ESTRADIOL SEBAGAI FAKTOR RISIKO KRIPTORKISMUS PADA ANAK Oleh: I Wayan Bikin Suryawan Di bawah bimbingan: Soetjiningsih, Ketut Suastika, Joserizal Latief Batubara Abstrak Kriptorkismus disebabkan multifaktorial dan peran polimorfisme gen insl3 dan lgr8, hormon INSL3 dan estradiol masih belum jelas. Penelitian ini bertujuan mengetahui frekuensi polimorfisme (exon 1, exon 2) gen insl3, frekuensi polimorfisme (exon 8, exon 12, exon 13) gen lgr8 pada anak kriptorkismus dan membuktikan polimorfisme (exin 1, exon 2) gen insl3, polimorfisme (exon 8, exon 12, exon 13) gen lgr8, kadar hormon INSL3 dan estradiol sebagai faktor risiko kriptorkismus. Penelitian ini merupakan penelitian observasional case control study, di poliklinik anak dua Rumah Sakit Umum dan satu Rumah Bersalin mulai September 2010 sampai Maret 2011, menggunakan 31 anak kriptorkismus sebagai kasus dan 31 anak sehat sebagai kontrol yang di matching usia kehamilan dan usia anak. Polimorfisme gen diperiksa dengan sequenzing hasil PCR, hormon diperiksa dengan ELISA. Frekuensi dianalisis dengan prosentase, polimorfisme dianalisis dengan odds ratio berpasangan, kadar hormon dianalisis dengan paired student t test dengan program komputer, hipotesis dengan tingkat kepercayaan (α ) diterima bila p<0,05. Penelitian ini menghasilkan frekuensi polimorfisme exon1(A9A=19,36%;T60T= 51,61%, T60A= 25,81%), exon 2 (E146E= 9,68%) gen insl3. Frekuensi polimorfisme exon 8 (kdn stp223M= 3,23%), exon 12 ( E319E= 100%; L331L= 48,39%), exon 13 ( S337A= 54,84%; P340P= 41,94%; H345P= 61,29%; K346K= 90,32%; Q354K= 16,13%; Q356P= 29,03%; S357S= 48,39%) gen lgr8. Polimorfisme T60T exon 1 gen insl3, polimorfisme E319E, L331L exon 12 gen lgr8 dan polimorfisme S337A, H345P, Q356P, S357S exon 13 gen lgr8, kadar hormon INSL3 rendah (< 0,42 ng/ml) dan kadar hormon estradiol tinggi (>10,22 ng/ml) ditemukan lebih banyak bermakna pada anak dengan kriptorkismus dibandingkan dengan kelompok control. Simpulan penelitian ini polimorfisme T60T, S357S dan E319E, L331L merupakan marker baru dan marker dan polimorfisme S337A, H345P dan Q356P, kadar hormon INSL3 rendah dan kadar hormon estradiol tinggi merupakan faktor risiko kriptorkismus. Penelitian ini diharapkan dapat dipakai menentukan pilihan terapi, prognosis dan dasar penelitian lebih lanjut. Kata kunci : Polimorfisme gen insl3, polimorfisme gen lgr8, hormon INSL3, hormon estradiol, kriptorkismus, anak vii POLYMORPHISMS OF THE insl3 AND lgr8 GENE, HORMONAL LEVEL OF INSL3 AND ESTRADIOL AS RISK FACTORS FOR CRYPTORCHIDISM IN CHILDREN By: I Wayan Bikin Suryawan Supervised by: Soetjiningsih, Ketut Suastika, Joserizal Latief Batubara Abstract Cryptorchidism has a multifactorial etiology and the role of insl3 and lgr8 gene polymorphism, INSL3 and estradiol hormonal remains unclear. This study aims to know the frequency of polymorphism (exon 1, exon 2) of insl3 gene, the frequency of polymorphism (exon 8, exon 12, exon 13) of lgr8 gene in children with cryptorchidism, and to examine whether polymorphism (exon 1, exon2) of insl3 gene and polymorphism (exon 8, exon 12, exon 13) of lgr8 gene, INSL3 and estradiol hormonal could be implied as risk factors for cryptorchidism. This is an observational case control study, conducted at the children’s ambulatory services of two general hospitals and one maternity clinic from September 2010 until March 2011, with 31 children with cryptorchidism and 31 healthy children as controls who were matched by gestational age and age of the children. Polymorphism of genes insl3 and lgr8 was examined by DNA sequencing using PCR, hormonal was examined by ELISA. Frequency was analyzed by percentages; polymorphism was analyzed by paired odd ratios, hormonal was analyzed by paired student t rest and computerized programmes, hypothesis with (α) and p<0,05. We found the following frequencies: polymorphisms of exon 1 (A9A= 19.36%; T60T= 51.61%, T60A= 25.81%), and of exon 2 (E146E= 9.68%) of insl3 gene. The frequency of polymorphism of exon 8 (stop codon 223M= 3.23%), exon 12 (E319E= 100%; L331L= 48.39%), exon 13 (S337A= 54.84%; P340P= 41.94%; H345P= 61.29%; K346K= 90.32%; Q354K= 16.13%; Q356P= 29.03%; S357S= 48.39%) of lgr8 gene. Both polymorphisms T60T of exon 1 insl3 gene, and polymorphisms E319E, L331L of exon 12 lgr8 gene and polymorphisms S337A, H345P, Q356P, and S357S of exon 13 lgr8 gene, INSL3 hormonal level low (<0,42 ng/ml) and estradiol hormonal level high (>10,22 ng/ml) were found significantly more often in children with cryptorchidism compared with those of the control group. In conclusion, polymorphisms T60T, S357S and E319E, L331L are respectively a new marker and a marker; and polymorphism S337A, Q356P and H345P, INSL3 hormonal level low and estradiol hormonal level high are risk factors for cryptorchidism. Hope this study can be use choise of therapy, prognosis and base are for the next study Keywords : insl3 gene polymorphism, lgr8 gene polymorphism, INSL3 hormonal, estradiol hormonal, cryptorchidism, children viii 9.Halaman Daftar Isi Halaman 1.Halaman Sampul Dalam ……………………………………………………………….. i 2.Halaman Prasyarat Gelar Doktor ………………………………………………………. ii 3.Halaman Persetujuan Promotor/Kopromotor …………………………………………. iii 4.Halaman Penetapan Panitia Penguji…………………………………………………….. iv 5.Halaman Ucapan Terima Kasih ……………………………………………………….... v 6.Halaman Abstrak ……..……………………………………………………………….... vii 7.Halaman Abstract ………………………………………………………………………. viii 8.Halaman Daftar Isi ……………………………………………………………………. ix 9.Halaman Daftar Tabel …………………………………………………………………. xiii 10.Halaman Daftar Gambar ……………………………………………………………… xiv 11.Halaman Daftar Singkatan …………………………………………………………… xvi 12.Halaman Daftar Lampiran ……………………………………………………………. xviii BAB I PENDAHULUAN …………………………………………………………… 1 1.1.Latar Belakang …………………………………………………………….. 1 1.2.Rumusan masalah ………………………………………………………….. 6 1.3.Tujuan penelitian…………………………………………………………… 7 1.4.Manfaat penelitian …………………………………………………………. 8 BAB II KAJIAN PUSTAKA …………………………………………………………. 9 2.1. Gonadotropin-Releasing Hormon dan Gonadotropin …….…………….... 9 2.2. Gonad …………………………………………………………………….. 9 2.2.1. Embriyogenesis gonad ………………………………………………….. 9 2.2.2. Hipospadia dan kordae …………………………………………………. 10 2.2.3. Mikropenis ……………………………………………………………… 11 ix 2.2.4. Hormon testosterone ……………………………………………………. 12 2.2.5. Anti mullerian hormone (AMH) ………………………………………. 16 2.2.6. Genitofemoral nerve (GFN) dan Calcitonin gen-related peptide (CGRP) 16 2.2.7. Hormon estradiol ……………………………………………………….. 17 2.2.8. Hormon INSL3 …………………………………………………………. 19 2.2.9. Reseptor LGR8 …………………………………………………….….. 22 2.3. Pertumbuhan Gubernakulum ……………………………………………… 24 2.4. Penurunan Testis ………………………………………………………….. 26 2.5. Gen dan Genom …………………………………………………………… 31 2.5.1. Struktur dan fungsi gen ………………………………………………….. 32 2.5.2. Gen yang berperan pada penurunan testis ………………………………. 33 2.5.3. Gen Insl3………………………………………………………………… 33 2.5.3.1. Polimorfisme gen Insl3 ……………………………………………….. 35 2.5.4. Gen Lgr8 ………………………………………………………………… 36 2.5.4.1. Polimorfisme gen Lgr8………………………………………………… 38 2.5.5. Identifikasi gen pada genom manusia …………………………………… 39 2.6. Polimorfisme Gen ………………………………………………………… 39 2.6.1. Single nucleotide polymorphism (SNPs) ……………………………….. 40 2.6.2. Mikrosatelit …………………………………………………………….. 43 2.6.3. Minisatelit ………………………………………………………………. 44 2.6.4. Dilesi, duplikasi dan insersi pada lokus yang tidak diulang (Indel) ……. 45 2.6.5. Bagaimana mendeteksi perubahan allel pada sepanjang lokus ………… 47 2.7. Kriptorkismus …………………………………………………………….. 48 2.7.1. Definisi kriptorkismus …………………………………………………… 48 2.7.2. Insiden kriptorkismus ………………………………………….……….. 49 x 2.7.3. Etiologi dan pathogenesis kriptorkismus ……………………………….. 50 2.7.4. Klasifikasi kriptorkismus ……………………………………………….. 51 2.7.5. Komplikasi kriptorkismus ………………………………………………. 54 2.7.6. Terapi pada kriptorkismus ……………………………………………….. 57 2.8. Teknik Enzyme-linked Immune-sorbent Assay(ELISA)untuk Asai Hormon 60 2.9. Polymerase Chain Reaction (PCR) ………………………………………… 63 BAB III. KERANGKA BERPIKIR, KONSEP, DAN HIPOTESIS PENELITIAN BAB IV. 64 3.1. Kerangka Berpikir ……………………………………………………….. 64 3.2. Konsep Penelitian ………………………………………………………… 65 3.3. Hipotesis Penelitian ……………………………………………………….. 66 METODE PENELITIAN 67 4.1. Rancangan Penelitian Observasional dengan Case Control Study ……….. 67 4.2. Lokasi dan Waktu Penelitian …………………………………………… 68 4.3. Penentuan Sumber Data …………………………………………………. 68 4.4. Variabel Penelitian ……………………………………………………….. 70 4.5. Bahan Penelitian ………………………………………………………….. 73 4.6. Instrumen Penelitian ……………………………………………………… 73 4.7. Prosedur Penelitian ……………………………………………………….. 74 4.8. Analisis Statistik ………………………………………………………….. 84 4.9. Keterangan Kelaikan Etik (Ethical Clearance) dan Ijin Penelitian ……….. 85 BAB V. HASIL PENELITIAN ……………………………………………………… 86 5.1.Karakteristik Sampel Penelitian …………………………………………… 86 5.2.Polimorfisme Gen Insl3 …………………………………………………… 88 5.2.1.Polimorfisme exon 1 gen insl3……………………………………………. 88 5.2.2.Polimorfisme exon 2 gen insl3 …………………………………………… 91 xi 5.3.Polimorfisme Gen Lgr8 ……………………………………………………. 94 5.3.1.Polimorfisme exon 8 gen lgr8 ……………………………………………. 94 5.3.2.Polimorfisme exon 12 gen lgr8…………………………………………… 95 5.3.3.Polimorfisme exon 13 gen lgr8……………………………………………. 98 5.4.Kadar Hormon INSL3 ……………………………………………………… 104 5.5.Kadar Hormon Estradiol …………………………………………………… 105 BAB VI PEMBAHASAN………………………………………………………………… 107 6.1.Frekuensi Polimorfisme …………………………………………………….. 110 6.2.Polimorfisme Exon 1,Exon 2 Gen insl3 dan Kriptorkismus ………………. 112 6.3.Polimorfisme Exon 8, Exon 12, Exon 13 Gen lgr8 dan Kriptorkismus ……. 115 6.4.Kadar Hormon INSL3, Hormon Estradiol dan Kriptorkismus …………….. 117 6.5. Hubungan Polimorfisme Gen insl3, Kadar Hormon Estradiol Plasma yang Tinggi, Kadar Hormon INSL3 Plasma yang Rendah dan Adanya Polimorfisme Gen lgr8 dengan Kejadian Kriptorkismus ………………….. 120 6.6.Kebaharuan Penelitian ( Novelty) ………………………………………… 125 6.7.Keterbatasan Penelitian ……………………………………………………. 126 BAB VII SIMPULAN DAN SARAN ………………………………………………… 127 7.1.Simpulan ……………………………………………………………………. 127 7.2.Saran ……………………………………………………………………….. 128 DAFTAR PUSTAKA …………………………………………………………………… 129 xii 9.Halaman Daftar Tabel Halaman Tabel 2.1 Kadar hormon pada anak-anak dan pubertas ………………………………… 15 Tabel 2.2 Perbandingan Undescended testis, testis ektopik dan testis retraktil ………… 54 Tabel 5.1 Karakteristik Subyek Penelitian Kelompok Kasus dan Kelompok Kontrol ... 86 Tabel 5.2 Jenis dan Lokasi Kriptorkismus pada Kelompok Kasus …………………….. 86 Tabel 5.3 Frekuensi Polimorfisme Gen Insl3, Gen lgr8 pada Kelompok Kasus dan Kontrol ………………………………………………………………….. 87 Tabel 5.4 Hubungan antara Frekuensi Polimorfisme Exon 1 Gen Insl3 dan Kejadian Kriptorkismus pada Anak Laki laki …………………………………………. 90 Tabel 5.5 Hubungan antara Frekuensi Polimorfisme Exon 2 Gen Insl3 dan Kejadian Kriptorkismus pada Anak Laki-laki …………………………………………. 93 Tabel 5.6 Hubungan antara Frekuensi Polimorfisme Exon 12 Gen lgr8 dan Kejadian Kriptorkismus pada Anak Laki-laki………………………………………….. 97 Tabel 5.7 Hubungan antara Frekuensi Polimorfisme Exon 13 Gen lgr8 dan Kejadian Kriptorkismus pada Anak pada Laki-laki …………………………………… 102 Tabel 5.8.1 Beda Kadar Hormon INSL3 Plasma antara Kasus dan Kontrol pada Anak Laki-laki ……………………………………………………………………. 104 Tabel 5.8.2 Beda Frekuensi Kadar Hormon INSL3 Plasma yang Rendah antara Kasus dan Kontrol pada Anak Laki-laki …………………………………………. 104 Tabel 5.9.1 Beda Kadar Hormon Estradiol Plasma antara Kasus dan Kontrol pada Anak Laki-laki …………………………………………………………… 105 Tabel 5.9.2 Beda Frekuensi Kadar Hormon Estradiol Plasma yang Tinggi antara Kasus dan Kontrol pada Anak Laki-laki …………………………………… 106 xiii 10.Halaman Daftar Gambar Halaman Gambar 2.1 Kelainan enzim pada biosintesis testosterone …………………………… 15 Gambar 2.2 Susunan asam amino estradiol 17-beta-dehydrogenase 1 ……………….. 19 Gambar 2.3 Peran hormon INSL3 pada penurunan testis ……………………………. 20 Gambar 2.4 Susunan asam amino hormon INSL3 …………………………………… 22 Gambar 2.5 Susunan asam amino reseptor LGR8 ……………………………………. 23 Gambar 2.6 Penurunan testis transabdominal dan transinguinal ………………………. 25 Gambar 2.7 Peran gubernakulum pada penurunan testis………………………………. 26 Gambar 2.8 Migrasi testis transabdominal ……………………………………………. 29 Gambar 2.9 Migrasi testis transinguinal ………………………………………………. 30 Gambar 2.10 Struktur gen ……………………………………………………………… 33 Gambar 2.11 Bentuk normal exon 1 gen Insl3 …………………………………………. 34 Gambar 2.12 bentuk normal exon 2 gen Insl3 …………………………………………. 35 Gambar 2.13 Bentuk normal exon 8 gen Lgr8 …………………………………………. 37 Gambar 2.14 Bentuk normal exon 12, exon 13 gen Lgr8 ……………………………… 38 Gambar 2.15 Single nucleotide polymorphism (SNPs)…………………………………. 43 Gambar 2.16 Mikrosatelit ………………………………………………………………. 44 Gambar 2.17 Minisatelit ……………………………………………………………….. 45 Gambar 2.18 Indel ……………………………………………………………………… 46 Gambar 2.19 Diagnosis dan terapi pada UDT ………………………………………….. 60 Gambar 3.1 Kerangka Berpikir…………………………………………………………. 64 Gambar 3.2 Konsep Penelitian ……………………………………………………….. 65 Gambar 4.1 Bagan Rancangan penelitian observasional dengan case control study …... 67 Gambar 4.2 Bagan alur penelitian ……………………………………………………… 76 xiv Gambar 4.3 Skema pengambilan darah ……………………………………………….. 79 Gambar 5.1 Hasil PCR exon 1 gen insl3 (panjang 451 pasang basa) …………………. 88 Gambar 5.2 Sequenzing exon 1 gen insl3 normal dan polimorfisme T60T(ACCNCC) 89 Gambar 5.3 Frekuensi Polimorfisme Exon 1 Gen insl3 ………………………………. 91 Gambar 5.4 Hasil PCR exon 2 gen insl3 (panjang 455 pasang basa)…………………. 92 Gambar 5.5 Sequenzing exon 2 gen insl3 normal dan polimorfisme E146E (GAGNAG) ……………………………………………………………. 92 Gambar 5.6 Hasil PCR exon 8 gen lgr8 (panjang 229 pasang basa) ………………..…. 94 Gambar 5.7 Sequenzing exon 8 gen lgr8 normal dan polimorfisme kdstp223M (AGAANA) …………………………………………………………… 95 Gambar 5.8 Hasil PCR exon 12-13 gen lgr8 ( panjang 439 pasang basa) …………….. 96 Gambar 5,9 Sequenzing exon 12 gen lgr8 normal dan polimorfisme E319E( GAAGAG) L331L (CTACTG) …………………………………………………….. 96 Gambar 5.10 Frekuensi Polimorfisme E319E, L331L Exon 12 Gen lgr8 ……………… 98 Gambar 5.11 Sequenzing exon 13 gen lgr8 normal dan polimorfisme S337A (TCAGCA), H345P (CACCCC) ……………………………………………………. 101 Gambar 5.12 Sequenzing exon 13 gen lgr8 normal dan polimorfisme Q356P (CAGCCG), S357S (TCTTCC) …………………………………………………….. 101 Gambar 5.13 Frekuensi Polimorfisme S337A, H345P, Q356P, S357S Exon 13 Gen lgr8 103 Gambar 5.14 Kurve ROC Kadar Hormon INSL3 Plasma ……………………………… 105 Gambar 5.15 Kurve ROC Kadar Hormon Estradiol Plasma ………………………….. 106 xv 11. Halaman Daftar Singkatan AMH = Anti Mullerian Hormone BMI = Body mass index CGRP = Calcitonin gen-related peptide CSL = Cranial Suspensari Ligament DHT = Dehydrotestosterone DNA = Deoxy nuckeic acid dNTP = Deoxyribonucleosida triphosphate EIA = Enzym immune antibody ELISA = Enzyme-linked immune-sorbent assay FSH = Follicle Stimulating Hormone GABA = Gamma Amino Buteric Acid GFN = Genitofemoral nerve GnRH = Gonadotropin Releasing Hormone hCG = Human Chorionic gonadotropin HHG = Hipothalamus Hipofise Gonad HRD = Horse radice peroxidase INSL3 = Leydig Insulin Like hormone/ Insulin 3 Hormone Sel Leydig insl3 = Gen Leydig insulin like hormone JAK3 = Jenis Kinase3 LGR8 = Reseptor Leucine-rich repeat-contaiing G Protein Coupled Receptor 8 lgr8 = Gen leucine-rich repeat-contaiining G Protein Coipled Receptor 8 LH = Luteinizing Hormone LHRH = Luteinizing Hormone Releasing Hormone MIS = Mullerian Inhibitory Substance mRNA = Mesennger Ribo nucleic acid xvi PCR = Polymerase chain reaction RLF = Relaxin-like factor RLFP = Restriction fragment lengt polymorphism Sf1 = Steriogenic factor 1 SNPs = Singe nucleotide Polymorfhisms SSR = Simple skuenzing repeate TMB = Tio metal benzidine tRNA = Tranfer Ribonucleic Acid UDT = Undescended testicle wt1 = Willem tumor 1 xvii 12.Halaman Daftar Lampiran HASIL SEQUENZING EXON 1 GEN Insl3 HASIL SEQUENZING EXON 2 GEN Insl3 HASIL SEQUENZING EXON 8 GEN Lgr8 HASIL SEQUENZING EXON 12-13 GEN Lgr8 ANALISIS STATISTIK DATA KARAKTERISTIK SUBYEK PENELITIAN DATA POLIMORFISME EXON 1, 2 GEN insl3, EXON 8, 12, 13 GEN lgr8 KADAR HORMON INSL3 PLASMA, HORMON ESTRADIOL PLASMA PADA SAMPEL TIME TABLE PENELITIAN KUISIONER PENELITIAN INFORMASI MENGENAI PENELITIAN KEPADA ORANG TUA RESPONDEN PERNYATAAN KESEDIAAN MENJADI RESPONDEN KETERANGAN KELAIKAN ETIK ( ETHICAL CLEARANCE ) SOP PENGAMBILAN SAMPEL DARAH SOP PEMERIKSAAN DNA DAFTAR PENELITIAN xviii 1 BAB I 1.1 PENDAHULUAN Latar Belakang Lokasi testis dalam skrotum sangat diperlukan untuk proses spermatogenesis dan fungsi epididimis, karena suhunya yang lebih rendah 1,5-2,0 derajat C dibandingkan dengan suhu tubuh. Dengan adanya testis dalam skrotum pemantauan ke arah keganasan testis dapat dilakukan dan adanya hernia inguinalis dapat dicegah di samping untuk pemantauan kesehatan yang lainnya. Pada saat bayi dilahirkan dalam keadaan normal kedua testis sudah berada di skrotum, bila kedua testis pada saat bayi lahir belum ada di skrotum akan menjadi problem untuk kesehatan selanjutnya. Turunnya testis dari rongga abdomen ke skrotum terjadi selama kehamilan, dan penurunan itu dipengaruhi oleh faktor hormonal dan faktor mekanik (Wales dkk, 2003). Pada tikus pertumbuhan gubernakulum dipengaruhi secara langsung oleh Leydig insulin like hormone (INSL3), regresi cranial suspensory ligament (CSL) dan penebalan gubernakulum menghasilkan migrasi transabdominal, yang mana membawa testis pada cincin inguinalis interna pada usia 3 bulan kehamilan. Fase penurunan testis transabdominal ini lebih banyak terjadi pada saat embrio (Kaefer, 2004). Pada fase migrasi transinguinal penurunan testis dimulai bulan ke 7 kehamilan dan sudah komplit pada akhir trimester 3 kehamilan. Antara bulan ke 7 dan ke 9 kehamilan testis cepat masuk ke kanalis inguinalis, kemudian secara perlahan-lahan ke skrotum. Selama waktu ini terjadi regresi gubernakulum yang dipengaruhi hormon testosteron dan diikuti persistennya ligamen gubernakulum. Secara normal prosesus vaginalis menutup komplit sebelum bayi lahir, tetapi apabila testis tidak turun maka prosesus vaginalis biasanya 1 2 masih menetap. Pada prematuritas sering diikuti penurunan testis secara inkomplit dan penutupan prosesus vaginalis bersifat sementara. Penurunan testis pascanatal pada kriptorkismus terjadi sampai usia 1 tahun, namun penurunan terbanyak terjadi selama usia 3 bulan pertama (Wales dkk., 2003; Kaefer, 2004; McGlynn dkk., 2005). Kriptorkismus merupakan kelainan saluran genitourinaria berupa tidak sempurnanya penurunan testis ke dalam skrotum, testis yang tidak turun ke skrotum dapat berada pada saluran yang normal di antara ginjal dan bagian dalam skrotum (Kaefer, 2004); atau testis terletak pada salah satu tempat sepanjang jalur desensus yang normal, tetapi tidak mencapai tempat kedudukannya yang normal di dalam skrotum (Styne, 2002). Pada bayi prematur insiden kriptorkismus ditemukan 30% dari bayi laki-laki yang prematur, insiden ini menurun menjadi 3 - 5% pada bayi yang lahir cukup bulan, kemudian pada usia 3 bulan insidennya menjadi 1-3% dan pada usia 1 tahun insiden tinggal 0,8% (Kaefer, 2004; Acerini dkk., 2009). Setelah usia 3 bulan insiden kriptorkismus bisa meningkat lagi karena adanya acending testis yang jumlahnya hampir seimbang dengan jumlah kriptorkismus testis kongenital (Acerini dkk., 2009; Sijstermans dkk., 2008; Toppari, 2009; Wohlfart-Veje dkk., 2009). Penelitian Virtanen dan Toppari tahun 2008 didapatkan insiden kriptorkismus 2-9% dari bayi laki-laki yang lahir cukup bulan dan insidennya juga ditemukan meningkat pada bayi prematur. Penelitian di Inggris pada bayi laki-laki yang lahir cukup bulan ditemukan insiden kriptorkismus meningkat dua kali dari tahun 1905 ke tahun 1980. Secara regional ada perbedaan yang bermakna antara satu Negara dengan Negara lainnya di mana insiden kriptorkismus paling rendah di Finlandia dan tertinggi di Denmark dan perbedaan ini 3 sebagian besar disebabkan oleh faktor lingkungan ( Toppari dkk., 2001). Kaefer tahun 2004 mengatakan kriptorkismus unilateral insidennya dua kali kriptorkismus bilateral, kriptorkismus dektra insidennya dua kali yang sinistra. Komplikasi kriptorkismus berupa infertilitas, keganasan, hernia inguinalis, torsi testis dan masalah psikologis. Insiden azoospermia lebih tinggi pada kelompok kriptorkismus bilateral daripada unilateral dan keadaan semen lebih baik pada yang unilateral (Moldenhauer dkk., 2003; Moretti dkk., 2007). Leydig insulin like hormone atau INSL3 merupakan faktor auto-parakrin yang menyebabkan formasi gubernakulum menjadi normal, dan formasi gubernakulum menentukan turunnya testis. Pada tikus percobaan dilesi gen insl3 menyebabkan kriptorkismus. Pada manusia polimorfisme gen insl3 banyak ditemukan tetapi hubungannya dengan kriptorkismus masih belum jelas ( Toppari dkk., 2001). Kekacauan genetik gen insl3 atau reseptornya gen lgr8 yang ada pada gubernakulum pada tikus percobaan menyebabkan tingginya kriptorkismus intraabdominal. Analisis mutasi gen insl3 dan gen lgr8 pada pasien kriptorkismus hanya ditemukan beberapa mutan dan khusus pada allel dengan single nucleotide polymorphysm (SNPs). Jadi dasar genetik dari kriptorkismus pada manusia masih tidak jelas (The Endocrine society, 2005). Adapun faktor risiko kriptorkismus adalah bayi lahir prematur dan bayi lahir berat badan rendah. (Virtanen & Toppari., 2008). Canto dkk (2003) melakukan 2 penelitian yaitu pertama dengan melakukan transgenik tikus dengan target dilesi gen insl3 menyebabkan terjadinya kriptorkismus bilateral. Penelitian kedua dari 150 pasien dengan kriptorkismus idiopatik diobservasi gen insl3 dan ditemukan mutasi misen pada exon 2, di mana terjadi substitusi nukleotida 4 2560, dan perubahan asparagin menjadi lisin pada codon 86, mutasi ini terletak pada rantai A protein INSL3. Pada penelitian ini ditemukan juga tiga polimorfisme pada exon 1 dari gen insl3. Penelitian Krausz dkk (2000) di Paris dengan melakukan sequenzing gen insl3 pada 31 anak laki-laki yang menderita kriptorkismus idiopatik unilateral dan bilateral, hanya ditemukan variasi perubahan asam amino pada molekul C peptide. Namun perubahan ini ditemukan juga pada anak yang dipakai kontrol. Penelitian Bogatcheva dkk (2003) mendapatkan mutasi exon 1 dan exon 2 gen insl3 yaitu pada P49S, P93L, R102C, N110K, R102H dan R73X. Penelitian Lim dkk (2001) dan Garlov dkk (2002) di Denmark menemukan tidak adanya kesuaian polimorfisme gen insl3 pada A 36T dengan isolated kriptorkismus. Ferlin dkk (2003) menemukan satu mutasi missen T222P pada exon 8 gen lgr8, pada 4 kasus anak dengan kriptorkismus namun pada kontrol tidak ditemukan mutasi. Keempat kasus yang mengalami mutasi menunjukkan fenotip yang berbeda-beda. Pada gen lgr8 ditemukan juga polimorfisme baik pada exon maupun pada intron, namun polimorfisme ini juga ditemukan pada kelompok kontrol. Adapun polimorfisme gen lgr8 ditemukan pada intron 2, exon 3 (261G>A) namun asam aminonya tetap (A87A), intron 4, exon 12 ( 957 G>A) dengan asam amino ( E319E), exon 12 ( 993A>G) dengan asam amino (L331L), intron 12, exon 12 berdekatan dengan exon13, exon 17 (1810 A>G) dengan asam amino (I160V) dan exon 18. Pada tikus, pemberian hormon estrogen dapat menghambat proses penurunan testis transabdominal. Pada ibu hamil yang mendapat pengobatan estrogen sintetik 5 (diethylstilbestrol) menunjukkan peningkatan insiden kriptorkismus pada anak lakilakinya (Kaefer, 2004). Penurunan testis secara signifikan dihambat oleh hormon estradiol atau diethylstilbesterol (estrogen non steroid). Pengaruh estrogen diperkirakan sebagai mediasi penekanan perkembangan sel leydig pasien yang menghasilkan penurunan produksi testosteron dan INSL3. Sebagai alternatif estrogen dapat secara langsung mempengaruhi perkembangan CSL dan gubernaculum (The Endocine society, 2005). Penelitian di Denmark menunjukkan ekspresi INSL3 secara substansi menurun oleh obat diethylstilbesterol ( Ferline dkk., 2003 ). Alat reproduksi laki-laki mengalami gangguan oleh xenobiotik dan khususnya xenoestrogen dimana fetus dan testis neonatus sangat sensitif terhadap estrogen karena terjadi inaktisipasi estrogen reseptor alfa, meningkatkan steriodogenesis dan inaktivasi estrogen reseptor beta (Delbes dkk., 2006 ). Penelitian pada tikus yang diobati dengan diethylstilbesterol kasus kriptorkismus ditemukan meningkat, ini terjadi karena adanya peningkatan inkomplit dari INSL3/RLF mRNA pada testis fetus. Hormon estrogen dapat menurunkan regulasi produksi INSL3 dan penurunan kinerja INSL3 (Main dkk., 2006 ). McGlynn dkk (2005) mendapatkan peningkatan estrogen ibu hamil tidak berhubungan dengan meningkatnya risiko kriptorkismus dan kemungkinan berhubungan dengan menurunnya risiko kriptorkismus. Dari uraian di atas dapat dikatakan kriptorkismus kasusnya cukup tinggi dan sebagian masih dapat turun spontan terutama pada usia 3 bulan pertama kelahiran, di samping itu insiden kriptorkismus meningkat dari tahun ke tahun dan ada perbedaan insiden antara satu Negara dengan negara lainnya. Kriptorkismus merupakan kelainan kongenital yang menjadi faktor risiko dan penyebab mayor terjadinya infertilitas dan keganasan testis di samping faktor risiko lainnya pada usia dewasa (The Endocrine 6 society, 2005). Kriptorkismus disebabkan oleh multifaktorial dan penyebab pasti masih belum jelas. Sampai saat ini belum ada data frekuensi polimorfisme gen insl3 dan gen lgr8, penelitian yang menghubungkan antara polimorfisme pada (exon 1, exon 2) gen insl3, polimorfisme pada (exon 8, exon 12, exon 13) gen lgr8 dengan kriptorkismus pada manusia belum ada. Begitu juga dengan penelitian yang menghubungkan kadar hormon estradiol plasma, kadar hormon INSL3 plasma dengan kriptorkismus pada manusia belum ada. 1.2 Rumusan Masalah Berdasarkan latar belakang di atas dapat dirumuskan masalah penelitian sebagai berikut : 1. Berapa frekuensi polimorfisme (exon 1, exon 2) gen insl3, ( exon 8, exon 12, exon 13 ) gen lgr8 pada anak laki-laki yang kriptorkismus ? 2. Apakah polimorfisme ( exon 1, exon 2) gen insl3 merupakan faktor risiko kejadian kriptorkismus pada anak laki-laki ? 3. Apakah polimorfisme (exon 8, exon 12, exon 13) gen lgr8 merupakan faktor risiko kejadian kriptorkismus pada anak laki-laki ? 4. Apakah kadar hormon INSL3 plasma yang rendah merupakan faktor risiko kejadian kriptorkismus pada anak laki-laki ? 5. Apakah kadar hormon estradiol plasma yang tinggi merupakan faktor risiko kejadian kriptorkismus pada anak laki-laki ? 7 1.3 Tujuan Penelitian 1.3.1 Tujuan umum Mengetahui frekuensi polimorfisme dan faktor – faktor risiko kejadian kriptorkismus pada anak laki-laki. 1.3.2 1. Tujuan khusus Mengetahui frekuensi polimorfisme (exon 1, exon 2) gen insl3, polimorfisme (exon 8, exon 12, exon 13 ) gen lgr8 pada anak laki-laki yang kriptorkismus. 2. Membuktikan polimorfisme (exon 1, exon 2) gen insl3 sebagai faktor risiko kejadian kriptorkismus pada anak laki-laki. 3. Membuktikan polimorfisme ( exon 8, exon 12, exon 13) gen lgr8 sebagai faktor risiko kejadian kriptorkismus pada anak laki-laki. 4. Membuktikan kadar hormon INSL3 plasma yang rendah sebagai faktor risiko kejadian kriptorkismus pada anak laki-laki. 5. Membuktikan kadar hormon estradiol plasma yang tinggi sebagai faktor risiko kejadian kriptorkismus pada anak laki-laki. 8 1.4 Manfaat Penelitian 1.4.1 Manfaat akademik / teoritis Untuk mendapatkan data dasar frekuensi polimorfisme (exon 1,exon 2) gen insl3, (exon 8, exon 12, exon 13) gen lgr8 pada anak laki-laki yang kriptorkismus. Bila terbukti polimorfisme (exon 1, exon 2) gen insl3, (exon 8, exon 12, exon 13) gen lgr8 sebagai faktor risiko kriptorkismus pada anak laki-laki, akan menambah kasanah teoritis bahwa polimorfisme ( exon 1, exon 2) gen insl3 dan ( exon 8, exon 12, exon 13) gen lgr8 akan mempengaruhi kadar hormon INSL3 dan mengurangi kemampuan hormon INSL3 dalam merangsang pertumbuhan gubernakulum. Bila terbukti hormon estradiol plasma yang tinggi sebagai faktor risiko kriptorkismus pada anak laki-laki, akan memperkuat teori hormon estradiol plasma yang tinggi menghambat pertumbuhan gubernakulum. 1.4.2 Manfaat praktis Bila terbukti Polimorfisme (exon 1, exon 2) gen insl3, (exon 8, exon 12, exon 13) gen lgr8 sebagai faktor risiko kriptorkismus pada anak laki-laki, ini bisa menjadi marker dalam target terapi hormon hCG dan untuk meramalkan prognosis. Bila terbukti hormon estradiol plasma yang tinggi sebagai faktor risiko kriptorkismus pada anak laki-laki, bisa disarankan untuk menghindarkan diri dari paparan hormon estradiol pada saat ibu hamil. 9 BAB II KAJIAN PUSTAKA 2.1 Gonadotropin-Releasing Hormon dan Gonadotropin Hipotalamus memproduksi gonadotropin-releasing hormone (GnRH), yang merangsang kelenjar hipofise anterior memproduksi luteinizing hormone (LH) dan folliclestimulating hormone (FSH). LH merangsang sel Leydig dalam testis untuk menghasilkan testosteron, dan FSH meningkatkan reseptor LH pada membrane sel Leydig. Bila terdapat gangguan pada tingkat hipotalamus pada sintesis gonadotropin releasing hormone seperti pada sindrom Kallman, sindrom Prader Willi, anencephali maka akan terjadi hipogonad. Hipotalamus dalam memproduksi GnRH dipengaruhi oleh, gamma amino buteric acid (GABA), hormon leptin, kelaparan, infeksi kronis dan tekanan psikososial (Kaefer, 2004). Pengukuran kadar FSH dan LH basal sering dilakukan pada saat evaluasi biokimia pertama kali untuk menilai aksis hipotalamus-hipofise- gonad (Muller, 2003). 2.2 Gonad 2.2.1 Embriyogenesis gonad Formasi gonad dimulai pada usia bayi lima bulan kehamilan dan potensial gonad terdiri dari epithel coelomic dan medial mesencym mesonefros. Dua sel penting dari testis dapat diidentifikasi pada usia kehamilan 8 minggu yaitu : sel Sertoli yang terletak pada garis tubulus seminiferus, dan sel Leydig yang terletak pada jaringan interstitiil. Hormon pertama yang dihasilkan oleh sel Sertoli adalah mullerian inhibitory substance (MIS, juga dikenal sebagai anti mullerian hormone atau AMH) . Sekresi dari MIS menyebabkan involusi system duktus muleri ipsilateral. Interstitial sel Leydig menghasilkan testosteron 9 10 yang dimulai pada usia 9 minggu kehamilan. Produksi testosteron meningkat dengan cepat dan kadar tertingginya pada usia 15 sampai 18 minggu kehamilan dan kemudian setelah itu kadar testosteron menurun sampai kelahiran, produksi testosteron dipengaruhi oleh enzim 3β-hydroxysteroid dehydrogenase. Walaupun human chorionic gonadotropin (hCG) tidak dibutuhkan untuk memulai fungsi sel Leydig, namun hCG mempertahankan rangsangan steroidogenesis pada hamil muda. Ketika kadar hCG menurun pada trimester tiga kehamilan, aksis hipotalamus-hipofise mempertahankan kontrol produksi testosteron. Tidak ada atau tidak sempurnanya aksis hipotamaus-hipofise menyebabkan kegagalan perkembangan genitalia pada fetus. Testis fetus harus mampu mempertahankan produksi testosteron yang tinggi selama beberapa minggu sampai lengkapnya defrensiasi traktus genitalia. Pada saat lahir kadar testosteron plasma lebih tinggi pada bayi laki-laki dibanding bayi perempuan. Sesaat setelah lahir, plasma testosteron meningkat lagi kedua kalinya akibat rangsangan aksis hipotalamus-hipofise-gonad. Kadar yang tinggi ini bertahan selama 3 bulan, setelah 3 bulan kadarnya menurun lagi sampai mulainya pubertas. 2.2.2 Hipospadia dan kordae Hipospadia merupakan tidak sempurnanya penutupan uretra pada ventral penis yang disebabkan berhentinya perkembangan spongiosum uretra dan bagian ventral penis. Pada anak yang mengalami hipospadia orifisium uretra eksterna tidak terletak pada ujung penis melainkan terletak pada pangkal bagian vental penis. Hipospadia biasanya juga diikuti oleh kordae yang merupakan lipatan kulit yang terbentang antara ventral penis dan skrotum sehingga penis kelihatan melekat pada krotum. Prevalensi hipospadia pada bayi laki-laki yang baru lahir adalah 3-4 kasus per seribu bayi laki-laki yang lahir hidup, sedangkan prevalensi kordae pada penis prevalensinya lebih banyak. Penyebab pasti dari 11 kasus hipospadia sendiri masih belum jelas, dikatakan gen yang berhubungan dengan hipospadia terletak pada kromosom 7q32.2–q36.1. Mutasi gen wil’m tumor 1(Wt1) dikatakan menyebabkan hipospadia. Gen Wt1 dan gen steriogenic factor 1 (Sf1) berfungsi membentuk urogenital ridge, sedangkan bipotensial gonad yaitu pemisahan 46xx dan 46xy dipengaruhi oleh gen Wt1, gen Sf1, gen SRY dan gen Sox 9. Gen Sf1 mengatur sel leydig dalam memproduksi hormon testosteron, dan hormon testosteron berfungsi dalam menstabilisasi struktur duktus wolffian, dikatakan pembentukan struktur duktus wolffian terjadi pada trimester pertama kehamilan, adanya hipospadia dan kordae menandakan tidak sempurnanya pembentukan struktur duktus wolffian pada trimester pertama kehamilan, yang berarti adanya gangguan produksi hormon testosteron pada trimester pertama kehamilan yang kemungkinan disebabkan oleh mutasi salah satu gen di atas (Hughes, 2009). 2.2.3 Mikropenis Mikropenis merupakan kelainan dalam ukuran panjang penis ( dari pangkal penis ke ujung gland penis) dengan ditarik lebih besar dari 2,5 standar deviasi (SD) dibawah panjang penis rata-rata sesuai usia anak, untuk usia neonatus sampai usia 5 bulan dikatakan mikropenis bila panjang penis dibawah 1,9 cm dan juga dikatakan mikropenis bila panjang penis 2,5 cm atau lebih rendah saat penis ditarik (Hughes, 2009). Mikropenis sering berhubungan dengan sindrom sindrom kelainan kongenital. Pertumbuhan penis sangat dipengaruhi oleh kelainan pada biosintesis hormon testosteron dan aktivitas hormon testeosteron. Hormon testosteron dalam merangsang pertumbuhan gitalia eksterna terutama panjang penis dirubah menjadi hormon dehydrotestosterone (DHT) dan gangguan dalam perubahan ini disebabkan kekurangan enzim 5 alfa reduktase, di samping itu hormon 12 testosteron dalam menjalankan aktivitasnya dipengaruhi oleh reseptor testosteron yang ada di penis, kelainan atau mutasi gen reseptor androgen menyebabkan complit androgen insensitivity syndrome (CAIS) dan partial androgen insensitivity syndrome (PAIS). Jadi gangguan pada produksi maupun aktivitas testosteron baik pada bayi dalam kandungan setelah trimester pertama maupun pada masa bayi dan anak akan menyebabkan ukuran penis kecil atau mikropenis (Hughes, 2009). 2.2.4 Hormon testosteron Fungsi hormon testis sangat penting selama kehidupan fetus dalam kandungan. Adanya determinasi kromosom Y pada gonad memberikan efek terjadinya penentuan gender. Selama masa anak-anak sampai usia 6 bulan sebelum mulainya pubertas produksi hormon testosteron minimal. Pada saat pubertas terjadi peningkatan produksi hormon testosteron karena rangsangan dari hormon gonadotropin yang merangsang aktivitas sel Leydig, pada saat pubertas terjadi sekresi inhibin dari tubulus seminiferus. Beberapa kelainan biosistessis kongenital banyak disebabkan kelainan genetik, sebagai contoh kelainan testosteron, kelainan reseptor androgen atau sindroma Kalman (hipogonadotropik hipogonadism). Pada bayi yang maskulin atau kelaki-lakian dapat terjadi kerusakan yang menimbulkan gangguan pada fetus dan fungsi testis pubertas. Pada saat pubertas beberapa kelainan dari fungsi testis dan defek klainan tersebut adalah virilisasi dan maskulin meningkat pada perempuan (Honour & Savage., 2003). Sintesis testosteron dan produksinya pada fetus laki-laki dimulai pada kira-kira usia 8 minggu usia fetus dan kadarnya maksimal pada usia 12 sampai 13 minggu kehamilan. Selama periode kritis dari perkembangan alat genitalia, sekresi sel Leydig terutama 13 disetimulasi oleh hormon yang dihasilkan plasenta berupa hCG (Gallagher & Oberfield., 2004). Di perifer terjadi konversi dari hormon testosteron oleh enzim mikrosomal 5αreduktase menghasilkan circulating dehydrotestosteron, hal ini sangat dibutuhkan juga untuk perkembangan prostat, palus (penis) dan skrotum (Honour & Savage., 2003, Nuver dkk., 2005). Volume testis yang besar dengan kadar inhibin B yang tinggi menunjukkan volume tubulus seminiferus membesar (Main dkk., 2006-a). Penelitian yang dilakukan di Denmark dan Finlandia, di Denmark kasus kriptorkismus dan hipospadianya tinggi diikuti oleh tingginya ca testis, kecilnya volume testis, kadar semen rendah dan kadar inhibin B postnatal juga rendah berlawanan dengan di Finlandia (Main dkk., 2006-b) Secara klinis pemeriksaan perabaan gonad adalah sangat penting, diikuti dengan pemeriksaan laboratorium dari fungsi testis. USG mungkin dapat membantu lokasi testis atau tidak terabanya testis. Kelainan testis unilateral kebanyakan disebabkan kelainan kongenital. Ukuran penis dapat bervarisi mulai dari normal klitoris sampai penis normal (Honour & Savage., 2003). Pada saat lahir konsentrasi plasma testosteron dapat meningkat sampai 15 nmol/L apabila diukur saat ekstraksi. Konsentrasi plasma testosteron menurun setelah minggu pertama kehidupan dan hormon hCG juga hilang dari sirkulasi. Mulai usia 2 minggu sampai 2 bulan setelah lahir konsentrasi plasma testosteron dan dihydrotestosteron meningkat sampai batas di bawah nilai normal dari konsentrasi laki-laki dewasa dan menurun setelah usia 3-4 bulan. LH menstimulasi sekresi testosteron selama periode ini. Pada bayi yang prematur, konsentrasi plasma testosteron sesuai dengan keadaan bayi. Kecepatan dari konsentrasi testosteron pada periode postnatal segera akan meningkat setelah lahir . Selama masa anak-anak kadar testosteron adalah < 1 nmol, dan kadar 14 dehydotestosteron < 0,5 nmol/L dan meningkat secara progresif pada awal pubertas terutama pada malam hari (Honour & Savage., 2003). Pengukuran testosteron pada hari pertama pada male pseudohermaprodite, kadar testosteronnya rendah akan mengidenfikasikan adanya indikasi kerusakan sintesis hormon berupa disgenesis testis dan apabila normal atau meningkat kemungkinan indikasi adanya defek aktivitas androgen perifer. Pada posnatal peningkatan kadar FSH, LH kemungkinan disebabkan androgen insensibility sindrom (AIS). Yang kedua bayi dengan mikropenis kemungkinan menderita sindroma Kallman disertai dengan rendahnya kadar testosteron dan hormon gonadotropin. Testosteron sebaiknya diukur pada usia 3 hari setelah lahir atau selama 3 bulan setelah hari pertamaa ( Honour & Savage., 2003). Selanjutnya diuraikan kelainan enzim pada biosintesis testosteron, serta tabel kadar testosteron, androstenedion, DHT, FSH dan LH 15 Cholesterol 1 3 4 Pregnenolone 2 17-Hydroxypregnenolone 3 2 Progesteron DHA 4 2 17-Hydroxyprogesteron 6 Androstenedione 1=20α-Hydroxylase;22α-Hydroxylase;20,22-desmolase Oestrone 5 2=3β-Hydroxysteroid dehydrogenase 6 Testosteron 3=17α-Hydroxylase 5 Oestradiol 7 4=17,20-Lase Dihydrotestosterone 5=17β-Hydroxysteroid dehydrogenase , 6 = Aromatase, 7 = 5α-Reduktase Gambar 2.1 Kelainan enzim pada biosintesis testosteron, dipetik dari Honour & Savage, 2003 Tabel 2.1 Kadar hormon pada anak-anak dan pubertas, dipetik dari Honour & Savage., 2003 Umur testosteron, nmol/l androstenedion, nmol/l DHT, nmol/l LH, IU/l FSH, IU/l 1-3 hari Naik 12 4-10 1,5-4,5 hCG terukur 0-10 4-7 hari 0,5-3,0 1-2,4 0,1-0,8 0-1 0-5 0,5-4 bln 4-14 0,5-2,5 0,2-4,5 0-1 0-28 5 bln-9 thn 0,2-0,5 0,1-0,7 0,05-2 0-1 0-7 P1 0,1-1 0,5-1,2 0-0,2 0,5-2,5 0,5-3 P2 0,1-2 1-2,5 0,1-0,2 1-4 * 0,5-4 P3 0,3-15* 1,5-3,5 0,2-0,8 1-5 * 2,5-4,5 P4 5-25 1,5-5 0,5-2 2-8 3-5,5 P5 9-32 2-5 0,5-2,5 2-8 2-5,5 * konsentrasi sebelum jam 10 pagi, peak ditemukan selama malam hari 16 2.2.5 Anti mullerian hormone (AMH) Anti-mullerian hormone (AMH) atau Mullerian inhibiting substance (MIS) berupa glikoprotein dihasilkan oleh sel sertoli sangat esensial untuk deferensiasi normal dari alat genitalia laki-laki, karena aktivitas AMH menekan perkembangan struktur duktus mulleri (Honour & Savage., 2003). AMH ini berperan pada fase penurunan testis transabdominal. Apabila terjadi kelainan genetik pada gen AMH atau reseptornya akan terjadi duktus muleri persisten, testis tidak turun disertai gubernakulum tipis dan mengalami elongasi, namun pengaruh AMH pada pertumbuhan gubernakulum minimal (Foresta dkk., 2008). 2.2.6 Genitofemoral nerve (GFN) dan Calcitonin gen-related peptide (CGRP) Selain hormon testis, genitofemoral nerve (GFN) mempunyai fungsi yang sangat penting dalam menghasilkan neurotransmitter calcitonin gen-related peptide (CGRP) (Bajpai&Menon.,2008). GFN diperlukan dalam maskulinisasi dan CGRP diperlukan untuk kontraksi ritmik gubernakulum, karena reseptor CGRP ditemukan pada gubernakulum. Testosteron yang dihasilkan oleh sel leydig testis mempunyai efek maskulinisasi pada nucleus sensoris dari GFN (Ganglia L1 dan L2), selanjutnya mensintesis dan mengeluarkan CGRF dari ujung saraf sensoris dan GFN diperlukan pada penurunan testis transinguinal, begitu juga pengobatan dengan antiandrogen (flutamide) saat hamil dapat menurunkan secara signifikan CGRP pada tikus laki-laki ( Foresta dkk., 2008). 17 2.2.7 Hormon estradiol Hormon estradiol diketahui mempunyai potensi sebagai regulator reproduksi lakilaki dan kematian sel germinal. Hormon estradiol dapat menimbulkan gangguan pada konsentrasi sirkulasi hormon gonadotropin dan testosteron, selanjutnya menyebabkan apoptosis pada sel germinal secara tidak langsung (Pentikainen dkk., 2003). Xenobiotik khususnya xenoestrogen dapat mengganggu alat reproduksi laki-laki, xenoestrogen konsentrasinya tinggi dalam lingkungan dan makanan, secara epidemiologi, klinis dan penelitian eksperimen diperkirakan terpapar secara berlebihan oleh estrogen dan xenoestrogen. Selama masa fetus dan perkembangan neonatal estrogen bisa merangsang kelainan perkembangan testis dan memicu kejadian fertilitas pada dewasa. Penelitian ini menjelaskan testis fetus dan neonatus sangat sensitif terhadap estrogen, inaktivasi estrogen reseptor alfa meningkatkan steriogenesis dan inaktivasi estrogen reseptor beta meningkatkan perkembangan sel germinal (Delbes dkk., 2006; Cederroth dkk., 2007). Toppari (2003) mengatakan hormon estrogen menekan regulasi gen Insl3 dan akan bisa menyebabkan kriptorkismus pada beberapa kasus. Penurunan testis secara signifikan dihambat oleh hormon estradiol atau diethylstilbesterol (estrogen non steroid), pengaruh estradiol diperkirakan sebagai mediasi penekanan perkembangan sel leydig pasien dan menyebabkan menurunnya produksi hormon testosteron dan hormon INSL3 (The endocrine society, 2005). Penelitian pada tikus yang diobati dengan diethylstilbesterol saat hamil kasus kriptorkismus ditemukan meningkat, diperkirakan adanya estrogen dalam fetus dapat menimbulkan penekanan ekspresi INSL3 dan adanya estrogen dalam testis menyebabkan feedbac inhibisi terhadap 18 axis hipothalamus hipofise gonad sehingga terjadi hipoandrogenisme (Ivell & Hartung., 2003). Thonneau dkk (2003) mendapatkan pencemaran lingkungan oleh bahan- bahan yang mengandung estrogen atau anti androgen akan mempengaruhi kesehatan reproduksi laki-laki. Watanabe dkk (2007) mengatakan gen estrogen reseptor 1 dapat meningkatkan kepekaan perkembangan kelainan alat genitalia laki-laki dihubungkan dengan responnya terhadap hormon estrogen. Menurut Delbes dkk ( 2005) estrogen reseptor α merupakan mediasi yang menghambat secara invivo pengaruh estrogen endogen pada perkembangan steriodogenesis testis selama fase janin dan neonatus pada tikus percobaan, karena produksi androgen merupakan satu-satunya kunci dari mekanisme difrensiasi testis lakilaki di samping diperlukan untuk pertumbuhan traktus reproduksi. Hal ini mendukung hipotesis fetus dan neonatus yang terpapar dengan lingkungan xenoestrogen dapat mengganggu maskulinisasi sistem urogenital laki-laki dan fertilitas pada laki-laki dewasa. Penghambatan biosintesis estrogen pada kriptorkismus unilateral pada binatang percobaan dengan kadar estrogen testis yang tinggi, bisa memperbaiki secara signifikan pengaruh estrogen pada fungsi testis. Pada penelitian Galan dkk (2007) menemukan Polimorfisme estrogen reseptor 1 dan polimorfisme single nukleotida 12 tidak berhubungan dengan infertilitas laki-laki yang berat, padahal pada populasi di Italia diperkirakan estrogen reseptor 1 dan single nukletida polimorfisme 12 mempunyai efek protektif pada kriptorkismus. Selanjutnya diuraikan gambaran susunan asam amino hormon estradiol 17beta-dehydrogenase sebagai berikut: 19 1 61 121 181 241 301 martvvlitg etlqldvrds rmlqaflpdm lsliecgpvh fltalrapkp gagpgaedea cssgiglhla ksvaaarerv krrgsgrvlv tafmekvlgs tlryftterf grgavgdpel vrlasdpsqs tegrvdvlvc tgsvgglmgl peevldrtdi lpllrmrldd gdppaapq fkvyatlrdl naglgllgpl pfndvycask htfhrfyqyl psgsnyvtam ktqgrlweaa ealgedavas faleglcesl ahskqvfrea hrevfgdvpa ralacppgsl vldvnvvgtv avlllpfgvh aqnpeevaev kaeagaeagg Atau 1 Met-Ala-Arg-Thr-Val-Val-Leu-Ile-Thr-Gly-Cys-Ser-Ser-Gly-Ile-Gly-Leu-His-Leu-Ala21 Val-Arg-Leu-Ala-Ser-Asp-Pro-Ser-Gln-Ser-Phe-Lys-Val-Tyr-Ala-Thr-Leu-Arg-Asp-Leu41 Lys-Thr-Gly-Gly-Arg-Leu-Trp-Glu-Ala-Ala-Arg-Ala-Leu-Ala-Cys-Pro-Pro-Gly-Ser-Leu61 Glu-Thr-Leu-Gln-Leu-Asp-Val-Arg-Asp-Ser-Lys-Ser-Val-Ala-Ala-Ala-Arg-Glu-Arg-Val81 Thr-Glu-Gly-Arg-Val-Asp-Val-Leu-Val-Cys-Asn-Ala-Gly-Leu-Gly-Leu-Leu-Gly-Pro-Leu101 Glu-Ala-Leu-Gly-Glu-Asp-Ala-Val-Ala-Ser-Val-Leu-Asp-Val-Asn-Val-Val-Gly-Thr-Val121 Arg-Met-Leu-Gln-Ala-Phe-Leu-Pro-Asp-Met-Lys-Arg-Arg-Gly-Ser-Gly-Arg-Val-Leu-Val141 Thr-Gly-Ser-Val-Gly-Gly-Leu-Met-Gly-Leu-Pro-Phe-Asn-Asp-Val-Tyr-Cys-Ala-Ser-Lys161 Phe-Ala-Leu-Glu-Gly-Leu-Cys-Glu-Ser-Leu-Ala-Val-Leu-Leu-Leu-Pro-Phe-Gly-Val-His181 Leu-Ser-Leu-Ile-Glu-Cys-Gly-Pro-Val-His-Thr-Ala-Phe-Met-Glu-Lys-Val-Leu-Gly-Ser201 Pro-Glu-Glu-Val-Leu-Asp-Arg-Thr-Asp-Ile-His-Thr-Phe-His-Arg-Phe-Tyr-Gln-Tyr-Leu221 Ala-His-Ser-Lys-Gln-Val-Phe-Arg-Glu-Ala-Ala-Gln-Asn-Pro-Glu-Glu-Val-Ala-Glu-val241 Phe-Leu-Thr-Ala-Leu-Arg-Ala-Pro-Lys-Pro-Thr-Leu-Arg-Tyr-Phe-Thr-Thr-Glu-Arg-Phe261 Leu-Pro-Leu-Leu-Arg-Met-Arg-Leu-Asp-Asp-Pro-Ser-Gly-Ser-Asn-Tyr-Val-Thr-Ala-Met281 His-Arg-Glu-Val-Phe-Gly-Asp-Val-Pro-Ala-Lys-Ala-Glu-Ala-Gly-Ala-Glu-Ala-Gly-Gly301 Gly-Ala-Gly-Pro-Gly-Ala-Glu-Asp-Glu-Ala-Gly-Arg-Gly-Ala-Val-Gly-Asp-Pro-Glu-Leu321 Gly-Asp-Pro-Pro-Ala-Ala-Pro-Gln Gambar 2.2 Susunan asam amino estradiol 17-beta-dehydrogenase 1, dipetik dari NCBI estradiol, 2010 2.2.8 Hormon INSL3 Sel leydig memproduksi dua hormon yang penting untuk penurunan testis ke kantong skrotum. Yang pertama hormon testosteron yang diperlukan untuk involusi dari ligamen suspensori kranial dan untuk migrasi testis transinguinal. Yang kedua hormon INSL3 disebut juga relaxin-like factor (RLF) yang merangsang pertumbuhan gubernakulum (Toppari, 2003). Hormon INSL3 merupakan hormon peptida yang baru dari relaxin-insulin family. Pada mamalia laki-laki hormon INSL3 merupakan produksi mayor sel Leydig testis dan pada testis dewasa ekspresi hormon INSL3 merupakan marker yang baik untuk mengetahui fungsi sel leydig . Hormon INSL3 ekspresinya melemah pada sel leydig prepubertas yang immatur atau sel leydig yang mengalami 20 hypertropi atau perubahan bentuk. Pada tikus percobaan yang mengalami kriptorkismus kadar hormon INSL3 konsentrasinya menurun ( Ivell & Bathgate., 2002). Selanjutnya diuraikan gambar peran hormon INSL3 pada penurunan testis sebagai berikut: Gambar 2.3 Peran hormon INSL3 pada penurunan testis, dipetik dari Bott, 2006 Identifikasi hormon INSL3 yang normal menandakan fungsi gen Insl3 adalah baik (Klonisch dkk., 2003). Sejak diketahui hormon INSL3 dapat mencegah apoptosis pada sel germinal, selanjutnya diperkirakan hormon INSL3 bisa berfungsi juga sebagai kontrasepsi pada laki-laki ( Amory dkk., 2007). Bott (2006) mengatakan hormon INSL3 dihasilkan oleh sel leydig testis sebelum proliferasi mesenchym dan pertumbuhan gubernakulum. Transgenik gen Insl3 pada tikus percobaan menyebabkan terjadinya kriptorkismus dengan gubernakulum yang tidak tumbuh, namun kasus kriptorkismus yang berhubungan dengan mutasi pada gen Insl3 atau reseptornya s ditemukan sedikit. 21 Pada laki-laki yang normal dan pada tikus percobaan yang organ seksualnya sudah matur hormon INSL3 konsentrasinya di sirkulasi dapat terdeteksi maksimum 1 ng/ml, sedangkan konsentrasi hormon INSL3 dalam vena spermatika alalah > 14 ng/ml, karena hormon Insl3 merupakan hormon autokrin-parakrin ( Anand-Ivell dkk., 2006 ). Hormon INSL3 merupakan marker penting untuk mengetahui fungsi sel leydig dan status difrensiasinya, ekpresi hormon INSL3 meningkat pada masa fetus, menurun setelah bayi lahir dan kemudian ekspresi INSL3 meningkat lagi saat remaja. Kekurangan hormon INSL3 sangat penting sebagai tanda dari adanya hipogonad ( Foresta dkk., 2008 ). Konsentrasi hormon INSL3 dalam sirkulasi meningkat pada tikus laki-laki yang dimulai pada usia 10 hari dan terus meningkat sampai konsentrasi hormon INSL3 mencapai kadar dewasa pada usia 39 hari setelah lahir. Testis turun ke sekrotum selama fase peningkatan konsentrasi INSL3. Hormon INSL3 merupakan produksi dari sel leydig fetus dan sel leydig testis setelah lahir, dan juga pada perempuan hormon INSL3 merupakan produksi sel theca dan sel luteal dari ovarium setelah lahir. Hormon INSL3 bisa juga berfungsi sebagai endokrin dan parakrin pada jaringan yang lain (Kumagai dkk., 2002-a). Selanjutnya diuraikan gambar susunan asam amino hormon INSL3 1 mdprlpawal vllgpalvfa lgpaptpemr eklcghhfvr alvrvcggpr wstearrpat 61 ggdrellqwl errhllhglv adsnltlgpg lqplpqtshh hrhhraaatn parycclsgc 121 tqqdlltlcp y 22 Atau: 1. Met-Asp-Pro-Arg-Leu-Pro-Ala-Trp-Ala-Leu-Val-Leu-Leu-Gly-Pro-Ala-Leu-Val-Phe-Ala21. Leu-Gly-Pro-Ala-Pro-Thr-Pro-Glu-Met-Arg-Glu-Lys-Leu-Cys-Gly-His-His-Phe-Val-Arg41. Ala-Leu-Val-Arg-Val-Cys-Gly-Gly-Pro-Arg-Trp-Ser-Thr-Glu-Ala-Arg-Arg-Pro-Ala-Thr61. Gly-Gly-Asp-Arg-Glu-Leu-Leu-Glu-Trp-Leu-Glu-Arg-Arg-His-Leu-Leu-His-Gly-Leu-Val81. Ala-Asp-Ser-Asn-Leu-Thr-Leu-Gly-Pro-Gly-Leu-Gln-Pro-Leu-Pro-Gln-Thr-Ser-His-His101. His-Arg-His-His-Arg-Ala-Ala-Ala-Thr-Asn-Pro-Ala-Arg-Tyr-Cys-Cys-Leu-Ser-Gly-Cys121. Thr-Gln-Gln-Asp-Leu-Leu-Thr-Leu-Cys-Pro-Tyr Gambar 2.4 Susunan asam amino hormon INSL3, dipetik dari NCBI INSL3 protein , 2010 2.2.9 Reseptor LGR8 Leucine-rich repeat-containing G Protein Coupled Receptor 8 (LGR8 /GREAT) merupakan reseptor dari hormon INSL3 (Ferline dkk., 2003; Nuti dkk., 2007). Hormon INSL3 dan reseptor LGR8 memainkan peran penting pada penurunan testis fase transabdominal (Kumagai dkk., 2002). Reseptor LGR8 tesebar di testis, ligamen gubernakulum dan pada epididymis (Anand- Ivell dkk., 2006 ), dan menurut Kumagai dkk (2002-b) reseptor LGR8 tersebar pada testis, otak, ginjal, otot, tiroid, uterus, sel darah perifir dan sumsum tulang. Selanjutnya diuraikan gambar susunan asam amino reseptor LGR8 1 61 121 181 241 301 361 421 481 mivflvfkhl rafhcdgkdd elecvngdlk ffglcnlqil vnnylealpk fsslknlgel erieipnint fvwviafitc qyqkyallwm fslrlitmff cgngadeenc svpmisnnvt ylnhncittl qmcaqmpqln dlssntitel rmfqpmknls fgnlfvigmr esvqcrlmgf llhfivlinv gdtsgwatif llslkknkih rpgifkdlhq wvdlegnrik sphlfkdlkl hiyfknfryc sfikaentth lamlstevsv kdfaltqgsm gtvhgnansv slpdkvfiky ltwlilddnp yltnstflsc lqklnlssnp syaphvricm amsikilcca llltyltlek itpscqkgyf altqecflkq tklkkiflqh itrisqrlft dsltvlflpr lmylhknqfe pltdgissfe dclmgvylff flvivfpfsn pcgnltkclp ypqccdcket ncirhisrka glnslfflsm nqigfvpekt slkqlqsldl dllannilri vgifdikyrg irpgkrqtsv 23 541 601 661 721 iliciwmagf afliivfsyi slfrveipdt slstsivwie liavipfwnk tmfcsiqkta mtswiviffl dssslklgvl dyfgnfygkn lqttevrncf pvnsalnpil nkitlgdsim gvcfplyydq tedigskgys lgiflgvnll grevavanrf ffivfsdaic wipvfvvkil ytlttnffkd klkqllhkhq rksifkikkk kpvs Atau: 1 21 41 61 81 101 121 141 161 181 201 221 241 261 281 301 321 341 361 381 401 421 441 461 481 501 521 541 561 581 601 621 641 661 681 701 721 741 Met-Ile-Val-Phe-Leu-Val-Phe-Lys-His-Leu-Phe-Ser-Leu-Arg-Leu-Ile-Thr-Met-Phe-PheLeu-Leu-His-Phe-Ile-Val-Leu-Ile-Asn-Val-Lys-Asp-Phe-Ala-Leu-Thr-Gln-Gly-Ser-MetIle-Thr-Pro-Ser-Cys-Gln-Lys-Gly-Tyr-Phe-Pro-Cys-Gly-Asn-Leu-Thr-Lys-Cys-Leu-ProArg-Ala-Phe-His-Cys-Asp-Gly-Lys-Asp-Asp-Cys-Gly-Asn-Gly-Ala-Asp-Glu-GLu-Asn-CysGly-Asp-Thr-Ser-Gly-Trp-Ala-Thr-Ile-Phe-Gly-Thr-Val-His-Gly-Asn-Ala-Asn-Ser-ValAla-Leu-Thr-Gln-Glu-Cys-Phe-Leu-Lys-Gln-Tyr-Pro-Gln-Cys-Cys-Asp-Cys-Lys-Glu-ThrGlu-Leu-Glu-Cys-Val-Asn-Gly-Asp-Leu-Lys-Ser-Val-Pro-Met-Ile-Ser-Asn-Asn-Val-ThrLeu-Leu-Ser-Leu-Lys-Lys-Asn-Lys-Ile-His-Ser-Leu-Pro-Asp-Lys-Val-Phe-Ile-Lys-TyrThr-Lys-Leu-Lys-Lys-Ile-Phe-Leu-Gln-His-Asn-Cys-Ile-Arg-His-Ile-Ser-Arg-Lys-AlaPhe-Phe-Gly-Leu-Cys-Asn-Leu-Gln-Ile-Leu-Tyr-Leu-Asn-His-Asn-Cys-Ile-Thr-Thr-LeuArg-Pro-Gly-Ile-Phe-Lys-Asp-Leu-His-Gln-Leu-Thr-Trp-Leu-Ile-Leu-Asp-Asp-Asn-ProIle-Thr-Arg-Ile-Ser-Gln-Arg-Leu-Phe-Thr-Gly-Leu-Asn-Ser-Leu-Phe-Phe-Leu-Ser-MetVal-Asn-Asn-Tyr-Leu-Glu-Ala-Leu-Pro-Lys-Gln-Met-Cys-Ala-Gln-Met-Pro-Gln-Leu-AsnTrp-Val-Asp-Leu-Glu-Gly-Asn-Arg-Ile-Lys-Tyr-Leu-Thr-Asn-Ser-Thr-Phe-Leu-Ser-CysAsp-Ser-Leu-Thr-Val-Leu-Phe-Leu-Pro-Arg-Asn-Gln-Ile-Gly-Phe-Val-Pro-Glu-Lys-ThrPhe-Ser-Ser-Leu-Lys-Asn-Leu-Gly-Glu-Leu-Asp-Leu-Ser-Ser-Asn-Thr-Ile-Thr-Glu-LeuSer-Pro-His-Leu-Phe-Lys-Asp-Leu-Lys-Leu-Leu-Gln-Lys-Leu-Asn-Leu-Ser-Ser-Asn-ProLeu-Met-Tyr-Leu-His-Lys-Asn-Gln-Phe-Glu-Ser-Leu-Lys-Gln-Leu-Gln-Ser-Leu-Asp-LeuGlu-Arg-Ile-Glu-Ile-Pro-Asn-Ile-Asn-Thr-Arg-Met-Phe-Gln-Pro-Met-Lys-Asn-Leu-SerHis-Ile-Tyr-Phe-Lys-Asn-Phe-Arg-Tyr-Cys-Ser-Tyr-Ala-Pro-His-Val-Arg-Ile-Cys-MetPro-Leu-Thr-Asp-Gly-Ile-Ser-Ser-Phe-Glu-Asp-Leu-Leu-Ala-Asn-Asn-Ile-Leu-Arg-IlePhe-Val-Trp-Val-Ile-Ala-Phe-Ile-Thr-Cys-Phe-Gly-Asn-Leu-Phe-Val-Ile-Gly-Met-ArgSer-Phe-Ile-Lys-Ala-Glu-Asn-Thr-Thr-His-Ala-Met-Ser-Ile-Lys-Ile-Leu-Cys-Cys-AlaAsp-Tys-Leu-Met-Gly-Val-Tyr-Leu-Phe-Phe-val-Gly-Ile-Phe-Asp-Ile-Lys-Tyr-Arg-GlyGln-Tyr-Gln-Lys-Tyr-Ala-Leu-Leu-Trp-Met-Glu-Ser-Val-Gln-Cys-Arg-Leu-Met-Gly-PheLeu-Ala-Met-Leu-Ser-Thr-Glu-Val-Ser-Val-Leu-Leu-Leu-Thr-Tyr-Leu-Thr-Leu-Glu-LysPhe-Leu-Val-Ile-Val-Phe-Pro-Phe-Ser-Asn-Ile-Arg-Pro-Gly-Lys-Arg-Gln-Thr-Ser-ValIle-Leu-Ile-Cys-Ile-Trp-Met-Ala-Gly-Phe-Leu-Ile-Ala-Val-Ile-Pro-Phe-Trp-Asn-LysAsp-Tyr-Phe-Gly-Asn-Phe-Tyr-Gly-Lys-Asn-Gly-Val-Cys-Phe-Pro-Leu-Tyr-Tyr-Asp-GlnThr-Glu-Asp-Ile-Gly-Ser-Lys-Gly-Tyr-Ser-Leu-Gly-Ile-Phe-Leu-Gly-Val-Asn-Leu-LeuAla-Phe-Leu-Ile-Ile-Val-Phe-Ser-Tyr-Ile-Thr-Met-Phe-Cys-Ser-Ile-Gln-Lys-Thr-AlaLeu-Gln-Thr-Thr-Glu-Val-Arg-Asn-Cys-Phe-Gly-Arg-Glu-Val-Ala-Val-Ala-Asn-Arg-PhePhe-Phe-Ile-Val-Phe-Ser-Asp-Ala-Ile-Cys-Trp-Ile-Pro-Val-Phe-Val-Val-Lys-Ile-LeuSer-Leu-Phe-Arg-Val-Glu-Ile-Pro-Asp-Thr-Met-Thr-Ser-Trp-Ile-Val-Ile-Phe-Phe-LeuPro-Val-Asn-Ser-Ala-Leu-Asn-Pro-Ile-Leu-Tyr-Thr-Leu-Thr-Thr-Asn-Phe-Phe-Lys-AspLys-Leu-Lys-Gln-Leu-Leu-His-Lys-His-Gln-Arg-Lys-Ser-Ile-Phe-Lys-Ile-Lys-Lys-LysSer-Leu-Ser-Thr-Ser-Ile-Val-Trp-Ile-Gln-Asp-Ser-Ser-Ser-Leu-Lys-Leu-Gly-Val-LeuAsn-Lys-Ile-Thr-Leu-Gly-Asp-Ser-Ile-Met-Lys-Pro-Val-Ser Gambar 2.5 Susunan asam amino reseptor LGR8, dipetik dari NCBI LGR8 protein, 2010 24 2.3 Pertumbuhan Gubernakulum Gubernakulum melekat pada gonad pada daerah inguinoskrotal dan ini menjadi bagian dari penurunan testis. Gubernakulum tumbuh dengan cepat pada fetus laki-laki, namun pada fetus perempuan pertumbuhan gubernakulum tidak sempurna. Faktor yang mungkin berperan pada pertumbuhan gubernakulum adalah: hormon INSL3, hormon testosteron. Tidak sempurnanya pertumbuhan gubernakulum berhubungan dengan aktivitas mitosis sel pada bulbus gubernakulum dari fetus laki-laki dan fetus perempuan. Gubernakulum dapat dibagi menjadi: bagian kranial, tali gubernakulum, bagian caudal, kantong gubernakulum atau gubernakulum bulb. Gubernakulum bulb mengandung inti mesenchym dengan pembungkus otot. Pada mamalia yang besar seperti babi, manusia, gubernakulum hanya mengandung sel mesenchym. Orchidektomi pada fetus dapat mencegah pertumbuhan keluar dari gubernakulum (Emmen dkk., 2000). Gubernakulum perannya sangat menentukan pada mekanisme yang komplek dari turunnya testis dan tertutupnya hernia inguinalis (Hutson dkk., 2004). Selanjutnya diuraikan gambar penurunan testis transabdominal dan transinguinal serta gambar peran gubernakulum pada penurunan testis sebagai berikut: 25 Gambar 2.6 Penurunan testis transabdominal dan transinguinal, dipetik dari Foresta dkk.,2008 Gambar A menunjukkan posisi testis sebelum penurunan transabdominal, dimana testis pada bagian cranial dipegang oleh CSL yang melekat pada dinding belakang abdomen dan bagian caudal dipegang oleh gubernakulum yang ujungnya pada cincin inguinalilis pada dinding abdomen. Gambar B penurunan testis transabdominal oleh karena terjadi pertumbuhan gubernakulum yang dipengaruhi hormon Insl3 dan regresi CSL yang dipengaruhi testosteron, dan regresi duktus mulleri yang dipengaruhi AMH. Gambar C penurunan testis transinguinal karena regesi gubernakulum yang dipengaruhi oleh hormon testosteron dan GFN. Gambar D testis sudah di skrotum dan sudah terjadi regesi penuh gubernakulum. 26 Gambar 2.7 Peran gubernakulum pada penurunan testis, dipetik dari Bott, 2006 2.4 Penurunan Testis Turunnya testis merupakan proses yang kompleks antara faktor anatomi dan faktor hormonal. Penurunan testis terjadi karena ada proses perkembangan testis, testis bergerak dari posisi semula intraabdominal turun ke dasar skrotum. Proses ini umumnya 27 terdiri dari 2 fase, yang pertama disebut fase pertama atau fase transabdominal terjadi sebelum bayi dilahirkan, pada fase transabdominal testis bergerak menuju abdomen bagian bawah. Fase kedua disebut juga fase transinguinal, pada fase transinguinal testis bergerak dari bagian bawah abdomen menuju dasar skrotum. Ada 2 ligamen yang mempengaruhi pergerakan testis seperti CSL yang melekat dengan gonad pada dinding perut bagian belakang, dekat dengan tulang rusuk paling bawah.Sedangkan gubernakulum melekat dengan testis melalui epididymis kemudian masuk dari intraabdominal menuju cincin bagian dalam canalis inguinalis. Selama fase transabdominal gubernakulum pada laki-laki berkembang dengan membesar pada cavum abdomen dan di bawah tekanan pertumbuhan organ visceral pada abdomen serta di bawah pengaruh hormonal terjadi regresi CSL dan pada saat ini pertumbuhan gubernakulum bagian caudal yang disebut gubernakulum bulb, pertumbuhan keluar gubernakulum menyebabkan terjadinya migrasi testis ke inguinal dan testis memilih tempat dibelakang leher kandung kencing (Emmen dkk., 2000; Foresta dkk.,2008; Virtanen & Toppari.,2008). Pada fase penurunan testis transinguinal testis bergerak dari inguinal menuju sekrotum. Pada fase ini terjadi pemendekan gubernakulum cord dan pemendekan pertumbuhan keluar dari gubernakulum bulb. Fase transabdominal terjadi antara usia kehamilan 10-23 minggu sedangkan fase transinguinal terjadi antara usia kehamilan 26-28 minggu dan saat lahir. Pada fase transabdominal yang diperlukan hormon INSL3 sedangkan pada fase traninguinal yang diperlukan hormon testosteron (Foresta, dkk., 2008). 28 Proses turunnya testis dibagi menjadi : 2.4.1 Migrasi testis transabdominal Perkembangan gonad testis dimulai pada dinding abdomen, dengan ligament suspensory pada bagian kranial dan ligament genitalia atau gubernakulum pada bagian caudal, hal ini terjadi paling lambat pada minggu ke tujuh kehamilan. Gubernakulum berhubungan dengan ujung bawah testis-epididimis pada bagian cranial kanalis inguinalis dan hal ini penting untuk perkembangan normal dari prosesus vaginalis. Mekanisme terputusnya bagian distal gubernaculum merupakan hasil dari berkurangnya perkembangan prosesus vaginalis. Regresi dari ligament suspensory cranial dan penebalan gubernakulum menghasilkan migrasi transabdominal. Keadaan ini membawa testis ke cincin inguinal interna pada usia tiga bulan kehamilan. Selama bulan ke empat sampai ke lima kehamilan, kantong luar peritoneum berkembang sepanjang bagian kaudal dari gubernakulum meluas lewat kanalis inguinalis kedalam skrotum (Achermann, 2005; Kaefer, 2004). Emmen dkk tahun 2000 menemukan pada penelitiannya dengan menggunakan tikus percobaan bahwa hormon INSL3 dan hormon androgen mempunyai peran yang sangat esensial pada pertumbuhan keluar dari gubernakulum selama penurunan testis transabdominal, diperkirakan gen Insl3 berperan sebagai perantara pada aktivitas perkembangan gubernakulum. Gubernakulum memainkan peran yang esensial pada mekanisme yang komplek dari penurunan testis dan tertutupnya hernia inguinalis (Hutson dkk., 2004). Selanjutnya diuraikan migrasi testis transabdominal sebagai berikut: 29 Gambar 2.8 Migrasi testis transabdominal, dipetik dari Amann &Veeramachaneni, 2007 2.4.2 Migrasi testis transinguinal Pase kedua dari penurunan testis dimulai pada bulan ke tujuh kehamilan dan biasanya lengkap pada trimester ketiga. Antara bulan ketujuh dan kesembilan kehamilan penurunan testis secara cepat pada kanalis inguinalis dan pelan-pelan masuk ke skrotum. Selama waktu ini, terjadi regresi gubernakulum atau kejadian ini dipengaruhi proses androgen dan tetap menetap di ligament gubernakulum. Dalam keadaan normal prosesus vaginalis menutup komplit sebelum bayi lahir, apabila testis tidak turun, prosesus vaginalis biasanya masih tertinggal jelas ( secara tidak langsung menjadi hernia inguinalis). Pada bayi prematur penurunan testis kedalam skrotum banyak tidak lengkap (Kaefer, berikut: 2004). Selanjutnya diuraikan gambar migrasi testis transinguinal sebagai 30 Gambar 2.9 Migrasi testis transinguinal, dipetik dari Amann & Veeramachaneni, 2007 2.4.3 Migrasi testis setelah lahir Kira-kira dua pertiga bayi lahir dengan kriptorkismus testisnya menurun secara spontan kedalam skrotum. Walaupun penurunan testis masih tetap berlangsung sampai usia 12 bulan, kebanyakan kasus penurunan testis ditemukan antara usia 4 sampai usia 6 bulan ( dengan asumsi bayi lahir cukup bulan). Terjadinya penurunan testis setelah lahir diperkirakan disebabkan oleh peningkatan kadar testosteron setelah lahir. Peningkatan kadar testosteron selama 3 bulan pertama kehidupan merupakan aktivitas kedua dari aksis hypothalamus-hipofise dengan hilangnya feeback negatif dari pengaruh lingkungan hormon ibunya (Kaefer, 2004; Suomi 2006). Suomi dkk tahun 2006 melakukan penelitian prospektif pada bayi laki-laki yang lahir dengan kriptorkismus diikuti selama 3 bulan, kemudian pada usia tiga bulan 31 dilakukan pemeriksaan hormon FSH, hormon LH dan inhibin B kemudian dibandingkan dengan kontrol, pada pasien pasien yang kadar hormon FSH, hormon LH yang meningkat dan produksi inhibin B yang rendah kejadian kriptorkismusnya menetap, sehingga disimpulkan kriptorkismus sesuai dengan kelainan primer pada testis. 2.5 Gen dan Genom Salah satu perbedaan antara jasad prokariot dan eukariot adalah pada organisasi bahan genetiknya. Pada kelompok prokariot, umumnya hanya ada satu unit bahan genetik utama yang membawa semua informasi genetik yang diperlukan untuk kelangsungan pertumbuhan jasad tersebut. Sebaliknya, pada kelompok eukariot, bahan genetik utama terdiri atas beberapa unit independen yang terpisah namun semua unit bahan genetik merupakan satu kesatuan genom yang menentukan kelangsungan hidup jasad. Gen merupakan unit molekul DNA atau RNA dengan panjang minimum tertentu yang membawa informasi mengenai urutan asam amino yang lengkap suatu protein, atau yang menentukan struktur lengkap suatu molekul rRNA atau tRNA. Genom merupakan salah satu kesatuan gen yang secara alami dimiliki oleh satu sel atau virus, atau kesatuan kromosom jasad eukariot dalam fase haploid. Dengan batasan ini maka sepotong molekul DNA yang tidak membawa informasi genetik yang lengkap tidak dapat disebut sebagai gen melainkan hanya sebagai fragmen DNA. Demikian juga satu kromosom suatu jasad yang mempunyai lebih dari satu kromosom juga tidak dapt disebut sebagai genom jasad tersebut ( Yuwono, 2005). 32 2.5.1 Struktur dan fungsi gen Molekul DNA merupakan dasar untuk metabolisme sel dan pembelahan sel, maupun memberikan dasar untuk sifat-sifat yang diwariskan. Struktur dan fungsi sejumlah gen telah ditemukan, dan penetapan urutan nukleotida pada sepasang gen utuh telah dimungkinkan. Suatu rantai tunggal DNA terdiri dari unit-unit gula deoksiribose yang dihubungkan oleh gugus fosfat. Basa purinnya adalah adenin (A) dan guanin (G) sedangkan basa pirimidinnya adalah sitosin (C) dan timin (T) dan urutan basa sepanjang molekul ini menyusun kode genetik. Kode DNA adalah bersifat umum untuk semua organisme, dengan perkecualian pada DNA mitokondria yang mempunyai sejumlah kodon yang berbeda. Urutan kode pada gen tidaklah bersifat kontinu, tetapi diselangseling oleh urutan bukan pengkode sebagai penyela yang jumlah dan panjangnya beraneka ragam sedangkan fungsinya masih belum diketahui. Urutan pengkode disebut exon dan urutan penyela disebut intron. Ukuran dan kerumitan gen manusia adalah berbeda-beda. Suatu mutasi genetik dapat memberikan efek pada setiap tingkat dalam proses trnskripsi dan translasi, yang akan menghasilkan mRNA yang tidak stabil atau mRNA yang tidak bisa ditranslasi kedalam molekul polipeptida yang berfungsi. Banyak jenis mutasi yang dikenal pada penyakit genetik manusia, yang meliputi mutasi titik, dielesi, inserti dan penyusun kembali dan duplikasi (Kopp, 2009). Selanjutnya diuraikan gambar struktur gen yang terdiri dari exon dan intron sebagai berikut: 33 Gambar 2.10 Struktur gen, dipetik dari Arya, 2007 2.5.2 Gen yang berperan pada penurunan testis Adapun gen yang berperan pada penurunan testis: gen SRY, gen insl3, gen igr8, gen Steriogenic faktor 1 (Sf1), gen Hoxa10, gen Willem tumor 1 (Wt1), gen Sox9, gen Gata4 (Kaleva & Toppari., 2003; Virtanen & Toppari., 2008). 2.5.3 Gen Insl3 Gen insl3 terletak pada kromosom 19 P13.1-13.3. Gen insl3 mempunyai panjang beaspear: 4.998 bp atau 4,9 kbp (dari 5001 – 9999), mempunyai 2 exon : exon 1 panjangnya 194 bp ( dari 5001 – 5195 ) dan exon 2 panjangnya 546 bp ( dari 9453 – 9999) (NCBI, 2010) dengan intronnya yang terputus pada daerah code C peptide. Adapun promoter dari gen Insl3 mengalami restriksi dalam intron 23 dari gen JAK3. Dipastikan bagian yang pendek hanya 500-700 basefare dan mempunyai intron yang cukup untuk menentukan ekspresi gen spesifik Insl3 bila terjadi tumor sel leydig ( Ivell 34 & Bathgate., 2002). Gubernakulum memanjang ke sekrotum diikuti masukknya testis ke kanalis inguinalis dipengaruhi hormon INSL3. Secara klinis perubahan pada gen Insl3 menyebabkan kegagalan testis secara normal masuk ke skrotum selama perkembangan embriyo ( Ferline dkk., 2003 ). Hal yang menarik ekspresi INSL3 merupakan regulasi faktor genetiK lainya. Hormon iNSL3 mempunyai struktur yang sangat menyerupai peptide hormon relaktin atau insulin. Estrogen dapat menurunkan regulasi produksi iNSL3 dan mengganggu aktivitas gen insl3(Kaleva & Toppari., 2003 ). Primer untuk Insl3 pada testis manusia adalah: 5!-(CCCAAGCTT)C-CACCATGGACCCCCGT-3! dan 5!-(CCCAGA TCT)GTAGG-GACAGAGGGTCAGCA-3! (Bogatcheva dkk., 2003). Sedangkan primer untuk exon 1 gen Insl3, Forward: 5!CTCGTTGCCCAGTGCTCCC3!, dan Reverse: 5!CATGCAAACCTGCCCACC3! dimana exon 1 panjangnya 195 bp (5001..5195) terdiri dari 65 kodon dan mengkode 63 asam amino, sedangkan gen insl3 yang diamplifikasi sepanjang 490 pasang basa, selanjutnya diuraikan gambar bentuk normal exon 1 gen insl3 sebagai berikut: Forward 4801 4861 4921 4981 5041 5101 5161 5221 5281 Reverse aaagactcgt gaaaggctct ctgtcccttc cttggccccg gctgggccct gttgtgcggc caccgaagcc gctctgggaa tgggcaggtt tgcccagtgc ggcactaacc tccaaggccc gcgccaccca gccctggtgt caccacttcg aggaggcctg gccgaggtgg tgcatgcatg tccctctggg ccacccttga ccagctggga ccaccatgga tcgcgttggg tacgcgcgct cgaccggagg ggcaggtgca tgcccagggc agaagtacat cctttttcct cggcccaggc cccccgtctg ccccgcgccc agtgcgcgtg cgaccgtgag cgtaggcgca tcacctgccg ccaaggccct gggcggtcct gcctataaag cccgcctggg accccagaga tgcgggggcc tggggacggg gatgcacacg gctgcgtgca ggccctggga gaagaatgtt ggggtccccg cgctggtgct tgcgtgagaa cccgctggtc cagggacagc tgcagggagg cagatcgtgg Gambar 2.11 Bentuk normal exon 1 gen insl3, dipetik dari NCBI gen bank insl3, 2010 35 primer untuk exon 2 gen insl3, Forward: 5!GGATTCGTGCACATGCAGC 3!, dan Reverse: 5!GGCCTGTAGATGCGAGAC3! dimana exon 2 panjangnya 547pasang basa (9453..9999) terdiri dari 182 kodon, sedangkan panjang gen insl3 yang diamplifikasi sepanjang 383 pasang basa, selanjutnya diuraikan gambar bentuk normal exon 2 gen Insl3 sebagai berikut: Forward 9361 9421 9481 9541 9601 9661 9721 Reverse 9781 9841 9901 9961 tcagtgggat tccgttccag acatctgctc cctgccccag ctactgctgc cctccttggg tgaggccaca gtgtgtggat ctgagtttca catgggctgg acctctcacc ctcagtggct tgcagcctca cagcaccata tcgtgcacat ctctgtcccc tggccgacag atcaccgcca gtacccaaca gagtggcctg aagtctcgca gcagcatggg aggtgagttg taatctcacg ccaccgtgca agacctgctg aggcccagag tctacaggcc gtagcatgtc ctacagtggc ctgggacctg gctgccacca accctctgtc ggtctggtct tttgattacc ctctgtcgtt tggagagacg gcctgcagcc accctgcacg cctactgatt ggtgagctcc tcctgggatg ggtgctcact aaatcacacc gccaaatgtc cttcttgctg atctacccca ctagccctgg ctcactccag tctcttagta gaccaatgcc cttggaggat gggagcccca aataaacgac acctgcagcc ccccgctttc gacgctccgc ccaaagcagc tgtggagtca acagatgctg tccctgcatg ttcctgcatt actgcagaat gacactgaca tgtaacaccc ttctctagaa Gambar 2.12 Bentuk normal exon 2 gen insl3, dipetik dari NCBI gen bank insl3, 2010 2.5.3.1 Polimorfisme gen Insl3 Dipastikan bagian yang pendek gen Insl3 hanya 500-700 basefare dan mempunyai intron yang cukup untuk menentukan ekspresi gen insl3 bila diperlukan tumor sel leydig. Kekacauan genetik dari gen insl3 pada tikus percobaan menyebabkan tingginya kriptorkismus intraabdominal. Analisis mutasi gen insl3 pada allel dengan single nucleotide polymorphisme (SNPs) pada pasien kriptorkismus hanya ditemukan beberapa mutan, jadi dasar genetik dari kriptorkismus pada manusia masih tidak jelas (The Endocine society, 2005). Pada penelitian Ferline dkk (2003) dengan menggunakan 87 pasien kriptorkismus dan 80 kontrol, kemudian dilihat gen insl3 dengan melakukan skuenzing ditemukan 3 mutasi gen insl3 pada 4 pasien. Pasien yang 36 mengalami mutasi menunjukkan perbedaan fenotip dari normosperma sampai komplit azoosperma, dan dari kriptorkismus bilateral sampai testis retraktil dengan fungsi endokrin yang masih normal. Pada penelitian Vinci dkk (2004) dengan menggunakan 14 pasien dengan anorchia, peneliti gagal menemukan mutasi pada gen insl3 namun dilaporkan adanya polimorfisme menghasilkan perubahan asam amino dari Alanin ke Treonin pada kodon 60 yang ditemukan pada beberapa kasus, namun perubahan ini tidak menyebabkan anorchia, kemungkinan polimorfisme merupakan risiko faktor genetik untuk kelainan kongenital lainnya. Penelitian di Denmark oleh Lim dkk (2001) menemukan tidak adanya kesuaian polimorfisme gen Insl3 pada A36T dengan isolated kriptorkismus. Penelitian ini menunjukkan ekspresi murin Insl3 secara substansi menurun oleh obat diethylstilbesterol. Pada penelitian Bogatcheva dkk (2003) dengan menggunakan 600 kasus didapatkan 4 varian mutan dari insl3 yaitu pada P49S, P93 L, R10ze dan Nii0K, dimana asam amino pertamanya berhubungan dengan codon pada lengan yang komplit. Walaupun mutasi gen insl3 yang ditemukan sedikit yang menyebabkan kriptorkismus, namun adanya faktor pembawa yang dapat dijelaskan dengan adanya polimorfisme menjadi pertimbangan terjadinya kriptorkismus. 2.5.4 Gen Lgr8 Gen Lgr8 ( Leucine-rich repeat-containing G protein-coupled receptor 8) disebut juga Relaxin / insulin- like family peptide receptor 2 (RXFP2) atau G Protein coupled receptor affecting testicular descent. Gen Lgr8 terdiri dari 18 exon dan terletak pada kromosom 13 yaitu 13q13.1 yang mempunyai panjang 63.330 bp atau 63,3 kbp ( dari 5001 – 68331 ). exon 1 (5001-5165), exon 2 (23717-23863), exon 3 (27183-27260), exon 4 37 (30496-30601), exon 5 (31415-31486), exon 6 (40079-40150), exon 7 (40777-40848), exon 8 (42835-42906), exon 9 (43971-44042), exon 10 (47130-47201), exon 11 (4813548206), exon 12 (51842-51913), exon 13 (52025-52096), exon 14 (54581-54652), exon 15 (57265-57494), exon 16 (58137-58547), exon 17 (62660-62878), exon 18 (6760568331) ( NCBI, 2010). Selanjutnya diuraikan gambar bentuk normal exon 8 gen lgr8 dengan panjang 72 pasang basa (42835 ….42906) yang terdiri dari 24 kodon, exon 8 gen lgr8 diamplifikasi dengan premer: Forward 5!ACACAAAGGAGTAGGCCAGG3! dan Reverse 5!CTAGTGCTAGATGTCATTGC3!, daerah yang diamplifikasi sepanjang 224 pasang basa, untuk jelasnya bisa dilihat pada gambar di bawah ini: Forward 42721 caggtgagcc aagtatggaa gcacacaaag gagtaggcca ggtgttgagg ggaggcaggt 42781 tttatttcac aaatgtctct aatattggaa atgtttcttg atacattttg tcagaattct 42841 agatgacaat ccaataacca gaatttcaca gcgcttgttt acgggattaa attccttgtt 42901 tttcctgtaa gtattcatca acctttcaat acatctatcg atacattgca atgacatcta 42961 gcactagctt acaaaaagaa cttttaaaaa aatcaagccc acaaaaattt ttattagtca Reverse Gambar 2.13 Bentuk normal exon 8 gen lgr8, diperik dari NCBI gen bank Lgr8, 2010 Berikut ini diuraikan gambar bentuk normal exon 12 gen lgr8 yang terdiri dari 72 pasang basa ( 51842.. 51913) dan dibagi menjadi 24 kodon, sedangkan exon 13 terdiri dari 72 pasang basa (52025..52096 ) dan dibagi menjadi 24 kodon . Exon 12 dan exon 13 gen Lgr8 berdekatan sehingga diamplifikasi dengan primer: Forward 5!GGATGATGATAATTGTGAGG3! dan Reverse 5!CTGAAATGCATGCTCCTGTG3! sedangkan daerah yang diamplifikasikan dari exon 12 dan exon 13 gen lgr8 sebesar: 439 pasang basa. Selanjutnya dapat dilihat bentuk normal exon 12 dan exon 13 gen lgr8 sebagai berikut: 38 Forward 51721 gttggttaaa ttggattcat attttctgtt acatcaaatg ggatgatgat aattgtgagg 51781 agtaataagt ctgtcattta cttccaaagt aattgctttg ggttttcatt gtcgtcaaca EXON 12 51841 gggatctgtc tagcaatacg ataacggaac tatcacctca cctttttaaa gacttgaagc 51901 ttctacaaaa gctgtaagtt ctacttctca ccataatcag atttaaaggg caatattttg 51961 agctttcaaa ataataatac cttcaaactt cttttcctct ctcatctaat ggtaaaaaaa EXON 13 52021 aaaggaacct gtcatccaat cctcttatgt atcttcacaa gaaccagttt gaaagtctta 52081 aacaacttca gtctctgtaa gtgaaatatt acaattatat tgattataat tttagtggat 52141 gtacttagag acacatttat ttttaaatgg gtattttgca cacaggagca tgcatttcag Reverse Gambar 2.14 Bentuk normal exon 12,exon 13 gen lgr8,dipetik dari NCBI gen bank lgr8, 2010 2.5.4.1 Polimorfisme gen lgr8 Analisis mutasi gen lgr8 dideteksi dengan SNPs, pada tikus percobaan perubahan susunan nukleotida gen lgr8 menyebabkan tingginya kasus kriptorkismus intraabdominal, dan pada penelitian kohort dengan menggunakan 87 pasien kontrol, dengan melakukan skuenzing kriptorkismus dan 80 gen lgr8 ditemukan 1 mutasi pada 4 pasien (Ferline dkk., 2003). Menurut Vinci dkk ( 2004) diketahui gen lgr8 pada manusia berhubungan dengan penurunan testis, namun kriptorkismus jarang yang disebabkan oleh mutasi gen lgr8. Pada penelitian Nuti dkk (2007) menemukan mutasi T222P gen lgr8 dan polimorfisme gen lgr8 yang dicurigai sebagai faktor risiko kriptorkismus. Kejadian mutasi gen lgr8 adalah 2,9% (28 dari 979 kasus) dan paling banyak pada T222P, namun fenotip dari mutasi ini berfariasi dari kriptorkismus bilateral, unilateral dan lokasi testis pada mutasi gen lgr8 juga bervariasi abdominal atau inguinal ( Foresta dkk., 2008) 39 2.5.5 Identifikasi gen pada genom manusia Gen biasanya diisolasi pertama-tama pada peta gen dari kromosom spesifik dan juga pada lokasi subkromosom. Lokasi spesifik gen pada kromosom diidentifikasi dengan bermacam macam teknik. Kira kira 100.000 atau lebih gen pada genom manusia. Pemetaan dan klonning gen yang normal dan persilangan gen disesuaikan dengan penyakit dimana step pertama yang menentukan sesuai dengan proses berkembangnya terapi gen. Fungsi normal gen dan karakteristik produksi proteinnya harus diketahui (Kopp, 2009). 2.6 Polimorfisme Gen Manusia menunjukkan hal yang istimewa berupa variasi genetik. Variasi ini ditunjukkan dari variasi tekanan darah, tinggi badan, warna kulit dan spektrum variasi genetik penyakit. Semua variasi genetik yang alamiah dari proses ini dikenal sebagai mutasi yang didefinisikan perubahan dari sequenzing DNA. Perbedaan skuenzing menentukan allel, dan lokasi gen pada kromosom disebut lokus. Bila individu mempunyai allel yang sama pada pasangan kromosom individu tersebut disebut homosigot dan bila allelnya berbeda pada sequenzing DNA maka individu tersebut disebut heterosigot. Allel ditemukan berada pada lokus dan mempengaruhi genotip dari lokus tersebut. Beberapa lokus kemungkinan keberadaannya secara individual, dan bila lokus mempunyai dua atau lebih allel yang keberadaannya secara berulang lebih dari 1% populasi maka lokus itu disebut polimorfik, dan lokus yang polimorfik sering disebut polimorfisme (Jorde dkk., 2006). Ada hubungan antara perlekatan polimorfisme dengan situs dari DRR1, dan kemampuan perlekatan ini berhubungan dengan dua parameter dan tempat perlekatan tersebut dalam visum gen (Jing 40 dkk.,2005). Keanekaragaman urutan basa (polimorfisme) pada DNA bukan pengkode adalah sangat sering terdapat pada seluruh genom. Apabila polimorfisme tadi mengenai sisi pemutus enzim restriksi, maka akan diperoleh fragmen DNA dengan ukuran yang berbedabeda setelah digesti DNA oleh endonuklease restriksi. Alel yang berbeda-beda yang dihasilkan disebut polimorfisme panjang fragmen restriksi ( restriktion fragment length polymorphism) (RLFP). Polimorfisme gen DNA dikatagorikan menjadi 4 klas berbeda yaitu: single nucleotide polymorphism, mikrosatelit, minisalelit, Indel. 2.6.1 Single nucleotide polymorphism (SNPs), Single nucleotide polymorphism atau SNPs merupakan perubahan genetik atau variasi yang kecil dan dapat ditemukan pada sequenzing DNA manusia, mempunyai code genetik yang spesifik dengan 4 nukleotida, yaitu: A (adenine), C (cytosine), T (thymine), dan G (guanine). Variasi SNPs ditemukan apabila satu nukleotida seperti A diganti dengan salah satu dari tiga nukleotida (C atau G atau T). Sebagai contoh SNPs adalah segmen DNA, AAGGTTA menjadi ATGGTTA, dan kejadian SNPs pada populasi manusia lebih dari 1% dan hanya 3-5% dari code sequenzing DNA manusia menghasilkan protein, sebagian besar SNPs berada di luar code sequenzing, SNPs yang berada pada code sequenzing menjadi perhatian khusus peneliti karena dia mempengaruhi fungsi protein. Walaupun kebanyakan SNPs tidak berpengaruh pada perubahan fisik, pada penelitian ini SNPs sebagai faktor predisposisi penyakit dan respon penyakit terhadap obat. DNA polimorfisme khususnya SNPs akan digunakan membantu peneliti dalam memahami dan menjelaskan mengapa individu berbeda kemampuannya dalam 41 menerima suatu obat, demikian juga menjelaskan mengapa individu mempunyai pengalaman efek samping yang berbeda pada obat. Selanjutnya SNPs tidak hanya digunakan untuk proses deteksi obat tetapi untuk pencegahan dan pengobatan yang praktis. Para peneliti menemukan kebanyakan SNPs tidak berhubungan dengan penyakit tertentu. SNPs merupakan marker biologi untuk terjadinya penyakit pada genom manusia tertentu, sebab SNPs biasanya terletak dekat dengan gen yang menyebabkan penyakit, ada kalanya SNPs secara aktual menyebabkan penyakit, dan selanjutnya dapat digunakan serta diteliti sebagai penyakit yang disebabkan oleh gen (SNPs NCBI, 2007). SNPs bersifat sederhana, prevalensinya banyak dan umumnya merupakan bagian dari polimorfisme DNA yang tumbuh dari substitusi pasang basa tunggal. Perubahan pasang basa, yang dapat dirangsang oleh mutan kimia atau kerusakan replikasi DNA, berhubungan dengan SNPs dan jumlahnya sangat banyak dari total variasi. Kebanyakan SNPs hanya mempunyai 2 allel dan rasio kedua allel pada populasi berkisar antara 1: 100 sampai 50 : 50. SNPs dapat diidentifikasi dengan melakukan skuenzing pada regio yang sama dari genom pada beberapa individu. Walaupun SNPs sudah mempunyai kode skuenzing, namun SNPs masih berhubungan dengan gene yang berhubungan langsung dengan fenotip, dan sebagian besar SNPs ditemukan locusnya anonim. Ditemukan lokus anonimus artinya tidak berhubungan secara langsung dengan fenotip. Beberapa kelainan pada gen yang lain berhubungan dengan perubahan fenotip secara signifikan yang merupakan marker DNA. Lokus DNA yang spesifik dengan variasi yang teridentifikasi pada penelitian medis dapat digunakan sebagai marker untuk identifikasi dan follow up perbedaan fenotip pada kelompok masyarakat (Hartwell dkk., 2008). SNPs bisa digunakan sebagai marker untuk mengenal adanya mutasi allel pada gen yang tidak 42 sempurna atau cacat pada individu dengan kelainan genetik dan sebagian diantaranya diwariskan pada keluarga yang lain sebagai karier. Dengan analisis DNA individu yang palsu dan yang ada hubungannya dengan keluarga bisa dipisahkan mana allel yang normal dan mana yang mutasi (Hickey dkk., 2007). Selanjutnya diuraikan 3 bentuk gambar SNPs sebagai berikut: 43 SNPs - - Cys - - - Asn - - - Arg - - ___ A - T G T - A A T - A G A -___ ___ A - T G T - G A T - A G A -___ - - Cys - - - Asp - - - Arg - - functioning or non-functioning protein? Gambar 2.15 single nucleotida polymorphism (SNPs), dipetik dari Wikipedia SNPs, 2010 2.6.2 Mikrosatelit Mikrosatelit merupakan pengulangan nukleotida dan pengulangan segmen yang dideteksi dengan cara sequensing, biasanya sederhana, berisi dua, tiga atau empat nukleotida yang diulang, nukleotida ini bisa diulang 10-100 kali. kejadian mikrosatelit sering ditemukan pada manusia dan genom lainnya, biasanya kejadiannya setiap seribu pasang basa, ada allel yang bervariasi dalam genom (microsatellite Wikipedia, 2010). Unit pada genom dari manusia atau organisme yang komplek lainnya, berada pada lokus yang didapat dengan cara skuenzing yang berulang. Mikrosatelit disebut juga SSRs ( simple sekuensing repeate ). Mikrosatelit meningkat secara spontan dari 44 pemeriksaan random pada awal produksi dengan empat dari lima pengulangan. Mikrosatelit merupakan polimorfisme dengan banyaknya allel yang berbeda pada locus mikrosatelit. Allel yang baru timbul pada lokus mikrosatelit rata-rata 10-3 per lokus gamet. Frekwensi dari peningkatan variasi rata-rata 10-9 dan menghasilkan variasi besar pada populasi. Pada saat yang sama rata-rata mutasi mikrosatelit adalah rendah (Hartwell dkk., 2008). Selanjutnya diuraikan gambar mikrosatelit sebagai berikut: Gambar 2.16 Mikrosatelit, dipetik dari Wikipedia Microsatellite, 2010 2.6.3 Minisatelit Merupakan katagori penting yang ke dua dari pengulangan DNA yang merupakan bentuk yang lebih besar. Pengulangan unit tersebut antara 20 – 100 base-pare dan unit trersebut diulang sampai seribu perlokus. Disini diberikan lokus minisatelit jumlah panjang lokus 0,5-20 kb. Baik mikrosatelit maupun minisatelit meningkat dari kejadian random beberapa ribu genom pada semua vertebrata. Minisatelit lokus kejadian polimorfisme tinggi sekali disebabkan kromosom yang homogen dengan bagian dari banyaknya pengulangan yang pendek sampai yang panjang. Secara genetik banyaknya lokus minisatelit yang melakukan penyilangan hybrid 5-10 lokus yang menjadi distribusi genom. Dengan menggunakan beberapa minisatelit yang sekuensingnya di hibridisasi 45 dapat ditunjukan pada genom. Prekwensi multi lokus adalah 1 : 100.000 base-pare dari 30.000 genum pada manusia (Hartwell dkk., 2008). Selanjutnya diuraikan gambar minisatelit sebagai berikut: Gambar 2.17 Minisatelit, dipetik dari Wikipedia Minisatelit, 2010 2.6.4 Dilesi, duplikasi dan insersi pada lokus yang tidak diulang ( Indel) Perubahan DNA pada katagori yang luas menghasilkan kejadian mutasi yang luas atau tidak berulangnya lokus DNA oleh delesi, duplikasi atau insersi satu atau lebih base-pair. Mutasi ini umumnya disebut indels, besarnya berkisar antara satu atau lebih base-pair sampai multipel megabase-pair. Dilesi yang kecil dan duplikasi dari sebagian kecil base-pair sampai kilo base-pair yang sangat panjang sering meningkat dari ketidaksamaan penyilangan antara tempat non homolog selama rekombinasi miotik. Bahan dilesi yang hilang dari satu homolog akan ditambahkan dengan duplikasi yang lainnya. Insersi yang kecil besarnya berkisar dari ratusan sampai ribuan base-pair dapat 46 juga disebabkan oleh pemindahan elemen yang terintegrasi secara random ke dalam genom. SNPs, mikrosatelit, minisatelit dan indels yang tidak berulang pada penyiapan lokus merupakan dasar mendeteksi perbedaan genotif diantara individu. Satu perbandingan sekuensing DNA atau penelitian analitik mempunyai identifikasi DNA yang berfariasi atau kumpulan dari variasi atau penelitian yang dapat digunakan. Ini merupakan tehnik pertama untuk mendeteksi langsung polimorfisme DNA (Hartwell dkk., 2008). Selanjutnya diuraikan gambar indel sebagai berikut: Gambar 2.18 Indel, dipetik dari Wikipedia Indel, 2010 47 2.6.5 Bagaimana mendeteksi perubahan allel pada sepanjang lokus SNPs dari polimorfisme DNA ditegaskan oleh beberapa bagian dari sequenzing DNA, yang menghasilkan semua cara deteksi didasarkan pada kemampuan mendeteksi variasi nukleotida. Dapat dikatagorikan tiga katagori DNA Polimorfisme yaitu mikrosatelit, minisatelit dan delesi / duplikasi/ insersi semuanya merupakan variasi secara actual ukuran dari lokus. Allel yang besarnya berbeda dari satu alell lainnya dapat secara langsung dan dengan mudah dikenal dengan elektroporesis gel. Apabila perbedaan besarnya antara allel lebih kecil dari 1 kb, penentuan genotip dapat dengan mudah dan cepat dapat diikuti. Pengerjaannya mulai dengan menggunakan sepasang primer tambahan untuk sequenzing pada salah satu pinggiran dari polimorfisme sebenarnya diperjelas dengan PCR pada lokus dari DNA secara individual. Kemudian produksi PCR dilakukan ekektroporesis gel untuk memisahkan fragmen DNA menurut besarnya. Setelah deberikan ethidium bromide allel menunjukan gerombolan yang spesifik. Semua kemungkinan genotip yang homozygote dan heterozygote dapat dikenal dengan jalan ini. Peneliti tunggal dapat menggunakan protokol ini untuk ratusan genotip dari sampel pada satu hari, tanpa peralatan khusus. Protokol ini juga dapat dipertanggungjawabkan menggunakan fluresensi primer tagged dan elektroporesis pada peralatan yang sama yang digunakan untuk sekuensing DNA secara otomatis. Sekarang fokus perhatian pada katagori khusus dari mikrosatelit dan minisatelit yang mana keduanya ditentukan sebagai polmorfisme yang berbeda pada jumlah dan pengulangan elemen (Hartwell dkk., 2008). 48 2.7. Kriptorkismus 2.7.1 Definisi kriptorkismus: Kriptorkismus merupakan kelainan saluran genitourinaria berupa tidak sempurnanya penurunan testis ke dalam skrotum yang sering ditemukan pada anak kecil. Testis yang tidak turun ke skrotum dapat berada pada saluran yang normal di antara ginjal dan bagian dalam skrotum (Kaefer, 2004), atau testis terletak pada salah satu tempat sepanjang jalur desensus yang normal, tetapi tidak mencapai tempat kedudukannya yang normal di dalam skrotum (Styne, 2002). Kriptorkismus merupakan kondisi patologi berupa kegagalan testis turun ke dalam skrotum, kadang-kadang karena kriptorkismus terjadi atropi tubulus semineferus dan lokasi testis pada kriptorkismus dapat berada di canalis inguinalis, daerah preskrotal atau daerah abdomen (Moretti dkk., 2007; Hutson, 2007). Istilah kriptorkismus berasal dari kata Yunani cryptos yang berarti tersembunyi, dan orchis yang dalam bahasa latin disebut sebagai testis. Kriptorkismus murni sering ditemukan pada bayi prematur, namun testis masih dapat turun selama satu tahun pertama kehidupannya (Wales dkk., 2003). Pada pemeriksaan Ultrasonografi (USG), banyak penulis yang meragukan kemampuan ultrasonografi untuk menditeksi testis intraabdominal oleh karena masih ada musuh utama bagi transduser USG ialah bayangan usus dan udara di dalam abdomen yang dapat memberikan artefak dan menghalangi identasi struktur organ disekitarnya. 49 2.7.2 Insiden kriptorkismus Oleh karena menurunnya testis terjadi selama kehidupan fetus, maka insiden dari kriptorkismus tergantung dari usia kehamilan dari bayi tersebut. Maksimum 30% bayi lakilaki yang prematur mempunyai testis yang tidak turun. Insiden ini menurun menjadi 3 sampai 5% pada bayi yang lahir cukup bulan. Penurunan testis akan terus berlangsung pada beberapa pasien selama satu tahun kehidupannya, yang mana pada usia satu tahun insiden kriptorkismus maksimal 0,8%. Penurunan testis pada bayi setelah lahir kebanyakan karena pengaruh testosteron neonatus dalam usia 3 bulan pertama. Walaupun sebelumnya testis dapat turun sampai usia satu tahun setelah lahir, kebanyakan testis akan turun secara spontan dalam 3 bulan pertama kelahiran. Kriptorkismus unilateral insiden biasanya dua kali kriptorkismus bilateral, dan kriptorkismus dektra insiden biasanya dua kali kriptorkismus yang sinistra. Disamping itu tidak ditemukan adanya perbedaan insiden antara ras (Kaefer, 2004). Penelitian prospektif mendapatkan prevalen kriptorkismus pada bayi dengan berat lahir lebih atau sama dengan 2500 gram, meningkat di United Kingdom dari 2,7% menjadi 4,1% antara tahun 1950 dan tahun 1990. Pada Negara lain dengan penelitian yang sama selama dua decade bervariasi antara 2,1% menjadi 8,4%. Selanjutnya terjadi penurunan testis spontan dan tinggal 0,9% sampai 1,8 % pada usia 3 bulan (Virtanen & Toppari., 2008), dilain pihak kriptorkismus ditemukan 1-4% pada bayi lakilaki yang lahir (McGlynn dkk., 2005). 50 2.7.3 Etiologi dan patogenesis kriptorkismus Kausa kriptorkismus ialah multiple dan mungkin berbeda pada kasus yang satu dengan yang lain, beberapa hal yang dianggap menentukan ialah: Meliputi kelainan axis hipotalamus-hipofise-testis. Hipotalamus menghasilkan GnRH, Hipofise anterior menghasilkan FSH, dan LH, sedangkan testis terdiri dari sel sertoli yang menghasilkan AMH, dan sel leydig yang menghasilkan hormon testosteron dan hormon INSL3. Desensus testis tidak terjadi pada mamalia yang hipofisenya telah diangkat, ini menandakan bahwa kekurangan FSH dan LH menyebabkan terjadinya kriptorkismus. Pemberian hormon gonadotropin pada pengobatan kriptorkismus ternyata efektif, maka itu dikemukan anggapan bahwa kriptorkismus disebabkan oleh defisiensi sekresi gonadotropin. Kekurangan hormon INSL3 akan mengakibatkan kriptorkismus karena hormon INSL3 menyebabkan pertumbuhan gubernakulum dan terjadinya desensus testis tranabdominal, demikian juga kekurangan AMH akan menyebabkan kriptorkismus karena AMH terjadi regresi duktus mulleri, demikian juga halnya kekurangan hormon testosteron akan menyebabkan kriptorkismus juga karena hormon testosteron menyebabkan regresi CSL dan regresi gubernakulum untuk desensus testis traninguinal (Foresta dkk., 2008). Peningkatan hormon estrogen dicurigai akan menekan rangsangan untuk turunnya testis karena hormon estrogen dicurigai menekan sel leydig testis dalam memproduksi INSL3 dan testosteron (McGlynn dkk., 2005). Menurut Wales dkk (2003) kriptorkismus dapat disebabkan oleh faktor-faktor mekanik atau kegagalan hormonal . Kadang-kadang bisa juga disebabkan oleh mutasi gen Insl3 yang mengontrol kontraksi gubernakulum. Frekuensi kriptorkismus meningkat pada : defisiensi gonadotropin, disgenesis testis termasuk kelainan kromosom, malformasi 51 congenital dan sindrom-sindrom. Pada aplasia hipofise ditemukan bayi lahir dengan cukup bulan mengalami mikropenis dan bilateral kriptorkismus, 2 jam setelah dilahirkan diperiksa kadar gula darahnya rendah, hormon testosteronnya rendah, defisiensi dehidrotestosteron, GH defisiensi sehingga diagnosisnya panhipopituitarisme. Di samping itu dapat diperkirakan penyebab mikropenis : 30% oleh karena hipopituitarisme, 25% oleh karena hipogonad primer dan 45% idiopatik. Mikropenis dengan hypoglikemia menjelaskan congenital hipopituitarism (Cervantes dkk., 2006). Pada hipogonad dan infertilitas ditemukan maksimum 40% prolaktinoma dari 60% adenoma hipofise dan menyebabkan terjadinya hipogonad (Gillam dkk., 2006). Adapun beberapa faktor risiko kriptorkismus adalah bayi berat lahir rendah, kelainan malformasi (hipospadia, kelainan epididimis dan hernia inguinalis) (Thonneau dkk, 2003). 2.7.4. Klasifikasi kriptorkismus Undescended testis (UDT) diklasifikasikan menjadi: testis teraba dan testis tidak teraba, testis teraba terdiri dari testis retraktil, testis ektopik dan murni UDT sedangkan testis tidak teraba diklasifikasikan menjadi testis intraabdominal dan canaliculer ( di dalam canalis inguinalis) . UDT umumnya kebanyakan inguinal (63%) diikuti preskrotal (24%), ektopik (12%) dan intraabdominal (8%). Perlu dibedakan antara murni kriptorkismus, testis retraktil dan testis ektopik untuk penanganan dan implikasi prognosis (Bajpai & Menon., 2008). Testis ektopik merupakan penyimpangan turunnya testis dari saluran yang normal, tidak melalui cincin inguinalis ekterna dan tidak berhubungan dengan kerusakan testis atau transformasi keganasan. Umumnya yang menjadi tempat dari testis ektopik adalah: bagian 52 luar dari kantong inguinal, pada perineum, kanalis femoralis, daerah suprapubik dan kontralateral dari skrotum. Testis ektopik bisa dibedakan dengan kriptorkismus oleh adanya pertumbuhan skrotum yang normal dan tidak adanya hernia inguinalis. Testis retraktil merupakan bentuk lain dari penurunan testis ke dalam skrotum dimana aktipnya reflek otot kremaster menyebabkan testis tertarik ke pangkal paha. Testis retraktil biasanya bilateral dan sering ditemukan pada anak usia 2-6 tahun, kejadiannya 20% dari anak lakilaki yang normal dimana testis masih dapat dimanipulasi samapi ke bagian bawah skrotum. Dengan membesarnya volume testis pada pase pubertas kejadian ini akan menjadi normal. Kejadian ini perlu dibedakan dengan kriptorkismus karena pertumbuhan skrotum normal dan tesis bisa turun ke skrotum (Bajpai & Menon., 2008). Maksimum 20% kriptorkismus testisnya tidak teraba pada pemeriksaan klinis, testis kebanyakan berada disebelah kiri. Dari testis yang tidak teraba 50%-60% kasus testisnya masih utuh dan berada pada posisi intraabdominal atau inguinal dan yang sungguhsungguh tidak ada sekitar 20% dari kasus. Testis yang naik atau kriptorkismus yang didapat sering ditemukan pada anak yang sebelumnya testis sudah turun di skrotum. Pada anak laki-laki yang testisnya sudah turun saat dilahirkan, tetapi selama masa anak-anak sering antara usia 4-10 tahun testis tidak masih ada di skrotum ( Bajpai & Menon., 2008). Menurut Kaufer (2004) kriptorkismus dapat diklasifikasikan berdasarkan etiopatogenesis, lokasi testisnya atau gambaran histopatologik. Dalam klinik yang sering digunakan berdasarkan lokasinya : 53 2.7.4.1 Klasifikasi berdasarkan etiopatogenesis : 1. Mekanis / anatomik ( perlekatan-perlekatan, kelainan kanalis inguinalis) 2. Endokrin/hormonal (kelainan axis hipotalamus-hipofisis-testis) 3. Disgenetik (Kelainan interseks multipel) 4. Herediter/ genetik 2.7.4.2 Klasifikasi berdasarkan lokasi 1. Skrotal tinggi (supraskrotal) : 40% 2. Intrakanalikular (inguinal) : 20% 3. Intraabdominal (abdominal ) : 10% 4. Terobstruksi : 30% 2.7.4.3 Klasifikasi berdasarkan gambaran histopatologik 1. Tipe I : Kelainan minimal 2. Tipe II : Hipoplasia germinal berat dan hipoplasia tubular ringan sampai berat, sel sertoli normal 3. Tipe III : Hipoplasia germinal dan tubular berat, hipoplasia sel sertoli 4. Tipe IV : Hipoplasia germinal dan tubular, hyperplasia sel sertoli Selanjutnya diuraikan tabel perbandingan UDT, testis ektopik dan testis retraktil sebagai berikut: 54 Tabel 2.2 Perbandingan Undescended testis, testis ektopik dan testis retraktil, dipetik dari ( Bajpai & Menon, 2008) Gambaran Uudescended testis Testis ektopik Testis retraktil Abnormalitas Testis tidak turun Deviasi dari normal Reflek kremaster meningkat Histologi testis Testis disgenesis Testis normal Testis normal Skrotum Perkembangan kurang baik Perkembangan normal Perkembangan normal Spermatic cord Panjang Panjang Normal Hernia Sering Jarang Tidak ada Komplikasi Keganasan, infertilitas Trauma Jarang 2.7.5 Komplikasi kriptorkismus 2.7.5.1 Infertilitas Insiden azoospermia lebih tinggi pada klompok kriptorkismus bilateral dari pada unilateral dan keadaan semen lebih baik pada yang unilateral (Moretti dkk., 2007). Menurut Moldenhauer dkk (2003) pada UDT unilateral / bilateral ditemukan infertilitas 30%-80%. Sampai usia satu tahun, secara histologi testis yang belum turun ke skrotum masih normal, termasuk masih normalnya populasi sel interstitial dan sel germinal. Pada usia 18 bulan kedua sel tadi dengan mikroskop elektron mengalami perubahan histologi berupa kerusakan populasi sel germinal. Keadaan yang sama juga terjadi pada usia 2 tahun pada testis kontralateral yang tidak turun. Secara klinis pada kriptorkismus terjadi penurunan fertilitas, Setelah orchidopeksi, penurunan fertilitas terjadi 50 sampai 70 % pada kriptorkismus unilateral dan 75% pada kriptorkismus bilateral (Kaefer, 2004). 55 Menurut Bajpai & Menon (2008) secara histology sel germinal sudah mengalami kerusakan pada UDT mulai anak usia 6-12 bulan bila testis tidak masuk ke dalam skrotum. Kerusakan yang terjadi berupa lambatnya maturasi sel germinal, menurunnya jumlah sel germinal, tubulus seminiferus mengalami hialinisasi dan menurunnya jamlah sel leydig yang khusus. 2.7.5.2 Keganasan Pada Negara industri dalam 10 tahun terakhir terjadi peningkatan insiden ca testis yang bersamaan dengan peningkatan insiden kriptorkismus (Thonneau dkk., 2003). Individu yang lahir dengan UDT mempunyai insiden keganasan maksimum 40 kali dibandingkan dengan yang lahir testisnya ada diskrotum (Kaefer, 2004), sedangkan Bajpai & Menon (2008) mengatakan risiko keganasan pada UDT adalah 4-10 kali lebih tinggi dibandingkan pada populasi normal dan maksimum 1 dari 80 UDT unilateral dan 1 dari 40 UDT bilateral. Sedangkan usia terjadinya keganasan adalah 15-40 tahun. Maksimum 10% dari testis yang berkembang menjadi tumor testis mempunyai riwayat UDT. Insiden keganasan testis meningkat dengan tingginya lokasi UDT testis dan tumor testis enam kali lebih banyak pada testis abdominal dibandingkan dengan testis inguinal. Kira-kira dari 14% testis intraabdominal, berkembang 50% nya menjadi tumor testis . Pada pengamatan 10-20% tumor testis yang ditemukan pada pasien kriptorkismus yang mengalami penurunan normal ditemukan mempunyai kelainan intrinsic (Kaefer, 2004). Keganasan yang sering terjadi pada testis kriptorkid ialah tumor sel germinal dan yang terbanyak ialah seminoma (43%). 56 2.7.5.3 Hernia inguinalis Maksimum 90% dari UDT disertai menetapnya prosesus vaginalis. Hernia inguinalis tidak langsung ditemukan banyak pada kasus penurunan testis yang minimal dan dengan epididimis yang abnormal. Testis ektopik insiden hernia inguinalisnya rendah. Walaupun menetapnya prosesus vaginalis sering kecil pada operasi hernia sebaiknya digabungkan dengan orkidopeksi (Kaefer, 2004). 2.7.5.4 Torsi testis Torsi testis merupakan komplikasi kriptorkismus yang juga penting. Kejadian ini bahkan dapat terjadi sebelum lahir. Diperkirakan bahwa insidennya mungkin lebih tinggi dibandingkan testis scrotal normal. Torsi testis yang berhubungan dengan kriptorkismus biasanya torsi intravaginal, yang mungkin diinduksi banyaknya kelainan pada persambungan epididimis-testis, maupun karena kemungkinan terkena trauma pada testis inguinal lebih tinggi dibandingkan testis skrotal. Torsi funikulus spermatikus juga dapat terjadi sekunder terhadap suatu tumor pada testis kriptorkid (Kaefer, 2004). 57 2.7.5.5 Masalah psikologis Pada penderita kriptorkismus sering terdapat masalah psikologis sejak masa anakanak, dan bertambah pada pubertas. Hal itu dapat terjadi bila anak itu membandingkan bentuk tubuhnya dengan anak yang lain. Masalah psikologis sudah dapat mulai timbul pada usia 4 tahun (Kaefer, 2004). 2.7.6 Terapi pada kriptorkismus 2.7.6.1 Terapi hormonal pada kriptorkismus Bila kemungkinan turunnya testis masih diragukan pada kriptorkismus dan kasusnya diperkirakan disebabkan oleh kekurangan gonadotropin sentral, kasus tersebut dapat diberikan suntikan hCG 500 unit secara intra muskuler dua kali seminggu selama 5 minggu pada usia 1-6 tahun, dan 1000 unit dua kali seminggu pada anak yang lebih besar. Bila hasilnya tidak memuaskan, bisa dilanjutkan dengan pembedahan (Wales dkk., 2003; Kaefer, 2004). Pemberian rekombinan human FSH (r-hFSH) merangsang pertumbuhan prepubertal testis dan peningkatan kadar inhibin B dalam sirkulasi. Hal ini terjadi karena rangsangan imatur kepada sel sertoli. Pubertas berhasil dengan rangsangan hCG dan r-h FSH. Inhibin B digunakan untuk memonitor aktivitas spermatogenesis pada bayi laki-laki yang diobati dengan hCG ( Raivio dkk., 2007). 2.7.6.1.1 Human chorionic gonadotropic hormone (hCG) Human chorionic gonadotropin (hCG) telah digunakan untuk pengobatan kriptorkismus sejak lama. hCG ini mempunyai cara kerja seperti LH melalui perangsangan terhadap sel Leydig untuk memproduksi testosteron yang kemudian secara 58 sendiri atau melalui Dehidro-testosteron (DHT) akan menginduksi turunnya testis. Keberasilan pengobatan dengan menggunakan hCG ini sangat bervariasi, berkisar antara 20-55%. Keberasilan terapi dengan hCG ini banyak ditentukan oleh posisi testis sebelum terapi. Hasil yang lebih baik didapatkan pada testis letak tinggi di inguinal dan testis yang retraktil, sedangkan pada testis yang terdapat di rongga abdomen hasilnya kurang memuaskan (Wales dkk., 2003). 2.7.6.1.2 Luteinizing hormon-releasing hormon (LHRH) LHRH diberikan pada penderita kriptorkismus dengan maksud terjadinya perangsangan terhadap hipotalamus untuk menghasilkan LH dan FSH yang kemudian akan merangsang sel Leydig untuk menghasilkan testosteron yang berfungsi dalam proses penurunan testis. LHRH diberikan secara nasal spray dosis 1,2 mg perhari. Nasal spray ini diberikan 200 µg perkali semprotan tiap lubang hidung sebanyak 3 kali sehari. Hasil pengobatan dengan LHRH ini sangat bervariasi. Pada penelitian yangdilakukan Bertelsen dkk dengan menggunakan dosis 1,2 mg LHRH perhari selama 4 minggu didapatkan penurunan testis pada 24% kasus (Wales dkk., 2003). 2.7.6.1.3 Kombinasi LHRH dengan hCG Beberapa peneliti melakukan pengobatan kombinasi antara LHRH dengan hCG. Pada permulaan diberikan LHRH nasal spray kemudian dilanjutkan dengan hCG. Mereka mendapatkan hasil yang lebih baik. Terapi kombinasi ini dilakukan untuk mengurangi terjadinya relaps pada pengobatan dengan LHRH saja (Wales., 2003). 2.7.6.2 Terapi bedah pada kriptorkismus 59 Kadar testosteron pada anak-anak anorchid tidak meningkat terhadap stimulasi hCG, sedangkan dengan testis normal selalu memberi respon pada umur berapapun. Dengan adanya respon testosteron negatif terhadap stimulasi hCG dan meningkatnya kadar gonadotropin basal, test hormone ini membuktikan adanya anorchidism congenital. Bentuk pembedahan secara orkidopeksi yang biasanya dikerjakan pada pasien kriptorkismus yang tidak mungkin turun, waktu yang baik untuk orkidopeksi adalah usia 2 sampai 3 tahun (Wales dkk., 2003; Kaefer, 2004). Tujuan operasi bedah adalah untuk mobilisasi testis dan arteri spermatika yang adekuat, operasi hernia yang menyertainya dan fiksasi testis adekuat di dalam skrotum. Banyak macam insisi dan tehnik fiksasi telah dideskripsikan. Kebanyakan adalah insisi inguinal dengan diseksi testis dan cord ekstraperitoneal. Laparoskopi dapat dilakukan untuk menemukan testis intraabdominal secara akurat dan melihat vas spermatika dan vas deferens memasuki annulus inguinalis interna. Laparoskopi juga dapat menemukan arteri spermatika yang buntu atau pembuluh darah di dalam abdomen. Pettersson dkk (2007) melakukan penelitian kohort pada anakanak kriptorkismus yang dilakukan orchidopeksi antara tahun 1964-1999 di Swedia menemukan bahwa pengobatan UDT sebelum masa pubertas dapat menurunkan risiko ca testis. Selanjutnya diuraikan gambar diagnosis dan terapi pada UDT sebagai berikut: 60 UDT Perabaan testis Testis teraba Perkembangan skrotum Tistis tidak teraba tes hCG Normal Testis retraktil atau ektopik Tidak ada UDT Coba dg hCG Tidak diobati Testis turun diawasi Positip UDT Negatip Anorchia Laparoscopy Tidak ada respon Orkhidopeksi Operasi Gambar 2.19 Diagnosis dan terapi pada UDT, dipetik dari Bajpai & Menon, 2008 2.8 Teknik Enzyme-linked Immune-sorbent Assai (ELISA) untuk Asai Hormon Prinsip pemeriksaan hormon dengan ELISA menggunakan tabung kecil yang standar disebut mikroplate biasanya isinya 96 lubang atau 96 sumuran. Pada mikroplate tertulis mereknya: Tissue Culture Test Plate, gama sterilred non pyrogenus disposible. Pada tes ELISA ada 2 metoda: 2.8.1 Teknik kepcher laesa atau teknik zandwit laesa ( hormon Estradiol ) 2.8.2 Teknik kompetitive laesa ( hormon INSL3) 61 2.8.1 Teknik kepcher laesa: Antibodi yang berhubungan dengan zat yang kita cari misalnya hormon estradiol, ditempelkan di sumuran (lubang mikroplate) dengan cloting buffer didiamkan selama 24 jam kemudian antibodi nempel pada sumuran selanjutnya mikroplate dicuci bersih namun antibodi yang sudah terlanjur nempel tidak bisa dicuci, sehingga bila ditambah plasma, hormon estradiolnya ditangkap oleh antibodi. Bila hormon estradiol konsentrasinya banyak maka yang diikat juga banyak, bila sedikit yang diikat sedikit. Kemudian mikroplate dicuci bersih, estradiol yang sudah diikat dilacak dengan penambahan antibodi yang kedua yang sudah dilabel dengan enzim, kemudian ditambahkan substrat dan antibodi yang kedua jadi berikatan dengan estradiol. Bila hormon estradiol banyak maka antibodi kedua yang diikat banyak, enzim yang diikat banyak dan substrat yang diikat juga banyak sehingga warnanya makin pekat. Antibodi pertama biasanya monoclonal hanya satu yang diikat. Tinggi rendahnya warna tergantung keperluan. Kadarnya ditentukan dengan membuat standar dengan kelipatan 2, biasanya memakai 7/8, konsentrasinya 100, 50, 25, 12,5, 6,75……… . kepekatan warna dibaca dengan spiktrofotometer, angka diset dai 0 sampai 3, konsentrasinya 0,1 sampai 3,0. Caranya standar dibuat di kertas grafik untuk menilai konsentrasi. Misalnya: konsentrasi 100% dengan OD 2,5, konsentrasi 50 % dengan OD 2,0, konsentrasi 25%, dengan OD 1,7, selanjutnya OD 0,2 . Supaya antibodi tidak lengket perlu ditambahkan blocking buffer (susu atau albumin), jadi sampel tidak berikatan dengan dinding mikroplate tapi berikatan dengan antibodi ( Astawa, 2010 ). 62 2.8.2 Teknik kompetitif : bisa dilakukan dengan 2 cara: 2.8.2.1 Teknik kompetitif 1: Pada teknik ini yang titempel pertama pada mikroplate pertama adalah antigen standar (estradiol atau INSL3). Selanjutnya pada mikroplate kedua ( di luar) setiap sampel ditambahkan antibodi standar yang sudah disiapkan oleh kit, kemudian setelah bereaksi diluar baru ditambahkan pada mikroplate yang sudah berisi antigen standar. Pembacaannya terbalik yang konsentrasi tinggi angkanya rendah karena antibodi yang terisi sedikit, dan yang konsentrasi rendah angkanya tinggi karena antibodi yang berikatan banyak ( Asatawa, 2010; Anonim, 2010 ). 2.8.2.2 Teknik kompetitif 2: Plat pertama titempelkan antibodi yang spesifik, kemudian ditambahkan sampel darah sama dengan kepcher Laesa, kemudian dicuci, selanjutnya ditambahkan antigen yang dilabel dengan biotin ditambah avidin yang dilabel dengan enzim HRP kemudian ditambahkan substrat, avidin akan berikatan dengan biotin dan warna akan pekat. sampel negatip warna pekat, 2 sampel rendah warna sedikit kurang pekat, 3 sampel sedang warna sedang, 10 sampel tinggi warna bening atau mendekati 0. Untuk menghitung konsentrasi dibuat label, misalnya konsentrasi 100, OD 0,1, yang sedang OD 2,3, paling tinggi OD 3. Antara teknik kepcher Laesa dan Kompetitif Laesa yang membedakan kemampuan deteksi, biasanya teknik Kepcher Laesa paling sensitif. INSL3 memakai teknik kompetitif strategi b, dan INSL3 diencerkan 1000 ( INSL3 assay Phoenix). INSL3: Imunoplate yang sudah diisi imuno antibodi akan berikatan dengan antigen yang sudah dilabel dengan biotin + antigen standar yang disatukan 63 dengan kitnya atau dengan antigen yang ada di sampel dideteksi. Dipakai avidin ( bidsa dari putih telor atau dari streptokokus) , disini digunakan avidin dari streptokokus disebut streptosidin dan label dengan enzim Horse Radice Peroxidase (HRP) ( Astawa, 2010; Anonim, 2010). 2.9 Polymerase Chain Reaction (PCR) Komponen yang diperlukan pada pemeriksaan PCR adalah: DNA templet, Premer, dNTP, dan tag polimerase. Premer digunakan untuk membatasi daerah pada DNA yang mau diamplifikasi, kemudian DNA yang double strain di denaturasi (dilonggarkan) pada suhu 950C, kemudian dilakukan annealing (menempelkan premer ke templet DNA) pada suhu 55650C atau tergantung melting tempratur premer dimana suhu annealing sedikit di bawah suhu melting tempratur premer, setelah nempel dilakukan polimerasi dengan menambahkan dNTP dan diektensi ( dipanjangkan ) pada suhu 720C sehingga didapatkan 2 double strain pada satu siklus PCR . PCR diulang 30 silkus . adapun total amplifikasi DNA adalah 2n . Pada saat PCR kita melihat DNA bening selanjutnya dicampur dengan loading dye untuk pemurnian, fungsinya memberatkan DNA dan sejauh mana dia sudah bergerak dalam gel. DNA bermuatan (-) pada saat ranning dijalankan dipakai etidium bromide yang berikatan dengan DNA supaya DNA dapat dilihat berwarna putih di bawah sinar ultraviolet kemudian di foto (Setianingsih, 2010). 64 BAB III KERANGKA BERPIKIR, KONSEP, DAN HIPOTESIS PENELITIAN 3.1 Kerangka Berpikir Dari landasan teori di atas dapat dibuat kerangka berpikir sebagai berikut : Gen : sry sf1 wt1 sox9 gata4 hoxa10 insl3 Hormon: GnRH FSH LH hCG T.Intra abdominal CSL GFN & CGRP Testis di Abdominal AMH Sel Sertoli Sel Leydig Hormon : INSL3 Testosteron Usia Kehamilan ibu Estradiol Gambar 3.1 Gubernakulum Gen lgr8 Testis di Inguinal Reseptor LGR8 Testis di Skrotum Kerangka berpikir 64 65 3.2 Konsep Penelitian Berdasarkan kajian pustaka dan permasalahan yang dihadapi, maka disusun suatu kerangka konsep penelitian seperti gambar di bawah ini: polimorfisme gen lnsl3, polimorfisme gen lgr8, kadar hormon INSL3 plasma yang rendah dan kadar hormon estradiol plasma yang tinggi merupakan faktor risiko terjadinya kriptorkismus. Variabel yang pengaruhnya dianggap sama pada kelompok kontrol dan kasus adalah: Kadar hormon testosteron, AMH dan tekanan intraabdominal. Hormon testosteron menyebabkan regresi gubernakulum, kadarnya dianggap normal dan sama antara kasus dan kontrol karena kelainan penis ( hipospadia, kordae, mikropenis) di ekslusi. Populasi : anak laki-laki usia 0-18 th Usia Pertumbuhan gubernakulum Polimorfisme gen lgr8 Polimorfisme gen insl3 Regresi gubernakulum T.intra abd AMH Kriptorkismus Reseptor LGR8 Hormon INSL3 Hormon estradiol Hormon testosteron, GFN & CGRP Gambar 3.2 Konsep penelitian Keterangan: Diperiksa : polimorfisme(exon 1,exon 2)gen insl3,polimorfisme(exon 8,exon 12,exon 13) ( ) gen lgr8, hormon INSL3, hormon estradiol, kriptorkismus, dan usia. Tidak diperiksa: reseptor LGR8, pertumbuhan gubernakulum, regresi gubernakulum, (----) hormon testosteron, AMH, GFN &CGRP, dan tekanan intraabdominal 66 3.3 Hipotesis Penelitian 1. Adanya frekuensi polimorfisme ( exon 1, exon 2 ) gen insl3, frekuensi polimorfisme ( exon 8, exon 12, exon 13 ) gen lgr8 pada anak laki-laki yang kriptorkismus. 2. Polimorfisme ( exon 1, exon 2 ) gen insl3 merupakan faktor risiko kejadian kriptorkismus pada anak laki-laki. 3. Polimorfisme ( exon 8, exon 12, exon 13 ) gen lgr8 merupakan faktor risiko kejadian kriptorkismus pada anak laki-laki. 4. Kadar hormon INSL3 plasma yang rendah merupakan faktor risiko kejadian kriptorkismus pada anak laki-laki. 5. Kadar hormon estradiol plasma yang tinggi merupakan faktor risiko kejadian kriptorkismus pada anak laki-laki. 67 BAB IV METODE PENELITIAN Penelitian ini merupakan penelitian observasional dengan case control study. 4.1 Rancangan Penelitian Observasional dengan Case Control Study Retrospektif Kasus Populasi FR + FR FR + F FR - Kontrol Gambar 4.1 Bagan rancangan penelitian observasional dengan case control study Catatan : Populasi: anak laki-laki usia 0-18 tahun. Kasus : anak laki-laki dengan Kriptorkismus positip (testis tidak ada di skrotum). Kontrol : anak laki-laki dengan Kriptorkismus negatip ( testis ada di skrotum ). FR + : polimorfisme (exon 1, exon 2) gen insl3, polimorfisme (exon 8, exon 12, exon 13) gen lgr8, hormon INSL3 plasma rendah, hormon estradiol plasma tinggi. FR - : gen insl3 normal, gen lgr8 normal, hormon INSL3 plasma normal, hormon estradiol plasma normal. 67 68 4.2 Lokasi dan Waktu Penelitian Penelitian dilakukan di Poliklinik anak RSUD Wangaya, RSUP Sanglah dan RB Permata Hati Denpasar, mulai bulan September – Desember 2010. Pemeriksaan hormonal dan sequenzing PCR bulan Januari – Maret 2011. 4.3 Penentuan Sumber Data 4.3.1 Populasi target Anak laki-laki usia 0- 18 tahun. 4.3.2 Populasi terjangkau Anak laki-laki usia 0-18 tahun di Poliklinik anak RSUP Sanglah, RSUD Wangaya, RB Permata Hati sejak bulan September sampai bulan Desember 2010. 4.3.3 Sampel Sampel dipilih secara konsekutif (non probability sampling ) dari populasi terjangkau. 4.3.4 Kriteria inklusi , eksklusi dan intended study subject 4.3.4.1 Kriteria inklusi 1. Anak laki-laki usia 0-18 tahun dengan kriptorkismus. 4.3.4.2 Kriteria eksklusi 1. Anak laki-laki usia 0-18 tahun dengan hipospadia. 2. Anak laki-laki usia 0-18 tahun dengan kordae (lipatan kulit). 3. Anak laki-laki usia 0-18 tahun dengan mikropenis 4.3.4.3 Intended study subject Adalah sampel yang memenuhi ketentuan kriteria inklusi dan kriteria ekslusi serta bersedia ikut serta dalam penelitian setelah menandatangani informed concent 69 4.3.5 Besar sampel penelitian n 2(Zα + Zβ ) P ( 1 – P ) = -------------------------------(P0 – Pt) Keterangan : n = Jumlah sampel masing-masing kelompok Zα = 1,96 ( α = 0,05 ) Zβ = 1,28 ( β = 0,1 kekuatan = 90% ) P0 = 0,024 ( Proporsi efek possitif pada kelompok kontrol ) Pt = 0,03 ( Proporsi efek positif pada kelompok kasus ) R0 = 1,25 P = ( Po + P1 ) /2 P = Prevalensi kriptorkismus (1-p) = Prevalensi non kriptorkismus Dari perhitungan rumus di atas didapatkan besar sampel masing-masing kelompok adalah 28,37 dibulatkan menjadi 29. Total sampel adalah 58 yang terdiri dari 29 anak laki- laki dengan kriptorkismus dan 29 anak laki-laki sehat. Drop out biasanya kecil karena Case Control Study tapi tetap diperhitungkan 5-10%, jadi kasus setelah diperhitungkan drop out jadinya 31 anak laki-laki kriptorkismus dan 31 anak laki-laki sehat. 4.3.6 Cara pemilihan sampel Dari populasi terjangkau penelitian ini diambil sampel kasus secara consecutive sampling dari catatan rekam medis anak laki-laki usia 0-18 tahun yang menderita kriptorkismus, kemudian diperiksa ulang oleh dokter spesialis anak konsultan endokrin 70 sesuai kriteria inklusi dan ekslusi setelah menandatangani informed consent jadilah kasus (sebanyak 31 kasus), kemudian masing-masing kasus dicarikan kontrol pada anak sehat yang tidak menderita kriptorkismus setelah diperiksa oleh dokter spesialis anak konsultan endokrin di Poliklinik anak RSUD Wangaya, RSUP Sanglah, RB Permata Hati yang di matching pada usia anak dalam tahun dan usia kehamilan (lahir kurang bulan atau cukup bulan), kontrol diambil sebanyak 31 orang. Pada kasus dan kontrol diambil masing-masing contoh darah vena sebanyak 6 ml. 4.4 Variabel Penelitian 4.4.1 Klasifikasi variabel Dari bagan kerangka konsep di atas dapat diklasifikasikan variabel-variabel penelitian sebagai berikut. 4.4.1.1 Variabel utama a. Variabel bebas : polimorfisme (exon 1, exon 2) gen insl3, polimorfisme (exon 8, exon 12, exon 13) gen lgr8, hormon INSL3, hormon estradiol b. Variabel antara : reseptor LGR8, gubernakulum c. Varibel tergantung: kriptorkismus 4.4.1.2 Variabel rambang ( random variable) a. Kadar hormon testosteron, GFN, CGRP b. Kadar AMH c. Tekanan intraabdominal 4.4.1.3 Variabel kendali (Controlled variable) a. Usia anak laki-laki (dalam tahun) b. Usia kehamilan (kurang bulan atau cukup bulan) 71 4.4.2 Definisi operasional variabel Untuk menghindari kesalahan dalam pengumpulan data maka variabel penelitian ini perlu didefinisikan seperti di bawah ini: 1. Usia : ialah usia anak laki-laki dalam tahun dan usia kehamilan (lahir kurang bulan dan lahir cukup bulan ) 2. Bayi lahir kurang bulan: ialah bayi yang lahir dengan usia kehamilan lebih kecil dari 37 minggu. 3. Bayi lahir cukup bulan: ialah bayi yang lahir dengan usia kehamilan lebih besar atau sama dengan 37 minggu. 4 . Kriptorkismus: ialah testis terletak pada salah satu tempat sepanjang jalur desensus yang normal, tetapi tidak mencapai tempat kedudukannya yang normal di dalam skrotum ( Styne, 2002), yang diperiksa dengan perabaan (anak dalam posisi tidur terlentang lutut ditekuk untuk pemeriksaan kemudian pemeriksa berada di sebelah kanan kaki anak, kemudian tangan kanan pemeriksa meraba testis di skrotum kanan dan kiri, bila tidak ketemu dilanjutkan meraba testis pada daerah inguinal secara milking ), bila ketemu tangan kanan memegang testis dan tangan kiri memegang orchidometer dan dibandingkan volumenya dalam ml. Volume testis yang diukur letaknya di skrotum, preskrotal dan inguinal. 5. Testis di skrotum: ialah kedua testis dapat ditemukan di skrotum, yang diperiksa dengan perabaan secara milking. 6. Hipospadia: ialah tidak sempurnanya penutupan uretra pada ventral penis yang disebabkan berhentinya perkembangan spongiosum uretra dan bagian ventral penis (Hughes, 2009). 72 7. Kordae: ialah lipatan kulit yang terbentang antara ventral penis dengan skrotum (Hughes, 2009). 8. Mikropenis: ialah panjang penis (dari pangkal ke ujung gland) dengan ditarik lebih besar dari 2,5 standar deviasi (SD) di bawah panjang rata-rata sesuai usia atau 1,9 cm ke bawah pada neonatus sampai bayi usia 5 bulan atau panjang penis maksimal 2,5 cm dengan ditarik (Hughes, 2009) 9. Kadar hormon estradiol plasma yang tinggi: ialah kadar hormon estradiol serum diukur secara ELISA dengan satuan ng/ml, lebih besar dari nilai optimum kurva ROC 10.Kadar hormon INSL3 plasma yang rendah: ialah kadar hormon INSL3 serum yang diukur secara ELISA dengan satuan ng/ml lebih kecil dari nilai optimum kurva ROC. 11. Polymerase chain reaction (PCR) : ialah merupakan teknik amplifikasi DNA spesifik secara invitro yang terdiri dari 3 tahap: denaturasi, anneling, polimerasi. 12. Sequenzing: ialah proses pemisahan template DNA menggunakan DNA polymerase primer, dNTP, dan ddNTP untuk menemukan mutasi atau polimorfisme gen. 13. Polimorfisme: merupakan variasi genetik dari lokus (lokasi gen pada kromosom) baik dalam ukuran besar maupun dalam jumlah allel yang dipunyai atau variasi dalam urutan basa pada DNA dan berulang lebih dari 1% pada populasi. Variasi ini bisa dalam bentuk SNPs, mikrosatelit, minisatelit maupun delesi, duplikasi dan insersi pada lokus yang tidak diulang (Kingston, 1997; Jorde dkk, 2006; Hartwell dkk, 2008). 73 4.5. Bahan Penelitian Bahan untuk pemeriksaan gen insl3 dan gen lgr8 adalah darah vena 3ml yang berisi EDTA, disimpan dalam bentuk DNA pada suhu -80oC. Sedangkan bahan untuk pemeriksaan hormon INSL3 dan hormon estradiol adalah darah vena 3 ml tanpa antikoagulan dicentrifuge pada suhu 4oC dan disimpan dalam bentuk serum yang dibagi dalam 4-6 tabung kecil, serum untuk pemeriksaan hormon INSL3 dan hormon estradiol disimpan pada suhu -80oC . 4.6. Intrumen Penelitian 4.6.1 Cara pengumpulan data 1. Wawancara: dilakukan kepada ibu atau ayah dari anak tersebut untuk mendapatkan data identitas, riwayat kehamilan dan riwayat persalinan. 2. Pemeriksaan fisik: termasuk pemeriksaan fisik secara umum dan status genitalia 3. Perabaan secara milking: ialah pemeriksaan untuk memeriksa lokasi testis dengan cara mengurut dari proximal. 4. Pemeriksaan laboratorium: untuk mendapatkan kadar hormon estradiol plasma dan kadar hormon INSL3 plasma, menemukan polimorfisme gen insl3, lgr8. 4.6.2 Alat pengumpulan data 1. Kuesioner terstruktur: adalah alat untuk mendapatkan data identitas, riwayat Kehamilan, riwayat persalinan. 2. Orkidometer: adalah alat yang terbuat dari kayu ukuran bulat lonjong dengan diameter mulai dari 1 ml sampai 20 ml untuk mengukur volume testis dengan membandingkan dengan alat tersebut. 3. Spatel kayu : ialah alat untuk mengukur panjang penis. 74 4. ELISA: ialah metode yang digunakan untuk mengukur kadar hormon estradiol dan kadar hormon INSL3 dalam serum. 5. Primer: ialah susunan nukleotida yang dipakai untuk membatasi bagian yang mau di amplifikasikan atau mau dibaca. 4.7 Prosedur Penelitian 4.7.1 Persiapan Sebelum penelitian ini dilaksanakan terlebih dahulu proposal dikirim ke Komisi Etik Penelitian, Unit penelitian dan pengembangan FK.UNUD/RSUP Sanglah untuk mendapatkan keterangan kelayakan Etik, kemudian dimintakan ijin untuk pelaksanaan penelitian kepada Direktur RSUD Wangaya, Direktur RSUP Sanglah, Direktur RB Permatahati dan Kepala SMF Anak RSUD Wangaya, kepala Bagian/SMF Anak FK UNUD/RSUP Sanglah. Selanjutnya setelah mendapatkan ijin, penelitian dilanjutkan dan sebelumnya orang tuanya menandatangani surat persetujuan. 4.7.2 Alur penelitian Dari populasi target yaitu anak laki-laki usia 0-18 tahun, kemudian dipilih populasi terjangkaunya di Poliklinik anak RSUD wangaya, RSUP Sanglah dan RB Permata Hati (multicenter), kemudian dibuatkan protokol pemeriksaan klinis dan protokol pengambilan sampel dengan menggunakan alat standar. Pemeriksaan klinis dilakukan oleh petugas yang terlatih dan dikonfirmasi oleh dokter spesialis anak konsultan endokrin, sedangkan pengambilan sampel darah dilakukan oleh petugas laboratorium prodia yang sudah terlatih, untuk mengurangi measurement bias atau recall 75 bias petugas tetap diobservasi oleh peneliti. Dari populasi terjangkau selanjutnya dilakukan kriteria inklusi dan kriteria eksklusi, kemudian diberikan informed concent didapatlah kasus anak yang kriptorkismus, kumudian dicarikan kontrol anak sehat yang diambilkan dari rumah sakit yang menjadi sampel (lihat bagan alur penelitian), untuk mengurangi selection bias atau confounding bias antara kasus dan kontrol dilakukan matching pada dua variabel yaitu usia anak dalam tahun dan usia kehamilan ( lahir kurang bulan dan lahir cukup bulan) antara kasus dan kontrol perbandingannya 1:1. Untuk lebih jelasnya bisa dilihat pada bagan alur penelitian sebagai berikut: 76 Populasi target *Anak laki-laki 0-18 th *Anak laki-laki 0-18 th di *Poli Anak: RSUW, RSUP, Populasi terjangkau *RB.Permata Hati K.Inklusi *Kriptorkismus *Berpartisipasi K.Eksklusi *Hipospadia *Kordae *Mikropenis Intended sample Informed consent Matching *Usia anak laki-laki *Usia kehamilan Kasus Anak laki-laki kriptorkismus Kontrol Anak laki-laki sehat Pemeriksaan hormon estradiol dan hormon INSL3 plasma dg ELISA Pemeriksaan hormon estradiol dan hormon INSL3 plasma dg ELISA PCR & Squencing gen Insl3 dan gen Llg8 PCR & Squencing gen Insl3 dan gen Lgr8 Analisis hasil penelitian/statistik Laporan Gambar 4.2 Bagan alur penelitian 77 4.7.3 Tata cara pengambilan sampel darah Pada anak laki-laki dengan kriptorkismus yang terpilih sebagai kasus dilakukan informed concent selanjutnya petugas prodia yang terlatih mengambil darah venanya sebanyak 6 ml, kemudian dibagi dua, 3ml dimasukkan ke dalam botol yang sudah berisi EDTA dan 3 ml lagi dimasukkan ke dalam botol yang tidak berisi antikoagulan. Kemudian darah yang berisi EDTA dan yang tidak berisi EDTA dibawa oleh petugas prodia tadi pada suhu 40C ke Laboratorium Biomolekuler FK UNUD dan diserahkan kepada petugas Laboratorium Biomolekuler FK UNUD yang sudah terlatih dan ditunjuk membantu pemelitian ini. Darah yang tanpa antikoagulan di laboratorium Biomolekuler FK UNUD oleh petugas yang ditunjuk langsung di sentrifuge pada suhu 4oC untuk mendapatkan serum, kemudian serumnya dibagi dua dimasukkan ke botol masing-masing, serum untuk pemeriksaan hormon INSL3 dan hormon estradiol disimpan pada suhu -80oC. Di Laboratorium darah yang dengan EDTA langsung diproses oleh petugas yang sudah terlatih dan ditunjuk untuk mendapatkan DNA kemudian DNA disimpan pada suhu -80oC (Freezer). Setelah mendapat kasus dicarikan kontrolnya yang di matching pada usia anak dalam tahun dan usia kehamilan, kemudian dilakukan informed concent selanjutnya diambil darah vena sebanyak 6 ml oleh petugas Laboratorium Prodia yang sudah terlatih dan kemudian sampel darah diperlakukan sama seperti sampel darah kasus. Proses ini dilakukan sama pada semua kasus dan kontrol sampai jumlahnya cukup. 78 4.7,4 Proses pengambilan DNA dari darah Darah 3 ml + EDTA yang disimpan pada suhu 40 C, kemudian ditambahkan larutan hipotonik Nacl 0,5% menyebabkan cairan hipotonik masuk ke dalam sel darah merah dan sel darah merah pecah, selanjutnya disentrifuge untuk mengendapkan sel yang berinti atau sel leukosit berupa pellet yang mengendap di bawah, cairan sel darah merah dibuang. Leukosit ada membran yang menyelubungi dan intinya berada di dalam sel, kemudian membran yang menyelubungi leukosit dirusak dengan ditambah deterjen atau ammonium asetat (senyawa yang bisa mengikat lemak, air dan bisa merusak protein ) selanjutnya disentrifuge lagi karena DNA ringan dan lemak dan sisa leukosit berat sehingga DNA mengambang dan lemak beserta sisa leukosit jadi pellet mengendap dibawah, kemudian cairan yang berisi DNA yang mengambang diambil dan dipindahkan ke tabung lain yang baru. Pada tabung yang baru ditambahkan isopropanol untuk menarik air dari DNA, pada saat ditambah isopropanol kita bisa melihat DNA berupa benangbenang putih, selanjutnya disentufuge kemudian airnya dibuang dan dicuci dengan etanol 70% kemudian disentrifuge, etanol dibuang dan pellet dikeringkan kemudian pellet dilarutkan lagi dengan Tris-EDTA PH 8.0. Kemudian ukur kandungan dan kemurnian DNA dengan spektrofotometer dan dicek dengan panjang gelombang 260 nano meter, kemudian DNA disimpan pada suhu -800C (freezer) (Setianingsih, 2010). 4.7.5 Cara penyimpanan sampel Sampel darah untuk pemeriksaan hormon INSL3 dan hormon estradiol disimpan di laboratorium Biomolekuler FK UNUD dalam bentuk serum pada suhu -800C. Sedangkan sampel darah untuk pemeriksaan gen insl3 dan gen lgr8 disimpan di Laboratorium Biomolekuler FK UNUD dalam bentuk DNA pada suhu - 800C . Setelah 79 sampel dianggap cukup sampel DNA diamplifikasi untuk memperbanyak dengan PCR yang sudah ditambahkan primer untuk exon masing-masing, setelah itu masing-masing exon 1, exon 2 gen insl3 dipurifikasi, begitu juga exon 8, exon 12 dan exon 13 gen lgr8 dipurifikasi, kemudian hasil purifikasi baru dikirim. 4.7.6 Cara pengiriman sampel Sampel exon 1, exon 2 gen insl3 dan sampel exon 8, exon 12, exon 13 gen lgr8 yang sudah dipurifikasi di Laboratorium Biomolekuler FK UNUD bila jumlahnya sudah cukup dimasukkan ke dalam box plastik kemudian dikirim ( dibawa langsung oleh petugas laboratorium yang ditunjuk) ke Lembaga Eijkman Jakarta pada suhu 40C untuk dilakukan pemeriksaan sequenzing . Sedangkan sampel serum yang sudah disimpan pada suhu -800C dan dibagi-bagi ke dalam tube, yang dimasukkan dalam plastik setelah jumlah sampel cukup dikirim ke Laboratorium Kedokteran Hewan UNUD untuk pemeriksaan hormon INSL3 dan hormon estradiol secara ELISA. 4.7.7 Skema pengambilan darah 3 ml + EDTA DNA simpan kirim ke Eijkman sequenzing -800C 6 ml darah vena 3 ml sentrifuge 40C serum gen insl3, lgr8 INSL3 simpan -800C (tanpa antikoagulan) estradiol simpan -80 0C Gambar 4.3 Skema pengambilan darah periksa hormon INSL3 periksa hormon estradiol 80 4.7.8 Pemeriksaan hormon INSL3 secara ELISA Pemeriksaan hormon INSL3 menggunakan teknik kompetitif: Microplate yang sudah dilapisi antiantibodi atau antibodi sekunder ditambahkan antibodi terhadap hormon INSL3, selanjutnya ditambahkan serum dari sampel dan ditambahkan sampel setandar selanjutnya ditambahkan INSL3 biotin (untuk melacak) yang dilacak jumlah biotinnya, Standar yang disiapkan adalah standar biasa (biotinilated) terhadap INSL3, biotin berikatan dengan tempat avidin yang sudah dilabel enzim HRP selanjutnya bila warnanya pekat konsentrasinya rendah. Standar ini diencerkan dengan konsentrasi 1000 ngram/ ml kemudian diencerkan lagi menjadi 100nano gram/ml dilanjutkan 10 nanogram/ ml dilanjutkan 1 nano gram/ ml dilanjutkan 0,1 nanogram/ml dan dilanjutkan menjadi 0,01 nanogram/ml. Proses ini memakai 5 seri selanjutnya diduplo pada 43 sampel. Substrat yang dipakai Tio Metil Benzidine (TMB), Substrat akan berwarna bening, bila ada enzim HRP akan berwarna biru pekat. Tingkat kepekatan warna dibaca dengan spectrophotometer. dipakai EIA Kit (Enzym immune antibody) dan memakai enzim kinetik Y merupakan kemampuan enzim untuk mengubah senyawa tertentu dalam kurun waktu tertentu. Enzim ditambah substrat dibaca dengan spectrophotometer setiap 30 detik selama 5 menit OD awal dan akhir ditentukan 1 sampai 0,4 seperti SGOT,SGPT disebut metode kinetic. EIA Kit yang dipakai 405 sedangkan untuk enzim pakai 340(Astawa, 2010; Phoenix Pharmaceuticals, 2010). 81 4.7.9 Pemeriksaan hormon estradiol secara ELISA: Untuk pemeriksaan hormon estradiol digunakan teknik kompetitif: micropalate ELISA yang sudah dilapisi dengan antibodi terhadap estradiol (sudah mampu menangkap estradiol dalam sampel) ditambahkan sampel dari serum kemudian ditambahkan lagi estradiol trizer (estradiol pelacak yang akan merubah warna). Makin banyak trizer yang melekat makin pekat warnanya, jumlah trizer yang melekat berbanding terbalik dengan kadar estradiol (karena kompetitif estradiol serum dan estradiol trizer sama-sama melekat dengan antibodi). Trizer adalah estradiol yang dilabel dengan enzim choline esterase. Estradiol standar adalah estradiol yang konsentrasinya sudah diketahui dan nanti akan diencerkan dengan konsentrasi awal 40 nanogram /ml kemudian diencerkan sebanyak 10 kali dan pengencerannya 90 mikroliter, pengenceran itu akan dipakai buat grafik. Disarankan di duplo (1 sampel untuk 2 lubang) warna dibuat dengan standar , paling ujung pekat sekali. Kalau ada perbedaan dibuat rata-ratanya dan digunakan rumus untuk mengetahui konsentrasinya. Kalau ada Orticle Density (OD) sampel dan OD standar, dimasukkan komputer keluar grafik. Software 3 atau 4 PL (parameter logistic) pakai regresi logistic, kalau 2 pakai linier logistic yang sering dipakai 3 (memperhitungkan kemiringan), 4 (lebih akurat), 5 paling akurat (jarang dipakai) (Astawa, 2010; Anonim, 2008) 82 4.7.10 Pemeriksaan gen insl3 dan gen lgr8 4.7.10.1 Polymerase chain reaction (PCR) exon 1 gen insl3, exon 2 gen insl3, exon 8 gen lgr8, exon 12, 13 gen lgr8 Masing masing DNA pada kasus dan kontrol dilakukan PCR untuk exon 1 gen insl3 digunakan primer forward (1F): tgggagaaaggctctggcac dan primer reverse (1R) : ctgggcacatgcatgcaaac, untuk exon 2 gen insl3 digunakan primer forward (2F): tgcatgcatgagtgtttggtggg dan primer reverse (2R) : gtgagcacccatcccaggaggtaatc, untuk exon 8 gen lgr8 digunakan primer forward (8F): acacaaaggagtaggccagg dan primer reverse (8R) : ctagtgctagatgtcattgc, untuk exon 12, 13 gen lgr8 digunakan primer forward (12-13F): ggatgatgataattgtgagg dan primer reverse (12-13R): ctgaaatgcatgctcctgtg dan semua ini dikerjakan di Laboratorium Biomolekuler FK UNUD oleh petugas terlatih yang ditunjuk. Komponen yang diperlukan adalah: DNA template + Primer (Forward dan reverse) masing-masing secara bergantian untuk exon 1 gen insl3, exon 2 gen insl3, exon 8 gen lgr8, exon 12,13 gen lgr8 + dNTP + tag polymerase, kemudian DNA yang double strain di denaturasi (dilonggarkan) pada suhu 950C, kemudian dilakukan annealing (menempelkan primer ke template DNA) pada suhu 55-650C atau tergantung melting tempratur primer, setelah menempel dilakukan polimerasi dengan menambahkan dNTP dan diektensi (dipanjangkan ) pada suhu 720C sehingga didapatkan 2 double strain pada satu siklus PCR . PCR diulang 30 silkus . kemudian dicampur loading dye untuk pemurnian, kemudian dilakukan running dan ditambahkan etidium bromide yang berikatan dengan DNA dan DNA digerakkan pada gel algarose di bawah sinar ultraviolet kemudian di foto, DNA kelihatan 83 seperti bayangan putih, kemudian hasil PCR dipurifikasi (dimurnikan) kemudian baru dikirim ke Lembaga Eijkman Jakarta untuk dilakukan sequenzing. 4.7.10.2.Skuenzing exon 1 gen insl3, exon 2 gen insl3, exon 8 gen lgr8, exon 12,13 gen lgr8 Secara bergantian kedalam mesin skuenzing masing-masing sampel dari purifikasi hasil PCR xon 1 gen insl3, exon 2 gen insl3, exon 8 gen lgr8, exon 12,13 gen lgr8 pada masing-masing kasus dan kontrol + DNA polymerase + primer untuk exon 1 gen insl3, exon 2 gen insl3, exon 8 gen lgr8, exon 12,13 gen lgr8 secara bergantian + dNTP + ddNTP kemudian keluar berupa grafik susunan nukletida selanjutnya dibandingkan dengan susunan nukleotida bentuk normal dari exon 1 gen insl3, exon 2 gen insl3, exon 8 gen lgr8, exon 12 dan exon 13 gen lgr8, kemudian dianalisis adanya polimorfisme atau adanya mutasi. 84 4.8 Analisis Statistik Data karakteristik demografi dianalisis secara deskriptif, dimana untuk data numerik dianalisis dengan rerata ± standar deviasi (SD) dan frekuensi dengan prosentase. Normalitas data diuji dengan Kolmogorov Smirnov / Shapiro Wilk, dan bila data berdistribusi normal analisis parametrik yang dipakai adalah t test dan bila data tidak berdistribusi normal digunakan analisis nonparametrik atau transformasi data logaritmik kemudian dilakukan uji normalitas bila normal dilakukan uji parametrik. Bila ada variasi data dilakukan uji homogenitas dengan Levene test. Pada data yang bivariat berpasangan digunakan tabel 2 x 2 untuk odds ratio berpasangan dengan 95% convident interval (CI) dan digunakan simple log rergresi untuk odds ratio 95% CI. Pada data yang multivariat dianalisis dengan multiple log regresi untuk odds ratio 95% CI. Untuk uji statistik beda kadar hormon pada kasus dan kontrol (match paired) dilakukan uji statistik paired student t test. Odds ratio berpasangan (paired) dengan formula b/c. Untuk menghitung tabel 2x2 dilakukan dengan komputer, untuk menghitung odds ratio berpasangan dilakukan dengan komputer. Hipotesis ini dianalisis dengan tingkat kepercayaan ( α ) diterima bila p < 0,05 Hipotesis statistik Variabel bebas : polimorfisme (exon 1, exon 2) gen insl3 Polimorfisme (exon 8, exon 12, exon 13) gen lgr8 Hormon INSL3 plasma , Hormon estradiol plasma Variabel tergantung : Kriptorkismus Hipotesis satu sisi : H0 : µ1 ≤ µ2 , Ha : µ1 > µ2 µ1 = Polimorfisme (exon 1, exon 2) gen insl3, polimorfisme (exon 8, exon 12, exon 13) gen lgr8, hormon INSL3 plasma rendah, hormon estradiol plasma tinggi. 85 µ2 = gen insl3 normal, gen lgr8 normal, hormon INSL3 plasma normal, hormon estradiol plasma rendah 4.9 Keterangan Kelaikan Etik ( Ethical Clearance ) dan Ijin Penelitian Penelitian ini telah mendapatkan keterangan kelaikan Etik ( Ethical Clearence) dari Unit Penelitian dan Pengembangan serta dari Komisi Etik Penelitian Fakultas Kedokteran Universitas Udayana dengan No surat: 289/ Skrt / v/ 2010. Penelitian ini juga telah mendapatkan ijin dengan permohonan ijin penelitian dari Program Studi Doktor Ilmu Kedokteran Program Pasca Sarjana Unud dengan no surat: 362/ H14.4.10/PL/2010 Untuk Kepala Rumah Bersalin Permata Hati, no surat: 363/ H14.4.10/PL/2010 untuk Direktur RSUD Wangaya, no surat: 364/H14.4.10/Pl/2010 untuk Direktur Utama RSUP Sanglah Denpasar. 86 BAB V HASIL PENELITIAN 5.1. Karakteristik Sampel Penelitian Penelitian ini menggunakan sampel 62 anak laki-laki yang terdiri dari 31 anak laki-laki yang menderita kriptorkismus sebagai kasus dan dicarikan 31 anak laki-laki yang normal sebagai kontrol, setiap kasus dan kontrol dimatching berdasarkan usianya dalam tahun. Tabel 5.1 Karakteristik Subyek Penelitian Kelompok Kasus dan Kelompok Kontrol Karakteristik Usia (tahun) Berat badan lahir (gram) Panjang badan lahir (cm) Umur kehamilan cukup umur Cara persalinan: - Spontan - Secsio sercario - Vakum ekstraksi Panjang penis (cm) Volume testis kanan (ml) Volume testis kiri (ml) Kelompok kasus ( n = 31 ) Rerata±SB/Frekuensi 4±3 3142,90 ± 619,90 49,52 ± 2,20 31 Kelompok kontrol ( n = 31 ) Rerata ±SB/Frekuensi 4±3 3206,45 ± 331,60 50,13 ± 1,28 31 15 15 1 4,23 ± 0,56 2,08 ±0,67 1,80 ± 0,49 19 12 0 4,65 ± 0,76 2,35 ± 0,61 2,37 ± 0,61 Nilai-p 0,92 0,62 0,19 0,02 0,12 0,001 Tabel 5.2 Jenis dan Lokasi Kriptorkismus pada Kelompok Kasus Jenis Kriptorkismus Bilateral Kanan Lokasi kriptorkismus Intraabdominal Inguinal Preskrotal Total 3 1 1 5 (16,13%) 4 4 2 10 (32,26%) 86 Kiri Total 6 8 2 16 (51,61%) 13 (41,94%) 13 (41,94%) 5 (16,12%) 31 (100%) 87 Semua sampel yang digunakan baik pada kasus maupun pada kontrol tidak menderita sindrom dan tidak mengalami mikropenis, bentuk penis normal tidak ada kordae dan hipospadia dan pada penelitian ini anak kriptorkismus yang dipakai kasus usianya 6 bulan ke atas. Tabel 5.3 Frekuensi Polimorfisme Gen insl3, Gen lgr8 pada Kelompok Kasus dan Kontrol Gen Exon Polimorfisme Kasus (%) (n=31) Kontrol (%) (n=31) insl3 Exon 1 M1M A9A L42L L42P V43M T60T T60A 1(3,23%) 6(19,36%) 1(3,23%) 1(3,23%) 1(3,23%) 16(51,61%) 8(25,81%) 0(0%) 2(6,45%) 0(0%) 0(0%) 0(0%) 5(16,13%) 15(48,39%) Exon 2 R73R C115W C116C Kdn stp140kdn stp G144G E146E Q157Q A166D 1(3,23%) 1(3,23%) 1(3,23%) 1(3,23%) 1(3,23%) 3(9,68%) 1(3,23%) 1(3,23%) 0(0%) 0(0%) 0(0%) 0(0%) 0(0%) 0(0%) 0(0%) 0(0%) Exon 8 Kdn stp223M 1(3,23%) 0(0%) Exon 12 N315N E319E L331L 2(6,45%) 31(100%) 15(48,39%) 0(0%) 23(74,19%) 6(19,36%) Exon 13 S337A P340P L344L H345P K346K Q348Q Q354K Q356P S357S S357C 17(54,84%) 13(41,94%) 1(3,23%) 19(61,29%) 28(90,32%) 1(3,23%) 5(16,13%) 9(29,03%) 15(48,39%) 1(3,23%) 0(0%) 8(25,81%) 0(0%) 9(29,03%) 21(67,74%) 0(0%) 0(0%) 0(0%) 0(0%) 0(0%) lgr8 88 5.2. Polimorfisme Gen insl3 5.2.1. Polimorfisme exon 1 gen insl3 Untuk menemukan polimorfisme pada exon 1 gen insl3 dilakukan sequencing pada hasil PCR menggunakan primer forward (1F): tgggagaaaggctctggcac dan primer reverse (1R) : ctgggcacatgcatgcaaac dan ukuran basa yang teramplifikasi dari proses PCR adalah 451 pasang basa. Adapun program PCR untuk exon 1 gen insl3 adalah pre denaturasi dengan suhu 950C selama 5 menit hanya 1 siklus, dilanjutkan dengan ( denaturasi dengan suhu 940C selama 1 menit, annealing dengan suhu 600C selama 1 menit, ekstensi dengan suhu 720C selama 1 menit ) sebanyak 35 siklus dan terakhir final ekstensi dengan suhu 720C selama 7 menit dan 1 siklus. Adapun campuran yang digunakan adalah master mix PCR 15µl, H2O 9µl, primer exon 1F 1,8µl, primer exon 1R 1,8µl, DNA template 2,4µl dan jumlah keseluruhan 30µl. Sedangkan untuk proses sequencing hanya menggunakan primer forward (1F): tgggagaaaggctctggcac . 451 bp Gambar 5.1 Hasil PCR exon 1 gen insl3 89 Wild type 280 Wild type 290 300 AGGAGGCCTGCGACCGGAGGCGAC Polimorfime T60T A G G A G G C C T G C G N C C G G A G G C G A C Polimorfisme ACCNCC Gambar 5.2 Sequenzing exon 1 gen insl3 wild type dan polimorfisme T60T (ACCNCC) Dari hasil sequencing ditemukan polimorfisme exon 1 pada: ATGNTG (M1M) pada kasus no 14, GCGGCN/GCA (A9A) pada kasus no: 2, 3, 7, 8, 9, 20, dan juga ditemukan pada kontrol no: 2, 17, CTACTN (L42L) pada kasus no: 19, CTACNN (L42P) pada kasus no: 29, GTGNNG (V43M) pada kasus no: 29. Polimorfisme ACCNCC (T60T) pada kasus no: 3, 4, 5, 6, 9, 13, 15, 16, 19, 20, 21, 22, 23, 25, 28, 30 dan juga ditemukan pada kontrol no: 20, 21, 23, 25, 28. Polimorfisme ACCGCC (T60A) pada kasus no: 2, 7, 8, 10, 11, 12, 17, 24, dan juga ditemukan pada kontrol no: 1, 2, 4, 7, 12, 13, 14, 15, 16, 17, 18, 19, 24, 26, 27. Hubungan polimorfisme exon 1 dengan kriptorkismus dapat dilihat pada tabel 5.4, gambar 5.3. 90 Tabel 5.4 Hubungan antara Frekuensi Polimorfisme Exon 1 Gen insl3 dan Kejadian Kriptorkismus pada Anak Laki-laki Polim Exon 1 Kasus (n=31) Positip ATGNTG (M1M) Kontrol GCGGCN/GCA (A9A) Kontrol CTACTN (L42L) Kontrol CTACNN (L42P) Kontrol GTGNNG (V43M) Kontrol ACCNCC (T60T) Kontrol ACCGCC (T60A) Kontrol (n=31) Total (n=31) Total (n=31) Total (n=31) Total (n=31) Total (n=31) Total (n=31) Total Total Statistik Negatip Positip Negatip 0(0%) 1(3,23%) 1(3,23%) 0(0%) 0(0%) 0 0(0%) 1 1 Tidak dianalisis Positip Negatip 1(3,23%) 5(16,13%) 6(19,36%) 1(3,23%) 0(0%) 1 2(6,45%) 5 7 Nilai-p: 0,22 Odds ratio: 5,0 95%CI: 0,56 - 236,45 Positip Negatip 0(0%) 1(3,23%) 1(3,23%) 0(0%) 0(0%) 0 0(0%) 1 1 Tidak dianalisis Positip Negatip 0(0%) 1(3,23%) 1(3,23%) 0(0%) 0(0%) 0 0(0%) 1 1 Tidak dianalisis Positip Negatip 0(0%) 1(3,23%) 1(3,23%) 0(0%) 0(0%) 0 0(0%) 1 1 Tidak dianalisis Positip Negatip 5(16,13%) 11(35,48%) 16(51,61%) 0(0%) 0(0%0 0 5(16,13%) 11 16 Nilai-p: 0,001 Odds ratio: infinity 95%CI: 2,51 - infinity Positip Negatip 5(16,13%0 3(9,68%) 8(25,81%) 10(32,26%) 0 10 15(48,39%) 3 18 Nilai-p: 0,09 Odds ratio: 0,30 95%CI: 0,05 - 1,17 Dari tabel 5.4. polimorfisme M1M, L42L, L42P, V43M pada exon 1 tidak bisa dianalisis secara statistik karena jumlahnya sangat sedikit tetapi polimorfisme ini hanya ditemukan pada kasus. Frekuensi polimorfisme A9A (GCGGCN/GCA) exon 1 gen insl3 ditemukan lebih banyak pada kelompok kasus dibandingkan kontrol (19,36% vs 6,45%) tetapi tidak berbeda bermakna dengan nilai-p =0,22 (p>0,05) dan asam aminonya tidak berubah. Polimorfisme T60A (ACCGCC) exon 1 ditemukan frekuensinya lebih banyak pada kelompok anak sehat (25,81% vs 48,39%) tetapi tidak berbeda secara bermakna dengan nilai-p=0,09 (p > 0,05) dan asam amino 91 no 60 berubah dari treonin menjadi alanin. Frekuensi polimorfisme T60T (ACCNCC) exon 1 gen insl3 lebih banyak ditemukan pada kasus dibanding kontrol (51,61% vs 16,13% ) dan berbeda bermakna (nilai-p= 0,001(p< 0,05) , Odds ratio= tak terhingga, 95% Convident interval= 2,51-tak terhingga) tetapi asam amino no 60 tetap treonin. Gambar 5.3 Frekuensi Polimorfisme Exon 1 Gen insl3 T60T: Nilai-p= 0,001; Odds ratio= tak terhingga; 95% Convident interval= 2,51 - tak terhingga 5.2.2. Polimorfisme exon 2 gen insl3 Untuk menemukan polimorfisme pada exon 2 gen insl3 dilakukan sequencing pada hasil PCR menggunakan primer forward (2F): tgcatgcatgagtgtttggtggg dan primer reverse (2R) : gtgagcacccatcccaggaggtaatc dan ukuran basa yang teramplifikasi dari proses PCR adalah 455 pasang basa. Adapun program PCR untuk exon 2 gen insl3 adalah pre denaturasi dengan suhu 950C selama 5 menit hanya 1 siklus, dilanjutkan dengan ( denaturasi dengan suhu 940C selama 1 menit , annealing dengan suhu 540C selama 1 menit, ekstensi dengan suhu 720C selama 1 menit ) 92 sebanyak 30 siklus dan terakhir final ekstensi dengan suhu 720C selama 7 menit dan 1 siklus. Adapun campuran yang digunakan adalah master mix PCR 15µl, H2O 9,6µl, primer exon 2F 1,8µl, primer exon 2R 1,8µl, DNA template 1,8µl dan jumlah keseluruhan 30µl. Sedangkan untuk proses sequencing menggunakan primer forward (2F): tgcatgcatgagtgtttggtggg, karena exon 2 gen insl3 panjang ada beberapa hasil sequencing yang kurang baik dan diulang dengan menggunakan primer reverse (2R): gtgagcacccatcccaggaggtaatc. 455bp Gambar 5.4 Hasil PCR exon 2 gen insl3 Wild type 330 340 Wild type GGCCCAGAGGGTCTGGTC Polimorfisme E146E GGCCCANAGGGTCTGGTC Polimorfisme GAGNAG Gambar 5.5 Sequenzing exon 2 gen insl3 wild type dan polimorfisme E146E(GAGNAG) 93 Dari hasil sequencing ditemukan polimorfisme exon 2 pada: CGACNA (R73R) pada kasus no: 13, TGCTGG (C115W) dan TGCTNGC (C116C) pada kasus no: 16, AGAANA (kodon stop140kodon stop), GGCNGC (G144G) pada kasus no: 31, GAGNAG (E146E) pada kasus no: 26, 29, 31, CAGCAN(Q157Q) kasus no: 29 dan GCCGCA (A166D) pada kasus no: 14. Tabel 5.5 Hubungan antara Frekuensi Polimorfisme Exon 2 Gen insl3 dan Kejadian Kriptorkismus pada Anak Laki-laki Polimorfisme exon 2 Kasus (n=31) Kontrol (n=31) Statistik CGACNA(R73R) 1 (3,23%) 0 Tidak dianalisis TGCTGG(C115W) 1 (3,23%) 0 Tidak dianalisis TGCTNGC(C116C) 1 (3,23%) 0 Tidak dianalisis AGAANA(kdstp140kdstp) 1 (3,23%) 0 Tidak dianalisis GGCNGC(G144G) 1 (3,23%) 0 Tidak dianalisis GAGNAG(E146E) 3 (9,68%) 0 Tidak dianalisis CAGCAN(Q157Q) 1 (3,23%) 0 Tidak dianalisis GCCGAC(A166D) 1 (3,23%) 0 Tidak dianalisis Dari tabel 5.5 polimorfisme R73R, C115W, C116C, kodon stop140kodon stop, G144G, E146E, Q157Q, A166D dari exon 2 gen insl3 tidak bisa dianalisis secara statistik karena jumlahnya sangat sedikit, tetapi polimorfisme ini hanya ditemukan pada kasus sedangkan pada kontrol tidak ditemukan polimorfisme. Dari polimorfisme ini ada 2 perubahan asam amino C115W ( sistein no 115 menjadi triptopan) dan A166D (alanin no 166 menjadi aspartat). 94 5.3. Polimorfisme Gen lgr8 5.3.1. Polimorfisme exon 8 gen lgr8 Untuk menemukan polimorfisme pada exon 8 gen lgr8 dilakukan sequencing pada hasil PCR menggunakan primer forward (8F): acacaaaggagtaggccagg dan primer reverse (8R) : ctagtgctagatgtcattgc dan ukuran basa yang teramplifikasi dari proses PCR adalah 229 pasang basa. Adapun program PCR untuk exon 8 gen lgr8 adalah pre denaturasi dengan suhu 950C selama 1 menit hanya 1 siklus, dilanjutkan dengan (denaturasi dengan suhu 940C selama 1 menit, annealing dengan suhu 540C selama 1 menit, ekstensi dengan suhu 680C selama 1 menit) sebanyak 35 siklus dan terakhir final ekstensi dengan suhu 680C selama 5 menit dan 1 siklus. Adapun campuran yang digunakan adalah master mix PCR 15µl, H2O 9,6µl, primer exon 8F 1,8µl, primer exon 8R 1,8µl, DNA template 1,8µl dan jumlah keseluruhan 30µl. sedangkan untuk proses sequencing hanya menggunakan primer forward (8F):acacaaaggagtaggccagg. 229bp Gambar 5. 6 Hasil PCR exon 8 gen lgr8 95 Wild type 70 80 90 Wild type AATCCAATAACCAGAATTTCACAG Polimorfisme AATCCAATAACCANAATTTCACAG kdstp223M Polimorfisme AGAANA Gambar 5.7Sequenzing exon 8 gen lgr8 wild type dan polimorfisme kdstp223M(AGAANA) Dari hasil sequencing ditemukan hanya 1 polimorfisme AGAANA (kdn stp223M) pada kasus no: 13 dan tidak bisa dianalisis secara statistik karena jumlahnya sangat sedikit, terjadi perubahan asam amino no 223 dari kodon stop ke metionin, tetapi polimorfisme ini hanya ditemukan pada anak laki-laki dengan kriptorkismus sedangkan pada anak yang sehat tidak ditemukan polimorfisme. 5.3.2. Polimorfisme exon 12 gen lgr8 Untuk menemukan polimorfisme pada exon 12 gen lgr8 dilakukan sequencing pada hasil PCR menggunakan primer forward (12-13F): ggatgatgataattgtgagg dan primer reverse (12-13R) : ctgaaatgcatgctcctgtg dan ukuran basa yang teramplifikasi dari proses PCR adalah 439 pasang basa. Adapun program PCR untuk exon 12-13 gen lgr8 adalah pre denaturasi dengan suhu 950C selama 1 menit hanya 1 siklus, dilanjutkan dengan ( denaturasi dengan suhu 950C selama 1 menit , annealing dengan suhu 520C selama 1 menit, ekstensi dengan suhu 720C selama 1 menit ) sebanyak 35 siklus dan terakhir final ekstensi dengan suhu 720C selama 5 menit dan 1 siklus. Campuran yang digunakan adalah master mix PCR 15µl, H2O 9,6µl, primer exon 12-13F 1,8µl, primer exon 12-13R 1,8µl, DNA template 1,8µl dan jumlah keseluruhan 30µl. sedangkan untuk proses sequencing menggunakan primer forward (12-13F): ggatgatgataattgtgagg, untuk hasil 96 sequencing yang exon 13 rusak atau tidak bisa untuk dibaca sequencing diulang dengan menggunakan primer reverse (12-13R): ctgaaatgcatgctcctgtg. 439bp Gambar 5.8 Hasil PCR exon 12-13 gen lgr8 Wild type 70 80 Wild type TAACGGAACTATCA Polimorfisme E319E TAACGGAGCTATCA Polimorfisme GAAGAG Wild type 100 Wild type 110 AAGCTTCTACAAAA Polimorfisme L331L AAGCTTCTGCAAAA Polimorfisme CTACTG Gambar 5.9 Sequenzing exon 12 gen lgr8 wild type dan polimorfisme E319E(GAAGAG); L331L(CTACTG) 97 Dari hasil sequencing ditemukan polimorfisme exon 12 pada: ATTANT (N315N) ditemukan pada kasus no: 10, 13, GAAGAN/GAG (E319E) ditemukan pada kasus no: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, dan juga ditemukan pada kontrol no: 1, 3, 4, 5, 7, 8, 9, 10, 12, 13, 15, 17, 18, 19, 20, 21, 22, 23, 25, 27, 28, 30, 31. Jadi polimorfisme E319E ditemukan pada semua kasus kriptorkismus dan pada 23 kontrol. Sedangkan polimorfisme CTACTN/CTG (L331L) ditemukan pada kasus no: 2, 6, 7, 11, 14, 16, 19, 20, 21, 23, 24, 25, 26, 28, 31 juga pada kontrol no: 2, 5, 19, 21, 23, 31. Hubungan polimorfisme exon 12 dengan kriptorkismus dilihat pada tabel 5.6, gambar 5.10 Tabel 5.6 Hubungan antara Frekuensi Polimorfisme Exon12 Gen lgr8 dan Kejadian Kriptorkismus pada Anak Laki-laki Polim Exon 12 ATTANT (N315N) GAAGAN/ GAG (E319E) CTACTN/ CTG (L331L) Kasus (n=31) Kontrol (n=31) Total Kontrol (n=31) Total Kontrol (n=31) Total Total Statistik Positip Negatip Positip Negatip 0(0%) 2(6,45%) 2(6,45%) 0(0%) 0(0%) 0 0(0%) 2 2 Nilai-p: 0,50 Odds ratio: infinity 95%CI: 0,19-infinity Positip Negatip 23(74,19%) 8(25,81%) 31(100%) 0(0%) 0(0%) 0 23(74,19%) 8 31 Nilai-p: 0,008 Odds ratio: infinity 95%CI: 1,71-infinity Positip Negatip 5(16,13%) 10(32,26%) 15(48,39%) 1(3,23%) 0(0%0 1 6(19,36%) 10 16 Nilai-p: 0,012 Odds ratio: 10,0 95%CI: 1,43-433,98 Dari tabel 5.6 polimorfisme N315N (ATTANT) hanya ditemukan pada kasus tetapi tidak berbeda bermakna nilai-p=0,50 (p>0,05) karena sangat sedikit. Polimorfisme E319E (GAAGAN/GAG) frekuensinya lebih banyak pada kasus (100% vs 74,19%) dengan nilai-p= 0,008 (p<0,05), Odds ratio= tak terhingga, 95% Convident interval: 1,71- tak terhingga. 98 Frekuensi polimorfisme L331L (CTACTN/CTG) lebih banyak ditemukan pada kasus dibandingkan kontrol (48,39% vs 19,36%) dengan nilai-p=0,012(p<0,05). Polimorfisme L331L berisiko 10,0 kali lebih besar untuk menimbulkan kriptorkismus dibandingkan dengan yang wild type (Odds ratio=10,0; 95% Convident interval= 1,43 – 433,98). Polimorfisme N315N, E319E dan L331L tidak merubah susunan asam amino hanya merubah susunan kodon dalam asam amino asparagin no 315, asam amino glutamate no 319 dan asam amino leusin no 331. Gambar 5.10 Frekuensi Polimorfisme Exon 12 Gen lgr8 (E319E, L331L) E319E : Nilai-p= 0,008; Odds ratio= tidak terhingga; 95% Convident interval= 1,71 – tidak terhingga L331L: Nilai-p= 0,012; Odds ratio= 10,0; 95% Convident interval= 1,43 – 433,98 5.3.3. Polimorfisme exon 13 gen lgr8 Untuk menemukan polimorfisme pada exon 13 gen lgr8 dibaca dari hasil sequencing exon 12-13 yang menggunakan primer forward (12-13F) atau primer reverse (12-13R), jadi hasil sequencing yang dibaca untuk exon 13 sama dengan untuk exon 12 hanya untuk melihat 99 polimorfisme exon 12 dibaca bagian exon 12 dan untuk melihat polimorfisme exon 13 dibaca bagian exon 13. Dari hasil sequencing ditemukan polimorfisme exon 13 pada: TCAGCA (S337A) ditemukan pada kasus no: 2, 3, 4, 5, 6, 8, 9, 10, 13, 16, 18, 20, 21, 22, 24, 25, 29, dan pada kontrol tidak ditemukan. Polimorfisme CCTCCN/CCC (P340P) ditemukan pada kasus no: 3, 4, 7, 8, 9, 10, 14, 16, 18, 19, 26, 29, 31 dan juga ditemukan pada kontrol no: 1, 4, 6, 17, 18, 19, 23, 31 . Polimorfisme CTTCTN (L344L) ditemukan pada kasus no: 1. Polimorfisme CACCCC (H345P) ditemukan pada kasus no: 2, 3, 4, 5, 6, 8, 9, 10, 13, 14, 16, 18, 20, 21, 22, 24, 25, 29, 31 dan juga ditemukan pada kontrol no: 1, 2, 3, 8, 9, 12, 20, 27, 30. Polimorfisme AAGAAN/AAA (K346K) ditemukan pada kasus no: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 28, 29, 30, 31 dan juga ditemukan pada kontrol no: 1, 2, 3, 4, 6, 7, 8, 9, 10, 12, 13, 17, 18, 19, 20, 22, 23, 27, 28, 30, 31. Polimorfisme CAGCAN (Q348Q) hanya ditemukan pada kasus no: 1, CAAAAA (Q354K) ditemukan pada kasus no: 7, 14, 19, 26, 31. Polimorfisme CAGCCG (Q356P) ditemukan pada kasus no: 4, 10, 13, 16, 18, 20, 22, 24, 25. Sedangkan polimorfisme TCTTCC (S357S) ditemukan pada kasus no: 2, 3, 4,6, 8, 9, 10, 13, 18, 20, 21, 22, 24, 25, 29 dan polimorfisme TCTTNT (S357C) ditemukan pada kasus no: 11 .Hubungan polimorfisme exon 13 dengan kriptorkismus dapat dilihat pada tabel 5.7 dan gambar 5.11 Dari tabel 5.7 polimorfisme L344L(CTTCTN), Q348Q (CAGCAN), S357C (TCTTNT) exon 13 gen Lgr8 tidak bisa dilakukan analisis statistik karena jumlahnya sangat sedikit, tetapi polimorfisme ini hanya ditemukan pada kelompok kasus dan tidak ditemukan pada kontrol. Polimorfisme S357C terjadi perubahan asam amino no 357 dari serin menjadi sistein. Polimorfisme P340P(CCTCCN/CCC) lebih banyak ditemukan pada kasus dibandingkan 100 dengan kontrol tetapi tidak berbeda secara bermakna dengan nilai-p =0,27 (p > 0,05) dan asam amino no 340 tetap prolin. Polimorfisme S337A (TCAGCA), polimorfisme Q354K (CAAAAA), polimorfisme Q356P (CAGCCG), polimorfisme S357S (TCTTCC) hanya ditemukan pada kelompok kasus. Polimorfisme S337A (TCAGCA) terjadi perubahan asam amino no 337 dari serin menjadi alanin dan frekuensinya berbeda bermakna dengan nilai-p: <0,001(p<0,05), Odds ratio: tidak terhingga, 95% Convident interval: 4,13-tidak terhingga. Polimorfisme Q354K (CAAAAA) terjadi perubahan asam amino no 354 dari glutamin menjadi lisin namun tidak berbeda bermakna antara kasus dan kontrol dengan nilai-p= 0,06(p>0,05). Polimorfisme Q356P (CAGCCG) terjadi perubahan asam amino no 356 dari glutamin menjadi prolin polimorfisme ini berbeda secara bermakna antara kasus dan kontrol dengan nilai-p: 0,004(p<0,05), Odds ratio= tidak terhingga, 95% Convident interval= 1,97- tidak terhingga. Polimorfisme S357S (TCTTCC) tidak terjadi perubahan asam amino no 357 asam aminonya tetap serin hanya susunan kodon dari asam amino serin yang berubah dari TCTTCC, tetapi polimorfisme ini berbeda secara bermakna antara kasus dan kontrol dengan nilai-p= <0,001(p<0,05), Odds ratio= tidak terhingga, 95% Convident interval= 3,59- tidak terhingga. Pada tabel 5.7 frekuensi polimorfisme H345P (CACCCC) exon 13 gen lgr8 lebih banyak ditemukan pada kasus dibandingkan kontrol (61,29% vs 29,03%) dengan nilai-p= 0,03(p<0,05), Odds ratio= 3,5 dan 95% Convident interval= 1,10 – 14,60. Frekuensi polimorfisme K346K (AAGAAN/AAA) lebih banyak ditemukan pada kasus dibandingkan dengan kontrol (90,32% vs 67,74%) dengan nilai-p = 0,07(p>0,05) dan polimorfisme ini asam aminonya tetap lisin hanya berubah susunan kodon dari asam amino lisin (AAGAAN/AAA). Wild type 230 Wild type 240 GAACCTGTCATCCAA 101 Polimorfisme S337A GAACCTGGCATCCAA Polimorfisme TCAGCA Wild type 250 260 Wild type TATGTATCTTCACAA Polimorfisme H345P TATGTATCTTCCCAA Polimorfisme CACCCC Gambar 5.11 Sequenzing exon 13 gen lgr8 wild type dan polimorfisme S337A(TCAGCA); H345P(CACCCC) Wild type 290 300 Wild type ACTTCAGTCTCTGTA Polimorfisme Q356P, S357S ACTTCCGTCCCTGTA Polimorfisme CAGCCG Polimorfisme TCTTCC Gambar 5.12 Sequenzing exon 13 gen lgr8 wild type dan polimorfisme Q356P(CAGCCG); S357S(TCTTCC) 102 Tabel 5.7 Hubungan antara Frekuensi Polimorfisme Exon 13 Gen lgr8 dan Kejadian Kriptorkismus pada Anak Laki-laki Polim Exon 13 Kasus (n=31) TCAGCA (S337A) Kontrol CCTCCN/ CCC (P340P) Kontrol CTTCTN (L344L) CACCCC (H345P) (n=31) Total (n=31) Total Kontrol (n=31) Total Kontrol (n=31) Total AAGAAN/ Kontrol AAA (K346K) (n=31) CAAAAA (Q354K) CAGCCG (Q356P) TCTTCC (S357S) TCTTNT (S357C) Kontrol (n=31) Total Kontrol (n=31) Total Kontrol (n=31) Total Kontrol (n=31) Total Kontrol (n=31) Total Statistik Positip Negatip Positip Negatip 0(0%) 17(54,84%) 17(54,84%) 0(0%) 0(0%) 0 0(0%) 17 17 Nilai-p: <0,001 Odds ratio: infinity 95%CI: 4,13-infinity Positip Negatip 4(12,90%) 9(29,03%) 13(41,94%) 4(12,90%) 0(0%) 4 8(25,81%) 9 17 Nilai-p: 0,27 Odds ratio: 2,25 95%CI: 0,63-10,0 Positip Negatip 0(0%) 1(3,23%) 1(3,23%) 0(0%) 0(0%) 0 0(0%) 1 1 Tidak dianalisis Positip Negatip 5(16,13%) 14(45,16%) 19(61,29%) 4(12,90%) 0(0%) 4 9(29,03%) 14 23 Nilai-p: 0,03 Odds ratio: 3,5 95%CI: 1,10-14,60 Positip Negatip 19(61,29%) 9(29,03%) 28(90,32%0 2(6,45%) 0(0%) 2 21(67,74%0 9 30 Nilai-p: 0,07 Odds ratio: 4,5 95%CI: 0,93-42,80 Positip Negatip 0(0%) 1(3,23%) 1(3,23%) 0(0%) 0(0%) 0 0(0%) 1 1 Tidak dianalisis Positip Negatip 0(0%) 5(16,13%) 5(16,13%) 0(0%) 0(0%) 0 0(0%) 5 5 Nilai-p: 0,06 Odds ratio: infinity 95%CI: 0,92-infinity Positip Negatip 0(0%) 9(29,03%) 9(29,03%) 0(0%) 0(0%) 0 0(0%) 9 9 Nilai-P: 0,004 Odds ratio: infinity 95%CI: 1,97-infinity Positip Negatip 0(0%) 15(48,39% 15(48,39%) 0(o%) 0(0%) 0 0(0%) 15 15 Nilai-p: < 0,001 Odds ratio: infinity 95%CI: 3,59-infinity Positip Negatip 0(0%) 1(3,23%) 1(3,23%) 0(0%) 0(0%) 0 0(0%) 1 1 Tidak dianalisis Total CAGCAN (Q348Q) Total 103 Gambar 5.13 Frekuensi Polimorfisme Exon 13 Gen lgr8 (S337A, H345P, Q356P, S357S) S337A: Nilai-p=< 0,001; Odds ratio= tidak terhingga; 95% Convident interval=4,13 - tidak terhingga H345P: Nilai-p=0,03; Odds ratio= 3,5; 95% Convident interval= 1,10 – 14,6 Q356P: Nilai-p= 0,004; Odds ratio= tidak terhingga; 95% Convident interval= 1,97 – tidak terhingga S357S: Nilai-p= <0,001; Odds ratio= tidak terhingga; 95% Convident interval: 3,59 – tidak terhingga Jadi polimorfisme exon 13 gen lgr8 yang diwakili oleh polimorfisme S337A, H345P, Q356P berbeda secara bermakna dan terjadi perubahan asam amino. Polimorfisme S357S tidak terjadi perubahan asam amino hanya perubahan basa dalam kodon asam amino serin. 104 5.4. Kadar Hormon INSL3 Tabel 5.8.1 Beda Kadar Hormon INSL3 Plasma antara Kasus dan Kontrol pada Anak Laki-laki Rerata ± SB Kadar hormon INSL3 plasma (ng/ml Kasus (n=31) Kontrol (n=31) Nilai-p 95% convident interval (beda rerata) 0,40 ± 0,24 0,91 ± 0,46 < 0,001 -0,72 s/d -0,31 Dari tabel 5.8.1 ditemukan rerata kadar hormon INSL3 plasma pada kasus 0,40 ± 0,24 ng/ml dan pada kontrol 0,91 ± 0,46 ng/ml. Jadi rerata kadar hormon INSL3 plasma lebih rendah bermakna pada kasus dibandingkan dengan kontrol (Nilai-p = <0,001 ( p < 0,05); 95% Convident interval= -0,72 - 0.31). Tabel 5.8.2 Beda Frekuensi Kadar Hormon INSL3 Plasma yang Rendah antara Kasus dan Kontrol pada Anak Laki-laki Kadar Hormon INSL3 Sampel Nilai-p Kasus(%) (n=31) Kontrol(%) (n=31) Rendah 18(58,06%) 3(9,68%) Normal 13(41,94%) 28(90,32%) Odds 95%CI ratio <0,001 12,92 3,23 – 51,78 Nilai batas optimum untuk diagnosis kriptorkismus (< 0,42 ng/ml, kurva ROC ) kadar hormon INSL3 plasma yang rendah lebih banyak ditemukan pada kasus dibandingkan dengan kontrol (58,06% vs 9,68%) dengan nilai-p= <0,001. Kadar hormon INSL3 plasma yang rendah berisiko 12,92 kali lebih besar untuk terjadinya kriptorkismus dibandingkan dengan yang normal (Odds ratio= 12,92; 95% Convident interval= 3,23 – 51,78). 105 ROC Curve 1.0 Sensitivity 0.8 0.6 0.4 0.2 0.0 0.0 0.2 0.4 0.6 0.8 1.0 1 - Specificity Diagonal segments are produced by ties. Gambar 5.14 Kurva ROC Kadar Hormon INSL3 Plasma 5.5. Kadar Hormon Estradiol Tabel 5.9.1 Beda Kadar Hormon Estradiol Plasma antara Kasus dan Kontrol pada Anak Laki-laki Rerata ± SB Kadar hormon Estradiol plasma (ng/ml Kasus (n=31) Kontrol (n=31) Nilai-p 95% convident interval (beda rerata) 17,08 ± 16,05 9,55 ± 4,92 0,02 1,16 s/d 13,90 Dari tabel 5.9.1 rerata kadar hormon estradiol plasma pada kasus 17,08 ± 16,05 ng/ml dan rerata kadar hormon estradiol plasma pada kontrol 9,55 ± 4,92 ng/ml. Jadi rerata kadar hormon estradiol plasma pada kasus lebih tinggi bermakna dibandingkan dengan kontrol (Nilai-p = 0,02 ( p < 0,05); 95% Convident interval= 1,16 – 13,90). 106 Tabel 5.9.2 Beda Frekuensi Kadar Hormon Estradiol Plasma yang Tinggi antara Kasus dan Kontrol pada Anak Laki-laki Kadar Hormon Estradiol Sampel Nilai-p Kasus(%) (n=31) Kontrol(%) (n=31) Tinggi 25(80,64%) 9(29,03%) Normal 6(19,36%) 22(70,97%) Odds 95%CI Ratio <0,001 10,19 3,13 – 33,19 Nilai batas optimum untuk diagnosis kriptorkismus ( > 10,22 ng/ml, Kurva ROC ) kadar hormon estradiol plasma yang tinggi lebih banyak ditemukan pada kasus dibandingkan kontrol (80,64% vs 29,03%) dengan nilai-p= <0,001. Kadar hormon estradiol plasma yang tinggi berisiko 10,19 kali lebih besar menimbulkan kriptorkismus. ROC Curve 1.0 Sensitivity 0.8 0.6 0.4 0.2 0.0 0.0 0.2 0.4 0.6 0.8 1.0 1 - Specificity Diagonal segments are produced by ties. Gambar 5.15 Kurva ROC Kadar Hormon Estradiol Plasma 107 BAB VI PEMBAHASAN Kriptorkismus merupakan kondisi patologi berupa kegagalan testis turun ke dalam skrotum, kadang-kadang karena kriptorkismus terjadi atropi tubulus semineferus dan lokasi testis pada kriptorkismus dapat berada di canalis inguinalis, daerah preskrotal atau daerah abdomen (Moretti dkk., 2007; Hutson, 2007). Menurunnya testis terjadi selama kehidupan fetus, maka insiden dari kriptorkismus tergantung dari usia kehamilan dari bayi tersebut, bayi laki-laki yang prematur yang mempunyai testis yang tidak turun dapat mencapai 30% dan insiden ini menurun menjadi 3 sampai 5% pada bayi yang lahir cukup bulan. Penurunan testis akan terus berlangsung pada beberapa pasien selama satu tahun kehidupannya, yang mana pada usia satu tahun insiden kriptorkismus adalah 0,8%. Penurunan testis pada bayi setelah lahir kebanyakan terjadi karena pengaruh hormon testosteron neonatus dalam usia 3 bulan pertama. Walaupun sebelumnya testis dapat turun sampai usia satu tahun setelah lahir, kebanyakan testis akan turun secara spontan dalam 3 bulan pertama kelahiran (Kaefer, 2004). Sampai usia satu tahun, secara histologi testis yang belum turun ke skrotum masih normal, termasuk masih normalnya populasi sel interstitial dan sel germinal. Pada usia 18 bulan kedua sel tadi dengan mikroskop elektron mengalami perubahan histologi berupa kerusakan populasi sel germinal. Keadaan yang sama juga terjadi pada usia 2 tahun pada testis kontralateral yang tidak turun. Secara klinis pada kriptorkismus terjadi penurunan fertilitas, setelah orkidopeksi penurunan fertilitas terjadi 50 sampai 70 % pada kriptorkismus unilateral dan 75% pada kriptorkismus bilateral (Kaefer, 2004). Menurut Bajpai & Menon (2008) secara histologi sel germinal sudah mengalami kerusakan pada kriptorkismus mulai anak usia 6-12 bulan bila testis tidak masuk ke dalam skrotum. Kerusakan yang terjadi berupa lambatnya maturasi sel germinal, menurunnya jumlah sel germinal, tubulus seminiferus mengalami hialinisasi dan menurunnya jamlah sel Leydig yang khusus. Main dkk (2006-b) 107 108 mengatakan pada kasus kriptorkismus volume testis akan mengecil, kadar semen dan inhibin B yang rendah. Hormon testosteron dihasilkan oleh sel leydig testis mulai usia 9 minggu kehamilan dan gangguan pada produksi maupun aktivitas hormon testosteron baik pada bayi dalam kandungan setelah trimester pertama maupun pada masa bayi dan anak akan menyebabkan ukuran penis kecil (Hughes, 2009). Penelitian ini menemukan rerata panjang penis pada kelompok kriptorkismus lebih pendek dibandingkan kelompok anak yang sehat (4,23 ± 0,56 cm vs 4,65 ± 0,76 cm) dan berbeda secara bermakna dengan nilai-p= 0,02 (p< 0,05). Rerata volume testis kiri juga lebih kecil secara bermakna pada kelompok anak dengan kriptorkismus dibandingkan dengan anak yang sehat (1,80 ± 0,49 ml vs 2,37 ± 0,61 ml ) dengan nilai-p= 0,001 (p<0,050). Hal ini mungkin disebabkan pada anak yang mengalami kriptorkismus sudah ada sedikit kerusakan sehingga produksi hormon testosteron lebih rendah. Volume testis kiri lebih kecil bermakna pada kriptorkismus kemungkinan karena 51,61% kriptorkismus kiri sedangkan kriptorkismus kanan hanya 32,26%, karena yang kanan mungkin banyak turun spontan. Pada penelitan ini prosentase kriptorkismus intraabdominal dan kriptorkismus inguinal sama yaitu masing-masing 41,94%, prosentase kriptorkismus kanan lebih kecil dari kriptorkismus kiri (32,26% vs 51,61%) dan kriptorkismus bilateral hanya 16,13%. Hasil ini berbeda dengan yang ditemukan Kaefer (2004) bahwa kriptorkismus unilateral dua kali lebih banyak dari kriptorkismus bilateral dan kriptorkismus kanan dua kali lebih banyak dari kriptorkismus kiri. Bajpai & Menon (2008) menemukan bahwa 20% testis tidak teraba dan kebanyakan letaknya di kiri. Pada penelitian ini anak kriptorkismus yang dipakai kasus berusia 6 bulan ke atas sedangkan 2/3 anak kriptorkismus bijinya akan turun spontan sebelum usia 6 bulan, karena itu kemungkinan kriptorkismus inguinal kiri yang tinggi sebelumnya adalah intraabdominal kiri dan kriptorkismus inguinal kanan saat lahir setelah usia 6 bulan kebanyakan 109 sudah turun sehingga prosentase kriptorkismus intraabdominal dan inguinal sama yaitu 41,94%, dan inguinal kiri lebih besar dari inguinal kanan. Terjadinya kriptorkismus intraabdominal disebabkan karena adanya gangguan pada produksi maupun sifat dari hormon INSL3, diketahui pada fase penurunan testis transabdominal terjadi pertumbuhan gubernakulum yang dipengaruhi oleh hormon INSL3 dan terjadi juga regresi CSL yang dipengaruhi oleh hormon testosteron. Pada kekurangan hormon INSL3 yang komplit menyebabkan gubernakulum tidak tumbuh dan testis tetap berada di dalam perut, terjadilah kriptorkismus intraabdominal. Fase kedua dari turunnya testis, testis turun dari cincin inguinalis interna dan langsung masuk ke skrotum. Penurunan testis transinguinal ini disebabkan karena terjadinya regresi dari gubernakulum yang sebelumnya gubernakulum sudah tumbuh sampai di dasar skrotum, regresi gubernakulum pada fase ini dipengaruhi oleh hormon testosteron dan gerakan ritmik gubernakulum dari cincin inguinalis interna ke dasar skrotum dipengaruhi oleh GFN dan CGRP. Selain hal diatas penurunan testis juga dipengaruhi oleh adanya tekanan intraabdominal dan hormon AMH terutama penurunan testis transabdominal. Pada anak laki-laki kriptorkismus intraabdominal disebabkan rendahnya kadar hormon INSL3 yang merangsang pertumbuhan gubernakulum, atau adanya resistensi dari reseptor hormon INSL3 ( LGR8). Kriptorkismus inguinal dan kriptorkismus presktrotal terjadi karena rendahnya kadar hormon INSL3 bersifat parsial sehingga gubernakulum tumbuh tetapi pertumbuhan gubernakulum tidak optimal atau petumbuhan gubernakulum tidak mencapai dasar skrotum atau rendahnya kadar hormon testosteron plasma sehingga meskipun gubernakulum sudah tumbuh sampai dasar skrotum tapi regresi dan gerakan ritmik testis tidak optimal sehingga testis berada dalam inguinal atau maksimal bisa mencapai preskrotal tapi tetap tidak mencapai dasar skrotum. 110 6.1. Frekuensi Polimorfisme Polimorfisme SNPs merupakan salah satu bentuk polimorfisme yang bersifat sederhana, prevalensinya banyak dan umumnya merupakan bagian dari polimorfisme DNA yang tumbuh dari substansi pasang basa tunggal. SNPs dapat diidentifikasi dengan melakukan sequenzing pada region yang sama dari genum pada beberapa individu , walaupun SNPs sudah mempunyai kode sequenzing, namun SNPs masih berhubungan dengan gene yang berhubungan langsung dengan fenotip, dan sebagian besar polimorfisme SNPs ditemukan lokusnya anonym. Beberapa kelainan pada pada gen yang lain berhubungan dengan perubahan fenotip secara signifikan merupakan marker DNA (Hartwell dkk., 2008). Polimorfisme SNPs merupakan marker biologi untuk terjadinya penyakit pada genum manusia tertentu, sebab polimorfisme SNPs biasanya terletak dekat dengan gen yang menyebabkan penyakit dan ada kalanya polimorfisme SNPs secara actual menyebabkan penyakit, dan selanjutnya dapat digunakan dan diteliti sebagai penyakit yang disebabkan oleh gen. Pada penelitian ini ditemukan polimorfisme exon 1 gen insl3 ( ditemukan pada anak dengan kriptorkismus dan anak yang sehat), polimorfisme exon 2 gen insl3 ( hanya ditemukan pada anak dengan kriptorkismus ), polimorfisme exon 8 gen lgr8 (hanya ditemukan pada anak dengan kriptorkismus), polimorfisme exon 12 gen lgr8 (ditemukan pada anak dengan kriptorkismus dan anak yang sehat), polimorfisme exon 13 gen lgr8 (ditemukan pada anak dengan kriptorkismus dan anak yang sehat). Frekuensi polimorfisme exon 1 gen insl3 pada anak laki-laki yang kriptorkismus ( A9A = 19,36%; T60T= 51,61%; T60A= 25,81%). Polimorfisme A9A dan polimorfisme T60T tidak terjadi perubahan asam amino, hanya terjadi perubahan susunan basa, sedangkan polimorfisme T60A terjadi perubahan asam amino no 60 dari treonin menjadi alanin dan ditemukan lebih banyak pada anak yang sehat namun tidak berbeda bermakna. Frekuensi polimorfisme exon 2 gen insl3 pada anak laki-laki yang 111 kriptorkismus ( E146E= 9,68%) polimorfisme ini tidak mengubah asam amino. Frekuensi polimorfisme exon 8 gen lgr8 pada anak laki-laki yang kriptorkismus ( kodon stop223M= 3,23%), polimorfisme ini meskipun ditemukan hanya 3,23% tapi hanya ditemukan pada anak kriptorkismus sedangkan pada anak sehat tidak ditemukan dan terjadi perubahan asam amino no 223 dari kodon stop menjadi metionin atau kodon start. Dalam proses replikasi DNA peranan kodon start dan kodon stop sangat penting yang mana kodon start tugasnya memulai suatu replikasi DNA dan kodon stop memberhentikan proses replikasi DNA. Perubahan kodon stop menjadi kodon start asam amino no 223 pada exon 8 gen lgr8 akan mempengaruhi sifat reseptor RGR8 terhadap hormon INSL3 dan selanjutnya berpengaruh pada pertumbuhan gubernakulum, dan kita ketahui pertumbuhan gubernakulum yang normal dan optimal sangat diperlukan untuk penurunan testis. Frekuensi polimorfisme exon 12 gen lgr8 pada anak laki-laki yang kriptorkismus ( E319E= 100%; L331L= 48,39%), kedua polimorfisme ini juga ditemukan pada anak yang sehat tapi jumlahnya pada anak kriptorkismus lebih banyak secara bermakna, polimorfisme E319E dan L331L asam aminonya no 319 tetap glutamate dan asam amino no 331 tetap leusin hanya terjadi perubahan susunan basa pada kodon asam amino glutamat dari GAAGAN/GAG, begitu juga dengan susunan basa asam amino lisin berubah darai CTACTN/CTG. Frekuensi polimorfisme exon 13 gen lgr8 pada anak laki-laki yang kriptorkismus ( S337A= 54,84%; P340P= 41,94%; H345P= 61,29%; K346K= 90,32%; Q354K= 16,13%; Q356P= 29,03%; S357S= 48,39%), polimorfisme S357S asam amino no 357 tetap serine hanya terjadi perubahan susunan basa pada asam amino serine no 357 dari TCTTCC, polimorfisme P340P asam amino no 340 tetap prolin hanya susunan basa asam amino prolin saja yang berubah dari CCTCCN/CCC, polimorfisme K346K asam amino no 346 tetap lisin hanya susunan basa dari asam amino lisin berubah dari AAGAAN/AAA. 112 Polimorfisme S337A terjadi perubahan asam amino no 337 dari serin menjadi alanin, polimorfisme H345P terjadi perubahan asam amino no 345 dari histidin menjadi prolin, polimorfisme Q354K terjadi perubahan asam amino no 354 dari glutamin menjadi lisin, polimorfisme Q356P terjadi perubahan asam amino no 356 dari glutamat menjadi prolin. Semua polimorfisme yang ditemukan berbentuk polimorfisme SNPs, hanya polimorfisme C116C (TGCTNGC) pada exon 2 berbentuk substitusi atau indel. 6.2. Polimorfisme Exon 1, Exon 2 Gen insl3 dan Kriptorkismus Gubernakulum perannya sangat menentukan pada mekanisme yang komplek dari turunnya testis dan tertutupnya hernia inguinalis (Hutson dkk., 2004), perubahan pada gen Insl3 menyebabkan kegagalan testis secara normal masuk ke skrotum selama perkembangan embriyo (Ferline dkk.,2003). Kekacauan genetik dari gen insl3 pada tikus percobaan menyebabkan tingginya kriptorkismus intraabdominal. Analisis mutasi gen insl3 dengan SNPs pada pasien kriptorkismus belum jelas (The Endocine society, 2005). Penelitian ini menemukan adanya polimorfisme exon 1 dan exon 2 gen insl3, polimorfisme exon 1 ditemukan berupa M1M (ATGNTG) asam amino no 1 tetap metionin, A9A (GCGGCN/GCA) asam aminonya tetap alanin, L42L (CTACTN) asam amino tetap leusin, L42P (CTACNN) asam amino berubah dari leusin menjadi prolin, V43M (GTGNNG) asam amino valin menjadi metionin, T60T (ACCNCC) asam amino tetap treonin, T60A (ACCGCC) asam amino berubah dari treonin menjadi alanin. Sedangkan peneliti lain yang menemukan polimorfisme exon 1 gen insl3 adalah Lim dkk (2001) menemukan polimorfisme pada exon 1 berupa A41A (GCGGCA) asam aminonya tetap alanin, polimorfisme ini tidak ditemukan pada penelitian ini. Ferlin dkk (2003) menemukan 113 polimorfisme exon 1 berupa A9A (GCGGCA) asam aminonya tetap alanin, L42L (CTACTG) asam aminonya tetap leusin, T60A (ACCGCC) asam amino berubah dari treonin menjadi alanin, polimorfisme ini ditemukan juga pada penelitian ini. Foresta dkk (2008) menemukan polimorfisme berupa V18M (GTGATG) asam amino berubah dari valin menjadi metionin, P49S (CCCTCC) asam amino berubah dari prolin menjadi serin, polimorfisme ini tidak ditemukan pada penelitian ini. Polimorfisme T60A ditemukan lebih banyak pada anak yang sehat dibandingkan anak dengan kriptorkismus meskipun tidak berbeda secara bermakna kemungkinan polimorfisme T60A merupakan faktor protektip untuk terjadinya kriptorkismus pada anak. Polimorfisme T60A dan polimorfisme T60T ditemukan dalam jumlah yang banyak baik pada anak dengan kriptorkismus maupun pada anak yang sehat hal ini kemungkinan exon 1 gen insl3 perannya kecil terhadap produksi hormon INSL3 oleh sel Leydig. Pada penelitian ini polimorfisme exon 2 ditemukan berupa R73R (CGACNA) asam aminonya tetap arginin, C115W (TGCTGG) asam amino berubah dari sistein menjadi triptopan, C116C (TGCTNGC) asam amino tetap sistein, kodon stop140kodon stop (AGAANA), G144G (GGCNGC) asam amino tetap glisin, E146E (GAGNAG) asam amino tetap glutamate, Q157Q (CAGCAN) asam amino tetap glutamin, A166D (GCCGAC) asam amino berubah dari alanin menjadi aspartat. Pada exon 2 meskipun jumlahnya kecil polimorfisme hanya ditemukan pada kelompok anak dengan kriptorkismus dan ada beberapa polimorfisme yang asam aminonya berubah. Polimorfisme exon 2 gen insl3 yang ditemukan hanya pada anak dengan kriptorkismus dan tidak ditemukan pada anak yang sehat menandakan exon 2 gen insl3 sangat berperan dalam memproduksi hormon INSL3 dan pertumbuhan gubernakulum. Peneliti lain yang menemukan polimorfisme pada exon 2 gen insl3 adalah Lim dkk (2001) berupa L85L (CTCCTG) asam aminonya tetap leusin, V141L 114 (GTGCTG) asam aminonya berubah dari valin menjadi leusin, (140A, 140G, 160T berupa dilesi atau polimorfisme indel), A152V (GCTGTT) asam aminonya berubah dari alanin menjadi valin, polimorfirme ini tidak ditemukan pada penelitian ini. Canto dkk (2003) menemukan polimorfisme berupa N86K (AACAAG) asam aminonya berubah dari asparagin menjadi lisin, polimorfisme ini tidak ditemukan pada penelitian ini. Ferlin dkk (2003) menemukan polimorfisme berupa P93L (CCCCTC) asam aminonya berubah dari prolin menjadi leusin, R102H (CGCCAC) asam aminonya berubah dari arginin menjadi histidin, R102C (CGCTGC) asam aminonya berubah dari arginin menjadi sistein, polimorfisme ini tidak ditemukan pada penelitian ini. Pada penelitian ini polimorfisme exon 1 M1M, L42L, L42P, V43M jumlahnya masing-masing 1 dan hanya ditemukan pada anak dengan kriptorkismus. Polimorfisme A9A, T60T, T60A ditemukan pada anak dengan kriptorkismus dan anak sehat. Frekuensi polimorfisme T60T ditemukan lebih banyak secara bermakna pada kelompok anak dengan kriptorkismus dibandingkan anak normal (51,61% vs 16,13%) , polimorfisme T60T berisiko tidak terhingga menyebabkan kejadian kriptorkismus dibandingkan dengan yang wild type, tetapi polimorfisme ini tidak merubah asam amino no 60 hanya merubah susunan basa dari kodon asam amino treonin ( ACCNCC). Pada polimorfisme T60A ada perubahan asam amino no 60 dari treonin menjadi alanin dan bersifat protektip untuk terjadinya kasus kriptorkismus pada anak karena frekuensinya lebih banyak pada anak yang sehat ( 25,81% vs 48,39%) tetapi tidak berbeda bermakna secara statistik. Dari hasil penelitian ini ditemukan polimorfisme exon 1 yang diwakili polimorfisme T60T berkaitan dengan marker baru kriptorkismus pada anak laki-laki karena lebih banyak secara bermakna pada kasus tetapi secara biologi asam aminonya tetap treonin (hanya susunan basa saja pada asam amino treonin yang berubah). 115 6.3. Polimorfisme Exon 8, Exon 12, Exon 13 Gen lgr8 dan Kriptorkismus Reseptor LGR8 merupakan reseptor dari hormon INSL3 (Ferlin dkk., 2003; Nuti dkk., 2007). Hormon INSL3 dan reseptor LGR8 memainkan peran penting pada penurunan testis fase transabdominal (Kumagai dkk., 2002a,b). Reseptor LGR8 tersebar di testis, ligament gubernakulum dan pada epididymis (Anand-Ivell dkk., 2006). Gen lgr8 terdiri dari 18 exon dan terletak pada kromosom 13 yaitu 13q13.1 yang mempunyai panjang 63.330 pasang basa (dari 5001 – 68331. Analisis mutasi gen lgr8 dideteksi dengan SNPs, pada tikus percobaan perubahan susunan basa gen lgr8 menyebabkan tingginya kasus kriptorkismus intraabdominal (Ferlin dkk., 2003). Penelitian ini juga menemukan polimorfisme exon 8 gen Lgr8 berupa (kodon stop223M) asam amino berubah dari kodon stop menjadi metionin, sedangkan peneliti lain menemukan polimorfisme exon 8 gen lgr8 berupa T222P (ACCCCC) asam amino berubah dari treonin menjadi prolin oleh (Garlov dkk 2002, Ferlin dkk 2003, Vinci dkk 2004, Nuti dkk 2007). Polimorfisme exon 8 pada penelitian ini hanya ditemukan pada anak dengan kriptorkismus (kodon stop223M) dan peneliti lain juga menemukan pada anak dengan kriptorkismus ( T222P ) meskipun jumlahnya tidak banyak kemungkinan exon 8 gen lgr8 banyak mempengaruhi fungsi reseptor LGR8. Polimorfisme exon 12 gen lgr8 berupa (N315N, E319E, L331L) asam aminonya tetap asparagin, glutamat, leusin. Polimorfisme E319E dan L331L juga ditemukan oleh peneliti lain Ferlin dkk (2003) dan Nuti dkk (2007). Pada penelitian ini polimorfisme E319E dan polimorfisme L331L berbeda bermakna antara kelompok anak dengan kriptorkismus dan anak sehat. Polimorfisme E319E dan L331L merupakan polimorfisme yang umum ditemukan oleh peneliti lain namun pada penelitian ini ditemukan perbedaan bermakna, perbedaan frekuensi ini kemungkinan disebabkan oleh faktor ras dan kemungkinan exon 12 gen lgr8 perannya terhadap 116 fungsi reseptor LGR8 tidak banyak. Polimorfisme exon 13 gen lgr8 berupa (S337A asam aminonya berubah dari serin menjadi alanin, P340P asam aminonya tetap prolin, L344L asam aminonya tetap leusin, H345P asam aminonya berubah dari histidin menjadi prolin, K346K asam aminonya tetap lisin, Q348Q asam aminonya tetap glutamin, Q354K asam aminonya berubah dari glutamin menjadi lisin, Q356P asam aminonya berubah dari glutamin menjadi prolin, S357S asam aminonya tetap serin, S357C asam aminonya berubah dari serin menjadi sistein), peneliti lain belum menemukan polimorfisme pada exon 13 gen lgr8, sehingga polimorfisme pada exon 13 gen lgr8 ini merupakan temuan baru dari penelitian ini. Polimorfisme pada exon 13 gen lgr8 banyak ditemukan adanya perubahan asam amino dan banyak ditemukan juga polimorfisme hanya pada anak dengan kriptorkismus hal ini kemungkinan peran exon 13 dalam mempengaruhi fungsi reseptor lgr8 sangatlah besar. Polimorfisme (kodon stop223M) exon 8, (N315N) exon 12, (S337A, L344L, Q348Q, Q354K, Q356P, S357S, S357C) exon 13 hanya ditemukan pada kelompok anak dengan kriptorkismus. Polimorfisme E319E dan L331L exon 12 ditemukan pada kelompok anak dengan kriptorkismus dan anak sehat, namun jumlahnya lebih banyak pada kelompok anak dengan kriptorkismus dan berbeda secara bermakna. Polimorfisme E319E dan L331L exon 12 gen lgr8 berisiko tidak terhingga untuk E319E dan 10,0 kali lebih besar untuk L331L menimbulkan kejadian kriptorkismus dibandingkan dengan yang wild type. Polimorfisme exon 12 yang diwakili polimorfisme E319E, L331L berkaitan dengan marker kejadian kriptorkismus pada anak laki-laki karena berbeda secara bermakna, tetapi asam amino tetap hanya terjadi perubahan susunan basa dari asam amino glutamat dan asam amino lisin. Polimorfisme exon 13 yang diwakili oleh S337A, H345P, Q356P berkaitan dengan meningkatnya risiko kejadian kriptorkismus pada anak laki-laki karena berbeda secara bermakna dan secara biologi terjadi perubahan asam amino, sedangkan polimorfisme S357S berkaitan 117 dengan marker baru kejadian kriptorkismus pada anak laki-laki karena yang berubah hanya susunan basa dari asam amino serin. 6.4. Kadar Hormon INSL3, Hormon Estradiol dan kriptorkismus Gubernakulum tumbuh dengan cepat pada fetus laki-laki, namun pada fetus perempuan pertumbuhan gubernakulum tidak sempurna, faktor yang berperan pada pertumbuhan gubernakulum adalah hormon INSL3, tidak sempurnanya pertumbuhan gubernakulum berhubungan dengan aktivitas mitosis dari bulbus gubernakulum dari fetus laki-laki dan fetus perempuan (Emmen dkk., 2000). Gubernakulum perannya sangat menentukan pada mekanisme yang komplek dari turunnya testis dan tertutupnya hernia inguinalis (Hutson dkk., 2004). Pada laki-laki yang normal dan pada tikus percobaan yang organ seksualnya sudah matur hormon INSL3 konsentrasinya di sirkulasi dapat terdeteksi maksimum 1 ng/ml, sedangkan konsentrasi hormon INSL3 dalam vena spermatika alalah > 14 ng/ml, karena hormon Insl3 merupakan hormon autokrin-parakrin ( Anand-Ivell dkk., 2006 ). Hormon INSL3 merupakan marker penting untuk mengetahui fungsi sel leydig dan status difrensiasinya, ekpresi hormon INSL3 meningkat pada masa fetus, menurun setelah bayi lahir dan kemudian ekspresi INSL3 meningkat lagi saat remaja. Kekurangan hormon INSL3 sangat penting sebagai tanda dari adanya hipogonad (Foresta dkk., 2008 ). Penelitian ini menemukan rerata kadar hormon INSL3 plasma pada kelompok anak dengan kriptorkismus adalah 0,40 ± 0,24 ng/ml, pada kelompok anak yang sehat adalah 0,91 ± 0,46 ng/ml, pada anak dengan kriptorkismus rerata kadar hormon INSL3 plasma lebih rendah secara bermakna. Nilai batas optimum kadar hormon INSL3 plasma untuk diagnosis kriptorkismus (< 0,42 ng/ml, kurva ROC), frekuensi kadar hormon INSL3 plasma yang rendah lebih banyak secara 118 bermakna pada anak kriptorkismus dibandingkan anak yang normal (58,06 % vs 9,68 % ) dan kadar hormon INSL3 plasma yang rendah berisiko 12,92 kali lebih besar untuk terjadinya kriptorkismus dibandingkan dengan anak yang normal. Kadar hormon INSL3 plasma yang rendah dengan nilai batas optimum <0,42 ng/ml berkaitan dengan meningkatnya risiko kriptorkismus pada anak laki-laki. Penelitian ini menemukan dari 31 anak laki-laki kriptorkismus 13 orang ( 41,94 % ) mengalami kriptorkismus intraabdominal, 13 orang ( 41,94 % ) mengalami kriptorkismus inguinal dan 5 orang ( 16, 12 % ) mengalami kriptorkismus preskrotal. Setelah dibandingkan kadar hormon INSL3 plasma yang rendah dengan nilai optimum < 0,42 ng/ml kurva ROC antara anak laki-laki dengan kriptorkismus intraabdominal dan kriptorkismus inguinal tidak ditemukan perbedaan ( 53,85% vs 53,85% ). Sementara diketahui hormon INSL3 plasma berperan dalam pertumbuhan gubernakulum dan pada penurunan testis transabdominal, sehingga diharapkan kadar hormon INSL3 plasma yang rendah ditemukan frekuensinya lebih banyak pada anak lakilaki dengan kriptorkismus intraabdominal namun pada penelitian ini frekuensi kadar hormon INSL3 yang rendah antara kriptorkismus intraabdominal dengan kriptorkismus preskrotal tidak ada perbedaan. Sedangkan kadar hormon INSL3 plasma yang rendah ditemukan lebih banyak pada anak kriptorkismus dibandingkan anak yang normal ( 58,06 % vs 9,68 % ). Kadar hormon INSL3 plasma pada anak yang kriptorkismus dipengaruhi oleh testis lainnya yang masih normal dan dipengaruhi juga oleh berat ringannya kerusakan testis anak yang kriptorkismus. Adanya resistensi pada reseptor LGR8 yang diakibatkan oleh banyaknya polimorfisme pada gen lgr8 mempengaruhi kadar hormon INSL3 karena bila ada resistensi pada reseptor dari hormon akan memacu pengeluaran hormon sebagai kompensasi. 119 Penurunan testis dihambat oleh hormon estradiol, pengaruh hormon estradiol diperkirakan sebagai mediasi penekanan perkembangan sel leydig pasien dan menyebabkan menurunnya produksi hormon testosteron dan hormon INSL3 (The endocrine society, 2005). Pada tikus yang diobati dengan diethylstilbesterol saat hamil kasus kriptorkismus ditemukan meningkat, diperkirakan estrogen dalam fetus dapat menimbulkan penekanan ekspresi Insl3 dan feedbac inhibisi terhadap axis hipothalamus hipofise gonad sehingga terjadi hipoandrogenisme (Ivell & Hartung., 2003). Penelitian ini menemukan rerata kadar hormon estradiol plasma pada kelompok anak dengan kriptorkismus adalah 17,08 ± 16,05 ng/ml , pada kelompok anak yang sehat adalah 9,55 ± 4,92 ng/ml, pada anak dengan kriptorkismus rerata kadar hormon estradiol plasma lebih tinggi secara bermakna. Nilai batas optimum kadar hormon estradiol plasma untuk diagnosis kriptorkismus (>10,22 ng/ml, kurva ROC), kadar hormon estradiol plasma yang tinggi lebih banyak secara bermakna pada anak kriptorkismus dibandingkan dengan anak yang normal dan kadar hormon estradiol plasma yang tinggi berisiko 10,19 kali lebih besar menimbulkan kriptorkismus dibandingkan anak yang normal. Kadar hormon estradiol plasma yang tinggi dengan nilai batas optimum > 10,22 ng/ml berkaitan dengan meningkatnya risiko kriptorkismus pada anak laki-laki. Kadar hormon estradiol plasma yang tinggi pada anak laki-laki bisa berasal dari perubahan hormon testosteron menjadi hormon entradiol melalui proses aromatisasi dengan enzim aromatase, gangguan pada proses aromatisasi menyebabkan kadar hormon estradiol plasma meningkat. Kadar hormon estradiol plasma pada anak laki-laki juga bisa berasal dari kadar hormon estradiol ibu saat bayi dalam kandungan dan bisa juga berasal dari makanan setelah bayi lahir ( anak makan makanan yang banyak mengandung estradiol). Kadar estradiol plasma yang 120 tinggi dalam plasma akan menekan produksi hormon INSL3 dan produksi hormon testosteron sehingga terjadi kriptorkismus. 6.5. Hubungan Polimorfisme Gen insl3, Kadar Hormon Estradiol Plasma yang Tinggi, Kadar Hormon INSL3 Plasma yang Rendah dan Adanya Polimorfisme Gen lgr8 dengan Kejadian Kriptorkismus Gubernakulum berhubungan dengan ujung bawah testis-epididimis terletak pada bagian kranial kanalis inguinalis di diperlukan untuk perkembangan normal prosesus vaginalis. Mekanisme terputusnya bagian distal gubernakulum merupakan hasil dari berkurangnya perkembangan prosesus vaginalis. Regresi ligamen suspensory kranial dan penebalan gubernakulum menghasilkan migrasi testis transabdominal, keadaan ini membawa testis ke cincin inguinalis interna pada usia tiga bulan kehamilan, selama bulan ke empat sampai ke lima kehamilan, kantong luar peritoneum berkembang sepanjang bagian kaudal dari gubernakulum meluas lewat kanalis inguinalis ke dalam skrotum (Kaefer, 2004., Achermann, 2005). Gubernakulum sangat berperan pada fase turunnya testis dari intraabdominal ke dasar sekrotum, pada fase pertama akan terjadi pertumbuahan gubernakulum sampai di dasar sekrotum, hal ini akan menyebabkan turunnya testsis dari intraabdominal dan masuk cincin inguinalis interna (penurunan testis transabdominal). Hormon yang mempengaruhi pertumbuhan gubernakulum adalah hormon INSL3, bila terjadi gangguan dalam produksi atau sifat dari hormon INSL3 atau resistensi akibat gangguan reseptor hormon INSL3 (gangguan reseptor LGR8) di gubernakulum, menyebabkan gangguan pertumbuhan gubernakulum atau gubernakulum tidak tumbuh (testis tetap di intraabdominal atau kriptorkismus intraabdominal) atau gubernakulum masih tumbuh tapi tidak optimal sampai di dasar sekrotum menyebabkan testis tidak bisa turun optimal sampai di dasar skrotum (kriptorkismus inguinal atau kriptorkismus presekrotal) hal ini karena pada saat 121 regresi gubernakulum pada fase penurunan testis traninguinal yang dipengaruhi hormon testosteron tetap tidak bisa menyebabkan penurunan testis sampai dasar sekrotum karena gubernakulum belum pernah turun sampai kantong sekrotum. Kita ketahui setelah bayi lahir sampai usia 1 tahun 2/3nya akan terjadi penurunan testis spontan karena terjadi peningkatan produksi hormon testosteron asal pertumbuhan gubernakulum sebelumnya sudah optimal sampai di dasar sekrotum. Pada penelitian ini ditemukan rerata kadar hormon INSL3 plasma pada anak yang kriptorkismus lebih rendah secara bermakna dibadingkan dengan rerata kadar hormon INSL3 plasma pada anak yang normal, dengan asumsi peneliti kadar hormon INSL3 juga rendah pada saat bayi dalam kandungan saat terjadi pertumbuhan gubernakulum dan gubernakulum tidak tumbuh pada anak dengan kriptorkismus intraabdominal atau pertumbuhan gubernakulum tidak optimal pada kriptorkismus inguinal dan kriptorkismus presekrotal. Rendahnya kadar hormon INSL3 dipengaruhi oleh faktor genetik berupa adanya polimorfisme pada exon 1 dan exon 2 gen insl3 yang ditemukan pada anak kriptorkismus dan dipengaruhi oleh faktor lingkungan berupa tingginya kadar hormon estradiol yang menekan produksi hormon INSL3 dan produksi hormon testosteron. Pada penelitian ini polimorfisme T60T ditemukan lebih banyak secara bermakna pada anak kriptorkismus dibandingkan anak yang normal, meskipun polimorfisme T60T tidak merubah asam amino treonin no 60 pada exon 1 gen insl3 tapi merubah basa dalam kodon asam amino treonin maka polimorfisme T60T bisa merupakan marker baru kriptorkismus. Pada penelitian ini rerata kadar hormon estradiol lebih tinggi secara bermakna pada anak kriptorkismus dibandingkan dengan anak yang normal, hormon estradiol yang tinggi merupakan faktor lingkungan yang menekan produksi hormon INSL3. Jadi adanya polimorfisme T60T yang merupakan marker baru kriptorkismus dikombinasikan dengan kadar hormon estradiol plasma 122 yang tinggi akan menyebabkan produksi hormon INSL3 berkurang dan kadar hormon INSL3 plasma menjadi rendah. Kadar hormon INSL3 yang rendah mempengaruhi pertumbuhan gubernakulum dan pertumbuhan gubernakulum tidak optimal sehingga testis tidak turun atau turun tidak optimal. Pada penelitian ini ditemukan polimorfisme exon 12 gen lgr8 (E319E, L331L) meskipun tidak merubah asam amino karena jumlahnya pada anak kriptorkismus lebih banyak secara bermakna sehingga merupakan marker kriptorkismus. Pada penelitian ini juga ditemukan polimorfisme exon 13 gen lgr8 (S337A, H345P, Q356P, S357S) ditemukan lebih banyak secara bermakna pada anak kriptorkismus dibandingkan anak yang normal, polimorfisme S357S merupakan marker kriptorkismus karena tidak merubah asam amino, tetapi polimorfisme S337A, H345P, Q356P merupakan faktor risiko kriptorkismus karena asam aminonya berubah. Polimorfisme exon 12 (E319E, L331L) exon 13 (S337A, H345P, Q356P,S357S) gen lgr8 mempengaruhi kepekaan atau terjadinya resistensi reseptor LGR8 terhadap hormon INSL3, sehingga peran hormon INSL3 dalam merangsang pertumbuhan gubernakulum berkurang dan testis tidak turun optimal. Produksi hormon INSL3 yang rendah diperberat lagi oleh adanya resistensi hormon INSL3 akibat gangguan pada reseptor LGR8 (reseptor dari hormon INSL3) di gubernakulum karena adanya polimorfisme exon 12, exon 13 gen lgr8 pada anak yang kriptorkismus. Sehingga kadar hormon INSL3 yang rendah disertai kemampuan yang kurang dalam merangsang pertumbuhan gubernakulum menyebabkan gubernakulum tumbuh tidak optimal dan terjadilah kriptorkismus dengan lokasi yang bervariasi ( intraabdominal, inguinal, presekrotal). Reseptor LGR8 merupakan reseptor dari hormon INSL3, reseptor LGR8 melekat pada permukaan gubernakulum, hubungan antara hormon INSL3 dengan reseptor LGR8 menyebabkan terjadinya pertumbuhan gubernakulum dan adanya gangguan pada kadar hormon 123 INSL3 atau gangguan pada reseptor LGR8 menyebabkan pertumbuhan gubernakulum terganggu atau pertumbuhan gubernakulum tidak optimal. Reseptor LGR8 dipengaruhi oleh gen lgr8, adanya polimorfisme pada gen lgr8 akan mempengaruhi fungsi reseptor LGR8. Pada penelitian ini dari 18 exon gen lgr8 diperiksa 3 exon yang predominan menimbulkan kelainan yaitu exon 8, exon 12 dan exon 13, exon 12 dan exon 13 karena berdekatan primer forward dan primer reversenya sama yaitu primer forward (12-13F): ggatgatgataattgtgagg dan primer reverse (1213R) : ctgaaatgcatgctcctgtg dan ukuran basa yang teramplifikasi dari proses PCR adalah 439 pasang basa. Exon 13 gen lgr8 banyak ditemukan polimorfisme, dan polimorfisme yang terjadi pada exon 13 merupakan faktor risiko atau marker kriptorkismus Polimorfisme pada exon 13 gen lgr8 menyebabkan resistensi reseptor LGR8 terhadap hormon INSL3, kalau produksi hormon INSL3 normal reseistensi reseptor LGR8 akan mengakibatkan produksi hormon INSL3 meningkat karena ada rangsangan untuk memproduksi hormon INSL3 yang lebih banyak. Adanya polimorfisme pada exon 13 gen lgr8 menyebabkan ikatan hormon INSL3 dengan reseptor LGR8 terganggu dan pertumbuhan gubernakulum juga terganggu sehingga terjadi hambatan dalam penurunan gubernakulum dan terjadilah kriptorkismus. Pada penelitian ini polimorfisme paling banyak ditemukan pada exon 13 gen lgr8 dan ada yang merubah susunan asam amino (S337A, Q356P) merubah susunan asam amino dari serin menjadi alanin dan dari glutamin menjadi prolin merupakan faktor risiko baru kejadian kriptorkismus pada anak laki-laki (hanya ditemukan pada anak yang kriptorkismus). Polimorfisme exon 13 gen lgr8 (H345P) merubah susunan asam amino dari histidin menjadi prolin tapi ditemukan juga pada anak yang sehat meskipun jumlahnya lebih sedikit secara bermakna sehingga merupakan faktor risiko atau marker baru kejadian kriptorkismus pada anak laki-laki. Polimorfisme exon 13 gen lgr8 (S357S) asam aminonya tetap tapi hanya ditemukan pada anak laki-laki yang kriptorkismus merupakan marker baru kejadian kriptorkismus pada anak laki-laki. Susunan asam amino yang disandi oleh exon 13 gen lgr8 adalah: Asn(335)Leu(336)-Ser(337)-Ser(338)-Asn(339)-Pro(340)-Leu(341)-Met(342)-Tyr(343)-Leu(344)- 124 His(345)-Lys(346)-Asn(347)-Gln(348)-Phe(349)-Glu(250)-Ser(351)-Leu(352)-Lys(353)Gln(354)-Leu(355)-Gln(356)-Ser(357)-Leu(358). Pada exon 12 gen lgr8 ditemukan 2 polimorfisme (E319E, L331L) asam aminonya tetap glutamate dan leusin merupakan marker kejadian kriptorkismus pada anak laki-laki. Susunan asam amino yang disandi oleh exon 12 gen lgr8 adalah: Asp(311)-Leu(312)-Ser(313)-Ser(314)-Asn(315)-Thr(316)-Met(317)-Thr(318)- Glu(319)-Leu(320)-Ser(321)-Pro(322)-His(323)-Leu(324)-Phe(325)-Lys(326)-Asp(327)Leu(328)-Lys(329)-Leu(330)-Leu(331)-Gln(332)-Lys(333)-Leu(334). Polimorfisme exon 1 gen insl3 (T60T) asam aminonya tetap treonin. Exon 1 gen insl3 menyandi susunan asam amino hormon INSL3 berupa: Met(1)-Asp(2)-Pro(3)Arg(4)-Leu(5)-Pro(6)-Ala(7)-Trp(8)-Ala(9)- Leu(10)- Val(11)-Leu(12)-Leu(13)-Gly(14)-Pro(15)-Ala(16)-Leu(17)-Val(18)-Phe(19)-Ala(20)Leu(21)-Glt(22)-pro(23)-Ala(24)-Pro(25)- Thr(26)-Pro(27)-Glu(28)-Met(29)-Arg(30)-Glu(31)- Lys(32)-Leu(33)-Cys(34)-Gly(35)-His(36)-His(37)-Phe(38)-Val(39)-Arg(40)-Ala(41)-Leu(42)Val(43)-Arg(44)-Val(45)-Cys(46)-Gly(47)-Gly(48)-Pro(49) –Arg(50)-Trp(51)-Ser (52)-Thr(53)Glu(54)-Ala(55)-Arg(56)-Arg(57)-pro(58)-Ala(59)-Thr(60)-Gly(61)-Gly(62)-Asp(63). Polimorfisme yang ditemukan pada penelitian ini menyandi asam amino yang sama, hanya terjadi perubahan susunan nukleotida saja ( T60T), (E319E, L331L), (S357S) dan ada yang menyandi asam amino berbeda (S337A, H345P, Q356P). Kadar hormon INSL3 plasma yang rendah (< 0,42 ng/ml), kadar hormon estradiol plasma yang tinggi ( >10,22 ng/ml), polimorfisme exon 13 gen lgr8 ( S337A, H345P, Q356P, S357S ) secara bersama-sama atau secara sendiri-sendiri berkaitan dengan meningkatnya risiko kriptorkismus pada anak laki-laki (nilai-p total: < 0,001, nilai-p hormon INSL3 rendah < 0,001, nilai-p hormon estradiol tinggi < 0,001, nilai-p polimorfisme exon13 gen lgr8 : 0,005). Dengan analisis regresi linier ditemukan 54,8 % kriptorkismus pada anak laki-laki dipengruhi oleh kadar hormon INSL3 plasma yang rendah, kadar hormon estradiol plasma yang tinggi dan adanya polimorfisme exon 13 gen lgr8 secara bersama-sama dan sisanya oleh sebab-sebab lain (R= 0, 740., RSquare = 0, 548., Adjusted R square : 0, 524 ). 125 6.6. Kebaharuan Penelitian ( Novelty ) 1. Faktor risiko kriptorkismus adalah: a. Polimorfisme S337A exon 13 gen lgr8 b. Polimorfisme H345P exon 13 gen lgr8 c. Polimorfisme Q356P exon 13 gen lgr8 d. Kadar hormon INSL3 plasma yang rendah < 0,42 ng/ml e. Kadar hormon estradiol plasma yang tinggi > 10,22 ng/ml 2. Marker kriptorkismus adalah: a. Polimorfisme T60T exon 1 gen insl3 b. Polimorfisme E319E exon 12 gen lgr8 c. Polimorfisme L331L exon 12 gen lgr8 d. Polimorfisme S357S exon 13 lgr8 3. Polimorfisme baru anak kriptorkismus adalah: a. Polimorfisme T60T exon 1 gen insl3 b. Polimorfisme S337A exon 13 gen lgr8 c. Polimorfisme H345P exon 13 gen lgr8 d. Polimorfisme Q356P exon 13 gen lgr8 e. Polimorfisme S357S exon 13 gen lgr8 126 6.7.Keterbatasan Penelitian Keterbatasan penelitian ini adalah tidak semua exon gen lgr8 diperiksa, dari 18 exon hanya exon yang predominan memiliki kelainan saja yang diperiksa yaitu exon 8, exon 12 dan exon 13. Tidak diperiksanya kadar hormon testosteron plasma untuk mengurangi kelemahan ini dilakukan kriteria eksklusi pada kelainan klinis karena rendahnya hormon testosteron (mikropenis, hipospadia, adanya kordae). Dari beberapa gen yang mempengaruhi kriptorkismus yang diperiksa hanya gen yang berhubungan dengan pertumbuhan gubernakulum yaitu gen insl3 dan gen lgr8. Adanya keterbatasan dengan studi kasus kontrol berupa tidak dapat memberikan angka insiden, tidak dapat dipakai menentukan lebih dari satu variabel tergantung. 127 BAB VII SIMPULAN DAN SARAN 7.1. Simpulan Dari hasil-hasil yang ditemukan dari penelitian ini dan pembahasannya diajukan simpulan sebagai berikut: 1. Frekuensi polimorfisme exon 1 gen insl3 pada anak laki-laki yang kriptorkismus adalah (A9A= 19,36%; T60T= 51,61%; T60A= 25,81%), exon 2 adalah 9,68%). (E146E= Frekuensi polimorfisme exon 8 gen lgr8 pada anak laki-laki yang kriptorkismus adalah (kdn stp223M= 3,23%), exon 12 adalah (E319E= 100%; L331L= 48,39%), exon 13 adalah (S337A= 54,84%; P340P= 41,94%; H345P= 61,29%; K346K= 90,32%; Q354K= 16,13%; Q356P= 29,03%; S357S= 48,39%). 2. Polimorfisme exon 1 gen insl3 (T60T) berkaitan dengan marker baru kriptorkismus pada anak laki-laki. 3. Polimorfisme exon 12 gen lgr8 (E319E, L331L) berkaitan dengan marker kriptorkismus pada anak laki-laki. Polimorfisme exon 13 (S357S) berkaitan dengan marker baru kriptorkismus pada anak laki-laki. Polimorfisme exon 13 (S337A, Q356P) berkaitan dengan meningkatnya risiko kriptorkismus pada anak laki-laki. Polimorfisme exon 13 (H345P) berkaitan dengan meningkatnya risiko atau marker baru kriptorkismus pada anak laki-laki. 4. Kadar hormon INSL3 plasma yang rendah dengan nilai batas optimum <0,42 ng/ml berkaitan dengan meningkatnya risiko kriptorkismus pada anak laki-laki. 5. Kadar hormon estradiol plasma yang tinggi dengan nilai batas optimum > 10,22 ng/ml berkaitan dengan meningkatnya risiko kriptorkismus pada anak laki-laki. 127 128 7.2. Saran Dari hasil-hasil penelitian ini dapat diajukan beberapa saran, sebagai berikut: 1. Pada anak laki-laki yang mengalami kriptorkismus bisa ditentukan langkah terapi dan prognosis selanjutnya (bila kadar hormon INSL3 normal dan tidak ada polimorfisme gen Insl3 dan gen Lgr8 untuk menurunkan testis bisa terapi dengan hormon hCG dan bila ada polimorfisme pada gen insl3 dan gen lgr8 bisa langsung terapi pembedahan berupa orkidektomi, prognosis kurang baik bila kadar hormon INSL3 rendah (< 0,42 ng/ml). Untuk mendapatkan pemeriksaan yang lebih efisien bisa dengan melakukan PCR pada salah satu: S337A, H345P, Q356P exon 13 gen lgr8 dengan enzim restriksi. 2. Perlu penelitian lebih lanjut kemungkinan penggunaan hormon Insl3 sintetik dan obat yang mempengaruhi kepekaan reseptor LGR8 terhadap hormon INSL3 pada anak kriptorkismus. 129 DAFTAR PUSTAKA Acerini,C.L., Miles,H.L., Dunger,D.B., Ong,K.K., Hughes,I.A. 2009. Abstract: The descriptipe epidemiology of congenital and acquired cryptorchidism in a UK infant cohort. Arch Dis Child, jun 18. (Epub ahead of print) PubMed PMID: 19542061. Achermann,J.C. 2005. Development of the reproductive systems. in: Brook,C.G.D., Clayton,P.E., Brown,R.S., editors. Clinical Pediatric Endocrinology. 5th . Ed. London: Blackwell. p. 153-170. Amann,R.P., Veeramachaneni,D.N.R. 2007. Review: Cryptorchidism in common eutherian mammals. Society for Reproduction and Fertility, 133: 541-561. Amory,J.K., Page,S.T., Anawalt,B.D., Coviello,A.D., Matsumoto,A.M., Bremner,W.J. 2007. Elevated End-of-treatment serum INSL3 is associated with failure to completely suppress spermatogenesis in men receiving male hormonal contraception. Journal of Andrology, 28(4): 548-554. Anand-Ivell,R.J.K., Relan, V., Balvers,M., Coiffec-Dorval, I., Fritsch, M., Bathgate, R.A.D., Ivell, R. 2006. Expression of the Insulin-Like Peptide 3 ( INSL3) Hormone-Receptor (LGR8 ) system in the Testis. Biology of Reproduction, 74: 945 – 953. Anonim. 2008. Immulite 1000 estradiol. Pilke 2-14. Anonim. 2010. Teknik ELISA untuk Asai hormon. Denpasar: Prodia. Arya. 2007. Kuliah Biomolekuler. Denpasar: S3 Ilmu Kedokteran FK UNUD. Astawa, N.M. 2010. Kuliah mata kuliah penunjang disertasi ( MKPD ), pemeriksaan hormon dengan teknik Elisa dan praktek. Denpasar: S3 Ilmu Kedokteran FK UNUD. Bajpai,A., Menon,P.S.N. 2008. Undescended Testis. in: Desai,M.P., Menon,P.s.N., Bhatia,V., editors. Pediatric Endocrine Disorders. 2nd. Ed. India: Orient Longman Private, p.432-441. Bogatcheva,N.V., Truong,A., Feng,S., Engel,W., Adham,I.M & Agoulnik, A.I. 2003. Great / LGR8 is the only Receptor Insulin-like peptide. Molecular Endocrinoilogy,17(12): 26392646 Bott,R.C., BVSc,E.K.G. 2006. Descent of scrotal testis and temperature regulation. BS 640 Fall. Canto,P., Escudero,I., Soderlund,D., Nishimura,E., Carranza,S., Lira., Gutierrez,J., Nova, A., Mendez, J. P. 2003. Original article: A novel mutation of the insulin-like 3 gene in patients with cryptorchidism. J Hum Genet, 48:86-90 129 130 Cederroth,C.R., Schood,O., Descombes,P., Chambon,P., Vassalli,J.P., Nef,S. 2007. Estrogen Receptor alfa Is a Major Contributor to Estrogen-mediated Fetal Testis Dysgenesis and Cryptorchidism. Endocrinology, 148(11): 5507-5519. Cervantes,L.F., Altman,N.R., Medina,L.S. 2006. Pituitary aplasia. Radiology, 241(3), December: 936-938. Delbes,G., Levacher,C., Duquene,C., Racine,C., Pakarinen,P and Habert,R. 2005. Endogenous Estrogens inhibit Mouse Fetal Leydig cell development via Estrogen Receptor α. Endocrinology, 146(5): 2454-2461. Delbes, G., Levacher,C and Habert,R. 2006. Review: Estrogen effects on fetal and neonatal testicular development. Society for Reproduction and Fertility, 132: 527-538. Departemen of Health & Human Services. 2010. Homo sapiens insulin-like 3 ( Leydig cell ) (INSL3) on chromosome 19, available at: http//www.ncbi.nlm.nih.gov/nuccore /NG012092.1? ordinalpos=9&itooi eutrezsyst. Emmen,J.M.A., Mc Luskey,A., Adham,I.M., Engel,W., Grootegold,J.A., Brinkmann,a.O. 2000. Hormonal control of Gubernaculum development during Testis descent: Gubernaculum outgrowth invitro requires both insulin-like factor and Androgen. Endocrinology, 141(12): 4720-4727. Estradiol 17-beta-dehydrogenase, (NCBI), Available at: http:www.NCBI.nlm.nih.gov/ protein/ AAB16941.1 (Access: 2010, May 17) Ferlin,A., Simonoto,M., Bartoloni,L., Rizzo,G., Bettella,A., Dottorini,T., Dallapiccola, B., Foresta, C. 2003. The INSL3- LGR8/Great Ligand-Receptor Pair in Human Cryptorchidism. The Jaurnal of Clinical Endocrinology & Metabolism, 88(9): 4273-4279. Foresta,C., Zuccarello,D., Garolla,A., Ferlin,A. 2008. Role of Hormonal, Genes, and Environment in Human Cryptorchidism. Endocrine Reviews by The Endocrine Society, 29(5): 560-580. Galan,J.J., Guarducci,E., Nuti,F., Gonzalez,A., Ruiz,M., Ruiz,A., Krausz, C. 2007. Molecular analysis of estrogen receptor alpha gene AGATA haplotype and SNP12 in European Populations: Potential protective effect for cryptorchidism and lack of association with male infertility. Human reproduction, 2 : 444-449. Gallagher,M.P., Oberfield,S.E. 2004. Disorders of sexual differentiation. in: Pescovitz,O.H., Eugster,E.A. editors. Pediatric Endocrinology, Mechanisms, Manifestations, and Management. Philadelphia: Lippincott Williams & Wilkins. p. 243-254. 131 Garlov,I.P., Kamat,A., Bogatcheva,N.V., Jones,E., Lamb,D.J., Truong,A., Bishop, C. E., McElreavey, K., Agoulnik, A. I. 2002. Mutation of the Great gene cause cryptorchidism. Human Molecular Genetics, 11 (9): 2309-2318. Gillam,M.P., Molitch,M.E., Lombardi,G., Calau,A. 2006. Advances in the Treatment of Prolactinomas. Endocrine Reviews, 27(5) Agust: 485-534. Hartwell,L.H., Hood,L., Goldberg,M.L., Reynolds,A.E., Silver,L.M., Veres,R.C. 2008. The direct detection of genotype distinguishes individual genomes. in: Hartwell,L.H., Hood,L., Goldberg,M.L., Reynolds,A.E., Silver,L.M., Veres,R.C., editors. Genetics from Genes to Genomes. 3rd. Ed. Boston Burr Ridge: Mc Graw – Hill. p. 391- 436. Hickey,G.I., Fletcher,H.L., Winter,P. 2007. Genetic Screening. in: Owen,E., Lyons,K.,editors. Genetics. 3rd. Ed. Francis: Taylor. p. 321-324. Homo sapiens insulin-like 3 (Leydig cell) (Insl3) on chromosome 19. 2010, Apr 20-last update, (NCBI), Available at: http://www.ncbi.nlm.nih.gov/nuccore/NG_012092./?&from= 5000&to=9998&repart=genbank (Accessed: 2010, May 9). Homo sapiens relaxin/insulin-like family peptide receptor 2 (RXFP2) on chromosome 13. 2010, Mar 5-last update, (NCBI), Available at: http://www.ncbi.nlm.nih.gov/NG_015819./?& from=5000&to=683308&repart=genbank (Accessed : 2010, May 9). Honour,J.W., Savage,M.O. 2003. Endocrine Function of the Testis. in: Ranke,M.B., editor. Diagnostics of Endocrine function in Children and Adolescents. 3rd. Ed. London: Karger. p.339-355. Hughes,I.A. 2009. Evaluation and Management of Disorders of Sex Development. in: Brook, C., Clayton, P., Brown, R., editors. Brook!s Clinical Pediatric Endocrinology. 6th. Ed. Hongkong: Wiley-Blackwell. p. 192-212. Hutson,J.M. 2007. Cryptorchidism and Hypospadias. Australia: Endotext.com. Hutson,J.M., Sasaki,Y., Huynh,J., Yong,E., Ting,A. 2004. Suplement: The Gubernaculum in Testicular descent and Cryptorchidism. The Turkish Journal of Pediatrics, 46: 3-6. Insulin-like 3 precursor (homo sapiens). 2010, Apr 19-last update, (NCBI), Available at: http://www.ncbi.nlm.nih.gov/protein/38327535 (Accessed: 2010, May 9). Ivell,R and Bathgate,R.A.D. 2002. Minireview: Reproductive Biology of the Relaxin-like faktor (RLF/INSL3). Biology of Reproduction, 67: 699-705. Ivell,R., Hartung,S. 2003. The molecular basis of crypthorchidism. Molecular Human Reproduction, 9 (4): 175-181. 132 Jing,R., knox,M.R., Lee,J.M., Vershinin,A.V., ambrose,M., Ellis,T.H.N., Flavell, A. J. 2005. Insertional Polymorphism and antiquity of PDRI Retrotransposon Insertions in Pisum Species. Genetics, 171: 741-752. Jorde,L.B., Carey,J.C., Bamshad,M.J., White,R.L. 2006. Genetic Variation: Its Origin and Detection. in: Jorde,L.B., Carey,J.C., Bamshad,M.J., White,R.L.editors. Medical Genetics. 3rd. Ed. U.S.A: Mosby. p.29-56. Kaefer,M. 2004. Diagnosis and Treatment of the Undescended Testicle. in: Pescovitz,O.H., Eugster,E.A., editors. Pediatric Endocrinology, Mechanisms, Manifestations, and Management. Philadelphia: Lippincott Williams & Wilkins. p. 255-274. Kaleva, M., Toppari,J. 2003. Review: Genetics and hormones in testicular descent. Hormones, 2(4): 211-216. Klonisch,T., Steger,K., Kehlen,A., Allen,W.R., Froehlich,C., Kauffold,J., Bergmann, M., Hombach-Klonisch, S. 2003. INSL3 Ligand-Receptor System in the Equine Testis. Biology of Reproduction, 68: 1975-1981. Kopp, P.A. 2009. Genetics and Genomics. in: Brook, C., Clayton, P., Brown, R., editors. Brook!s Clinical Pediatric Endocrinology. 6th. Ed. Hongkong: Wiley-Blackwell. p. 1- 23. Krausz,C., Murci,L.Q., Fellous,M., Siffroi, J.P., Mc Elreavey, K. 2000. Absense of mutations involving the INSL-3 gene in human idiopathic cryptorchidism. Molecular Human Reproduction, 6(4) : 298-302. Kumagai,J., Hsu,S. Y., Matsumi,H. Roh,J,S., Fu,P., Wade,J.D., Bathgate, R. A. D., Hsueh, A. J. W. 2002-a. INSL3/Leydig insulin-like peptide activates the LGR8 receptor important in testis descent. JBC Papers in Press, p.1-13. Kumagai,J., Hsu,S. Y., Matsumi,H., Roh,J,S., Fu,P., Wade,J.D., Bathgates, R. A. D., Hsuch, A. J. W. 2002-b. INSL3/Leydig insulin-like peptide activates the LGR8 receptor important in testis descent. The Journal of Biological Chemistry , 277(35): 31283- 31286. Lim,H.L., Rajpert-De Meyts,E., Skakkebaek,N.E., Hawkins,J.R & Hughes,L.A. 2001. Clinical study: Genetic analysis of the INSL3 gene in patients with maldecent of the testis. European Journal of Endocrinology, 144: 129-137. Main,K.M.,Toppari,J., Skakkebalk,N.E. 2006-a. Gonadal development and reproductive hormones in infant boys. European Journal of Endocrinology, 155: 51-57. Main,K.M., Toppari,J., Suomi,A.M., Kaleva,M., Chellakooty,M., Schnidt,I.M., Virtanen, H. E., Boisen, K. A., Kai, C. M., Damgaard, I. N., Skakkebaek, N. E. 2006-b. Large Testes and Higher Inhibin B levels in Finnish than in Danies Newborn boys. The Journal of Clinical Endocrinology & Metabolism, 91(7): 2732-2737. 133 McGlynn, K.A., Graubard,B.I., Nam,J.M., Stanczyk,Z., Longuecker,M.P., Klebanoff,M.A. 2005. Maternal Hormone Levels and Risk of Cryptorchism among Populations at high and low Risk of Testicular germ cell Tumors. Cancer Epidemiology, Biomarkkers & Prevention, 14(7) July : 1732-1737. Microsatellite. 2010, May 6-last update, (WIKIPEDIA), Available at : http://en.Wipedia.org/ Wiki/microsatelit (Accessed: 2010, May 17) Minisatellite. 2010, May 2-last update, (WIKIPEDIA), Available at: http://en.Wikipedia.org/ Wiki/minisatellite (Accessed: 2010,May 17) Indel. 2010, May 16-last update, (WIKIPEDIA), Available at: http://en.Wikipedia.org/ Wiki/Indel (Accessed: 2010 May 17) Moldenhauer,J.S., Ostermeier,G.C., Johuson,A., Diamond,M.P., Krawetz,S.A. 2003. Review: Diagnosing male factor infertility using microarrays. Journal of Andrology, 24 (6) Nopember/Desember : 783-789. Moretti, E., Cairano,G, D., Copitani, S., Scapigliati, G., Baccetti, B., Collodel, G. 2007. Cryptorchidism and Semen Quality: A tem and molecular Study. Journal of Andrology, 28(1) January/February: 194-199. Muller,J. 2003. Gonadotropins, Gonadotropin-Releasing Hormone Tests, and the Ovary. in: Ranke,M.B., editor. Diagnostics of Endocrine function in Children and Adolescents. 3rd. Ed. Copenhagen: Karger. p. 356-371. Nuti,F., Marinari,E., Erdei,E., El-hamshari,M., Echavarria,M.G., Ars,E., Balercia, G., Merksz, M., Giachini, C., Shaeer, K. Z. M., Forti, G., Ruiz-Castane, E., Krausz, C. 2007. The Leucine-Rich Repeat-Containing G Protein-coupled Receptor 8 Gene T222P mutation does not couse Cryptorchidism. J Clin endocrinol Metab, 93(3): 1072-1076. Nuver,J., Smit,A.J., Wolffenbuttel,B.H.R., Shuiter,W.J., Hoekstra,H.J., Sleijfer,D.T. 2005. The Metabolic Syndrome and Disturbances in Hormone levels in Long-Term Survivors of Disseminated Testicular Cancer. Journal of Clinical Oncology, 23: 3718-3725. Pentikainen,V., Dunkel, L., Erkkila, K. 2003. Male Germ Cell Apoptosis. in: Soder,O., editor. The Developing Testis Physiology and Pathophysiology. vol 5. London: Karger. p. 56-80. Pettersson,A., Richiardi,L., Nordenskjold,A., Kaijser,M., Arke,O. 2007. Age at Surgery for Undescended Testis and risk of Testicular Cancer. The New England Journal of Medicine, 356: 1835-1841. Phoenix Pharmaceuticals. 2010, Protocol for catalog # EK-035-27 INSL3 (human ) EIA Kit (range: 0 – 100ng/ml), Available at: http://prodia.co.id/webapps/webmail/src/read_body. php?mailbox=INBOX&passed_id=1 (Accessed : 2010, February 10). 134 Raivio,T., Wikstrom,A.M., Dunkel, L. 2007. Treatment of Gonadotropin –deficient boy with Recombinant human FSH: Lonh-term observation and Out come. European Journal of Endokrinology, 156: 105-111. Relaxin receptor 2 isoform1 (homo sapiens). 2010, Mar 4-last update, (NCBI), Available at: http://www.ncbi.nlm.nih.gov/protein/18677729 (Accessed : 2010, May 9). Setianingsih, I. 2010. Kuliah deteksi polimorfisme gen Insl3 dan gen LGR8. Jakarta: Lembaga Biologi Molekuler Eijkman. Sijstermans,K., Hack,W.W., Meijer,R.W., Van der Voort-Doedens,L.M. 2008. Abstract: The frequency of undescended testis from birth to adulthood: a review. Int J Androl, 31(1): 1-11. Single-nucleotide polymorphism: Variation on a theme. 2007, Sep 20-last update, (NCBI), Available at: http://www.ncbi.nlm.nih.gov/about/primer/Snps.html (Accessed: 2010, May 13) Single-nucleotide polymorphism: (Wikipedia), Available at: http://en.Wikipedia.org/ Singlenucleotide polymorphism #use_and_infortan_of_Snps (Accessed : 2010, May 13) Styne,D.M. 2002. The Testes, Disorders of Sexual Differentiation and Puberty in the Male. in: Sperling,M.A., editor. Pediatric Endocrinology. 2nd. Ed. U.S.A: Saunders. p. 565-628. Suomi,A.M., Main,K.M., Kaleva,M., Schmidt,I.M., Chellakooty,M., Virtanen,H.E., Boisen, K. A., Damgaard, I.N., Kai, C. M., Skakkebaek, N. E., Toppari, J. 2006. Hormonal changes in 3-month-old Cryptorchid Boys. The Journal of Clinical Endocrinology & Metabolism, 91(3): 953-958. The Endocrine Society. 2005. Editorial: Cryptorchidism- An Estrogen Spoil. The Journal of Clinical Endocrinology & Metabolism, 90(8) : 4975-4977. Thonneau,P.F., Caudia,P., Mieusset,R. 2003. Review: Cryptorchidism Incidence, Risk Factors, and potential role of environment an update. Journal of Andrology, 24(2): p.155-162. Toppari,J. 2009. Management of Cryptorchidism. in: Meet the Expert Sessions Handout. LWPES/ESPE 8th joint meeting, September 9-12, 2009. New York. Toppari,J.2003. Physiology and Disorders of Testicular Descent. in: Soder,O., editor. The Developing Testis Physiology and Pathophysiology, vol 5. London: Karger. p. 104-109. Toppari,J., Kaleva, M and Virtamen, H.E. 2001. Trends in the incidence of cryptorchidism and hypospadias and methodological limitations of registry-based date. Human Reproduction Update, 7(3): 282-286 135 Vinci,G., Anjot,M.N., Trivin,C., Lottmann,H; Branner,R and McElrlaves,K. 2004. An Analysis of the Genetic factors Involved in testicular Descent in a Cohort of 14 male Patients with Anorchia. The Journal of Clinical Endocrinology & Metabolism, 89(12): 6282- 6285. Virtanen, H.E., Toppari, J. 2008. Epidemiology and pathogenesis of cryptorchidism. Human Reproduction Update, 14 (1): 49-58 Wales,J.K.H., Wit,J.M., Rogol,A.D. 2003. Pediatric Endocrinology and Growth. 2nd. Ed. Edinburgh: Saunders. p.173-174. Watanabe,M., Yoshida,R., Ueoka,K., Aoki,K., Sosagama,I., Hasegawan,T., Sueoka, K., Kamatani, N., Yoshimura, Y., Ogata, T. 2007. Haplotype analysis of the estrogen receptor 1 gene in male genital and reproductive abnormalities. Human Reproduction. 22(5) : 1279-1284. Wohlfahrt-Veje,C., Boisen,K.A., Boas,M., damgaard,I.N., Kai,C.M., Schmidt,I.M., Chellakooty, M., Suomi, A. M., Toppari, J., Skakkebaek, N. E., Main, K.M . 2009. Abstract: Acquired cryptorchidism is frequent in infancy and childhood. Int J Androl, Jan 6. (Epub ahead of print) PubMed PMID: 19515170. Yuwono,T. 2005. Organisasi Genom. in: Safitri,A., editor. Biologi Molekuler. Jakarta: Erlangga. hal. 75-92. ANALISIS STATISTIK Exon 1 gen insl3 Ca se P rocessing Sum ma ry Ex on-1 A9A * Sam pel Ex on-1 T60T * Sam pel Ex on-1 T60A * Sam pel Valid N Percent 62 100,0% 62 100,0% 62 100,0% N Cases Mi ssing Percent 0 ,0% 0 ,0% 0 ,0% Total N 62 62 62 Percent 100,0% 100,0% 100,0% Exon-1 A9A * Sampel Cr osstab Count Ex on-1 A9A A9A Normal Total Sampel Kasus Kontrol 6 2 25 29 31 31 Total 8 54 62 Chi-Square Tests Pearson Chi-Square Continuity Correction a Likelihood Ratio Fis her's Exact Test Linear-by-Linear As soci ation N of Valid Cases Value 2,296 b 1,292 2,390 1 1 1 As ymp. Sig. (2-sided) ,130 ,256 ,122 1 ,133 df Exact Sig. (2-sided) Exact Sig. (1-sided) ,255 2,259 62 a. Computed only for a 2x2 table b. 2 cells (50,0%) have expected count less than 5. The mi nimum expected count is 4,00. Risk Estimate Value Odds Ratio for Exon-1 A9A (A9A / Norm al) For cohort Sam pel = Kasus For cohort Sam pel = Kontrol N of Valid Cases 95% Confidence Interval Lower Upper 3,480 ,644 18,810 1,620 ,990 2,651 ,466 ,137 1,586 62 Exon-1 T60T * Sampel Crosstab Count Ex on-1 T60T Total T60T Normal Sampel Kontrol Kasus 16 5 15 26 31 31 Total 21 41 62 ,128 Chi-Square Tests Pearson Chi-Square Continuity Correction a Likelihood Ratio Fis her's Exact Test Linear-by-Linear As soci ation N of Valid Cases Value 8,713b 7,201 9,047 1 1 1 As ymp. Sig. (2-sided) ,003 ,007 ,003 1 ,003 df Exact Sig. (1-sided) Exact Sig. (2-sided) ,007 8,573 62 a. Computed only for a 2x2 table b. 0 cells (,0%) have expected count less than 5. The m inim um expected count is 10,50. Risk Estimate 95% Confidence Interval Lower Upper Value Odds Ratio for Exon-1 T60T (T60T / Normal) For cohort Sam pel = Kasus For cohort Sam pel = Kontrol N of Valid Cases 5,547 1,690 18,203 2,083 1,303 3,327 ,375 ,169 ,835 62 Exon-1 T60A * Sampel Crosstab Count Ex on-1 T60A T60A Normal Total Sampel Kasus Kontrol 8 15 23 16 31 31 Total 23 39 62 Chi-Square Tests Pearson Chi-Square Continuity Correction a Likelihood Ratio Fis her's Exact Test Linear-by-Linear As sociation N of Valid Cases Value 3,387b 2,488 3,428 df 1 1 1 3,332 As ymp. Sig. (2-sided) ,066 ,115 ,064 1 Exact Sig. (2-sided) Exact Sig. (1-sided) ,114 ,057 ,068 62 a. Computed only for a 2x2 table b. 0 cells (,0%) have expected count less than 5. The m inim um expected count is 11,50. Risk Estimate Value Odds Ratio for Exon-1 T60A (T60A / Normal) For cohort Sam pel = Kasus For cohort Sam pel = Kontrol N of Valid Cases 95% Confidence Interval Lower Upper ,371 ,127 1,081 ,590 ,318 1,094 1,590 ,983 2,570 62 ,003 Exon 12 gen lgr8 Ca se P rocessing Sum ma ry E12_N315N * S ampel E12_E 319E * S ampel E12_L331L * S ampel Cases Missing Percent N 0 ,0% 0 ,0% 0 ,0% Valid N Percent 62 100,0% 62 100,0% 62 100,0% Total N 62 62 62 Percent 100,0% 100,0% 100,0% E12_N315N * Sampel Crosstab Count E12_ N315N N315N Normal Total Sampel Kontrol Kasus 0 2 31 29 31 31 Total 2 60 62 Chi-Square Tests Pearson Chi-Square Continuity Correction a Likelihood Ratio Fis her's Exact Test Linear-by-Linear As sociation N of Valid Cases 1 1 1 As ymp. Sig. (2-sided) ,151 ,472 ,092 1 ,154 df Value 2,067b ,517 2,839 2,033 Exact Sig. (2-sided) Exact Sig. (1-sided) ,492 ,246 62 a. Computed only for a 2x2 table b. 2 cells (50,0%) have expected count less than 5. The minimum expected count is 1,00. Ri sk Estim ate Value For cohort Sampel = Kas us N of V alid Cas es 95% Confidenc e Int erval Lower Upper 2,069 1,593 2,688 62 E12_E319E * Sampel Crosstab Count E12_ E319E Total E319E Normal Sampel Kasus Kontrol 31 23 0 8 31 31 Total 54 8 62 Chi-Square Tests Value 9,185b 7,032 12,280 Pearson Chi-Square Continuity Correction a Likelihood Ratio Fis her's Exact Test Linear-by-Linear As sociation N of Valid Cases df 1 1 1 9,037 As ymp. Sig. (2-sided) ,002 ,008 ,000 1 Exact Sig. (2-sided) Exact Sig. (1-sided) ,005 ,002 ,003 62 a. Computed only for a 2x2 table b. 2 cells (50,0%) have expected count less than 5. The minimum expected count is 4,00. Ri sk Estim ate 95% Confidenc e Int erval Lower Upper Value For cohort Sampel = Kontrol N of Valid Cas es ,426 ,313 ,581 62 E12_L331L * Sampel Crosstab Count E12_ L331L L331L Normal Total Sampel Kasus Kontrol 15 6 16 25 31 31 Total 21 41 62 Chi-Square Tests Pearson Chi-Square Continuity Correction a Likelihood Ratio Fis her's Exact Test Linear-by-Linear As sociation N of Valid Cases Value 5,833b 4,609 5,977 5,739 1 1 1 As ymp. Sig. (2-sided) ,016 ,032 ,014 1 ,017 df Exact Sig. (2-sided) Exact Sig. (1-sided) ,031 ,015 62 a. Computed only for a 2x2 table b. 0 cells (,0%) have expected count less than 5. The m inim um expected count is 10,50. Risk Estimate Value Odds Ratio for E12_ L331L (L331L / Normal) For cohort Sampel = Kasus For cohort Sampel = Kontrol N of Valid Cases 95% Confidence Interval Lower Upper 3,906 1,255 12,163 1,830 1,146 2,924 ,469 ,228 ,962 62 Exon 13 gen lgr8 Ca se P rocessi ng S um mary Ex on-13 Ex on-13 Ex on-13 Ex on-13 Ex on-13 Ex on-13 Ex on-13 S 337A P 340P H345P K 346K Q354K Q356P S 357S Cases Missing Percent N 0 ,0% ,0% 0 ,0% 0 ,0% 0 0 ,0% ,0% 0 ,0% 0 Valid Percent N 100,0% 62 100,0% 62 100,0% 62 100,0% 62 100,0% 62 100,0% 62 100,0% 62 * S ampel * S ampel * S ampel * S ampel * S ampel * S ampel * S ampel Total N 62 62 62 62 62 62 62 Exon-13 S337A * Sampel Crosstab Count Ex on-13 S337A S337A Normal Total Sampel Kasus Kontrol 17 0 14 31 31 31 Total 17 45 62 Chi-Square Tests Pearson Chi-Square Continuity Correction a Likelihood Ratio Fis her's Exact Test Linear-by-Linear As sociation N of Valid Cases df Value 23,422 b 20,748 30,151 1 1 1 23,044 As ymp. Sig. (2-sided) ,000 ,000 ,000 1 Exact Sig. (2-sided) Exact Sig. (1-sided) ,000 ,000 ,000 62 a. Computed only for a 2x2 table b. 0 cells (,0%) have expected count less than 5. The m inim um expected count is 8,50. Ri sk Estim ate Value For cohort Sampel = Kas us N of V alid Cas es 3,214 95% Confidenc e Int erval Lower Upper 2,081 4,965 62 Exon-13 P340P * Sampel Crosstab Count Ex on-13 P340P Total P340P Normal Sampel Kasus Kontrol 13 8 18 23 31 31 Total 21 41 62 Percent 100,0% 100,0% 100,0% 100,0% 100,0% 100,0% 100,0% Chi-Square Tests Value 1,800b 1,152 1,813 Pearson Chi-Square Continuity Correction a Likelihood Ratio Fis her's Exact Test Linear-by-Linear As sociation N of Valid Cases As ymp. Sig. (2-sided) ,180 ,283 ,178 df 1 1 1 1,771 1 Exact Sig. (2-sided) Exact Sig. (1-sided) ,283 ,142 ,183 62 a. Computed only for a 2x2 table b. 0 cells (,0%) have expected count less than 5. The minimum expected count is 10,50. Risk Estimate 95% Confidence Interval Lower Upper Value Odds Ratio for Exon-13 P340P (P340P / Normal) For cohort Sampel = Kasus For cohort Sampel = Kontrol N of Valid Cases 2,076 ,709 6,085 1,410 ,871 2,283 ,679 ,369 1,248 62 Exon-13 H345P * Sampel Crosstab Count Ex on-13 H345P Sampel Kasus Kontrol 19 9 12 22 31 31 H345P Normal Total Total 28 34 62 Chi-Square Tests Pearson Chi-Square Continuity Correction a Likelihood Ratio Fis her's Exact Test Linear-by-Linear As sociation N of Valid Cases Value 6,513b 5,275 6,637 df 1 1 1 6,408 As ymp. Sig. (2-sided) ,011 ,022 ,010 1 Exact Sig. (2-sided) Exact Sig. (1-sided) ,021 ,010 ,011 62 a. Computed only for a 2x2 table b. 0 cells (,0%) have expected count less than 5. The minimum expected count is 14,00. Risk Estimate Value Odds Ratio for Exon-13 H345P (H345P / Normal) For cohort Sampel = Kasus For cohort Sampel = Kontrol N of Valid Cases 95% Confidence Interval Lower Upper 3,870 1,341 11,172 1,923 1,141 3,239 ,497 ,275 ,899 62 Exon-13 K346K * Sampel Crosstab Count Ex on-13 K346K Sampel Kasus Kontrol 28 21 3 10 31 31 K346K Normal Total Total 49 13 62 Chi-Square Tests Value 4,769b 3,504 4,980 Pearson Chi-Square Continuity Correction a Likelihood Ratio Fis her's Exact Test Linear-by-Linear As soci ation N of Valid Cases 1 1 1 As ymp. Sig. (2-sided) ,029 ,061 ,026 1 ,030 df 4,692 Exact Sig. (2-sided) Exact Sig. (1-sided) ,059 ,029 62 a. Computed only for a 2x2 table b. 0 cells (,0%) have expected count less than 5. The m inim um expected count is 6,50. Risk Estimate 95% Confidence Interval Lower Upper Value Odds Ratio for Exon-13 K346K (K346K / Normal) For cohort Sampel = Kasus For cohort Sampel = Kontrol N of Valid Cases 4,444 1,086 18,183 2,476 ,891 6,878 ,557 ,359 ,865 62 Exon-13 Q354K * Sampel Crosstab Count Ex on-13 Q354K Sampel Kasus Kontrol 5 0 26 31 31 31 Q354K Normal Total Total 5 57 62 Chi-Square Tests Pearson Chi-Square Continuity Correction a Likelihood Ratio Fis her's Exact Test Linear-by-Linear As sociation N of Valid Cases Value 5,439b 3,481 7,371 1 1 1 As ymp. Sig. (2-sided) ,020 ,062 ,007 1 ,021 df 5,351 Exact Sig. (2-sided) Exact Sig. (1-sided) ,053 ,026 62 a. Computed only for a 2x2 table b. 2 cells (50,0%) have expected count less than 5. The minimum expected count is 2,50. Ri sk Estim ate Value For cohort Sampel = Kas us N of V alid Cas es 2,192 62 95% Confidenc e Int erval Lower Upper 1,651 2,911 Exon-13 Q356P * Sampel Crosstab Count Ex on-13 Q356P Sampel Kasus Kontrol 9 0 22 31 31 31 Q356P Normal Total Total 9 53 62 Chi-Square Tests Pearson Chi-Square Continuity Correction a Likelihood Ratio Fis her's Exact Test Linear-by-Linear As soci ation N of Valid Cases 1 1 1 As ymp. Sig. (2-sided) ,001 ,004 ,000 1 ,001 df Value 10,528 b 8,319 14,012 Exact Sig. (2-sided) Exact Sig. (1-sided) ,002 10,358 ,001 62 a. Computed only for a 2x2 table b. 2 cells (50,0%) have expected count less than 5. The mi nimum expected count is 4,50. Ri sk Estim ate 95% Confidenc e Int erval Lower Upper Value For cohort Sampel = Kas us N of V alid Cas es 2,409 1,750 3,316 62 Exon-13 S357S * Sampel Crosstab Count Exon-13 S357S S357S Normal Total Sampel Kasus Kontrol 15 0 16 31 31 31 Total 15 47 62 Chi-Square Tests Pearson Chi-Square Continuity Correction a Likelihood Ratio Fis her's Exact Test Linear-by-Linear As sociation N of Valid Cases Value 19,787 b 17,237 25,666 1 1 1 As ymp. Sig. (2-sided) ,000 ,000 ,000 1 ,000 df 19,468 Exact Sig. (2-sided) Exact Sig. (1-sided) ,000 ,000 62 a. Computed only for a 2x2 table b. 0 cells (,0%) have expected count less than 5. The minimum expected count is 7,50. Ri sk Estim ate Value For cohort Sampel = Kas us N of Valid Cas es 2,938 62 95% Confidenc e Int erval Lower Upper 1,973 4,373 Kadar hormon INSL3 pada kasus dan kontrol T-Test Paired Samples Statistics Mean .3964 .9120 h_insl3_kasus h_insl3_kontrol Pair 1 N Std. Deviation .24379 .45683 31 31 Std. Error Mean .04379 .08205 Paired Samples Test Paired Differences Mean Pair 1 h_insl3_kasus h_insl3_kontrol -.51564 Std. Deviation Std. Error Mean .56908 .10221 95% Confidence Interval of the Difference Lower Upper -.72439 -.30690 t df -5.045 Sig. (2-tailed) 30 .000 Kadar hormon estradiol pada kasus dan kontrol T-Test Paired Samples Statistics Pair 1 h_estradiol_kas us h_estradiol_kontrol Mean 17.0788 9.5456 N 31 31 Std. Deviation 16.05380 4.91833 Std. Error Mean 2.88335 .88336 Paired Samples Test Paired Differences Mean Pair 1 h_estradiol_kas us h_estradiol_kontrol 7.53325 Std. Deviation Std. Error Mean 17.36546 3.11893 95% Confidence Interval of the Difference Lower Upper t 1.16355 2.415 13.90296 df Sig. (2-tailed) 30 .022 Kadar Hormon INSL3 Plasma ROC Curve Case Processing Summary Valid N (lis twis e) 31 31 Sampel Positivea Negative Larger values of the test result variable(s) indicate stronger evidence for a positive actual state. a. The positive actual s tate is Kasus . ROC Curve 1.0 Sensitivity 0.8 0.6 0.4 0.2 0.0 0.0 0.2 0.4 0.6 0.8 1.0 1 - Specificity Diagonal segments are produced by ties. Area Unde r the Curve Test Result Variable(s): Kadar Hormon INSL3 Plasma Area ,138 a Std. Error ,046 Asymptotic b Sig. ,000 Asymptotic 95% Confidence Interval Lower Bound Upper Bound ,048 ,229 The test result variable(s): Kadar Hormon INSL3 Plasma has at least one tie between the positive actual state group and the negative actual state group. Statistics may be biased. a. Under the nonparametric assumption b. Null hypothesis: true area = 0.5 Coordinates of the Curve Test Resul t Variable(s): Kadar Hormon INSL3 Plas ma Positive if Greater Than a or Equal To -,899099600 ,102586550 ,110687100 ,130656050 ,152507250 ,175046350 ,189847300 ,201751050 ,235802250 ,265840250 ,277447150 ,282594950 ,296351350 ,319246050 ,351554000 ,387488580 ,401195530 ,410578400 ,421262300 ,455496150 ,494938800 ,506584050 ,516833350 ,523770400 ,530867700 ,543528350 ,574199000 ,607942150 ,622602850 ,631211750 ,672831450 ,738645150 ,835745750 ,942012200 1,017144050 1,070465450 1,128543450 1,175157000 1,193082400 1,211164500 1,244081050 1,344682650 1,584973150 1,811390550 1,991949150 3,114116000 Sensiti vity 1,000 ,968 ,935 ,903 ,871 ,806 ,774 ,742 ,710 ,677 ,645 ,613 ,581 ,548 ,516 ,484 ,484 ,452 ,419 ,387 ,355 ,355 ,323 ,290 ,258 ,194 ,161 ,129 ,097 ,065 ,065 ,065 ,032 ,032 ,032 ,032 ,032 ,032 ,032 ,032 ,032 ,000 ,000 ,000 ,000 ,000 1 - Specificity 1,000 1,000 1,000 1,000 1,000 1,000 1,000 1,000 1,000 1,000 ,968 ,968 ,968 ,968 ,968 ,968 ,935 ,935 ,903 ,903 ,871 ,839 ,806 ,806 ,774 ,742 ,710 ,677 ,613 ,581 ,548 ,516 ,484 ,452 ,419 ,387 ,323 ,290 ,226 ,194 ,161 ,129 ,097 ,065 ,032 ,000 The tes t res ult variable(s ): Kadar Horm on INSL3 Plasm a has at leas t one tie between the positive actual state group and the negative actual s tate group. a. The sm allest cutoff value is the m inim um observed test value minus 1, and the largest cutoff value is the maximum observed test value plus 1. All the other cutoff values are the averages of two consecutive ordered obs erved test values . Kadar Hormon Estradiol Plasma ROC Curve Case Processing Summary Sampel Positivea Negative Valid N (lis twis e) 31 31 Larger values of the test result variable(s) indicate stronger evidence for a positive actual state. a. The positive actual s tate is Kasus . ROC Curve 1.0 Sensitivity 0.8 0.6 0.4 0.2 0.0 0.0 0.2 0.4 0.6 0.8 1.0 1 - Specificity Diagonal segments are produced by ties. Area Unde r the Curve Test Result Variable(s): Kadar Hormon E stradiol Plas ma Area ,765 a St d. E rror ,061 As ymptotic b Sig. ,000 As ymptotic 95% Confidenc e Int erval Lower Bound Upper Bound ,885 ,645 The tes t result variable(s): K adar Hormon Es tradiol P lasma has at least one tie bet ween the pos itive act ual s tate group and the negat ive actual state group. St atist ics may be biased. a. Under the nonparametric as sumption b. Null hy pothesis : true area = 0.5 Coordinate s of the Curve Te st R esul t Var iable (s): Kad ar Ho rmo n Es trad iol Plasm a Po sitive if Gr eate r Tha n a or Equ al To -,9 9988 750 0 ,00 011 7450 ,00 013 5950 3,5 460 9535 0 7,1 089 3435 0 7,1 769 0595 0 7,2 451 4425 0 7,2 709 0925 0 7,5 364 9735 0 7,8 117 4235 0 7,8 391 6195 0 7,8 574 9475 0 7,8 758 6305 0 8,0 156 3925 0 8,2 615 1370 0 8,4 151 2265 0 8,4 729 7495 0 8,5 121 1910 0 8,5 514 1325 0 8,7 823 8465 0 9,0 127 3820 0 9,1 794 7235 0 9,3 538 1985 0 9,3 962 9795 0 9,5 742 7255 0 9,8 919 9410 0 10 ,104 0865 00 10 ,217 7120 00 10 ,286 2700 00 10 ,484 3620 00 10 ,754 3775 00 10 ,977 8655 00 11 ,197 3585 00 11 ,314 0635 00 11 ,451 8290 00 12 ,118 2730 00 12 ,711 6670 00 12 ,780 4010 00 13 ,003 3655 00 13 ,199 1655 00 13 ,241 6940 00 13 ,471 6085 00 13 ,716 9960 00 13 ,968 6345 00 14 ,404 9035 00 14 ,648 8355 00 14 ,820 3145 00 14 ,992 0990 00 15 ,477 1375 00 16 ,029 7890 00 16 ,541 1690 00 17 ,864 2525 00 19 ,266 0015 00 20 ,240 1385 00 22 ,039 7370 00 23 ,721 0060 00 29 ,524 5395 00 36 ,080 2565 00 66 ,213 1595 00 96 ,244 7480 00 Se nsiti vity 1,0 00 1,0 00 1,0 00 1,0 00 1,0 00 1,0 00 1,0 00 1,0 00 1,0 00 1,0 00 1,0 00 1,0 00 1,0 00 ,96 8 ,90 3 ,87 1 ,87 1 ,87 1 ,83 9 ,83 9 ,83 9 ,83 9 ,83 9 ,83 9 ,83 9 ,80 6 ,80 6 ,80 6 ,77 4 ,74 2 ,74 2 ,71 0 ,67 7 ,64 5 ,64 5 ,61 3 ,58 1 ,54 8 ,48 4 ,45 2 ,41 9 ,38 7 ,35 5 ,35 5 ,32 3 ,32 3 ,29 0 ,25 8 ,25 8 ,25 8 ,22 6 ,19 4 ,19 4 ,16 1 ,12 9 ,12 9 ,09 7 ,06 5 ,03 2 ,00 0 1 - Spe cificity 1,0 00 ,96 8 ,93 5 ,90 3 ,87 1 ,83 9 ,80 6 ,77 4 ,74 2 ,71 0 ,67 7 ,64 5 ,61 3 ,61 3 ,61 3 ,61 3 ,58 1 ,54 8 ,54 8 ,51 6 ,48 4 ,45 2 ,41 9 ,38 7 ,35 5 ,35 5 ,32 3 ,29 0 ,29 0 ,29 0 ,25 8 ,25 8 ,25 8 ,25 8 ,22 6 ,22 6 ,22 6 ,22 6 ,22 6 ,22 6 ,19 4 ,19 4 ,19 4 ,16 1 ,16 1 ,12 9 ,12 9 ,12 9 ,09 7 ,06 5 ,06 5 ,06 5 ,03 2 ,03 2 ,03 2 ,00 0 ,00 0 ,00 0 ,00 0 ,00 0 Th e tes t res ult varia ble(s ): Ka dar Horm on Estr adio l Pla sm a ha s at leas t one tie b etw een the p ositive a ctua l sta te g roup and the nega tive actu al state g rou p. a. Th e sm alle st cu toff value is the m inim um ob served te st va lue minu s 1 , and the larg est cutoff va lue is the ma ximu m ob ser ved test value plu s 1. All the othe r cutoff va lues are the aver ages of two co nsecutive ord ered obs erve d te st va lues . KADAR HORMON INSL3 PLASMA RENDAH < 0,42 ng/ml KURVA ROC, SENSITIVITAS: 41,9% dan SPESIFITAS: 9,75 Crosstabs Case Processing Summary Cases Mis sing N Percent Valid N Kadar hormon INSL3 plasma * Sampel Percent 62 100,0% 0 Total Percent N ,0% 62 Ka dar hormon INSL3 pla sma * S am pel Crossta bula tion Count Kadar hormon INSL3 plas ma Sampel Kasus Kontrol 18 3 13 28 31 31 Rendah Normal Total Total 21 41 62 Chi-Square Tests Pearson Chi-Square Continuity Correction a Likelihood Ratio Fis her's Exact Test Linear-by-Linear As sociation N of Valid Cases Value 16,202 b 14,114 17,505 1 1 1 As ymp. Sig. (2-sided) ,000 ,000 ,000 1 ,000 df 15,941 Exact Sig. (2-sided) Exact Sig. (1-sided) ,000 ,000 62 a. Computed only for a 2x2 table b. 0 cells (,0%) have expected count less than 5. The minimum expected count is 10,50. Risk Estimate Value Odds Ratio for Kadar hormon INSL3 plas ma (Rendah / Normal) For cohort Sampel = Kasus For cohort Sampel = Kontrol N of Valid Cases 95% Confidence Interval Lower Upper 12,923 3,225 51,781 2,703 1,669 4,377 ,209 ,072 ,609 62 100,0% KADAR HORMON ESTRADIOL PLASMA TINGGI >1 0,22 ng/ml KURVA ROC, SENSITIVITAS: 80,6% dan SPESIFITAS: 71% Crosstabs Case Processing Summary Cases Mis sing N Percent Valid N Kadar hormon Estradiol plasma * Sampel Percent 62 100,0% Total N ,0% 0 Percent 62 100,0% Ka dar hormon Estradiol plasma * Sa mpel Crosstabulation Count Kadar hormon Estradiol plasma Sampel Kasus Kontrol 25 9 6 22 31 31 Tinggi Normal Total Total 34 28 62 Chi-Square Tests Pearson Chi-Square Continuity Correction a Likelihood Ratio Fis her's Exact Test Linear-by-Linear As sociation N of Valid Cases 1 1 1 As ymp. Sig. (2-sided) ,000 ,000 ,000 1 ,000 df Value 16,672 b 14,653 17,555 16,403 Exact Sig. (2-sided) Exact Sig. (1-sided) ,000 ,000 62 a. Computed only for a 2x2 table b. 0 cells (,0%) have expected count less than 5. The minimum expected count is 14,00. Risk Estimate Value Odds Ratio for Kadar hormon Es tradiol plasma (Tinggi / Normal) For cohort Sampel = Kasus For cohort Sampel = Kontrol N of Valid Cases 95% Confidence Interval Lower Upper 10,185 3,126 33,188 3,431 1,641 7,173 ,337 ,186 ,609 62 Regresi Hormon INSL3 Rendah, Hormon Estradiol Tinggi, Polimorfisme Exon13 b Va riab les Entere d/Re mo ved Model 1 Variables Entered Polimorfis me ex on 13 gen lgr8, K adar hormon es tradiol plasm a, Kadar hormon Ins l3 a Pl asm a Variables Removed Method . Enter a. Al l reques ted variables ent ered. b. Dependent Variabl e: s ampel Model Summ ary Model 1 R ,740a R Square ,548 Adjust ed R Square ,524 St d. E rror of the Es timate ,348 a. Predic tors: (Constant), Polimorfisme ex on 13 gen lgr8, Kadar hormon estradiol plasma, Kadar hormon Insl3 Plasma ANOVA b Model 1 Regression Residual Total Sum of Squares 8,490 7,010 15,500 df 3 58 61 Mean Square 2,830 ,121 F 23,415 Sig. ,000a a. Predictors: (Constant), Polimorfisme exon 13 gen lgr8, Kadar hormon estradiol plasma, Kadar hormon Insl3 Plasma b. Dependent Variable: sampel Coefficients a Model 1 (Constant) Kadar hormon Insl3 Plasma Kadar hormon estradiol plasma Polimorfisme exon 13 gen lgr8 Unstandardized Coefficients B Std. Error -,346 ,230 a. Dependent Variable: sampel Standardized Coefficients Beta t -1,506 Sig. ,138 ,462 ,094 ,437 4,901 ,000 ,465 ,089 ,463 5,216 ,000 ,260 ,089 ,259 2,918 ,005 DATA ANALISIS POLIMORFISME SECARA BERPASANGAN 1. Polimorfisme A9A exon 1 gen insl3 Paired observations, dichotomous variable [module A] (A9A) DATA: A yes, B yes: 1 pairs A yes, B no: 5 pairs A no, B yes: 1 pairs A no, B no: 0 pairs RESULTS: If inverse sampling was used, see results at end of output. TESTS AND MEASURES OF DIFFERENCE: Exact tests: one-tailed P two-tailed P Fisher's P: 0.109 0.219 Mid-P: 0.063 0.125 McNemar test: 0.051 0.102 with cont.corr. 0.110 0.221 Wald test, modif 0.033 0.065 Odds ratio (odds A : odds B) = 5.000 Fisher's confidence intervals: 90% confidence interval = 0.719 to 116.475 95% confidence interval = 0.559 to 236.488 99% confidence interval = 0.340 to 1196.498 2. Polimorfisme T60T exon 1 gen insl3 Paired observations, dichotomous variable [module A] (T60T) DATA: A yes, B yes: 5 pairs A yes, B no: 11 pairs A no, B yes: 0 pairs A no, B no: 0 pairs RESULTS: If inverse sampling was used, see results at end of output. TESTS AND MEASURES OF DIFFERENCE: Exact tests: one-tailed P two-tailed P Fisher's P: 0.000 [ 4.9E-0004 ] 0.001 [ 9.8E-0004 ] Mid-P: 0.000 [ 2.4E-0004 ] 0.000 [ 4.9E-0004 ] McNemar test: 0.000 [ 4.6E-0004 ] 0.001 [ 9.1E-0004 ] with cont.corr. 0.001 [ 1.2E-0003 ] 0.003 [ 2.6E-0003 ] Wald test, modif 0.000 [ 8.9E-0008 ] 0.000 [ 1.8E-0007 ] Odds ratio (odds A : odds B) = infinity Fisher's confidence intervals: 90% confidence interval = 3.195 to infinity 95% confidence interval = 2.510 to infinity 99% confidence interval = 1.616 to infinity 3. Polimorfisme T60A exon 1 gen insl3 Paired observations, dichotomous variable [module A] (T60A) DATA: A yes, B yes: 5 pairs A yes, B no: 3 pairs A no, B yes: 10 pairs A no, B no: 0 pairs RESULTS: If inverse sampling was used, see results at end of output. TESTS AND MEASURES OF DIFFERENCE: Exact tests: one-tailed P Fisher's P: Mid-P: 0.046 two-tailed P 0.092 0.029 0.057 McNemar test: 0.026 0.052 with cont.corr. 0.048 0.096 Wald test, modif 0.019 0.037 Odds ratio (odds A : odds B) = 0.300 Fisher's confidence intervals: 90% confidence interval = 0.071 to 0.979 95% confidence interval = 0.053 to 1.165 99% confidence interval = 0.029 to 1.636 4. Polimorfisme N315N exon 12 gen lgr8 Paired observations, dichotomous variable [module A] (N315N) DATA: A yes, B yes: 2 pairs A yes, B no: 2 pairs A no, B yes: 0 pairs A no, B no: 0 pairs RESULTS: If inverse sampling was used, see results at end of output. TESTS AND MEASURES OF DIFFERENCE: Exact tests: one-tailed P Fisher's P: 0.250 0.500 Mid-P: 0.125 0.250 McNemar test: 0.079 0.157 with cont.corr. 0.240 0.480 Wald test, modif 0.079 two-tailed P 0.157 Odds ratio (odds A : odds B) = infinity Fisher's confidence intervals: 90% confidence interval = 0.288 to infinity 95% confidence interval = 0.188 to infinity 99% confidence interval = 0.076 to infinity 5. Polimorfisme E319E exon 12 Gen lgr8 Paired observations, dichotomous variable [module A] (E319E) DATA: A yes, B yes: 23 pairs A yes, B no: 8 pairs A no, B yes: 0 pairs A no, B no: 0 pairs RESULTS: If inverse sampling was used, see results at end of output. TESTS AND MEASURES OF DIFFERENCE: Exact tests: one-tailed P two-tailed P Fisher's P: 0.004 [ 3.9E-0003 ] 0.008 [ 7.8E-0003 ] Mid-P: 0.002 [ 2.0E-0003 ] 0.004 [ 3.9E-0003 ] McNemar test: 0.002 [ 2.3E-0003 ] 0.005 [ 4.7E-0003 ] with cont.corr. 0.007 [ 6.7E-0003 ] 0.013 Wald test, modif 0.001 [ 1.1E-0003 ] 0.002 [ 2.4E-0003 ] Odds ratio (odds A : odds B) = infinity Fisher's confidence intervals: 90% confidence interval = 2.202 to infinity 95% confidence interval = 1.707 to infinity 99% confidence interval = 1.065 to infinity 6. Polimorfisme L331L exon 12 gen lgr8 Paired observations, dichotomous variable [module A] (L331L) DATA: A yes, B yes: 5 pairs A yes, B no: 10 pairs A no, B yes: 1 pairs A no, B no: 0 pairs RESULTS: If inverse sampling was used, see results at end of output. TESTS AND MEASURES OF DIFFERENCE: Exact tests: one-tailed P two-tailed P Fisher's P: 0.006 [ 5.9E-0003 ] 0.012 Mid-P: 0.003 [ 3.2E-0003 ] 0.006 [ 6.3E-0003 ] 0.003 [ 3.3E-0003 ] 0.007 [ 6.7E-0003 ] McNemar test: with cont.corr. 0.008 [ 7.9E-0003 ] 0.016 Wald test, modif 0.000 [ 3.2E-0004 ] 0.001 [ 6.3E-0004 ] Odds ratio (odds A : odds B) = 10.000 Fisher's confidence intervals: 90% confidence interval = 1.745 to 213.953 95% confidence interval = 1.423 to 433.977 99% confidence interval = 0.966 to 2193.995 7. Polimorfisme S337A exon 13 gen lgr8 Paired observations, dichotomous variable [module A] DATA: A yes, B yes: 17 pairs A yes, B no: 17 pairs A no, B yes: 0 pairs A no, B no: 0 pairs RESULTS: If inverse sampling was used, see results at end of output. TESTS AND MEASURES OF DIFFERENCE: Exact tests: one-tailed P two-tailed P Fisher's P: 0.000 [ 7.6E-0006 ] 0.000 [ 1.5E-0005 ] Mid-P: 0.000 [ 3.8E-0006 ] 0.000 [ 7.6E-0006 ] McNemar test: 0.000 [ 1.9E-0005 ] 0.000 [ 3.7E-0005 ] with cont.corr. 0.000 [ 5.2E-0005 ] 0.000 [ 1.0E-0004 ] Wald test, modif 0.000 [ 1.7E-0008 ] 0.000 [ 3.5E-0008 ] Odds ratio (odds A : odds B) = infinity Fisher's confidence intervals: 90% confidence interval = 5.189 to infinity 95% confidence interval = 4.127 to infinity 99% confidence interval = 2.734 to infinity 8. Polimorfisme P340P exon 13 gen lgr8 Paired observations, dichotomous variable [module A] (P340P) DATA: A yes, B yes: 4 pairs A yes, B no: 9 pairs A no, B yes: 4 pairs A no, B no: 0 pairs RESULTS: If inverse sampling was used, see results at end of output. TESTS AND MEASURES OF DIFFERENCE: Exact tests: one-tailed P two-tailed P Fisher's P: 0.133 0.267 Mid-P: 0.090 0.180 McNemar test: 0.083 0.166 with cont.corr. 0.134 0.267 Wald test, modif 0.079 0.158 Odds ratio (odds A : odds B) = 2.250 Fisher's confidence intervals: 90% confidence interval = 0.746 to 7.876 95% confidence interval = 0.628 to 9.999 99% confidence interval = 0.447 to 16.521 9. Polimorfisme H345P exon 13 gen lgr8 Paired observations, dichotomous variable [module A] (H345P) DATA: A yes, B yes: 5 pairs A yes, B no: 14 pairs A no, B yes: 4 pairs A no, B no: 0 pairs RESULTS: If inverse sampling was used, see results at end of output. TESTS AND MEASURES OF DIFFERENCE: Exact tests: one-tailed P two-tailed P Fisher's P: 0.015 0.031 Mid-P: 0.010 [ 9.6E-0003 ] 0.019 McNemar test: 0.009 [ 9.2E-0003 ] 0.018 with cont.corr. 0.017 0.034 Wald test, modif 0.004 [ 4.5E-0003 ] 0.009 [ 9.0E-0003 ] Odds ratio (odds A : odds B) = 3.500 Fisher's confidence intervals: 90% confidence interval = 1.279 to 11.548 95% confidence interval = 1.099 to 14.603 99% confidence interval = 0.821 to 23.985 10. Polimorfisme K346K exon 13 gen lgr8 Paired observations, dichotomous variable [module A] (K346K) DATA: A yes, B yes: 19 pairs A yes, B no: 9 pairs A no, B yes: 2 pairs A no, B no: 0 pairs RESULTS: If inverse sampling was used, see results at end of output. TESTS AND MEASURES OF DIFFERENCE: Exact tests: one-tailed P two-tailed P Fisher's P: 0.033 0.065 Mid-P: 0.019 0.039 McNemar test: 0.017 0.035 with cont.corr. 0.035 0.070 Wald test, modif 0.015 0.030 Odds ratio (odds A : odds B) = 4.500 Fisher's confidence intervals: 90% confidence interval = 1.127 to 29.013 95% confidence interval = 0.931 to 42.800 99% confidence interval = 0.643 to 100.836 11. Polimorfisme Q354K exon 13 gen lgr8 Paired observations, dichotomous variable [module A] (Q354K) DATA: A yes, B yes: 5 pairs A yes, B no: 5 pairs A no, B yes: 0 pairs A no, B no: 0 pairs RESULTS: If inverse sampling was used, see results at end of output. TESTS AND MEASURES OF DIFFERENCE: Exact tests: one-tailed P two-tailed P Fisher's P: 0.031 0.063 Mid-P: 0.016 0.031 McNemar test: 0.013 0.025 with cont.corr. 0.037 0.074 Wald test, modif 0.004 [ 3.8E-0003 ] 0.008 [ 7.5E-0003 ] Odds ratio (odds A : odds B) = infinity Fisher's confidence intervals: 90% confidence interval = 1.219 to infinity 95% confidence interval = 0.916 to infinity 99% confidence interval = 0.530 to infinity 12. Polimorfisme Q356P exon 13 gen lgr8 Paired observations, dichotomous variable [module A] (Q356P) DATA: A yes, B yes: 9 pairs A yes, B no: 9 pairs A no, B yes: 0 pairs A no, B no: 0 pairs RESULTS: If inverse sampling was used, see results at end of output. TESTS AND MEASURES OF DIFFERENCE: Exact tests: one-tailed P two-tailed P Fisher's P: 0.002 [ 2.0E-0003 ] 0.004 [ 3.9E-0003 ] Mid-P: 0.001 [ 9.8E-0004 ] 0.002 [ 2.0E-0003 ] McNemar test: 0.001 [ 1.3E-0003 ] 0.003 [ 2.7E-0003 ] with cont.corr. 0.004 [ 3.8E-0003 ] 0.008 [ 7.7E-0003 ] Wald test, modif 0.000 [ 6.2E-0005 ] 0.000 [ 1.2E-0004 ] Odds ratio (odds A : odds B) = infinity Fisher's confidence intervals: 90% confidence interval = 2.532 to infinity 95% confidence interval = 1.974 to infinity 99% confidence interval = 1.247 to infinity 13. Polimorfisme S357S exon 13 gen lgr8 Paired observations, dichotomous variable [module A] (S357S DATA: A yes, B yes: 15 pairs A yes, B no: 15 pairs A no, B yes: 0 pairs A no, B no: 0 pairs RESULTS: If inverse sampling was used, see results at end of output. TESTS AND MEASURES OF DIFFERENCE: Exact tests: one-tailed P Fisher's P: 0.000 [ 3.1E-0005 ] 0.000 [ 6.1E-0005 ] Mid-P: 0.000 [ 1.5E-0005 ] 0.000 [ 3.1E-0005 ] McNemar test: 0.000 [ 5.4E-0005 ] 0.000 [ 1.0E-0004 ] with cont.corr. 0.000 [ 1.5E-0004 ] 0.000 [ 3.0E-0004 ] Wald test, modif 0.000 [ 1.3E-0007 ] 0.000 [ 2.7E-0007 ] Odds ratio (odds A : odds B) = infinity Fisher's confidence intervals: 90% confidence interval = 4.524 to infinity 95% confidence interval = 3.587 to infinity 99% confidence interval = 2.360 to infinity two-tailed P PANJANG BADAN LAHIR Group Statistics Panjang Badan Lahir (cm) Sampel Kasus Kontrol N Mean 49,52 50,13 31 31 Std. Error Mean ,396 ,231 Std. Deviation 2,204 1,284 Independent Samples Test Levene's Test for Equality of Variances F Panjang Badan Lahir (cm) Equal variances as sumed Equal variances not ass umed t-test for Equality of Means Sig. 5,148 t ,027 df Sig. (2-tailed) Mean Difference Std. Error Difference 95% Confidence Interval of the Difference Lower Upper -1,338 60 ,186 -,613 ,458 -1,529 ,304 -1,338 48,266 ,187 -,613 ,458 -1,534 ,308 BERAT BADAN LAHIR Group Statistics Berat Badan Lahir (gram) Mean 3142,90 3206,45 N Sampel Kasus Kontrol 31 31 Std. Deviation 619,904 331,598 Std. Error Mean 111,338 59,557 Independent Samples Test Levene's Test for Equality of Variances F Berat Badan Lahir (gram) Equal variances assumed Equal variances not assumed 9,498 Sig. ,003 t-test for Equality of Means t df Sig. (2-tailed) Mean Difference Std. Error Difference 95% Confidence Interval of the Difference Lower Upper -,503 60 ,617 -63,548 126,266 -316,119 189,022 -,503 45,869 ,617 -63,548 126,266 -317,729 190,632 PANJANG PENIS Group Statistics Panjang Penis (cm) 31 31 Std. Error Mean ,09993 ,13590 Std. Deviation ,55641 ,75668 Mean 4,2323 4,6452 N Sampel kasus Kontrol Independent Samples Test Levene's Test for Equality of Variances F Panjang Penis (cm) Equal variances as sumed Equal variances not ass umed t-test for Equality of Means Sig. ,005 t ,945 df Sig. (2-tailed) Mean Difference Std. Error Difference 95% Confidence Interval of the Difference Lower Upper -2,448 60 ,017 -,41290 ,16869 -,75033 -,07547 -2,448 55,103 ,018 -,41290 ,16869 -,75095 -,07485 VOLUME TESTIS Group Sta tisti cs N Sampel Volume Testis Kanan Kasus (ml) Kontrol Volume Testis Kiri (ml) Kasus Kontrol Mean 2,075 2,348 1,796 2,365 24 31 23 31 St d. Deviat ion ,6726 ,6131 ,4922 ,6102 St d. E rror Mean ,1373 ,1101 ,1026 ,1096 Independent Samples Test Levene's Test for Equality of Variances F Volume Tes tis Kanan (ml) Volume Tes tis Kiri (ml) Equal variances as sumed Equal variances not ass umed Equal variances as sumed Equal variances not ass umed 1,079 ,028 Sig. ,304 ,868 t-test for Equality of Means t df Sig. (2-tailed) Mean Difference Std. Error Difference 95% Confidence Interval of the Difference Lower Upper -1,572 53 ,122 -,2734 ,1739 -,6222 ,0754 -1,553 47,151 ,127 -,2734 ,1760 -,6274 ,0806 -3,670 52 ,001 -,5689 ,1550 -,8799 -,2578 -3,789 51,589 ,000 -,5689 ,1501 -,8702 -,2675 USIA Group Statistics Us ia ( tahun ) Sampel Kasus Kontrol N 31 31 Mean 3,67077 3,59168 Std. Deviati on 3,024875 2,888453 Std. Error Mean ,543284 ,518781 Independent Samples Test Levene's Test for Equality of Variances F Us ia ( tahun ) Equal variances as sumed Equal variances not ass umed Sig. ,029 ,864 t-test for Equality of Means t df Sig. (2-tailed) Mean Difference Std. Error Difference 95% Confidence Interval of the Difference Lower Upper ,105 60 ,916 ,079097 ,751193 -1,423513 1,581707 ,105 59,873 ,916 ,079097 ,751193 -1,423579 1,581773 KRIPTORKISMUS Case Processing Summary Valid N Lokasi Kriptorkismus * Jenis Kriptorkismus Percent 31 96,9% Cases Missing N Percent 1 Total N 3,1% Percent 32 Lokasi Kri ptorkism us * Je nis Kriptorkism us Crosstabulation Count Lokasi Kriptorkismus Total Int rabadominal Inguinal Preskrotal Jenis K ript orkis mus Bilateral Kanan Kiri 3 4 6 1 4 8 1 2 2 5 10 16 Total 13 13 5 31 100,0% Chi-Square Te sts Pearson Chi-S quare Lik elihood Ratio Linear-by-Linear As soc iation N of V alid Cases Value 1,574a 1,656 ,077 4 4 As ymp. Sig. (2-sided) ,813 ,799 1 ,781 df 31 a. 7 c ells (77,8%) have ex pec ted c ount les s than 5. The minimum expected count is ,81. DATA KARAKTERISTIK SUBYEK PENELITIAN NO UMUR DX vol Ka vol Ki P penis BBL UK PBL 1a 1b 1 th, 5 bln 1 th, 7 bln K Inguinal ki Sehat 2 2 2 2 3.6 3550 Aterm 4.5 3100 Aterm 52 51 2a 2b 1 th, 8 bln 1 th, 8 bln K Inguinal ki Sehat 1.5 1.5 1.5 1.5 4.2 2200 Aterm 4.2 2600 Aterm 48 49 3a 3b 1 th, 9 bln 1 th, 11 bln K Intraabdominal ki Sehat 2 2 2 3.5 2900 Aterm 3.7 3900 Aterm 49 53 4a 4b 1 th, 2 bln 10 bln K Preskrotal ki Sehat 1.5 2 1.5 2 4 2450 Aterm 4 3100 Aterm 45 50 5a 5b 7 th, 2 bln, 23 hr 6 th, 8 bln K Inguinal Bilateral Sehat 2 2.5 1 2.5 4.5 3700 Aterm 4.5 3200 Aterm 51 52 6a 6b 1 th, 5 bln, 16 hr 1 th, 5 bln, 3 hr K Inguinal ki Sehat 2.5 2 2 2 4 3300 Aterm 4.3 2850 Aterm 52 49 7a 7b 1 th, 7 hr 1 th, 2 bln, 21 hr K Inguinal ka Sehat 1.5 2.5 1.5 2.5 4 3030 Aterm 4.7 2900 Aterm 49 51 8a 8b 3 th, 1 bln, 3 hr 3 th, 1 bln, 10 hr K Inguinal ki Sehat 2.5 3 1 3 5 3800 Aterm 4.8 3500 Aterm 52 51 9a 9b 1 th, 3 bln, 14 hr 1 th, 4 bln, 25 hr K Preskrotal ka Sehat 1.5 2.5 2 2.5 3.8 3400 Aterm 4.2 3550 Aterm 51 52 2 2 3.9 3350 Aterm 53 2.5 2.5 5 3350 Aterm 49 2 2 4.9 3900 Aterm 4.4 2950 Aterm 50 48 2 4.2 3500 Aterm 4.5 3200 Aterm 50 50 4 4090 Aterm 50 10a 10b hr 9 bln, 2 hr 10 bln, 1 K Inguinal ki Sehat 11a 1 th, 13 hr 11b 1 th, 1 bln, 23 hr K Inguinal ka Sehat 2 2 12a 4 th, 3 bln, 13 hr 12b 4 th, 3 bln, 27 hr K Intraabdominal ki Sehat 3 2 13a K Intraabdominal 11 bln Bilateral 13b hr 7 bln, 25 14a 1 th, 10 bln, 7 hr 14b 1 th, 6 bln, 8 hr 15a hr 15b 11 bln, 10 8 bln Sehat 2 2 3.7 3400 Aterm 52 K Inguinal ki Sehat 1 2 1 2 3.7 2800 Aterm 4.2 3200 Aterm 50 50 K Intraabdominal ki Sehat 2 3 3 3.7 3150 Aterm 4 3900 Aterm 49 51 2 2 3.5 1950 Aterm 5 2700 Aterm 47 49 16a 1 th, 3 bln, 2 hr 16b 1 th, 7 bln, 10 hr K Intraabdominal Bilateral Sehat 17a 17b K Preskrotal ki Sehat 3 1.8 2 1.8 3.7 3870 Aterm 4 3200 Aterm 52 51 18a 4 th, 1 bln, 15 hr 18b 4 th, 3 bln, 26 hr K Bilateral Sehat 2.5 2 2.5 5.3 3200 Aterm 5 2800 Aterm 50 51 19a 5 th, 9 bln, 19 hr 19b 5 th, 9 bln, 19 hr K Intraabdominal ka Sehat 2 2 2.5 5 1900 Aterm 5 2900 Aterm 43 50 20a 4 th, 10 bln, 3 hr 20b 4 th, 9 bln, 13 hr K Inguinal ki Sehat 3 2.5 1.8 2.5 4 3550 Aterm 5 3200 Aterm 51 50 21a 8 th, 9 bln, 13 hr 21b 8 th, 9 bln, 9 hr K Preskrotal ka Sehat 2.5 2.5 2 2.5 5 3250 Aterm 5 3200 Aterm 50 48 22a 5 th, 1 bln, 2 hr 22b 5 th, 7 bln K Intraabdominal ka Sehat 2.5 2 2.5 4 2900 Aterm 4.2 3500 Aterm 48 48 23a 12 th, 5 bln, 2 hr 23b 11 th, 7 bln K Preskrotal Bilateral Sehat 3 5 2.5 5 5 3000 Aterm 8 3200 Aterm 50 50 4 th, 11 bln, 14 24a hr 24b 4 th, 6 bln, 29 hr K Inguinal ka Sehat 2 2 2 2 5 3050 Aterm 4.5 3500 Aterm 48 50 25a 7 th, 7 bln, 22 hr 25b 7 th, 6 bln, 6 hr K Inguinal ki Sehat 1.8 2.5 1 2.5 5 3800 Aterm 5 3100 Aterm 52 50 6 bln, 6 hr 9 bln, 27 hr 26a 6 th, 8 bln, 30 hr 5 th, 10 bln, 21 26b hr K Inguinal ka 2.5 3 4.2 4100 Aterm 50 Sehat 2 2 5 3000 Aterm 51 27a 3 th, 1 bln, 6 hr 27b 2 th, 5 bln, 18 hr K Intraabdominal ki Sehat 0.5 2 2 3.4 1900 Aterm 4.6 3300 Aterm 46 48 8 th, 11 bln, 26 28a hr 28b 8 th, 8 bln, 28 hr K Intraabdominal ki Sehat 3 3 3 4.5 3300 Aterm 5 2800 Aterm 51 50 29a 5 th, 5 bln, 11 hr 29b 5 th, 8 bln, 11 hr K Intraabdominal ka Sehat 2.5 2 2.5 4.7 2500 Aterm 5 3800 Aterm 48 51 30a 2 th, 6 bln, 8 hr 30b 2 th, 5 bln K Intraabdominal ki Sehat 1.5 2.5 2.5 4 2700 Aterm 5 3000 Aterm 49 50 31a 1 th, 7 bln, 28 hr 31b 1 th, 9 bln, 3 hr K Intraabdominal ka Sehat 2 1.5 2 3.9 3340 Aterm 4 3500 Aterm 49 49 DATA POLIMORFISME EXON 1, 2 GEN insl3, EXON 8, 12, 13 GEN lgr8 NO Exon 1 gen Insl3 Exon 2 gen Insl3 Exon8 gen Lgr8 Exon 12 gen Lgr8 1a normal normal normal gaa-->gag*(E319E) 1b acc->gcc*(T60A) normal normal gaa-->gag*(E319E) normal gaa->gan*(E319E) 2a 2b 3a gcg-->gca (A9A) acc->gcc*(T60A) normal gcg-->gca (A9A) acc->gcc*(T60A) normal gcg-->gcn (A9A) acc->ncc*(T60T) cta-->ctn (L 331L) normal normal cta-->ctn (L 331L) normal gaa-->gag*(E319E) 3b normal normal normal gaa->gan*(E319E) 4a acc-- normal normal gaa-->gag*(E319E) Exon 13 gen Lgr8 ctt-->ctn (L 344 L) aag->aaa*(K346K) cag-->can(Q 348 Q) cct-->ccc (P 340 P) cac-->ccc (H 345 P) aag->aaa*(K346K) tca-->gca (S 337 A) cac-->ccc (H 345 P) aag->aaa*(K346K) tct-->tcc (S 357 S) cac-->ccc (H 345 P) aag->aaa*(K346K) tca-->gca (S 337 A) cct-->ccc (P 340 P) cac-->ccc (H 345 P) aag->aaa*(K346K) tct-->tcc (S 357 S) cac-->ccc (H 345 P) aag->aaa*(K346K) tca-->gca (S 337 >ncc*(T60T) 4b acc->gcc*(T60A) normal normal gaa-->gag*(E319E) 5a acc->ncc*(T60T) normal normal gaa-->gag*(E319E) 5b normal normal normal gaa-->gag*(E319E) cta-->ctg (L331L) 6a acc->ncc*(T60T) normal normal gaa-->gag*(E319E) cta-->ctg (L331L) 6b normal normal normal normal 7a gcg-->gcn (A9A) acc->gcc*(T60A) normal normal gaa-->gag*(E319E) 7b acc->gcc*(T60A) cta-->ctg (L331L) normal normal gaa-->gag*(E319E) A) cct-->ccc (P 340 P) cac-->ccc (H 345 P) aag->aaa*(K346K) cag-->ccg (Q 356 P) tct-->tcc (S 357 S ) cct-->ccc (P 340 P) aag->aaa*(K346K) tca-->gca (S 337 A) cac-->ccc (H 345 P) aag->aaa*(K346K) normal tca-->gca (S 337 A) cac-->ccc (H 345 P) aag->aaa*(K346K) tct-->tcc (S 357 S) cct-->ccc (P 340 P) aag->aaa*(K346K) cct-->ccc (P 340 P) aag->aaa*(K346K) caa-->aaa (Q 354K) aag->aaa*(K346K) 8a gcg-->gcn (A9A ) acc->gcc*(T60A) normal normal gaa-->gag*(E319E) 8b normal normal normal gaa-->gag*(E319E) 9a gcg-->gcn (A9A ) acc->ncc*(T60T) normal normal gaa-->gag*(E319E) 9b normal normal normal gaa-->gag*(E319E) 10a acc->gcc*(T60A) normal normal aat-->ant (N315N) 11a acc->gcc*(T60A) normal normal normal normal tca-->gca (S 337 A) cct-->ccc (P 340 P) cac-->ccc (H 345 P) aag->aaa*(K346K) tct-->tcc (S 357 S) cac-->ccc (H 345 P) aag->aaa*(K346K) gaa->gan*(E319E) tca-->gca (S 337 A) cct-->ccc (P 340 P) cac-->ccc (H 345 P) aag->aaa*(K346K) cag-->ccg(Q 356 P) tct-->tcc (S 357 S) aag->aaa*(K346K) gaa-->gag*(E319E) tct-->tnt (S 357 C) gaa-->gag*(E319E) 10b normal tca-->gca (S 337 A) cct-->ccc (P 340 P) cac-->ccc (H 345 P) aag->aaa*(K346K) tct-->tcc (S 357 S) cac-->ccc (H 345 P) aag->aaa*(K346K) 11b normal acc->gcc*(T60A) acc-12b >gcc*(T60A) 12a 13a acc->ncc*(T60T) normal normal cta-->ctg (L331L) normal normal normal gaa-->gag*(E319E) normal normal gaa-->gag*(E319E) cga-->cna(R73R) aga-->ana aat-->ant (N315N) (n 223 g-->t ) gaa-->gag*(E319E) aga=kdn stp ata=Met acc-13b >gcc*(T60A) 14a atg-->ntg (M1M) normal normal gaa-->gag*(E319E) gcc->gac(A166D) normal gaa-->gag*(E319E) cta-->ctg (L331L) acc-14b >gcc*(T60A) acc->ncc*(T60T) acc-15b >gcc*(T60A) 15a 16a acc->ncc*(T60T) normal normal cac-->ccc (H 345 P) aag->aaa*(K346K) tca-->gca (S 337 A) cac-->ccc (H 345 P) aag->aaa*(K346K) cag-->ccg (Q 356 P) tct-->tcc (S 357 S) aag->aaa*(K346K) cct-->ccc (P 340 P) cac-->ccc (H 345 P) aag->aaa*(K346K) caa-->aaa(Q 354 K) normal normal normal normal normal normal gaa--gag*(E319E) aag->aaa*(K346K) normal normal gaa--gag*(E319E) normal normal gaa-->gag*(E319E) tgc->tgg(C115W) tgc->tngc(C116C) cta-->ctg (L331L) tca-->ncc (S 337 A) cct-->ccn (P 340 P) cac-->ccc (H 345 P) aag-- >aan*(K346K) cag-->cng(Q 356 P) acc-16b >gcc*(T60A) normal normal normal acc->gcc*(T60A) normal normal gaa-->gag*(E319E) 17b gcg-->gca (A9A) acc->gcc*(T60A) normal normal gaa-->gag*(E319E) 18a normal normal normal gaa-->gag*(E319E) acc-18b >gcc*(T60A) normal normal gaa-->gag*(E319E) 17a 19a cta-->ctn (L42L) acc->ncc*(T60T) acc-19b >ncc*(T60A) normal normal gaa-->gag*(E319E) cta-->ctn (L331L) normal normal gaa-->gag*(E319E) cta-->ctn (L331L) 20a gcg-->gcn (A9A) acc->ncc*(T60T) normal normal gaa->gan*(E319E) cta-->ctn (L331L) normal aag->aaa*(K346K) cct-->ccc (P 340 P) aag->aaa*(K346K) tca-->gcc (S 337 A) cct-->ccn (P 340 P) cac-->ccc (H 345 P) aag->aaa*(K346K) cag-->ccg (Q 356 P) tct-->tcc (S 357 S) cct-->ccc (P 340 P) aag->aaa*(K346K) cct-->ccc (P 340 P) aag->aaa*(K346K) caa-->aaa(Q 354 K) cct-->ccc (P 340 P) aag->aaa*(K346K) tca-->gca (S 337 A) cac-->ccc (H 345 P) acc-20b >ncc*(T60T) 21a acc->ncc*(T60T) normal normal normal normal gaa-->gag*(E319E) gaa-->gag*(E319E) cta-->ctn (L331L) acc-21b >ncc*(T60T) 22a acc->ncc*(T60T) normal normal gaa-->gag*(E319E) cta-->ctg (L331L) normal normal gaa-->gag*(E319E) normal normal gaa-->gag*(E319E) acc->ncc*(T60T) normal normal acc-23b >ncc*(T60T) gaa-->gag*(E319E) cta-->ctg (L331L) normal normal gaa-->gag*(E319E) 22b normal 23a cta-->ctn (L331L) 24a acc->gcc*(T60A) normal normal gaa->gan*(E319E) cta-->ctn (L331L) aag->aaa*(K346K) cag-->ccg (Q 356 P) tct-->tcn (S 357 S) cac-->ccc (H 345 P) aag->aaa*(K346K) tca-->gca (S 337 A) cac-->ccc (H 345 P) aag->aaa*(K346K) tct-->tcc (S 357 S) normal tca-->gca (S 337 A) cac-->ccc (H 345 P) aag->aaa*(K346K) cag-->ccg(Q 356 P) tct-->tcc (S 357 S) aag->aan*(K346K) aag->aan*(K346K) cct-->ccc (P 340 P) aag->aaa*(K346K) tca-->gca (S 337 A) cac-->ccc (H 345 P) acc-24b >gcc*(T60A) 25a acc->ncc*(T60T) aag-->aaa (K346K) cag-->ccg(Q 356 P) tct-->tcc (S 357 S) normal normal normal normal normal normal gaa->gan*(E319E) tca-->gca (S 337 A) cac-->ccc (H 345 P) aag->aaa*(K346K) cag-->ccg (Q 356 P) tct-->tcc (S 357 S) cta-->ctn (L331L) acc-25b >ncc*(T60T) normal 26a gag->nag(E146E) normal normal normal gaa-->gag*(E319) gaa-->gag*(E319E) cta-->ctn (L331L) acc-26b >ncc*(T60A) normal normal normal normal normal normal normal acc-27b >gcc*(T60A) normal normal gaa-->gag*(E319E) acc->ncc*(T60T) normal normal gaa-->gag*(E319E) cta-->ctg (L331L) 28a cct-->ccc (P 340 P) aag->aaa*(K346K) caa-->aaa (Q354K) normal gaa->gan*(E319E) 27a normal cac-->ccc (H 345 P) aag->aaa*(K346K) aag->aan*(K346K) acc-28b >ncc*(T60T) normal normal gaa-->gag*(E319E) aag->aan*(K346K) 29a gag-- normal gaa-->gag*(E319) tca-->gca (S 337 cta-->cnn (L 42P) gtg->nnG(V43M) 29b normal 30a acc->ncc*(T60T) 30b normal 31a normal 31b normal >nag(E146E) cag->can(Q157Q) normal normal normal normal normal gaa-->gag*(E319E) normal normal gaa-->gag*(E319E) normal gaa-->gag*(E319E) aga>ana(st140st) ggc->ngc(G144G) gag->nag(E146E) normal cta-->ctn (L331L) normal gaa-->gag*(E319E) cta-->ctn (L331L) A) cct-->ccn (P 340 P) cac-->ccc (H 345 P) aag->aaa*(K346K) tct-->tcc (S 357 S) normal aag->aan*(K346K) cac-->ccc (H 345 P) aag->aaa*(k346K) cct-->ccc (P 340 P) cac-->ccc (H 345 P) aag->aaa*(K346K) caa-->aaa(Q 354 K) cct-->ccc (P 340 P) aag->aaa*(K346K) KADAR HORMON INSL3 PLASMA, HORMON ESTRADIOL PLASMA PADA SAMPEL NO Sampel 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 H. INSL3 KASUS (ng/ml) 0.1904058 0.5362109 0.4012646 0.3292573 0.281722 0.5975522 0.1442106 0.1608039 0.1042727 0.4198922 0.3738507 0.2731723 0.4226324 0.5220163 0.6268736 1.2724178 0.1608039 0.5116504 0.1892888 0.5508458 0.6183321 0.5362109 0.7671773 0.2834679 0.1009004 0.1171015 0.2130963 0.2585082 0.3092348 0.5255245 0.4883599 H.INSL3 KONTROL (ng/ml) 1.4169475 0.9043142 0.40112646 0.6355499 1.086353 0.5975522 2.114116 1.086353 0.6183321 0.4198922 0.5015177 0.2731723 1.7529988 1.0545779 0.6268736 1.2724178 0.710113 0.5116504 1.1707339 0.5508458 0.6183321 0.5362109 0.7671773 1.1795801 1.2065847 1.1795801 1.8697823 0.9797102 1.2157443 0.5255245 0.4883599 H.ESTRADIOL KASUS (ng/ml) 34.978942 11.11795 13.213316 8.5317286 8.1462224 12.821716 16.96918 8.376805 14.176422 9.7364492 8.1462224 13.270072 10.837781 11.276767 16.113158 24.070137 12.739086 14.664286 10.29775 11.552298 10.27479 13.673145 14.976343 20.707599 7.8850561 12.684248 37.181571 95.244748 12.821716 13.185015 19.772678 H.ESTRADIOL KONTROL (ng/ml) 0.0001224 7.7934803 7.2623041 10.047539 10.670974 18.759325 9.4120959 13.760847 9.3271397 7.0920412 14.633385 11.35136 8.9936714 8.4534403 10.160634 15.007855 0.0001125 9.031805 7.8483195 8.4925096 7.1258275 15.94642 23.371875 7.8300044 0.0001495 7.2795144 8.5710979 7.2279844 9.3805 7.86667 13.213316 TIME TABLE PENELITIAN Jenis kegiatan Th 2009 Seminar praproposal 26 Nopember Ujian Kwalifikasi Kuliah MKPD Mengurus ethical clearance Seminar kelayakan proposal Ujian proposal Pelaksanaan penelitian Seminar kelayakan naskah Disertasi Th 2010 Th Th Th Th Th Th 2010 2010 2010 2010 2010 2010 Th 2011 Th 2011 12 Maret 6 April - 18 juni 25 Mei -9 Juni 7 Juli 2 Sep Sep Des Maret 18 Mei Ujian tertutup 16 Juni Ujian terbuka 4 Agus KUISIONER PENELITIAN Identitas sampel: Nama sampel : Tanggal lahir : Umur : No CM : Cara persalinan : Berat badan lahir : Umur kehamilan : Panjang badan lahir : Tempat penelitian : Penyakit yang pernah diderita oleh sampel : Nama ayah : Riwayat ayah testisnya tidak turun : 1. Ya, 2. Tidak Bila ya testisnya tidak turun : 1. Kanan, 2. Kiri, 3. Keduanya kanan dan kiri Riwayat saudara laki-laki ayah testis tidak turun : 1. Ya, 2. Tidak Bila ya testisnya yang tidak turun: 1. Kanan, 2. Kiri, 3. Keduanya kanan dan kiri Nama ibu : Alamat : No. Telpon : Riwayat ibu minum obat yang mengandung estrogen saat hamil : Riwayat ibu minum obat yang mengandung estrogen saat menyusui: Riwayat saudara laki-laki dari ibu testis tidak turun : 1. Ya, 2. Tidak Bila ya testisnya yang tidak turun : 1. Kanan, 2. Kiri, 3. Keduanya kanan dan kiri Nama kakek dari ayah : Riwayat kakek dari ayah testisnya tidak turun: 1. Ya, 2. Tidak Bila ya testisnya tidak turun: 1. Kanan, 2. Kiri, 3. Keduanya kanan dan kiri Nama kakek dari ibu : Riwayat kakek dari ibu testisnya tidak turun : 1. Ya, 2. Tidak Bila ya testisnya yang tidak turun: 1. Kanan, 2. Kiri, 3. Keduanya kanan dan kiri Riwayat saudara laki-laki dari sampel yang testis tidak turun: 1. Ya, 2. Tidak Bila ya testis yang tidak turun: 1.kanan, 2.kiri, 3.keduanya kanan dan kiri Hasil pemeriksaan fisik sampel: Adanya sindroma : 1. Ya, 2. Tidak, Bila ya sindroma apa : Testis teraba keduanya : 1. Ya. 2. Tidak teraba Bila ya lokasinya : 1.inguinal , 2. Preskrotal, 3. Retraktil, 4. Skrotum Volume testis yang teraba : 1 kanan = ml , 2, kiri = Testis teraba satu : 1. Ya. 2. Tidak Bila ya lokasinya : 1. Kanan, atau 2. kiri Bila ya lokasinya : 1. Inguinal, 2.Preskrotal, 3. Retraktil, 4. Skrotum Volume testis yang teraba: ml Bentuk penis : 1. Normal, 2 tidak normal , panjang penis : …….cm Kordae : 1. Ada, 2. Tidak ada, Hipospadia : 1. Ada, 2. Tidak ada Hasil pemeriksaan laboratorium Hormon estradiol : Hormon Insl3 : Gen Insl3 : Gen LGR-8 : ml. INFORMASI dan PERSETUJUAN IKUT PENELITIAN (Inform Concent) INFORMASI MENGENAI PENELITIAN KEPADA ORANG TUA RESPONDEN Judul Penelitian : Polimorfisme gen Insl3 dan LGR8, Kadar hormon INSL3 dan estradiol sebagai faktor risiko kriptorkismus pada anak. Latar Belakang: Kriptorkismus merupakan tidak sempurnanya penurunan testis kedalam skrotum dan testis dapat berada pada saluran yang normal diantara ginjal dan bagian dalam skrotum. Adapun insiden kriptorkismus adalah sampai 30 % pada bayi prematur, sedangkan pada bayi cukup bulan insidennya 3-5% , pada saat bayi berumur 3 bulan insiden masih 1-3% dan pada usia 1 tahun insiden kriptorkismus tinggal 0,8%. Komplikasi kriptorkismus berupa: infertilitas, keganasan (ca testis), hernia inguinalis, torsi testis, dan masalah psikologis. Kriptorkismus disebabkan oleh multifaktorial, sedangkan peranan polimorfisme gen INSL-3, polimorfisme gen LGR-8 dan kadar hormon estradiol sampai saat ini masih belum jelas. Tujuan Penelitian: Mengetahui faktor-faktor yang berkaitan dengan peningkatan risiko terjadinya kriptorkismus pada anak. Manfaat Penelitian: Bila terbukti polimorfisme gen Insl3, gen LGR8 dan kadar estradiol berkaitan dengan peningkatan risiko terjadinya kriptorkismus pada anak. Akan menambah kasanah teoritis dan merupakan sumbangan pengetahuan praktis dalam pengelolaan kriptorkismus pada anak. Cara Penelitian: Penelitian dilakukan dengan wawancara kepada orang tua sampel, pemeriksaan fisik sampel dan pengambilan contoh darah vena sampel untuk pemeriksaan kadar hormon INSL3 plasma, hormon estradiol plasma, polimorfisme gen Insl3 dan Gen LGR8 di Lembaga Eijkman Jakarta. Risiko dan Kerahasian anak: Tidak ada risiko yang diterima dengan ikut serta dalam penelitian ini. Informasi mengenai data pasien akan dirahasiakan secara hukum. INFORMASI dan PERSETUJUAN IKUT PENELITIAN (Inform Concent) PERNYATAAN KESEDIAN MENJADI RESPONDEN Saya yang bertanda tangan di bawah ini: Nama : Umur : Jenis Kelamin : Orang tua / Wali : Bersedia dengan sukarela anak saya diikutkan menjadi subjek penelitian dengan judul : “Polimorfisme gen Insl3 dan LGR8, Kadar hormon Insl3 dan estradiol sebagai faktor risiko kriptorkismus pada anak”, setelah mendengar penjelasan mengenai latar belakang, manfaat, risiko dan cara kerja dalam penelitian ini. Demikian pernyataan ini saya buat dengan sebenarnya tanpa ada tekanan dari pihak manapun. Denpasar,…………………………… Peneliti ( I Wayan Bikin Suryawan ) Yang membuat pernyataan (…………………………………………….) Tanda tangan, nama terang S.O.P PENGAMBILAN SAMPEL DARAH 1. Kasus anak kriptorkismus yang diambil secara consecutive sampling dari rekam medis dianamnesis dan diperiksa ulang oleh peneliti atau oleh dokter spesialis anak konsultan endokrin, kemudian dicarikan kontrol di poliklinik anak RSUD wangaya, RSUP Sanglah, RB permata hati yang di matching pada usia dalam tahun dan usia kehamilan. 2. Sampel yang sudah memenuhi syarat sebagai kasus maupun kontrol diberikan penjelasan oleh peneliti mengenai prosedur ,tujuan, manfaat dan efek samping penelitian ini, setelah orang tua sampel bersedia sebagai sampel disarankan untuk menandatangai informed concent. 3. Kasus maupun kontrol yang sudah menandatangai informed concent disiapkan untuk diambil contoh darahnya. 4. Disiapkan alat-alat untuk mengambil contoh darah ( wing needle no 25, spuit 10ml, alkohol swab untuk desinfeksi, betadin 60 ml, plester, hanchun, botol steril yang berisi EDTA dan yang tidak berisi EDTA, termos es untuk menyimpan sampel, karet untuk membendung aliran vena) 5. Pengambilan sampel darah dilakukan oleh petugas Laboratorium Prodia yang terlatih dan ditunjuk membantu penelitian ini. Sebelum mengambil contoh darah petugas menggunakan hanchun, kemudian dilakukan pembenungan pada lengan atas dengan karet dan melakukan desinfeksi pada daerah cubiti dengan betadin dan alkohol swab 70%. 6. Setelah dilakukan desinfeksi petugas mengambil darah vena pada bagian volar articulus cubiti dengan menggunakan wing needle no 25 yang disambung dengan spuit 10 ml, selanjutnya darah vena diambil sebanyak 6 ml, setelah dapat darah sebanyak 6 ml, kemudian 3 ml dimasukkan ke dalam botol yang sudah berisi EDTA dan 3 ml dimasukkan ke dalam botol yang tidak berisi EDTA. 7. Botol dengan darah EDTA dan tanpa EDTA diberikan etiket identitas sampel kemudian dimasukkan ke dalam termos es. 8. Bila sampel yang mau diambil darahnya sudah habis petugas laboratorium prodia yang membantu penelitian ini membawa sampel darah ke Laboratorium Biomolekuler FK UNUD yang selanjutnya diserahkan kepada petugas laboratorium biomolekuler yang ditunjuk membantu penelitian ini (pengambilan sampel darah dilakukan pada hari senin sampai hari jumat). 9. Darah yang berisi EDTA langsung diperoses di Laboratorium Biomolekuler FK UNUD untuk mendapatkan DNA oleh petugas laboratorium yang ditunjuk membantu penelitian ini kemudian disimpan pada lemari pendingin pada suhu -800C 10. Darah yang tidak berisi EDTA langsung disentrifuge pada suhu 40C untuk mendapatkan serum, selanjutnya serum dimasukkan ke dalam tube kecil-kecil dan disimpan pada suhu -800C untuk persiapan pemeriksaan hormon INSL3 dan hormon estradiol. 11. Setelah sampel darah jumlahnya cukup serum dikirim ke laboratorium Poliklinik Hewan FKH UNUD oleh petugas laboratorium bersama peneliti, dan di laboratorium poliklinik hewan diperiksa kadar hormon INSL3 dan kadar hormon estradiol dengan metoda ELISA oleh peneliti bersama petugas laboratorium. 12. Sampel DNA sebelum dikirim dilakukan PCR dulu dan hasil PCR dipurifikasi setelah itu hasil purifikasi PCR baru diantar oleh petugas laboratorium Biomolekuler ke Lembaga Biologimolekuler Eijkman Jakarta untuk diperiksa skuenzing exon 1, exon 2 gen Insl3 dan exon 8, exon 12,13 gen Lgr8. S.O.P Pemeriksaan DNA 1. Urutan pemeriksaan DNA: Extraks DNA yang sudah disimpan pada suhu -200C diambil untuk dilakukan PCR, selanjutnya hasil PCR di purifikasi, hasil purifikasi atau hasil PCR dikirim ke Lembaga Eijkman Jakarta, untuk dilakukan cycle Sequencing, kemudian dilakuan presipitasi, kemudian hasil presipitasi yang berupa pure dried DNA ditambahkan Hidi Formamide dan masukkan kedalam mesin sequencer untuk melakukan sequencing electrophoresis, hasilnya berupa electro pherogram yang kemudian dianalisis menggunakan Bioedit Soft Ware. 2. PCR: menggunakan mesin PCR biasa 9700 atau 9600, bahannya adalah: dNTP, tag polimerase, MgCl (buffer), Primer Forward, Primer Reverse, d H2O yang steril, DNA hasil extraksi. 3. Cycle Sequencing : menggunakan mesin PCR biasa 9700 atau 9600, bahannya adalah: dNTP, ddNTP, tag polimerase, buffer, menggunakan salah satu primer Forward atau primer Reverse, DNA hasil purifikasi, dH2O steril ( free RNAse), 4. Presipitasi : menggunakan mesin Thermo Scientific Centrifuge, bahannya adalah: EDTA, sodium asetat, etanol absorbent, etanol 70 %, DNA hasil cycle sequencing, hasilnya berupa: pure dried DNA 5. Sequencing electrophoresis: menggunakan mesin Applied Biosystem (ABI) Genetic Analyzer 3130 atau 3130XL, bahannya pure dried DNA dan Hidi Formamide, hasilnya berupa electro pherogram. DAFTAR PENELITIAN NO 1 JUDUL / JURNAL / PENELITI METODOLOGI HASIL PENELITIAN KESIMPULAN Genetic analysis of INSL-3 gene in Case control study: 3 klp kasus dan 3 klp kontrol SSCP/HA dapat ditemukan 8 variasi mutasi, Mutasi dan polimorfisme gen INSL-3 patients with maldescent of the klp kasus: tistis tidak turun n=28, Gangguan maskulini 5 squen urutan protein berubah (A-16, V19L, P25S, tidak menjadi penyebab mayor tidak testis, Clinical study sasi dan gonad abdominal n=24, gonad inguinal n=33 A36T, R78H) dan 3 perubahan pada asam amino turunnya testis dg atau tanpa gangguan European Journal of Endocrinology Kontrol: laki-laki normal n=15, laki-laki gangguan (A-1G, V19L, R78H) Polimorfisme aa, A36T maskulinisasi (2001) 144: 129-139, Lim HN dkk maskulinisasi n=29, prempuan n=82 ditemukan pada kedua klp pasien dan kontrol dengan frekwensi yang serupa. 2 3 4 Absence of mutations involving the 31 kasus dg kriptorkismus idiopatik bilateral dan Pada exon 1 terjadi polimorfisme Alan-->Thr, ada Mutasi pada gen INSL-3 tidak umum INSL-3 gene in human idiopathic unilateral di Eropah dan semua kasus mengalami 16 polimorfisme dg 2 silent polimorfisme pd menyebabkan kriptorkismus pada cryptorchidism. Molecular Human infertilitas 9 kontrol laki-laki infertilitas dan tidak exon 1 keduanya ada pada kriptorkismus maupun anak laki-laki. Polimorfisme tidak Reproductation (2000) vol 6, no 4, ada riwayat kriptorkismus. Analisis molekuler, yg normal, ditemukan tranversi G-->A pd posisi 27 berhubungan dg penotif pp. 298-302, Krausz C dkk squens pada exon 1 dan exon 2 gen INSL-3 dg primer dan 126 pd 16 kriptorkismus laki-laki tranversi F2/R1 atau F5/R5 untuk exon 1 dan F4/R4 untuk G-->A pd posisi 178 kode C-peptida, dari 31 kasus exon 2, sebelumnya dilakukan PCR 1 perubahan pd homozigot dan 15 pd heterozigot A novel mutation of the insulin-like 3 Case control study,menggunakan 150 pasien dg Ada 3 perubahan polimorfisme pada exon 1, Penemuan ini memberikan fakta-fakta gene in patients with cryptorchidism. idiopatik kriptorkismus unilateral kiri 48, unilateral G-->A pada nukleotida 1167 mengkode Alanin baru mengenai INSL3 berperan pada J Hum Genet (2003) 48: 86-90, kanan 57, bilateral 45 atau ada riwayat kriptorkismus perubahan tidak ada pada asam amino leusin penurunan testis pada manusia Canto P dkk kontrol 50 laki-laki dari etnis Mexico dg faktor G-->A pada nukleotida 1338 Alanin-->Threonin walaupun mutasi pada gen ini tidak keluarga tidak ada, lahir aterm, usia 2 bulan - 27 tahun Mutasi pada exon 2 C-->G pd nukleotida 2560 banyak menyebabkan kriptorkismus Genom DNA diisolasi dari lekosit darah pasien, Asparagin-->Lysin pada codon 86 didapat dari PCR dan primer kedua exon ditentukan. Ibu dg heterozigot menjadi karier dari C-->G pd Analisa mutasi atau variasi squen dikonfirmasi dg 3 nukleotida 2560 amplifikasi PCR indevendent dan squens dianalisa Perubahan seperti ini juga ditemukan pada kontrol Mutations of the Great gene cause 61 kasus kriptorkismus idiopatik bilateral atau Variasi nukleotida pada Great cDNA ditemukan Mutasi missen pada gen Great menjadi cryptorchidism. Human Molecular unilateral, 20 orang prancis dan 41 orang campuran pada kasus dan kontrol, secara khusus ada mutasi penyebab beberapa kasus Genetic (2002), vol 11, no 19, kontrol 193 dg fertil dan testis di skrotum 62 francis missen (T222P) pada ectodomain reseptor Great pp.2309-2318, Garlov I P dkk 100 orang Jerman dan 31 orang USA mutasi DHPCL pada satu pasien, mutasi pada reseptor Great dianalisa dg squen. Genom diisolasi pada exon 12-16 menyebabkan kegagalan merespon stimulasi kriptorkismus pada manusia dari gene Great squen dg premer K/o derivat dari vector bacbone, vector 53527 dan inser-reverse dan sisipan kebalikannya 5 The INSL3-LGR8/GREAT Ligand-Recep 87 pasien kriptorkismus usia 24-45th dg 36 kriptorkis 18 pasien normosperma, 16 pasien oligosperma Kriptorkismus banyak berhubungan tor pair in Human Cryptorchidism. mus bilateral, 46 kriptorkismus unilateral, usia dan 53 azosperma ditemukan 3 polimorfisme dg mutasi pada INSL-3 dan reseptornya The Journal of Clinical Endocrinology & Metabolism (2003) 88(9): 42734279 orchidopeksi 1-27th, 5 kasus testis turun sendiri usia L9L (27G-->A) 3% kriptorkismus, 5 % kontrol A60T (178G-->A), 42,5% kriptorkismus, 47% kontrol LGR8/GREAT. Gen ini punya peran Ferlin A dkk 6 7 1 tahun, kontrol 80 kasus di Italia. Genom DNA penting pada penurunan testis tanpa diambil dari darah perifer, digunakan LGR8 cDNA L42L (126--> A) 57% kriptorkismus, 58% kontrol berpengaruh pada spermatogenesis untuk squen kromosum 13 dan didesain 17 pasangan Ditemukan 3 mutasi INSL-3 pada 4 pasien dan dan komponen endokrin testis premer untuk 18LGL8 hasil PCR dicek polimorfisme 1 mutasi INSL-3 pada 4 pasien. Great/LGR-8 is the only Receptor for Seluruh lengan wild-type INSL-3 cDNA diamplifikasi INSL-3 pada defisiensi GREAT tidak terjadi Reseptor GREAT/LGR8 hanya satu-satu Insulin-like 3 pepteda. Molecular Endocrinology(2003)17 (12)26392646 RT-PCR dan RNA testis manusia dg primer difrensiasi gubernakulum dan pada perempuan nya reseptor INSL-3 in vivo. Interaksi 5!-(CCCAAGCTT)C-CACCATGGACCCCCGT-3! Dan overekpresi INSL-3 dan dilesi GREAT terjadi INSL-3 dan LGR-8 dapat dipahami pada Bogatcheva NV dkk 5!-(CCCAGATCT)GTAGG-GACAGAGGGCAGCA-3! ovarium letak tinggi di abdomen. Rekombinan desensus testis dan kriptorkismus dianalisa mutasi dari wild type INSL-3 cDNA dan INSL-3 mampu meningkatkan cAMP pada GREAT. Mutasi P49S pada INSL-3 dapat diiden dilakukan aktivasi dari reseptor LGR7 dan GREAT dg INSL-3 merupakan aktivator spesifik pada GREAT tifikasi pada pasien kriptorkismus INSL-4 dan INSL-6 INSL-4,INSL-6 tidak mengaktivasi LGR7 atau GREAT INSL-3 Ligand-Receptor system in the Jaringan testis kuda diambil dari 9 tempat untuk Peptida LGR-8 testis kuda dapat ditunjukkan dg Telah diidentifikasi testis kuda dan Equine Testis.Biologyof Reproduction testis dewasa: testis normal n=9, gangguan spermato identifikasi LGR-8 manusia 94,8%, dg LGR-8 tikus target jaringan dari INSL3.Diperkirakan (2003) 68: 1975-1981, Klonisch T dkk genesis n=7, kriptorkismus inguinal n= 3. Pada kuda 80,5%, tapi hanya dapat 55,3% berhubungan dg fungsi intratestikular INSL3-LGR8 prepubertas diambil dari 8 tempat: kriptorkismus LGR7 manusia. Pada desensus testis kuda dewasa secara hormonal berhubungan di kontralateral n= 3, kriptorkismus inguinal n= 5 eINSL3 spesifik dapat dideteksi secara imunologis dalam testis kuda dilanjutkan pemeriksaan PCR pada jaringan testis pada sel Leydig. Pada kriptorkismus abdominal, diperiksa imunohistokimianya dan dg Werten Blot inguinal dan prepubertas testis kuda juga Analisis aktivitas INSL-3 dan LGR-8 testis kuda dg menunjukkan imunopositif eINSL3. INSL3,LGR8 testis manusia dan tikus Dengan Water Blot Analisis adanya penurunan secara signifikan imunoreaaktif eINSL3 pada ekstrak protein kriptorkismus dan prepubertas 8 Hormonal control of Gubernaculum Tikus dewasa dianalisa imunohistokimia dari Analisa histologi dari fetus tikus pada E17 dan E19 INSL-3 dan androgen punya peran Development during Testis descent: gubernakulum . Prolifirasi sel pada gubernakulum menstimulasi perkembangan seksual dismorfik penting pd pentumbuhan keluar Gubernaculum Outgrowth in vitro invivo diawasi dengan 5-bromo deoxyuridine pada bulbus gubernakulum jaringan testis yang gubernakulum pada penurunan testis Requires both Insulin-like factor and Dipakai DNA gubernakulum tikus fetus dan 5-bromo berisi R 1881, androgen sintetis menstimulasi gubernakulum invivo dan invitro Androgen. Endocrinology (2000) deoksyuridin dan dipakai DNA gubernakulum tikus pertumbuhan gubernakulum. berhubungan dengan regulasi ekspresi 141: 4720-4727, Emmen JMA dkk fetus diaktivasi dari E17 fetus di cek juga : INSL-3, gen INSL-3 pada penurunan testis . AMH dan androgen. Sebagian besar penelitian selanjutnya memiliki gen yang berpengaruh terhadap aktivasi INSL-3 pada perkembangan gubernakulum. 9 An analysis of the Genetic factor Penelitian kohort pada 14 anak laki-laki dengan Mutasi gen INSL-3 dan T222P pada gen LGR-8 Mutasi pada gen INSL-3 dan T222P dari involved in testicular descent in bilateral anorchia usia (1,3-15,8) tahun antara tahun diketahui menyebabkan kriptorkismus. Konfirma gen LGR-8 semata mata berhubungan a cohort of 14 male patients with 1981-tahun 2003. Dilakukan pembedahan, kemudian si dengan hasil mutasi pada gen SRY tidak berhu dengan desensus testis dan tidak Anorchia. The Journal of Clinical analisa hormonal (testosteron, AMH, FSH,LH) dan bungan dengan anorchia. Walapun umumnya berhubungan dengan anorchia, data Endocrinology & Metabolism(2004) analisa DNA pada ( Gen SRY, gen INSL-3, T222P pada polimorfisme gen INSL-3 telah teridentifikasi ini menunjukkan kemungkinan ada 89(21): 6282-6285, Vinci G dkk gen LGR-8) dianalisa mutasi pada gen tersebut. pada kasus ini namun pada observasi tidak dite faktor genetik lain juga yang berperan Dilakukan juga modifikasi untuk menciptakan primer mukan adanya mutasi dan pengulangan mutasi pada desensus testis seperti HOXA 10 yang menditeksi tempat restriksi baru untuk polimor T222P dari gen LGR-8 tidak dijumpai. fisme 10 INSL-3 /Leydig insulin -like peptide activites the LGR-8 receptor infortant Ada 293 jaringan testis manusia diperiksa INSL-3 dan Dikatakan ikatan INSL-3 dan LGR-8 sangatlah baik Penurunan testis sangat tergantung pada LGR-8 kemudian dianalisa pengaruhnya pada ikatan ini sangat berguna untuk pertumbuhan gen INSL-3 dan gen LGR-8 ikatan ini in testis descent. The American gubernakulum gubernakulum menentukan pertumbuhan gubernaku Society for Biochemistry and molecu lum . Pada perempuan INSL-3 berhu lar Biologi (2002) 1-13, Kumagai J dkk bungan dg sel corpul luteum dan gangguan INSL-3 menyebabkan ovarium letak tinggi 11 The Leucine-Rich Repeat-Containing Jumlah sampel 822 dg 359 riwayat kriptorkismus dan Analisa mutasi exon 8 dari gen LGR-8 dari 822 pasi Mutasi T222P pada gen LGR-8 tidak G Protein-Coupled Receptor 8 gene 463 sebagai kontrol dari negara: Italia n=159, spanyol en, mutasi T222P pada pasien dan kontro. dapat dipertimbangkan sebagai penye T222P mutation does not cause n=77, Hungaria n= 70 dan Egypt n= 53 mutasi pada Pasien: 3,6% dari 359 dan pada kontrol 1,7% dari bab atau faktor risiko kriptorkismus Cryptorchidism. J Clin Endocrine gen T222P dari LGR-8 dg squens langsung dg premer 463 tidak berbeda signifikan. Mutasi pada pasien: namun pada penelitian ini banyak Metab (2007) 93 (3): 1072-1076, exon 8 yang berisi mutasi T222P. 5 Polimorfisme Egypt = 5,66%, Italia = 5,03%, Hungaria = 2,86% ditemukan polimorfisme gen LGR-8 Nuti F dkk dianalisa pada 19 karier dari mutasi T222P Spanyol 0%, Pada Kontrol mutasi: Spanyol =4,17% Italia = 1,82%, Hungaria = 0,71%. Analisa polimorfisme 5 exon dan intron dari 19 kasus ditemukan mayoritas pada pasien dibanding kan dg kontrol 12 Impaired Estrogen Production by Menggunakan 16 babi yang kriptorkismus dan yang Diukur berat testis dari 16 babi dan terjadi pengu Testis di skrotum dari kriptorkismus Leydig cells of Naturally Retained normal diobservasi di universitas Swine Reseach rangan berat pada kriptorkismus abdominal. unilateral pada binatang percobaan Testis in unilaterally Cryptorchid senter selama usia 3-4 bulan, pada usia 4 bulan testis Produksi estrone meningkat oleh sel Leydig pada menekan aliran produksi estrogen dari Boars and Stallions. J Androl (1986) yang di skrotum dari 4 kriptorkismus unilateral dan testis skrotal. Terjadi hambatan sekresi estron testis abdominal. Testis di skrotum 7: 100-104, Ryan PL dkk 1 yang normal dioprasi dan dipindahkan ke abdomen pada testis abdominal. Pada kriptorkismus berfungsi sebagai regulasi aliran yang melalui kanalis inguinalis. Kemudian testis dibawa produksi estrogen dapat terdeteksi. Produksi berlebihan dari aktivitas aromatisasi ke laboratorium selama 5 menit untuk pemeriksaan androgen tidak berbeda antara testis skrotal testis abdominal. Aliran estrogen ini sel Leydig. Kemudian pemeriksaan radioimunoassy dengan testis tranlokasi ke abdominal. nilainya normal 2 bulan setelah dengan menggunakan estrone sulfat dan estrone orchidopeksi Analisa statistik dengan student! T test 13 Estrogen Receptor α is a major contri 13 anjing yang hamil diberi suntikan 0,2 ml dimethyl Terjadi kriptorkismus pada binatang yang ibunya Xenoestrogen menghambat fungsi butor to Estrogen-mediated fetal sulfaxide (DMSO) atau ditambah 6 mg 17β-E2 terpapar E2 pada kadar 18,5. Pada uterus yang endokrin sel Leydig fetus, berhubungan testis dysgenesis and cryptorchidism sebelumnya. Untuk paparan DES anjing hamil menda terpapar estrogen 6 gen dari 55 gen testis menga dengan mekanisme langsung estrogen endocrinology (2007) 148 (11) : 5507- pat paparan 10 µg/d--> anjing hamil dibunuh dengan lami regulasi menurun yaitu gen: INSL-3, Star, reseptor α. Sebab ekspresi INSL-3 dan 5519, Cederroth CR dkk E18,5 dan testis anak anjing dikeluarkan . Diekstraksi Cyp17a!, Ren!, FMO2, dan lefty.A. Sementara 31 produksi androgen sel leydig dibutuh RNAnya dengan RT-PCR , dengan primer disquens. gen mengalami regulasi yang meningkat. Pada kan dalam keadaan normal untuk defe Total RNAs dari wild-type atau mutasi Erα testis yang inaktivasi Erβ tidak berpengaruh. Terjadi toxicoge rensiasi laki-laki dan fungsi testis. terekspresi dengan DMSO atau 17β E2 diektraksi nik pada mutasi Erα pada paparan xenoestrogen. Obat-obat estrogen akan menyebabkan tersendiri. Analisa statistik perbedaan nilai mean Pada real-time RT PCR validasi ekspresi gen pada teratogenik dalam fase maskulinisasi antara klinis dg genotif dg unpaired t test. One-way E2 atau DES yang terpapar terjadi blokade Erα dan pertumbuhan saluran urogenital anova membedakan kedua group atau lebih pada testis. Pada paparan minimal terjadi desen dan fertilitas. sus testis. 14 Endogenous Estrogens inhibit Mouse Tikus rumah dikontrol dengan lampu 0800-2000h Ex vivo produksi testosteron basal berhubungan Erα menjadi mediasi in vivo pengham fetal Leydig cell Development via dan disediakan air secukupnya. Umumnya tikus homo dengan kandungan testosteron intra seluler. Pada batan pengaruh estrogen endogen pada Estrogen Receptor α. Endocrinology (2005)146(5): 2454-2461, Delbes G dkk zigot untuk Erα. Kemudian yang heterozigot dikum testosteron basal dan stimulasi LH. Produksi perkembangan steriodogenesis testis pulkan pada malam hari. Tikus yang hamil dibius pada testosteron meningkata untuk homozigote tapi selama masa fetus dan perkembangan kehamilan 13,5 hari dengan injeksi 4 mg/100g tidak untuk heterozigot. Erα aktivasi gen selama neonatal pada tikus. Hal ini mendukung . 15 sodium pentobarbital. Neonatus laki-laki dibunuh 2 hari dibanding binatang wild type. Plasma FSH hipotesis fetus dan neonatus yang dengan leher dipotong pada usia 2-3 hari dilakukan dan LH 2 hari setelah lahir tidak ada beda antara terpapar xenoestrogen dapat mengala PCR pada testis, total sel leydig diukur digenakan Erα -/- dengan wild type. Peningkatan kadar mi gangguan maskulinisasi traktus Real Time PCR untuk gen steriodogenik (StAR, P450Scc, biosintesa androgen pada Erα -/- dan endrolin urogenital dan fertilisasi pada dewasa dan P450C17 pada testis, Testosteron dg RIA . FSH,LH pada b ayi tak sesuai dengan perubahan pada bayi dg imunoflorometrik assay. Dianalisa dg student! tak sesuai. Peningkatan kadar biosintesa androgen unpaired t tes dan one-way ANOVA. tidak sesuai untuk India. Peningkatan biosintesa. Haplotype analysis of the estrogen Dilakukan analisa haplotype dari estrogen reseptor α LD Block pada kelompok pasien dan kontrol diban Mendukung hipotesis homozigot untuk receptor 1 gene in male genital and (ESR1) pada 328 subjek orang jepang dengan 70 pasien dingkan. Frekuensi homozigot dengan AGATA estrogen reseptor α (ESR1) spesifik and reproductive abnormalities. mikropenis (MP), 43 pasien hipospadia (HS), 80 pasien haplotype spesifik hasilnya paling tinggi pada AGATA haplotype, bisa meningkatkan Human Reproduktion (2007) 22 (5): kegagalan sperma (SF) dan 135 kontrol. Genotyping dg pasien HS(p=0,0000033), OR = 11,26) sedikit tinggi kepekaan berkembangnya kelainan 1279 - 1284. Watanabe M dkk 5! Nuclease assay. pada pasien MP(p=0,034, OR= 3,64) dibandingkan alat genitalia laki-laki sebagai respon dengan kontrol dan AGATA haplotype sangat kuat hubungannya dg HS (p= 0,0000022, OR = 11,26) dan lemah dengan MP (p=040 dan OR = 3,64) pada type estrogenik dari terputusnya lingkungan resesip. Tidak ada perbedaan bermakna antara endokrin (EEDs) pasien SF dengan kontrol. Analisa SNPs frekwensi genotif 8-15 peningkatan AA pada SNP 10 (p=0,023) dan SNP 12 (p=0,03) pada HS. 16 Molecular analysis of estrogen receptor alpha gene ABATA haplotype Dua kelompok besar yaitu kasus 335 orang dan kontrol SNP12 merupakan representatip SNP untuk AGATA 567 orang pada dua populasi kulit putih kemudian haplotype juga pada kulit putih. Kita ketahui berla dari observasi didapatkan efek yang berlawanan dg kriptorkismus dianjurkan and SNP12 in European populations: dianalisa SNP12 yg merupakan representasi SNP1-15 wanan dengan populasi di Jepang didapatkan adanya penelitian lain selanjutnya potential protective effect for Cryptorchidism and lack of association dan AGATA haplotype ( estrogen reseptor α ) untuk pada kasus independent dan kontrol membuktikan apakah variasi genetik ini dan yang ESR1 SNP12 mempunyai efek protektip terhadap terjadinya kriptorkismus pada polpulasi Italia. Tidak dari etnis berbeda dan daerah yang ber ditunjukkan oleh SNP berhubungan dengan kriptorkis ada hubungan antara SNP12 dengan gangguan beda. Pada bagian lain terjadi hal yang mus atau gangguan spermatogenesis yang berat. spermatogenesis yang berat. Frekwensi allel dan with male infertility. Human Repro duction (2007), vol 22, no 2,pp.444449 Galan JJ dkk Kontrol Italia = 168 laki-laki, AGATA karyotive 109 SNP12 pada orang italia dan spanyol adalah berlawanan pada polimorfisme ESR1, SNP12. polimorfisme tidak berhubungan dari 168 laki-laki, dan di serum SNP12 13,4% dan 9,3% (p=0,04, OR = 1,51) dan dengan faktor infertilitas laki-laki C1 95-1,02 . Dan kasus =13,4 , kontrol = 7,2 17 Morphometric study of the Guberma Speasmen diambil dari tikus usia 21-25 minggu yg Pada sayatan sagital ada perbedaan bermakna Paparan estrogen tidak jelas perannya culum in male Estrogen Receptor dibiakkan dari reseptor estrogen tikus yg dimatikan ketiga grup.Pada wide type semua testis turun pada perkembangan gubernakulum. mutant mice . Journal of Andrology ditunjukkan genotif estrogen reseptor ketiganya. kecuali 1 atropi intraabdominal. ERKO heterozigot Estrogen lewat penekanan testosteron (1996) 17: 91-95, Donalson Km dkk jaringan difiksasi dg formalin 10% kemudian 3 dari 8 turun dan 5 retraktil. ERKO homozigot dan aktivasi MIS berpengaruh pada sampel dibagi 3 kelompok: 4 wide type, 4 ER heterozi 1 turun dan 6 dari 8 retraktil.Kantong kremaster perkembangan gubernakulum. Estrogen got dan 4 ER homozigot yang mutasi. Kemudian dipe membesar dan meleber pada wide type (p<0,05) exogen menyebabkan atropi perkem riksa genotif dan morfologi jaringan. Hasil PCR diperik penurunan testis lebih dibawah pada wide type bangan gubernakulum normal dan blok sa hasilnya: 239 base pair untuk yang normal dan 449 base pare untuk yang terganggu. Morfologi otot kremas ter diperiksa, dianalisa dg mean, SD dan student!s t test Otot kremaster lebihbesar dan teratur pada wide pada estrogen gubernakulum tumbuh cepat (tidak ditemukan pd penelitian ini) Ditemukan perkembangan otot kremaster diperkirakan berhubungan dg gubernakulum Kelainan spermatogenesis pd homozigot type (p<0,02) dg heterozigot dan (p<0,05) dg homozigot. Potongan sagital (p< 0,01) 18 Hormonal changes in 3-month-old Penelitian secara prospeftif longitudinal dengan Anak laki-laki Finlandia yg kriptorkismus FSH tinggi Hasil penelitian ini mendukung hipotesa Cryptorchid Boys. The Journal of basis populasi. Dilakukan pada dua pusat pelayanan 1.59(0,50-3,53) dengan 1,30 (0,49-2,92) IU/L, kriptorkismus berhubungan dengan Clinical Endocrinology&Metabolism primer obstetri, adapun sampel sebanyak 386 anak p<0,0001, inhibin B rendah =426 (254-770) dg 459 kerusakan testis primer, yang mana (2006) 91(3): 953-958, Suomi AM dkk laki-laki Finlandia 88 dengan kriptorkismus, 433 anak (216-742) pg/ml, p< 0,015, median (2,5th-97,5th menyebabkan kriptorkismus . laki-laki Denmark 34 dengan kriptorkismus. Pemerik persentil. Di Denmark kriptorkismus FSH tinggi Gangguan fungsi ini dapat ditunjukkan saan klinis dilakukan pada usia 0 bulan dan 3 bulan, 1,47 (0,54-3,89) dg 1,18 (0,41-3,64) iu/L p=0.018 oleh produksi inhibin yang rendah sedangkan pemeriksaan sampel darah usia 3 bulan. Inhibin B lebih rendah pada Denmark lebih rendah 380 (233- 637) pg/ml p<0,000 dan tidak turun pada pada penelitian kohort di Finlandia Hasil utama yang diukur adalah posisi testis dan kadar hormon reproduksi. kriptorkismus di Denmark 392 (236-672) pg/ml p: 0,851. Perubahan kadar hormon sangat kuat pada dan peningkatan kadar gonadotropin pada penelitian di Finlandia dan Denmark. anak dengan kriptorkismus berat dan persisten. tetapi juga terdeteksi pada kriptorkismus ringan dan sementarsa. Pengaruhnya pada sel Leydig sedikit dengan peningkatan LH Finlandia tapi tidak pada Denmark, LH= 1,97 (0,77-5,91) dg 1,75 (0,58-4,o4), p<0,021, tetapi testosteron masih normal. 19 Maternal hormone levels and Risk of Penelitian kohort prospektif ibu hamil dg anak krip Tidak ada perbedaan signifikan testosteron , Peningkatan estrogen ibu tidak berhu Cryptorchidism among population at torkismus dan kontrol, diteliti ibu kulit hitam resiko α-fetoprotein, sex hormon- binding-globulin, atau pada Hight low risk of testicular germ ca testis rendah dan ibu amerika kulit putih resiko ratio estrogen dengan androgen. Total estradiol bungan dengan meningkatnya risiko kriptorkismus dan mungkin berhubungan cell tumor. Cancer Epidemiologi , ca testis tinggi. Diambil 200 kasus dan 200 sampel lebih rendah bermakna pada kasus (p=0,03) dengan menurunnya kriptorkismus. biomarker & prevention (2005) 14(7) secara nested. Hipotesis estrogen ibu meningkatkan diantara seluruh ibu dan sebagian ibu kulit putih Risiko rendahnya estrogen pada kasus 1732-1737, Mc Glynn KA dkk. kriptorkismus dan ca testis, androgen ibu mencegah (p=0,05), estriol juga lebih rendah bermakna mengindikasikan defek plasenta Diambil serum ibu: estradiol (total,bebas, bioavilable) pada kasus (p=0,05) diantara semua kasus dan meningkatkan risiko kriptorkismus dan estriol,testosteron (total,bebas,bioavilable), sex- diantara kulit putih. kemungkinan ca testis. Penelitian hormon binding globulin, α-fetoprotein, rasio selanjutnya disarankan meneliti estradiol : testosteron pada kasus dan kontrol cairan amnion, darah umbilikal, atau sampel darah bayi 20 Elevated End-of-Treatment serum Analisa retrospektif kadar serum INSL-3 pada laki-laki Usia subjek dari 3 penelitian 32±8 tahun, rerata Kadar serum INSL-3 berhubungan INSL-3 is associated with failure to completely suppress spermatogenesis yang diobati dengan kontrasepsi hormonal testosteron bermakna dengan persisten spermato plus fungsi progestogen : Diukur kadar serum INSL-3 berat badan: 83 ± 15 kg. Pada akhir pengobatan 63 laki-laki (59%) azoosperma dan 44 laki-laki (41%) in men receiving male hormonal dengan RIA pada 107 laki-laki dari 3 penelitian ada sperma. Data awal INSL-3 tidak ada korelasi pada pencegahan komplit penekanan contraception. Journal of Andrology yang baru mendapat kontrasepsi hormonal. Nilai dengan konsentrasi sperma dan akhir pengobatan spermatogenesis pada laki-laki dengan (2007) 28(4): 548-554, Amory JK dkk. genesis. INSL-3 memegang peranan normal INSL-3: 291-1132 pg/ml, batas bawah yang serum INSL-3 lebih tinggi bermakna pada nonazo penggunaan kontrasepsi hormonal. masih terukur: 16 pg/ml, FSH dan LH juga diukur sperma dibanding azosperma median 95 (73-127) Selanjutnya INSL-3 menjadi target dengan RIA. Azoosperma tidak ada sperma, oligosper pg/ml berbanding 80 (67-101)pg/ml dengan nilai potensial untuk pengembangan ma sperma ≤ 1millien sperma/ml ejakulat. Data p = 0,03. Selanjutnya serum INSL-3 punya korelasi kontrasepsi laki-laki. dianalisa dengan: nonparametrik, Wilcoxon-rank-sum positip dengan konsentrasi sperma (r = 0,25, test, analisa univariat dan bivariat logistik regresi p=0,009). Pada akhir pengobatan INSL-3 punya dengan kemaknaan α < 0,05. hubungan bermakna dengan nonazosperma oleh multipariat logistik regresi (p=0,03). Setelah 6 bulan pengobatan tingginya konsentrasi serum INSL-3 berhubungan dengan produksi sperma yang persisten.