8 BAB II TINJAUAN PUSTAKA 2.1 Teknik Reproduksi
advertisement

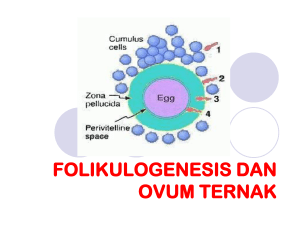
BAB II TINJAUAN PUSTAKA 2.1 Teknik Reproduksi Berbantu Fertilisasi In Vitro Fertilisasi in vitro adalah fertilisasi yang dilakukan diluar tubuh melalui proses tertentu untuk mendapatkan embrio (Speroff, dkk., 2010). Proses itu meliputi stimulasi ovarium, petik ovum, fertilisasi, dan transfer embrio. Sementara, proses kehamilan lanjutan seperti implantasi, plasentasi, tumbuhkembang, dan maturasi berlangsung merujuk pada kehamilan alamiah; termasuk risiko-risikonya. Hal ini merupakan salah satu cara TRB yang biasanya dilakukan pada pasangan infertil setelah upaya-upaya untuk memperoleh kehamilan dengan teknik TRB yang lainnya tidak berhasil. Dengan demikian, FIV merupakan rangkaian proses yang meliputi stimulasi ovarium terkontrol, petik ovum, fertilisasi, dan transfer embrio. 1. Stimulasi ovarium terkontrol adalah upaya merangsang folikulogenesis dan oogenesis dengan berbagai cara terkontrol sehingga diperoleh multi folikel dan ovulasi multipel. Tujuan akhir stimulasi ovarium adalah untuk memperoleh oosit yang lebih banyak. 2. Petik ovum adalah proses pengambilan oosit melalui aspirasi cairan folikel menggunakan jarum disposibel khusus bertekanan negatif antara 100-110 mmHg sampai dinding folikel mengalami kolaps. Petik ovum dilakukan transvaginal dengan bantuan ultrasonografi (USG) dan transabdominal dengan bantuan laparoskopi atau laparotomi. 8 9 3. Fertilisasi adalah proses pembuahan oosit oleh spermatosit sehingga terjadi proses fusi menghasilkan zigot dan berkembang menjadi embrio. Terdapat beberapa cara FIV yaitu: a. Konvensional adalah cara fertilisasi dimana oosit diinkubasi dengan 50.000-100.000 sperma hidup dalam tempo 12-18 jam, suhu 370 C, 5% CO2, dan 98% kelembaban. b. Intracytoplasmicsperm injection (ICSI) adalah cara fertilisasi dimana oosit diinjeksi dengan satu spermatosit yang telah diseleksi dengan bantuan pipet berpenampang 2-7 µm. 4. Transfer embrio adalah proses pemindahan embrio dari luar tubuh ke dalam kavum uterus memakai pipet khusus. Sementara, implantasi pada endometrium terjadi secara alamiah. Ada beberapa cara transfer embrio, antara lain (Speroff dkk, 2010): a. Transcervical embrio transfer yaitu transfer embrio melalui kanalis servikalis. Cara transfer embrio ini dapat dilakukan dengan bantuan USG untuk identifikasi ketepatan kanula. b. Zygote intra fallopian transfer (ZIFT) yaitu transfer zigot kedalam tuba uterina Falopi dengan bantuan laparoskopi. c. Tubal embryo transfer (TET) adalah transfer embrio kedalam tuba uterina Falopii dengan bantuan laparoskopi. Berdasarkan uraian diatas maka dapatlah dinyatakan bahwa TRB-FIV relatif mahal terkait dengan padat teknologi, padat karya dan sumberdaya dengan kompetensi khusus serta waktu yang ketat. 10 2.2 Folikulogenesis Folikulogenesis adalah proses pematangan folikel pada korteks ovarium yang tersusun dari sel somatik padat dan mengandung oosit imatur. Proses ini menggambarkan perubahan dari folikel primordial kecil menjadi folikel preovulasi besar. Peran utama pematangan folikel adalah untuk mendukung oogenesis yang pada akhirnya menghasilkan oosit. Sejak lahir, pada ovarium terdapat sejumlah folikel primordial imatur yang mengandung oosit primer yang juga imatur. Selanjutnya, folikel primordial mengalami perubahan karakter histologis dan fisiologis dimana akan terbentuk baik folikel tersier maupun folikel antral. Proses ini bergantung pada berbagai jenis hormon yang menyebabkan kecepatan folikulogenesis dan oogenesis yang berakhir adanya ovulasi atau sebaliknya atresia folikel. Pada folikulogenesis, GnRH yang diproduksi dan dilepaskan secara pulsatil dalam jumlah tertentu oleh hipotalamus akan mempengaruhi hipofise (Ernesto, dkk., 2001; Speroff, dkk., 2010). Selanjutnya, sel hipofise pars anterior memproduksi FSH yang berperan penting dalam folikulogenesis. Folikulogenesis ini ditandai oleh peningkatan diameter folikel dan berakhir pada folikel pre-ovulasi. Dan, kerjasama FSH dan lutenizing hormone (LH) mengakibatkan terjadinya ovulasi yang menghasilkan oosit matur (Berlinguera, dkk., 2007;.Speroff, dkk., 2010). Folikulogenesis dimulai sejak kehidupan prenatal yang dibedakan atas 5 stadium yaitu: 1. Folikel Primordial 11 Pada janin usia 20 minggu, korteks ovarium mengandung sekitar 7 juta folikel primordial; suatu jumlah paling banyak selama masa kehidupan. Folikel primordial ini mengandung oosit imatur yang dikelilingi sel granulosa pipih dan dipisahkan dari lingkungan oosit oleh lamina basalis. Folikel primordial sebagai cadangan folikel berkurang menjadi 2 juta saat lahir dan 300 ribu saat pubertas. Hanya sekitar 400 yang akan sampai pada stadium folikel pre-ovulasi. Pada stadium folikel primordial tidak menunjukkan aktivitas biologis. Selanjutnya, folikel primordial merespon perubahan pola hormonal dan memasuki tahap rekruitmen. Selanjutnya, berupa folikel primer yang dimediasi oleh keseimbangan antara stimulasi dan inhibisi hormon serta pembentukan faktor pertumbuhan lokal. 2. Folikel Primer Pada stadium ini ditandai oleh perubahan sel granulosa folikel primordial dari pipih menjadi kuboid menunjukkan mulainya folikel primer. Pada saat yang sama mulai tampak adanya gap junctions yang menghubungkan antara oosit dengan sel granulosa yang berfungsi sebagai jalur nutrisi, metabolisme, dan komunikasi antara oosit dengan sel granulosa. Gap junction merupakan saluran yang terbentuk dari susunan protein yang disebut kaneksin. Kaneksin berperan penting pada pertumbuhan dan multiplikasi sel-sel granulosa serta untuk nutrisi dan regulasi perkembangan oosit. Selanjutnya, terjadi aktivasi oosit dimana folikel tumbuh pesat dan hampir mencapai diameter 0,1 12 milimeter. Pada stadium folikel primer sudah terbentuk reseptor FSH, akan tetapi tidak memberikan respon kepada gonadotropin. Kapsul glikoprotein polimer membentuk kapsul yang mengelilingi zona pelusida. Zona pelusida yang ikut oosit post ovulasi mengandung enzim yang mampu mengkatalisasi sperma sehingga mampu melakukan penetrasi. 3. Folikel Sekunder Stadium ini ditandai aktivitas mitosis folikel yang sangat tinggi dan tidak berlangsung lama sebelum sel granulosa terbentuk berlapislapis. Lapisan sel teka paling luar yang mengelilingi folikel disebut lamina basalis dan mengalami diferensiasi sel menjadi teka eksterna dan teka interna. Juga, terbentuk jaringan pembuluh kapiler antara 2 lapisan tersebut dan mulai mensuplai darah dari dan menuju ke folikel yang disebut folikel sekunder stadium dini. Selanjutnya, folikulogenesis memasuki folikel sekunder stadium lanjut. Folikel sekunder stadium lanjut disebut juga folikel preantral. Secara histologis, folikel preantral ditandai oleh oosit yang telah berkembang penuh dan dikelilingi zona peluzida, kurang lebih 9 lapis sel granulosa, lamina basal, teka interna, dan jaringan kapiler serta teka eksterna. Selanjutnya, folikulogenesis akan memasuki pembentukan folikel tersier. 13 4. Folikel Tersier Folikel tersier disebut juga folikel de Graaf atau folikel antral yang ditandai oleh pembentukan cairan dalam kavum yang berdekatan dengan oosit disebut antrum. Struktur dasar folikel matur telah selesai dan tidak ada sel baru yang terbentuk. Sel granulosa dan sel teka melanjutkan mitosis yang bersamaan dengan bertambah besarnya volume antrum. Sel granulosa dari folikel tersier mulai berdiferensiasi menjadi 4 subtipe yaitu 1) Korona radiata yang mengelilingi zona pelusida, 2) Membrana yang merupakan bagian dalam lamina basalis, 3) Periantral yang berdekatan dengan antrum, dan 4) Kumulus oovorus yang menghubungkan membrana dan korona radiata. Setiap tipe sel tersebut menunjukkan respon yang berbeda terhadap FSH. Sel teka membentuk reseptor LH yang akan memproduksi androgen dan memproduksi estrogen melalui aromatisasi, terutama estradiol sehingga jumlah estrogen mulai meningkat (Speroff, dkk., 2010). 5. Folikel Tersier Stadium Lanjut dan Preovulasi Folikel tersier stadium lanjut dan preovulasi merupakan fase folikuler pada siklus menstruasi. Pada stadium ini, sebagian besar folikel yang tumbuh sejak 360 hari mengalami atresia yang ditandai oleh apoptosis semua sel dan oosit. Meskipun tidak diketahui penyebab atresia, kadar FSH yang tinggi dapat mencegahnya. Peningkatan kadar FSH disebabkan oleh adanya degenerasi estradiol dan inhibin yang disekresi oleh folikel ini mengawali supresi FSH. 14 Folikel yang mempunyai jumlah reseptor FSH yang tidak cukup, tidak bisa berkembang lebih jauh dan akan mengalami retardasi pada kecepatan pertumbuhannya dan menjadi atresia (Emery, dkk., 2007; Sperroff, dkk., 2010). Kelompok folikel tersebut mengalami pertumbuhan sampai tahap tertentu dan selanjutnya mengalami apoptosis. Namun, adanya rangsangan gonadotropin dengan kadar dan waktu tertentu (threshold-window theory) maka folikel dapat terus tumbuh menjadi folikel dominan (McGee dan Hsueh, 2000). Akhirnya, hanya satu folikel dominan yang akan tumbuh pesat mencapai diameter 20 milimeter dan menjadi folikel preovulasi melalui mekanisme tahapan rekruitmen folikel yaitu: a. Initial recruitment, yaitu proses pemilihan sekelompok folikel primordial yang akan masuk ke fase pertumbuhan dimana proses ini tidak tergantung gonadotropin. Sampai saat ini belum diketahui dengan jelas mekanisme yang mengatur jumlah dan pemilihan folikel yang memasuki initial recruitment. Proses yang dinamis ini berlangsung terus menerus mulai sejak neonatus sampai dengan menopause. b. Cyclic recruitment, yaitu pemilihan sekelompok folikel antral yang terselamatkan dari proses atresia karena dipengaruhi oleh gonadotropin. Pada siklus haid yang normal, umumnya hanya satu dari kelompok folikel ini yang terus tumbuh menjadi folikel dominan, kemudian mengalami ovulasi menghasilkan satu oosit. 15 Folikulogenesis membutuhkan waktu sekitar 85 hari dan sebagian besar waktu tersebut berlangsung dalam keadaan yang tidak dipengaruhi oleh regulasi hormonal (Griesinger, dkk., 2005; Speroff, dkk., 2010). 2.3 Diameter Folikel Folikulogenesis akan menghasilkan folikel dalam berbagai ukuran /diameter dimana diameter folikel tersebut diduga dapat dipakai sebagai salah satu prediktor untuk mengetahui kualitas oosit (McGee dan Hsueh, 2000; Ebner, dkk., 2003). Diameter folikel mencerminkan besar folikel sehubungan dengan bahwa 90% folikel betuk bulat penuh dan 10% bulat lonjong (Speroff, dkk., 2010). Cairan yang berada didalam folikel berasal dari sekresi sel granulosa dan sel teka yang merupakan kumpulan sel yang membentuk folikel dalam zona pelusida. Kualitas oosit berkaitan dengan morfologi oosit seperti terbentuknya PB-I dan granulasi berperan penting dalam upaya meningkatkan kualitas embrio yang pada akhirnya juga meningkatkan keberhasilan TRB itu sendiri. 2.4 Oogenesis Oogenesis adalah proses perubahan secara sitologi-histologi-anatomi dari oogonia sampai dengan terbentuknya oosit matur. Tujuan oogenesis adalah menghasilkan oosit matur yang terjadi pada korteks ovarium. Pada siklus alamiah, oosit matur yang dihasilkan pada oogenesis merupakan rujukan kualitas oosit yang berkualitas baik. Oogenesis dibedakan atas 2 tahapan yaitu (Speroff, dkk., 2010): 16 2.4.1 Pematangan pranatal Ketika se-sel benih primordial tiba di kelenjar kelamin yang secara genetik wanita, terjadi diferensiasi menjadi oogonia. Diferensiasi sel benih primordial menjadi oogonia dimulai segera setelah tiba di ovarium. Menjelang bulan ketiga masa perkembangan, beberapa oogonia menjadi oosit primer yang masuk ke profase pembelahan meiosis pertama. Tahap profase ini dapat berlangsung selama 40 tahun atau lebih dan akan selesai bila sel tersebut memulai tahap pematangan akhir. Selama tahap profase ini, oosit primer mengandung 46 kromosom bersusun ganda. Sel ini mengalami sejumlah pembelahan mitosis dan pada akhir bulan ketiga tersusun dalam kelompok-kelompok yang dikelilingi oleh selapis sel epitel gepeng. Semua oogonia di dalam satu kelompok mungkin berasal dan satu sel benih primordial. Sedangkan sel epitel gepeng yang dikenal sebagai sel folikel berasal dari epitel permukaan yang membungkus ovarium. Pada janin usia empat bulan, oogonia terkumpul dalam kelompok dibagian korteks ovarium. Sel-sel tersebut sebagian besar membelah terus, tetapi beberapa diantaranya berdiferensiasi menjadi oosit primer yang jauh lebih besar dan sudah memasuki tahap profase pembelahan miosis pertama. Pada bulan-bulan berikutnya, jumlah oogonia meningkat dengan cepat. Menjelang bulan kelima, jumlah keseluruhan oosit di dalam ovarium mencapai puncaknya yaitu sekitar 7 juta. Pada saat ini, mulai terjadi kematian sel dan banyak oogonia maupun oosit primer menjadi atretik. Menjelang bulan ketujuh, sebagian besar oogonia berdegenerasi, kecuali beberapa yang letaknya dekat dengan permukaan. Akan tetapi, semua oosit primer yang masih bertahan hidup 17 sudah memasuki pembelahan meiosis pertama, dan kini sebagian besar di antaranya dikelilingi oleh selapis sel epitel gepeng. Sebuah oosit primer, bersama dengan sel epitel gepeng yang mengelilinginya dikenal sebagai folikel primordial. Pada janin usia 7 bulan, hampir semua oogonia berubah menjadi oosit primer dalam tahap profase pembelahan meiosis pertama. Pada saat lahir, oogonia tidak ditemukan. Setiap oosit primer dikelilingi oleh selapis sel folikuler sehingga membentuk folikel primordial. Oosit telah memasuki fase diploten dan fase ini dipertahankan hingga tepat sebelum saat ovulasi. Kemudian, oosit ini memasuki tahap metafase pembelahan meiosis pertama. 2.4.2 Pematangan postnatal Menjelang saat kelahiran, semua oosit primer telah berada pada profase pembelahan meiosis pertama, tetapi tidak memasuki metafase melainkan beralih ke tahap diploten. Tahap diploten adalah suatu masa istirahat selama profase yang ditandai oleh adanya jalinan halus kromatin. Oosit primer tetap berada dalam tahap profase dan tidak menyelesaikan pembelahan meiosis pertamanya sebelum mencapai masa pubertas, rupanya disebabkan oleh penghambat pematangan oosit, suatu zat yang dikeluarkan oleh sel folikuler. Jumlah seluruh oosit primer pada waktu lahir diperkirakan berkisar antara 700 ribu sampai 2 juta. Selama dua tahun masa kanak-kanak berikutnya, sebagian besar oosit menjadi atresia; kira-kira hanya tinggal 400.000 menjelang permulaan masa pubertas. Dan, kurang dari 500 akan mengalami ovulasi sepanjang masa reproduksi seorang wanita (Wallace dan Kelsey, 2004; Speroff, dkk., 2010). Penting diketahui bahwa beberapa oosit yang mencapai kematangan pada usia lanjut, menjalani masa tidak aktif dalam tahap 18 diploten pembelahan mitosis pertama selama 40 tahun atau lebih. Sampai sekarang belum diketahui apakah tahap diploten merupakan fase yang paling sesuai untuk melindungi oosit terhadap pengaruh lingkungan yang mempengaruhi ovarium sepanjang hidup. Angka kejadian anak yang mengalami kelainan kromosom bertambah besar sesuai dengan bertambahnya usia ibu. Hal ini diduga berkaitan dengan semakin lama berlangsungnya meiosis maka oosit primer semakin mudah mengalami kerusakan (Baart, dkk., 2007; Speroff, dkk., 2005). Memasuki pubertas, 5-15 folikel primordial mulai mencapai kematangan pada setiap daur ovarium. Oosit primer pada tahap diploten ini mulai membesar, sementara sel folikuler yang mengelilinginya berubah bentuk dan gepeng menjadi kuboid dan berproliferasi membentuk epitel bertingkat sel granulosa. Folikel ini sekarang disebut folikel primer. Sel granulosa terletak di atas suatu membran basalis yang memisahkannya dan sel stroma sekelilingnya yang membentuk teka folikel. Disamping itu, sel-sel granulosa dan oosit mengeluarkan suatu lapisan glikoprotein pada permukaan oosit tersebut sehingga membentuk zona pelusida. Karena folikel terus berkembang maka sel-sel teka folikel tersusun menjadi satu lapisan dalam sel sekretoris teka interna dan satu lapisan luar jaringan ikat yang mengandung sel-sel mirip fibroblas berupa teka eksterna. Juga, tonjol-tonjolan kecil sel folikuler yang menyerupai jari-jari menjulur melintasi zona pelusida dan saling terjalin dengan mikrovili membrana plasma oosit tersebut. Tonjol-tonjolan ini diperkirakan penting untuk pengangkutan zat-zat menuju ke oosit (Wallace dan Kelsey, 2004; Speroff, dkk., 2010). 19 Perkembangan berlanjut terus, ruang-ruang yang terisi cairan tampak di antara sel-sel granulosa dan ruang-ruang ini saling bergabung terbentuklah antrum dimana folikel ini disebut folikel sekunder. Pada mulanya, antrum berbentuk bulan sabit tetapi makin lama makin membesar. Sel granulosa di sekitar oosit tetap utuh dan membentuk kumulus ooforus. Sesuai dengan pematangannya, folikel yang diameternya bisa 10 mm atau lebih dikenal sebagai folikel tersier / vesikuler / folikel de Graaf. Folikel ini dikelilingi oleh teka interna yang disusun oleh sel-sel yang mempunyai ciri khas sekresi steroid yang kaya pembuluh darah. Dan, teka eksterna yang berangsur-angsur menyatu dengan stroma ovarium (Speroff, dkk., 2010). Bersamaan dengan setiap daur ovarium, sejumlah folikel mulai berkembang, tetapi biasanya hanya satu saja yang mencapai kematangan penuh. Sedangkan, folikel yang lain berdegenerasi dan menjadi atretik. Segera setelah folikel tersebut rnatang, oosit primer melanjutkan pembelahan meiosis pertama dan menghasilkan dua sel anak yang tidak sama besar tetapi masing-masing membawa 23 kromosom bersusun ganda. Satu sel oosit sekunder menerima seluruh sitoplasma sedangkan yang lain menerima badan kutub pertama sehingga praktis tidak memperoleh sitoplasma. Hal ini terletak di antara zona pelusida dan selaput sel oosit sekunder di ruang perivitelina. Pembelahan meiosis pertama berlangsung sesaat sebelum ovulasi (Speroff, dkk., 2010). Setelah pembelahan pematangan pertama selesai dan sebelum inti oosit sekunder kembali dalam stadium istirahatnya, sel memasuki pembelahan pematangan kedua tanpa replikasi DNA. Pada saat oosit sekunder memperlihatkan 20 pembentukan kumparan dengan kromosom berjajar lurus pada sediaan metafase, terjadilah ovulasi dan oosit dilepaskan dari ovarium. Pembelahan pematangan kedua hanyaakan berlangsung apabila terjadi fertlisasi. Apabila tidak terjadi fertilisasi maka sel akan berdegenerasi kurang lebih 24 jam setelah ovulasi (Speroff dkk, 2010). Tidak diketahui dengan pasti apakah badan kutub pertama selalu mengalami pembelahan kedua atau tidak tetapi pernah ditemukan sel telur yang telah dibuahi disertai oleh tiga buah badan kutub. Terdapat kesan bahwa pada FIV dimana dilakukan stimulasi ovarium dengan siklus GnRH analog, diameter folikel tidak menunjukkan kualitas oosit (Ebner, dkk., 2003; Depalo, dkk., 2009). Maturasi oosit terdiri dari dua proses yang saling berhubungan dan saling tergantung satu sama lain yaitu maturasi sitoplasma dan maturasi inti. Maturasi sitoplasma meliputi perubahan-perubahan sitoplasma seperti redistribusi organela, perubahan mikro dan makro molekuler yang terjadi selama maturasi oosit. Perubahan ini akan memungkinkan oosit mampu melakukan (Navarro, dkk., 2009; Speroff, dkk., 2005): 1. Maturasi inti 2. Fertilisasi yang berhasil 3. Pembelahan 4. Perkembangan Selama proses maturasi oosit, maturitas inti mengalami perubahan kromatin yang dimulai sejak germinal vesikalis melewati meiosis I ke meiosis II. Berhentinya maturasi inti menyebabkan oosit berhenti pada metafase II. Pada stadium ini, oosit 21 secara fisiologis disiapkan untuk menyelesaikan pembelahan meiosis kedua saat fertilisasi. Hanya oosit yang telah tumbuh sempurna yang mampu menyelesaikan pembelahan meiosisnya (Speroff dkk, 2010). Dengan demikian, perubahanperubahan sitoplasma yang terjadi sebelum maturasi oosit penting dalam terjadinya kompetensi maturasi. Akan tetapi, berhentinya pertumbuhan oosit tidak absolut menentukan berhentinya maturasi inti. Bahkan, oosit yang telah menyelesaikan pertumbuhannya dapat mengalami maturasi sitoplasma parsial sehingga mengganggu maturasi inti. Jadi, ada hubungan yang sangat rumit diantara seluruh proses selama oogenesis yang menentukan kualitas oosit yang bisa dibuahi (Lasiene, 2009). 2.5 Polar Body Primer Polar body primer (PB-I) merupakan suatu struktur sel yang ditemukan di dalam sebuah oosit yang dikenal juga sebagai sel polar. Pembelahan sel yang tidak simetris mendorong pembentukan PB selama proses oogenesis. Untuk menghemat nutrisi, sebagian besar sitoplasma dipisah menjadi oosit sekunder saat meiosis pertama dan menjadi ovum saat meiosis kedua. Sel kedua yang tersisa dari proses meiosis, berukuran kecil dan mengandung relatif lebih sedikit sitoplasma dan akan menjadi PB yang pada akhirnya mengalami degenerasi (Depalo, dkk., 2009; Speroff, dkk., 2010). Di dalam oosit kemungkinan terdapat satu atau dua PB yaitu PB-I dan PBII. Polar body-I adalah salah satu dari dua produk pada tahap meiosis pertama yang mengandung haploid dengan 23 kromosom dan 46 kromatid, sedangkan PBII adalah haploid, dengan 23 kromosom dan 23 kromatid. Kadang-kadang PB-I 22 mengalami pembelahan meiosis yang kedua. Seperti sebuah telur matang yang melewati dua tahap proses pembelahan, pembelahan pertama akan terjadi saat ovulasi dan pembelahan kedua saat fertilisasi (Revelli, dkk., 2009; Speroff, dkk., 2010). Kadang kala, terdapat PB yang mengandung tiga haploid merupakan hasil dari proses pembelahan dimana pada dasarnya akan dibuang oleh sel telur. Dengan menganalisis PB akan dapat mengetahui status genetik oosit sehingga dapat melakukan tes untuk mengetahui kontribusi genetik ibu tehadap embrio. Adanya PB kembar merupakan sebuah hipotesis mekanisme kejadian kehamilan kembar pada wanita dimana sebuah PB yang tidak memisah dan dibuahi oleh spermatosit (Lewis, 2007; Sperroff, dkk., 2010). Akan tetapi beberapa perkembangan biasanya tidak akan terjadi karena PB-I tidak mengandung sitoplasma yang cukup (atau kuning telur, karena sel telur memiliki kuning telur) untuk memberi nutrisi embrio yang sedang berkembang (Bigalk, 2007). Bentuk ireguler atau fragmentasi dan ukuran PB-I berhubungan dengan kualitas embrio, perkembangan blastokis, tingkat implantasi atau aneuploidi (Navarro, dkk., 2009). Ebner, dkk., (2005) membedakan 4 gradasi PB sebagai berikut: 1. Gradasi 1 adalah PB oval dengan permukaan halus. 2. Gradasi 2 adalah PB oval dengan permukaan kasar. 3. Gradasi 3 adalah PB yang mengalami fragmentasi . 4. Gradasi 4 adalah PB yang berukuran besar. 2.6 Inklusi Sitoplasma Inklusi sitoplasma adalah struktur abnormal berupa benda asing dalam inti sel atau sitoplasma berbentuk bulat, oval atau badan yang tidak beraturan. Hal ini 23 memiliki sifat dan karakteristik pewarnaan yang berhubungan dengan infeksi virus tertentu seperti rabies / cacar dan bahan metabolik inaktif (Rienzi, dkk., 2010; Speroff, dkk., 2010). Inklusi sitoplasma dapat berupa simpanan makanan, hasil sekresi (seperti enzim, asam amino, dan mukosubstansi), bahan-bahan nutritif (seperti glukosa dan lemak), dan granula pigmen (melanin dan hemosiderin). Menurut Ebner, dkk., (2003), jenis inklusi sitoplasma adalah sebagai berikut: 1 Vacuoles yaitu adanya vakuola dalam sitoplasma oosit yang berisi cairan. 2 Refractile body yaitu inklusi sitoplasma dengan bermacam-macam ukuran berisi lipofusin. 3 Smooth endoplasmic reticulum (SER) cluster yaitu inklusi sitoplasma berbentuk elips di tengah sitoplasma. 4 Dark cluster yaitu daerah agak gelap dalam sitoplasma. Adanya inklusi sitoplasma berhubungan dengan penurunan kemampuan fertilisasi dan perkembangan embrio (Otsuki, dkk., 2007) dan tingkat kehamilan klinis (Loutradis, dkk., 1999). Menurut Wilding, dkk., (2001), oosit dengan inklusi sitoplasma juga memiliki kemampuan fertilisasi dan perkembangan embrio yang lebih rendah serta tingkat aneuploidi yang lebih tinggi. Menurut Griesinger, dkk., (2006), seleksi oosit sebelum fertilisasi / inseminasi pada FIV / ICSI sangat penting karena: 1. Memberikan informasi penting dalam hal kemungkinan kemampuan perkembangan embrio tersebut. 24 2. Membantu mengurangi jumlah inseminasi oosit dan karenanya mengurangi jumlah embrio yang dihasilkan. 3. Menghindari inseminasi oosit berkualitas jelek yang membawa risiko kelainan kromosom. 4. Membantu memilih jumlah oosit yang sesuai pada program donor sel telur. Namun, peniliaian kualitas oosit masih kontroversial dan pemilihan metode masih belum efektif. Adanya sel kumulus dan sel korona mengakibatkan evaluasi morfologi oosit sulit dilakukan. Kualitas dan derajat ekspansi sel-sel ini bukan petanda kualitas oosit yang baik dan sebagian besar tergantung pada protokol stimulasi ovarium yang digunakan. Adanya PB-I, biasanya dianggap sebagai petanda maturitas inti oosit yang baik (Sperof, dkk., 2005). Tetapi penelitian terakhir dengan mikroskop cahaya terpolarisasi menunjukkan bahwa pada oosit imatur juga terdapat PB-I (Ebner, dkk., 2005; Depalo, dkk., 2009). 2.7 Stimulasi Ovarium Pada Fertilisasi In Vitro Sampai saat ini ada beberapa cara stimulasi ovarium dalam kaitannya dengan TRB. Khusus pada FIV, cara stimulasi ovarium yang lazim dipakai adalah dengan GnRH analog (Murber, dkk., 2009). Kelebihan metode ini terutama adalah munculnya folikel multipel dan efek samping yang relatif rendah (Wilcox, dkk., 2005; Speroff, dkk., 2010). Pada TRB-FIV, pemberian GnRH agonis atau GnRH antagonis merupakan tahapan awal. Hal ini bertujuan untuk menekan sekresi GnRH dan gonadotropin endogen dengan harapan menghindari pengaruh gonadotropin endogen sehingga kadar gonadotropin dapat dikendalikan dan 25 menghindari lonjakan LH dini diluar pengamatan. Selain itu, petik ovum dapat diatur waktunya sesuai yang dikehendaki. Pemberian GnRH agonis dapat dengan metode protokol panjang atau dengan protokol pendek. Analisis komparatif tentang hasil penggunaan protokol dengan dan tanpa GnRH agonis memperlihatkan bahwa protokol agonis menghasilkan angka penurunan kejadian lonjakan LH dini, peningkatan jumlah oosit, angka kehamilan, dan angka kelahiran hidup (Samsulhadi dan Hendy, 2009; Speroff, dkk., 2010). Pemberian GnRH antagonis mempunyai efek inhibisi langsung pada sekresi gonadotropin. Molekul antagonis yang bersifat penghambat kompetitif menempati reseptor GnRH sehingga menghambat kerja GnRH endogen. Preparat GnRH antagonis menyebabkan supresi langsung tanpa flare up dan reseptor GnRH tidak berkurang. GnRH antagonis juga menyebabkan supresi hipofise yang lebih baik dibandingkan dengan GnRH agonis (Macklon dan Fauser, 2006; Permadi, 2008). Secara umum, stimulasi ovarium akan berhasil dengan baik bila digunakan pada pasien-pasien dengan respon ovarium yang baik. Keadaan ini dapat diketahui melalui pemeriksaan kadar hormonal basal yaitu pada hari ke-2 atau ke3 haid. Bila didapatkan kadar FSH basal > 12 IU/mL, apalagi sampai diatas 20 IU/mL, berhubungan dengan respon ovarium yang jelek. Tingginya kadar FSH ini berhubungan pula dengan meningkatnya usia penderita dimana peningkatan usia menyebabkan penurunan jumlah oosit dan kualitas oosit. Tingginya kadar estradiol pada hari ke-2 atau ke-3 haid yang melebihi 80 pg/mL juga dapat 26 memprediksi sulitnya terjadi proses kehamilan. Peningkatan kadar estradiol yang prematur berhubungan dengan recruitment folikel sebagai respon meningkatnya sekresi FSH. Bila kadar basal FSH dan estradiol tinggi pada hari ke-2 atau hari-3 haid menunjukkan respon ovarium terhadap stimulasi ovarium yang jelek (Teissier dkk, 2000; Speroff dkk, 2005). Bila hanya didasarkan pada kadar estradiol basal, protokol pendek digunakan bila kadar estradiol basal < 50 pg/mL. Protokol stimulasi ovarium GnRH antagonist short protocol, menekankan cara pemberian GnRH-a dan gonadotropin secara bersamaan yaitu pada saat awal fase proliferasi (hari ke-2 haid) sampai saat pemberian hCG (Oussaid, dkk., 2000; Nogueira dkk, 2006). Klinik Bayi Tabung Graha Tunjung Bag/SMF Obstetri dan Ginekologi FK Unud/RSUP Sanglah Denpasar dan Unit Bayi Tabung RS Prima Medika Denpasar, stimulasi ovarium menggunakan 2 jenis protokol yaitu: 2.7.1 Protokol pendek atau siklus GnRH antagonis 1. Hari ke-1 ditentukan sebagai hari pertama haid. 2. Hari ke-2 dilakukan pemeriksaan laboratorium lengkap,status hormonal basal dan USG transvaginal. 3. Hari ke-3 mulai dilakukan pemberian gonadotropin sampai hari ke-6. 4. Hari ke-7 dilakukan pemeriksaan sonografi transvaginal untuk memonitor perkembangan folikel dan pemeriksaan kadar estradiol. Pada tahapan ini dapat diputuskan untuk membatalkan siklus pengobatan atau melanjutkan ke tahapan berikutnya. Bila pada saat ini 27 didapatkan perkembangan folikel > 15mm dan kadar estradiol adekuat dilakukan pemberian 0.125mg CTT. 5. Hari ke 10 dilakukan pemeriksaan sonografi transvaginal dan kadar estradiol, bila didapatkan 3 buah folikel 18mm dilakukan penyuntikan hCG 5000-10.000 IU pada malam hari. 6. Hari petik ovum ditentukan 34-36 jam setelah pemberian hCG. Petik ovum dilakukan di kamar operasi dibawah anestesi umum melalui transvaginal oocyte retrieval dengan bantuan USG, 7. Hari pertama pasca petik ovum (PO+1) dapat dipastikan terjadinya fertilisasi. 8. Dokter dapat memberitahukan hasilnya kepada pasien dan menentukan hari atau waktu transfer embrio 9. Hari ke-2 dan ke-3 pasca petik ovum (PO+2/3) merupakan waktu alternatif untuk transfer embrio. Hari ke-5, 8, dan 11 merupakan waktu untuk penunjang fase luteal dengan pemberian hCG 1500 IU. 10. Hari ke-15 pasca petik ovum jika belum terjadi haid dilakukan pemeriksaan β-hCG. Kehamilan secara kimiawi ditentukan dengan kadar β-hCG = 50mIU/mL dan kadar estradiol > 3000 pg/m. 2.7.2 Protokol panjang atau siklus GnRH agonis Pada protokol panjang, GnRH agonis dapat juga diberikan mulai fase folikular dini yaitu hari ke 2 menstruasi siklus sebelumnya yang disebut long follicular protocol. Obat GnRH-a diberikan sampai hari ke 9 atau 10, sehari sebelum pemberian hCG pada siklus berikutnya. Pemberian GnRH agonis dapat 28 juga dimulai pada fase midluteal, sekitar satu minggu setelah ovulasi yaitu hari ke 21 pada siklus sebelumnya; disebut long luteal protocol. Obat GnRH-a diberikan sampai hari ke 9 atau 10 atau sampai saat pemberian hCG pada siklus berikutnya. Pemberian gonadotropin mulai hari ke 2 atau 3 siklus menstruasi sampai hari ke 9 atau 10 atau sampai pemberian hCG pada siklus berikutnya (Speroff, dkk., 2010). Obat GnRH diberikan sampai terdapat keyakinan bahwa fungsi hipofise dapat ditekan secara total. Dari beberapa penelitian, diperoleh penggunaan protokol panjang memberikan angka kehamilan yang lebih baik dibanding dengan protokol pendek. Walaupun protokol panjang menghasilkan angka kehamilan yang lebih banyak, terdapat kekhawatiran timbulnya dampak negatif seperti blokade total hipofise sehingga mengakibatkan terjadinya desensitisasi total dan biaya yang lebih mahal mengingat penggunaan obat-obatan dibutuhkan lebih banyak. Selain itu, juga dikhawatirkan bahwa desensitisasi yang terjadi tidak sepenuhnya dapat dipulihkan dalam waktu yang singkat untuk mengembalikan fungsi hipofise. Hal ini didukung dengan adanya penurunan aktifitas enzim aromatase, produksi progesteron, dan penurunan reseptor LH sebanyak 83%. Lonjakan LH dini juga dicegah dengan pemberian GnRH antagonis. Stimulasi ovarium dengan GnRH antagonis disebut juga GnRH antagonist short protocol berkembang sejak tahun 1990-an. GnRH antagonis bekerja langsung menekan sekresi gonadotropin, tidak ada flare up, durasi kerjanya juga lebih pendek dibanding GnRH agonis. Oleh karenanya GnRH antagonis diberikan hanya pada saat bahaya lonjakan LH endogen mulai mengancam. Pemberian GnRH antagonis 29 pada protokol antagonis ini dapat diberikan secara dosis tunggal dan multipel yaitu pada hari ke 8-12 (Speroff, dkk., 2010).