Registrasi Obat Jadi
advertisement

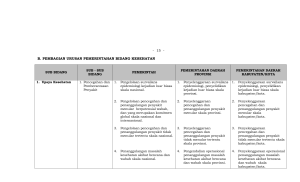
Registrasi Obat Jadi Definisi • Registrasi : prosedur pendaftaran dan evaluasi obat utk mendapatkan izin edar • Izin edar : bentuk persetujuan registrasi obat utk dapat diedarkan di wil.Indonesia • Obat yg diedarkan di wil Indonesia, sebelumya harus dilakukan registrasi utk memperoleh izin edar, kecuali : obat penggunaan khusus atau permintaan dokter; obat donasi; obat utk uji klinik; obat sampel utk registrasi Obat yg memiliki izin edar harus memenuhi kriteria berikut : • Khasiat yg meyakinkan dan keamanan yg memadai dibuktikan melalui percobaan pra klinis dan klinis atau bukti2 lain sesuai dg status perkembangan ilmu pengetahuan yg bersangkutan • Mutu yg memenuhi syarat yg dinilai dari proses produksi sesuai CPOB, spesifikasi dan metoda pengujian thd semua bahan yg digunakan serta produk jadi dg bukti sahih • Penandaan berisi informasi yg lengkap dan obyektif yg dpt menjamin penggunaan obat scr tepat, rasional, dan aman • Sesuai dg kebutuhan nyata masyarakat • Khusus utk psikotropika harus memiliki keunggulan kemanfaatan dan keamanan dibandingkan dg obat standar dan obat yg telah disetujui beredar di Indonesia utk indikasi yg diklaim • Khusus kontrasepsi utk program nasional dan obat program lainnya yg akan ditentukan kemudian, harus dilakukan uji klinik di Indonesia Kategori registrasi obat • Registrasi baru • Registrasi variasi • Registrasi ulang kategori 7 Registrasi baru • Kategori 1 : registrasi obat baru dan produk biologi, termasuk produk biologi sejenis (PBS) • Kategori 2 : registrasi obat copy • Kategori 3 : registrasi sediaan lain yg mengandung obat Registrasi baru Obat Baru • Zat Berkhasiat Baru • Indikasi Baru • Bentuk Sediaan/Cara Pemberian Baru Produk Biologi Obat Kopi/ me too product • Obat yang berkhasiat sama dengan obat yang sudah terdaftar Registrasi variasi • Kategori 4 : registrasi variasi major (VaMa) • Kategori 5 : registrasi variasi minor yg memerlukan persetujuan (VaMi-B) • Kategori 6 : registrasi variasi minor dengan notifikasi (VaMi-A) Registrasi Obat Narkotika • Registrasi hanya dapat dilakukan oleh industri farmasi yg memiliki izin khusus untuk memproduksi narkotika dari menteri • Industri tsb wajib memenuhi persyaratan CPOB yg dibuktikan dg sertifikat CPOB yg dikeluarkan oleh kepala Badan Registrasi Obat Kontrak • Registrasi dilakukan oleh industri farmasi pemberi kontrak, dengan melampirkan dokumen kontrak • Industri farmasi pemberi kontrak wajib memiliki izin industri farmasi dan sekurang2nya memiliki 1 fasilitas produksi sediaan lain yg telah memenuhi persyaratan CPOB • Industri farmasi pemberi kontrak bertanggung jawab atas mutu obat jadi yg diproduksi berdasarkan kontrak • Penerima kontrak adl industri farmasi dan telah menerapkan CPOB utk sediaan yg dikontrakkan Registrasi Obat Impor • Obat yg diimpor diutamakan untuk obat program kesehatan masyarakat, obat penemuan baru dan obat yg dibutuhkan tapi tidak dpt diproduksi di dalam negeri • Registrasi dilakukan oleh industri farmasi dalam negeri yg mendapat persetujuan tertulis dari industri farmasi di luar negeri • Persetujuan tsb harus mencakup alih teknologi dg ketentuan paling lambat dlm jangka waktu 5 tahun harus sdh dpt diproduksi di dalam negeri, kecuali obat yg masih dilindungi paten • Industri farmasi di luar negeri wajib memenuhi persyaratan CPOB yg dibuktikan dg dokumen yg dilengkapi dg data inspeksi terakhir paling lama 2 tahun yg dikeluarkan oleh pejabat berwenang setempat atau jika diperlukan dilakukan pemeriksaan setempat oleh petugas yg berwenang yg ditetapkan oleh kepala Badan Registrasi Obat khusus Ekspor • Hanya dilakukan oleh industri farmasi • Harus memenuhi kriteria khasiat dan mutu • Harus memenuhi ketentuan lain yg dipersyaratkan dari negara tujuan Registrasi obat yg dilindungi paten • Registrasi dilakukan oleh industri farmasi dalam negeri pemegang hak paten atau industri farmasi lain yg ditunjuk oleh pemegang hak paten • Hak paten dibuktikan dengan sertifikat paten • Registrasi oleh industri farmasi dalam negeri bukan pemegang hak paten dapat diajukan mulai 2 tahun sebelum berakhirnya perlindungan hak paten • Bila registrasi disetujui, obat bersangkutan hanya boleh diedarkan setelah habis masa perlindungan paten obat inovator Prosedur Pendaftaran Obat Jadi • Ada dua tahapan Registrasi Obat, yaitu: • Pra Registrasi Untuk pertimbangan jalur evaluasi dan kelengkapan dokumen registrasi – Obat Baru (Jalur I: 100 HK, Jalur II: 150 HK, Jalur III: 300 HK) – Obat Copy (Jalur I: 100 HK, Jalur III: 80 HK atau 150 HK) • Konsultasi kelengkapan dan persyaratan dokumen registrasi Registrasi Penyerahan dokumen registrasi dengan persyaratan sbb: – Mengisi form permintaan disket sesuai hasil Pra Registrasi atau surat permohonan – Membayar biaya evaluasi – Mengisi disket – Menyerahkan berkas lengkap sesuai tujuan registrasi Siapakah yang Mengajukan Pendaftaran? Industri Farmasi utk : • Obat Jadi Lokal dan kontrak • Obat Jadi Lisensi • Obat Jadi Impor Pedagang Besar Farmasi (PBF) untuk: • Obat Jadi Impor DATA ADMINISTRASI PENDAFTARAN OBAT Produksi Dalam Negeri • Fotokopi izin industri farmasi • Fotokopi sertifikat CPOB Kontrak • Fotokopi izin industri farmasi pendaftar dan penerima kontrak • Fotokopi perjanjian kontrak • Fotokopi sertifikat CPOB penerima kontrak dan pendaftar DATA ADMINISTRASI PENDAFTARAN OBAT Lisensi • Persyaratan sama dengan produksi dalam negeri disertai dengan: • Perjanjian lisensi Impor • Fotokopi izin industri farmasi / PBF • Surat penunjukan dari pemilik produk di luar negeri • Certificate of Pharmaceutical Product /Free sale certificate (asli) dari negara produsen • Site master file : produsen yang produknya belum memiliki izin edar di Indonesia atau kondisi tertentu DATA TEKNIS PEDAFTARAN OBAT Data Teknis • Form A • Form B • Form C1 (Data mutu dan teknologi) • Form C2,C3,C4,C5,D2,D3,D4,D5 (Data khasiat dan keamanan) • Kemasan DATA TEKNIS PEDAFTARAN OBAT Kelengkapan data teknis yg harus diserahkan : • Obat Baru : A,B,C,D,E • Obat Copy dan Produk Biologi : A,B,C,E Perubahan : – Tambah/perubahan kemasan : • Beda jenis kemasan : A, C, E • Beda besar kemasan : A, E – Perubahan disain kemasan / logo : A, E – Perubahan redaksional brosur (tanpa uji preklinik/klinik) • No. izin edar yang habis masa berlaku : A, B, C, E • No. izin edar yang masih berlaku : A, B (yang berubah), E – – – – – – – • Perubahan lokal menjadi impor atau sebaliknya : A, B, C, E Perubahan produsen : A, B, C, E Perubahan nama produsen/ pemberi lisensi : A, E Perubahan importir : A, E Perubahan golongan obat : A, B, C, E, data pendukung Perubahan formula : A, B, C, E Perubahan bentuk sediaan (Tidak termasuk bentuk sediaan baru) : A,B,C,E Semua Form di atas dapat diperoleh di tempat/loket pendaftaran Tempat/loket pendaftaran Obat Jadi Direktorat Penilaian Obat dan Produk Biologi Badan Pengawas Obat dan Makanan Gedung D Lt.1 - Jl. percetakan Negara no. 23 Jakarta 10560 Telepon/Fax: 4245459 ext. 105 dan 110, Email : [email protected] • Registrasi dikenakan biaya sesuai peraturan perundangan • Kepala Badan melaporkan izin edar kepada menteri satu tahun sekali • Bila registrasi obat ditolak, biaya registrasi obat tdk dpt ditarik kembali • Bila registrasi obat ditolak, pendaftar dapat mengajukan keberatan melalui tata cara peninjauan kembali • Izin edar berlaku 5 tahun dan dapat diperpanjang selama memenuhi kriteria yg berlaku Biaya PENDAFTARAN DAN EVALUASI SATUAN TARIF Obat dengan zat aktif baru,produk biologi, kombinasi baru Per Item Rp 30.000.000,00 Obat copy dengan nama dagang Per Item Rp 7.500.000,00 Obat copy dengan nama generik Per Item Rp 2.000.000,00 Pra registrasi Per Item Rp 1.000.000,00 Registrasi ulang Per Item Rp 5.000.000,00 Registrasi ulang obat generik Per Item Rp 1.000.000,00 Produk fitofarmaka Per Item Rp 6.000.000,00 Pelaksanaan izin edar • Pendaftar yg mendapat izin edar wajib memproduksi atau mengimpor dan mengedarkan selambat-lambatnya 1 tahun setelah tanggal persetujuan dikeluarkan yg dilaporkan kepada kepala badan Siklus Hidup Produk Farmasi • Keuntungan industri farmasi berada pada ranking ke-4 setelah industri software, perminyakan, dan makanan. • Dibanding rata-rata industri, keuntungan perusahaan farmasi lebih besar yaitu 13.27% dibanding dengan rata-rata 10.19%. • Mekanisme mendapat keuntungan ini dipengaruhi berbagai sifat khas industri farmasi yang tidak dijumpai pada industri lain. • Salah satu sifat tersebut adalah adanya Barriers to Entry yang akan mempengaruhi harga obat. • Hambatan untuk masuk ke industri farmasi dilakukan dalam berbagai bentuk: (1) regulasi obat; (2) hak paten; dan (3) sistem distribusi. Ekivalensi • Ekivalensi farmasetik : Dua produk obat mempunyai ekivalensi farmaseutik jika keduanya mengandung zat aktif yang sama dalam jumlah yang sama dan bentuk sediaan yang sama • Alternatif farmasetik :Dua produk obat merupakan alternatif farmaseutik jika keduanya mengandung zat aktif yang sama tetapi berbeda dalam bentuk kimia (garam, ester, dsb.) atau bentuk sediaan atau kekuatan Ekivalensi • Ekivalensi terapeutik : Dua produk obat mempunyai ekivalensi terapetik jika keduanya mempunyai ekivalensi farmaseutik atau merupakan alternatif farmaseutik dan pada pemberian dengan dosis molar yang sama akan menghasilkan efikasi klinik dan keamanan yang sebanding. • Dengan demikian, ekivalensi/inekivalensi terapeutik seharusnya ditunjukkan dengan uji klinik. Bioekivalensi • Dua produk obat disebut bioekivalen jika keduanya mempunyai ekivalensi farmaseutik atau merupakan alternatif farmaseutik dan pada pemberian dengan dosis molar yang sama akan menghasilkan biovailabilitas yang sebanding sehingga efeknya akan sama, dalam hal efikasi maupun keamanan. • Jika bioavailabilitasnya tidak memenuhi kriteria bioekivalen maka kedua produk obat tersebut disebut bioinekivalen. Uji Ekivalensi • Uji ekivalensi terdiri atas : a. Uji Bioekivalensi (uji in vivo); atau b. Uji Disolusi Terbanding (uji in vitro). Kriteria untuk ekivalensi Produk obat yg memerlukan uji in vivo : • Uji ekivalensi in vivo dapat berupa studi bioekivalensi farmakokinetik, studi farmakodinamik komparatif, atau uji klinik komparatif. • Dokumentasi ekivalensi in vivo diperlukan jika ada resiko bahwa peredaran bioavailabilitas dapat menyebarkan inekivalensi terapi. • Contoh : critical use drugs, obat2 index terapi sempit, perbedaan eksipien yg menyebabkan bioinekivalensi, obat2 yg bekerja sistemik, obat2 non parenteral non sistemik (oral, nasal, okular, dermal, rektal, vaginal, dsb) yg dikhawatirkan terjadi absorbsi sistemik yg tdk diinginkan Kriteria untuk ekivalensi Produk obat yg cukup dilakukan uji in vitro • Produk obat copy dengan kekuatan lebih rendah • Produk obat copy yang masuk kategori BCS kelas 1 dan 3 Kriteria untuk ekivalensi Produk obat yg tdk memerlukan uji ekivalensi: • Produk obat copy yg mengandung zat aktif yg sama dalam kadar molar yg sama serta eksipien yg sama/mirip dg produk pembanding. • Produk obat copy berupa bubuk untuk dilarutkan • Produk obat copy berupa gas Desain uji bioekivalensi • Studi bioekivalensi (BE) adalah studi bioavailabilitas (BA) komparatif yang dirancang untuk menunjukkan bioekivalensi antara produk uji (suatu produk obat copy) dengan produk obat inovator/pembandingan. • Caranya dengan membandingkan profil kadar obat dalam darah atau urin antara produk-produk yang dibandingkan pada subyek manusia. • Karena itu desain dan pelaksanaan studi BE harus mengikuti Pedoman Cara Uji klinik yang Baik (CUKB), termasuk harus lolos kaji Etik. Desain uji bioekivalensi • Uji bioekivalensi dilakukan menggunakan desain menyilang 2-way atau 2 kelompok paralel • Obat diberikan dosis tunggal • Dilakukan kepada sukarelawan sehat, kecuali untuk obat yg terlalu toksik (dilakukan pada penderita dg indikasi tertentu) • Jumlah subjek uji min.12 dan maks.40 orang, biasanya 18-24 orang Appendix Notes: Largest products (U.S.:>=$500Mn, Others: Top 2-5) with protection expiries in the 2012-2016 period, listed in descending order by country sales in constant US$ at Q4 2011 exchange rates. Estimates of protection expiry from information available as of March 31, 2012. Source: IMS MIDAS, May 2012 Protection Expiry Year US Japan UK France Germany 2012 Plavix Seroquel Singulair Actos Lexapro Diovan Diovan HCT® Geodon Viagra Boniva Oxycontin® Aciphex Zometa Xeloda Opana ER Asacol Nu Lotan Myslee Preminent Haigou Seroquel Lipitor Amias Seroquel Aricept® Singulair Tahor Singulair Pariet Ixprim Aprovel Seroquel Atacand Atacand Plus Sortis Aricept Diovan Plavix Livalo Elplat Viagra Xeloda Seretide Coaprovel Xeloda Micardis Viagra Viani Zometa Atmadisc Coaprovel Viagra 2014 Nexium® Cymbalta Celebrex Symbicort Lunesta Restasis Evista Sandostatin LAR Actonel Prograf Glivec Abilify Abilify Cipralex Risperdal Consta Seroplex Abilify Ebixa Risperdal Consta LP Axura Risperdal Consta Blopress Plus 2015 Abilify Copaxone Gleevec Namenda Provigil Combivent Zyvox Prezista Avodart Zyprexa Adoair Alimta Spiriva Symbicort Spiriva Cymbalta Alimta Alimta Spiriva Copaxone Protelos Cymbalta Spiriva Copaxone Alimta Cymbalta 2013