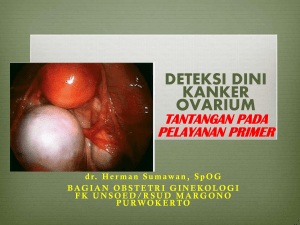
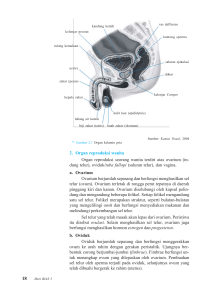
tidak ber hubungan dengan derajat diferensia si sel pada kanker
advertisement

EKSPRESI PRO TEIN B CELL LYMPHOMA-2 ( BCL2) TIDAK BER HUBUNGAN DENGAN DERAJAT DIFERENSIA SI SEL PADA KANKER OVARIUM EPITELIAL Dr. dr. Wayan Megadhana, Sp.OG(K) BAGIAN/S MF OBSTETRI DAN GINEKOLOGI FAKULTAS KE DOKTERAN UNIVERSITAS UDAYANA/ R SUP SANGLAH DENPASAR 2014 ABSTRAK EKSPRESI PROTEIN B CELL LYMPHOMA-2 (BCL-2) TIDAK BERHUBUNGAN DENGAN DERAJAT DIFERENSIASI SEL PADA KANKER OVARIUM EPITELIAL Kanker ovarium merupakan suatu keganasan di bidang ginekologi yang cukup banyak dijumpai di kalangan wanita.Sekitar 90 % dari kanker ovarium berasal dari jaringan epitelial.Berdasarkan penilaian mikroskopis, sel kanker ovarium epitelial dapat dibagi menjadi derajat diferensiasi baik, sedang, dan buruk. Ratusan gen terkait kanker telah ditemukan. Gen pengatur apoptosis merupakan salah satu gen yang penting karena dengan menurunnya proses apoptosis merupakan salah satu dari tujuh perubahan mendasar pada transformasi keganasan kanker. Mutasi sel pada gen yang mengatur proses apoptosis dapat menyebabkan sel kanker ovarium epitelial resisten terhadap apoptosis, sehingga sel dapat menyerupai atau gagal menyerupai sel normalnya. Salah satu gen yang berperan dalam proses apoptosis adalah gen Bcl-2. Overekspresi Bcl-2 dapat mencegah atau mengurangi kematian sel yang di induksi oleh berbagai macam stimulus. Dengan demikian maka dalam penelitian ini dilakukan untuk mencari hubungan antara ekspresi bcl-2 dengan derajat diferensiasi sel pada kanker ovarium epitelial Penelitian ini merupakan studi cross-sectional di Bagian Kebidanan dan Penyakit Kandungan, Patologi Anatomi dan Rekam Medis Rumah Sakit Umum Pusat (RSUP) Sanglah, Denpasar yang dilakukan mulai Januari 2012 sampai bulan Desember 2013 dengan sampel penelitian sebanyak 51 buah blok parafin. Sampel blok parafin ini dikelompokkan berdasarkan derajat diferensiasi kanker ovarium epitelial yaitu derajat diferensiasi baik, sedang dan buruk. Masingmasing kelompok derajat diferensiasi kanker ovarium epitelial dilakukan pemeriksaan ekspresi protein bcl-2 dengan teknik imunohistokimia, yang kemudian dilakukan analisis hubungan antara ekspresi protein bcl-2 pada kanker ovarium epitelial pada derajat diferensiasi baik, sedang dan buruk dengan menggunakan uji Spearman. Penelitian ini memperoleh rerata umur (P=0,217), paritas (P=0,809) dan Indek Massa Tubuh (IMT) (P=0,363), pada ketiga kelompok derajat diferensiasi kanker ovarium epitelial adalah homogen. Berdasarkan uji Spearman diperoleh tidak terdapat hubungan antara ekspresi protein bcl-2 dengan derajat diferensiasi sel pada kanker ovarium epitelial (r=0,217, P=0,127). Kata kunci: ekspresi protein bcl-2, kanker ovarium epitelial, derajat diferensiasi. ABSTRACT B CELL LYMPHOMA-2 (BCL-2) PROTEIN EXPRESSION DOES NOT RELATE WITH THE CELL DIFFERENTIATION DEGREE IN EPITHELIAL OVARIAN CANCER Ovarian cancer is a common gynecologic malignancy in women. Approximately 90% of ovarian cancers originate from epithelial tissue. Based on the microscopic cell assessment of epithelial ovarian cancer, it can be divided into well, moderate and poor grade differentiation. Hundreds of cancer-related genes have been found. Apoptosis regulating gene is one of the important genes because decrease in apoptotic process is one of the seven fundamental changes in the malignant transformation of cancer. Cells mutation in apoptotic regulating genes can lead to epithelial ovarian cancer cells resistant to apoptosis, so that the cells can resemble or fail to resemble normal cells. One of the genes that play a role in the process of apoptosis is the bcl-2 gene. Overexpression of bcl-2 can prevent or reduce cell death induced by various stimuli. Thus, this study was conducted to find the relationship between the protein expressions of BCL-2 with cell differentiation degree in epithelial ovarian cancer. This study was a cross-sectional study in the Obstetrics and Gynecology Department, Pathology Anatomy Department and Medical Records of Sanglah General Hospital, Denpasar held from January 2012 to December 2013, with 51 paraffin blocks as samples. Paraffin block samples were grouped based on the differentiation degree of the epithelial ovarian cancer such as well, moderate, and poor differentiated. BCL-2 protein expression was examined in each differentiation degree groups by immunohistochemical techniques, and they were analyzed for the relationship of BCL-2 protein expression in epithelial ovarian cancer with well, moderate and poor differentiation degree by using the Spearman test. The mean age (P=0.217), parity (P=0.809), and Body Mass Index (BMI) (P=0.363) in the three groups sample of the epithelial ovarian cancer differentiation degree was homogeneous. Based on the Spearman test, there was no correlation between the protein expression of BCL-2 with cell differentiation degree in epithelial ovarian cancer (r =0.217, P=0.127). Keywords: bcl-2 protein expression, epithelial ovarian cancer, differentiation degree BAB I PENDAHULUAN 1.1 Latar Belakang Kanker ovarium merupakan suatu keganasan di bidang ginekologi yang cukup banyak dijumpai di kalangan wanita.Sekitar 90 % dari kanker ovarium berasal dari jaringan epitelial. Kanker ovarium epitelial sering disebut sebagai “the silent killer” hal ini berkaitan dengan fatalitas dan prevalensi dari kanker ovarium yaitu gejalanya yang tidak spesifik, keterbatasan dalam upaya deteksi dini dan sering terlambat dalam penegakan diagnosis sehingga survival ratenya rendah . Di Amerika Serikat kanker ovarium merupakan salah satu penyebab utama kematian pada wanita yang disebabkan oleh penyakit keganasan ginekologi.Pada tahun 2006, ditemukan lebih dari 20.000 kasus baru kanker ovarium dan lebih dari 15.000 wanita meninggal dikarenakan penyakit ini (John et al, 2008).Di Indonesia kanker ovarium menduduki urutan terbanyak keenam dari keganasan pada wanita (Djuana et al, 2001). Angka kejadian kanker ovarium di Indonesia berdasarkan data Badan Registrasi Kanker pada tahun 2006 mencapai 5,99% (Badan Registrasi Kanker, 2006). Angka kejadian kanker ovarium di Rumah Sakit Umum Pusat (RSUP) Sanglah pada tahun 2005 sebesar 35% dari seluruh kanker ginekologi, dengan angka harapan hidup selama lima tahunnya hanya 15% (Karyana, 2005). 1 Patogenesis maupun penyebab kanker ovarium epitelial masih merupakan hipotesis, salah satu alur karsinogenesis kanker ovarium epitelial diketahui berkembang dari perubahan akumulasi genetik yang mengarah kepada transformasi keganasan dari kista jinak menjadi tumor LMP (Low malignantPotential) dan pada akhirnya berkembang menjadi kanker ovarium epitelial,dimana diketahui terjadi beberapa mutasi gen yang terlibat dalam alur karsinogenesis tersebut melalui perannya menghambat apoptosis seluler dan meningkatkan proliferasi seluler (Schorge, 2008). Perjalanan alamiah, etiologi serta histogenesis kanker ovarium masih belum banyak diketahui.Etiologi perubahan seluler yang berperan dalam perkembangan kanker ovarium didasari oleh perubahan yang terjadi pada tingkat molekuler serta terjadinya defek yang spesifik, hal ini menandakan bahwa perbedaan gambaran dan pola histologis pada kanker ovarium berhubungan dengan terjadinya defek yang berbeda-beda pada gen-gen yang mendasari setiap tipe fenotip histologisnya. Pengetahuan tentang aspek biologi molekuler yang bertanggung jawab terhadap pertumbuhan dan perkembangan sel kanker ovarium sangat penting dalam hal menentukan biomarker untuk deteksi dini, indikator prognosis atau luaran klinis, bahkan terhadap perkembangan terapi yang memiliki target spesifik pada gen atau protein tertentu yang mendasari proses karsinogenesis (Wheeler, 2001). Selama dua dekade terakhir, ratusan gen terkait kanker telah ditemukan. Gen pengatur apoptosis merupakan salah satu gen yang penting karena menurunnya proses apoptosis merupakan salah satu dari tujuh perubahan mendasar pada transformasi keganasan kanker (Robbins et al, 2010). B-cell lymphoma-2 2 merupakan gen pertama yang memiliki karakteristik jelas yang terlibat dalam programmed cell death (PCD) dengan menghambat apoptosis dan meningkatkankemampuan sel untuk bertahan hidup/survival (Maria et al, 1998). Protein BCL-2 berperan dalam mengontrol permeabilitas mitokondria dan mencegah kebocoran protein mitokondria seperti sitokorom c yang memiliki kemampuan untuk menginisiasi kematian sel (apoptosis).Overekspresi protein BCL-2 dapat mencegah atau secara nyata mengurangi kematian sel yang diinduksi oleh berbagai macam stimulus (John, 1994). Akibat mutasi pada gen yang berperan pada proses apoptosis, maka sel – sel kanker resisten terhadap apoptosis, mutasi tersebut menyebabkan sel dapat menyerupai atau gagal menyerupai sel normalnya (Robbins et al, 2010). Sel kanker secara mikroskopis dapat dinilai melalui derajat diferensiasi dan juga dapat digunakan untuk menentukan fitur morfologis, keagresifan atau sifat biologis dari sel kanker tersebut (Huston, 2006).Derajat diferensiasi karsinoma ovarium epitelial juga merupakan karakteristik histopatologi yang memiliki nilai prognostik dan relevansi terhadap terapi yang signifikan (Sato, et al., 2003). Belum banyak penelitian yang mencari hubungan langsung antara ekspresi BCL-2 dengan derajat diferensiasi sel pada kanker ovarium epitelial di Indonesia. Menurut Rauf et al (2004), ekspresi protein BCL-2 meningkat sesuai dengan makin buruknya derajat diferensiasi kanker. Penelitian ini memperlihatkan bahwa kelainan molekuler pada bcl-2 berhubungan dengan fenotip kanker ovarium. 3 Menurut Chan et al (2000), ekspresi protein BCL-2 pada kanker ovarium epitelial lebih kuat dideteksi pada derajat diferensiasi baik, dimana derajat diferensiasi sedang dan buruk menunjukkan ekspresi protein BCL-2 moderat. Dalam proses apoptosis dan karsinogenesis gen bcl-2 merupakan salah satu komponen yang berperan. Terdapat gen lain yang saling mempengaruhi berperan dalam proses tersebut diantaranya onkogen, gen yang terlibat sebagai pemicu pertumbuhan sel (her2-neu, ras, myc, dan cdk1), gen yang terlibat dalam inaktivasi gen supresor tumor (brca 1, brca 2 dan p53), gen pengatur apoptosis (bax), dan gen yang terlibat pada perbaikan DNA (brca 1 dan brca 2) (Kumar dkk., 2010). Sebagai contoh salah satu gen yang paling banyak diteliti bersama dengan gen bcl-2 adalah gen p53 dimana diketahui overekspresi protein P53 dapat menekan ekspresi protein BCL-2 (Preethi et al, 2002). Berdasarkan hal tersebut maka dalam penelitian ini dilakukan penilaian hubungan antara ekspresi protein BCL-2 dengan derajat diferensiasi sel pada kanker ovarium epitelial yang kemudian diharapkan dapat dimanfaatkan dalam menjelaskan patogenesis dan prognosis serta dapat dimanfaatkan sebagai target terapi kanker ovarium epitelial. 1.2 Rumusan Masalah Apakah ada hubungan antara ekspresi protein BCL-2 dengan derajat diferensiasi sel pada kanker ovarium epitelial? 1.3 Tujuan Penelitian Untuk mengetahui hubungan antara ekspresi protein BCL-2 dengan derajat diferensiasi sel pada kanker ovarium epitelial. 4 1.4 Manfaat Penelitian 1.4.1 Manfaat bagi pengetahuan 1. Untuk menambah pengetahuan mengenai hubungan ekspresi protein BCL-2 dihubungkan dengan derajat diferensiasi sel pada kanker ovarium epitelial. 2. Sebagai data dasar, acuan serta masukan untuk karsinogenesis molekuler kanker ovarium lebih lanjut. 1.4.1 Manfaat bagi pelayanan Hasil penelitian ini diharapkan menjadi masukan atau tambahan dalam upaya pemahaman protein BCL-2 dalam patogenesis, prognosis dan target terapi kanker ovarium sehingga penanganan pasien menjadi lebih tepat dan efisien. 5 BAB II KAJIAN PUSTAKA 2.1 Kanker Ovarium 2.1.1 Epidemiologi Insidensi kanker ovarium yang tertinggi terdapat di Swedia (19,6/100.000) dan Amerika Serikat (15,4/100.000), sedangkan insidensi yang terendah terdapat di Jepang (10,1/100.000). Di Amerika Serikat insidensi tertinggi kanker ovarium terdapat pada wanita kaukasia, wanita Afrika-Amerika intermediet, dan insidensi terendah pada wanita asli Amerika (John et al, 2008). Dari beberapa penelitian di Indonesia, Kartodimejo (1976) di Yogyakarta mendapatkan angka kejadian kanker ovarium sebesar 30,5% dari seluruh keganasan ginekologi, Gunawan (1979) di Surabaya mendapatkan 7,4% dari keganasan ginekologi, Danukusumo (1990) di Jakarta mendapatkan kejadian kanker ovarium sebesar 13,8% dari seluruh keganasan ginekologi, dan Fadlan (1993) di Medan pada tahun 1981–1990 melaporkan sebesar 10,64% dari seluruh keganasan ginekologi (Sahil, 2007). 2.1.2 Etiologi dan faktor risiko Faktor yang telah diketahui berkaitan dengan peningkatan risiko kanker ovarium adalah umur, paritas, indek massa tubuh (IMT) dan riwayat keluarga kanker ovarium. Risiko kejadian kanker ovarium meningkat seiring dengan bertambahnya umur.Sebanyak 80% dari kejadian kanker ovarium ditemukan pada umur wanita lebih dari 45 tahun (Fauzan, 2009). Kanker ovarium dapat 6 ditemukan pada semua golongan umur, bahkan pada kasus yang jarang, juga dapat ditemukan pada bayi di bawah lima tahun (balita) dan anak-anak. Namun angka kejadian paling banyak ditemukan pada rentang umur 60 sampai 74 tahun dengan median umur saat terdiagnosis adalah 59 tahun. Bahkan, risiko tumor ovarium untuk mangalami degradasi keganasan pun meningkat seiring dengan bertambahnya umur, di mana risiko keganasan didapatkan sebesar 13% pada wanita premenopause dan 45% postmenopause (Colditz, 2004). Paritas merupakan faktor genetik penting yang mempengaruhi risiko kanker ovarium.Risiko kanker ovarium menurun secara progresif dengan meningkatnya jumlah kehamilan (John, 2008).Pada wanita yang tidak memiliki anak atau nullipara memiliki risiko dua kali lipat lebih besar untuk terjadinya kanker ovarium daripada wanita dengan paritas tiga atau lebih (Granstrom, 2008). Berbagai penelitian membuktikan bahwa peningkatan IMT dapat meingkatkan risiko terjadinya kanker ovarium (Reeves, 2007). Penelitian yang dilakukan oleh European Prospective Investigation into Cancer and Nutrition tahun 2006 memperoleh hasil bahwa pada wanita dengan IMT di atas 30 atau obesitas memiliki risiko relatif sebesar 1,59 untuk terjadinya kanker ovarium dibandingan dengan wanita dengan IMT normal (Lahmann, 2009). Penelitian yang berbeda memperoleh hasil bahwa peningkatan IMT pada wanita premenopause meningkatkan risiko terjadinya kanker ovarium dengan risiko relatif sebesar 1,72. Namun peningkatan IMT tersebut tidak bermakna meningkatkan risiko terjadinya kanker ovarium pada wanita pascamenopause (Schouten et al, 2008). 7 Risiko wanita Amerika untuk menderita kanker ovarium dengan tanpa riwayat keluarga dari penyakit ini adalah 1 per 70 wanita (1,4%) (John, 2008). Secara umum, risiko terjadinya kanker ovarium adalah 1,6% pada keseluruhan populasi. Risiko tersebut dapat meningkat sampai 4-5% apabila ada satu anggota keluarga, baik ibu atau saudara kandung, menderita kanker ovarium.Sedangkan apabila terdapat dua anggota keluarga yang menderita kanker ovarium, maka risiko menderita kanker ovarium meningkat menjadi 7%.Adanya riwayat kanker payudara dan kolon juga dapat meningkatkan risiko terjadinya kanker ovarium pada anggota keluarga yang lainnya (Busman, 2008). Penggunaan kontrasepsi oral juga menunjukkan penurunan risiko kanker ovarium. Risiko kanker ovarium menurun kira – kira 11% sampai maksimal 46% per tahun pada penggunaan kontrasepsi oral setelah lima tahun penggunaan (John, 2008). Dari berbagai observasi maka didapatkan beberapa teori – teori etiologi kanker ovarium.Teori pertama adalah teori incessant ovulasi.Berdasarkan teori ini, risiko kanker ovarium epitelial berkaitan secara langsung dengan jumlah siklus ovulasi yang belum terganggu. Saat ovulasi, permukaan epitelium rusak kemudian akan mengalami proliferasi dan perbaikan yang cepat. Pada saat ovulasi, terjadi invaginasi dari permukaan epitelium ke stroma dibawahnya yang akan membentuk kista inklusi. Garis epitelium dari kista inklusi tersebut kemudian akan mengalami transformasi neoplasma dibawah pengaruh dari faktor – faktor onkogen. Observasi pada menarche pada usia yang sangat muda dan menopause yang terlambat berkaitan dengan peningkatan risiko kanker ovarium, 8 hal tersebut konsisten dengan teori ini, karena keduanya dapat meningkatkan jumlah dari siklus ovulasi (John et al, 2008). Teori kedua dari karsinogenesis ovarium adalah hipotesis menstruasi retrograd.Menurut hipotesis ini, transportasi retrograd karsinogen dari uterus dan traktus genital bagian bawah terjadi melalui tuba fallopi menuju ke ovarium pada saat menstruasi.Efek proteksi dari kontrasepsi oral konsisten dengan hipotesis ini, hal ini disebabkan karena penggunaannya dikaitkan dengan pengurangan kehilangan darah saat mensturasi dan oleh karenanya mengurangi terjadinya menstruasi retrograd.Sebaliknya, pada observasi didapatkan pula risiko kanker ovarium meningkat berkaitan dengan terapi penggantian hormon yang kemungkinan dimediasi melalui periode perdarahan uterus abnormal yang terjadi melalui banyak regimen hormonal.Hipotesis ini juga didukung dengan diketahui berkurangnya risiko kanker ovarium pada wanita yang mengalami ligasi tuba atau histerektomi, karena prosedur ini mencegah menjalarnya faktor onkogenik yang potensial dari traktus genital bagian bawah ke ovarium (John et al, 2008). Hipotesis terakhir adalah paparan pituitari gonadotropin dosis tinggi terhadap eptelium ovarium yang secara persisten yang menghasilkan transformasi neoplasma.Follilce stimulating hormone (FSH) telah diketahui dapat meningkatkan pertumbuhan sel epitelial kanker ovarium secara in vitro, dan efek ini dapat di blok oleh Leutinizing hormone (LH). Menurut hipotesis ini peningkatan level sirkulasi gonadotropin akan meningkatkan biosintesis estrogen pada stroma ovarium, yang kemudian akan menyebabkan proliferasi abnormal dari epitel yang berdekatan. Menyusui, telah dilaporkan mengurangi risiko kanker 9 ovarium, hal tersebut berkaitan dengan penurunan konsentrasi serum FSH dan estradiol. Kehamilan dan penggunaan kontrasepsi oral rupanya menurunkan risiko kanker ovarium dengan menghambat sekresi pituitari gonadotropin. Teori ini juga menerima dukungan dari observasi peningkatan risiko kanker ovarium pada wanita yang memakai obat kesuburan karena obat ini menstimulasi ovulasi dengan meningkatkan level FSH, terutama saat fase folikuler dari siklus menstruasi (John et al, 2008). Telah diketahui pula beberapa alur tumorgenesis yang berbeda pada kanker ovarium epitelial.Pertama, beberapa kasus berkembang dari perubahan akumulasi genetik yang mengarah kepada transformasi keganasan dari kista jinak menjadi tumor LMP (Low malignant Potential) dan pada akhirnya berkembang menjadi karsinoma ovarium invasif (Makarla, 2005; Schorge, 2008). Secara khas, tumor invasif ini biasanya low grade dan secara klinis lamban perkembangannya. Pada tumor ini, terjadi mutasi onkogenik k-ras sejak awal.Famili dari ras onkogen terdiri dari k-ras, h-ras dan n-ras.Produk protein dari famili ras tersebut berperan pada regulasi siklus sel dan mengontrol proliferasi dari sel. Mutasi ras terlibat dalam karsinogenesis melalui perannya menghambat apoptosis seluler dan meningkatkan proliferasi seluler. Kanker invasif yang berkembang dari tumor LMP juga mengalami mutasi pada P53 tumor suppressor gen (Schorge, 2008). Kedua, sekitar 5 sampai 10 persen dari karsinoma ovarium epitelial berasal dari predisposisi pewarisan. Wanita yang dilahirkan dengan mutasi brca hanya membutuhkan satu “pengaruh” kepada copy normal yang lain (alel) untuk “melumpuhkan” produk dari brca tumor suppressor gen. Brca-terkait ovarium dan 10 kanker peritoneal memiliki patogenesis molekuler yang unik, karena membutuhkan inaktivasi p53 untuk berkembang (Buller, 2001). P53 adalah tumor suppressor gen yang telah dipetakan pada kromosom 17. Produk proteinnya dapat mencegah sel memasuki tingkat selanjutnya dari pembelahan sel dan dengan demikian akan terjadi penghentian dari replikasi sel tumor yang tidak terkontrol. Mutasi pada p53 berkaitan dengan bermacam kanker. Hilangnya fungsi brca dan p53 yang terdeteksi sebelum invasi, mendukung anggapan lebih lanjut mengenai gen – gen tersebut penting pada tahap awal pencetus tumor (Schorge, 2008) Ketiga, kebanyakan dari karsinoma muncul dari sel epitelial permukaan ovarium yang terjebak pada kista inklusi dengan stroma ovarium.Beberapa alur telah diusulkan.Sebagai contoh, siklus perbaikan dari permukaan ovarium dalam periode yang lama dan ovulasi berulang membutuhkan daya proliferasi yang cukup banyak. Pada kasus ini, mutasi p53 secara spontan berkembang pada sintesis DNA yang menyertai proliferasi dan tampaknya memainkan peran utama pada proses karsinogenesis (Schorge, 2008). Berdasarkan klinikopatologi dan studi molekuler diketahui karsinoma ovarium dibagi menjadi dua grup : (1) karsinoma low grade (well differentiated) dan (2) karsinoma high grade (moderately sampai poorly differentiated). Perbedaan ini dibagi berdasarkan atipia inti sel dan hubungannya dengan kemampuan pasien bertahan hidup (Robbins et al, 2010). Beberapa karsinoma lowgrade berkembang berhubungan dengan tumor serous borderline, sedangkankebanyakan karsinoma high grade berkembang secara “de novo” tanpa dikenali lesi prekusornya (Robbins et al , 2010). 11 Studi molekuler dari low- dan high-grade karsinoma serous menunjukkan perbedaan molekuler genetik pada kedua tipe karsinoma (Robbins et al, 2010).Tumor low grade berkembang dari tumor serous borderline yang mengalami mutasi dari onkogen kras atau braf, dan sangat jarang mutasi pada p53.Berbeda, tumor high grade memiliki frekuensi mutasi yang tinggi pada gen p53 tetapi sedikit mutasi pada kras atau braf.Banyak kasus melaporkan karsinoma ovarium yang berkembang pada wanita dengan mutasi brca 1 atau brca 2 adalah karsinoma serous high grade dan biasanya mengalami mutasi p53.Pemeriksaan secara tertutup dari tumor ini menyimpulkan bahwa terdapat presentase yang signifikan dari brca 1 dan brca 2-terkait tumor yang berkembang pada garis epithelium ujung fimbria tuba fallopi.Penemuan ini mengarahkan penelitian untuk berspekulasi bahwa sedikitnya beberapa karsinoma high grade ovarium bersifat sopradis dan juga dinamakan karsinoma serous primary peritoneal yang juga berasal dari bagian distal tuba fallopi, area yang diteliti (Robbins et al, 2010). 2.1.3 Klasifikasi Telah diketahui bahwa tumor ovarium berasal dari satu diantara tiga komponen : (1) derivat epitelium permukaan dari epithelium coelomic; (2) sel germ, yang bermigrasi ke ovarium dari yolk sac dan pluripoten, serta (3) stroma ovarium, termasuk sex cord, yang merupakan pelopor aparatus endokrin dari ovarium postnatal. Tetapi terdapat grup tumor yang tidak dapat diklasifikasikan, dan terakhir terdapat tumor ovarium sekunder atau metastasis (Robbins et al, 2010). 12 Gambar 2.1 Pembagian Tumor Ovarium Berdasarkan Sel Asalnya (Robbins et al, 2010) Tabel 2.1 Pembagian Tumor Ovarium Berdasarkan Sel Asalnya Sel asal Frekuensi keseluruhan Proporsi tumor ovarium ganas Onset Tipe Sel epitel permukaan 65-70% Germ sel 15-20% Sex cord stroma 5-10% Metastase ke ovarium 5% 90% 3-5% 2-3% 5% 20+tahun 0-25+ tahun Semua usia Bervariasi Serus Musinus Endometrioid Clear cell Tumor Brenner Cystadenofibroma Teratoma Disgerminoma Endodermal sinus tumor Koriokarsinoma Fibroma Tumor Sel Granulose – teka Tumor sel sertoli – leydig Sumber : Robbins et al, 2010 Walaupun beberapa tumor spesifik telah memiliki ciri – ciri yang khusus dan aktif secara hormonal, tetapi kebanyakan tidak fungsional dan hanya menghasilkan gajala yang ringan sampai mencapai ukuran yang lebih besar. Tumor malignan biasanya menyebar keluar ovarium sampai diagnosis definitif 13 dapat dibuat. Beberapa tumor, khususnya tumor epitelial biasanya bilateral. Nyeri perut dan distensi, gejala traktus urinarius dan gastrointestinal dikarenakan kompresi oleh tumor atau invasi kanker, serta perdarahan dari vagina merupakan gejala yang sering ditemui. Bentuk jinak dapat tidak bergejala dan biasanya ditemukan secara tidak sengaja pada pemeriksaan abdominal, pelvik atau sepanjang operasi (Robbins et al, 2010). 2.1.4 Stadium Stadium dari kanker berdasarkan pada ukuran dan lesi primer, dapat berkembang dan menyebar ke nodus limfatikus regional atau metastasis melalui darah (Robbins et al, 2010). Malignasi ovarium epitelial di kelompokkan berdasarkan sistem FIGO. Stadium FIGO berdasarkan penemuan saat eksplorasi pembedahan. Evaluasi preoperatif seharusnya dapat menyingkirkan metastasis ekstraperitoneal (Berek et al, 2005). Tabel 2.2 Stadium Kanker Ovarium Menurut FIGO Staging I II Keterangan Tumor terbatas pada ovarium IA Tumor terbatas pada satu ovarium, kapsul tumor utuh, tidak ada pertumbuhan tumor di permukaan ovarium, tidak ada sel tumor di cairan asites ataupun pada bilasan cairan di rongga peritoneum. IB Tumor terbatas pada dua ovarium, kapsul tumor utuh, tidak ada pertumbuhan tumor pada permukaan ovarium, tidak ada sel tumor di cairan asites ataupun pada bilasan cairan di rongga peritoneum. IC Tumor terbatas pada satu atau dua ovarium dengan salah satu faktor yaitu kapsul tumor pecah, pertumbuhan tumor pada permukaan ovarium, ada sel tumor di cairan asites ataupun pada bilasan cairan di rongga peritoneum Tumor pada satu atau dua ovarium dengan perluasan di pelvis IIA Tumor meluas ke uterus dan/atau ke tuba tanpa sel tumor di cairan asites ataupun bilasan cairan di rongga peritoneum. IIB Tumor meluas ke jaringan/organ pelvis lainnya tanpa sel tumor 14 di cairan asites ataupun bilasan cairan di rongga peritoneum. Perluasan di pelvis (IIA atu IIB) dengan sel tumor di cairan asites ataupun bilasan cairan di rongga peritoneum. III Tumor pada satu atau dua ovarium disertai dengan perluasan tumor pada rongga peritoneum di luar pelvis dengan/atau metastasis kelenjar getah bening regional. IIIA Metastasis mikroskopik di luar pelvis. IIIB Metastasis makroskopik di luar pelvis dengan besar lesi ≤ 2 cm. IIIC Metastasis makroskopik di luar pelvis dengan besar lesi > 2 cm dan/atau metastasis ke kelenjar getah bening. IV Metastasis jauh (di luar rongga peritoneum). Sumber : Berek et al, 2005 IIC 2.1.5 Derajat diferensiasi Derajat diferensiasi merupakan hasil penilaian mikroskopis sel kanker yang berfungsi untuk menentukan fitur morfologis, keagresifan atau sifat biologis dari sel kankernya (Huston, 2006). Pada kebanyakan jaringan, sel baru di produksi melalui pembelahan dari sel undifferentiated yang dinamakan stem sel. Diferensiasi keturunan dari stem sel menghasilkan sel dengan tipe – tipe yang terspesialisasi yang berfungsi pada jaringan tersebut. Karena stem sel dan sel – sel keturunannya memiliki kapasitas untuk membelah, hal ini menyebabkan peningkatan populasi dari sel tumor. Sel tumor dapat terdiri dari berbagai derajat diferensiasi. Pada beberapa kasus, mutasi dapat memblok proses diferensiasi, menghasilkan sedikit diferensiasi yang dinamakan anaplasia. Karena terjadi mutasi yang menghambat diferensiasi hal tersebut menyebabkan sel tetap berada dalam status proliferasi yang akan berkontribusi pada progresifitas kanker (David, 2007). Derajat diferensiasi dari sel kanker, terdiri dari jumlah mitosis dan ciri – ciri arsitektural. Beberapa skema derajat diferensiasi telah berkembang, dan secara 15 umum berkisar antara dua kategori (low grade dan high grade) sampai empat kategori. Kriteria untuk setiap derajat diferensiasi bervariasi pada setiap neoplasia, tetapi semuanya secara pokok berusaha untuk menilai secara luas apakah sel tumor menyerupai atau gagal menyerupai normalnya (Robbins et al, 2010). Derajat diferensiasi histologi telah menunjukkan memiliki prognostik signifikan pada berbagai tumor. Terdapat berbagai macam derajat diferensiasi, akan tetapi Shimizu dan Silverberg melaporkan sistem derajat diferensiasi baru berdasarkan modifikasi dari sistem derajat diferensiasi Nottingham untuk kanker payudara dan dapat digunakan untuk semua tipe dari kanker ovarium (Silverberg, et al 2000). Pada sistem ini nilai ditetapkan dari masing-masing 3 parameter berikut: pola arsitektur (glandular, papiler, atau solid), derajat atipia inti dan indeks mitosis (Tabel 2.3). Nilai dari masing-masing parameter tersebut kemudian dijumlahkan, menghasilkan skor total yang menentukan derajat diferensiasi (Tavasolli, et al., 2003; Vang, et al., 2009). Sistem derajat diferensiasi universal ini membagi derajat diferensiasi karsinoma ovarium menjadi tiga kelompok, skor 3-5: Grade 1 (derajat diferensiasi baik); skor 6-7: Grade 2 (derajat diferensiasi sedang); skor 8- 9: Grade 3 (derajat diferensiasi buruk) (Gambar 2.2). Tabel 2.3 Sistem Derajat Diferensiasi Shimizu-Silverberg Kanker Ovarium Skor Pola arsitektur dominan Atipia sitologi Mitosis per 10 HPF 1 Glandular Ringan 0-9 2 Papiler Sedang 10-24 3 Solid Berat >25 Sumber: Malpica, 2004 16 Gambar 2.2 Sistem Derajat Diferensiasi Shimizu-Silverberg: Grade 1, 2 dan 3 (Kommoss, et al., 2009) Pola arsitektur sel kanker ditentukan melalui bagian yang paling dominan yaitu glandular, papiler, dan bentuk solid (Gambar 2.8).Atipia sitologi dinilai pada area tumor yang tampak paling atipik.Atipia ringan bila terdapat sel dengan inti vesikuler relatif uniform, tidak ditemukan penggumpalan kromatin atau anak inti yang prominen.Atipia sedang bila terdapat variasi bentuk dan ukuran inti, anak inti dapat diamati tetapi kecil, kromatin inti menggumpal, dan tidak ada sel bizarre.Atipia berat bila terdapat bentuk dan ukuran inti yang sangat bervariasi,kromatin inti sangat menggumpal, membrane inti tebal, anak inti prorninen eosinofilik, dan dapat dijumpai adanya sel bizarre (Gambar 2.9) Gambar 2.3 Derajat arsitekural: glanduler, papiler dan solid (Kommoss, et al., 2009) 17 Gambar 2.4 Derajat atipia inti: ringan, sedang dan berat (Kommoss, et al., 2009) Jumlah mitosis pada umumnya akan meningkat sejalan dengan bertambahnya derajat atipia inti, sebagai suatu mitotic figures (MF) yang abnormal. Jumlah mitosis dihitung pada area mitosis yang paling aktif.Aktifitas mitosis dinilai pada bagian perifer tumor karena biasanya pertumbuhannya lebih aktif.Penghitungan inti sel dilakukan hanya pada fitur morfologi yang terbatas pada metafase, anafase, atau telofase.Inti sel yang hiperkromatik dan mengalami apoptosis dieksklusi. Penilaian dilakukan sedikitnya pada 30 lapangan pandang dan dihitung jumlah terbanyak dari mitotic figures (MF) per 10-high power microscopic fields (MF/10 HPF) menggunakan 10x wide field eyepiece 40x objective dengan diameter lapangan pandang dan luas berturut-turut 0,663 mm dan 0,345 mm 2 (Ishioka et al., 2003).Sistem ini sangat sederhana, dapat dipakai berulang kali, menyediakan informasi prognostik yang sangat berguna. Menggunakan sistem ini diperoleh 5-year surveilance rate derajat diferensiasi I (91%), derajat diferensiasi II (64%), derajat diferensiasi III (38%) (Sato, 2003). Tipe histologi kanker ovarium epitelial terbanyak pada populasi penelitian yang dilakukan di RSUP Sanglah tahun 2008 adalah tipe serous (40,6%), diikuti 18 oleh tipe sel jernih (31,3%), musinus (21,9%), dan endometrioid (6,3%), dengan prevalensi karsinoma ovarium tipe serous derajat diferensiasi baik (30,8%), sedang (15,4%) dan buruk (53,8%) di populasi (Sriwidnyani, 2008). 2.1.6 Transformasi keganasan Gen terkait kanker berperan pada tujuh perubahan mendasar dalam fisiologi sel dan secara bersama – sama menentukan fenotip keganasan (Robbins et al, 2010). Tujuh perubahan mendasar tersebut adalah sebagai berikut : 1. Kecukupan ketersediaan sinyal pertumbuhan : Tumor memiliki kemampuan proliferasi tanpa rangsangan eksternal, biasanya sebagai akibat dari aktivasi onkogen. 2. Ketidakpekaan terhadap sinyal inhibisi pertumbuhan : Tumor mungkin tidak merespon molekul yang menghambat proliferasi sel normal seperti transforming growth factor (TGF-β) dan direct inhibitors of cyclindependent kinases (CDKIs). 3. Pengelakan dari apoptosis : Tumor mungkin resisten terhadap program kematian sel, sebagai konsekuensi dari inaktivasi dari p53 atau aktifasi dari gen anti apoptosis. 4. Potensi replikasi yang tidak terbatas : Tumor memiliki kapasitas untuk berproliferasi, menghindari proses penuaan selular. 5. Proses angiogenesis yang berkelanjutan : Sel tumor, seperti sel normal, tidak dapat tumbuh tanpa adanya pasokan pembuluh darah untuk membawa nutrisi dan oksigen serta membuang produk yg tidak diperlukan. Oleh karena itu tumor harus menginduksi angiogenesis. 19 6. Kemampuan untuk menginvasi dan metastasis : Tumor metastasis adalah penyebab sebagian besar kematian akibat kanker dan tergantung pada proses yang intrinsik dengan sel atau di inisiasi oleh sinyal dari jaringan. 7. Kerusakan pada DNA repair : Tumor mungkin gagal untuk memperbaiki kerusakan DNA yang disebabkan oleh karsinogen atau selama proliferasi seluler, hal ini menyebabkan ketidakstabilan genom dan mutasi pada proto-onkogen dan tumor suppressor gen (Robbins et al, 2010). Mutasi pada satu atau lebih gen yang mengatur karakteristik selular terdapat pada setiap kanker. Tetapi alur genetik yang tepat untuk menimbulkan karakteristik tersebut berbeda pada setiap kanker walaupun pada organ yang sama. Dipercaya bahwa terjadinya mutasi pada gen terkait kanker dihubungkan oleh kekuatan mesin DNA-repair, serta mekanisme perlindungan seperti apoptosis dan penuaan yang mencegah proliferasi sel-sel dengan DNA yang rusak (Robbins et al, 2010). Pada karya tulis ini yang akan banyak dibahas adalah mengenai anti apoptosis gen. 20 Gambar 2 .5 Skema Dasar Sederhana Molekul Kanker(Robbins et al, 2010). 2.2 Protein BCL-2 B-cell lymphoma-2 pertama kali dipublikasikan dalam penelitian oleh Tsujimoto dan kawan – kawan pada tahun 1984 (Tsujimoto et al, 19884). BCL-2 merupakan protein kedua dari berbagai protein yang ditemukan pada limfoma. Sesuai dengan namanya, gen ini ditemukan dikarenakan keterlibatannya dalam keganasan sel-B, dim ana terjadi translokasi kromosomal yang kemudian 21 mengaktifkan sebagian besar gen pada non-Hodgkin’s sel-B limfom a folikuler. Pada translokasi itu, g en bcl-2 berpindah dari lokasi kromosom no rmalnya di 18q21 ke lokus 14q32 yang mana merupakan jajaran dengan elemen penguat pada rantai berat immunoglo bulin (IgH), hal tersebut menyebabkan pengaturan kembali gen bcl-2 dan produksi berlebihan dari mRNA bcl-2 serta protein – pr otein yang dikodekannya (Tsujimoto et al, 1985). Gambar 2.6 Translokasi bcl2 (Anonim, 2011) Vaux et al (1988 ) pertama kali yang melaporkan bahwa bcl-2 dapat memperpanjang kehidu pan dari sel dan kemudian Hockenbery et al (1990) memperkirakan bahwa bcl-2 memiliki kemampuan untuk memblok program kematian sel/programmed cell death (PCD). Pada banyak kasus yang diperiksa, Bcl-2 terlihat secara relatif memblok kejadian – kejadian awal yang berkaitan dengan kematian sel apoptosis, yang mana karakteristik perubahan morfologi seperti sel yang menciut, kondensasi kromatin, dan fragmentasi nuklear serta degradasi DNA terlihat berkurang atau dicegah (John, 1994). 22 2.2.1 Struktur bcl-2 Gen bcl-2 memiliki rentang lebih dari 230 kb dari DNA dan terdiri dari tiga exons dimana exon 2 dan sebagian kecil dari exon 3 mengkode protein. Tergantung dari sambungan dengan intron 2-nya, BCL-2 mengkode 2 mRNA, yaitu BCL-2α dan BCL-2β, yang mana hanya BCL-2α yang sepertinya memiliki relevansi biologis. Protein BCL-2 merupakan membran protein yang memiliki berat molekul 26 kDa terletak pada bagian sitosolik dari amplop nuklear, retikulum endoplasma dan bagian luar membran mitokondria (Miguel, 2008). Dengan penggunaan isolasi gen homolog, interaksi screen protein, substraction kloning dan analisis gen virus, telah memperkenalkan secara luasberbagai keluarga protein terkait BCL-2 pada mamalia. Berdasarkan dari atribut struktural dan fungsional, protein BCL-2 dapat dibagi menjadi tiga subgroup : 1) the antiapoptotic channel-forming protein BCL-2 dengan 4 BH (BCL-2 homolog)domain (BH 1 sampai 4) dan transmembran anchor sequence, 2) the proapoptoticchannel-forming protein dengan 3 BH domain (BH 1 sampai 3) dan transmembran anchor sequence tanpa BH4, 3) the proapoptotic ligands yanghanya mengandung BH 3 domain (Sheau et al, 2000). Protein subgrup 1 dan 2 dipercaya “berjangkar” pada membran mitokondria dan protein subgroup 3 bertindak sebagai ligand yang berdimerisasi dengan “jangkar” membran, reseptor channel-forming BCL-2 (Sheau et al, 2000). BH3 domain pada sub grup ke 3penting untuk aktivitas pengikatan dari ligand tersebut. 23 Gambar 2.7 Tig a Subgroup BCL-2 Protein dan BCL-2 Homolog Domain (Sheau et al, 2000) Protein mitochondria-anchored antiapoptotic diwakili oleh ced-9 d an BCL-2, berbentuk seperti ion c hannel yang dapat menjaga homeostatsis membran dan mencegah pelepasan dari sitokrom c, yang kemudian akan mening katkan sel survival. Protein – pr otein ini juga berinteraksi dengan ced-4/Apaf-1 untukmencegah aktivasi caspase – caspase yang terkait, yang kemudian akan mensupresi alur caspase dan apoptosis. Sebagai tambahan selain ced-9 dan BCL-2, beberapa protein BC L-2 lain, seperti BCL-XL, BCL-W, MCL-1 d an BFL-1, memiliki aktifitas antiap optosis dan motif pengaturan fungsional yang mirip tetapi memiliki pola distribusi jaringan yang overlaping dan unik. Bcl-xl d an bcl-2 di indentifikasi dengan homologous screen. Infeksi virus dapat mencetuskan apoptosis pada sel inan g untuk mencegah perkembangbiakan virus, dan beberapa virus telah mengembangkan beberapa mekanisme untuk mencegah ke matian sel inang. Beberapa gen virus seperti adenovirus E1B 19K, Epstein-Barr virus BHRF- 24 1, demam flu babi Afrika virus LMW5-HL, ORF16 dan KsBCL-2, mengkode protein yang secara struktural dan fungsional homolog terhadap protein BCL-2 antiapoptosis mamalia.Supresi apoptosis oleh beberapa protein virus tersebut memperpanjang kehidupan dari sel inang dan meningkatkan efisiensi dari replikasi virus (Sheau et al, 2000). Tidak seperti anggota antiapoptosis bcl-2 pembentuk channel, protein keluarga BCL-2 pada subgrup kedua (BAX, BAK, BOK) tidak hanya antagonis dari aksi survival protein BCL-2 antiapoptosis tetapi juga aktif dalam mencetuskan apoptosis pada sel yang terinfeksi. Pada subgroup ini protein BCL2 memiliki BH1,-2, dan -3 domain dan regio membran-anchoring tetapi tidak memiliki NH2-terminal BH4 domain yang penting untuk inhibisi apoptosis yang mana akan berdimerisasi dengan protein BCL-2 antiapoptosis, dan kemudian dapat membebaskan ced-4/Apaf-1 dari supresi yang menekan dengan protein BCL-2 serta akan meningkatkan aktifasi caspase. Proapoptosis mitochonriaanchored protein BCL-2 juga dapat meningkatkan apoptosis dengan merubahhomeostasis membran mitokondria dan meningkatkan pelepasan sitokrom c (Sheau et al, 2000). Subgrup ketiga dari protein BCL-2, homolog dari protein nematoda EGL-1 yang baru – baru ini diidentifikasi, terdiri dari proapoptosis ligand dan hanya memiliki BH3 domain.Protein ini memiliki kemampuan untuk berinteraksi dengan pembentuk-channel protein BCL-2 yang selektif untuk mempromosikan kematian sel dan dapat bertidak sebagai adaptor protein – protein yang terkait dengan alur sinyal pada setiap langkah dari program apoptosis. Seperti pada 25 nematoda EGL-1, beberapa proapoptosis ligand (BAD, BOD/Bim, dan BID) hanya memiliki BH3 domain. Sebagai tambahan beberapa protein pada subgroup ini (Bik/Nbk, Blk, Harakiri/DP5, NIP3L/Nix, dan NIP3) memiliki regio tambahan COOH-terminal transmembran untuk membran-anchoring (Sheau et al, 2000). Protein BCL-2 dan beberapa protein terkait merupakan protein multifungsional dan interaksi antar protein memiliki peran penting pada regulasi apoptosis. Salah satu mekanisme protein BCL-2 meregulasi apoptosis yaitu melalui homodimerisasi dan heterodimerisasi dengan protein pada keluarga yang sama. BH3 domain pada protein BCL-2 proapoptosis bertindak sebagai ligand untuk mengikat reseptor domain (meliputi BH3, BH2, dan BH1 domain) pada anggota antiapoptosis. Pada prototipe protein BCL-2 antiapoptosis mengandung BH4 domain yang unik, dipercaya berperan penting untuk berinteraksi dengan Apaf-1, yang akan mencegah aktivasi dari caspase. Sebagai tambahan terdapat regio COOH-terminal transmembran yang esensial untuk anchoring terhadap mitokondria, retikulum endoplasma atau membran nuclear, α-helix 5 dan 6 meliputi regio BH1 dan BH2 penting dalam pembentukan channel pada regulasi pelepasan sitokrom c oleh mitokondria. Walaupun tidak ada molekul yang spesifik yang diidentifikasi untuk berinteraksi dengan channel domain protein BCL-2 ini, studi terkini menunjukkan bahwa pembentuk channel keluarga BCL2 dapat berinteraksi dengan multipel protein mitokondria untuk meregulasi pelepasan sitokrom c melalui transisi permeabilitas dari pori – pori mitokondria (Sheau et al, 2000). 26 Gambar 2.8 Prototipe bcl2 (Sheau et al, 2000). 2.2.2 Apoptosis dan peran bcl-2 Apoptosis adalah alur kematian sel yang di induksi oleh program “bunuh diri” sel yang diatur dengan ketat dimana sel – sel yang ditakdirkan untuk mati mengaktifkan enzim yang akan mendegradasi inti DNA sel itu sendiri dan protein sitoplasma. Sel apoptosis terpecah menjadi beberapa fragmen, yang disebut badan apoptosis, yang terdiri dari sebagian sitoplasma dan inti.Membran plasma dan badan sel apoptosis tetap utuh, tetapi strukturnya diubah sedemikian rupa sehingga ini menjadi "lezat" bagi fagosit. Sel yang mati dan fragmen – fragmennya dengan cepat di fagositosis, sebelum isi dari sel keluar dan karena itu kematian sel melalui alur ini tidak menimbulkan reaksi inflamasi pada inang/host (Robbins et al 2010). Apoptosis terjadi secara fisiologis baik selama masa perkembangan dan sepanjang masa dewasa, serta berfungsi untuk menghilangkan sel – sel yang tidak diinginkan, sel – sel yang sudah menua atau sel yang berpotensi berbahaya. Apoptosis juga merupakan peristiwa patologis ketika sel – sel sakit menjadi rusak dan tidak dapat diperbaiki akhirnya akan dieliminasi (Robbins et al, 2010). 27 2.2.2.1 Mekanisme apoptosis Setiap sel mengandung mekanisme yang mana terdapat sinyal kematian atau bertahan hidup, apoptosis dihasilkan dari ketidakseimbangan antara kedua sinyal tersebut.Dikarenakan apoptosis yang terlalu banyak atau terlalu sedikit dapat mendasari banyak penyakit, seperti penyakit degenerasi dan kanker. Salah satu fakta yang muncul adalah mekanisme dasar apoptosis, gen, dan protein yang mengendalikan proses dan urutan alur apoptosis terdapat dalam semua organisme multiseluler (Robbins et al, 2010) Proses apoptosis dapat dibagi menjadi tahap inisiasi, di mana terdapat beberapa caspases yang menjadi katalis aktif, serta tahap eksekusi atau pelaksanaan, di mana caspases lainnya memicu degradasi komponen seluler. Inisiasi apoptosis terjadi oleh karena sinyal dari dua jalur yang berbeda:. Jalur intrinsik, atau mitokondria,, dan ekstrinsik, atau kematian reseptor (Robbins et al, 2010). Jalur ini diinduksi oleh stimulus yang berbeda dan melibatkan set protein yang berbeda, walaupun terdapat beberapa persilangan jalur diantaranya. Kedua jalur bertemu untuk mengaktifkan caspases, yang merupakan mediator sebenarnya kematian sel (Robbins et al, 2010). 28 Gambar 2.9 Mekanisme Apoptosis (Robbins et al, 2010) 2.2.2.2 Inisiasi apoptosis alur intrinsik (mitokondria) Alur apoptosis intrinsik akan menghasilkan peningkatan permeabilitas mitokondria dan pelepasan dari molekul pro-apoptosis (death inducers) ke dalam sitoplasma. Mitokondria mengandung protein seperti sitokrom c yang penting bagi kehidupan, tetapi bila beberapa protein yang serupa terlepas ke dalam sitoplasma (merupakan indikasi bahwa sel tersebut tidak sehat), akan menginisiasi program “bunuh diri” dari apoptosis. Pelepasan protein mitokondria ini dikontrol secara seimbang melalui anggota keluarga protein BCL antara pro dan antiapoptosis.Terdapat lebih dari 20 anggota dari keluarga BCL.Faktor pertumbuhan dan sinyal – sinyal bertahan hidup/survival menstimulasi produksi dari protein antiapoptosis, salah satu yang utama adalah BCL-2, BCL-X dan MCL-1. Normalnya protein ini terdapat pada sitoplasma dan membran mitokondria, dimana mereka mengontrol permeabilitas mitokondria dan 29 mencegah kebocoran protein mitokondria yang nantinya memiliki kemampuan untuk mencetuskan kematian. Bila sel kehilangan sinyal bertahan/survival, terjadi kerusakan DNA, atau kesalahan sintesis protein maka akan merangsang stres retikulum endoplasma (RE), sensor dari kerusakan atau stres akan diaktifkan. Sensor tersebut juga merupakan anggota dari keluarga Bcl, dan termasuk juga protein yang dinamakan Bim, Bid dan Bad yang mengandung “BCL-2 homologydomain” tunggal (tiga dari empat domain tersebut ada pada BCL-2) dandinamakan “BH3-only proteins”. Sensor kemudian akan mengaktifkan dua kritikal (proapoptosis) efektor, Bax dan Bak, yang membentuk oligomers yang kemudian masuk kedalam membran mitokondria dan membuat saluran/channel yang memperbolehkan protein dari membran dalam mitokondria untuk bocor ke dalam sitoplasma. BH3 juga mengikat dan memblok fungsi dari bcl-2 dan bcl-x, diwaktu yang sama sintesis dari bcl-2 dan bcl-x menurun. Hasil dari aktivasi dari bax-bak disertai dengan hilangnya fungsi perlindungan dari anggota keluarga bcl antiapoptosis, maka terjadi pelepasan beberapa protein mitokondria kedalam sitoplasma yang akan mengaktifkan alur caspase.Salah satu protein tersebut adalah sitokrom c, yang diketahui fungsinya pada respirasi mitokondria. Sekali terlepas ke dalam sitosol, sitokrom c mengikat protein yang dinamakan Apaf-1 (apoptosis-activating factor-1, homolog dari Ced-4 pada C elegans), yang yang kemudian akan membentuk hexamer berbentuk seperti roda yang disebut apoptosom. Komplek ini dapat mengikat caspase-9, inisiator caspase yang penting dari alur mitokondria, dan enzim akan memecah molekul caspase-9 yang berdekatan, sehingga membentuk sebuah proses auto-amplifikasi. Protein 30 mitokondria lainnya, seperti Smac/diablo, memasuki sitoplasma, kemudian mereka mengikat dan menetralisir protein sitoplasma yang berfungsi sebagai inhibitor fisiologis apoptosis (disebut IAP). Fungsi normal dari IAP adalah untuk memblokir aktivasi caspases, termasuk caspase-3, dan menjaga sel-sel tetap hidup.Netralisasi dari IAP ini merupakan inisiasi dari alur caspase (Robbins et al, et al 2010). Gambar 2.10 Apoptosis Alur Intrinsik (Mitokondria) (Robbins et al, 2008) 2.2.2.3 Inisiasi apoptosis alur ekstrinsik (inisiasi reseptor kematian) Alur ini diawali melalui keterlibatan reseptor kematian membran plasma pada berbagai sel. Reseptor kematian merupakan anggota dari keluarga reseptor TNF yang mengandung domain sitoplasma yang ikut dalam interaksi protein, disebut domain kematian karena pentingnya untuk mengantarkan sinyal apoptosis (beberapa anggota keluarga reseptor TNF tidak mengandung domain kematian, 31 fungsi mereka untuk mengaktivasi alur inflamasi, dan perannya dalam mencetuskan apoptosis sangat sedikit). Reseptor kematian yang paling banyak diketahui adalah reseptor TNF tipe 1 (TNFR1) dan protein yang terkait yang dinamakan Fas (CD95).Mekanisme apoptosis yang di induksi oleh reseptor kematian digambarkan dengan baik pada Fas.Reseptor kematian diekspresikan pada berbagai tipe sel. Ikatan terhadap Fas dinamakan Fas ligand (FasL).FasL di ekspresikan pada sel T untuk mengenali self antigen (berfungsi untuk mengeliminasi self-reactive limfosit), dan pada beberapa limfosit T sitotoksik (yang membunuh sel yang terinfeksi virus atau tumor). Ketika FasL mengikat Fas, tiga atau lebih molekul dari Fas dibawa bersama – sama dengan domain kematian sitoplasma yang kemudian membentuk tempat pengikatan untuk protein yang juga mengandung domain kematian dan dinamakan FADD (Fas-associated deathdomain). FADD yang melekat pada reseptor kematian kemudian berubah bentukmenjadi caspase-8 inaktif (pada manusia, caspase-10), juga melalui domain kematian.Molekul pro-caspase-8 multipel dibawa ke dalam jarak tertentu sehingga mereka bersatu membentuk caspase-8 aktif. Enzim kemudian akan mencetuskan aktifasi caspase dengan memecah dan dengan mengaktifkan procaspase yang lain, serta enzim yang aktif memediasi fase eksekusi apoptosis. Alur apoptosis ini dapat dihambat oleh protein yang dinamakan FLIP, yang dapat mengikat pro-caspase-8 tetapi tidak dapat membelah dan mengaktifkan caspase karena sedikit mengandung domain protease. Beberapa virus dan sel normal memproduksi FLIP dan menggunakan inhibitor ini untuk melindungi dirinya dari apoptosis yang dimediasi oleh Fas (Robbins et al, 2010). 32 Gambar 2.11 Apoptosis Alur Ekstrinsik (Inisiasi Reseptor Kematian) (Robbins et al, 2010) Telah digambarkan mengenai alur ekstrinsik dan intrinsik untuk menginisiasi apoptosis secara berbeda dikarenakan secara fundamental melibatkan molekul yang berbeda untuk melakukan inisiasi, tetapi kemungkinan didapatkan interkoneksi antara alur tersebut, contoh singkatnya, pada hepatosit dan beberapa sel tipe yang lainnya, sinyal Fas mengaktivasi protein BH3 yang dinamakan Bid, yang kemudian akan mengaktifkan alur mitokondria. (Robbins et al, 2008) 33 Gambar 2.12 Hubungan Antara Inisiasi Apoptosis Alur Ekstrinsik Dengan Alur Intrinsik (Robbins et al, 2010) 2.2.2.4 Apoptosis fase eksekusi Kedua alur inisiasi bersatu pada aktifasi alur caspase, yang akan memediasi fase akhir dari apoptosis. Seperti yang kita lihat, alur mitokondria berujung pada aktifasi inisiator caspase-9, dan alur reseptor kematian kepada inisiator caspase-8 dan -10.Setelah inisiator caspase membelah untuk membentuk bentuk aktifnya, enzim program kematian diatur dengan gerakan yang cepat dan berurutan untuk aktifasi dari eksekusioner caspase. Eksekusioner caspase seperti caspase-3 dan - 6 bekerja pada banyak komponen selular. Secara singkat, caspase ini, sekali aktif 34 akan menghilangkan inhibisi dari sitoplasma DNase dan membuat DNase secara enzimatik aktif; enzim ini menginduksi karakteristik pemecahan DNA menjadi pecahan – pecahan ukuran nukelosom. Caspase juga mendegradasi komponen struktural dari matriks inti, dan memacu fragmentasi dari nukleus.Beberapa langkah dari apoptosis tidak sepenuhnya dapat dijelaskan, secara singkat, kita tidak mengetahui bagaimana struktur dari membran plasma berubah pada sel apoptosis, atau bagaimana membran menggembung dan membentuk badan apoptosis (Robbins et al, 2010). 2.2.2.5 Penghancuran sel yang mati Badan apoptosis terbagi menjadi fragmen – fragmen dengan ukuran yang dapat dimakan oleh fagosit.Sel apoptosis dan fragmen – fragmennya juga menjalani beberapa perubahan pada membrannya yang secara aktif mempromosi fagositosis maka sel – sel tersebut dapat di bersihkan sebelum menjalani nekrosis sekunder dan melepaskan komponen selularnya (yang dapat menyebabka inflamasi).Pada sel yang sehat phosphatidylserine muncul pada lipatan dalam membran plasma, tetapi pada sel apoptosis phospolipid ini melipat keluar dan terekspresi pada lapisan luar dari membran, dimana dikenali oleh beberapa reseptor makrofag.Sel apoptosis yang hampir mati mensekresi faktor – faktor yang dapat larut yang kemudian menarik fagosit (Robbins et al, 2010). Beberapa dari badan apoptosis mengekspresikan thrombospondin, glikoprotein adesif yang dikenali oleh fagosit, dan makrofag sendiri dapat memproduksi protein yang mengikat sel apoptosis (tetapi tidak kepada sel yang hidup) dan oleh karena itu sel target mati di makan. Badan apoptosis dilapisi oleh 35 antibodi natural dan protein dari sistem komplemen, terutama C1q yang dikenali oleh fagosit (Robbins et al, 2010). Dengan demikian, reseptor pada fagosit dan ikatan – ikatan yang terjadi yang diinduksi pada sel apoptosis terlibat dalam proses pengikatan dan pemakanan sel ini. Proses fagositosis sel apoptosis sel ini sangat efisien yang menyebabkan sel mati hilang, bahkan dalam waktu hitungan menit, tanpa meninggalkan jejak, dan tidak terjadi inflamasi (Robbins et al, 2010). 2.2.3 Eksepresi bcl-2 Peranan bcl-2 pada apoptosis ovarium didukung melalui beberapa penemuan dalam penelitian, termasuk (i) penurunan jumlah folikel pada defisiensi bcl-2 pada tikus; (ii) ekspresi yang kuat dari bcl-2 menunjukkan penurunan dari apoptosis folikuler dan atresia; (iii) defisiensi bax pada tikus mempunyai folikel yang abnormal dengan jumlah sel granulose yang banyak; dan (iv) ekspresi bax kuat pada folikel yang atresia dibandingkan dengan folikel yang sehat (Mahmoud, 2005). Saat bcl-2 mengalami overekspresi, protein BCL-2 akan menekan apoptosis yang di induksi oleh bermacam - macam agen baik invitro maupun invivo (Allsopp et al, 1993). Kemampuan produksi protein BCL-2 yang berlebihan untuk mencegah kematian sel tanpa mempengaruhi proliferasi menyebabkan gen bcl-2 digolongkan sebagai kategori baru dari onkogen (John, 1994). 36 Gambar 2.13 Keseimbangan Proliferasi dan Kematian S el (Loren, 2008) Gangguan regulasi ekspresi bcl-2 pada jaringan neoplasma menarik dalam beberapa hal. Pertama, kemungkinan bahwa jumlah ekspresi bcl-2 yang tidak seimbang terlibat dalam transformasi neoplasma, dan kedua, ekspresi bcl-2 oleh sel tumor dapat membe rikan resistensi terhadap kemoterapi dengan menyebabkan sel terhindar dari apoptosis (Jonathan et al, 1996). Ekspresi bcl-2 te lah diteliti pada tumor solid, ter masuk non small sel paru – paru, prostat, colon, dan payudara. Ekspresi bcl-2 yang signifikan tidak menentu, tetapi secara paradoks, studi retrospektif pada non-small sel paru – paru dan karsinoma payudara menunjukkan bahwa ekspresi bcl-2 berkaitan dengan memperpa njang usia harapan hidup (Jonathan et al, 1996). B-cell lymphoma-2 (pro-survival), bax (proapoptosis) diekspresikan pada sel granulosa baik pada ovarium fetus dan d an c-myc dew asa. Bcl-2 ditemukan sebagian be sar pada folikel yang sedang berkembang seda ngkan bax biasanya terlihat pada fo likel yang atresia (Mahmoud, 2005). 37 Ekspresi protein BCL-2 ditemukan pada semua komponen dari ovarium fetus manusia (usia kandungan 19-33 minggu) yang bertujuan untuk mengatasi aktivitas apoptosis yang luas. Ekspresi ini terkait dengan level dari gonadotropin yang mana semakin tinggi gonadotropin akan meningkatkan ekspresi bcl-2 dan menurunkan ekspresi dari bax (Mahmoud, 2005). Maria, et al (1998) menemukan bahwa jaringan ovarium normal memiliki level BCL-2 yang lebih tinggi secara signifikan dibandingkan dengan jaringan ovarium neoplasma. Sedangkan jaringan normal mengekspresikan level bax, bclxl, dan bcl-xs lebih rendah dibandingkan dengan jaringan ovarium neoplasma. Data tersebut menunjukkan kemungkinan bahwa regulasi dan peran gen ini pada apoptosis mungkin berbeda dibandingkan pada karsinoma. Rauf et al melakukan penelitian pada 41 jaringan ovarium ganas dan borderline. Terdapat 63,4% sampel kanker ovarium yang mengekspresikan bcl2. Akumulasi bcl-2 ditemukan pada sitoplasma dan perinuklear.Ekspresi bcl-2 sangat kuat pada karsinoma ovarium dan lemah pada ovarium borderline, ekspresi meningkat sesuai dengan makin buruknya derajat diferensiasi tumor.Terdapat hubungan bermakna antara ekspresi bcl-2 dengan stadium penyakit dan derajat diferensiasi (Rauf, et al, 2004). 38 BAB III KERANGKA BERPIKIR, KONSEP DAN HIPOTESIS PENELITIAN 3.1 Kerangka Berpikir Dasar dari molekuler kanker adalah terjadinya kerusakan DNA namun kerusakan tersebut bersifat tidak mematikan. Terdapat empat kelas gen normal yang menjadi sasaran pokok kerusakan genetik pada patogenesis kanker, gen tersebut yaitu growth-promoting proto-oncogenes, growth-inhibiting tumorsuppressor genes, gen yang mengatur programmed cell death (apoptosis), dan genyang terlibat dalam perbaikan DNA. Mutasi yang terjadi pada gen DNA repair tidak secara langsung akan mengubah sel, akan tetapi terlebih dahulu mempengaruhi proses proliferasi atau apoptosis. Gen perbaikan DNA mempengaruhi proliferasi dan mekanisme bertahan hidup sel melalui kemampuan suatu organisme untuk dapat memperbaiki kerusakan gen yang tidak bersifat mematikan, termasuk pada proto-onkogen, tumor suppressor gen, dan gen yang mengatur apoptosis. Tidak berfungsinya gen DNA repairakan mempengaruhi sel untuk menyebarkan mutasi pada genom dan menyebabkan transformasi neoplasma. Aktivasi dari growth-promoting proto-oncogenes (contoh : gen her2-neu, ras, myc dan cdk1) dan growth-inhibiting tumor suppressor genes (contoh : gen p53) yang disertai dengan kegagalan perbaikan DNA (contoh : gen brca1 dan brca2) akan menyebabkan proliferasi sel yang tidak terkontrol. Sedangkan mutasi pada 39 gen yang mengatur programmed cell death/apoptosis (contoh : gen bax dan bcl2) akan menyebabkan penurunan dari aktivitas apoptosis. Salah satu mutasi gen pengatur apoptosis yang dikenal luas adalah bcl-2. Protein BCL-2 berperan dalam mengontrol permeabilitas mitokondria dan mencegah kebocoran protein mitokondria seperti sitokorom c yang memiliki kemampuan untuk mencetuskan kematian sel (apoptosis).Overekspresi bcl-2 dapat mencegah atau secara nyata mengurangi kematian sel yang diinduksi oleh berbagai macam stimulus. Derajat diferensiasi merupakan hasil penilaian mikroskopis untuk menentukan keagresifan atau sifat biologis dari sel kanker, sesuai dengan peran mutasi gen bcl-2 dalam proses malignansi kanker ovarium, terjadinya proliferasi sel yang tidak terkontrol dengan penurunan dari aktivitas apoptosis akan menyebabkan pertumbuhan dari sel kanker ovarium, dan selanjutnya akan mempengaruhi derajat diferensiasi sel kanker tersebut. 3.2 Konsep Penelitian Secara skematis konsep penelitian ditunjukkan pada bagan 3.1 bcl-2 Derajat Diferensiasi Baik (G1) Derajat Diferensiasi Sedang (G2) Bagan 3.1 Konsep Penelitian 40 Derajat Diferensiasi Buruk (G3) 3.3 Hipotesis Adapun hipotesis pada penelitian ini adalah sebagai berikut: Terdapat hubungan antara ekspresi protein BCL-2 dengan derajat diferensiasi sel pada kanker ovarium epitelial. 41 BAB IV METODE PENELITIAN 4.1 Rancangan Penelitian Rancangan penelitian berupa observasional analitik (cross-sectional), sampel yang dipilih adalah jaringan blok parafin pasien penderita kanker ovarium dengan derajat diferensiasi baik, sedang, dan buruk yang diperiksa dengan pengecatan immunohistokimia untuk mengetahui adanya hubungan dengan overekspresi bcl-2 pada jaringan blok parafin . Kanker ovarium epitelial Derajat diferensiasi baik Derajat diferensiasi sedang Derajat diferensiasi buruk Ekspresi bcl-2 (+)/(-) Ekspresi bcl-2 (+)/(-) Ekspresi bcl-2 (+)/(-) Bagan 4.1. Rancangan Penelitian 4.2. Lokasi dan Waktu Penelitian Penelitian ini dilaksanakan di Bagian Obstetri dan Ginekologi, Patologi Anatomi, dan Rekam Medis Rumah Sakit Umum Pusat (RSUP) Sanglah, Denpasar.Waktu Penelitian dilaksanakan mulai bulan Januari 2012 sampai bulan Desember 2013. 42 4.3 Ruang Lingkup Penelitian Adapun populasi target penelitian adalah semua pasien dengan kanker ovarium epitelial. Populasi terjangkau penelitian adalah semua pasien kanker ovarium epithelial yang telah menjalani pembedahan laparotomi di RSUP Sanglah dari tahun 2011 sampai 2013, dimana jaringan hasil pembedahannya tersebut telah dibuat blok parafin di bagian Patologi Anatomi RSUP Sanglah. 4.4 Penentuan Sumber Data Sampel penelitian ini adalah semua blok parafin pasien kanker ovarium epitelial di bagian Patologi Anatomi RSUP Sanglah yang berasal dari pasien kanker ovarium epitelial yang telah menjalani pembedahan di RSUP Sanglah dari tahun 2011 sampai 2013 serta memenuhi kriteria inklusi dan eksklusi. 4.4.1 Kriteria inklusi Kriteria inklusi penelitian adalah : a. Blok parafin dari pasien yang terdiagnosis kanker ovarium epitelial dengan kualitas blok parafin baik (tidak rusak) dan dapat dilakukan pemeriksaan imunohistokimia bcl-2 dan pemeriksaan histopatologi derajat diferensiasi sel kanker ovarium epitelial. b. Data rekam medis yang lengkap 4.4.2 Kriteria eksklusi Kriteria eksklusi penelitian adalah : Blok parafin dari pasien kanker ovarium epitelial yang sebelumnya pernah menjalani kemoterapi atau radiasi (neoadjuvant) sebelum pembedahan. 43 4.4.3 Perhitungan besar sampel Besar sampel pada penelitian ini dihitung dengan menggunakan rumus sebagai berikut (Araoye, 2003): ____ _ N= (__) _ (1) _ Keterangan: N = besar sampel Zα = 1,96 (α = 0,05) P = 15,4% (prevalensi derajat diferensiasi sedang kanker ovarium epitelial tipe serous di populasi) q = 84,6% (1-p) d = 10 % (penyimpangan absolut penelitian) Berdasarkan hasil perhitungan dengan menggunakan rumus di atas, diperoleh besar sampel penelitian adalah 50,04 buah. Sehingga dalam penelitian ini diambil sampel penelitian sebanyak 51 buah. 4.4.4 Cara pengambilan sampel Sampel diambil dari blok parafin pasien kanker ovarium epithelial yang telah menjalani pembedahan di RSUP Sanglah dari tahun 2011 sampai 2013 serta telah memenuhi kriteria inklusi dan eksklusi, kemudian dipilih dengan cara random sampling sebanyak 51 buah. 4.5 Variabel Penelitian 4.5.1 Identifikasi variabel Identifikasi variabel adalah sebagai berikut : Variabel bebas : ekspresi protein B-cell lymphoma-2 (BCL-2) 44 Variabel tergantung : derajat diferensiasi kanker ovarium epithelial Variabel terkontrol : Umur, paritas, Indek Massa Tubuh (IMT), 4.5.2 Definisi operasional variabel Definisi operasional variabel penelitian adalah sebagai berikut. a. Kanker ovarium epitelial adalah keganasan pada ovarium dimana jaringannya berasal dari jaringan epitelial coelomicatau mesotelium b. Ekspresi protein BCL-2 adalah protein BCL-2 pada sediaan kaca objek yang terwarnai granula coklat pada sebagian besar perinuklear dan sitoplasma sel epitelial, yang mana merupakan lokasi dari mitokondria dan retikulum endoplasma menggunakan teknik imunohistokimia/IHC (monoklonal) dan dilihat dalam suatu lapangan pandang mikroskopis dengan pembesaran 400x kemudian dihitung secara semi-kuantitatif. b.1 Dinyatakan overekspresi jika terwarnai coklat lebih dari 10% (positif). b.2 Dinyatakan tidak overekspresi jika terwarnai coklat kurang atau sama dengan 10% (negatif) (Yamashita, 2004). c. Derajat diferensiasi adalah tingkat diferensiasi yang dinilai menurut Shimizu-Silverberg grading system.Sistem ini membagi derajatdiferensiasi tumor menjadi berdasarkan pola arsitektur yang dominan, derajat atipia inti, dan indeks mitosis (Malpica et al, 2004).Pola arsitektur sel kanker ditentukan melalui bagian yang paling dominan yaitu glandular, papiler, dan bentuk solid Atipia sitologi dievaluasi pada area tumor yang paling atipik. Atipia ringan jika sel dengan inti vesikuler 45 relatifuniform, tanpa adanya penggumpalan kromatin atau anak inti yang prominen. Atipia sedang jika variasi bentuk dan ukuran inti sedang, anak inti dapat diamati tetapi kecil, kromatin inti menggumpal, tidak ada bizarre.Atipia berat jika bentuk dan ukuran inti sangat bervariasi,kromatin inti sangat menggumpal, membran inti tebal, anak inti prominen eosinofilik, dan dapat dijumpai bizarre.Jumlah mitosis dihitung pada area yang paling aktif. c.1 Derajat diferensiasi baik (G1) adalah apabila skor total ShimizuSilverberg grading system adalah 3-5 c.2 Derajat diferensiasi sedang (G2) adalah apabila skor total Shimizu-Silverberg grading system adalah 6-7 c.3 Derajat diferensiasi buruk (G3) adalah apabila skor total Shimizu-Silverberg grading system adalah 8-9 d. Umur adalah usia pasien dalam tahun yang diperoleh dari rekam medis pasien. e. Paritas adalah Jumlah janin viabel yang dilahirkan, diperoleh dari rekam medis pasien. f. Indek Massa Tubuh (IMT) adalah indek antropometri yang dihitung dengan menggunakan parameter berat badan dan tinggi badan, yaitu berat badan (dalam kilogram) dibagi dengan kuadrat dari tinggi badan (dalam meter). Berat badan dan tinggi badan diperoleh dari catatan rekam medis. Kemudian hasil perhitungan tersebut dimasukkan dalam kelompok 46 berdasarkan kategori IMT menurut Departemen kesehatan (Depkes) tahun 1994 (tabel 4.1) Tabel 4.1 Kategori Indek Massa Tubuh (IMT) untuk Indonesia 2 IMT(kg/m ) Kategori Kurang berat badan berat < 17,0 Kurang berat badan ringan 17,0 – 18,5 Normal > 18,5 – 25,0 Kelebihan berat badan ringan > 25,0 – 27,0 Kelebihan berat badan berat > 27,0 4.6 Instrumen Penelitian Instrumen yang digunakan dalam penelitian adalah formulir penelitian, komputer, alat tulis serta perlengkapan lainnya termasuk didalamnya instrumen pengecatan imunohistokimia. 4.7 Prosedur penelitian Prosedur penelitian adalah sebagai berikut : 1. Mengumpulkan blok parafin dari pasien kanker ovarium epitelial yang menjalani pembedahan di RSUP Sanglah dari tahun 2011 sampai 2013 di bagian Patologi Anatomi RSUP Sanglah. 2. Blok parafin tersebut telah diperiksa secara histopatologis di Bagian Patologi Anatomi dan telah terdiagnosis secara histopatologis sebagai kanker ovarium epitelial. 3. Blok parafin pasien kanker ovarium epitelial selanjutnya harus memenuhi kriteria inklusi dan eksklusi penelitian. 47 4. Blok parafin yang telah memenuhi kriteria inklusi dan eksklusi, kemudian dipilih dengan cara random sampling sebanyak 51 buah. 5. Sampel blok parafin ini dilakukan pemeriksaan penentuan derajat diferensiasi yaitu : derajat diferensiasi baik, sedang, dan buruk 6. Pada blok parafin yang sama kemudian dilakukan pemeriksaan ekspresi bcl2 dengan teknik imunohistokimia. 7. Akhirnya, dilakukan analisis terhadap hasil pemeriksaan ekspresi bcl-2 pada masing-masing kelompok derajat diferensiasi kanker ovarium epitelial. 48 Blok parafin pasien kanker ovarium epitelial Kriteria inklusi Kriteria eksklusi Sampel penelitian Random sampling Pemeriksaan Derajat diferensiasi sel kanker ovarium Ekspresi bcl-2 Analisis Bagan 4.2. Alur Penelitian 4.8 Pengumpulan dan Analisis Data 4.8.1 Pengumpulan data Data hasil penelitian yang diperoleh dari bagian Obstetri dan Ginekologi, Patologi Anatomi, dan Rekam Medis RSUP Sanglah dikumpulkan dan dimasukkan dalam formulir penelitian (terlampir). 4.8.2 Analisis data 49 Data pada formulir penelitian kanker ovarium diolah dengan menggunakan SPSS 17,0 for windows. Kemudian dilakukan beberapa tes atau uji, antara lain adalah sebagai berikut: a. Karakteristik sampel disajikan secara deskriptif, dengan menggunakan tabel. b. Uji One sample KS untuk mengetahui normalitas data, uji One Way Anova serta Uji Kruskal-Wallis untuk membandingkan nilai rerata masing-masing variabel digunakan. c. Uji Spearman digunakan untuk mengetahui hubungan antar variabel penelitian. 50 BAB V HASIL PENELITIAN Penelitian dengan rancangan observasional analitik (cross-sectional), yang dilaksanakan di Bagian Obstetri dan Ginekologi, Patologi Anatomi, dan Rekam Medis RSUP Sanglah, Denpasar, mulai bulan Januari 2012 sampai bulan Desember 2013. Sampel adalah jaringan blok parafin pasien penderita kanker ovarium epitelial yang diperiksa dengan pengecatan immunohistokimia. Dari 60 sampel yang didapatkan dipilih sebanyak 51 buah dengan carasimple randomsampling. Sampel hematoxylin-eosinuntuk yang terpilih melihat derajat tersebut dilakukan diferensiasi dan pewarnaan pewarnaan imunohistokimia untuk melihat ekspresi protein BCL-2 kemudian dianalisis. 5.1 Karakteristik Sampel Penelitian Data karakteristik subjek yang meliputi umur, paritas, dan IMT disajikan pada Tabel 5.1. Tabel 5.1 Karakteristik subjek yang meliputi umur, paritas, IMT Derajat Diferensiasi Variabel Baik P Sedang Buruk (n=15) (n=17) (n=19) Umur (tahun) 49,00±9,58 43,41±11,33 48,11±8,25 0,217 Paritas 1,80±1,42 1,59±1,18 1,84±1,26 0,809 IMT 23,25±5,20 22,88±4,35 21,02±2,34 0,363 51 Tabel 5.1 di atas, menunjukkan bahwa dengan uji One Way Anova dan UjiKruskal-Wallis didapatkan nilai P > 0,05 pada ketiga variabel. Hal ini berartibahwa tidak ada perbedaan nilai rerata antar kelompok pada masingmasing variabel. 5.2 Hubungan Antara Ekspresi Protein BCL-2 Dengan Derajat Diferensiasi Sel Pada Kanker Ovarium Epitelial Untuk mengetahui hubungan antara ekspresi BCL-2 dengan derajat diferensiasi sel pada kanker ovarium epitelial dipakai uji Spearman.Hasil analisis disajikan pada Tabel 5.2. Tabel 5.2 Hubungan antara ekspresi protein BCL-2 dengan derajat diferensiasi sel pada kanker ovarium epitelial Derajat Diferensiasi Baik Positif Sedang 2 9 Buruk r 8 BCL-2 0,217 Negatif 13 8 p 0,127 11 Tabel 5.2 di atas menunjukkan bahwa tidak terdapat hubungan antara ekspresi protein BCL-2 dengan derajat diferensiasi sel pada kanker ovarium epitelial (r=0,217, P=0,127). 52 BAB VI PEMBAHASAN Kanker ovarium epitelial merupakan kanker ovarium dengan tipe histologis yang terbanyak.Sampai saat ini etiologi dan patogenesis kanker ovarium epitelial belum jelas. Mutasi pada gen yang berperan dalam proses karsinogenesis dimana salah satunya gen pengatur apoptosis diperkirakan berperan penting dalam perkembangan sel epitel kanker ovarium. Gen utama yang telah dikenal berperan dalam proses apoptosis adalah B cell lymphoma-2 (bcl-2) dimana berperan sebagai antiapoptosis. Untuk mengetahui hubungan antara ekspresi protein BCL-2 dengan derajat diferensiasi sel pada kanker ovarium epitelial maka dilakukan penelitian crosssectional, yang dilaksanakan di Bagian Kebidanan dan Penyakit Kandungan,Patologi Anatomi dan Rekam Medis RSUP Sanglah, Denpasar dari bulan Januari 2012 sampai bulan Desember 2013 dengan jumlah sampel 51 buah blok parafin. 6.1 Karakteristik Subyek Penelitian ini menggunakan 51 buah blok parafin sebagai sampel yang telah memenuhi kriteria inklusi dan kriteria eksklusi, yang terdiri dari 15 buah blok parafin dengan derajat diferensiasi baik, 17 buah dengan derajat sedang, dan 19 buah dengan derajat buruk. Dari hasil penelitian didapatkan rerata umur kelompok derajat diferensiasi baik adalah 49,00±9,58 tahun, rerata umur kelompok derajat sedang adalah 43,41±11,33 tahun, dan rerata umur kelompok derajat buruk adalah 48,11±8,25 53 tahun, dengan nilai P = 0,127. Hal ini berarti bahwa tidak ada perbedaan umur antar kelompok derajat diferensiasi. Hasil ini sesuai berdasarkan data distribusi umur pada kanker ovarium di Indonesia tahun 2002 dimana didapatkan bahwa kanker ovarium paling banyak pada usia 35 – 54 tahun dengan puncak umur penderita kanker ovarium adalah umur 45 - 54 tahun (Aziz, 2009). Sedangkan di Amerika Serikat insiden kanker ovarium meningkat sejalan dengan meningkatnya umur. Lebih dari 80% kanker ovarium terjadi pada umur lebih dari 45 tahun, dimana umur rata – rata adalah 63 tahun (Permuth-Wey dan Sellers, 2009). Hal tersebut sesuai dengan salah satu mekanisme terjadinya kanker ovarium yaitu berdasarkan pada teori incessant ovulation.Berdasarkan teori ini risiko kanker ovarium epitelial berkaitan secara langsung dengan jumlah siklus ovulasi yang belum terganggu. Saat ovulasi, permukaan epitelium rusak kemudian akan mengalami proliferasi dan perbaikan yang cepat. Pada saat ovulasi, terjadi invaginasi permukaan epitelium ke stroma dibawahnya yang akan membentuk kista inklusi. Garis epitelium dari kista inklusi tersebut kemudian akan mengalami transformasi neoplasma dibawah pengaruh dari faktor – faktor onkogen. (John et al, 2008). Rerata paritas kelompok derajat diferensiasi baik adalah 1,80±1,42, rerata paritas kelompok derajat sedang adalah 1,59±1,18, dan rerata paritas kelompok derajat buruk adalah 1,84±1,26, dengan nilai P = 0,809. Hal ini berarti bahwa tidak ada perbedaan paritas antar kelompok derajat diferensiasi. 54 Risiko kanker ovarium menurun secara progresif dengan meningkatnya jumlah kehamilan (John, 2008).Kaitan antara kehamilan dan risiko kanker ovarium telah banyak diteliti.Kehamilan menyebabkan anovulasi dan menekan sekresi gonadotropin di hipofisis.Wanita multipara diperkirakan memiliki risiko yang lebih rendah 30-60% terhadap kanker ovarium dibandingkan wanita nulipara. Lebih lanjut,setiap tambahan kehamilan aterm akan menurunkan risiko kanker ovarium sekitar 15% (Permuth-Wey dan Sellers, 2009). Paparan gonadotropin dosis tinggi terhadap eptelium ovarium secara persisten dapat menghasilkan transformasi neoplasma.Follilce stimulating hormone (FSH) telah diketahui dapat meningkatkan pertumbuhan sel epitelial kanker ovarium secara invitro. Menurut hipotesis ini peningkatan level sirkulasi gonadotropin akanmeningkatkan biosintesis estrogen pada stroma ovarium, yang kemudian akan menyebabkan proliferasi abnormal dari epitel yang berdekatan (John et al, 2008). Rerata IMT kelompok derajat diferensiasi baik adalah 23,25±5,20 kg/m2, rerata IMT kelompok derajat sedang adalah 22,88±4,35 kg/m2, dan rerata IMT kelompok derajat buruk adalah 21,02±2,34 kg/m2, dengan nilai P = 0,363. Hal ini berarti bahwa tidak ada perbedaan IMT antar kelompok derajat diferensiasi. Hubungan antara faktor hormonal terhadap risiko kanker ovarium menimbulkan pertanyaan mengenai pengaruh potensial lain dari kadar estrogen yang bersirkulasi. IMT mengukur lemak tubuh yang dikalkulasikan dari berat dalam kilogram dibagi tinggi dalam meter kuadrat.Pada wanita terutama yang postmenopause sumber estrogen yang bersirkulasi berkaitan dengan aromatisasi androgen pada jaringan adiposa (Permuth-Wey dan Sellers, 2009). 55 Schouten et al melakukan penelitian mengenai hubungan IMT dengan risiko kanker ovarium, didapatkan bahwa IMT ≥ 30 memiliki relative risk 1.03 (95% CI, 0.86-1.22) dibandingkan wanita dengan IMT 18.5 sampai 23. Dengan perbandingan yang sama didapatkan relative risk 1.72 1.72 (95% CI, 1.02-2.89) pada wanita premenopause dan 1.07 (95% CI, 0.87-1.33) pada wanita postmenopause. Disimpulkan bahwa IMT tidak berkaitan dengan risiko kanker ovarium pada wanita postmenopause tetapi memiliki hubungan positif pada wanita premenopause (Schouten et al, 2008). 6.2 Hubungan Antara Ekspresi Protein BCL-2 Dengan Derajat Diferensiasi Sel Pada Kanker Ovarium Epitelial Pada penelitian ini didapatkan ekspresi protein BCL-2 sebanyak 2 dari 15 sampel (13,3%) pada derajat diferensiasi baik, 9 dari 17 sampel (52,9 %) pada derajat diferensiasi sedang dan 8 dari 19 sampel (42,1%) derajat diferensiasi buruk. Dengan uji Spearman didapatkan bahwa tidak terdapat hubungan antara ekspresi protein BCL-2 dengan derajat diferensiasi sel pada kanker ovarium epitelial dengan nilai P=0,127. Hasil ini sesuai dengan penelitian yang dilakukan oleh Sagarra et al, dimana didapatkan ekspresi protein BCL-2 sebanyak 8% pada derajat diferensiasi baik, 21% pada derajat diferensiasi sedang dan 24% pada derajat diferensiasi buruk. Walaupun kecenderungan intensitas pewarnaan yang semakin meningkat dengan meningkatnya derajat diferensiasi, akan tetapi tidak ada korelasi langsung antara ekspresi protein BCL-2 dan derajat diferensiasi sel kanker ovarium tipe epitelial (P=0.56) (Sagarra, 2002). Arik dan Kulacoglu juga mendapatkan bahwa tidak ada hubungan antara ekspresi protein BCL-2 dengan 56 derajat diferensiasi sel kanker ovarium dimana ekspresi bcl-2 sebanyak 33% pada derajat diferensiasi baik, 33,3% pada derajat diferensiasi sedang dan tidak ada pewarnaan pada derajat diferensiasi buruk (Arik dan Kulacoglu, 2010) Hasil tersebut berbeda dengan beberapa penelitian lain. Penelitian yang dilakukan di Indonesia oleh Rauf et al menemukan bahwa terdapat korelasi yang signifikan antara derajat diferensiasi sel kanker ovarium dengan ekspresi protein BCL-2, dimana derajat diferensiasi buruk memiliki pewarnaan yang lebih kuat dibandingkan derajat diferensiasi yang lebih baik (P=0.023) (Rauf et al, 2004). Sedangkan Chan et al melakukan penelitian dimana didapatkan penurunan ekspresi protein BCL-2 yaitu 30% pada derajat diferensiasi baik, 27% pada derajat diferensiasi sedang, dan 7% pada derajat diferensiasi buruk. (Chan et al, 2000). Lukyanova et al menemukan bahwa pewarnaan bcl-2 secara mayoritas didapatkan pada kanker ovarium epitelial dengan derajat diferensiasi baik (Lukyanova et al, 2000). Skirnisdóttir et al juga menyatakan hubungan terdapat terbalik antara ekspresi protein BCL-2 dengan derajat diferensiasi (P=0.034) pada kanker ovarium epitelial (Skirnisdóttir et al, 2002). Preethi et al menemukan penurunan secara gradual ekspresi protein BCL-2 pada kanker ovarium dengan derajat diferensiasi buruk (Preethi et al, 2002).Elnashar dan Hafez juga menemukan hubungan terbalik antara ekspresi protein BCL-2 dan derajat diferensiasi kanker ovarium epitelial (P<0.005) (Elnashar dan Hafez, 2012). Adapun perbedaan ekspresi protein BCL-2 pada penelitian ini dengan beberapa penelitian yang lain dapat disebabkan oleh karena adanya ketidakseragaman pada fase preanalitik dan fase analitik, Perbedaan pada fase 57 preanalitik adalah fase yang dimulai sejak jaringan dikeluarkan dari tubuh penderita sampai jaringan siap diproses untuk pemeriksaan imunohistokimia, dalam hal ini jaringan beku atau jaringan yang telah di blok parafin dan fiksasi jaringan yang dipergunakan, hal tersebut akan mempengaruhi hasil pemeriksaan imunohistokimia. Demikian pula dengan fase analitik, fase dimana jaringan mulai diproses sampai menjadi sediaan yang siap diintrepretasi oleh patologik terutama dalam hal antibodi primer yang dipergunakan.Perbedaan kriteria interpretasi yang dipergunakan pun juga mempengaruhi hasil penelitian. Pada penelitian ini tidak didapatkan hubungan antara ekspresi protein BCL2 dengan derajat diferensiasi sel kanker ovarium epitelial dapat dikarenakan untuk terjadinya suatu proses keganasan membutuhkan beberapa gen yang terlibat dalam jalur karsinogenesis yang multistep. Gen tersebut dibagi menjadi empat kelompok, yaitu onkogen sebagai gen pemicu pertumbuhan sel (her2-neu, ras, myc, dan cdk1), inaktivasi gen supresor tumor (brca1, brca2 dan p53), perubahan pada gen apoptosis (bax dan bcl-2), dan kerusakan gen yang terlibat pada perbaikan DNA (brca 1 dan brca 2). Mutasi yang terjadi pada gen-gen tersebut berperan dalam proses karsinogenesis termasuk dalam tingkat derajat diferensiasi sel dan proses apoptosis, sehingga gen bcl-2 bukan satu – satunya gen yang berperan dalam diferensiasi sel dan apoptosis (Robbins et al, 2010). Mutasi gen yang banyak diteliti pada perkembangan kanker ovarium epitelial diantaranya mutasi onkogenik k-ras. Famili dari ras onkogen terdiri dari k-ras, h-ras dan n-ras. Produk protein dari famili ras tersebut berperan pada regulasi siklus sel dan mengontrol proliferasi dari sel. Mutasi ras terlibat dalam karsinogenesis 58 melalui perannya menghambat apoptosis seluler dan meningkatkan proliferasi seluler. Mutasi gen ini banyak didapatkan pada kanker ovarium yang berkembang dari perubahan akumulasi genetik yang mengarah kepada transformasi keganasan dari kista jinak menjadi tumor LMP (Low malignant Potential) dan pada akhirnya berkembang menjadi karsinoma ovarium invasif (Makarla, 2005; Schorge, 2008). Kanker invasif yang berkembang dari tumor LMP juga mengalami mutasi pada p53 tumor suppressor gen (Schorge, 2008). Gen berikutnya adalah gen brca. Wanita yang dilahirkan dengan mutasi BRCA hanya membutuhkan satu “pengaruh” kepada copy normal yang lain (alel) untuk “melumpuhkan” produk dari brca tumor suppressor gen. Brca-terkait ovarium dan kanker peritoneal memiliki patogenesis molekuler yang unik, karena membutuhkan inaktivasi p53 untuk berkembang (Buller, 2001). P53 adalah tumor suppressor gen yang telah dipetakan pada kromosom 17. Produk proteinnya dapatmencegah sel memasuki tingkat selanjutnya dari pembelahan sel dan dengan demikian akan terjadi penghentian dari replikasi sel tumor yang tidak terkontrol. Mutasi pada p53 berkaitan dengan bermacam kanker. Hilangnya fungsi brca dan p53 yang terdeteksi sebelum invasi, mendukung anggapan lebih lanjut mengenai gen – gen tersebut penting pada tahap awal pencetus tumor (Schorge, 2008). Fungsi utama bcl-2 pada sel epitel ovarium permukaan belum begitu jelas. Protein BCL-2 selain berperan dalam menghambat proses apoptosis, juga diperkirakan berperan penting dalam menjaga fungsi fisiologis normal dan integritas dari epitel permukaan ovarium yang mengalami ovulasi. Penekanan regulasi dari protein BCL-2 dapat mengganggu fisiologis normal epitel ovarium 59 normal yang dapat menyebabkan perubahan abnormal bahkan keganasan. Diebold et al melaporkan bahwa apoptosis terjadi paling banyak pada tumor dengan derajat diferensiasi buruk, hal tersebut menyatakan bahwa walaupun tumor ganas menunjukan aktivitas proliferatif yang tinggi, secara relatif terjadi aksi dari apoptosis yang tinggi, hal tersebut menunjukkan bahwa terjadi proses penggantian sel yang tinggi pada tumor ini (Chan et al, 2000). Selain itu beberapa penelitian menunjukkan bahwa terdapat gen lain yang berhubungan dengan bcl-2 dalam proses apoptosis. Gen yang paling banyak diteliti adalah p53. Apoptosis secara signifikan lebih tinggi pada tumor dengan derajat diferensiasi buruk dibandingkan dengan tumor derajat diferensiasi baik atau sedang, dimana tumor dengan derajat diferensiasi buruk menunjukkan overekspresi p53 dan berkurangnya ekspresi bcl-2.Beberapa penelitian menunjukkan bahwa overekspresi mutan p53 dapat menginduksi penekanan bcl2 pada tingkat mRNA dan protein.Juga telah ditunjukkan bahwa wild dan mutan p53 menekan bcl-2 dengan mengikat elemen trankripsi silencer dengan promoter bcl-2 (Preethi et al, 2002). Ekspresi protein juga dipengaruhi oleh proses sintesis protein oleh gen. Sintesis protein secara garis besar dibagi menjadi dua tahap, yaitu tahap transkripsi (mengkopi informasi DNA menjadi molekul lain yang dinamakan RNA messenger) dan tahap translasi (sintesis protein dari asam amino dengan menggunakan RNA messenger sebagai blueprint). Tahap transkripsi terjadi di nukleus sel, terdiri dari tiga proses yaitu, inisiasi (RNA polymerase mengikat DNA pada tempat yang spesifik yang dinamakan promoter, berlokasi dekat 60 dengan bagian awal gen), elongasi (RNA polymerase membentuk ribonukleotida yang sesuai untuk membentuk mRNA), terminasi (RNA polymerase dikenal pada bagian ujung gen). Tahap translasi terjadi pada sitoplasma sel, terdiri dari tiga tahap yaitu, inisiasi (ribosom mengikat mRNA, dan bergerak sepanjang untai membaca 3 nukleotida secara bersamaan), elongasi (tRNA menghantarkan asam amino yang sesuai untuk membentuk polypeptida), terminasi (tRNA mencaoai 3 urutan basa yang merupakan sinyal untuk berhenti, dan polypeptide dilepaskan). Pada kanker ovarium dapat terjadi kerusakan gen. Kerusakan dan gangguan yang terjadi pada proses transkripsi maupun translasi pada gen bcl-2 akan menyebabkan tidak terjadi sintesis protein atau sintesis protein yang tidak sesuai dengan seharusnya. Hal tersebut dapat menyebabkan lemahnya ekspresi protein bcl-2 pada kanker ovarium epitelial (Moat A. G. et al, 2002) 61 DAFTAR PUSTAKA Anonim, 2011, BCL-2. [cited 2011 November http://users.rcn.com/jkimball.ma.ultranet/BiologyPages/B/BCL-2.html 12] Alan, H. D., Lauren, N. 2002. Premalignant and Malignant Disorder of The Ovaries and Oviduct. Current obstetric & gynecology diagnosis and treatment. Eight edition. United States of America : The McGraw-Hill Companies. Chapter 49. Araoye, M. O. 2003. Sample Size in: Research Methodology with Statistic for Health and Social Sciences. Ilorin: Nathadex Publishers. p. 115-122. Arik, D. and Kulaçoğlu, S. 2011. p53, bcl-2, and nm23 Expressions in Serous Ovarian Tumors: Correlation with the Clinical and Histopathological Parameters. Cilt; 1: 38-45 Aziz, M. F. 2009. Gynecological Cancer In Indonesia. J Gynecol Oncol.vol 20; 1:8-10 Badan Registrasi Kanker. 2006. Kanker di Indonesia Tahun 2006 DataHistopatologik. Jakarta: Yayasan Kanker Indonesia. Berek, J. S., Hacker, N. F. 2005. Epithelial Ovarian Cancer.PracticalGynecologic Oncology, 4th ed. Philadelphia : Lippincott Williams & Wilkins.p.443-509. Buller, R. E., Lallas, T. A., Shahin, M. S. 2001. The p53 Mutational Spectrum Associated with BRCA1 Mutant Ovarian Cancer. Clin Cancer Res 7, pp. 831. Busman, B. Aziz, M. .F., Andriono, Siafuddin, A .B 2008. Kanker Ovarium. Buku Acuan Nasional Onkologi dan Ginekologi. Jakarta: Yayasan Bina PustakaSarwono Prawirohardjo. Chan, W. Y., Kwok-Kuen, C., John, O. S., Lee-Wen H, William R. W, Debra A. B Ross S. B and Samuel C. M. 2000. Short Communication : Bcl-2 and p53 Protein Expression, Apoptosis, and p53 Mutation in Human Epithelial Ovarian Cancers. American Journal of Pathology, Vol. 156, No. 2,pp. 409-417. Colditz, G. A. 2004. Handbook of Cancer Risk Assesment and Prevention. (serial online), [cited 2010 Aug. 18). Available from: URL: http://riskfactor.cancer.gov/cancer_risk_prediction/workshop/JNCI_Workshop_C ommentary.pdf. 62 Danukusumo, D. 1991. Akurasi Pembedahan Kanker Ovarium, Tinjauan Retrospektif di RS Cipto Mangunkusumo 1991.Simposium Keganasan Ovarium.PTP POGI IX, Bandung. David, O. M. 2007. The Cell Cycle in Cancer.The Cell Cycle principles ofcontrol, pp. 248-267. Djuana, A., Rauf, S., Manuaba, I. B. G. F. 2001. Pengenalan Dini Kanker Ovarium. Makalah ilmiah PIT XII POGI Palembang. Elnashar, A. T., and Hafez, A. S. 2012.Immunohistochemical Expression of CD44V6, P53 and BCL-2 in Epithelial Ovarian Tumors.Journal of AmericanScience; 8(8):258-264. Fadlan. 1993. “Tinjauan Kasus Neoplasma Ovarium Ganas di Rumah Sakit Dr. Pirngadi Medan (1981–1990)” (tesis) Medan : Universitas Sumatera Utara. Fauzan, R. 2009. “Gambaran Faktor Penggunaan Kontrasepsi Terhadap Angka Kejadian Kanker Ovarium di RSUPN Dr. Cipto Mangunkusumo Jakarta berdasarkan pemeriksaan histopatologik tahun 2003-2007” (tesis). Jakarta: Universitas Indonesia. Granstrom, C. 2008. Population Attributable Fractions for Ovarian Cancerin Swedish Women by Morphological Type. (serial online), [cited 2010 Oct. 21].Available from: URL: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2359681/. Gunawan, P. 1979. Neoplasma Ovarium Ganas di RS Dr Sutomo Surabaya selama 3 tahun (Oktober 1974–Oktober 1977).Naskah Lengkap KOGI IV.hal 629-38. Hockenbery, D. M., Nunez, G., Milliman, C., Schreiber, R. D., and Korsmeyer, S. J. 1990. Bcl-2 Is An Inner Mitochondrial Membrane Protein That Blocks Programmed Cell Death. Nature 348, pp. 334-336. Huston, L. M. 2006. Cell Differentiation and Natural Compounds ThatInduced Differentiation Induce-Differentiation [cited 2010 Nov.24]. Availablefrom : http://www.physiolcell.org/sch/art/17/. Ishioka, S., Sagae, S., Terasawa, K., Sugimura, M., Nishioka, Y., Tsukada, K., Kudo, R. 2003. Comparison of the Usefulness Between a New Universal Grading System for Epithelial Ovarian Cancer and the FIGO Grading System. Gynecologic Oncology, 89(3). p. 447-452. John, A. R., Howard, W. J. III. 2008. Ovarian Cancer: Etiology, Screening, and Surgery. Te Linde’s Operative Gynecology tenth edition. United State of America : Lippincott Williams & Wilkins. Chapter 49. 63 John, C. R,. 1994. Bcl-2 and the Regulation of Programmed Cell Death. jcb.rupress.org, pp. 1-6 Jonathan, O. J. H., Aristides, G. E., Jane, W., Gerald, N., Lawrence, S. Y., and David, J. K. 1996. The Prognostic Significance of Bcl-2 and p53 Expression in Ovarian Carcinoma.Cancer research. 56, pp. 2178-2184 Kartodimejo, D. 1976. Karsinoma Ovarii. Naskah Lengkap KOGI-III, Medan, hal 405-12. Karyana, K. 2005. “Profil Kanker Ovarium di Rumah Sakit Sanglah Denpasar periode Januari 2002 sampai Desember 2004” (tesis). Denpasar Universitas Udayana Kommoss, S., Schmidt, D., Hedderich, J., Harter, P., Pfisterer, J., du Bois, A. 2009. Histological Grading in a Large Series of Advanced Stage Ovarian Carcinomas by Three Widely Used Grading Systems Consistent Lack of Prognostic Significance.Virchows Arch, 454:249-256 Lahmann, P. H. 2009. Anthropometric Measures and Epithelial OvarianCancer Risk in The European Prospective Investigation into Cancer and Nutrition. (serial online), [cited 2010 Sep. 18]. Available from: URL:http://www.ncbi.nlm.nih.gov/pubmed/19821492. Lukyanova, N. Y., Kulik, G. I., Yurchenko, O. V., Shatrova, K . M., Vorobyova, L. I., Svintitsky, V. S., Evtushenko, G. V., Chekhun, V. F. Expression Of P53 And Bcl-2 Proteins In Epithelial Ovarian Carcinoma With Different Grade Of Differentiation. Experimental Oncology ;22: 91-93. Mahmoud, R. H. 2005. Apoptosis in The Ovary: Molecular Mechanisms. Human reproduction Updated vol 11 No 2, pp. 162-178 Makarla, P. B., Saboorian, M. H., Ashfaq, R. 2005. Promoter Hypermethylation Profile of Ovarian Epithelial Neoplasms.Clin Cancer Res 11, pp. 5365. Maria, M., Giovanni, S., Simona, M., Gabriella.F., Sonia, l., Anna, D. P., Pierluigi, B. P., and Salvatore, M. 1998.Bcl-2, bax, bcl-xL, and bcl-xı Expression in Normal and Neoplastic Ovarian Tissues.Clinical Cancer Research Vol. 4, pp. 517-524. Malpica, A. Deavers, M T., Lu, K., Bodurka, D. C. Atkinson, E .N. Gershenson, D. M., Silva, E .G. 2004. Grading Ovarian Serous Carcinoma Using Two Tier System. Am J Surg Pathol 28, pp. 249-504. 64 Malpica A. 2007. Interobserver and Intraobserver Variability of A Two-Tier System for Grading Ovarian Serous Carcinoma. Am J Surg Pathol 31, pp. 1168. Miguel, H. B., MaryAnn, F., Giuseppe, G. 2008.Genetic Markers in Sporadic Tumors.Principles of Molecular Oncology, pp. 83-84. Moat A. G, Foster J. W, Spector M. P. 2002. Macromolecular Synthesis And Processing : DNA, RNA, And Protein Synthesis. Microbial Physiology. Chapter 2, pp. 27 – 100 Morita, Y., and Tilly, J. L. 1999. Oocyte Apoptosis: Like Sand Through An Hourglass. Dev Biol 213, pp. 1–17 Permuth-Wey, J., and Sellers, T. A. 2009.Epidemiology of Ovarian Cancer.Methods of Molecular Biology.Cancer Epidemiology, vol. 472 Preethi, T. R., Chacko, P., Kesari, A. L., Praseeda, I., Chellam, V. G., Pillai, M. R. 2002. Apoptosis in Epithelial Ovarian Tumors.Pathol. Res. Pract. 198: 273–280. Rauf S., Rina, M., Irawan, Y. 2004.Bcl-2 Protein Expression in Ovarian Cancer.J Med Nus 25, pp. 55-58. Reed, J. C., Jurgensmeimer, J. M., and Matsumaya, S. 1998. Bcl-2 Family Proteins and Mitochondria.Biochim.Biophysis. Acta 1366, pp. 127-137. Reeves, G. K. 2007. Cancer Incidence and Mortality in Relation to Body Mass Index in The Million Women Study: Cohort Study. (serial online), [Accessed: 2010 Aug. 5]. Available from: URL: http://www.bmj.com/content/335/7630/1134.abstract. Robbins, Cotran. 2010. Molecular Basis of Cancer. Pathologic Basis ofDisease 8th edition, Saunders, an imprint of Elsevier Inc, Philadelphia. Sagarra, R. A. M., Andrade, L. A., Nartinez, E. Z., Pinto, G. A., Syrjanen, K. J., Derchain, S. F. M. 2002. P53 and Bcl-2 as Prognostic Predictors in Epithelial Ovarian Cancer.Int J Gynecol Cancer; 12: 720-727 Sahil. M. F. 2007. Penatalaksanaan Kanker Ovarium Pada Wanita Usia Muda Dengan Mempertahankan Fungsi Reproduksi. Pidato pengukuhan jabatan gurubesar tetap dalam bidang ilmu onkologi ginekologi pada fakultas kedokteran,diucapkan di hadapan rapat terbuka universitas sumatera utara, hal.1-38. Sato, Y., S., Tomihiro, M. D. A., Satoshi, M. .D., Asada, Y. M. D., Hayashi, T. M. D. 2003. Prognostic Value of Histologic Grading of Ovarian Carcinomas. Int J Gynecol Pathol, 22(1): 52-6. 65 Schorge, J. O. 2008. Epithelial Ovarian Cancer ,Ovarian Germ Cell and Sex Cord–Stromal Tumors. Williams Gynecology Section 4. Texas: The McGrawHill Companies Inc. chapter 35-36. Schouten, L. J. 2008. Height, Body Mass index, and Ovarian Cancer: aPooled Analysis of 12 Cohort Studies. (serial online), [cited 2010 Sep. 10].Available from: URL: http://info.cancerresearchuk.org/cancerstats/types/ovary/riskfactors/. Sheau, Y. S., and Aaron, J. W. H. 2000. Tissue Specific Bcl-2 Protein Partners in Apoptosis: An Ovarian Paradigm. Physiological review vol 80, No 2, pp. 593-610. Silverberg, S. G. 2000. Histopathologic Grading of Ovarian Carcinoma: A Review and Proposal. Int J Gynecol Pathol 19, pp. 7–15. Skirnisdóttir, T. Seidal, E. Gerdin, B., Sorbe. 2002. The Prognostic Importance of P53, Bcl-2, And Bax in Early Stage Epithelial Ovarian Carcinoma Treated With Adjuvant Chemotherapy. Int J Gynecol Cancer;12:265–276. Sriwidyani N P. 2008. Korelasi Ekspresi Her-2/neu Dengan Tipe Histologik dan Derajat Diferensiasi karsinoma Ovarium, (tesis), Denpasar, Universitas udayana. Stefan, K., Dietmar ,S., Friedrich, K., Juergen, H., Philipp, H., Jacobus, P., Andreas, D. B. 2009. Histological Grading in a Large Series of Advanced Stage Ovarian Carcinomas by Three Widely Used Grading Systems: Consistent Lack of Prognostic Significance. A Translational Research Subprotocol of a Prospective Randomized Phase III Study (AGO-OVAR 3 Protocol).Virchows Arch 454, pp. 249–256. Tavasolli, F. A., and Devilee, P. 2003. Tumours of the Ovary and Peritoeum. Lyon: IARC Press, p. 113-202. Tsujimoto, Y., Finger, L. R., Yunis, J., Nowell, P. C., Croce, C. M. 1984. "Cloning of the Chromosome Breakpoint of Neoplastic B Cells With The T (14;18) Chromosome Translocation". Science 226 (4678), pp. 1097–1099. Tsujimoto, Y., Cossman, J., Jaffe, E., and Croce, C. 1985. Involvement of the Bcl-2 Gene in Human Follicular Lymphoma.Science (Was. DC) 228, pp. 1449-1443. Vang, R., Shih, I., Kurman, R.J. 2009.Ovarian Low-grade and High-grade Serous Carcinoma; Pathogenesis, Clinicopathologic and Molecular Biologic Features, and Diagnostic Problems.Adv Anat Pathol. 16: 267-282. 66 Vaux, D. L., Silke, J. 2003. Mammalian Mitochondrial IAP Binding Proteins.Biochem Biophys Res Commun 304, pp. 499. Wheeler, J.E. 2001. Histopathology of Ovarian Cancer in: Rubin, S.C., nd Sutton, G.P., editors. Ovarian Cancer, 2 .Ed.Lippincott Williams&Wilkins.p.201-218. Yamashita. 2004. P53 and BCL-2 Sscoring. Breast Cancer.Res. 6, pp. 24-30. 67 Data Penelitian No 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 CM 01.44.62.10 01.44.94.40 01.45.18.86 01.45.44.57 00.44.13.72 01.46.84.91 01.46.67.88 01.44.95.40 01.46.61.79 01.47.05.36 01.38.48.90 01.47.90.00 01.47.69.39 01.47.21.38 01.23.13.40 01.48.31.89 01.49.25.03 01.49.63.90 01.46.20.82 01.52.30.28 01.52.52.09 01.48.35.96 01.50.80.92 01.53.48.73 01.53.50.97 01.53.39.11 01.53.95.99 01.54.14.54 01.54.80.49 01.55.67.92 01.55.81.11 01.18.69.85 01.55.43.48 01.55.04.87 01.14.23.14 01.55.66.84 01.52.30.28 No. Parafin blok 245/pp/2011 385/PP/2011 442/pp/2011 554/pp/2011 668/pp/2011 1151/pp/2011 1246/pp/2011 1306/pp/2011 1391/pp/2011 1460/pp/2011 1737/pp/2011 1914/pp/2011 1992/pp/2011 2024/pp/2011 2139/pp/2011 2208/pp/2011 2527/pp/2011 2667/pp/2011 2965/pp/2011 4335/pp/2011 4474/pp/2011 4497/pp/2011 175/pp/2012 263/pp/2012 0479/pp/2012 507/pp/2012 721/pp/2012 917/pp/2012 1097/pp/2012 1691/pp/2012 1709/pp2012 1285/pp/2012 1321/pp/2012 1324/pp/2012 1348/pp/2012 554/pp/2012 4335/pp/2011 Umur 50 34 48 59 49 30 40 64 44 60 48 45 28 44 43 36 50 47 37 61 36 48 39 52 55 39 67 35 56 44 58 39 48 63 35 66 46 71 Derajat BCL-2 diferensiasi Paritas positif 3 2 positif 2 2 negatif 3 0 positif 3 3 positif 3 3 negatif 2 1 negatif 1 0 positif 1 3 negatif 2 2 positif 1 3 negatif 1 2 positif 2 2 negatif 2 2 negatif 1 0 positif 2 2 negatif 3 2 positif 3 2 negatif 2 0 negatif 1 3 negatif 1 2 negatif 2 2 negatif 1 2 positif 2 1 positif 2 4 negatif 1 0 positif 3 0 negatif 2 0 positif 3 2 positif 2 3 negatif 2 2 negatif 3 1 negatif 3 2 positif 3 0 negatif 1 4 negatif 1 0 negatif 3 4 negatif 3 0 IMT 18.9 18.3 21.2 22.0 21.6 26.8 29.6 17.3 20.0 22.8 19.4 19.1 28.3 21.2 23.8 19.4 22.5 32.3 38.2 26.8 18.9 23.5 20.5 24.6 22.0 18.2 28.4 23.3 15.2 23.3 24.5 15.5 23.8 17.7 23.4 17.8 20.0 38 39 40 41 42 43 44 45 46 47 48 49 50 51 01.60.66.47 01.60.65.71 01.61.98.89 01.61.89.00 01.55.59.01 13.00.39.42 01.22.78.66 01.64.20.03 13.00.50.48 01.64.70.41 13.00.71.29 13.00.34.13 01.64.45.93 01.64.81.09 0022/pp/2013 0154/pp/2013 829/pp/2013 1246/pp/2013 1463/pp/2013 3545/PP/13 3554/PP/13 2506/pp/2013 3583/pp/2013 3587/pp/2013 3593/pp/2013 3162/pp/2013 3261/pp/2013 2877/pp/2013 46 45 51 50 44 29 44 60 61 40 50 33 45 46 72 negatif negatif negatif negatif negatif positif negatif negatif positif negatif negatif positif negatif positif 3 1 3 1 3 2 3 3 2 1 2 2 1 3 2 2 4 4 3 0 1 2 3 1 1 0 1 2 22.2 19.8 20.4 22.0 21.2 22.1 20.2 23.4 24.2 22.3 19.9 23.2 22.8 23.2 Langkah – langkah Pengecatan Pengecatan rutin dengan reagen hematoxylin-eosin (derajat diferensiasi) 1. Potong blok parafin dengan mikrotom dengan ketebalan 5 mikron. 2. Masukan hasil potongan mikrotom ke dalam waterbath 3. Tempelkan hasl potongan mikrotom diatas kaca objek yang sudah diberi nomor lab dengan pensil kaca (menjadi preparat). 4. Deparafinisasi dengan xylol sebanyak 4x (xylol I, xylol II, xylol III, dan xylol IV) masing – masing selama 3-5 menit. 5. Dilanjutkan rehidrasi dengan alkohol bertingkat menurun (alkohol 95%, 80%, 70%, 50%) selama masing – masing 3-5 menit. 6. Cuci dengan air mengalir selama 5-10 menit. 7. Rendam preparat dalam larutan Mayer’s hematoxillin selama 10-15 menit. 8. Cuci dengan air mengalir selama 20 menit. 9. Celupkan dalam HCL 0,4% sebanyak 1-2 celup. 10. Cuci dengan air mengalir selama 5-10 menit. 11. Celupkan dalam Litium karbonat 5% sebanyak 3 celup. 12. Cuci lagi dengan air mengalir selama 510 menit. 13. Rendam dalam larutan Eosin selama 15 detik-2 menit. 14. Dilanjutkan dehidrasi dengan alkohol 50%, alkohol 70%, alkohol 80%, dan alkohol 95% secara berturut-turut, masing-masing selama 3-5 menit. 73 Pengecatan imunohistokimia bcl-2 1. Siapkan blok yang akan dicat imunohistokimia 2. Potong blok sesuai permintaan yang diinginkan (5 mikron) serta kontrol positif (tonsil) 3. Tiriskan sebentar kemudian ditekan menggunakan kertas saring pelan – pelan. Panaskan sebentar diatas hot plate dan disimpan dalam inkubator suhu 45⁰C selama semalam. 4. Deparafinisasi dengan urutan xylol, xylol, xylol, xylol, alkohol 95%, alkohol 95%, alkohol 95%, alkohol 95%, dan air, masing-masing 2 menit. 5. Cuci dengan aquadest. Rotator selama 5 menit. 6. Dilanjutkan dengan penetesan H2O2 3% selama 20 menit dalam chamber. 7. Slide ditempatkan pada wadah lalu dilanjutkan dengan cuci aquadest sambil digoyang-goyang selama 5 menit dan dilanjutkan dengan pencucian memakai PBS selama 5 menit pada rotator. 8. Slide dilap dengan kassa lalu dilakukan penetesan Ultra V blok selama 5 menit. Slide cukup dilap saja tanpa dicuci, dilanjutkan dengan penetesan antibodi “Novocastra Lyphilized Mouse Monoclonal antibody (NCL-bcl-2)” dengan pengenceran 1:50, inkubasi selama 60 menit pada suhu 25⁰C. 9. Slide dicuci dengan PBS selama 5 menit pada rotator sebanyak 2x. 10. Diteruskan dengan penambahan Biotin (kuning), diamkan selama 15 menit. 15. Lalu rendam dalam xylol sebanyak 4x, masing-masing selama 3-5 menit. 11. Dicuci kembali dengan PBS selama 5 menit pada rotator sebanyak dua kali. 16. Mounting menggunakan entelan danpreparat ditutup dengan kaca penutup. 17. Beri label. 18. Diserahkan ke dokter PA untuk dibaca. 12. Diteteskan streptavidin (merah), diamkan selama 10 menit. 13. Dicuci dengan PBS baru pada rotator selama 4 menit. 14. Ditetesi dengan kromogen selama 10 nmenit. 19. Pembacaan di mikroskop dengan pembesaran bertahap, penilaian derajat 15. Disiram dengan air kran 1x, lalu diferensiasi dilakukan pada dicuci kembali dengan air mengalir pembesaran mikroskop 400x. selama 10 menit 20. Derajat diferensiasi dinilai menurut 16. Ditetesi dengan HE mayer selama 4 Shimizu-Silverberg grading system. menit saja. Dicuci dengan air mengalir sampai bersih. 17. Dicelupkan sebentar pada alkohol bertingkat, xylol, xylol, xylol, xylol. 18. Mounting menggunakan entelan dan slide ditutup dengan deck glass. 19. Diserahkan ke dokter PA untuk dibaca. 20. Pembacaan di mikroskop dengan pembesaran secara bertahap, perhitungan semi kuantitatif ekspresi protein bcl-2 dilakukan pada pembesaran mikroskop 400x. 21. Dinyatakan overekspresi jika terwarnai coklat lebih dari 10% dan dinyatakan tidak overekspresi jika kurang atau sama dengan 10% Sumber : Buku Panduan Laboratorium Patologi Anatomi RSUP Sanglah Denpasar tahun 2012 74 Hasil Pemeriksaan Imunohistokimia Bcl-2 Positif Negatif 75 Perhitungan Uji Statistik Uji Normalitas Data Karakteristik Subjek yang Meliputi Umur, Paritas, dan IMT Tests of Normality a Kolmogorov-Smirnov Statistic df Sig. Shapiro-Wilk df Statistic * .200 Umur .098 51 Paritas .207 51 .000 IMT .160 51 .002 a. Lilliefors Significance Correction *. This is a lower bound of the true significance. .974 .892 .901 Sig. 51 51 51 .309 .000 .000 Uji One Way Anova Data Umur antar Derajat Diferensiasi Descriptives 95% Confidence Interval for Mean Std. Mean Deviation Std. Error 15 49.00 9.577 2.473 43.70 54.30 35 64 Sedang 17 43.41 11.331 2.748 37.59 49.24 28 67 Buruk 19 48.11 8.252 1.893 44.13 52.08 35 66 Total 51 46.80 9.863 1.381 44.03 49.58 28 67 N Umur Baik Lower Bound Upper Bound Minimu Maxim m um Test of Homogeneity of Variances Levene Statistic Umur Paritas IMT df1 df2 1.047 .477 1.924 2 2 2 Sig. 48 48 48 .359 .623 .157 ANOVA Sum of Squares Umur Between Groups df Mean Square 300.132 2 150.066 Within Groups 4563.907 48 95.081 Total 4864.039 50 76 F 1.578 Sig. .217 Uji Kruskal-Wallis Data Paritas dan IMT antar Derajat Diferensiasi Descriptives 95% Confidence Interval for Mean N Paritas Baik Sedang Buruk Total IMT Baik Sedang Buruk Total 15 Std. Mean Deviation 1.80 1.424 Std. Error .368 Lower Bound 1.01 Upper Minimu Maxim Bound m um 2.59 0 4 17 19 1.59 1.84 1.176 1.259 .285 .289 .98 1.24 2.19 2.45 0 0 4 4 51 15 1.75 23.25 1.262 5.197 .177 1.342 1.39 20.38 2.10 26.13 0 17 4 38 17 19 51 22.88 21.02 22.29 4.354 2.338 4.075 1.056 .536 .571 20.64 19.89 21.15 25.12 22.14 23.44 15 16 15 32 24 38 Kruskal-Wallis Test Ranks Grade Paritas IMT N Mean Rank Baik Sedang 15 17 26.63 24.18 Buruk 19 27.13 Total 51 Baik Sedang 15 17 27.77 28.71 Buruk Total 19 51 22.18 a,b Test Statistics Paritas Chi-Square df Asymp. Sig. a. Kruskal Wallis Test IMT .423 2 .809 77 2.028 2 .363 a,b Test Statistics Paritas Chi-Square df Asymp. Sig. a. Kruskal Wallis Test b. Grouping Variable: Grade IMT .423 2 .809 2.028 2 .363 Uji Hubungan dengan Spearman berdasarkan Tabulasi Silang 2 x 3 antara Bcl-2 dengan Derajat Diferensiasi Bcl_2 * Grade Crosstabulation Count Grade Bcl_2 Positif Negatif Total Baik Sedang Buruk Total 2 9 8 19 13 8 11 32 15 17 19 51 Symmetric Measures Value Interval by Interval Ordinal by Ordinal Pearson's R Spearman Correlation N of Valid Cases Asymp. Std. Approx. a b Error Approx. T Sig. .225 .125 1.617 .112 .217 .129 1.553 .127 51 a. Not assuming the null hypothesis. b. Using the asymptotic standard error assuming the null hypothesis. c. Based on normal approximation. 78 c c